Method Article
Биоинжиниринг гуманизированных микроуровней костного мозга в мышах и их визуализация с помощью Live Imaging
В этой статье
Резюме
Представлен метод создания и живого изображения различных гуманизированных нитей костного мозга у мышей. Основываясь на поддерживающей нише, созданной человеческими мезенхимальными клетками, добавление эндотелиальных клеток человека индуцирует образование сосудов человека, в то время как добавление rhBMP-2 индуцирует образование мышино-мышиной химерной зрелой костной ткани.
Аннотация
Человеческие гемопоэтические стволовые клетки (HSC) находятся в нише костного мозга (BM), сложной многофакторной сети компонентов, продуцирующих цитокины, факторы роста и внеклеточный матрикс. Способность HSC оставаться спокойным, самовосстанавливаться или дифференцироваться, приобретать мутации и становиться злокачественными, зависит от сложных взаимодействий, которые они устанавливают с различными стромальными компонентами. Чтобы наблюдать перекрестные помехи между человеческими HSC и человеческой нитью человека в физиологических и патологических состояниях, мы разработали протокол для эктопической модели и изображения гуманизированной ниши BM у иммунодефицитных мышей. Мы показываем, что использование различных клеточных компонентов позволяет формировать гуманизированные структуры и возможность поддерживать долгосрочное кроветворное кроветворение человека. Используя двухфотонную микроскопию, мы можем жить-изображать эти структуры in situ при разрешении одной ячейки, обеспечивая мощный новый инструмент для функциональной характеристики человеческого BM mМикроокружение и его роль в регуляции нормального и злокачественного гемопоэза.
Введение
Решения о клеточной судьбе, наблюдаемые в отделениях стволовых клеток, жестко регулируются как внутренними, так и внешними факторами. В частности, в настоящее время широко признано, что микроокружение BM играет фундаментальную роль в контроле переключения в HSC от покоя до активного состояния, а также в решении 1 самообновления или дифференциации. Более того, недавние данные показывают, что гематологические злокачественные опухоли влияют на функцию микроокружения BM, указывая на существование активных перекрестных помех между двумя отделениями 2 , 3 , 4 , 5 , 6 . Несмотря на недавние достижения, многие ключевые вопросы остаются в отношении того, как активность отдельных компонентов BM-ниши способствует поведению HSC и злокачественной трансформации.
Микроокружение BM является очень гетерогенным Энером и сложной смесью многих типов клеток, каждая со специальными функциями. Обильный эндотелий (EC) и сосудистый компонент регулируют оборот питательных веществ и метаболитов, вход и выход различных клеток в BM и из BM и несколько функций HSC 7 , 8 . Мезенхимальные стромальные клетки (MSC), гетерогенная популяция недифференцированных стволовых клеток и предшественников, выделенных тремя различными линиями ( то есть остеогенными, хондрогенными, адипогенными), являются еще одним фундаментальным компонентом ниши BM. Эти MSC локализуются как в центральных областях БМ, так и вблизи эндостиального региона. Они могут быть связаны с сосудистыми структурами и связаны с регуляцией функции HSC 9 , 10 , 11 , 12 , 13 ,"> 14 , 15 .
Многие сообщения указывают на то, что HSC находятся на разных определенных участках мозга и что их функция может зависеть от их точной локализации. Большинство существующих знаний о HSC и их взаимодействии с микроокружением BM происходит из исследований на мышах 1 . Использование моделей ксенотрансплантата распространило эти знания на нормальные и злокачественные HSC человека, приживаясь в мышином BM иммунодефицитных мышей 16 , 17 , 18 , 19 , 20 . Несмотря на то, что это представляет собой приемлемую модель, она по-прежнему представляет собой множество проблем, таких как необходимость усвоения мыши-реципиента в большинстве случаев для обеспечения самонаведения и приживления человеческого HSC или межвидового барьера и его слабо понимаемого влияния на взаимодействия клеток и клеток функции.
Использование нейтрализующих антител и генетически модифицированных мышей наряду с ксенотрансплантацией сыграло важную роль в освещении сложного диалога, который человеческие HSC устанавливают с их микросредами. Введение и развитие внутривидовой двухфотонной конфокальной микроскопии продвинуло эти исследования на шаг вперед, позволяя прямое, высокое разрешение и динамическое изображение костного мозга 19 , 20 , 21 , 22 и обеспечивает мощный инструмент для функционального Характеристика микроокружения BM и ее роль в регулировании функции HSC. Чтобы обойти некоторые проблемы, возникающие в классических моделях ксенотрансплантации, концепция интродукции гуманизированной структуры БМ была выдвинута на первый план. Слияние биоматериалов и концепций имплантации клеток, отчеты показали возможность подражания человеческой кости мArrow микроокружение в гетеротопических областях 23 , 24 , 25 , 26 , 27 . Это открывает возможность использования биоинженерии в моделях мыши для изучения нормального и злокачественного гемопоэза человека 28 , 29 , 30 , 31 , 32 , 33 , 34 , 35 , 36 , 37 , 38 , 39 , опухолеобразования и метастазов 40 , 41 , 42 , 43 , 44 .
Основываясь на предыдущем опыте в области инженерии костной ткани и визуализации in vivo 19 , 22 , 45 , 46 , 47 , 48 , 49 , 50 , 51 , 52 , мы описываем протокол биоинженерии и жировых изображений органотипических человеческих BM-тканей. Эти структуры происходят от имплантации стромальных клеток, продуцируемых человеческим BM, в коллагеновые основы, подкожно привитые у иммунодефицитных мышей. В предыдущем докладе мы продемонстрировали, что человеческие MSC обеспечивают образование микроокружения человека, адекватного приживлению человеческих кроветворных клеток 45 . Кроме того, здесь мы описываем, как совместная имплантация другого человеческого клеточного компонента BMS, такие как эндотелиальные клетки человека (hEC) и / или цитокины, важные для формирования костей ( например, hBMP2), сотрудничают с hMSC, чтобы генерировать различные гуманизированные микросреды, которые могут отображаться в реальном времени на месте .
протокол
Все эксперименты на животных проводились в соответствии с PPL 70/8904, одобренными Министерством внутренних дел Великобритании и в соответствии с рекомендациями Cancer Research UK. Использование образцов человеческой пуповинной крови (UCB) и первичных образцов острой миелоидной лейкемии (AML) человека было одобрено Ист-Лондонским этическим комитетом после получения согласия и было проведено в соответствии с Хельсинкской декларацией.
1. Биоинженерные основы на основе коллагена с человеческими гемопоэтическими и стромальными клетками
ПРИМЕЧАНИЕ. Весь протокол должен выполняться в стерильных условиях и со стерильным материалом. Клеточная культуральная среда 1 соответствует hMSC-среде (MEM-α, P / S и 10% hMSC-FBS); Клеточная культуральная среда 2 соответствует среде ЕС (M199, 20% FBS, P / S, 10 мМ HEPES, 50 мкг / мл гепарина, 2 мМ глутамина и 50 мкг / мл ЭКГС), а клеточная культуральная среда 3 соответствует кроветворной среде (H5100 И P / S).
- Подготовьте пуповинную кровь m(CB-MNCs) или первичный AML (костный мозг или MNC периферической крови) с использованием градиента плотности Ficoll-Paque в соответствии с хорошо установленными протоколами 53 .
- Для AML истощают Т-клетки с использованием антитела OKT.3. Инкубируйте 4 мкг OKT.3 в 1 × 10 6 AML MNC в течение 30 мин при комнатной температуре перед промыванием клеток в PBS. При необходимости криоконсервируют МНК в FBS с 10% ДМСО при 2 × 10 8 клеток на мл.
- Подготовьте культуры hMSC (культуральная среда 1) и EC (культура культуральной среды 2). Пластинчатые hMSC-клетки (см. Таблицу материалов ) на обычных колбах для культивирования клеток в среде hMSC. Пластины EC (см. Таблицу материалов ) на коллагеновых покрытиях с 1 покрытием в среде EC.
- При 85-90% слияния клеток удаляют среду, дважды промывают PBS и добавляют раствор трипсина-ЭДТА (20 мкл на см 2 ).
- Через 5 мин проверьте, что клетки отсоединены. Восстановите клетки путем разбавления 1:3 с клеточной культуральной средой. Центрифугируют при 300 × g в течение 5 мин и повторно суспендируют в соответствующей среде для каждого типа клеток и подсчитывают клетки с использованием камеры Нойбауэра.
- Используйте клетки при 2 × 10 6 - 10 7 клеток на мл. Если оба типа клеток необходимо использовать вместе, смешайте hMSC и EC суспензии в соотношении 1: 1.
- Перенесите клеточную суспензию в шприц для инсулина.
- Используя скальпель, вырежьте стерилизованную желатиновую губку ( например, gelfoam) начальные леса (20 мм x 60 мм x 7 мм) на 24 части одинакового размера (6,6 мм х 7,5 мм х 7 мм, рис. 1А и В ).
- Восстановить желатиновые леса путем погружения в PBS (5 мин).
- Один за другим осторожно помещайте лески в стерильную ткань, чтобы удалить избыток PBS. Перенесите леса в одну лунку 24-луночного планшета (сверхнизкая поверхность прикрепления) и используйте шприц для инъекции 50 мкл, содержащий 10 5 - 10 6 клеток (hMSC alОдин или в сочетании с hEC; Рисунок 1С ).
- Повторите шаг 1,7 с каждым эшафотом, пока все необходимые леса не будут засеяны стромальными клетками.
- Инкубируйте в течение 1 часа внутри инкубатора клеточной культуры (37 ° C и CO 2 5%).
- Заполните каждую лунку 3 мл среды для культивирования клеток 1 ( рисунок 1D ) и верните строительные леса в инкубатор клеточной культуры (37 ° C и CO 2 5%) для инкубации в течение ночи. Используйте среду для культивирования клеток 2, если ECs используются в строительных лесах.
- Thaw CB-MNC и изолировать клетки CD34 + от них согласно соответствующему протоколу комплекта CD34 + . Приостановите выбранные CD34 + клетки в среде 3 и подсчитайте их в камере Нойбауэра.
ПРИМЕЧАНИЕ. Здесь клетки использовали при концентрации 2 × 10 6 клеток на мл.- Если используются первичные образцы, полученные из AML, оттаивают клетки, разбавляют их 1:10 в FBS, центрифугируют их в течение 5 мин при 300Xg, повторно суспендировать клетки в PBS-2% FBS, добавлять анти-человеческое антитело CD3 (2-4 мкг на 10 6 клеток) и инкубировать при комнатной температуре в течение 30 мин. Центрифугируют в течение 5 мин при 300 мкг и ресуспендируют в среде гематопоэтических клеток, дополненной цитокинами (20 нг / мл гранулоцитарно-колониестимулирующего фактора (G-CSF), 20 нг / мл IL-3 и 20 нг / мл тромбопоэтина (TPO)), ,
- Повторите шаги 1,7 - 1,9, но в этом случае выделите 1 х 10 5 человеческих гемопоэтических клеток вместо стромальных компонентов, как указано выше.
- Заполните лунку 3 мл клеточной культуральной среды 3 ( рис. 1D ) и верните строительные леса в инкубатор клеточной культуры (37 ° C и CO 2 5%) для инкубации в течение ночи. Используйте смесь 1: 1 клеточных культуральных сред 2 и 3 Если ECs используются в строительных лесах.
- Для только рекомбинантных каркасных несущих каркасов кости-2 (rhBMP-2) человеческих костей осторожно помещайте лески один за другим на стерильную ткань для удаления избытка PBS. Перенесите леса в одну лунку на 96-луночный планшет ( рис. 1Е ) и добавьте 5 мкл rhBMP-2, тщательно покрывая эшафот.
- Добавьте 20 мкл тромбина, а затем 20 мкл фибриногена, тщательно покрывая каркас каждый раз ( рис. 1F ). Повторите процедуру для каждого леса, пока все необходимые леса не будут обработаны, а затем инкубируйте в течение 5-10 минут при 37 ° C. Проверьте, успешно ли сформирована коагуляция.
2. Хирургическая имплантация биоинженерных лесов
ПРИМЕЧАНИЕ. Здесь использовались мышиные или женские, 6-12-недельные мыши NSG. Поскольку животные являются иммунодефицитными, все процедуры должны проводиться в стерильных условиях. Шаги 2.10 - 2.13 связаны с стратегиями выживания и послеоперационной опекой.
- 60 - 120 мин до операции, подкожно назначают обезболивающее (carprofen, 5 мг / кг веса тела / мышь).
- Вызывают анестезию в камере с 0,5% изофлураном и 2 л / мин O 2 . Мышей следует постоянно контролировать во время процедуры. Перенесите животное в хирургическую зону в положении лежа, чтобы иметь легкий доступ к спине. Держите животное под наркозом, используя носовой конус, снабжающий 1,5% изофлурана и 2 л / мин O 2 . Держите мышь под анестезией во время хирургической процедуры и часто проверяйте состояние животного.
- Пока он находится под наркозом, используйте глазный гель на глазах мышей, чтобы предотвратить сухость, и держите мышь при 37 ° C.
- Берегите хирургическую область на задней части мыши с помощью электрического триммера. Чтобы стерилизовать кожу, опустите наконечник хлопка в разбавленный клорексидин (разведенный 1:10 в PBS) и используйте этот наконечник для очистки поверхности кожи. Повторите эту процедуру дважды.
- Используя стерильные щипцы и скальпель (или ножницы), сделайте от 0,5 до 0,7 см переднего и заднего полного разреза кожи. Использовать щипцыПод подкожной клетчаткой сделать карман.
- Вставьте подкожную подставку, убедившись, что она находится глубоко внутри кармана ( рис. 1G и H ). Закройте разрез хирургическим клеем ( рис. 1I и J ).
- Для лечения постхирургической боли подкожно вводить бупренорфин (0,1 мг / кг массы тела).
- Во время восстановления поместите животное на бок в предварительно нагретую клетку и наблюдайте восстановление до нормального поведения.
- Разбавьте обезболивающее средство в воде (карпрофен, 0,1 мг / мл воды) и предоставьте его животным в качестве питьевой воды в течение 4 дней после операции.
- Часто проверяйте животное и рану в течение 48-часового послеоперационного периода для возможных побочных эффектов.
3. Мышцы, эвтаназия и выборка для визуализации
ПРИМЕЧАНИЕ. Анализ строительных лесов выполняется между8 и 24 недели после имплантации.
- За 60 мин до визуализации держите имплантированную мышь в теплой коробке при 37 ° С и внутривенно вводите 100 мкл человеческого иммуноглобулина для блокирования неспецифических сайтов.
- 30 мин до визуализации, внутривенно вводить 10 мкг (на мышь) специфических антител для маркировки интересующих клеток.
- За 5 мин до визуализации внутривенно вводят 15 мкл (разведенный в 100 мкл PBS) меченого флуорофором, мешающего флуорофору, агента для объединения сосудов (655-VPA) для визуализации сосудистых структур.
- Усыплять мышь через шейную дислокацию.
- Используя острые ножницы, сделайте продольный разрез кожи на задней части мыши, рядом с исходным местом имплантации.
- С помощью пинцета и ножниц аккуратно отделите кожу от подкожного кармана, где имплантирован эшафот.
- Держите щит пинцетом и аккуратно эксплантируйте его с кожи, разрезая остаточную мембрану aИ ткани, окружающие леса, используя ножницы. См. Примеры строительных лесов, которые должны быть восстановлены на рисунке 2 .
- Закрепите каркас быстродействующим адгезивным клеем на образной пластине (чашка Петри 35 мм × 10 мм) и заполните солевым раствором (PBS) при комнатной температуре.
- Для лесов BMP, прежде чем заполнять пластину PBS, используйте хирургический микросверль для тонкой поверхности кости под микрохирургическим микроскопом; Это позволяет визуализировать флуороформу и захват изображения высокого разрешения. Используйте заусенцы 1,2 или 1,6 мм, в зависимости от размера леса.
ПРИМЕЧАНИЕ. Пользователь будет понимать, как много развернуть в зависимости от толщины кости. В целом, поскольку каркасы BMP васкуляризуются, кость слегка изменит цвет и станет более красной при приближении к правильной толщине изображения. - Вставьте пластину на стадию конфокального микроскопа.
4. Живое изображение с использованием двухфотонного микроскопаопировать
ПРИМЕЧАНИЕ. При использовании неселективных детекторов (NDD) всегда используйте слайдер NDD для визуализации для направления флуоресценции на NDD. Конфигурация микроскопа представлена на рисунке 3 .
- Включите микроскоп и компьютер, запустите программное обеспечение, нажав «Запустить систему» и перейдите в режим «Приобретение».
- Отметьте поле «Показать ручные инструменты». В меню «Лазер» переключите «на» двухфотонный лазер и дайте ему прогреться и стабилизироваться.
- В меню «Настройка изображения» одновременно активируйте «Режим канала» и «Переключить трек каждого кадра». В меню «Путь света» выберите «Non Descanned» и «Разделитель основного луча MBS 760+». Отметьте, чтобы активировать четыре NDD и установить конфигурацию, как показано на рисунке 3 .
ПРИМЕЧАНИЕ. При такой конфигурации коллагеновый сигнал от костных структур (сек.Генерация гармонической гармоники, SHG) собирают при 380-448 нм, FITC-hCD31 + человеческие эндотелиальные клетки и AF488-hCD45 + человеческие гемопоэтические клетки при 500-550 нм и 655-VPA при 640-690 нм. - В меню «Channels» установите «длина волны лазера» до 890 нм и мощность до 50%. Установите «Gain (Master)» на 500-600, «Digital Offset» на 0 и «Digital Gain» на 15 для каждого канала. Отрегулируйте эти значения после начала приобретения.
- В «режиме сбора данных» установите требуемые параметры для получения изображений с высоким разрешением без повреждения ткани и отбеливания флуорофоров. Установите «Режим сканирования» на «Рамка», «Размер рамки» на «x512 y512», «Шаг линии» до «1», «Скорость» до 9, «Усредняющее число» до 8, «Глубина бит» до «8 бит», Режим "на", "Направление" на "двунаправленный" и "Метод" означает "означает".
- Установите "ZoOm "до 1 для первоначального сканирования изображения и увеличить его, если требуется, чтобы сосредоточиться на определенных областях.
- Поместите пластину, содержащую эшафот на ступень микроскопа, под линзу 20X, 1,0 NA с водой и опустите линзу, пока она не коснется солевого раствора. Установите фокус объектива на эшафот, используя окуляры микроскопа, используя лампу в качестве источника света.
- Активируйте меню «Z-stack», выберите функцию «Первая / Последняя» и установите требуемый интервал между двумя субпоследовательными срезами ( например, 2-мкм Z-стек). Держите интервалы постоянными в Z-стеке.
- Выберите «Live», чтобы отобразить живое сканирование образца и настроить «Цифровой коэффициент усиления» и «Цифровое смещение» для оптимальной экспозиции. Чтобы визуализировать несколько каналов одновременно, выберите функцию «Разделить».
- В меню «Этап», находясь в режиме «Живой», отсканируйте изображения и «Отметьте» области интер-(ROI), таких как местоположение гемопоэтических клеток человека и сосудистых структур. Когда проверка образца завершена, перейдите к первому ROI, чтобы начать визуализацию.
- В режиме «Живой» установите верхнюю и нижнюю части 3D-Z-стека вокруг интересующей области, используя функции «Установить первым» и «Установить последний». По завершении установите центр «C.». Начните приобретение ROI с помощью кнопки «начать эксперимент». См. Примеры изображений на рисунке 4 , рисунке 5 и рисунке 6 .
- По завершении получения сохраните изображение в указанной папке. Перейдите к следующему ROI и повторите шаг 4.10. Как только эксперимент будет завершен, снимите пластину с микроскопом, аккуратно отделите образец от пластины и очистите остаточный клей.
- Подготовьте образец для следующего метода анализа.
5. Образец процессаG для гистологии и иммуноокрашивания
ПРИМЕЧАНИЕ. Образцы обрабатываются в соответствии с протоколом, описанным в общих лабораторных методах JoVE 54, описывающих процессы фиксации, внедрения и секционирования образцов. Образующие кости образцы следует обрабатывать в течение 7 дней в декальцификаторе на основе EDTA между процессами фиксации и встраивания. Блокирующий / пермеабилизирующий раствор представляет собой 10 мМ буфера PBS pH 7,4 с 1% Triton X-100, 1% бычьего сывороточного альбумина (BSA) и 10% нормальной сыворотки коз (NGS).
- Поместите кусочки в ксилоле в течение 10 мин), ксилол в течение 5 мин, 100% этанол в течение 5 мин, 70% этанола в течение 5 мин, 50% этанола в течение 5 мин и Н 2 О в течение 5 мин.
- Перенесите срезы на антиген, основанный на цитрате, разоблачающее рабочее решение.
- Вскипятите ломтики в течение 15 минут и дайте им остыть до комнатной температуры.
- Промойте срезы в 10 мМ раствора PBS pH 7,4 с 1% Triton X-100 (5 мин, 3 раза).
- Передайте samК раствору для блокирования / пермеализации и инкубировать в течение 30 мин.
- Добавить первичное антитело, разведенное в блокирующем / пермеабилизирующем растворе, и инкубировать в течение ночи при 4 ° С.
- Промойте срезы в 10 мМ раствора PBS pH 7,4 с 1% Triton X-100 (5 мин, 3 раза).
- Добавить вторичное антитело, разведенное в блокирующем / пермеабилизирующем растворе, в течение 1 ч в темноте при комнатной температуре.
- Промыть H 2 O (5 мин, 3 раза).
- Чтобы уменьшить фоновые флуоресценции, погрузите ломтики в рабочий раствор суданского черного раствора в течение 10 минут, в темноте и при комнатной температуре.
- Вымойте ломтики в H 2 O (5 мин, 3 раза).
- Установите срезы с помощью флуоресцентной монтажной среды с DAPI (0,5 мкг / мл).
- Храните ломтики при температуре 4 ° C и убедитесь, что монтажная среда сухая перед проведением флуоресцентной визуализации. См. Примеры изображений на рисунке 7 .
Результаты
На рисунке 1 показаны типичные изображения процессов посева и имплантации ячеистых клеток. На рисунке 1C обратите внимание, что клетки вводятся непосредственно в эшафот. На рисунке 1G обратите внимание, что надрез сделан в задней части мыши, где создается подкожный карман и имплантируется каркас. На рисунке 2 показана общая морфология различных лесов, имплантированных у мышей NSG и полученная через 8 недель. Обратите внимание на небольшую васкуляризацию в посевных лесах hMSC ( рисунок 2A ). Совместное поселение человеческих EC с hMSC на эшафоте позволяет формировать более значимую сосудистую сеть в лесах ( рис. 2B ). Наконец, присутствие rhBMP-2 вызывает образование костей. В этом случае извлекаемые строительные леса больше, и они состоят изКости, напоминающие твердые ткани.
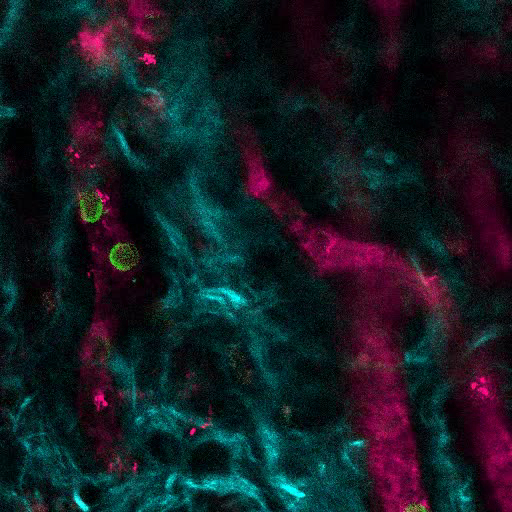
На рисунке 3 показана настройка конфигурации канала на микроскопе для прямой видимости с помощью NDD (подробности в легенде). Рисунок 4 и Видео 1 показывают человеческие гемопоэтические клетки в hMSC-покрытых лесах. Леса были эксплантированы через 8 недель после имплантации и после внутривенной инокуляции антитела AF488-hCD45 и 655-VPA. Эта процедура позволяет визуализировать имплантированные гемопоэтические клетки человека и сосудистую структуру с помощью двухфотонной конфокальной микроскопии. В этом случае на изображениях показаны кровеносные сосуды (655-VPA) на каркасах и долгосрочное приживление гемопоэтических клеток человека (AF488-hCD45) в паренхиме лесов. Рисунок 5 и Видео 2 соответствуют человеческим каркасам, засеянным hECs и hMSC. Через 8 недель после операции, каркасы были эксплантированы после внутривенногоИнокуляция антитела FITC-hCD31 и 655-VPA, и изображения были получены с помощью двухфотонного конфокального микроскопа, как упоминалось ранее. Изображения показывают участие hECs в образовании сосудов в эшафоте, что приводит к химерной сосудистой сети мыши.
На фиг.6А показаны репрезентативные данные о подходе, используемом для стимуляции образования костей в каркасах MSC. Как и в предыдущих рисунках, через 8 недель после имплантации была проведена внутривенная инокуляция 655-VPA, были извлечены строительные леса, и изображения были получены с помощью двухфотонной конфокальной микроскопии. RhBMP-2-стимулированные леса вызывают образование костной ткани, которая может быть визуализирована из-за SHG (голубой цвет на изображениях), обеспечиваемый кальцием в кости. Представленные изображения также показывают образование полостей и васкуляризированной эндостиальной ткани, которые очень напоминают эндостеалярную ткань BM. На рисунке 6B и Video 3 , hECs были совместно имплантированы hMSC. Леса извлекались после внутривенной инокуляции антитела FITC-hCD31 и 655-VPA, а изображения с двумя фотонными конфокальными микроскопами показывали участие hECs в неоваскуляризации в костно-формирующем лесу.
На рисунке 7 показаны репрезентативные изображения гистологии, процедура, выполняемая для подтверждения ранее описанных результатов. Иммунофлуоресцентные изображения показывают мышечную сосудистую сеть, hECs, hMSC и долгосрочные привитые человеческие гемопоэтические клетки в структурах лесов. Леса, полученные от мышей, фиксировали и использовали для иммунофлюоресценции. В каркасно-несущих каркасах rhBMP-2 ( рис. 7D- F ) обратите внимание на морфологию ткани, напоминающую зрелый костный мозг с жировой тканью. В этом костно-формирующем эшафоте мы показываем, что hMSC представляют собой фибробласты, которые указывают на tОни вносят вклад в новообразованную ткань в виде стромальных клеток. Мы также показываем экспрессию маркера человека adipocyte, что указывает на то, что hMSC также способствуют образованию жировой ткани.
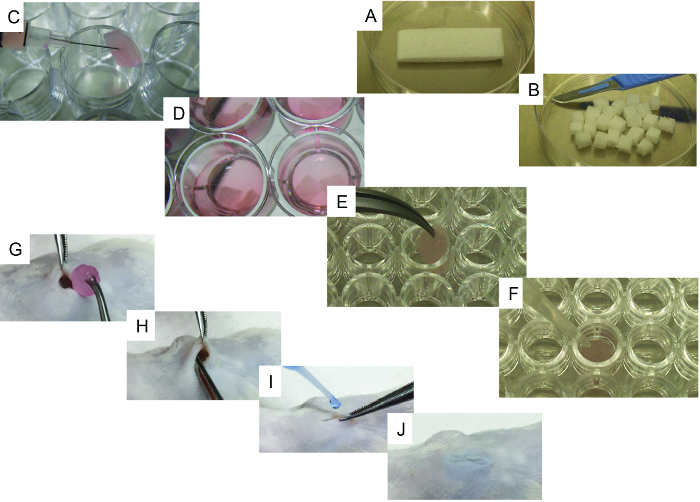
Рисунок 1. Репрезентативные изображения процессов высева клеток и имплантации. A) Начальный эшафот и его метод резания с использованием скальпеля. B) 24 штуки, полученные на первоначальном эшафоте. C) Метод посева ячеистых клеток с использованием шприца. D) Ячеистые леса с культуральной средой, готовые к имплантации. EF). Конкретные шаги для костно-формирующих лесов: E) каркас переносится на 96-луночный планшет u-bottom и F) репрезентативное изображение метода, используемого для добавления rhchMP2, тромбина и фибриногена к эшафоту. GJ) Сурги Калорийную имплантацию под общей анестезией: G) рану, созданную при имплантации кожи и каркаса, метод имплантации H) и процедуру закрывания раны IJ с использованием хирургического клея. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
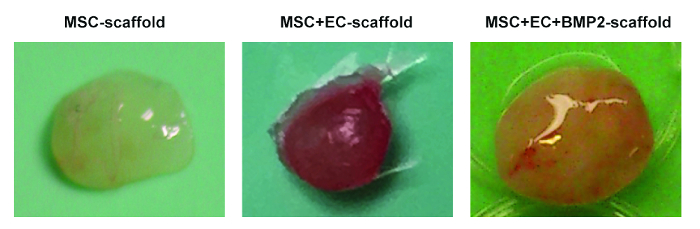
Рисунок 2. Различные леса, полученные из мышей. Репрезентативные изображения лесов MSC (слева), лесов MSC + EC (средний) и лесов MSC + EC + BMP (справа). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4 / 55914fig3.jpg "/>
Рисунок 3. Конфигурация канала. Отображается настройка фильтра микроскопа. A) Существует четыре блока детекторов NDD: в первом модуле имеется два куба фильтра; Второй и третий модули имеют по одному кубику фильтра; И последний модуль не имеет куба (не используется). Первая фотоумножитель (PMT) предназначена для дальнего красного канала (640-690 нм), отражающего более низкие длины волн; Следующие - 380 - 485 нм, 500 - 550 нм и 555 - 625 нм (порядок всегда от нижних до более высоких длин волн). B) Выбросы флуорофора, обнаруженные с помощью вышеуказанных конфигураций (с цветовой кодировкой). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
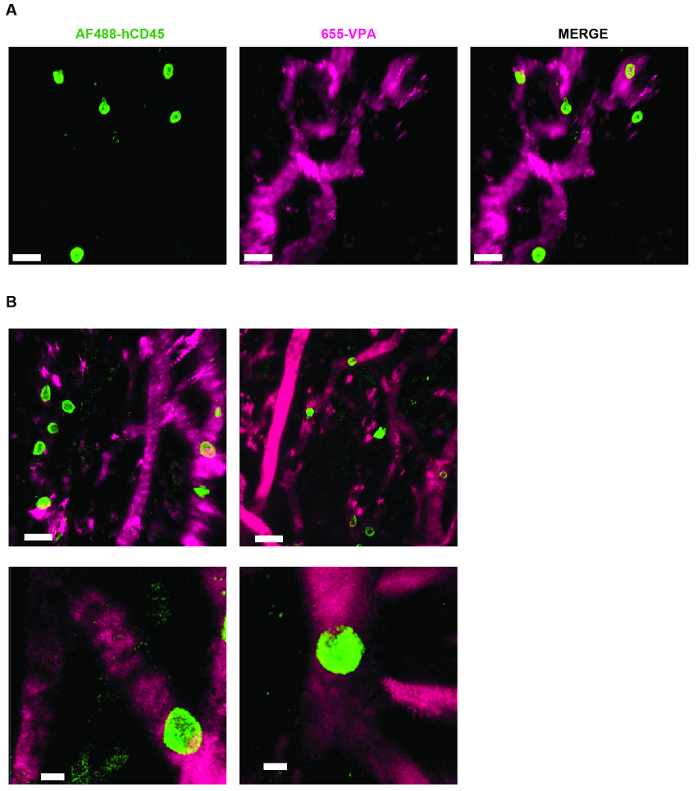
Рисунок 4. MSC Scaffold S Позволяют формировать нишу для гематопоэтических клеток человека. A) и B) 3D-реконструкции Z-стеков, взятых после эксплантации, после внутривенной инокуляции AF488-hCD45 (зеленый), для маркировки гемопоэтических клеток человека и 655-VPA (пурпурный) m для маркировки сосудистой сети. Шкалы шкалы представляют собой 20 мкм в A и B (верхние панели) и 5 мкм в B (нижние панели). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1. Леса MSC позволяют формировать нишу для гемопоэтических клеток человека . 3D-реконструкция гемопоэтических клеток человека (AF488-hCD45), связанная с сосудистой сеткой (655-VPA) в каркасе MSC (структуры коллагена: SHG, голубой). Каждый стек имеет размер 140 x 140 мкм.Ef = "https://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/55914/55914video1.mov" target = "_ blank"> Нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши, чтобы загрузить.)
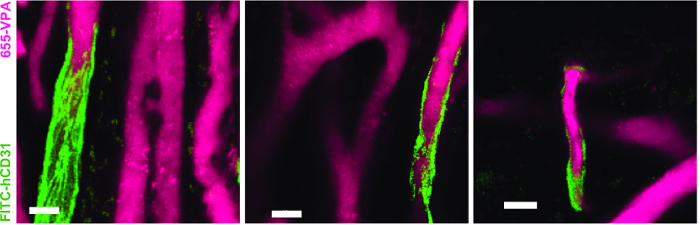
Рисунок 5. Участники ЕС участвуют в формировании гуманизированных сосудов в строительных лесах MSC. 3D-реконструкция сосудистой сети (655-VPA), выровненная EC человеческого происхождения (FITC-hCD31) в каркасах MSC + EC. Шкала шкалы составляет 20 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Видео 2. EC-участники ЕС участвуют в формировании гуманизированных сосудов в строительных лесов MSC. 3D-реконструкция человеческих EC (FITC-hCD31), выровняющая va Sculature (655-VPA) в каркасах MSC + EC. Каждый стек имеет размер 240 x 240 мкм. Нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши, чтобы загрузить.)
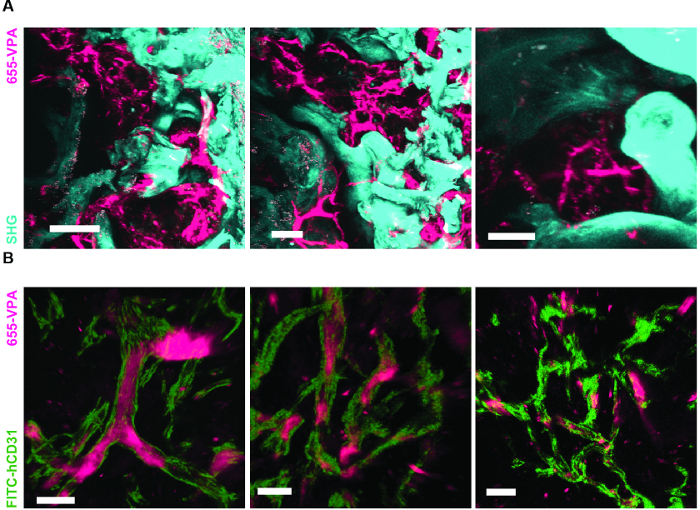
Рисунок 6. Несущие леса rhBMP-2 имеют костные поверхности и гуманизированную сосудистую систему, сходную с костным мозгом. A) 3D-реконструкция каркасов MSC + BMP, показывающих образование костных структур (SHG-голубой) и сосудистой системы (655-VPA). Шкала шкалы составляет 100 мкм (слева), 70 мкм (средняя) и 50 мкм (справа). B) 3D-реконструкция лесов MSC + EC + BMP, показывающих гуманизированные сосуды (655-VPA), выровненные с человеческими EC (FITC-hCD31). Шкала шкалы представляет собой 50 мкм (слева) и 30 мкм (средний и правый).14 / 55914fig6large.jpg «target =" _ blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Видео 3. У несущих каркасов rhBMP-2 есть костяные поверхности и гуманизированная сосудистая сеть, сходная с костным мозгом. 3D-реконструкция каркасов MSC + VERA + BMP (кость: SHG; сосуды: 655-VPA, человеческие EC: FITC-hCD31). Каждый стек имеет размер 600 x 600 мкм. Нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши, чтобы загрузить.)
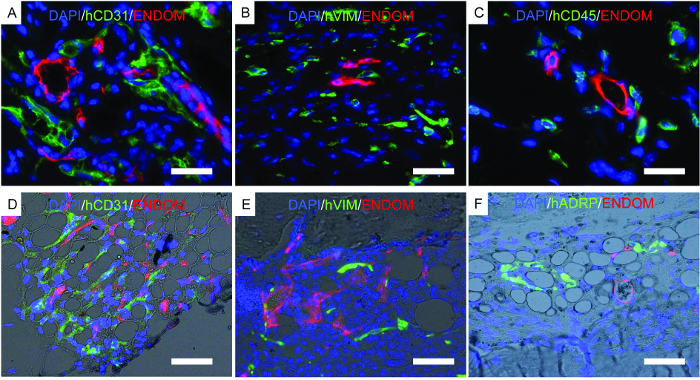
Рисунок 7. Представительные изображения иммунофлюоресценции, выполненные на неподвижных строительных лесов. AF) Исследования иммунофлуоресценции, проведенные для определения местоположения клеток человека, имплантированных iN строительных лесов. AC) Леса, имплантированные hECs, hMSC и hHSC. DF) Костообразующие леса, имплантированные hECs, hMSC и hHSC. Цветные каналы следующие: AD) человеческий EC (hCD31) и сосудистая структура мыши (эндомуцин, ENDOM), BE) hMSCs (hVimentin, hVIM) и сосудистые клетки мыши (эндомуцин, ENDOM), C) гемопоэтические клетки человека (hCD45) И мышечная сосудистая сеть (эндомуцин, ENDOM) и F) человеческий белок дифференцировки жировой ткани (hADRP) и мышечная сосудистая сеть (эндомуцин, ENDOM). Шкала шкалы представляет собой 10 мкм (A и C), 20 мкм (B и E) и 40 (D и F) мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Значение в отношении существующих методов:
В этом протоколе мы описали метод генерации различных гуманизированных микросреждений у мышей и визуализации их архитектуры с помощью двухфотонной микроскопии и гистологии. Представленные данные свидетельствуют о возможности подхода, используя различные стромальные клетки для создания гуманизированных тканей. Протокол имеет специфические применения для изучения гемопоэтических клеток человека и клеток, полученных из ниши, костного мозга в нормальных и патологических условиях. Эти приложения включают изучение эволюции клонов, скрининга лекарств и перекрестных помех между человеческими HSC и стромальными компонентами. В новой области тканевой инженерии было предложено несколько альтернативных подходов. Подходы к сведению включают разработку 3D гуманизированных структур BM in vitro 55 , 56 , 57 ,S = «xref»> 58 , 59 , 60 , 61 , 62 , 63 и ортотопический трансплантат гуманизированных каркасов BM у мышей 64 . Преимущество нашего подхода заключается в сочетании как сложной системы in vivo, так и простой анатомической доступности гуманизированного тканевого трансплантата.
Модификации и устранение неполадок:
Источник изменчивости в этом протоколе можно найти в выборе ячеек, используемых для посева каркасов. В нашей работе мы использовали BMC-hMSC. Однако мезенхимные клетки могут быть получены из нескольких тканей, которые могут проявлять отличительные свойства в зависимости от происхождения. Поэтому можно рассматривать использование hMSC, полученных из разных органов. Однако их способность формировать костную ткань in vivo должна быть проверена до использования в этом pRotocol. В этом протоколе используется коммерчески доступный источник эндотелиальных клеток человека ( т.е. EUORF1-трансдуцированный HUVEC). Недавно было сообщено об использовании органоспецифических эндотелиальных клеток для различных целей 65 , 66 . Более того, использование первичных hEC, полученных из BM, может представлять интересное усовершенствование протокола. Поэтому использование различных источников эндотелиальных клеток может приводить к различным результатам in vivo .
Мы использовали мышей с иммунодефицитом NSG с иммунодефицитом, чтобы способствовать имплантации гуманизированных лесов и избежать отторжения тканей. Мы не исключаем возможности использования этого протокола для разработки эктопических тканей костного мозга в других штаммах мыши. Действительно, rhBMP-2 может индуцировать образование костей в разных моделях млекопитающих 47 , 48 , 49 , 50 , 52 . Однако различия в жизнеспособности клеток и длительной трансплантации, вероятно, будут наблюдаться с использованием разных штаммов / моделей.
Время восстановления эшафотов также может быть гибким, в зависимости от конечной цели эксперимента. В представленном протоколе мы возвращаем образцы через 8-12 недель после имплантации для оценки долговременного гемопоэтического приживления. Для изучения ранних стадий формирования нитей человеческого BM ( например, образования остеохондральной ткани 47 или развития сосудов) могут быть выбраны разные моменты времени.
Техника визуализации в реальном времени, описанная в этом протоколе, показана для краткосрочной визуализации эксплантов. Использование равновесной камеры для поддержания физиологической температуры, кислородного напряжения и концентрации CO 2 следует рассматривать в случаях долгосрочной визуализации, например, для изучения поведения моторики.
КритическийEps в рамках Протокола:
Среди проблем, связанных с протоколом, мы хотели бы выделить технические навыки, необходимые для некоторых шагов. Мезенхимальные и эндотелиальные клетки следует использовать при низких числах проходов клеток; В противном случае они не смогут поддерживать приживление гемопоэтических клеток человека in vivo или участвовать в сосудистой сети de novo и формировании костей in vivo . Мы рекомендуем использовать hMSCs и hECs в проходах 1-5. Для подготовки и подготовки ячеек требуется базовые навыки клеточной культуры и знание свойств конкретных клеток, используемых в процедуре. Протокол хирургии довольно прост, но требует некоторой практики. Сохранение асептической среды во избежание заражения имплантированных каркасов у иммунодефицитных мышей имеет решающее значение для обеспечения успеха эксперимента. Эксплантат образца и живое изображение требуют хирургической практики (особенно для использования микротрещины) и знаний оМикроскоп. Наконец, обработка образцов и гистология требуют базового знания методов, которые будут использоваться.
Ограничения техники:
Подход, который мы описываем, позволяет визуализировать живые человеческие гемопоэтические клетки, высевающие гуманизированный микроокружение костного мозга, с эндотелиальными клетками человека, образующими сосудистые структуры и мезенхимальные клетки, образующие пространство кости / костного мозга. Поскольку ткань образуется in vivo , конечный инженерный эшафот по-прежнему будет химерическим (человеческим и мышиным). Следует учитывать эту проблему, поскольку химерная ткань не может полностью имитировать сложность и среду человеческого костного мозга.
Имплантируемые каркасы имеют ограниченный размер (мы пробовали максимум 6,6 х 7,5 х 7 мм), и поэтому они могут размещать ограниченное количество клеток для ксенотрансплантации. Абсолютное количество восстановленных клеток также будет ограничено; Таким образом, количество имплантированных лесов должноРассчитывается как функция количества клеток, необходимых для эксперимента.
Прикладное изображение, которое мы описали, особенно полезно для наблюдения больших площадей живых тканей на глубинах 150-200 мкм от поверхности без нарушения архитектуры и повреждения клеток. Поэтому он не позволяет визуализировать весь эшафот. Если требуется полное сканирование ткани, более подходящими являются стандартные подходы к иммунофлюоресценции.
Будущие приложения:
Будущее направление этой биоинженерной модели будет заключаться в увеличении сложности компонентов человека в ткани. Знания и характеристика человеческой ниши BM развивались в последние годы 67 , и описанный протокол мог бы стать интересной платформой для изучения функции этих новых клеточных компонентов и растворимых факторов, а также их роли в поддержании нормального / злокачественногоAnt HSCs.
Кроме того, метод визуализации обеспечивает возможность визуализации изображений в каркасном состоянии в продольных исследованиях, что потребует технических улучшений при визуализации изображений на живых, обезболиваемых мышах, после восстановления после операции. Этот подход потребует дополнительных шагов и в настоящее время находится на стадии расследования в лаборатории.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим сотрудников в основных учреждениях Института Фрэнсиса Крика (Biological Research, In Vivo Imaging и Experimental Histopathology) и Йоланды Сааведра-Торрес и Мерседес Санчес-Гарсон, ветеринары в Крике и LRI, соответственно, за их ценную помощь. Мы благодарны д-ру У. Грей за критическое чтение рукописи. DP поддерживалась неклиническим исследовательским стипендиатом от EHA. Эта работа была поддержана Институтом Фрэнсиса Крика, который получает основное финансирование от Cancer Research UK (FC001045), Британского совета медицинских исследований (FC001045) и Welcome Trust (FC001045).
Материалы
| Name | Company | Catalog Number | Comments |
| Ficoll-Paque | Ge Healthcare | 17-1440-03 | |
| Cd34 positive selection Kit | Stemcell | 18056 | Store a 4°C. |
| Magnet | Stemcell | 18000 | |
| Anti-human CD3 antibody, clone OKT-3 | Bioxcell | BE0001-2 | Store at 4°C. Used for T cell depletion in primary AML samples. |
| Cytokines (IL3, G-CSF, and TPO) | PeproTech | 200-03, 300-23 and 300-18 | For doing the stock: Dilute each one of the cytokines in 100 μL of water and mix them. Add 200 μL, do alicuots of 45 μL and Store at -20 °C. |
| DMSO | Sigma | D4540 | |
| FBS | Life technologies | 10270106 | Heat-inactivate at 56 °C during 30 min, do aliquots and freeze down. Warm in 37 °C water bath before use. |
| MEM-α | Invitrogen | 32571-028 | Store at 4 °C. Warm in 37 °C water bath before use. |
| Myelocult H5100 | corning | 5100 | Store at 4 °C. Warm in 37 °C water bath before use. |
| 199 | Gibco | 41150-020 | Store at 4 °C. Warm in 37 °C water bath before use. |
| hMSC-FBS, Heat-inactivated | Gibco | 12662-029 | Store at -20 °C. Warm in 37 °C water bath before use. |
| P/S | Sigma-Aldrich | P0781 | Store at -20 °C. Warm in 37 °C water bath before use. |
| ECGS | Millipore | 02-102 | Dilute in culture media and use 0.22 mm filter. |
| HEPES | Sigma-Aldrich | S1558-50ML | Store at 4 °C. |
| Heparin | Sigma-Aldrich | H3149 | Store at 4 °C. |
| Glutamine | Gibco | 25030 | Store at -20 °C. |
| Collagen 1 coated cell culture plate | corning | 354505 | |
| Trypsin-EDTA solution | Thermo-Fisher | 25200056 | Store at -20 °C. Warm in 37 °C water bath before use. |
| hMSC | Lonza | PT-2501 | Alternatively, hMSCs we also kindly provided by Dr. Dosquet (University Paris Diderot, Paris) from human bone marrow obtained during orthopaedic surgery under ethical approval 10-038 from IRB00006477. |
| VeraVec HUVEC endothelial cells | Angiocrine bioscience | hVera101 | Alternatively, other human endothelial cell source may be used. |
| Human hematopoietic cells | Umbilical Cord blood or primary Acute Myeloid Leukemia (AML) samples were obtained from the Royal London Hospital (London, UK) after informed consent and protocol of use was approved by the East London Ethical Committee and carried out in accordance with the Declaration of Helsinki. | ||
| Gelfoam, Size 12 - 7mm | Pfizer | 00009-0315-08 | Alternative supplier: Febelco |
| PBS | Thermo-Fisher | 10010023 | |
| Surgical material | Multiple | Sterile forceps, tweezers and sharp scissors. | |
| Sterile tissues | Heat-sterilize paper tissues. | ||
| 1 mL Syringe with needle of 25G | Terumo | SS+01H25161 | |
| Ultra Low Attachment Multiple Well Plates | Corning | 3473 or 3471 | |
| BMP2 | Noricum | rhBMP-2 | Dilute at 5 mg/mL in acetic acid 50 mM and store at 4 °C. |
| Thrombin | Sigma | T8885 | Dilute in CaCl2 2%, 500 mL per vial, and store at 4 °C. |
| Fibrinogen | Sigma | F3879 | Dilute at 4 mg/100 mL in PBS. Store at -20 °C. Warm before use. |
| Tissue-culture dishes 35 mm x 10 mm | Falcon | 353001 | |
| U-Botton 96 well plate | Falcon | 353077 | |
| NSG mice | The Jackson Laboratory | 5557 | NSG mice were a kind gift from Dr Leonard Shultz (The Jackson Laboratory). |
| Chlorhexidine | G9 | Dilute 1:10 before use | |
| Carprofen | Pfizer | Rimadyl | 5 mg/kg of mouse |
| Buprenorphine | Alstoe | Vetergesic | 0.1 mg/kg of mouse body weight |
| Isoflurane | Abbott | B506 | Induction of anaesthesia 2%, maintenance 1% |
| Trimmer | Wella | Contura HS61 | |
| Surgical glue | 3M | Vetbond | |
| carbomer (polyacrylic acid) as Ophthalmic gel | Novartis | Viscotears Liquid Gel | |
| Human Normal Immunoglobulin | Gammaplex | 10g vial | 100 mL/mouse intravenously, 30 min before infusion of specific antibody. |
| NT-QTracker | Invitrogen | Q21021MP | Vessel-pooling agent. Administrate 15 mL/mouse intravenously 5 min before imaging. |
| AF488-hCD45 | Biolegend | 304017 | 100 mL/mouse intravenously, 30 min before imaging. |
| FITC-hCD31 | BD Pharmigen | 555445 | 100 mL/mouse intravenously, 30 min before imaging. |
| Super glue | Loctite | Super Glue | |
| Micro-Drill Kit | IDEAL - Fisher Scientific | NC9010016 | |
| Microsurgical microscope | No specific brand/company is adviced. | ||
| LSM 710 NLO | Zeiss | Upright confocal microscope with motorized stage, two-photon laser and 20X 1.0 NA water immersion lens. Alternatively, a microscope with similar specifications could be used. | |
| MaiTai “High Performance” fully automated 1-box 517 mode-locked Ti:Sapphire laser with DeepSee dispersion compensation | Spectra-Physics | ||
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| Ethanol | Sigma-Aldrich | 32294 | |
| Osteosoft | Millipore | 1.01728.1000 | |
| Polysine slices | Thermo scientific | J2800AMNZ | |
| Antigen unmasking solution | Vector | H-3300 | Store at 4 °C. Dilute 1:100 in H2O for working solution. |
| Triton 100x | Sigma-Aldrich | T9284 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A96470 | Store at 4 °C. |
| Normal Goat serum (NGS) | Sigma-Aldrich | G9023 | Store at 4 °C. |
| Endomucin Antibody | Santa Cruz | sc-65495 | Store at 4 °C. |
| hVimentin antibody | Santa Cruz | sc-6260 | Store at 4 °C. |
| hCD31 antibody | DAKO | M0823 | Store at 4 °C. |
| hCD45 antibody | DAKO | M0701 | Store at 4 °C. |
| ADRP (Perilipin2) | antibodies-online | ABIN283918 | Store at 4 °C. |
| Goat anti mouse secondary antibodies | Invitrogen | A11029 or A11005 | Store at 4 °C. |
| Goat anti Rabbit secondary antibodies | Invitrogen | A11037 or A11008 | Store at 4 °C. |
| Goat anti Rat secondary antibodies | Invitrogen | A11007 or A21247 | Store at 4 °C. |
| Sudan Black | Sigma | S2380 | Prepare a stock of 1% sudan black in ethanol 70%. Store at RT. Prepare working solution of 0.1% sudan black in ethanol 70% and filter using filter-paper before use. |
| DAPI | Sigma | D8417 | Prepare stock in H20 at 100 mg/mg. Store at 4 °C. |
| Fluorescent mounting media | Dako | S3023 | Add DAPI before use (1:400 from DAPI stock). |
| Cover glass | VWR | 631-0147 |
Ссылки
- Hoggatt, J., Kfoury, Y., Scadden, D. T. Hematopoietic Stem Cell Niche in Health and Disease. Annu Rev Pathol. 11, 555-581 (2016).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Zhang, B., et al. Altered microenvironmental regulation of leukemic and normal stem cells in chronic myelogenous leukemia. Cancer Cell. 21 (4), 577-592 (2012).
- Schepers, K., et al. Myeloproliferative neoplasia remodels the endosteal bone marrow niche into a self-reinforcing leukemic niche. Cell Stem Cell. 13 (3), 285-299 (2013).
- Krause, D. S., et al. Differential regulation of myeloid leukemias by the bone marrow microenvironment. Nat Med. 19 (11), 1513-1517 (2013).
- Mendez-Ferrer, S., Scadden, D. T., Sanchez-Aguilera, A. Bone marrow stem cells: current and emerging concepts. Ann N Y Acad Sci. 1335, 32-44 (2015).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Ding, L., Morrison, S. J. Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature. 495 (7440), 231-235 (2013).
- Kunisaki, Y., et al. Arteriolar niches maintain haematopoietic stem cell quiescence. Nature. 502 (7473), 637-643 (2013).
- Pinho, S., et al. PDGFRalpha and CD51 mark human nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion. J Exp Med. 210 (7), 1351-1367 (2013).
- Mizoguchi, T., et al. Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development. Dev Cell. 29 (3), 340-349 (2014).
- Zhou, P., Wang, Y., Li, D., Hu, S. Y., Chen, G. H. Therapeutic efficacy of mixed hematopoietic stem cell transplantation for pediatric hematologic diseases. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 22 (2), 434-439 (2014).
- Sugiyama, T., Kohara, H., Noda, M., Nagasawa, T. Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity. 25 (6), 977-988 (2006).
- Tzeng, Y. S., et al. Loss of Cxcl12/Sdf-1 in adult mice decreases the quiescent state of hematopoietic stem/progenitor cells and alters the pattern of hematopoietic regeneration after myelosuppression. Blood. 117 (2), 429-439 (2011).
- Pearce, D. J., et al. AML engraftment in the NOD/SCID assay reflects the outcome of AML: implications for our understanding of the heterogeneity of AML. Blood. 107 (3), 1166-1173 (2006).
- Sanchez, P. V., et al. A robust xenotransplantation model for acute myeloid leukemia. Leukemia. 23 (11), 2109-2117 (2009).
- Uzan, B., et al. Interleukin-18 produced by bone marrow-derived stromal cells supports T-cell acute leukaemia progression. EMBO Mol Med. 6 (6), 821-834 (2014).
- Foster, K., et al. Different Motile Behaviors of Human Hematopoietic Stem versus Progenitor Cells at the Osteoblastic Niche. Stem Cell Reports. 5 (5), 690-701 (2015).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Holzapfel, B. M., Wagner, F., Thibaudeau, L., Levesque, J. P., Hutmacher, D. W. Concise review: humanized models of tumor immunology in the 21st century: convergence of cancer research and tissue engineering. Stem Cells. 33 (6), 1696-1704 (2015).
- Scotti, C., et al. Engineering of a functional bone organ through endochondral ossification. Proc Natl Acad Sci USA. 110 (10), 3997-4002 (2013).
- Scotti, C., et al. Recapitulation of endochondral bone formation using human adult mesenchymal stem cells as a paradigm for developmental engineering. Proc Natl Acad Sci USA. 107 (16), 7251-7256 (2010).
- Kuznetsov, S. A., et al. Single-colony derived strains of human marrow stromal fibroblasts form bone after transplantation in vivo. J Bone Miner Res. 12 (9), 1335-1347 (1997).
- Bianco, P., Robey, P. G. Skeletal stem cells. Development. 142 (6), 1023-1027 (2015).
- Vaiselbuh, S. R., Edelman, M., Lipton, J. M., Liu, J. M. Ectopic human mesenchymal stem cell-coated scaffolds in NOD/SCID mice: an in vivo model of the leukemia niche. Tissue Eng Part C Methods. 16 (6), 1523-1531 (2010).
- Groen, R. W., et al. Reconstructing the human hematopoietic niche in immunodeficient mice: opportunities for studying primary multiple myeloma. Blood. 120 (3), e9-e16 (2012).
- Chen, Y., et al. Human extramedullary bone marrow in mice: a novel in vivo model of genetically controlled hematopoietic microenvironment. Blood. 119 (21), 4971-4980 (2012).
- Reinisch, A., et al. A humanized bone marrow ossicle xenotransplantation model enables improved engraftment of healthy and leukemic human hematopoietic cells. Nat Med. 22 (7), 812-821 (2016).
- Sontakke, P., et al. Modeling BCR-ABL and MLL-AF9 leukemia in a human bone marrow-like scaffold-based xenograft model. Leukemia. 30 (10), 2064-2073 (2016).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Antonelli, A., et al. Establishing human leukemia xenograft mouse models by implanting human bone marrow-like scaffold-based niches. Blood. 128 (25), 2949-2959 (2016).
- Holzapfel, B. M., et al. Tissue engineered humanized bone supports human hematopoiesis in vivo. Biomaterials. 61, 103-114 (2015).
- Reinisch, A., et al. Epigenetic and in vivo comparison of diverse MSC sources reveals an endochondral signature for human hematopoietic niche formation. Blood. 125 (2), 249-260 (2015).
- Lee, J., et al. Implantable microenvironments to attract hematopoietic stem/cancer cells. Proc Natl Acad Sci USA. 109 (48), 19638-19643 (2012).
- Lee, J., Heckl, D., Parekkadan, B. Multiple genetically engineered humanized microenvironments in a single mouse. Biomater Res. 20 (19), 1-13 (2016).
- Ho, M. S., Medcalf, R. L., Livesey, S. A., Traianedes, K. The dynamics of adult haematopoiesis in the bone and bone marrow environment. Br J Haematol. 170 (4), 472-486 (2015).
- Bersani, F., et al. Bioengineered implantable scaffolds as a tool to study stromal-derived factors in metastatic cancer models. Cancer Res. 74 (24), 7229-7238 (2014).
- Thibaudeau, L., et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies. Cancer Metastasis Rev. 33 (2-3), 721-735 (2014).
- Holzapfel, B. M., et al. Species-specific homing mechanisms of human prostate cancer metastasis in tissue engineered bone. Biomaterials. 35 (13), 4108-4115 (2014).
- Thibaudeau, L., Holzapfel, B. M., Hutmacher, D. W. Humanized mice models for primary bone tumor and bone metastasis research. Cell Cycle. 14 (14), 2191-2192 (2015).
- Thibaudeau, L., et al. A tissue-engineered humanized xenograft model of human breast cancer metastasis to bone. Dis Model Mech. 7 (2), 299-309 (2014).
- Abarrategi, A., Foster, K., Hamilton, A., Mian, S., Passaro, D., Gribben, J., Mufti, G., Bonnet, D. Versatile humanized niche model enables study of normal and malignant human hematopoiesis. J Clin Invest. 127 (2), (2017).
- Abarrategi, A., et al. In vivo ectopic implantation model to assess human mesenchymal progenitor cell potential. Stem Cell Rev. 9 (6), 833-846 (2013).
- Rubio, R., et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem Cells. 32 (5), 1136-1148 (2014).
- Abarrategi, A., et al. Multiwall carbon nanotube scaffolds for tissue engineering purposes. Biomaterials. 29 (1), 94-102 (2008).
- Abarrategi, A., et al. Gene expression profile on chitosan/rhBMP-2 films: A novel osteoinductive coating for implantable materials. Acta Biomater. 5 (7), 2633-2646 (2009).
- Abarrategi, A., et al. Biological properties of solid free form designed ceramic scaffolds with BMP-2: in vitro and in vivo evaluation. PLoS One. 7 (3), e34117 (2012).
- Abarrategi, A., et al. Chitosan scaffolds for osteochondral tissue regeneration. J Biomed Mater Res A. 95 (4), 1132-1141 (2010).
- Abarrategi, A., et al. Improvement of porous beta-TCP scaffolds with rhBMP-2 chitosan carrier film for bone tissue application. Tissue Eng Part A. 14 (8), 1305-1319 (2008).
- Prasain, N., Meador, J. L., Yoder, M. C. Phenotypic and functional characterization of endothelial colony forming cells derived from human umbilical cord blood. J Vis Exp. (62), (2012).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. J Vis Exp. , (2016).
- Hong, J. K., Yun, J., Kim, H., Kwon, S. Three-dimensional culture of mesenchymal stem cells. Tissue Eng Regen Med. 12 (4), 211-221 (2015).
- Bara, J. J., et al. Three-dimensional culture and characterization of mononuclear cells from human bone marrow. Cytotherapy. 17 (4), 458-472 (2015).
- Dong, H. W., Qin, S., Rafailovich, M., Ma, Y. Developing an Optimal Biofunctional Scaffold for Hematopoietic Stem Cell Quiescent Maintenance and Expansion. N Am J Med Sci. 8 (2), (2015).
- Raic, A., Rodling, L., Kalbacher, H., Lee-Thedieck, C. Biomimetic macroporous PEG hydrogels as 3D scaffolds for the multiplication of human hematopoietic stem and progenitor cells. Biomaterials. 35 (3), 929-940 (2014).
- Miyoshi, H., Morita, M., Ohshima, N., Sato, C. Expansion of mouse hematopoietic progenitor cells in three-dimensional cocultures on frozen-thawed stromal cell layers formed within porous scaffolds. Exp Hematol. 43 (2), 115-124 (2015).
- Cuddihy, M. J., Wang, Y., Machi, C., Bahng, J. H., Kotov, N. A. Replication of bone marrow differentiation niche: comparative evaluation of different three-dimensional matrices. Small. 9 (7), 1008-1015 (2013).
- Sharma, M. B., Limaye, L. S., Kale, V. P. Mimicking the functional hematopoietic stem cell niche in vitro: recapitulation of marrow physiology by hydrogel-based three-dimensional cultures of mesenchymal stromal cells. Haematologica. 97 (5), 651-660 (2012).
- Leisten, I., et al. 3D co-culture of hematopoietic stem and progenitor cells and mesenchymal stem cells in collagen scaffolds as a model of the hematopoietic niche. Biomaterials. 33 (6), 1736-1747 (2012).
- Ferreira, M. S., et al. Cord blood-hematopoietic stem cell expansion in 3D fibrin scaffolds with stromal support. Biomaterials. 33 (29), 6987-6997 (2012).
- Baldwin, J. G., et al. Periosteum tissue engineering in an orthotopic in vivo platform. Biomaterials. 121, 193-204 (2017).
- Rafii, S., Butler, J. M., Ding, B. S. Angiocrine functions of organ-specific endothelial cells. Nature. 529 (7586), 316-325 (2016).
- Seandel, M., et al. Generation of a functional and durable vascular niche by the adenoviral E4ORF1 gene. Proc Natl Acad Sci USA. 105 (49), 19288-19293 (2008).
- Medyouf, H. The microenvironment in human myeloid malignancies: emerging concepts and therapeutic implications. Blood. 129 (12), 1617-1626 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены