Method Article
Bioingeniería de los microambientes humanizados de la médula ósea en el ratón y su visualización por imágenes en directo
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta un método para crear y vivir-imagen diferentes nichos humanizados de médula ósea en ratones. Basándose en el nicho de soporte creado por las células mesenquimales humanas, la adición de células endoteliales humanas induce la formación de vasos humanos, mientras que la adición de rhBMP-2 induce la formación de tejido óseo maduro quimérico humano-ratón.
Resumen
Las células madre hematopoyéticas humanas (HSCs) residen en el nicho de la médula ósea, una red intrincada y multifactorial de componentes que producen citoquinas, factores de crecimiento y matriz extracelular. La capacidad de las HSC para permanecer quiescentes, renovarse o diferenciarse y adquirir mutaciones y llegar a ser malignas depende de las complejas interacciones que establecen con diferentes componentes estromales. Para observar la diafonía entre HSC humanos y el nicho BM humano en condiciones fisiológicas y patológicas, se diseñó un protocolo para modelar e imagen ectopicamente un nicho de BM humanizado en ratones inmunodeficientes. Mostramos que el uso de diferentes componentes celulares permite la formación de estructuras humanizadas y la oportunidad de sostener el injerto hematopoyético humano a largo plazo. Usando la microscopía de dos fotones, podemos vivir la imagen de estas estructuras in situ a la resolución de una sola célula, proporcionando una nueva herramienta poderosa para la caracterización funcional de la BM humanaIcroenvironment y su papel en la regulación de la hematopoyesis normal y maligna.
Introducción
Las decisiones sobre el destino celular observadas en los compartimentos de las células madre están estrictamente reguladas por factores intrínsecos y extrínsecos. En particular, ahora se reconoce ampliamente que el microambiente BM desempeña un papel fundamental en el control del cambio en las HSC de un estado inactivo a un estado activo, así como en su decisión de auto-renovación o diferenciación 1 . Además, hallazgos recientes indican que las neoplasias malignas hematológicas afectan la función del microambiente BM, señalando la existencia de diafonía activa entre los dos compartimentos 2 , 3 , 4 , 5 , 6 . A pesar de los avances recientes, quedan muchas preguntas clave sobre cómo la actividad de componentes específicos de nicho de BM contribuye al comportamiento de HSC ya la transformación maligna.
El microambiente BM es un Eneosa y compleja de muchos tipos diferentes de células, cada una con funciones especializadas. El abundante componente endotelial (CE) y vascular regulan la circulación de nutrientes y metabolitos, la entrada y salida de diferentes células hacia y desde el BM, y varias funciones HSC 7 , 8 . Las células del estroma mesenquimal (CSM), una población heterogénea de células madre indiferenciadas y progenitores comprometidos a través de tres linajes diferentes ( es decir, osteogénica, condrogénica, adipogénica), son otro componente fundamental del nicho BM. Estos MSCs localizan tanto en áreas centrales de la BM y en la proximidad de la región endosteal. Pueden estar asociados con estructuras vasculares y están implicados en la regulación de la función HSC 9 , 10 , 11 , 12 , 13 ,"> 14 , 15 .
Muchos informes sugieren que HSCs residen en varios sitios definidos dentro de la médula y que su función podría depender de su localización precisa. La mayor parte del conocimiento actual sobre HSCs y su interacción con el microambiente BM deriva de estudios murinos 1 . El uso de modelos de xenoinjerto ha extendido este conocimiento a HSC normales y malignas humanas, injertándose dentro de la BM murina de ratones inmunodeficientes 16 , 17 , 18 , 19 , 20 . Aunque esto representa un modelo válido, todavía presenta muchos desafíos, tales como la necesidad de condicionar al ratón receptor en la mayoría de los casos para permitir el homing y el injerto de HSC humano o la barrera entre especies y su influencia poco comprendida en las interacciones célula-célula Funciones.
El uso de anticuerpos neutralizantes y ratones modificados genéticamente, junto con el xenotrasplante, ha sido un instrumento para destacar el complejo diálogo que las HSC humanas establecen con sus microambientes. La introducción y desarrollo de la microscopía confocal intravital de dos fotones ha llevado a estos estudios a un paso adelante, permitiendo la imagen directa, de alta resolución y dinámica de la médula ósea 19 , 20 , 21 , 22 y proporciona una poderosa herramienta para la funcionalidad Caracterización del microambiente BM y su papel en la regulación de la función HSC. Con el fin de eludir algunos de los problemas que surgen en los modelos clásicos de xenotrasplante, se ha puesto de relieve el concepto de ingeniería de una estructura de BM humanizada. Fusión de biomateriales y conceptos de implantación celular, los informes han demostrado la viabilidad de imitar el hueso humano mArrow microambiente en regiones heterotópicas 23 , 24 , 25 , 26 , 27 . Esto abre la posibilidad de utilizar la bioingeniería en modelos de ratones para estudiar la hematopoyesis humana normal y maligna 28 , 29 , 30 , 31 , 32 , 33 , 34 , 35 , 36 , 37 , 38 , 39 , tumorigénesis y metástasis 40 , 41 , 42. , 43 , 44 .
Basado en la experiencia previa en ingeniería de tejido óseo y en imágenes in vivo 19 , 22 , 45 , 46 , 47 , 48 , 49 , 50 , 51 , 52 , describimos un protocolo para bioingeniería y tejidos BM humanos organotípicos de imagen viva. Estas estructuras se originan de la implantación de células estromales derivadas de BM humanas en andamios basados en colágeno subcutáneamente injertados en ratones inmunodeficientes. En un informe anterior, hemos demostrado que humanos MSCs garantizar la formación de un microambiente humano adecuado para el injerto de células hematopoyéticas humanas [ 45] . Además, aquí se describe cómo la co-implantación de otros humanos BM componente celularS, tales como las células endoteliales humanas (hEC), y / o citoquinas importantes para la formación ósea ( por ejemplo, hBMP2), cooperan con hMSCs para generar diferentes microambientes humanizados, que pueden ser imágenes vivas in situ .
Protocolo
Todos los experimentos con animales se realizaron con PPL 70/8904, aprobado por el Ministerio del Interior del Reino Unido y de acuerdo con las directrices de Cancer Research UK. El Comité de Ética de East London aprobó el uso de muestras de sangre humana del cordón umbilical (UCB) y de leucemia mieloide aguda humana (AML), después de recibir el consentimiento y se llevó a cabo de conformidad con la Declaración de Helsinki.
1. Andamios basados en colágeno de bioingeniería con células hematopoyéticas y estromales humanas
NOTA: Todo el protocolo debe realizarse en condiciones estériles y con material estéril. El medio de cultivo celular 1 corresponde al medio hMSC (MEM - alpha, P / S, y hMSC - FBS al 10%); El medio de cultivo celular 2 corresponde al medio EC (M199, 20% de FBS, P / S, HEPES 10 mM, heparina 50 μg / ml, glutamina 2 mM y ECGS de 50 μg / mL) y el medio de cultivo celular 3 corresponde al medio celular hematopoyético Y P / S).
- Preparar la sangre del cordón umbilical mOnonucleares (CB-MNCs) o primaria AML (médula ósea o sangre periférica MNCs) utilizando un gradiente de densidad Ficoll-Paque, de acuerdo con protocolos bien establecidos [ 53] .
- Para AML, agotar las células T utilizando OKT.3 anticuerpos. Incubar 4 μg de OKT.3 por 1 x 10 6 AML MNC durante 30 min a temperatura ambiente antes de lavar las células en PBS. Si es necesario, criopreservar las MNC en FBS con DMSO al 10% a 2 x 10 8 células por ml.
- Preparar cultivos de células hMSC (medio de cultivo 1) y EC (medio de cultivo 2). Las células hMSC de placa (véase la Tabla de Materiales ) en matraces de cultivo celular regulares en medio hMSC. Placas CE (véase la Tabla de Materiales ) sobre superficies recubiertas de colágeno 1 en medio EC.
- En la confluencia de células 85-90% retirar el medio, lavar dos veces con PBS, y añadir una solución de tripsina-EDTA (20 l por cm 2).
- Después de 5 minutos, compruebe que las células están desprendidas. Recuperar las células diluyendo 1:3 con medio de cultivo celular. Centrifugar a 300 xg durante 5 min y volver a suspender en el medio correspondiente para cada tipo de célula y contar las células utilizando una cámara de Neubauer.
- Utilizar células a 2 x 10 6 - 10 7 células por ml. Si ambos tipos de células necesitan ser utilizados juntos, mezcle las suspensiones hMSC y EC en una proporción de 1: 1.
- Transferir la suspensión celular a una jeringa de insulina.
- Utilizando un bisturí, corte la esponja de gelatina esterilizada ( por ejemplo, gelfoam) (20 mm x 60 mm x 7 mm) en 24 piezas de tamaño similar (6,6 mm x 7,5 mm x 7 mm), Figura 1A y B ).
- Reconstituir los andamios de gelatina por inmersión en PBS (5 min).
- Uno por uno, suavemente poner los andamios en un tejido estéril para eliminar el exceso de PBS. La transferencia de los andamios para un pocillo de una (superficie de fijación ultra-bajo) de 24 pocillos de placa y usar la jeringa para inyectar 50 l que contenía 10 5 - 10 6 células (hMSC alUno o en combinación con hEC; Figura 1C ).
- Repita el paso 1.7 con cada andamio hasta que todos los andamios necesarios se siembren con células estromales.
- Incubar durante 1 h dentro de una incubadora de cultivo celular (37 ° C y CO 2 5%).
- Llenar cada pocillo con 3 ml de medio de cultivo celular 1 ( Figura 1D ) y devolver los andamios a una incubadora de cultivo celular (37 ° C y CO 2 5%) para la incubación durante la noche. Utilizar el medio de cultivo celular 2 si se utilizan EC en los andamios.
- Descongelar CB-MNCs y aislar células CD34 + de ellos siguiendo un protocolo de kit de sección CD34 + apropiado. Suspender las células CD34 + seleccionadas en el medio 3 y contarlas en una cámara Neubauer.
NOTA: En este caso, se usaron células a una concentración de 2 x 106 células por ml.- Si se utilizan muestras primarias derivadas de AML, descongelar las células, diluirlas 1:10 en FBS, centrifugarlas durante 5 min a 300Xg, resuspender las células en PBS-2% FBS, añadir anti-CD3 anticuerpo humano (2-4 μ g por 10 6 células), e incubar a temperatura ambiente durante 30 min. Centrífuga durante 5 min a 300 xg y resuspender en medio de células hematopoyéticas suplementado con citoquinas (20 ng / ml de factor de estimulación de colonias de granulocitos (G-CSF), 20 ng / ml de IL-3 y 20 ng / mL de trombopoyetina (TPO) .
- Repita los pasos 1.7 - 1.9 pero en este caso semilla 1 x 10 5 células hematopoyéticas humanas en lugar de componentes estromales, como se ha indicado anteriormente.
- Llenar el pocillo con 3 ml de medio de cultivo celular 3 ( Figura 1D ) y devolver los andamios a una incubadora de cultivo celular (37ºC y CO 2 5%) para la incubación durante la noche. Utilice una mezcla 1: 1 de medios de cultivo celular 2 y 3 Si se utilizan EC en los andamios.
- Para sólo los andamios portadores de la proteína 2 morfogenética del hueso humano recombinante (rhBMP-2), poner suavemente los andamios uno a uno sobre un tejido estéril para eliminar el exceso de PBS. Transferir los andamios a un pocillo de una placa de 96 pocillos de fondo u ( Figura 1E ) y añadir 5 μl de rhBMP-2, cubriendo completamente el andamio.
- Añadir 20 μL de trombina seguido de 20 μl de fibrinógeno, cubriendo a fondo el andamio cada vez ( Figura 1F ). Repita el procedimiento para cada andamio hasta que todos los andamios necesarios se tratan y luego se incuba durante 5 - 10 min a 37 ° C. Compruebe si la coagulación se ha formado con éxito.
2. Implantación Quirúrgica de Andamios Bioingeniería
NOTA: Aquí se usaron ratones NSG de 6 a 12 semanas de edad, machos o hembras. Dado que los animales son inmunodeficientes, todos los procedimientos deben realizarse en condiciones estériles. Los pasos 2.10 a 2.13 están relacionados con las estrategias de supervivencia y la atención posquirúrgica.
- 60 - 120 min antes de la cirugía, administrar por vía subcutánea analgésicos (carprofeno, 5 mg / kg de peso corporal / ratón).
- Inducir la anestesia en una cámara con 0,5% de isoflurano y 2 L / min de O 2 . Los ratones deben ser monitorizados continuamente durante el procedimiento. Transferir el animal al área quirúrgica en posición prona para tener fácil acceso a la espalda. Mantenga el animal bajo anestesia usando un cono de nariz que suministre 1,5% de isoflurano y 2 L / min de O 2 . Mantenga el ratón bajo anestesia durante el procedimiento quirúrgico y verifique con frecuencia el estado animal.
- Mientras esté bajo anestesia, use gel oftálmico en los ojos del ratón para evitar la sequedad y mantenga el ratón a 37 ° C.
- Afeita el área quirúrgica en la parte posterior del ratón usando un recortador eléctrico. Para esterilizar la piel, sumerja una punta de algodón en clorexidina diluida (diluida 1:10 en PBS) y utilice esta punta para limpiar la superficie de la piel. Repita este procedimiento dos veces.
- Usando pinzas estériles y un bisturí (o tijeras), realice una incisión completa de la piel de 0,5 a 0,7 cm de ancho a posterior. Utilice la pinza insertadaBajo el tejido subcutáneo para hacer un bolsillo.
- Inserte el andamio subcutáneamente, asegurándose de que está colocado profundamente dentro del bolsillo ( Figura 1G y H ). Cierre la incisión con pegamento quirúrgico ( Figura 1I y J ).
- Para tratar el dolor posquirúrgico, administrar buprenorfina por vía subcutánea (0,1 mg / kg de peso corporal).
- Durante la recuperación, coloque el animal en su lado en una jaula precalentada y supervise la recuperación hasta que se observe el comportamiento normal.
- Diluir el medicamento para el dolor en agua (carprofeno, 0.1 mg / mL de agua) y suministrarlo a los animales como agua potable durante 4 días después de la cirugía.
- Compruebe frecuentemente el animal y la herida durante los 48 h posteriores a la cirugía para detectar posibles efectos adversos.
3. Tratamientos de ratón, eutanasia y recuperación de muestras para imágenes
NOTA: El análisis de los andamios se realiza entre8 y 24 semanas después de la implantación.
- 60 min antes de la obtención de imágenes, mantener el ratón implantado caliente en una caja de calentamiento a 37 ° C y administrar por vía intravenosa 100 μl de inmunoglobulina humana para bloquear sitios inespecíficos.
- 30 min antes de la formación de imágenes, administrar por vía intravenosa 10 μg (por ratón) de anticuerpos específicos para marcar las células de interés.
- 5 min antes de la formación de imágenes, administrar por vía intravenosa 15 μL (diluido en 100 μl de PBS) de un agente de agrupación de vasos (655-VPA) marcado con fluoróforo de 655 nm para visualizar estructuras vasculares.
- Eutanasia del ratón mediante dislocación cervical.
- Usando tijeras afiladas, haga una incisión cutánea longitudinal en la parte posterior del ratón, cerca del sitio de implantación original.
- Con la ayuda de pinzas y tijeras, cuidadosamente separar la piel de la bolsa subcutánea donde el andamio se ha implantado.
- Sostenga el andamio con una pinza y suavemente explante de la piel cortando la membrana residual aNd tejido que rodea el andamio usando tijeras. Ver ejemplos de andamios que se recuperarán en la Figura 2 .
- Asegure el andamio con pegamento adhesivo de acción rápida a una placa de imagen (una placa de Petri de 35 mm x 10 mm) y rellene con solución salina (PBS) a temperatura ambiente.
- Para los andamios BMP, antes de llenar la placa con PBS, utilice un microdrill quirúrgico para adelgazar la superficie ósea bajo un microscopio microquirúrgico; Esto permite la visualización fluoróforo y captura de imágenes de alta resolución. Utilice las fresas de 1,2 o 1,6 mm, dependiendo del tamaño del andamio.
NOTA: El usuario se dará cuenta de cuánto taladrar dependiendo del grosor del hueso. En general, a medida que los andamios BMP son vascularizados, el hueso cambiará ligeramente de color y se volverá más rojo cuando se aproxima al espesor correcto para la formación de imágenes. - Insertar la placa en la etapa del microscopio confocal.
4. Imágenes en vivo utilizando Microscopio de dos fotonesOpio
NOTA: Cuando utilice detectores no descentrados (NDD), utilice siempre el control deslizante NDD para la imagen para dirigir la fluorescencia al NDD. La configuración del microscopio se proporciona en la Figura 3 .
- Encienda el microscopio y el ordenador, inicie el software haciendo clic en "Iniciar Sistema" y vaya al modo "Adquisición".
- Marque la casilla "Mostrar herramientas manuales". En el menú "Laser", encienda el láser de dos fotones y déjelo calentar y estabilizar.
- En el menú "Imaging Setup", simultáneamente active "Channel Mode" y "Switch track every Frame". En el menú "Light Path", seleccione "Non Descanned '" y "Splitter Principal MBS 760+". Marque para activar los cuatro NDD y configure la configuración como se ilustra en la Figura 3 .
NOTA: Con esta configuración, la señal de colágeno de las estructuras óseasSHG) se recoge a 380 - 485 nm, células endoteliales humanas FITC - hCD31 + y células hematopoyéticas humanas AF488 - hCD45 + a 500-550 nm, y 655 - VPA a 640 - 690 nm. - En el menú "Canales", ajuste la "longitud de onda del láser" a 890 nm y la potencia al 50%. Ajuste el "Gain (Master)" a 500-600, el "Digital Offset" a 0, y el "Digital Gain" a 15 para cada canal. Ajuste estos valores una vez iniciada la adquisición.
- En "Modo de Adquisición", configure los parámetros requeridos para obtener imágenes de alta resolución sin dañar el tejido y blanquear los fluoróforos. Ajuste "Modo de escaneo" a "Marco", "Tamaño de cuadro" a "x512 y512", "Paso de línea" a 1, "Velocidad" a 9, "Número de media" a 8, "Profundidad de bits" a " Modo "a" línea "," Dirección "a" bidireccional "y" Método "a" significa ".
- Establecer el "ZoOm "a 1 para el escaneado inicial de la imagen, e incrementarla si es necesario para enfocar áreas particulares.
- Coloque la placa que contiene el andamio en la etapa del microscopio debajo de la lente de inmersión de agua de 20X, 1,0 NA y baje la lente hasta que toque la solución salina. Ajuste el foco de la lente en el andamio usando los oculares del microscopio, usando una lámpara como fuente de luz.
- Active el menú "Z-stack", seleccione la función "First / Last" y establezca el intervalo necesario entre dos segmentos sub-secuenciales ( p. Ej., Pila Z de 2 μm). Mantenga los intervalos constantes dentro de la pila Z.
- Seleccione "Live" para visualizar una imagen en vivo de la muestra y ajustar "Digital Gain" y "Digital Offset" para una exposición óptima. Para visualizar múltiples canales al mismo tiempo, seleccione la función "Split".
- En el menú "Escenario", mientras que en el modo "En directo", escanear la imagen y "Marcar" regiones de interEst (ROI), tales como la localización de células hematopoyéticas humanas y estructuras vasculares. Cuando el escaneo de la muestra se haya completado, muévase al primer ROI para iniciar la obtención de imágenes.
- En el modo "Live", ajuste la parte superior e inferior de la pila Z 3D alrededor del área de interés usando las funciones "Set first" y "Set last". Una vez terminado, ajuste el centro, "C." Inicie la adquisición del ROI con el botón "Iniciar experimento". Vea ejemplos de imágenes en la Figura 4 , Figura 5 y Figura 6 .
- Una vez finalizada la adquisición, guarde la imagen en la carpeta designada. Vaya al siguiente ROI y repita el paso 4.10. Una vez terminado el experimento, retire la placa de imagen del microscopio, separe cuidadosamente la muestra de la placa y limpie cualquier pegamento residual.
- Preparar la muestra para la siguiente técnica de análisis.
5. Ejemplo de procesamientoG para histología e inmunotinción
NOTA: Las muestras se procesan de acuerdo con el protocolo descrito en las técnicas de laboratorio generales JoVE 54 que describen los procesos de fijación de la muestra, incrustación y seccionamiento. Las muestras que forman hueso deben ser tratadas durante 7 días en un agente decalcificante basado en EDTA entre los procesos de fijación y de inclusión. La solución de bloqueo / permeabilización es tampón PBS 10 mM pH 7,4 con Triton X-100 al 1%, albúmina de suero bovino al 1% (BSA) y suero de cabra normal (NGS) al 10%.
- Se ponen las rebanadas en xileno durante 10 minutos), xileno durante 5 min, etanol al 100% durante 5 min, etanol al 70% durante 5 min, etanol al 50% durante 5 min y H _ { 2} O durante 5 min.
- Transfiere las rodajas a una solución de trabajo para desenmascarar el antígeno a base de citrato.
- Hervir las rebanadas durante 15 minutos y dejar que se enfríen a temperatura ambiente.
- Lavar las rodajas en solución de PBS 10 mM pH 7,4 con Triton X-100 al 1% (5 min, 3 veces).
- Transferir el samA la solución de bloqueo / permeabilización e incubar durante 30 min.
- Añadir anticuerpo primario diluido en solución de bloqueo / permeabilización e incubar durante la noche a 4 ° C.
- Lavar las rodajas en solución de PBS 10 mM pH 7,4 con Triton X-100 al 1% (5 min, 3 veces).
- Añadir anticuerpo secundario diluido en solución de bloqueo / permeabilización durante 1 h en la oscuridad a temperatura ambiente.
- Lavar con H _ { 2} O (5 min, 3 veces).
- Para reducir la fluorescencia de fondo, sumerja las rodajas en la solución de trabajo Sudan Black durante 10 min, en la oscuridad ya temperatura ambiente.
- Lavar las rodajas en H 2 O (5 min, 3 veces).
- Montar las rodajas utilizando medio fluorescente de montaje con DAPI (0,5 μ g / mL).
- Guarde las rebanadas a 4 ° C y compruebe que el medio de montaje esté seco antes de realizar la formación de imágenes fluorescentes. Vea las imágenes de ejemplo en la Figura 7 .
Resultados
En la Figura 1 , se muestran imágenes representativas de los procesos de siembra de células de andamio y de implantación. En la Figura 1C , tenga en cuenta que las células se inyectan directamente en el andamio. En la figura 1G , observe que se realiza una incisión en la parte posterior del ratón, donde se crea la cavidad subcutánea y se implanta el andamio. La figura 2 muestra la morfología macroscópica de diferentes andamios implantados en ratones NSG y recuperados después de 8 semanas. Obsérvese la ligera vascularización en los andamios sembrados con hMSC ( Figura 2A ). La co-siembra de ECs humanos con hMSCs en el andamio permite la formación de vasculatura más relevante en andamios ( Figura 2B ]. Por último, la presencia de rhBMP-2 induce la formación ósea. Los andamios recuperados son más grandes en este caso, y están constituidos porHueso-parecido al tejido duro.
La Figura 3 muestra la configuración de canal configurada en el microscopio para imágenes en vivo con NDD (detalles en la leyenda de la figura). La Figura 4 y el Vídeo 1 muestran células hematopoyéticas humanas en andamios recubiertos de hMSC. Los andamios fueron explantados 8 semanas después de la implantación y después de la inoculación intravenosa de anticuerpo AF488-hCD45 y 655-VPA. Este procedimiento permite la visualización de las células hematopoyéticas humanas implantadas y la estructura vascular mediante microscopía confocal de dos fotones. En este caso, las imágenes muestran vasos sanguíneos (655-VPA) en andamios y el injerto a largo plazo de células hematopoyéticas humanas (AF488-hCD45) en el parénquima del andamio. La Figura 5 y el Vídeo 2 corresponden a andamios humanos sembrados con hECs y hMSCs. 8 semanas después de la cirugía, andamios fueron explantados después de la intravenosaO una inoculación del anticuerpo FITC-hCD31 y 655-VPA, y las imágenes se adquirieron con un microscopio confocal de dos fotones, como se mencionó anteriormente. Las imágenes muestran la participación de hECs en la formación de vasos en el andamio, resultando en una vasculatura quimérica murino-humana.
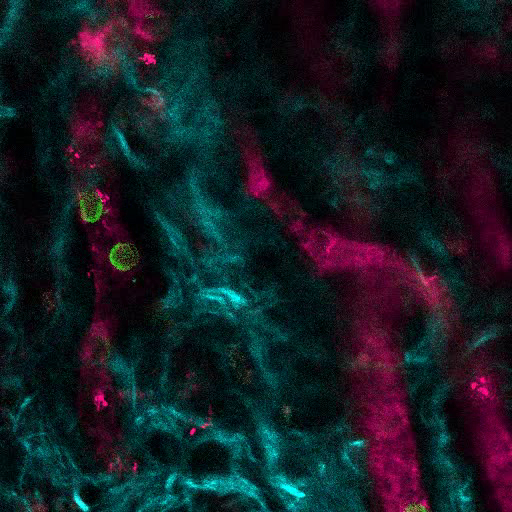
La figura 6A muestra datos representativos de la aproximación utilizada para estimular la formación ósea en andamios MSC. Similar a las cifras anteriores, 8 semanas después de la implantación, se realizó la inoculación intravenosa de 655-VPA, se recuperaron andamios y se adquirieron imágenes con microscopía confocal de dos fotones. Los andamios estimulados con rhBMP-2 inducen la formación de tejido óseo, lo que se puede visualizar debido al SHG (color ciano en las imágenes) proporcionado por el calcio en el hueso. Las imágenes proporcionadas también muestran la formación de cavidades y tejido endosteal vascularizado, que se asemejan mucho al tejido endosteal BM. En la figura 6B y Video 3 , los hECs fueron co-implantados con hMSCs. Los andamios se recuperaron después de la inoculación intravenosa de anticuerpo FITC-hCD31 y 655-VPA, y las imágenes de microscopía confocal de dos fotones muestran la participación de hECs en la neovascularización en un andamio de formación de hueso.
La figura 7 muestra imágenes representativas de histología, un procedimiento realizado para corroborar los resultados previamente descritos. Las imágenes inmunofluorescentes muestran vasculatura de ratón, hECs, hMSCs y células hematopoyéticas humanas injertadas a largo plazo en las estructuras de andamio. Los andamios recuperados de ratones se fijaron y se utilizaron para la inmunofluorescencia. En los soportes de formación de hueso portador de rhBMP-2 ( Figura 7D- F ), observe la morfología del tejido, que se asemeja a médula ósea madura con tejido adiposo. En este andamio de formación de hueso, mostramos que hMSCs son fibroblastos, lo que indicaría tQue contribuyen a tejido recién formado como células del estroma. También se muestra la expresión de los adipocitos humanos marcador, lo que indicaría que hMSCs también contribuyen a la formación de tejido adiposo.
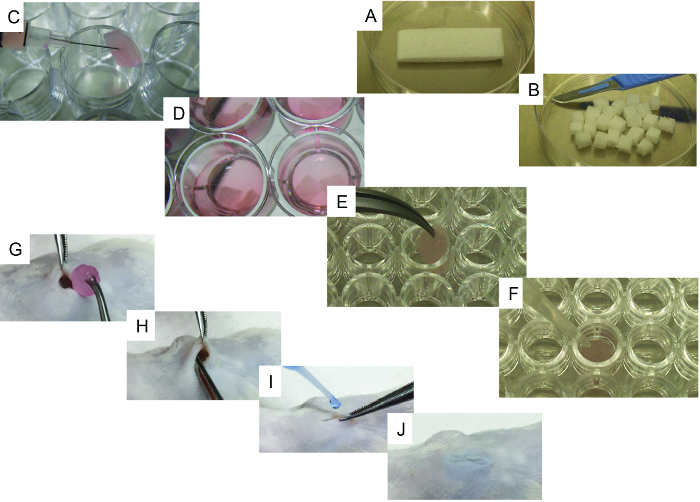
Figura 1. Imágenes representativas de los procesos de siembra e implantación celular. A) Andamio inicial y su método de corte utilizando un bisturí. B) 24 piezas obtenidas del andamio inicial. C) Método de siembra de células de andamiaje utilizando una jeringa. D) Andamios semillados con medio de cultivo, listos para ser implantados. EF) Pasos específicos para los andamios de formación de hueso: E) andamiaje que se transfiere a una placa de 96 pocillos de fondo en U y F) imagen representativa del método usado para añadir rhBMP2, trombina y fibrinógeno al andamio. GJ) Surgi Procedimiento de implantación cal en anestesia general: G) herida creada en la implantación de piel y andamio, H) método de implantación, e IJ) procedimiento de cierre de herida con cola quirúrgica. Haga clic aquí para ver una versión más grande de esta figura.
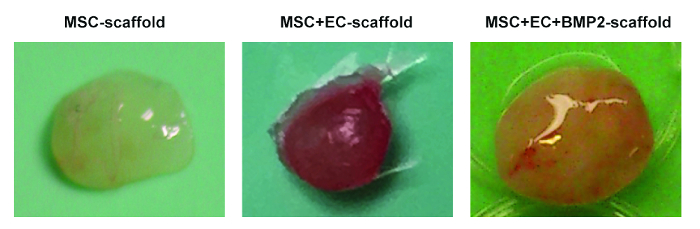
Figura 2. Diferentes Andamios Recuperados de Ratones. Imágenes representativas de andamios MSC (izquierda), andamios MSC + EC (medio) y andamios MSC + EC + BMP (derecha). Haga clic aquí para ver una versión más grande de esta figura.
4 / 55914fig3.jpg "/>
Figura 3. Configuración del canal. Se muestra la configuración del filtro del microscopio. A) Hay cuatro módulos detectores NDD: en el primer módulo, hay dos cubos de filtro; El segundo y tercer módulos tienen un cubo de filtro cada uno; Y el último módulo no tiene cubo (no utilizado). El primer tubo fotomultiplicador (PMT) es para el canal rojo lejano (640 - 690 nm), que refleja las longitudes de onda inferiores; Los siguientes son 380 - 485 nm, 500 - 550 nm, y 555 - 625 nm (el orden es siempre de las longitudes de onda inferiores a mayores). B) Las emisiones de fluoróforos detectables con las configuraciones anteriores (codificadas por colores). Haga clic aquí para ver una versión más grande de esta figura.
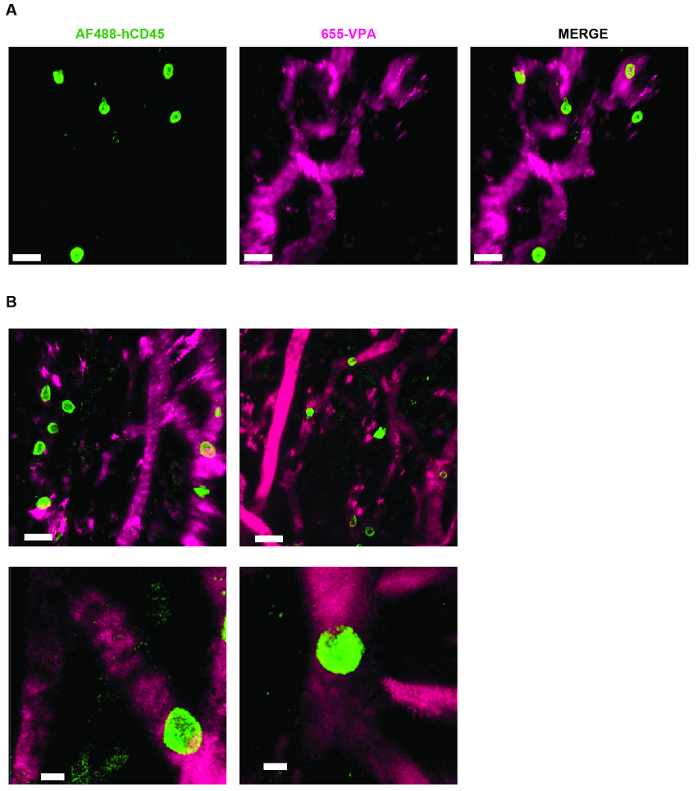
Figura 4. Andamio MSC S Permitir la formación de un nicho para las células hematopoyéticas humanas. A) y B) reconstrucciones en 3D de las pilas Z tomadas después del explante, después de la inoculación intravenosa con AF488-hCD45 (verde), para marcar células hematopoyéticas humanas, y 655-VPA (magenta) m para marcar la vasculatura. Las barras de escala representan 20 μm en A y B (paneles superiores) y 5 μm en B (paneles inferiores). Haga clic aquí para ver una versión más grande de esta figura.
Video 1. MSC Scaffolds permiten la formación de un nicho para las células hematopoyéticas humanas . Reconstrucción 3D de células hematopoyéticas humanas (AF488-hCD45) asociadas con la vasculatura (655-VPA) en el andamio MSC (estructuras de colágeno: SHG, cian). Cada pila mide 140 x 140 μm.Ef = "https://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/55914/55914video1.mov" target = "_ blank"> Haga clic aquí para ver este video. (Haga clic derecho para descargar.)
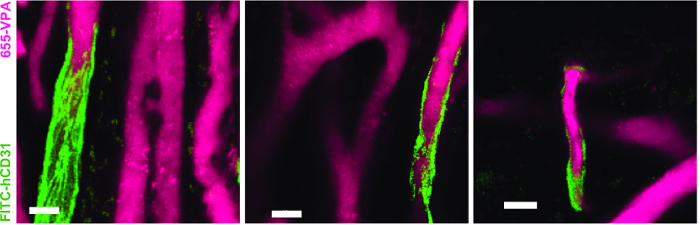
Figura 5. Las EC humanas participan en la formación de vasos humanizados en andamios MSC. Reconstrucción 3D de la vasculatura (655-VPA) forrado por ECs de origen humano (FITC-hCD31) en andamios MSC + EC. Las barras de escala representan 20 μm. Haga clic aquí para ver una versión más grande de esta figura.

Video 2. Las EC humanas participan en la formación de los vasos humanizados en los andamios del MSC. Reconstrucción 3D de ECs humanas (FITC-hCD31) que alinean el va (655-VPA) en los andamios MSC + EC. Cada pila mide 240 x 240 μm. Haga clic aquí para ver este video. (Haga clic derecho para descargar.)
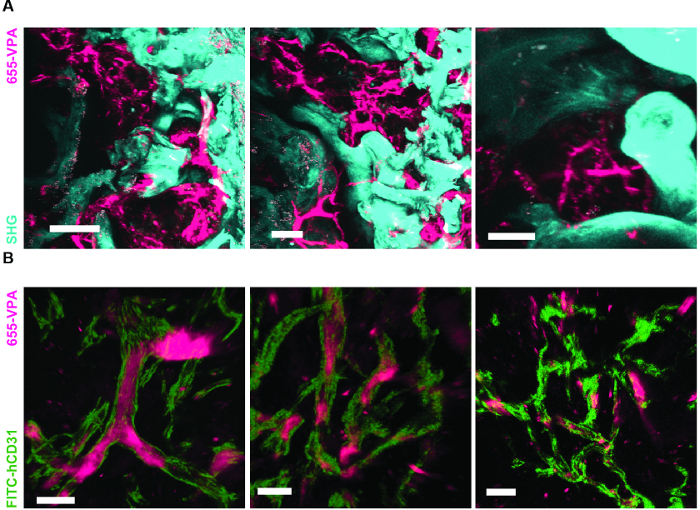
Figura 6. Los andamios portadores de rhBMP-2 tienen superficies óseas y vasos humanizados similares a la médula ósea. A) Reconstrucción 3D de los andamios MSC + BMP mostrando la formación de estructuras óseas (SHG-cyan) y vasculatura (655-VPA). Las barras de escala representan 100 μm (izquierda), 70 μm (medio) y 50 μm (derecha). B) Reconstrucción 3D de los andamios MSC + EC + BMP mostrando vasos humanizados (655-VPA) alineados con ECs humanas (FITC-hCD31). Las barras de escala representan 50 μm (izquierda) y 30 μm (centro y derecha).14 / 55914fig6large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Video 3. Los andamios portadores rhBMP-2 tienen superficies óseas y vasos sanguíneos humanizados similares a la médula ósea. Reconstrucción 3D del andamio MSC + VERA + BMP (hueso: SHG, vasos: 655-VPA, ECs humanas: FITC-hCD31). Cada pila mide 600 x 600 μm. Haga clic aquí para ver este video. (Haga clic derecho para descargar.)
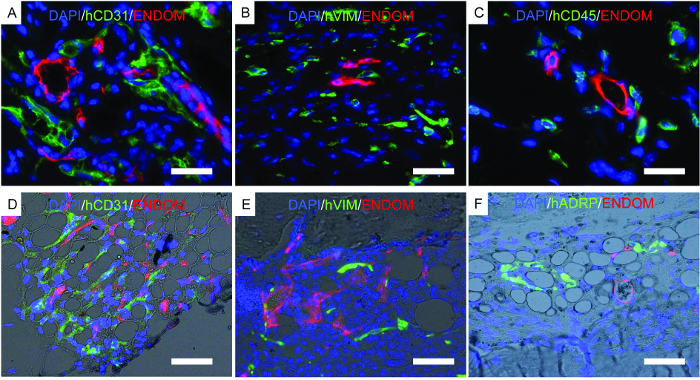
Figura 7. Imágenes representativas de inmunofluorescencia realizadas en andamios fijos. AF) Se realizaron estudios de inmunofluorescencia para localizar células humanas implantadas iN andamios. AC) Andamios implantados con hECs, hMSCs y hHSCs. DF) Andamios de formación de hueso implantados con hECs, hMSCs y hHSCs. Los canales de color son los siguientes: AD) humana EC (hCD31) y estructura vascular de ratón (endomucina, ENDOM), BE) hMSCs (hVimentina, hVIM) y células vasculares de ratón (endomucina, ENDOM) C) células hematopoyéticas humanas (hCD45) Y la vasculatura del ratón (endomucina, ENDOM) y F) la proteína relacionada con la diferenciación adiposa humana (hADRP) y la vasculatura del ratón (endomucina, ENDOM). Las barras de escala representan 10 μm (A y C), 20 μm (B y E) y 40 (D y F) μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Significado con respecto a los métodos existentes:
En este protocolo, describimos un método para generar diferentes microambientes humanizados en ratones y visualizar su arquitectura a través de microscopía de dos fotones e histología. Los datos representativos proporcionados muestran la viabilidad del enfoque, utilizando diferentes células estromales para diseñar tejidos humanizados. El protocolo tiene aplicaciones específicas para el estudio de células hematopoyéticas humanas y células derivadas de nichos de médula ósea en condiciones normales y patológicas. Estas aplicaciones incluyen el estudio de la evolución clonal, la detección de fármacos y la diafonía entre HSCs humanos y componentes estromales. En el campo emergente de la ingeniería de tejidos, se han propuesto varios enfoques alternativos. Los enfoques de la nota incluyen el desarrollo de 3D humanizado BM estructuras in vitro 55 , 56 , 57 ,S = "xref"> 58 , 59 , 60 , 61 , 62 , 63 y el injerto ortotópico de andamios BM humanizados en ratones 64 . Nuestro enfoque tiene la ventaja de combinar tanto la complejidad del sistema in vivo con la fácil accesibilidad anatómica del injerto de tejido humanizado.
Modificaciones y solución de problemas:
Una fuente de variabilidad en este protocolo se puede encontrar en la selección de células utilizadas para sembrar los andamios. En nuestro trabajo, hemos utilizado BM-derivado hMSCs. Sin embargo, las células mesenquimales se pueden obtener de varios tejidos, que pueden mostrar propiedades distintivas dependiendo del origen. Por lo tanto, se puede considerar el uso de hMSCs derivadas de diferentes órganos. Sin embargo, su capacidad para formar tejido óseo in vivo debe ser probado antes de su uso en este pRotocol. Este protocolo utiliza una fuente de células endoteliales humanas comercialmente disponibles ( es decir, HUVEC transducida con E4ORF1). Recientemente, el uso de órgano-células endoteliales específicas para diferentes propósitos se ha informado [ 65 , 66] . Además, el uso de hEC primarias derivadas de la BM podría representar una mejora interesante del protocolo. Por lo tanto, el uso de diferentes fuentes de células endoteliales puede producir diferentes resultados in vivo .
Se utilizó NSG immunocompromised ratones receptores para favorecer la implantación de andamios humanizados y evitar el rechazo de tejido. No excluimos la posibilidad de utilizar este protocolo para la ingeniería ectópica de tejidos de médula ósea en otras cepas de ratón. De hecho, la rhBMP-2 puede inducir la formación ósea en diferentes modelos de mamíferos 47 , 48 , 49 , 50 , 52 . Sin embargo, las diferencias en la viabilidad celular y trasplante a largo plazo es probable que se observan utilizando diferentes cepas / modelos.
La sincronización de la recuperación del andamio también puede ser flexible, dependiendo del propósito final del experimento. En el protocolo presentado, recuperamos muestras a las 8-12 semanas después de la implantación para evaluar el injerto hematopoyético a largo plazo. Para estudiar los primeros pasos de la formación de nicho de BM humano ( por ejemplo, formación de tejido osteocondral 47 o desarrollo vascular), se pueden elegir diferentes puntos de tiempo.
La técnica de imágenes en vivo descrita en este protocolo está indicada para la obtención de imágenes a corto plazo de los explantes. El uso de una cámara equilibrada para mantener la temperatura fisiológica, la tensión de oxígeno y la concentración de CO 2 debería considerarse en los casos de imágenes a largo plazo, como para estudiar comportamientos de motilidad.
Critical StEps dentro del Protocolo:
Entre los desafíos relacionados con el protocolo, destacamos las habilidades técnicas requeridas para algunos pasos. Las células mesenquimales y endoteliales deben utilizarse en los números de paso de células bajas; De lo contrario, no serán capaces de soportar el injerto de células hematopoyéticas humanas in vivo o participar en la vasculatura de novo y la formación ósea in vivo . Recomendamos el uso de hMSCs y hECs en los pasajes 1 - 5. La preparación del andamio y los pasos de siembra de células requieren habilidades básicas de cultivo celular y conocimiento de las propiedades de las células específicas usadas en el procedimiento. El protocolo de cirugía es bastante sencillo, pero requiere cierta práctica. El mantenimiento de un entorno aséptico para evitar la contaminación de los andamios implantados en ratones inmunodeficientes es crucial para asegurar el éxito del experimento. El explante de muestra y la imagen en vivo requieren la práctica quirúrgica (especialmente para el uso del microdrill) y el conocimiento delSistema de microscopio. Por último, el procesamiento de muestras y la histología requieren conocimientos básicos de las técnicas a utilizar.
Limitaciones de la Técnica:
El enfoque que describimos permite la visualización de células hematopoyéticas humanas vivas sembrando un microambiente humanizado de médula ósea, con células endoteliales humanas formando estructuras vasculares y células mesenquimales que forman espacio óseo / médula ósea. A medida que se forma el tejido in vivo , el armazón de ingeniería final seguirá siendo quimérico (humano y murino). Esta cuestión debe tenerse en cuenta, ya que el tejido quimérico puede no imitar completamente la complejidad y el medio ambiente de la médula ósea humana.
Los andamios implantados tienen un tamaño limitado (probamos un máximo de 6,6 x 7,5 x 7 mm), y por lo tanto, son capaces de albergar un número limitado de células para el xenotrasplante. El número absoluto de células recuperadas también será limitado; Por lo tanto, el número de andamios implantadosSe calcula como una función del número de células necesarias para el experimento.
La aplicación de imágenes que describimos es particularmente útil para observar grandes áreas de tejido vivo a profundidades de 150-200 μm desde la superficie sin alterar la arquitectura y dañar las células. Por lo tanto, no permite la visualización de todo el andamio. Si se requiere un escaneo completo del tejido, los enfoques estándar de inmunofluorescencia serían más apropiados.
Aplicaciones futuras:
La dirección futura de este modelo bioingeniería sería aumentar la complejidad de los componentes humanos en el tejido. El conocimiento y la caracterización del nicho humano BM ha progresado en los últimos años 67 , y el protocolo descrito podría ser una plataforma interesante para estudiar la función de estos nuevos componentes celulares y factores solubles, así como su papel en el apoyo normal / malignoHSCs de hormigas.
Además, la técnica de imagen proporciona el potencial para la imagen intravital de los andamios en estudios longitudinales, lo que requeriría mejoras técnicas en la imagen de los andamios en ratones vivos, anestesiados, con recuperación post-quirúrgica. Este enfoque requeriría pasos adicionales y actualmente está siendo investigado en el laboratorio.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al personal de las instalaciones principales del Instituto Francis Crick (Centro de Investigación Biológica, In Vivo Imaging y Experimental Histopathology) y Yolanda Saavedra-Torres y Mercedes Sanchez-Garzon, los veterinarios de Crick y LRI, respectivamente, por su valiosa ayuda. Estamos agradecidos al Dr. W. Gray por leer críticamente el manuscrito. DP recibió el apoyo de una beca de investigación no clínica de la EHA. Este trabajo fue apoyado por el Instituto Francis Crick, que recibe su financiación principal de Cancer Research UK (FC001045), el Consejo de Investigación Médica del Reino Unido (FC001045) y el Welcome Trust (FC001045).
Materiales
| Name | Company | Catalog Number | Comments |
| Ficoll-Paque | Ge Healthcare | 17-1440-03 | |
| Cd34 positive selection Kit | Stemcell | 18056 | Store a 4°C. |
| Magnet | Stemcell | 18000 | |
| Anti-human CD3 antibody, clone OKT-3 | Bioxcell | BE0001-2 | Store at 4°C. Used for T cell depletion in primary AML samples. |
| Cytokines (IL3, G-CSF, and TPO) | PeproTech | 200-03, 300-23 and 300-18 | For doing the stock: Dilute each one of the cytokines in 100 μL of water and mix them. Add 200 μL, do alicuots of 45 μL and Store at -20 °C. |
| DMSO | Sigma | D4540 | |
| FBS | Life technologies | 10270106 | Heat-inactivate at 56 °C during 30 min, do aliquots and freeze down. Warm in 37 °C water bath before use. |
| MEM-α | Invitrogen | 32571-028 | Store at 4 °C. Warm in 37 °C water bath before use. |
| Myelocult H5100 | corning | 5100 | Store at 4 °C. Warm in 37 °C water bath before use. |
| 199 | Gibco | 41150-020 | Store at 4 °C. Warm in 37 °C water bath before use. |
| hMSC-FBS, Heat-inactivated | Gibco | 12662-029 | Store at -20 °C. Warm in 37 °C water bath before use. |
| P/S | Sigma-Aldrich | P0781 | Store at -20 °C. Warm in 37 °C water bath before use. |
| ECGS | Millipore | 02-102 | Dilute in culture media and use 0.22 mm filter. |
| HEPES | Sigma-Aldrich | S1558-50ML | Store at 4 °C. |
| Heparin | Sigma-Aldrich | H3149 | Store at 4 °C. |
| Glutamine | Gibco | 25030 | Store at -20 °C. |
| Collagen 1 coated cell culture plate | corning | 354505 | |
| Trypsin-EDTA solution | Thermo-Fisher | 25200056 | Store at -20 °C. Warm in 37 °C water bath before use. |
| hMSC | Lonza | PT-2501 | Alternatively, hMSCs we also kindly provided by Dr. Dosquet (University Paris Diderot, Paris) from human bone marrow obtained during orthopaedic surgery under ethical approval 10-038 from IRB00006477. |
| VeraVec HUVEC endothelial cells | Angiocrine bioscience | hVera101 | Alternatively, other human endothelial cell source may be used. |
| Human hematopoietic cells | Umbilical Cord blood or primary Acute Myeloid Leukemia (AML) samples were obtained from the Royal London Hospital (London, UK) after informed consent and protocol of use was approved by the East London Ethical Committee and carried out in accordance with the Declaration of Helsinki. | ||
| Gelfoam, Size 12 - 7mm | Pfizer | 00009-0315-08 | Alternative supplier: Febelco |
| PBS | Thermo-Fisher | 10010023 | |
| Surgical material | Multiple | Sterile forceps, tweezers and sharp scissors. | |
| Sterile tissues | Heat-sterilize paper tissues. | ||
| 1 mL Syringe with needle of 25G | Terumo | SS+01H25161 | |
| Ultra Low Attachment Multiple Well Plates | Corning | 3473 or 3471 | |
| BMP2 | Noricum | rhBMP-2 | Dilute at 5 mg/mL in acetic acid 50 mM and store at 4 °C. |
| Thrombin | Sigma | T8885 | Dilute in CaCl2 2%, 500 mL per vial, and store at 4 °C. |
| Fibrinogen | Sigma | F3879 | Dilute at 4 mg/100 mL in PBS. Store at -20 °C. Warm before use. |
| Tissue-culture dishes 35 mm x 10 mm | Falcon | 353001 | |
| U-Botton 96 well plate | Falcon | 353077 | |
| NSG mice | The Jackson Laboratory | 5557 | NSG mice were a kind gift from Dr Leonard Shultz (The Jackson Laboratory). |
| Chlorhexidine | G9 | Dilute 1:10 before use | |
| Carprofen | Pfizer | Rimadyl | 5 mg/kg of mouse |
| Buprenorphine | Alstoe | Vetergesic | 0.1 mg/kg of mouse body weight |
| Isoflurane | Abbott | B506 | Induction of anaesthesia 2%, maintenance 1% |
| Trimmer | Wella | Contura HS61 | |
| Surgical glue | 3M | Vetbond | |
| carbomer (polyacrylic acid) as Ophthalmic gel | Novartis | Viscotears Liquid Gel | |
| Human Normal Immunoglobulin | Gammaplex | 10g vial | 100 mL/mouse intravenously, 30 min before infusion of specific antibody. |
| NT-QTracker | Invitrogen | Q21021MP | Vessel-pooling agent. Administrate 15 mL/mouse intravenously 5 min before imaging. |
| AF488-hCD45 | Biolegend | 304017 | 100 mL/mouse intravenously, 30 min before imaging. |
| FITC-hCD31 | BD Pharmigen | 555445 | 100 mL/mouse intravenously, 30 min before imaging. |
| Super glue | Loctite | Super Glue | |
| Micro-Drill Kit | IDEAL - Fisher Scientific | NC9010016 | |
| Microsurgical microscope | No specific brand/company is adviced. | ||
| LSM 710 NLO | Zeiss | Upright confocal microscope with motorized stage, two-photon laser and 20X 1.0 NA water immersion lens. Alternatively, a microscope with similar specifications could be used. | |
| MaiTai “High Performance” fully automated 1-box 517 mode-locked Ti:Sapphire laser with DeepSee dispersion compensation | Spectra-Physics | ||
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| Ethanol | Sigma-Aldrich | 32294 | |
| Osteosoft | Millipore | 1.01728.1000 | |
| Polysine slices | Thermo scientific | J2800AMNZ | |
| Antigen unmasking solution | Vector | H-3300 | Store at 4 °C. Dilute 1:100 in H2O for working solution. |
| Triton 100x | Sigma-Aldrich | T9284 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A96470 | Store at 4 °C. |
| Normal Goat serum (NGS) | Sigma-Aldrich | G9023 | Store at 4 °C. |
| Endomucin Antibody | Santa Cruz | sc-65495 | Store at 4 °C. |
| hVimentin antibody | Santa Cruz | sc-6260 | Store at 4 °C. |
| hCD31 antibody | DAKO | M0823 | Store at 4 °C. |
| hCD45 antibody | DAKO | M0701 | Store at 4 °C. |
| ADRP (Perilipin2) | antibodies-online | ABIN283918 | Store at 4 °C. |
| Goat anti mouse secondary antibodies | Invitrogen | A11029 or A11005 | Store at 4 °C. |
| Goat anti Rabbit secondary antibodies | Invitrogen | A11037 or A11008 | Store at 4 °C. |
| Goat anti Rat secondary antibodies | Invitrogen | A11007 or A21247 | Store at 4 °C. |
| Sudan Black | Sigma | S2380 | Prepare a stock of 1% sudan black in ethanol 70%. Store at RT. Prepare working solution of 0.1% sudan black in ethanol 70% and filter using filter-paper before use. |
| DAPI | Sigma | D8417 | Prepare stock in H20 at 100 mg/mg. Store at 4 °C. |
| Fluorescent mounting media | Dako | S3023 | Add DAPI before use (1:400 from DAPI stock). |
| Cover glass | VWR | 631-0147 |
Referencias
- Hoggatt, J., Kfoury, Y., Scadden, D. T. Hematopoietic Stem Cell Niche in Health and Disease. Annu Rev Pathol. 11, 555-581 (2016).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Zhang, B., et al. Altered microenvironmental regulation of leukemic and normal stem cells in chronic myelogenous leukemia. Cancer Cell. 21 (4), 577-592 (2012).
- Schepers, K., et al. Myeloproliferative neoplasia remodels the endosteal bone marrow niche into a self-reinforcing leukemic niche. Cell Stem Cell. 13 (3), 285-299 (2013).
- Krause, D. S., et al. Differential regulation of myeloid leukemias by the bone marrow microenvironment. Nat Med. 19 (11), 1513-1517 (2013).
- Mendez-Ferrer, S., Scadden, D. T., Sanchez-Aguilera, A. Bone marrow stem cells: current and emerging concepts. Ann N Y Acad Sci. 1335, 32-44 (2015).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Ding, L., Morrison, S. J. Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature. 495 (7440), 231-235 (2013).
- Kunisaki, Y., et al. Arteriolar niches maintain haematopoietic stem cell quiescence. Nature. 502 (7473), 637-643 (2013).
- Pinho, S., et al. PDGFRalpha and CD51 mark human nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion. J Exp Med. 210 (7), 1351-1367 (2013).
- Mizoguchi, T., et al. Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development. Dev Cell. 29 (3), 340-349 (2014).
- Zhou, P., Wang, Y., Li, D., Hu, S. Y., Chen, G. H. Therapeutic efficacy of mixed hematopoietic stem cell transplantation for pediatric hematologic diseases. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 22 (2), 434-439 (2014).
- Sugiyama, T., Kohara, H., Noda, M., Nagasawa, T. Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity. 25 (6), 977-988 (2006).
- Tzeng, Y. S., et al. Loss of Cxcl12/Sdf-1 in adult mice decreases the quiescent state of hematopoietic stem/progenitor cells and alters the pattern of hematopoietic regeneration after myelosuppression. Blood. 117 (2), 429-439 (2011).
- Pearce, D. J., et al. AML engraftment in the NOD/SCID assay reflects the outcome of AML: implications for our understanding of the heterogeneity of AML. Blood. 107 (3), 1166-1173 (2006).
- Sanchez, P. V., et al. A robust xenotransplantation model for acute myeloid leukemia. Leukemia. 23 (11), 2109-2117 (2009).
- Uzan, B., et al. Interleukin-18 produced by bone marrow-derived stromal cells supports T-cell acute leukaemia progression. EMBO Mol Med. 6 (6), 821-834 (2014).
- Foster, K., et al. Different Motile Behaviors of Human Hematopoietic Stem versus Progenitor Cells at the Osteoblastic Niche. Stem Cell Reports. 5 (5), 690-701 (2015).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Holzapfel, B. M., Wagner, F., Thibaudeau, L., Levesque, J. P., Hutmacher, D. W. Concise review: humanized models of tumor immunology in the 21st century: convergence of cancer research and tissue engineering. Stem Cells. 33 (6), 1696-1704 (2015).
- Scotti, C., et al. Engineering of a functional bone organ through endochondral ossification. Proc Natl Acad Sci USA. 110 (10), 3997-4002 (2013).
- Scotti, C., et al. Recapitulation of endochondral bone formation using human adult mesenchymal stem cells as a paradigm for developmental engineering. Proc Natl Acad Sci USA. 107 (16), 7251-7256 (2010).
- Kuznetsov, S. A., et al. Single-colony derived strains of human marrow stromal fibroblasts form bone after transplantation in vivo. J Bone Miner Res. 12 (9), 1335-1347 (1997).
- Bianco, P., Robey, P. G. Skeletal stem cells. Development. 142 (6), 1023-1027 (2015).
- Vaiselbuh, S. R., Edelman, M., Lipton, J. M., Liu, J. M. Ectopic human mesenchymal stem cell-coated scaffolds in NOD/SCID mice: an in vivo model of the leukemia niche. Tissue Eng Part C Methods. 16 (6), 1523-1531 (2010).
- Groen, R. W., et al. Reconstructing the human hematopoietic niche in immunodeficient mice: opportunities for studying primary multiple myeloma. Blood. 120 (3), e9-e16 (2012).
- Chen, Y., et al. Human extramedullary bone marrow in mice: a novel in vivo model of genetically controlled hematopoietic microenvironment. Blood. 119 (21), 4971-4980 (2012).
- Reinisch, A., et al. A humanized bone marrow ossicle xenotransplantation model enables improved engraftment of healthy and leukemic human hematopoietic cells. Nat Med. 22 (7), 812-821 (2016).
- Sontakke, P., et al. Modeling BCR-ABL and MLL-AF9 leukemia in a human bone marrow-like scaffold-based xenograft model. Leukemia. 30 (10), 2064-2073 (2016).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Antonelli, A., et al. Establishing human leukemia xenograft mouse models by implanting human bone marrow-like scaffold-based niches. Blood. 128 (25), 2949-2959 (2016).
- Holzapfel, B. M., et al. Tissue engineered humanized bone supports human hematopoiesis in vivo. Biomaterials. 61, 103-114 (2015).
- Reinisch, A., et al. Epigenetic and in vivo comparison of diverse MSC sources reveals an endochondral signature for human hematopoietic niche formation. Blood. 125 (2), 249-260 (2015).
- Lee, J., et al. Implantable microenvironments to attract hematopoietic stem/cancer cells. Proc Natl Acad Sci USA. 109 (48), 19638-19643 (2012).
- Lee, J., Heckl, D., Parekkadan, B. Multiple genetically engineered humanized microenvironments in a single mouse. Biomater Res. 20 (19), 1-13 (2016).
- Ho, M. S., Medcalf, R. L., Livesey, S. A., Traianedes, K. The dynamics of adult haematopoiesis in the bone and bone marrow environment. Br J Haematol. 170 (4), 472-486 (2015).
- Bersani, F., et al. Bioengineered implantable scaffolds as a tool to study stromal-derived factors in metastatic cancer models. Cancer Res. 74 (24), 7229-7238 (2014).
- Thibaudeau, L., et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies. Cancer Metastasis Rev. 33 (2-3), 721-735 (2014).
- Holzapfel, B. M., et al. Species-specific homing mechanisms of human prostate cancer metastasis in tissue engineered bone. Biomaterials. 35 (13), 4108-4115 (2014).
- Thibaudeau, L., Holzapfel, B. M., Hutmacher, D. W. Humanized mice models for primary bone tumor and bone metastasis research. Cell Cycle. 14 (14), 2191-2192 (2015).
- Thibaudeau, L., et al. A tissue-engineered humanized xenograft model of human breast cancer metastasis to bone. Dis Model Mech. 7 (2), 299-309 (2014).
- Abarrategi, A., Foster, K., Hamilton, A., Mian, S., Passaro, D., Gribben, J., Mufti, G., Bonnet, D. Versatile humanized niche model enables study of normal and malignant human hematopoiesis. J Clin Invest. 127 (2), (2017).
- Abarrategi, A., et al. In vivo ectopic implantation model to assess human mesenchymal progenitor cell potential. Stem Cell Rev. 9 (6), 833-846 (2013).
- Rubio, R., et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem Cells. 32 (5), 1136-1148 (2014).
- Abarrategi, A., et al. Multiwall carbon nanotube scaffolds for tissue engineering purposes. Biomaterials. 29 (1), 94-102 (2008).
- Abarrategi, A., et al. Gene expression profile on chitosan/rhBMP-2 films: A novel osteoinductive coating for implantable materials. Acta Biomater. 5 (7), 2633-2646 (2009).
- Abarrategi, A., et al. Biological properties of solid free form designed ceramic scaffolds with BMP-2: in vitro and in vivo evaluation. PLoS One. 7 (3), e34117 (2012).
- Abarrategi, A., et al. Chitosan scaffolds for osteochondral tissue regeneration. J Biomed Mater Res A. 95 (4), 1132-1141 (2010).
- Abarrategi, A., et al. Improvement of porous beta-TCP scaffolds with rhBMP-2 chitosan carrier film for bone tissue application. Tissue Eng Part A. 14 (8), 1305-1319 (2008).
- Prasain, N., Meador, J. L., Yoder, M. C. Phenotypic and functional characterization of endothelial colony forming cells derived from human umbilical cord blood. J Vis Exp. (62), (2012).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. J Vis Exp. , (2016).
- Hong, J. K., Yun, J., Kim, H., Kwon, S. Three-dimensional culture of mesenchymal stem cells. Tissue Eng Regen Med. 12 (4), 211-221 (2015).
- Bara, J. J., et al. Three-dimensional culture and characterization of mononuclear cells from human bone marrow. Cytotherapy. 17 (4), 458-472 (2015).
- Dong, H. W., Qin, S., Rafailovich, M., Ma, Y. Developing an Optimal Biofunctional Scaffold for Hematopoietic Stem Cell Quiescent Maintenance and Expansion. N Am J Med Sci. 8 (2), (2015).
- Raic, A., Rodling, L., Kalbacher, H., Lee-Thedieck, C. Biomimetic macroporous PEG hydrogels as 3D scaffolds for the multiplication of human hematopoietic stem and progenitor cells. Biomaterials. 35 (3), 929-940 (2014).
- Miyoshi, H., Morita, M., Ohshima, N., Sato, C. Expansion of mouse hematopoietic progenitor cells in three-dimensional cocultures on frozen-thawed stromal cell layers formed within porous scaffolds. Exp Hematol. 43 (2), 115-124 (2015).
- Cuddihy, M. J., Wang, Y., Machi, C., Bahng, J. H., Kotov, N. A. Replication of bone marrow differentiation niche: comparative evaluation of different three-dimensional matrices. Small. 9 (7), 1008-1015 (2013).
- Sharma, M. B., Limaye, L. S., Kale, V. P. Mimicking the functional hematopoietic stem cell niche in vitro: recapitulation of marrow physiology by hydrogel-based three-dimensional cultures of mesenchymal stromal cells. Haematologica. 97 (5), 651-660 (2012).
- Leisten, I., et al. 3D co-culture of hematopoietic stem and progenitor cells and mesenchymal stem cells in collagen scaffolds as a model of the hematopoietic niche. Biomaterials. 33 (6), 1736-1747 (2012).
- Ferreira, M. S., et al. Cord blood-hematopoietic stem cell expansion in 3D fibrin scaffolds with stromal support. Biomaterials. 33 (29), 6987-6997 (2012).
- Baldwin, J. G., et al. Periosteum tissue engineering in an orthotopic in vivo platform. Biomaterials. 121, 193-204 (2017).
- Rafii, S., Butler, J. M., Ding, B. S. Angiocrine functions of organ-specific endothelial cells. Nature. 529 (7586), 316-325 (2016).
- Seandel, M., et al. Generation of a functional and durable vascular niche by the adenoviral E4ORF1 gene. Proc Natl Acad Sci USA. 105 (49), 19288-19293 (2008).
- Medyouf, H. The microenvironment in human myeloid malignancies: emerging concepts and therapeutic implications. Blood. 129 (12), 1617-1626 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados