Method Article
Sinyal Proteinlerin Fonksiyonu taklit: Yapay Sinyal İletimi Tedavisi Doğru
Bu Makalede
Özet
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Özet
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Giriş
Sinyal transdüksiyon yollarının hemen hemen her türlü hücresel işlemde önemli bir rol oynamaktadır ve hücre hızlı çevresel sinyallere cevap verir. 1. Bu yollar sık sık, hücre içi enzimlerin aktivasyonu ile sonuçlanır hücre dışı bir reseptör, bir sinyal molekülünün bağlanması ile tetiklenir. Amplifikasyon ve hücre içinde, bu sinyalin yayılma enzimleri tersine çevrilebilir yüksek özgüllük ile aktive olan protein-protein etkileşimleri, bir ağ oluşturmak proteinlerin sinyal fonksiyonunun aracılık eder. Bu ağların düzensizliği sık kanser gelişimine yol açar, çünkü uyuşturucu malign sinyal yolları bozmak için tasarlanmış bu sayede 'kanser sinyal iletim tedavisi', 2 kurulmasında çok ilgi olmuştur. Biz son zamanlarda doğal olmayan sinyal iletim yollarını oluşturmak için ilaçların yeteneklerine bağlıdır iletim tedavisi sinyal alternatif bir yaklaşım önerdi. 3 biz sinyal proteinlerinin fonksiyonunu taklit eden sentetik maddeler tasarlayarak, dolaylı hücrenin fonksiyonunu modüle etmek mümkün olacağı düşünülmektedir. Örneğin, bu yapay ağlar ön ilaçlarını bölen enzimleri aktive protein biyobelirteçlerini sağlayabilir. Alternatif olarak, bu sinyal protein taklitleri terapötik etkilere neden doğal olmayan hücre sinyal yolları aktive mümkün olabilir.
Bu yaklaşımın uygulanabilirliğini göstermek için, son zamanlarda bir glutatyon-S-transferaz (GST), aktive ederek bir antikanser ön ilacın bölünmesini tetiklemek için, trombosit türevli büyüme faktörü (PDGF) sağlayan sentetik bir "Kimyasal transdüser '4 oluşturduk değil doğal bağlama ortağı. Bu 'transdüktörün' yapısı GST için bir iki değerli önleyici ile modifiye edilmiş bir anti-PDGF DNA aptamer oluşur. Bu nedenle, bu sentetik madde için bağlanma yerleri bir molekül ailesine aitFarklı proteinler, dimerizasyonunun 5-7 gibi kimyasal uyarıcılar (Müşteri Kimlikleri) 8-10 ve oligonükleotid-sentetik bir molekül konjugatlarının göre protein bağlayıcı grup. 11-21
Bu tür sistemlerin tasarımını temel genel ilkeleri burada tarif edildiği ve sentezlemek ve konvansiyonel enzimatik deneyleri ile bu 'transdüser' fonksiyonunu test etmek için ayrıntılı protokoller sağlanır. Bu çalışma, hücre içi protein-protein iletişim aracılık etmek ve bunun sonucu olarak, yapay hücre sinyalizasyon yolları uyarılması için kullanılabilecektir Bu sınıf, ilave 'dönüştürücüleri' geliştirilmesinin kolaylaştırılması için tasarlanmıştır.
Şekil 1 doğal olmayan protein-protein iletişimi aracılık sentetik 'kimyasal dönüştürücüler' çalışma prensiplerini açıklar. prot için sentetik bağlayıcı entegre Bu resimde, bir 'kimyasal transdüser' inEins I ve II (bağlayıcı I ve II), doğal bağlanma ortağı olmayan proteinin katalitik aktivitesi I tetiklemek için protein II sağlar. Protein II yokluğunda, dönüştürücü enzimi (protein I) 'e katalitik bağlayan ve aktivitesi (Şekil 1, durumu ii) inhibe eder. Protein II 'transdüktörün' bağlanmasının, ancak, bunun bir sonucu olarak etkili konsantrasyonunu proteini I'e doğru yakınlığını azaltır bağlayıcı I ve protein II yüzeyi (Şekil 1, konum III), arasındaki etkileşimi teşvik ' çözelti içinde serbest 'dönüştürücü transformatör-protein ayrışmasına yol açan azaltılır karmaşık ve protein ı yeniden aktive etmek (Şekil 1, durumu iv). (1) 'dönüştürücü', protein hedeflerinin her biri için (2) etkileşim betwe belirli bir bağlayıcı olmalıdır: Birlikte ele alındığında, bu adımlar verimli 'dönüştürücüler' tasarımı altında yatan üç temel ilkeleri vurgulamakbağlayıcı II ve protein tr II Ben protein II yüzeyi ile etkileşim mümkün olmalıdır bağlayıcı I ve protein I ve (3) bağlayıcı arasındaki etkileşim daha güçlü olmalıdır. Bu son prensibi mutlaka protein II doğru yüksek bir afiniteye ve seçimliliğe sahip olur yalnız bu bağlayıcı gerekli değildir. Bunun yerine, bir proteine denk gelen sentetik bir molekül getiren bu molekülün ve protein yüzeyi arasındaki etkileşimi teşvik etmek için olası olduğunu göstermiştir son çalışmalara dayanmaktadır. 19,22,23

Şekil 1:. 'Kimyasal dönüştürücü' aktif protein I (devlet i) eklendiğinde 'kimyasal dönüştürücüler' ve Çalışma prensipleri, bu bağlayıcı aracılığıyla aktif sitesine I bağlanır ve faaliyetlerini (devlet ii) inhibe eder. protein II varlığında, ancak, bağlanmamış "Kimyasal transducer 'bağlayıcı I ve protein II yüzeyi arasındaki etkileşimi teşvik bağlayıcı II yoluyla protein II ile etkileşir. Bu uyarılmış bağlayıcı I-protein II etkileşimi Ben karmaşık ve proteine ben etkinleştirme (devlet iv). 'Transducer'-protein ayrışmasına yol açar bağlayıcı I etkili konsantrasyonunu azaltır tıklayınız Bu rakamın büyük bir versiyonunu görmek için .
Protokol
'Kimyasal Transducer' 1. Sentezi
- ön hazırlıklar
- ultra saf su 114 ml asetik asit ve 400 ml trietilamin 278 ml karıştırılarak 2M trietilamonyum asetat (TEAA) tamponu hazırlayın. karanlık şişe tutun 7 pH ayarlamak ve 1 L'lik bir son hacme su ilave edilir.
Not: Bu çözelti, yıl stabildir. - ultra saf su, 20 ml, askorbik asit, 18 mg eritilmesi ile 5 mM askorbik asit çözeltisi hazırlayın. taze bir çözüm kullanın; Çözelti bir gün için stabildir.
- 11 ml dimetil sülfoksit (DMSO) içinde TBTA 10, aşırı saf su ile yıkanır ve 58 mg bakır (II) sülfat pentahidrat 25 mg çözülmesiyle 10 mM Cu (II) / tris (benzyltriazolylmethyl) amin (TBTA) çözeltisi hazırlayın. İki çözüm karıştırın. Oda sıcaklığında tutun ve ışıktan korumak.
- ultra saf su 114 ml asetik asit ve 400 ml trietilamin 278 ml karıştırılarak 2M trietilamonyum asetat (TEAA) tamponu hazırlayın. karanlık şişe tutun 7 pH ayarlamak ve 1 L'lik bir son hacme su ilave edilir.
- birleşme prosedürü
- 80 ul değiştirilmiş oligonükleotid, 100 nmol (ODN-1) çözündürüntaze ultra-saf su. pH = 7, askorbik asit (su içinde 5 mM) yeni hazırlanmış bir çözeltiye 80 ul ekle 2 M TEAA 20 ul ekle.
- DMSO, 180 ul azido-değiştirilmiş etakrinik asit, 1.5 umol (574,5 ug) çözülür ve solüsyona ekleyin. Cu (ll) / TBTA çözeltisi (% 55, 10 mM (h / h) DMSO / su) 40 ul hızla 60 saniye boyunca argon ile ve çözelti gaz çıkışına.
- sıkıca kapatın, Argon ile tekrar temizleyin ve bir gece boyunca karıştırın.
- (Mobil faz A) reaksiyonun ilerlemesini izlemek ve RP-HPLC ile saflaştırılması konjügat,% 5 asetonitril,% 5 TEAA,% 90 saf su; B)% 65 asetonitril,% 5 TEAA,% 30 saf su). 24
2. PDGF tarafından GST Etkinliği Kontrol
- ön hazırlıklar
- 8 mM son fosfat konsantrasyonunun ve reklam elde etmek için, aşırı saf su 16,1 ml fosfat tamponlu tuz (PBSx1) 33.9 mi karıştırılarak deney tamponu 50 ml hazırlamakD MgCl2 23.8 mg 5 mM nihai konsantrasyon elde etmek için.
- 50 mM Tris pH 7.5, 50 mM NaCI ihtiva eden bir tampon içinde proteinin ile GST M1-1 bir stok çözeltisi hazırlanır, 1 mM ditiotreitol (DTT) ve 30 uM bir nihai konsantrasyon 5 mM etilendiamin tetraasetik asit (EDTA). -80 ° C'de bu küçük kısma çözüm ve mağaza bölün. Deney tamponu içerisinde, bölüm 2.1.5.1 uygun olarak, yeni seyreltilir ve buz üzerinde tutulur.
Not: enzim aktivitesinde bir azalma oluncaya kadar solüsyon yaklaşık 5 saat boyunca sabit olabilir veya olacaktır. - Aşağıdaki talimatlara göre alt-tabakanın hazırlanması:
- 100 mM'lik bir stok çözeltiden bir son konsantrasyona kadar, aşırı saf su 325 ul indirgenmiş glutatyon (GSH), 10 mg çözülür. 2.1 mM çalışma çözeltisinin bir son konsantrasyon için deney tamponu 979 ul bu stok çözeltinin 21 ul seyreltilir.
- e 492 ul 2,4-dinitroklorobenzen 10 mg (CDNB) çözülür100 mM stok çözeltisi, bir nihai konsantrasyona kadar -metanol. 4.32 mM'lik çalışma çözeltisi bir son konsantrasyon için, bir deney tamponu 956,8 ul stok çözeltisinden 43,2 ul seyreltilir.
- 96 oyuklu bir plaka içerisinde, ayrı bir hat (12 kuyu), her alt-tabakanın koydu. çözelti, hızlı ve kolay bir çekme izin vermek için her bir kuyunun içine en az 60 ul ekle. Hafif korunması için bir alüminyum levha ile plaka örtün.
- Deney tamponu aşağıdaki stok çözelti hazırlayın:
- dimer 0.6 uM nihai konsantrasyona kadar 50 ile GST M1-1 seyreltilir.
- 30 uM stok çözeltisine 'kimyasal dönüştürücüyü' sulandırmak.
- 40 uM'lik nihai bir konsantrasyona kadar PDGF seyreltilir.
- 250 uM nihai konsantrasyona kadar PDGF aptamer seyreltilir.
- 'Kimyasal transdüser' Varlığında ve PDGF GST Etkinliği ölçün.
- deneysel prosedür i kurmakkinetik ölçüm için plaka okuyucu n tane.
- bir 'standart protokolü' olarak yeni bir deneme oluşturun.
- 'Prosedür' basın prosedürü ayarları penceresini açmak için.
- Pencerenin üst tarafındaki açılır listesinde, plaka üreticiye göre '384 plakalı' türü seçin.
- Sol menüde Basın 'Oku'.
- algılama yöntemi 'Absorbans' seçim ile ilgili olarak.
- okuma türüne ilişkin 'End noktası' seçin.
- dalgaboyu penceresinde 340 nm yazınız.
- Sağ üst taraftaki 'Tam plaka' alt Basın ve kuyu seçmek ölçülecek.
- Basın 'ok' kapatmak için 'oku' penceresi.
- Seç, sol menüde 'kinetik başlıyorum.
- çalışma süresi 10 dk olun.
- Asgari aralıkları seçeneğini seçin.
- Basın 'Tamam' kinetik penceresini kapatmak için.
- 'Oku' satır i sürükleyinkinetik ölçüm nto.
- 'Doğrulamak' düğmesini ve ardından 'Tamam' düğmesine basın.
- Denemeyi kaydedin.
- 'Oynamak' düğmesine basın. Bir iletişim kutusu belirecektir - Ölçüm geçilmelidir yalnızca 'Tamam' düğmesine basın.
- , Kopyaların deneyi gerçekleştirmek dört numune "Kimyasal transdüktörün 've GST M1-1 3.25 ul, her biri 3.25 ul hazırlanması için. sırasıyla her bir örnek, 0, 1.2, 2.4, ya da PDGF ve 123.5, 122.3, 121.1, 4.9 ul ya da deney tamponu 118.6 ul ekle.
- 10 dakika boyunca oda sıcaklığında çözelti inkübe edin.
- 384 şeffaf plaka, her bir oyuğa örnek 40 ul yerleştirin. Alt tabaka eklenmesi için çok pipet kullanımına izin vermek için sadece tek kuyularda veya yalnızca aynı çizgide bile kuyularda örnekleri yerleştirin.
- 12 kanallı çok pipet kullanarak hızlı bir şekilde t her birinden 10 ul96 oyuklu plaka (bölüm 2.1.4) 'de önceden hazırlanmış O alt-tabakalar. kabarcıkları önlemek için yavaşça ve hızlı bir şekilde karıştırın. okuyucu plaka takın ve kinetik ölçümü başlatın. GST kinetiği oldukça hızlı olduğundan, substrat ilavesi ve kinetik ölçüm başlangıcı arasındaki süreyi en aza indirmeye çalışın.
- deneysel prosedür i kurmakkinetik ölçüm için plaka okuyucu n tane.
- GST Aktivasyon 'kimyasal transdüser tarafından' Aracılı / İnhibisyon yapar.
- , Kopyaların deneyi gerçekleştirmek 5 numune deney tamponu 84.5 ul, 'Kimyasal transdüktörün' 3.25 ul ve GST M1-1 3.25 ul içeren her hazırlanması için. 3 dakika boyunca oda sıcaklığında inkübe edilir.
- Tahlil tamponu 3.65 ul numuneler 2-5 PDGF 1 ve 3.65 ul örnek ekleyin. 3 dakika boyunca oda sıcaklığında inkübe edilir.
- örneklerin 1-2 deney tamponu 3.12 ul ve örnekler 3-5 PDGF aptamer 3.12 ul ekle. 3 dakika boyunca oda sıcaklığında inkübe edilir.
- örnekler deney tamponu 24.4 ul ekleörneklerin 4-5 PDGF 1-3 ve 24.4 ul. 3 dakika boyunca oda sıcaklığında inkübe edilir.
- 5 dakika boyunca oda sıcaklığında inkübe 5. örnek örnekleri 1-4 ve PDGF aptamer 7.8 ul deney tamponu 7.8 ul ekle.
- 384 şeffaf plaka, her kuyuya örnek 40 ul yerleştirin. Sadece tek içine veya sadece aynı çizgide bile kuyulara takın örnekleri.
- 12 kanallı çok pipet kullanarak hızlı bir şekilde her alt-tabakadan 10 ul (96 oyuklu plaka içerisinde önceden hazırlanmış). kabarcıkları önlemek için yavaşça ve hızlı bir şekilde karıştırın. okuyucu plaka takın ve kinetik ölçümü başlatın.
- T 340 nm = aktivasyon / inhibisyon geri dönüşüm değerlendirmek için t 340 nm = 1.5 dakika ölçülen OD 0,5 dakikada ölçülen OD çıkarılarak her koşul altında V 0 [MOD / dak] hesaplayın. 25
- Çevre Değişiklik Yapılması 'kimyasal transdüser' Gerçek zamanlı Yanıtı değerlendirin.
- PDGF ek Gerçek zamanlı etkisi
- kinetik ölçüm için plaka okuyucu deneysel prosedür ayarlayın.
- Yineleyin 2.2.1.1-2.2.1.10 adımları.
- çalışma süresi 3.5 dakika yapın.
- Asgari aralıkları seçeneğini seçin.
- Basın 'Tamam' kinetik penceresini kapatmak için.
- kinetik ölçüm içine 'Oku' çizgiyi sürükleyin.
- Sol menüde / In Out Plate seçin.
- seçeneği 'plaka dışarı (hiçbir iletişim)' seçiniz.
- Sol menüde 'Delay' seçeneğini seçin ve 30 saniye girin.
- Sol menüde / In Out Plate seçin.
- seçenek '(hayır iletişim kutusunda) plaka' seçin.
- 2.2.1.14 ancak bölüm 2.2.1.11 25 dk yerine 10 dk olmak üzere kinetik set - adımlarını 2.2.1.4 yineleyerek ikinci bir kinetik ölçüm oluşturun.
- 'Doğrulamak' düğmesini ve ardından 'Tamam' düğmesine basın.
- Denemeyi kaydedin.
- 'Pla basıny 'düğmesine basın. Bir iletişim kutusu belirecektir - Ölçüm geçilmelidir yalnızca 'Tamam' düğmesine basın.
- GST M1-1 1 ul ve Tahlili tamponu 38 ul 'kimyasal transdüser' 1 ul karıştırılarak iki örnek hazırlayın. Bu iki kuyu arasında boş bir kuyu bırakarak, 384 şeffaf plaka iki kuyu içine örnekleri yerleştirin.
- hızlı, her bir alt tabaka 10 ul hafifçe karıştırın ve hızlı bir şekilde kabarcıkları önlemek için, okuyucu plaka takın ve kinetik ölçümü başlatın, bir 12 kanallı multi-pipet kullanarak.
- Plaka (3.5 dakika sonra) kadar açıldığında, hızlı, kuyu birine PDGF 1.125 ul ekleyin hafifçe karıştırın ve plaka kalan kinetik ölçümler için yukarı kapatmak için izin verir.
- PDGF aptamer ekleme Gerçek zamanlı etkisi
- Yineleyin 2.4.1.1-2.4.1.15 adımları.
- GST M1-1 1 ul, 1 ul karıştırılarak iki numune hazırlama 'Kimyasal dönüştürücü "ve deney tamponu 36.9 ul PDGF 1.125 ul. Bu iki kuyu arasında boş bir kuyu bırakarak, 384 şeffaf plaka iki kuyu içine örnekleri yerleştirin.
- , Kabarcıkları önlemek okuyucu plaka takın ve kinetik ölçüm başlatmak için hızlı hızlı, her bir alt tabaka 10 ul hafifçe karıştırın ve bir 12 kanallı multi-pipet kullanarak.
- Plaka (1.5 dakika sonra) kadar açıldığında, hızlı, kuyu birine PDGF aptamer 1.2 ul ekleyin hafifçe karıştırın ve plaka kalan kinetik ölçümler için yukarı kapatmak için izin verir.
- PDGF ek Gerçek zamanlı etkisi
- 'Kimyasal transdüser' ve PDGF Varlığında GST tarafından JS-K Ön ilaç Etkinleştirme ölçün.
- kinetik ölçüm için plaka okuyucu deneysel prosedür ayarlayın.
- bir 'standart protokolü' olarak yeni bir deneme oluşturun.
- 'Prosedür' basın prosedürü ayarları penceresini açmak için.
- Pencerenin üst tarafındaki açılır listesinde plaka üreticiye göre '384 plakalı' türü seçin.
- Sol menüde Basın 'Oku'.
- algılama yöntemi 'Absorbans' seçti ilgili.
- okuma türüne ilişkin 'End noktası' seçin.
- dalgaboyu penceresinde 305 nm yazınız.
- Sağ üst taraftaki 'Tam plaka' düğmesine basın ve kuyu seçmek ölçülecek.
- Basın 'ok' kapatmak için 'oku' penceresi.
- Seç, sol menüde 'kinetik başlıyorum.
- çalışma süresi 10 dk olun.
- Asgari aralıkları seçeneğini seçin.
- Basın 'Tamam' kinetik penceresini kapatmak için.
- kinetik ölçüm içine 'Oku' çizgiyi sürükleyin.
- 'Doğrulamak' düğmesini ve ardından 'Tamam' düğmesine basın.
- Denemeyi kaydedin.
- 'Oynamak' düğmesine basın. Bir iletişim box görünecektir - Ölçüm geçilmelidir yalnızca 'Tamam' düğmesine basın.
- NO üretimi için ölçümler nitrit / nitrat kalorimetrik kiti kullanın. 96 oyuklu bir plaka üçüncü bir satıra bir satıra ikinci bir satıra Reaktif Griess 70 ul ve Griess reaktifi II 70 ul deney tamponu 50 ul yerleştirin.
- , Kopyaların deneyi gerçekleştirmek dört numune 'kimyasal transdüser' her içeren 4.8 ul hazırlamak için. Deney tamponu 155.2 ul, örnek 1 ile; GST-M1-1 3.2 ul ve Tahlili tampon 152 ul ekleyin, 2 örnek; PDGF 9.6 ul ve Tahlili tampon 145.6 ul ekleyin, 3 örnek; ve 4 örnek GST-M1-1 3.2 ul, PDGF 9.6 ul ve analiz tamponu 142.4 ul ekle.
- 10 dakika boyunca oda sıcaklığında çözelti inkübe edin.
- 384 şeffaf plaka, her kuyuya örnek 50 ul yerleştirin. yalnızca tek ya da sadece insert örnekleriaynı satırda da kuyu alt-tabaka eklenmesi için bir çoklu pipet kullanımına izin vermek için.
- Her bir oyuğa, JS-K 0,54 ul (DMSO içinde 5 mM) eklenir.
- hızlı kabarcıklarını önlemek için hızlı bir şekilde (96-çukurlu plaka içinde önceden hazırlanmış), yavaşça karıştırın GSH çözeltiden 10 ul ve 12 kanallı bir çoklu pipet kullanarak. okuyucu plaka takın ve kinetik ölçümü başlatın.
- Griess I reaktifi 50 ul ve 50 ul hemen kinetik ölçümden sonra, 12 kanallı bir çoklu pipet kullanarak, önceden hazırlanmış 96 oyuklu plaka içerisinde deney tamponu satıra her örnekten 50 ul almak ve hızlı bir şekilde ekleme Griess II reaktif. Oda sıcaklığında 10 dakika süre ile ışıktan koruyarak inkübe ve 550 nm'de absorbans ölçümü.
Not: Deney Tamponu ve reaktifler miktarlar kitleri protokolü bağlıdır.
- kinetik ölçüm için plaka okuyucu deneysel prosedür ayarlayın.
Sonuçlar
Tasarımı, sentezi ve PDGF ve GST arasındaki yapay iletişim uyarabilir "kimyasal transdüktörün 'etki mekanizması, Şekil 2'de sunulmaktadır.' Transdüktörün 'yapısı, PDGF, DNA aptamer ve bis-etakrinik amid entegre (BEA ) sırasıyla 26 nM ve 144 nM arasında bilinen bir GST önleyicisi (Şekil 2a). 19 Bu bağlayıcı maddeler (ayrılma sabitleri, Kd 'dönüştürücüyü ", yani, farklı afinitelere sahip iki PDGF ve GST bağlamaya olanak' ler) olan Bu tasarıma göre ek olarak. 4, PDGF bağlanma BEA biriminin belirgin BEA inhibitörünün gücünü azaltacak PDGF yüzeyi arasındaki spesifik olmayan etkileşimleri neden olmalıdır. 19,22,23 Şekil 2b görüntülemektedir Bu sistemin temelindeki çalışma mekanizması. Etkin bir GST için 'dönüştürücüyü' ekleyerek üzerine,İki EA tane eş zamanlı olarak bu dimerik enzimin her iki aktif sitesi bağlanan ve onun etkinliğini inhibe eder. PDGF varlığında, tam bir PDGF-'transducer kompleks GST inhibe gelen BEA birimi engelleyen oluşturulur. Bu sonuç, karmaşık GST-'transducer 'ayrışması ve GST reaktivasyonuna yol açar. GST ardından 'Kimyasal dönüştürücü' yerinden tekrar GST inhibe olmasını sağlar modifiye edilmemiş bir PDGF aptamer eklenerek yeniden inhibe edilebilir.
GST aktivitesi kontrol PDGF yeteneği öncelikle farklı konsantrasyonları varlığında GST-'chemical dönüştürücü 'kompleksinin aktivitesi olan ve "Kimyasal transdüktörün' (500 nM), GST (10 nM) aktivitesinin ölçülmesi ve ölçüm ile gösterilmiştir PDGF (250, 500 ve 1000 nM) (Şekil 3a). 'Kimyasal dönüştürücü' yapay PDGF-GST iletişimi uyardığını kurduktan sonra, bizBir sonraki sinyal transdüksiyon adımlara benzer bu yapay bir iletişim, aynı zamanda tersine çevrilebilir olduğu tespit hızla ortamındaki değişikliklere uyum sağlar. GST Döner aktivasyon / inhibisyon GST-'chemical transdüktör kompleks (Şekil 3b) için PDGF ve modifiye edilmemiş PDGF aptamer sıralı eklenmesi ile gerçekleştirilmiştir. kendi ortamında gerçek zamanlı değişikliklere sistemin tepkisi farklı girdi eklerken GST aktivitesini ölçerek değerlendirildi. GST aktivitesi hızlı bir artış, 3.5 dakika yüzeyler (Şekil 4A) eklenmesinden sonra, karmaşık GST-'transducer '(10 nM ve sırasıyla, 500 nM) ile PDGF (750 nM) üzerine gözlenmiştir. Benzer şekilde, GST aktivitesi azalma GST (10 nM), PDGF (750 nM) ihtiva eden bir karışıma, PDGF aptamer (5 uM) ilave edildikten sonra gözlendi ve "Kimyasal dönüştürücü '(500 nM) (Şekil 4b).
Fon olarak çevreye değişikliklere yanıt olarak ön-ilaç aktivasyonunu kontrol etmek için böyle bir sistemin ortaya koydu. JS-K toksik NO (Şekil 5a) serbest bırakmak için GST ile aktive bir anti-kanser ön ilaçtır. 'Kimyasal transdüktörün' (750 nM) ve GST (10 nM) ve PDGF (2 uM) farklı kombinasyonları JS-K (45 uM) ilave edilmesi üzerine serbest NO miktarı, (Şekil 5B), bu şekilde teyit ölçüldü bu GST ve PDGF hem sadece varlığı ön ilacın aktivasyonu ile sonuçlanır.
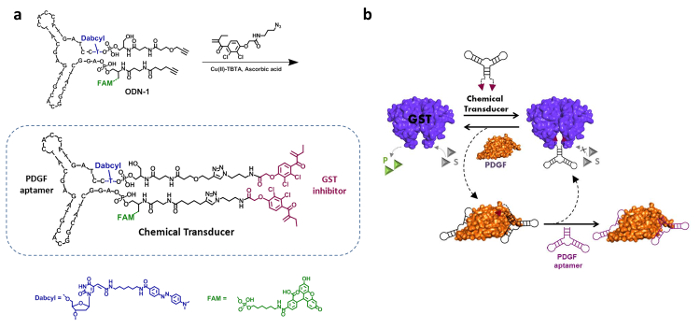
Şekil 2. "Kimyasal dönüştürücü '-. Sentez ve çalışma mekanizması (a)' kimyasal dönüştürücü ', bir PDGF aptamer, bir iki değerli etakrinik amid (EA) GST inhibitörü, bir florofor (FAM) oluşmaktadır ve bir söndürücü (Dabcyl) . Bu aptamer-inhibitör konjügatıbir azid ile modifiye edilmiş etakrinik amid (EA) türevi takılarak sentezlenmiş bir dialkyne modifiye edilmiş ve floresan işaretli DNA aptamer (ODN-1). Referans 4 izni ile yeniden basılmış. (B) ya da GST enzimatik aktivitesi, enzimin aktif sitlerde EA gruplarının bağlanması için, 'Kimyasal transdüktörün' tarafından inhibe edilir. PDGF eklenmesi bu nedenle enzimatik aktivitesi geri, transducer'-GST etkileşimi PDGF-'chemical dönüştürücü 'bozan kompleksi' oluşumuna yol açar. Değiştirilmemiş bir PDGF aptamer aşağıdaki eklenmesi 'kimyasal transdüser' bültenleri ve enzim yeniden inhibe sağlar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
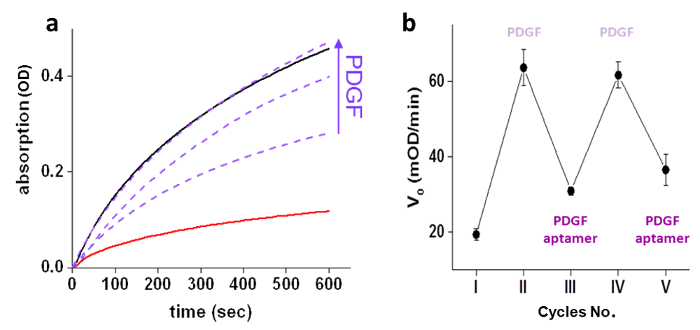
Fi. şekil 3: PDGF-kontrollü GST aktivitesi, (a) mevcudiyetinde GST (10 nM) enzimatik aktivitesi (-) ve yokluğunda (-) 'Kimyasal transdüktörün' bölgesinin (500 nM), ve "Kimyasal transdüktörün varlığında artan konsantrasyonlarda PDGF (---) (250, 500, ya da 1000 nM) '(500 nM). (B) ilk hız değişiklikleri ile ortaya GST enzimatik aktivitesinin inhibisyonu aktivasyon döngüleri (V 0) IV ((I) 'in yok, (II), PDGF (750 nM), (III), PDGF aptamer (4 uM): GST-'chemical transdüktörün kompleks PDGF'nin ve modifiye edilmemiş PDGF aptamer sıralı eklemeler (: VIII) yanıt olarak ), PDGF (5 uM), ve (V), PDGF aptamer (10 uM). Grafik, üç kez STDEV'leri ortalama ± sunulur. Yeniden baskılı referans 4 izni ile. Bir büyük görmek için tıklayınız Bu rakamın sürümü.

. Şekil 4: (-) ya da GST aktivitesinin gerçek zamanlı kontrol (a) ya da GST enzimatik aktivitesinin arttırılması 750 nM PDGF ilavesinden hemen sonra tespit GST (10 nM) içeren çözeltinin ve "Kimyasal transdüktörün '(500 nM)' e ( -) t = 3.5 dk. (B) değiştirilmemiş PDGF aptamer (5 uM) ilavesi (-) (-) t = 1.5 dakika (500 nM) ya da GST (10 nM), PDGF (750 nM), ve "Kimyasal dönüştürücüyü" ihtiva eden bir çözeltiye enzimatik reaksiyon hızında ani bir düşüşe sebep olur. Yeniden baskılı referans 4 izni ile. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
5 "src =" / files / ftp_upload / 54396 / 54396fig5.jpg "/>
Şekil 5:. Kontrollü ön ilaç aktivasyon JS-K ön ilacının (a) GST aktivasyonu toksik NO serbest bırakmak için. (B) ya da GST (10 nM) ve PDGF (2 uM) "Kimyasal transdüktörün 've farklı kombinasyonları varlığında bir salma. Grafik, üç kez STDEV'leri ortalama ± sunulur. Referans 4 izni ile değiştirilebilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to follow the deactivation of GST by a competing aptamer, as well as the PDGF-mediated cleavage of an anticancer prodrug. Other switchable protein binders that can control the activity of proteins by responding to oligonucleotide inputs have been described.26 The protocols describe herein, however, demonstrates a means to follow the function of a new class of protein binders that respond to the presence of natural proteins. In this way, the regulation of an enzyme by a protein biomarkers can be detected in real time, which opens the way for using such systems to selectively activate prodrugs and other substrates of GST.
It is important to keep in mind that the kinetics of GST is very rapid and hence, to obtain reliable results from this enzymatic assay, it is essential to minimize the time between the substrate addition and the beginning of the measurement. In addition, because small changes in enzyme or substrate concentrations may have significant effects on the kinetic measurement, it is recommended to perform all experiments in triplicate and to perform positive and negative control experiments in order to avoid experimental errors and misinterpretation of the results.
One limitation of using enzymatic assays to follow unnatural protein-protein communication is the need to have an enzyme as one of the protein partners. In addition, the current assays follow changes in absorbance and hence, they are less suitable for detecting the activation of the enzyme in living cells, which would require using fluorogenic substrates. However, considering that this field is in its infancy, we believe that similar design principles and experimental protocols could also be used for developing future 'chemical transducers', which may be used to alter the response of cells to environmental signals or to provide them with new properties. If such changes will also result in therapeutic effects, these developments may lead to artificial signal transduction therapy, which relies on drugs that can mediate unnatural protein-protein communication.3
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Bu araştırma Minerva Vakfı, HFSP Örgütü ve Avrupa Araştırma Konseyi Grant tarafından desteklenmiştir (Grant 338265 Başlangıç).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Referanslar
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır