Method Article
シグナル伝達タンパク質の機能を模倣:人工シグナル伝達療法に向けて
要約
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
要約
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
概要
シグナル伝達経路は、事実上すべての細胞プロセスにおいて重要な役割を果たし、細胞が急速に環境シグナルに応答することができます。1これらの経路は、多くの場合、細胞内酵素の活性化をもたらす細胞外受容体へのシグナル伝達分子の結合によってトリガされます。細胞内でこの信号の増幅及び伝播は酵素が可逆的に高い特異性で活性化されたタンパク質 - タンパク質相互作用のネットワークを形成するタンパク質のシグナル伝達機能によって媒介されます。これらのネットワークの調節不全は、しばしば癌の発生につながるので、薬は悪性のシグナル伝達経路を破壊するように設計されていることにより、2 '癌のシグナル伝達療法」を確立する上で多くの関心が集まっています。我々は最近、不自然なシグナル伝達経路を生成する薬物の能力に依存している形質導入療法をシグナリングするための代替的なアプローチを提案しています。 図3は、我々は、シグナル伝達タンパク質の機能を模倣する合成薬剤を設計することによって、間接的に、細胞の機能を調節することが可能であると考えています。例えば、これらの人工的なネットワークは、プロドラッグを切断する酵素を活性化するタンパク質バイオマーカーを使用可能にすることができます。あるいは、これらのシグナル伝達タンパク質の模倣物は、治療効果が得られ、不自然な細胞シグナル伝達経路を活性化することができるかもしれません。
このアプローチの実現可能性を実証するために、我々は最近であるグルタチオン-S-トランスフェラーゼ(GST)を、活性化することによって抗癌プロドラッグの切断を誘発する血小板由来増殖因子(PDGF)を可能にする合成「化学変換器4 ' を作成しましたない、その天然の結合パートナー。この「トランスデューサー」の構造は、GSTのための二価阻害剤で修飾されている抗PDGFのDNAアプタマーで構成されています。したがって、この合成剤は、への結合部位を有する分子のファミリーに属し異なるタンパク質、二量体化の5-7のような化学誘導物質(のCID)8-10と、オリゴヌクレオチド合成分子複合体に基づいてタンパク質-結合剤のグループに。11月21日
そのようなシステムの設計の基礎となる一般的な原理は、本明細書に記載されており、合成及び従来の酵素アッセイを使用してこの「変換器」の機能を試験するための詳細なプロトコルが提供されます。この作業は、細胞内のタンパク質 - タンパク質の通信を仲介し、その結果として、人工的な細胞シグナル伝達経路を誘導するために使用することができるこのクラスの追加の「変換器」を、開発を促進することを意図しています。
図1は、不自然なタンパク質-タンパク質の通信を媒介することができる合成「化学変換器」の動作原理を説明しています。 protのための合成バインダーを統合し、この図では、「化学変換器」では、アインスIおよびII(バインダーIおよびII)は、その天然の結合相手ではないタンパク質の触媒活性Iを、トリガするタンパク質IIを可能にします。タンパク質IIの非存在下では、トランスデューサは、酵素(タンパク質I)の触媒部位に結合した ( 図1、状態II)の活性を阻害します。タンパク質IIに「トランスデューサ」の結合が、その結果の有効濃度をタンパク質I.向かってその親和性を低下させるバインダーIおよびIIタンパク質の表面( 図1、状態III)の間の相互作用を促進します」溶液中の遊離」トランスデューサは、私は複雑で、タンパク質I( 図1、状態IV)の再活性化にトランスデューサタンパク質の解離につながる、減少します。 (1)「トランスデューサー」はタンパク質標的のそれぞれについて具体的なバインダーを持っている必要があり、(2)相互作用betwe:まとめると、これらの手順は、効率的な「変換器」の設計の基礎となる3つの基本的な原則を強調表示しましたバインダーIIおよびタンパク質II専用私はタンパク質IIの表面と相互作用することができなければならないIおよびタンパク質I、および(3)バインダーバインダーとの間の相互作用よりも強いでなければなりません。この最後の原則は必ずしもバインダーは、単独で私はタンパク質IIに対して高い親和性と選択性を有することは必要ありません。その代わりに、それは、タンパク質の近傍に合成分子をもたらすことは、この分子とタンパク質表面との間の相互作用を促進する可能性があることを示した我々の最近の研究に基づいている。19,22,23

図1:「化学トランスデューサは'I(状態I)活性タンパク質に付加されている場合「化学変換器」の動作原理は 、それがバインダーIを介して、その活性部位に結合し、その活性(状態II)を阻害します。タンパク質II、但し、結合していない「化学Tの存在下でransducerは「バインダーI及びタンパク質IIの表面との間の相互作用を促進するバインダーIIを通じてタンパク質IIと相互作用します。この誘導された結合剤I-タンパク質IIの相互作用は、私は、複雑な「transducer'タンパク質の解離につながるバインダーの有効濃度Iを、減少させ、タンパク質に私が再活性化(状態IV)。 この図の拡大版をご覧になるにはこちらをクリックしてください。 。
プロトコル
「化学トランスデューサー」の1合成
- 予備の準備
- 2 M酢酸トリエチルアンモニウム(TEAA)バッファは、超純水の酢酸の114ミリリットルと400ミリリットルとトリエチルアミン278ミリリットルを混合して準備します。暗いボトルに保管してpHを7に調整し、1 Lの最終体積に水を追加します。
注:このソリューションは、年間安定です。 - 超純水20ml中にアスコルビン酸の18ミリグラムを溶解することにより5mMのアスコルビン酸溶液を調製します。新鮮な溶液を使用してください。溶液を1日間安定です。
- 超純水の10ミリリットルと11ミリリットル中TBTA 58mgのジメチルスルホキシド(DMSO)で銅25mgの(II)五水和物を溶解することにより10mMの銅(II)/トリス(benzyltriazolylmethyl)アミン(TBTA)溶液を調製します。二つの溶液を混ぜます。室温でそれを維持し、光から保護します。
- 2 M酢酸トリエチルアンモニウム(TEAA)バッファは、超純水の酢酸の114ミリリットルと400ミリリットルとトリエチルアミン278ミリリットルを混合して準備します。暗いボトルに保管してpHを7に調整し、1 Lの最終体積に水を追加します。
- 結合手順
- 80μlの修飾オリゴヌクレオチドの100ナノモル(ODN-1)を溶解新鮮な超純水。 2 M TEAA20μlのはpH = 7は、アスコルビン酸の新たに作られた溶液(水中5 mM)の80μlのを追加。
- DMSOの180μlのアジド修飾されたエタクリン酸の1.5マイクロモル(574.5μgの)を溶解し、溶液に追加します。ドガ60秒間アルゴンを使用し、迅速にCu(II)/ TBTA溶液(55%中の10mM(v / v)のDMSO /水)から40μlを添加するソリューション。
- 近くにしっかりと、アルゴンで再びパージし、そして一晩攪拌します。
- 反応の進行状況を監視し、RP-HPLC(移動相:A)によって結合体を精製し、5%アセトニトリル、5%TEAA、90%の超純水; B)65%アセトニトリル、5%TEAA、30%超純水)24
2. PDGFによってGST活性を制御します
- 予備の準備
- 8mMの最終リン酸塩濃度および広告を達成するために、超純水16.1 mlのリン酸緩衝生理食塩水(PBSx1)33.9 mlと混合することによってアッセイ緩衝液を50mlの調製DのMgCl 2の23.8 mgを5mMの最終濃度を達成します。
- 50mMトリスpH7.5の、50mMのNaClを含む緩衝液中でタンパク質を溶解することによりGST M1-1のストック溶液を調製し、1mMジチオスレイトール(DTT)、30μMの最終濃度5mMのエチレンジアミン四酢酸(EDTA)。 -80℃で小分けし、ストアにこのソリューションを割ります。アッセイ緩衝液中で、セクション2.1.5.1によると、新鮮に希釈し、氷上に保ちます。
注:溶液を、約5時間、安定であるか、または酵素活性の減少があるまで。 - 以下の手順に従って基板を準備します。
- 100mMのストック溶液の最終濃度になるように超純水325μlの還元グルタチオン(GSH)10mgを溶解します。 2.1 mMのワーキング溶液の最終濃度のためにアッセイ緩衝液の979μlのこのストック溶液から21μLを希釈します。
- Eの492μlの2,4-ジニトロクロロベンゼン(CDNB)10mgを溶解させます100mMのストック溶液の最終濃度までthanol。 4.32 mMのワーキング溶液の最終濃度のためにアッセイ緩衝液の956.8μlの原液から43.2μLを希釈します。
- 96ウェルプレートでは、別の行(12ウエル)の各基板を置きます。ソリューションの迅速かつ簡単に撤退を可能にするために、各ウェルに少なくとも60μLを挿入します。光保護のためにアルミシートでプレートをカバーしています。
- アッセイ緩衝液中で、次のストック溶液を準備します。
- 二量体の0.6μMの最終濃度に50によってGST M1-1を希釈します。
- 30μMの原液に「化学変換器 'を希釈します。
- 40μMの最終濃度にPDGFを希釈します。
- 250μMの最終濃度にPDGFアプタマーを希釈します。
- 「化学変換器」とPDGFの存在下でのGST活性を測定します。
- 実験手順を設定する私動態測定のためにプレートリーダーをNです。
- 「標準プロトコル」などの新しい実験を作成します。
- 「手順」を押して、手順の設定ウィンドウを開きます。
- ウィンドウの上側のポップアップリストでは、プレートのメーカーによると「384プレート」タイプを選択します。
- 左側のメニューを押し「読みます」。
- 検出方法については「吸光度」を選択します。
- 読み取りタイプについて「エンドポイント」を選択します。
- 波長ウィンドウ上に340nmを書きます。
- 右上側の「フル板」底を押して、測定されるべき十分を選択します。
- 押して「OK」「読む」ウィンドウを閉じます。
- 選択し、左メニューの「運動を開始」。
- 実行時間10分を行います。
- 最小間隔オプションを選択します。
- プレス運動ウインドウを閉じるには「OK」。
- 私は、「読む」の行をドラッグします反応速度測定Ntoを。
- 「検証」ボタンを押して「OK」ボタンを押してください。
- 実験を保存します。
- 「プレイ」ボタンを押してください。ダイアログボックスが表示されます - 測定を開始しなければならない場合にのみ、「OK」ボタンを押してください。
- 三連の実験を行うためには、4つのサンプルに「化学変換器」とGST M1-1の3.25μlの各含む3.25μLを準備します。それぞれ、各サンプル0、1.2、2.4、またはPDGFおよび123.5、122.3、121.1の4.9μlの、またはアッセイ緩衝液の118.6μlに加えます。
- 10分間室温で溶液をインキュベートします。
- 384透明ウェルプレートで、各ウェルにサンプルの40μlのを挿入します。基質添加のためのマルチピペットの使用を可能にするためにのみ、奇数ウェル中や、同じ行にあっても、ウェル内のサンプルを挿入します。
- 12チャンネルマルチピペッターを使用して、すぐにTのそれぞれから10μLを加えます96ウェルプレート(セクション2.1.4)に予め用意した彼の基板。泡を避けるために、静かにかつ迅速に混ぜます。リーダーにプレートを挿入し、反応速度測定を開始します。 GST速度が非常に高速であるため、基質添加および反応速度測定の開始との間の時間を最小限に抑えるようにしてください。
- 実験手順を設定する私動態測定のためにプレートリーダーをNです。
- 「化学変換器」によって媒介されるGST活性化/阻害サイクル。
- 、三連の実験を行う5つのサンプルのアッセイ緩衝液84.5μlを、「化学変換器」の3.25マイクロリットル、およびGST M1-1の3.25μLを含むそれぞれを調製するために。 3分間、室温でインキュベートします。
- サンプル2-5にPDGFの1と3.65μLをサンプリングするアッセイ緩衝液の3.65μLを加えます。 3分間、室温でインキュベートします。
- サンプル3-5に、サンプル1-2とPDGFアプタマーの3.12μlにアッセイ緩衝液の3.12μLを加えます。 3分間、室温でインキュベートします。
- サンプルにアッセイ緩衝液の24.4μlを添加しますサンプル4-5のPDGFの1-3と24.4μlの。 3分間、室温でインキュベートします。
- 5分間、室温で5インキュベートをサンプリングするPDGFアプタマーのサンプル1-4と7.8μlにアッセイ緩衝液の7.8μlを添加します。
- 384透明ウェルプレートで、各ウェルにサンプルを40μlを挿入します。のみ奇数または、同じ行にあってもウェルににサンプルを挿入します。
- 12チャンネルマルチピペッターを使用して、すぐにそれぞれの基板からの10μLを加える(96ウェルプレート中に予め調製しました)。泡を避けるために、静かにかつ迅速に混ぜます。リーダーにプレートを挿入し、反応速度測定を開始します。
- tにおいて340nmで測定したODを差し引くことにより、各条件でV 0 [MOD /分]を算出= ODから0.5分、Tで340 nmで測定し= 1.5分活性化/阻害リサイクル性を評価すること。25
- 環境の変化に「化学変換器」のリアルタイム応答を評価します。
- PDGFの添加のリアルタイム効果
- 反応速度測定用のプレートリーダーでの実験手順を設定します。
- 繰り返しは2.2.1.1-2.2.1.10を繰り返します。
- 実行時間を3.5分にします。
- 最小間隔オプションを選択します。
- プレス運動ウインドウを閉じるには「OK」。
- 運動の測定に「読む」の行をドラッグします。
- 左側のメニュー/上にプレートアウトを選択します。
- オプション 'プレートアウト(ダイアログなし)」を選択します。
- 左メニューの「遅延」オプションを選択し、30秒を入力します。
- 左側のメニュー/上にプレートアウトを選択します。
- オプション '(なしダイアログ)でプレート]を選択します。
- 2.2.1.14をしかし、セクション2.2.1.11で25分の代わりに10分であることが運動を設定する - 手順2.2.1.4を繰り返すことにより、第2の運動の測定を作成します。
- 「検証」ボタンを押して「OK」ボタンを押してください。
- 実験を保存します。
- 「ナンプラーを押してくださいY 'ボタンをクリックします。ダイアログボックスが表示されます - 測定を開始しなければならない場合にのみ、「OK」ボタンを押してください。
- GST M1-1の1μlのとアッセイ緩衝液の38μlの中で「化学変換器」の1μLを混合することにより、二つのサンプルを準備します。これらの2つのウェル間の空井戸を残し、384透明ウェルプレートの2ウェルにサンプルを挿入します。
- すぐに、各基板から10μLを追加穏やかに混合し、すばやく泡を避けるために、リーダーにプレートを挿入し、反応速度測定を開始し、12チャンネルのマルチピペッターを使用しました。
- プレートは、(3.5分後)まで開いたら、すぐに、ウェルの1にPDGFの1.125μlを添加穏やかに混合し、そしてプレートは、残りの反応速度測定のためにクローズアップすることができます。
- PDGFアプタマーを追加のリアルタイム効果
- 繰り返しは2.4.1.1-2.4.1.15を繰り返します。
- GST M1-1の1μlを、1μLを混合することにより、二つのサンプルを準備します」化学変換器」、およびアッセイ緩衝液の36.9μlの中のPDGFの1.125μlの。これらの2つのウェル間の空井戸を残し、384透明ウェルプレートの2ウェルにサンプルを挿入します。
- 12チャンネルのマルチピペッターを使用して、迅速に、各基板から10μlを添加する気泡を避けるために、静かにかつ迅速に混ぜて、リーダーにプレートを挿入し、反応速度測定を開始します。
- プレートは、(1.5分後)まで開いたら、すぐに、ウェルの1にPDGFアプタマーの1.2μlを添加穏やかに混合し、プレートを残りの反応速度測定のためにクローズアップすることができます。
- PDGFの添加のリアルタイム効果
- 「化学変換器」とPDGFの存在下でGSTによってJS-Kプロドラッグ活性化を測定します。
- 反応速度測定用のプレートリーダーでの実験手順を設定します。
- 「標準プロトコル」などの新しい実験を作成します。
- 「手順」を押して、手順の設定ウィンドウを開きます。
- ウィンドウの上側のポップアップリストでプレートメーカーによると「384プレート」タイプを選択します。
- 左側のメニューを押し「読みます」。
- 検出方法については「吸光度」を選択しました。
- 読み取りタイプについて「エンドポイント」を選択します。
- 波長窓に305 nmのを書きます。
- 右上側の「フル板」ボタンを押して、測定されるべき十分を選択します。
- 押して「OK」「読む」ウィンドウを閉じます。
- 選択し、左メニューの「運動を開始」。
- 実行時間10分を行います。
- 最小間隔オプションを選択します。
- プレス運動ウインドウを閉じるには「OK」。
- 運動の測定に「読む」の行をドラッグします。
- 「検証」ボタンを押して「OK」ボタンを押してください。
- 実験を保存します。
- 「プレイ」ボタンを押してください。ダイアログBOXが表示されます - 測定を開始しなければならない場合にのみ、「OK」ボタンを押してください。
- NO産生の測定のために亜硝酸/硝酸熱量測定キットを使用します。 96ウェルプレートでは、1行に私は3番目の行に2行目に試薬、およびグリースII試薬70μlのグリースの70μLをアッセイ緩衝液50μlを挿入します。
- 三連の実験を行うためには、4つのサンプルに「化学変換器」のそれぞれを含む4.8μLを準備します。 1をサンプリングするために、アッセイ緩衝液の155.2μlを添加します。 2をサンプリングするために、GST-M1-1およびアッセイ緩衝液の152μlに3.2μlを添加します。 3をサンプリングするために、PDGFの9.6μlのとアッセイ緩衝液の145.6μlを添加します。そして、4をサンプリングするために、GST-M1-1の3.2μlを、PDGFの9.6μlを、およびアッセイ緩衝液の142.4μlを添加します。
- 10分間室温で溶液をインキュベートします。
- 384透明ウェルプレートで、各ウェルに50μlのサンプルを挿入します。のみ奇数またはだけででサンプルを挿入同じ行であってもウェルは、基質添加のためのマルチピペットの使用を可能にします。
- 各ウェルにJS-Kの0.54μlの(DMSO中の5mM)を追加します。
- すぐに気泡を避けるために迅速に(96ウェルプレート中に予め調製した)を、穏やかに混合GSH溶液10μLを加えると、12チャンネルマルチピペッターを使用して。リーダーにプレートを挿入し、反応速度測定を開始します。
- すぐに運動測定後、12チャンネルのマルチピペッターを使用して、事前に用意した96ウェルプレートでアッセイバッファー行に各試料から50μLを取り、すぐにそれにグリースI試薬を50μl及び50μlのを追加グリースII試薬。 RTで10分間、光から保護しながらインキュベートし、550 nmの吸光度を測定します。
注意:アッセイ緩衝液および試薬のボリュームがキット」プロトコルに依存しています。
- 反応速度測定用のプレートリーダーでの実験手順を設定します。
結果
設計、合成、およびPDGFとGSTとの間に人工的な通信を誘導することができる「化学変換器」の作用の機構は、図2に示されている。「変換器」の構造は、PDGF DNAアプタマー及びビスエタクリンアミドを統合(BEA )、これは既知のGST阻害剤( 図2A)である。19これらのバインダーは、それぞれ、26 nmおよび144 nMでの解離定数(K dの)で、すなわち、異なる親和性でPDGFとGSTの両方に結合する「変換器」を可能にします。また4、この設計によれば、PDGFへの結合が著しく、BEA阻害剤の効力を減少させるであろうBEAユニットおよびPDGFの表面との間の非特異的相互作用を誘導する必要があります。19,22,23 図2bは示してこのシステムの基礎となる操作機構。アクティブGSTへの「変換器」を付加すると、2 EAユニットは、同時に、この二量体酵素の両方の活性部位に結合し、その活性を阻害します。 PDGFの存在下では、しかしながら、PDGF-'transducer」複合体は、GSTの阻害からBEAユニットを防止する、形成されています。この結果、GST-'transducer」複合体の解離にし、GSTの再活性化につながります。 GSTは、次に「化学変換器」変位と再びGSTを阻害することを可能にする非修飾PDGFアプタマーを添加することによって再抑制することができます。
GSTの活性を制御するためのPDGFの能力は、最初の「化学変換器」(500 nM)を用いて及びなしGST(10 nM)を活性を測定し、種々の濃度の存在下で、GST-'chemicalトランスデューサ」複合体の活性を測定することによって実証されましたPDGF(250、500、1000 nMで)( 図3a)の。 「化学変換器は、「人工的なPDGF-GSTの通信を誘導することを確立した後、我々次の確立されたシグナル伝達工程と同様、この人工的な通信も、可逆的であり、迅速に環境の変化に適応します。 GSTの可逆的活性化/阻害は、GST-'chemicalトランスデューサ」複合体( 図3b)にPDGFおよび非修飾PDGFアプタマーの逐次添加することにより行いました。その環境でのリアルタイムの変化に対するシステムの応答は、異なる入力を追加しながら、GST活性を測定することによって評価しました。 GST活性の急激な増加は、3.5分の基板( 図4a)を添加した後、GST-'transducerにPDGF(750 nM)を添加「複合体(それぞれ10 nmおよび500 nmで)上に観察されました。同様に、GST活性の低下は、GST(10 nM)を、PDGF(750 nM)を、および「化学変換器」(500 nM)を( 図4b)の混合物へのPDGFアプタマー(5μM)の添加時に観察されました。
Finally、環境の変化に応じて、プロドラッグの活性化を制御するために、このようなシステムの能力を実証しました。 JS-Kは、毒性NO( 図5a)を解放するために、GSTによって活性化された抗癌プロドラッグです。 「化学変換器」(750 nm)をGST(10 nM)をし、PDGF(2μM)の異なる組み合わせにJS-K(45μM)を添加した際に放出されるNOの量は、このように確認し、( 図5b)を測定しましたそのGSTおよびPDGF両方の唯一の存在は、プロドラッグ活性化になります。
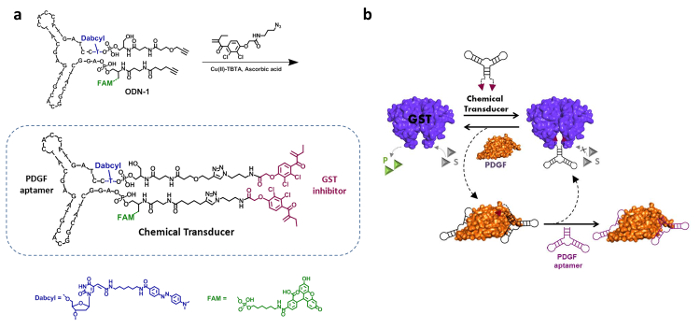
図2.「 化学トランスデューサ' -合成及び操作機構 (a)の 「化学トランスデューサ「PDGFアプタマー、二価エタクリンアミド(EA)GST阻害剤、フルオロフォア(FAM)で構成され、およびクエンチャー(ダブシル) 。このアプタマー - 阻害剤複合体ジアルキン変性および蛍光標識されたDNAアプタマー(ODN-1)の誘導体、アジド修飾エタクリンアミド(EA)を取り付けることにより合成されます。参照4からの許可を得て再印刷。 (B)GSTの酵素活性を伴う酵素の活性部位でEA基の結合のために、「化学変換器」によって阻害されます。 PDGFの添加は、したがって、酵素活性を回復する、transducer'-GST相互作用PDGF-'chemicalトランスデューサ '破壊複合体」の形成をもたらします。未修正のPDGFアプタマーの以下の追加は「化学変換器」をリリースし、それが酵素を再抑制することができます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
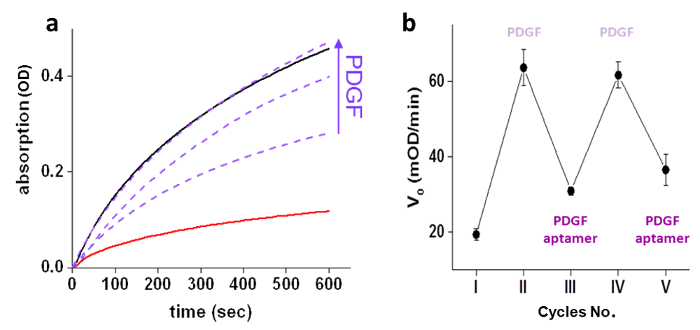
Fiのグレ3:PDGF-制御GST活性存在下で、(a)は、GST(10 nM)を酵素活性( - )および非存在下( - )「化学変換器」(500 nM)を、および「化学変換器の存在下で行われます。 PDGF(---)の増加する濃度(250、500、または1000 nM)を持つ」(500 nM)を有します。 (b)は、初期速度(V 0)の変化によって現れるGST酵素活性の阻害活性化サイクル (I)なし、(II)、PDGF(750 nM)を、(III)PDGFアプタマー(4μM)、(IV:GST-'chemicalトランスデューサ '複雑にPDGFおよび非修飾PDGFアプタマーの逐次添加(IIV)に応答して、 )PDGF(5μM)、および(V)PDGFアプタマー(10μM)。グラフは、三重の標準偏差±平均値を提示します。再印刷された参照4からの許可を得て。 大きく表示するには、こちらをクリックしてください。この図のバージョン。

。 図4:( - )GST活性のリアルタイム制御は、(a)は、GST酵素活性の増強は、750 nMのPDGFの添加直後に検出GST(10 nM)を含有する溶液と「化学変換器」(500 nm)に( - )はt = 3.5分で。 (b)は未修正のPDGFアプタマー(5μM)の添加( - )( - )tで= 1.5分(500 nM)をGST(10 nM)を、PDGF(750 nM)を、および「化学変換器」を含む溶液へ酵素反応速度の即時の減少をもたらします。参照4からの許可を得て再印刷。 この図の拡大版をご覧になるにはこちらをクリックしてください。
5 "SRC =" /ファイル/ ftp_upload / 54396 / 54396fig5.jpg "/>
図5:制御されたプロドラッグ活性化有毒なNOを放出するためのJS-Kプロドラッグの(a)の GST活性化。 (b)は GST(10 nM)をし、PDGF(2μM)の「化学的トランスデューサ'と異なる組み合わせの存在下でのNO放出。グラフは、三重の標準偏差±平均値を提示します。参照4から許可を得て変更しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to follow the deactivation of GST by a competing aptamer, as well as the PDGF-mediated cleavage of an anticancer prodrug. Other switchable protein binders that can control the activity of proteins by responding to oligonucleotide inputs have been described.26 The protocols describe herein, however, demonstrates a means to follow the function of a new class of protein binders that respond to the presence of natural proteins. In this way, the regulation of an enzyme by a protein biomarkers can be detected in real time, which opens the way for using such systems to selectively activate prodrugs and other substrates of GST.
It is important to keep in mind that the kinetics of GST is very rapid and hence, to obtain reliable results from this enzymatic assay, it is essential to minimize the time between the substrate addition and the beginning of the measurement. In addition, because small changes in enzyme or substrate concentrations may have significant effects on the kinetic measurement, it is recommended to perform all experiments in triplicate and to perform positive and negative control experiments in order to avoid experimental errors and misinterpretation of the results.
One limitation of using enzymatic assays to follow unnatural protein-protein communication is the need to have an enzyme as one of the protein partners. In addition, the current assays follow changes in absorbance and hence, they are less suitable for detecting the activation of the enzyme in living cells, which would require using fluorogenic substrates. However, considering that this field is in its infancy, we believe that similar design principles and experimental protocols could also be used for developing future 'chemical transducers', which may be used to alter the response of cells to environmental signals or to provide them with new properties. If such changes will also result in therapeutic effects, these developments may lead to artificial signal transduction therapy, which relies on drugs that can mediate unnatural protein-protein communication.3
開示事項
The authors have nothing to disclose.
謝辞
この研究はミネルバ財団、HFSP組織、および欧州研究評議会助成金(グラント338265を開始する)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
参考文献
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved