Method Article
Imitieren die Funktion von Signalproteinen: Gegen künstliches Signal Transduction Therapie
In diesem Artikel
Zusammenfassung
We present guidelines for developing synthetic 'chemical transducers' that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific 'transducer' that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Zusammenfassung
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell's function. We present guidelines for designing 'chemical transducers' that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific 'transducer', which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in 'artificial signal transduction therapy'. This work is intended to facilitate developing additional 'transducers' of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Einleitung
Signaltransduktionswege spielt eine bedeutende Rolle in praktisch allen zellulären Prozess und damit die Zelle rasch auf Umgebungssignale zu reagieren. 1 Diese Wege häufig durch die Bindung eines Signalmoleküls an einen extrazellulären Rezeptor ausgelöst werden, die in der Aktivierung von intrazellulären Enzymen führt. Verstärkung und Ausbreitung dieses Signals innerhalb der Zelle wird durch die Funktion vermittelt Proteine von Signalisierungs, die ein Netzwerk von Protein-Protein-Wechselwirkungen bilden, in denen Enzyme mit hoher Spezifität reversibel aktiviert werden. Da Dysregulation dieser Netze führt häufig zur Entwicklung von Krebs, hat es bei der Einrichtung "Signaltransduktion Therapie von Krebs" viel Interesse gewesen, 2 , wobei Medikamente wurden entwickelt , um bösartige Signalwege zu stören. Vor kurzem haben wir einen alternativen Ansatz zur Signaltransduktion Therapie, die beruht auf der Fähigkeit von Arzneimitteln zu erzeugen unnatürliche Signaltransduktionswege vorgeschlagen. 3 Insbesondere glauben wir, dass synthetische Wirkstoffe durch die Gestaltung, die die Funktion von Signalproteinen nachahmen, wäre es möglich , die Zelle die Funktion indirekt zu modulieren. Beispielsweise können diese künstlichen Netzwerken Proteinbiomarker ermöglichen Enzyme zu aktivieren, die Prodrugs abspalten. Alternativ könnten diese Signalprotein-Mimetika können unnatürliche Zelle Signalwege zu aktivieren, in therapeutischen Wirkungen zur Folge hat.
Um die Machbarkeit dieses Ansatzes zu demonstrieren, haben wir vor kurzem eine synthetische "chemische Wandler '4 , die durch Aktivierung von Glutathion-s-Transferase (GST), das von Blutplättchen abstammenden Wachstumsfaktor (PDGF) auszulösen , die Spaltung eines Antikrebs - Prodrug ermöglicht ist nicht seine natürlichen Bindungspartner. Die Struktur dieses "Wandler" besteht aus einem anti-PDGF-Aptamer-DNA, die mit einem bivalenten Inhibitor für GST modifiziert wird. Daher gehört diese synthetische Mittel auf eine Familie von Molekülen mit Bindungsstellenverschiedene Proteine, 5-7 wie chemische Induktoren der Dimerisierung (CIDs) 8-10 und auch an die Gruppe von Protein-Bindemittel auf Basis von Oligonukleotid-synthetisches Molekül - Konjugate. 11-21
Die allgemeinen Prinzipien der Konstruktion solcher Systeme zugrundeliegende Aufgabe wird hierin beschrieben und detaillierte Protokolle zum Synthetisieren und Testen der Funktion dieses "Wandler" mit herkömmlichen enzymatischen Assays bereitgestellt. Diese Arbeit soll zusätzlichen "Wandler" dieser Klasse zu erleichtern entwickeln, die verwendet werden können intrazelluläre Protein-Protein-Kommunikation zu vermitteln und folglich künstliche Zellsignalwege induzieren.
1 schematisch beschreibt die Arbeitsweise von synthetischen "chemische Sensoren" , die unnatürliche Protein-Protein - Kommunikation vermitteln kann. In dieser Darstellung eine "chemische Wandler", die für Prot synthetische Bindemittel integrierteins I und II (Bindemittel I und II), ermöglicht Protein II die katalytische Aktivität des Proteins auszulösen I, die nicht ihren natürlichen Bindungspartner ist. In Abwesenheit von Protein II bindet der Wandler die katalytische Stelle des Enzyms (Proteins I) und inhibiert seine Aktivität (Abbildung 1, Zustand II). Die Bindung des "Transducer" zum Protein II, jedoch fördert Wechselwirkungen zwischen Bindemittel I und der Oberfläche des Protein II (Abbildung 1, Zustand III), die als Ergebnis ihrer Affinität zu Protein I. reduziert, die effektive Konzentration des ' frei "Wandler in der Lösung verringert wird , was dazu führt zur Dissoziation des Wandlers-Protein - Komplex I und Reaktivierung von Protein I (Abbildung 1, Zustand iv). Zusammengenommen markieren diese Schritte drei Grundsätze für die Gestaltung effizienter "Wandler" zugrunde liegen: (1) ein "Wandler" sollte für jeden der Protein-Targets ein spezifisches Bindemittel haben, (2) die Interaktion between Bindemittel II und Protein sollte II als die Wechselwirkung zwischen Bindemittel I und Protein I, und (3) Bindemittel stärker I der Lage mit der Oberfläche des Proteins zu interagieren II sein müssen. Das letzte Prinzip erfordert nicht unbedingt, dass Bindemittel Ich hätte allein eine hohe Affinität und Selektivität gegenüber Protein II. Stattdessen wird es auf unserer jüngsten Studien basieren , die zeigten , daß ein Protein , ein synthetisches Molekül in die Nähe bringen wahrscheinlich Wechselwirkungen zwischen diesem Molekül und der Oberfläche des Proteins zu fördern. 19,22,23

Abb . 1: Funktionsprinzipien von "chemischen Wandler" Wenn die "chemische Wandler" zu einem aktiven Protein hinzugefügt I (Zustand i), bindet es an seine aktive Stelle durch Bindemittel I und hemmt ihre Aktivität (Zustand ii). In Gegenwart von Protein II jedoch die ungebundene "chemische transducer 'in Wechselwirkung mit Protein II durch Bindemittel II, die II Wechselwirkungen zwischen Bindemittel I und der Oberfläche des Proteins fördert. Dieser induzierte Bindemittel I-Protein II Wechselwirkung reduziert die effektive Konzentration des Bindemittels I, die zur Dissoziation des 'transducer'-Protein führt I - Komplex und zur Protein Reaktivierung I (Stand iv). Bitte hier klicken um eine größere Version dieser Figur zu sehen .
Protokoll
1. Synthese des "Chemical Transducer"
- Vorläufige Vorbereitungen
- Bereiten 2 M Triethylammoniumacetat (TEAA) -Puffer durch Mischen von 278 ml Triäthylamin mit 114 ml Essigsäure und 400 ml Reinstwasser. Stellen Sie den pH-Wert auf 7 und Wasser bis zu einem Gesamtvolumen von 1 L. Halten Sie es in einer dunklen Flasche.
Hinweis: Diese Lösung seit Jahren stabil ist. - Bereiten Sie eine 5 mM Ascorbinsäure-Lösung von 18 mg Ascorbinsäure in 20 ml Reinstwasser gelöst wird. Verwenden Sie eine frische Lösung; die Lösung ist für einen Tag stabil.
- Vorbereiten eines 10 mM Cu (II) / Tris (benzyltriazolylmethyl) amin (TBTA) Lösung, die durch Lösen von 25 mg Kupfer (II) -sulfat-pentahydrat in 10 ml Reinstwasser und 58 mg TBTA in 11 ml Dimethylsulfoxid (DMSO). Die beiden Lösungen mischen. Halten Sie es bei Raumtemperatur und schützen Sie es vor Licht.
- Bereiten 2 M Triethylammoniumacetat (TEAA) -Puffer durch Mischen von 278 ml Triäthylamin mit 114 ml Essigsäure und 400 ml Reinstwasser. Stellen Sie den pH-Wert auf 7 und Wasser bis zu einem Gesamtvolumen von 1 L. Halten Sie es in einer dunklen Flasche.
- Konjugation Verfahren
- Man löst 100 nmol des modifizierten Oligonukleotid (ODN-1) in 80 ulvon frischem Reinstwasser. In 20 ul 2 M TEAA, pH = 7. Fügen Sie 80 ul einer frisch zubereiteten Lösung von Ascorbinsäure (5 mM in Wasser).
- Man löst 1,5 & mgr; Mol (574,5 ug) von Azid-modifizierten Ethacrynsäure in 180 & mgr; l DMSO und fügen Sie ihn in die Lösung. Entgasen der Lösung für 60 Sekunden und fügen Sie schnell 40 & mgr; l aus der Cu (II) / TBTA-Lösung (10 mM in 55% (v / v) DMSO / Wasser) unter Verwendung von Argon.
- Spülen Sie wieder mit Argon, dicht schließen, und über Nacht rühren.
- Überwachen Sie den Fortschritt der Reaktion und reinigen das Konjugat durch RP-HPLC (mobile Phase: A) 5% Acetonitril, 5% TEAA, 90% Reinstwasser; B) 65% Acetonitril, 5% TEAA, 30% Reinstwasser). 24
2. Kontrolle GST-Aktivität von PDGF
- Vorläufige Vorbereitungen
- Vorbereitung 50 ml Testpuffer durch 33,9 ml phosphatgepufferter Kochsalzlösung (PBSx1) mit 16,1 ml Reinstwasser Mischen einer 8 mM final Phosphatkonzentration und Anzeige zu erreichen,d 23,8 mg 2 MgCl eine 5 mM Endkonzentration zu erreichen.
- Vorbereitung einer Stammlösung von GST M1-1 durch das Protein in einem Puffer aufgelöst, der 50 mM Tris pH 7,5, 50 mM NaCl, 1 mM Dithiothreitol (DTT) und 5 mM Ethylendiamintetraessigsäure (EDTA) in einer Endkonzentration von 30 uM. Teilen Sie diese Lösung in kleinen Portionen und bei -80 ° C. Verdünnen Sie frisch, gemäß Abschnitt 2.1.5.1, in dem Assaypuffer und auf Eis halten.
Anmerkung: Die Lösung wird für etwa 5 Stunden stabil sein, oder bis es zu einer Verringerung der Enzymaktivität ist. - Bereiten Sie das Substrat gemäß den folgenden Anweisungen:
- Man löst 10 mg reduziertem Glutathion (GSH) in 325 & mgr; l ultrareinem Wasser in einer Endkonzentration von 100 mM Stammlösung. Verdünnen 21 & mgr; l aus dieser Stammlösung in 979 & mgr; l Assaypuffer für eine Endkonzentration von 2,1 mM Arbeitslösung.
- Man löst 10 mg 2,4-Dinitrochlorbenzol (CDNB) in 492 & mgr; l eTHANOL bis zu einer Endkonzentration von 100 mM Stammlösung. Verdünnte 43,2 & mgr; l der Vorratslösung in 956,8 ul eines Assay-Puffers für eine Endkonzentration von 4,32 mM Arbeitslösung.
- In einer 96-Well-Platte, setzen jedes Substrat in einer separaten Zeile (12 Wells). mindestens 60 & mgr; l in jeder Einsatz auch eine schnelle und leichte Entnahme der Lösung zu ermöglichen. Die Platte mit einem Aluminiumblech für Lichtschutz.
- Die folgenden Stammlösungen im Assay-Puffer:
- Verdünne GST M1-1 um 50 bis zu einer Endkonzentration von 0,6 uM des Dimers.
- Verdünnen Sie die "chemische Wandler" zu einer 30 & mgr; M Stammlösung.
- Verdünnte PDGF zu einer Endkonzentration von 40 uM.
- Verdünnte PDGF-Aptamer mit einer Endkonzentration von 250 uM.
- Messen Sie die GST-Aktivität in Gegenwart des "chemischen Wandler 'und PDGF.
- Stellen Sie eine experimentelle Verfahren i upn den Plattenleser für die kinetische Messung.
- Erstellen Sie ein neues Experiment als "Standardprotokoll".
- Drücken Sie auf "Verfahren" das Verfahren Einstellungsfenster zu öffnen.
- In der Pop-up-Liste auf der oberen Seite des Fensters, wählen Sie "384 Platte 'Typ gemäß der Plattenhersteller.
- Drücken Sie 'Read' im linken Menü.
- In Bezug auf das Nachweisverfahren "Absorptions" wählen.
- In Bezug auf die Lesetyp 'Endpunkt' wählen.
- Schreib 340 nm auf der Wellenlängenfenster.
- Drücken Sie auf der 'Vollplatte "unten auf der rechten oberen Seite und wählen Sie das gut gemessen werden.
- Drücken Sie auf "OK" zu schließen das "Lesen" Fenster.
- Wählen Sie "Start kinetische 'im linken Menü.
- Sprechen Sie die Laufzeit 10 min.
- Wählen Sie die Mindestabstände Option.
- Drücken Sie "OK", um die kinetische Fenster zu schließen.
- Ziehen Sie das "Lesen" der Zeile into die kinetische Messung.
- Drücken Sie die 'Bestätigen' Taste und dann die Taste "OK".
- Speichern Sie das Experiment.
- Drücken Sie die "Play" -Taste. Ein Dialogfeld erscheint - drücken Sie die Taste "OK" nur dann, wenn die Messung gestartet werden soll.
- Um die Triplikaten Experiment durchführen, bereiten vier Proben mit jeweils 3,25 ul des "chemischen Wandler" und 3,25 ul GST M1-1. In jeder Probe 0, 1.2, 2.4 oder 4.9 ul PDGF und 123,5, 122,3, 121,1 oder 118,6 ul des Puffers Assay sind.
- Inkubieren der Lösung bei Raumtemperatur für 10 min.
- In einem 384-Well-Platte transparent, legen Sie 40 ul der Probe in jede Vertiefung. Setzen Sie die Proben nur in den ungeraden Brunnen oder nur in den geraden Vertiefungen in der gleichen Linie die Verwendung eines Multi-Pipettor für Substratzugabe zu ermöglichen.
- Mit einem 12-Kanal-Multi-Pipette, fügen Sie schnell 10 ul von jedem der ter Substrate, die in der 96-Well-Platte (siehe Abschnitt 2.1.4), bereits vorgefertigt wurden. Vorsichtig mischen und schnell Blasen zu vermeiden. Legen Sie die Platte in das Lesegerät und die kinetische Messung starten. Da GST Kinetik sehr schnell ist, versuchen, die Zeit zwischen der Substratzugabe und dem Beginn der kinetischen Messung zu minimieren.
- Stellen Sie eine experimentelle Verfahren i upn den Plattenleser für die kinetische Messung.
- GST Aktivierung / Hemmung Zyklen durch die "chemische Wandler 'Vermittelte.
- Um die Triplikaten Experiment durchführen, bereiten 5 Proben mit je 84,5 ul Assay-Puffer, 3,25 & mgr; l 'chemischen Wandler "und 3,25 ul GST M1-1. Inkubieren bei Raumtemperatur für 3 min.
- In 3,65 ul Assaypuffer 1 und 3,65 ul von PDGF auf Probe 2-5 zu den Proben. Inkubieren bei Raumtemperatur für 3 min.
- In 3,12 ul Assay-Puffer zu den Proben 1-2 und 3,12 ul PDGF Aptamer Proben 3-5. Inkubieren bei Raumtemperatur für 3 min.
- Hinzufügen, 24,4 & mgr; l Assay-Puffer zu den Proben1-3 und 24,4 & mgr; l von PDGF auf die Proben 4-5. Inkubieren bei Raumtemperatur für 3 min.
- 7.8 & mgr; l Assay-Puffer zu den Proben 1-4 und 7,8 & mgr; l PDGF-Aptamer für 5 min 5. Inkubieren bei Raumtemperatur abzutasten.
- In einem 384-Well-Platte transparent, legen Sie 40 ul der Probe in jede Vertiefung. Legen Sie Proben nur in den ungeraden oder nur in den geraden Vertiefungen in der gleichen Linie.
- Mit einem 12-Kanal-Multi-Pipette, fügen Sie schnell 10 & mgr; l von jedem Substrat (pre-vorbereitet in der 96-Well-Platte). Vorsichtig mischen und schnell Blasen zu vermeiden. Legen Sie die Platte in das Lesegerät und die kinetische Messung starten.
- Berechne den V 0 [mOD / min] unter jeder Bedingung durch die OD bei 340 nm bei t gemessen Subtrahieren = 0,5 min von der OD bei 340 nm gemessen bei t = 1,5 min , die Aktivierung / Sperrung Recycelbarkeit zu beurteilen. 25
- Bewerten Sie die Reaktion in Echtzeit des "chemischen Wandler" auf Veränderungen in der Umwelt.
- Echtzeit-Wirkung von PDGF hinaus
- Stellen Sie eine experimentelle Verfahren in der Plattenleser für die kinetische Messung auf.
- Wiederholen Sie die Schritte 2.2.1.1-2.2.1.10.
- Machen Sie die Laufzeit 3,5 min.
- Wählen Sie die Mindestabstände Option.
- Drücken Sie "OK", um die kinetische Fenster zu schließen.
- Ziehen Sie das "Lesen" Zeile in die kinetische Messung.
- Wählen Sie Platte Out / In im linken Menü.
- Wählen Sie die Option "plate out (kein Dialog) '.
- Wählen Sie die "Verzögerung" Option im linken Menü auf und geben Sie 30 Sek.
- Wählen Sie Platte Out / In im linken Menü.
- Wählen Sie die Option "Platte in (ohne Dialog) '.
- Erstellen Sie eine zweite kinetische Messung durch die Schritte 2.2.1.4 zu wiederholen - 2.2.1.14 aber in Abschnitt 2.2.1.11 die kinetische gesetzt 25 min anstelle von 10 min zu sein.
- Drücken Sie die 'Bestätigen' Taste und dann die Taste "OK".
- Speichern Sie das Experiment.
- Drücken Sie die 'play 'Taste. Ein Dialogfeld erscheint - drücken Sie die Taste "OK" nur dann, wenn die Messung gestartet werden soll.
- Bereiten Sie zwei Proben von 1 ul GST M1-1 Mischen und 1 ul des "chemischen Wandler 'in 38 ul Puffer Assay. Legen Sie die Proben in zwei Vertiefungen einer 384-Well-Platte transparent, eine leere gut zwischen diesen beiden Brunnen zu verlassen.
- Mit einem 12-Kanal-Multi-Pipettor, schnell 10 & mgr; l von jedem Substrat hinzufügen, vorsichtig mischen und schnell Blasen zu vermeiden, um die Platte in das Lesegerät einlegen und die kinetische Messung starten.
- Wenn die Platte öffnet sich (nach 3,5 min), fügen Sie schnell 1,125 ul PDGF zu einem der Brunnen, vorsichtig mischen, und lassen Sie die Platte für die verbleibenden kinetischen Messungen zu schließen.
- Echtzeit-Effekt der Zugabe des PDGF-Aptamer
- Wiederholen Sie die Schritte 2.4.1.1-2.4.1.15.
- Bereiten Sie zwei Proben von 1 ul GST M1-1 Mischen, 1 & mgr; l der 'chemische Wandler "und 1,125 & mgr; l PDGF in 36,9 ul Puffer Assay. Legen Sie die Proben in zwei Vertiefungen einer 384-Well-Platte transparent, eine leere gut zwischen diesen beiden Brunnen zu verlassen.
- Mit einem 12-Kanal-Multi-Pipettor, schnell 10 & mgr; l von jedem Substrat hinzufügen, vorsichtig mischen und schnell Blasen zu vermeiden, um die Platte in das Lesegerät einlegen, und die kinetische Messung starten.
- Wenn die Platte öffnet sich (nach 1,5 min), fügen Sie schnell 1,2 ul PDGF - Aptamer an einem der Brunnen, vorsichtig mischen und lassen Sie die Platte für die verbleibenden kinetischen Messungen zu schließen.
- Echtzeit-Wirkung von PDGF hinaus
- Messen Sie JS-K Prodrug-Aktivierung durch GST in der Gegenwart des "chemischen Wandler 'und PDGF.
- Stellen Sie eine experimentelle Verfahren in der Plattenleser für die kinetische Messung auf.
- Erstellen Sie ein neues Experiment als "Standardprotokoll".
- Drücken Sie auf "Verfahren" das Verfahren Einstellungsfenster zu öffnen.
- In der Pop-up-Liste auf der oberen Seite des Fensters '384 Platte' Typ gemäß der Plattenhersteller wählen.
- Drücken Sie 'Read' im linken Menü.
- In Bezug auf das Nachweisverfahren "Absorptions" gewählt haben.
- In Bezug auf die Lesetyp 'Endpunkt' wählen.
- Schreib 305 nm auf der Wellenlängenfenster.
- Drücken Sie auf die "Vollplatte" -Taste auf der oberen rechten Seite und wählen Sie das gut gemessen werden.
- Drücken Sie auf "OK" zu schließen das "Lesen" Fenster.
- Wählen Sie "Start kinetische 'im linken Menü.
- Sprechen Sie die Laufzeit 10 min.
- Wählen Sie die Mindestabstände Option.
- Drücken Sie "OK", um die kinetische Fenster zu schließen.
- Ziehen Sie das "Lesen" Zeile in die kinetische Messung.
- Drücken Sie die 'Bestätigen' Taste und dann die Taste "OK".
- Speichern Sie das Experiment.
- Drücken Sie die "Play" -Taste. Ein Dialog box erscheint - drücken Sie die Taste "OK" nur dann, wenn die Messung gestartet werden soll.
- Für die NO-Produktion Messungen verwenden, um ein Nitrit / Nitrat kalorimetrischen-Kit. In einer 96-Well-Platte 50 ul Testpuffer einfügen in eine Zeile, 70 & mgr; l Griess ich in einer zweiten Reihe Reagens und 70 ul von Griess II Reagenz in einer dritten Reihe.
- Um die Triplikaten Experiment durchführen, bereiten vier Proben mit jeweils 4,8 ul des "chemischen Wandler". Zu 1 Probe, 155,2 ul Assay-Puffer hinzuzufügen; 2, fügen 3,2 ul GST-M1-1 und 152 & mgr; l Assaypuffer zu probieren; 3, fügen 9,6 ul PDGF und 145,6 ul Assaypuffer zu probieren; und 4 Probe, fügen 3,2 ul GST-M1-1, 9,6 ul PDGF und 142,4 ul Puffer Assay.
- Inkubieren der Lösung bei Raumtemperatur für 10 min.
- In einem 384-Well-Platte transparent, fügen Sie 50 ul der Probe in jede Vertiefung. Legen Sie Proben nur in den ungeraden oder nur in derauch Vertiefungen in der gleichen Linie die Verwendung eines Multi-Pipettor für Substratzugabe zu ermöglichen.
- Hinzufügen, 0,54 ul JS-K (5 mM in DMSO) zu jedem Well.
- Mit einem 12-Kanal-Multi-Pipettor, schnell 10 & mgr; l aus der GSH-Lösung (in der 96-Well-Platte vorbereitete) hinzufügen, vorsichtig mischen und schnell Blasen zu vermeiden. Legen Sie die Platte in das Lesegerät und die kinetische Messung starten.
- Unmittelbar nach der kinetischen Messung, ein 12-Kanal-Multipipette, nehmen 50 & mgr; l von jeder Probe in den Testpuffer Zeile in der vorbereiteten 96-Well-Platte und schnell auf sie 50 ul Reagenz Griess ich hinzufügen und 50 ul Griess II Reagenz. Inkubieren während sie von Licht für 10 min bei RT und Messen der Extinktion bei 550 nm zu schützen.
Hinweis: Der Testpuffer und Reagenzien Volumen auf der Kits 'Protokoll abhängig sind.
- Stellen Sie eine experimentelle Verfahren in der Plattenleser für die kinetische Messung auf.
Ergebnisse
Das Design, die Synthese und Wirkungsmechanismus eines "chemischen Wandler ' , die künstliche Verbindung zwischen PDGF und GST induzieren kann in Abbildung 2 dargestellt. Die Struktur des" Transducer "integriert eine PDGF DNA - Aptamer und einem bis-Ethacrynic amid (bea ), die eine bekannte GST - Inhibitor (2a) ist. 19. Diese Bindemittel die "Wandler" ermöglichen sowohl PDGF und GST mit unterschiedlichen Affinitäten zu binden, und zwar mit Dissoziationskonstanten (K d 's) von 26 nM und 144 nM bzw. Darüber hinaus. 4 gemäß diesem Entwurf soll die Bindung an PDGF induzieren unspezifische Wechselwirkungen zwischen der BeA - Einheit und der Oberfläche des PDGF, die deutlich die Wirksamkeit des BeA - Hemmer verringern würde. 19,22,23 2b zeigt die Betätigungsmechanismus dieses System zugrunde liegt. Nach Zugabe des "Transducer" zu einem aktiven GST, diezwei EA-Einheiten binden gleichzeitig beide aktiven Zentren dieser dimeres Enzym und seine Aktivität hemmen. In Gegenwart von PDGF, jedoch ein PDGF-'transducer 'Komplex gebildet, der die BeA-Einheit von hemmenden GST verhindert. Dies führt folglich zur Dissoziation des GST-'transducer 'komplex und GST Reaktivierung. GST kann dann durch Zugabe eines nicht-modifizierten PDGF-Aptamer, das die "chemische Wandler" verdrängt und ermöglicht es zu verhindern, GST wieder erneut gesperrt werden.
Die Fähigkeit von PDGF auf GST-Aktivität Kontrolle wurde zunächst durch Messung GST (10 nM) Aktivität mit und ohne die "chemische Wandler '(500 nM) und Messen der Aktivität des GST-'chemical Wandler" Komplex in Gegenwart verschiedener Konzentrationen nachgewiesen von PDGF (250, 500 und 1000 nM) (Abbildung 3a). Nach Feststellung, dass die "chemische Wandler" künstliche PDGF-GST Kommunikation induziert, wirnächstes festgestellt, dass diese künstliche Kommunikation, ähnlich zu den Signalübertragungsschritten, auch umkehrbar ist und passt sich schnell auf Änderungen in der Umgebung. Reversible Aktivierung / Hemmung von GST wurde durch aufeinanderfolgende Zugaben von PDGF und PDGF unmodifizierten Aptamer an das GST-Wandler'chemical 'Komplexes (3b) durchgeführt. Die Antwort des Systems in Echtzeit Änderungen in ihrer Umgebung wurde durch Messung GST-Aktivität bewertet, während die verschiedenen Eingaben hinzufügen. Eine rasche Zunahme der GST - Aktivität wurde nach der Zugabe von PDGF (750 nM) an die GST-'transducer 'Komplex (10 nM und 500 nM jeweils) 3,5 Minuten nach Zugabe von Substraten (4a) beobachtet. In ähnlicher Weise wurde bei der Zugabe von PDGF - Aptamer (5 uM) zu einer Mischung von GST (10 nM), PDGF (750 nM), und die "chemischen Wandler '(500 nM) (4b) eine Abnahme der GST - Aktivität beobachtet.
Fsprünglich zeigten wir die Fähigkeit eines solchen Systems Prodrug-Aktivierung in Reaktion auf Änderungen in der Umgebung zu steuern. JS-K ist ein Anti - Krebs - Prodrug von GST aktiviert toxischen NO freizugeben (Abbildung 5a). Die Menge an NO bei der Zugabe von JS-K (45 & mgr; M) auf die "chemischen Wandler '(750 nM) und verschiedene Kombinationen von GST freigegeben (10 nM) und PDGF (2 uM) wurden gemessen (Abbildung 5b), was bestätigt , dass nur die Anwesenheit sowohl GST und PDGF wird in Prodrug-Aktivierung führen.
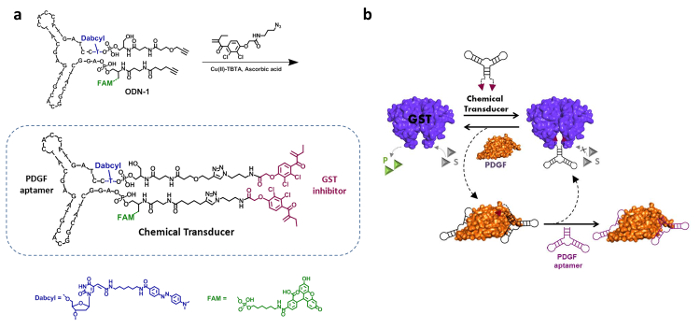
Abbildung 2. "Chemische Wandler . " - Synthese und Betätigungsmechanismus (a) Der "chemische Wandler 'besteht aus einem PDGF - Aptamer, einem bivalenten Ethacrynic Amid (EA) GST - Inhibitor, einem Fluorophor (FAM) und einen Löscher (Dabcyl) . Dieses Aptamer-Inhibitor-Konjugatsynthetisiert wird durch Anbringen eines Azid-modifizierten Ethacrynic amid (EA) Derivat ein Dialkins modifizierte und fluoreszenzmarkierten DNA-Aptamer (ODN-1). Neu gedruckt mit Genehmigung aus Lit. 4. (B) Die enzymatische Aktivität von GST wird mit dem chemischen Wandler 'gehemmt durch die Bindung der EA - Gruppen an den aktiven Zentren des Enzyms. Zugabe von PDGF führt zur Bildung des PDGF-'chemical Wandler "Komplex, der die stört 'transducer'-GST-Wechselwirkung, damit die enzymatische Aktivität wieder her. Die folgende Zugabe einer unmodifizierten PDGF Aptamer stellt den "chemischen Wandler" und ermöglicht es , das Enzym wieder zu hemmen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
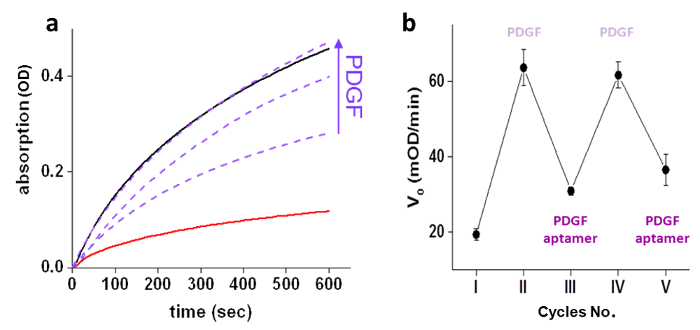
Fi. Abbildung 3: PDGF-gesteuerte GST - Aktivität (a) GST (10 nM) die enzymatische Aktivität in Gegenwart (-) und Abwesenheit (-) des "chemischen Wandler '(500 nM), und in Gegenwart des" chemischen Wandler '(500 nM) mit steigenden Konzentrationen (250, 500, oder 1000 nM) von PDGF (---). (B) Inhibition-Aktivierungszyklen des GST enzymatische Aktivität manifestiert sich durch Veränderungen in der Anfangsgeschwindigkeit (V 0) in Reaktion auf aufeinanderfolgende Zugaben (IIV) von PDGF und PDGF unmodifizierten Aptamer an das GST-'chemical Wandler "Anlage: (I) keine, (II), PDGF (750 nM), (III) PDGF-Aptamer (4 & mgr; M), (IV ) PDGF (5 uM) und (V) PDGF-Aptamer (10 uM). Die Grafik zeigt den Mittelwert ± STABW von Triplikaten. Re-gedruckt mit Genehmigung aus Lit. 4. Bitte klicken Sie hier um ein , um zu vergrößern Version dieser Figur.

. Abbildung 4: Echtzeit - Kontrolle der GST - Aktivität (a) Verbesserung der GST - Enzymaktivität detektiert unmittelbar nach der Zugabe von 750 nM PDGF (-) zu einer Lösung , die GST (10 nM) und "chemischen Wandler '(500 nM) ( -) bei t = 3,5 min. (B) Zugabe eines unmodifizierten PDGF - Aptamer (5 uM) (-) zu einer Lösung , die GST (10 nM), PDGF (750 nM), und die "chemische Wandler '(500 nM) (-) bei t = 1,5 min führt zu einer sofortigen Abnahme der enzymatischen Reaktionsgeschwindigkeit. Re-gedruckt mit Genehmigung aus Lit. 4. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
5 "src =" / files / ftp_upload / 54396 / 54396fig5.jpg "/>
Abb . 5: Kontrollierte Prodrug - Aktivierung (a) GST Aktivierung von JS-K Prodrug toxischen NO freizusetzen. (B) NO - Freisetzung in Gegenwart des "chemischen Wandler und unterschiedliche Kombinationen von GST (10 nM) und PDGF (2 uM). Die Grafik zeigt den Mittelwert ± STABW von Triplikaten. Geändert mit Genehmigung aus Lit. 4. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
We presented a method for designing and testing of a 'chemical transducer' that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the 'chemical transducer' and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to follow the deactivation of GST by a competing aptamer, as well as the PDGF-mediated cleavage of an anticancer prodrug. Other switchable protein binders that can control the activity of proteins by responding to oligonucleotide inputs have been described.26 The protocols describe herein, however, demonstrates a means to follow the function of a new class of protein binders that respond to the presence of natural proteins. In this way, the regulation of an enzyme by a protein biomarkers can be detected in real time, which opens the way for using such systems to selectively activate prodrugs and other substrates of GST.
It is important to keep in mind that the kinetics of GST is very rapid and hence, to obtain reliable results from this enzymatic assay, it is essential to minimize the time between the substrate addition and the beginning of the measurement. In addition, because small changes in enzyme or substrate concentrations may have significant effects on the kinetic measurement, it is recommended to perform all experiments in triplicate and to perform positive and negative control experiments in order to avoid experimental errors and misinterpretation of the results.
One limitation of using enzymatic assays to follow unnatural protein-protein communication is the need to have an enzyme as one of the protein partners. In addition, the current assays follow changes in absorbance and hence, they are less suitable for detecting the activation of the enzyme in living cells, which would require using fluorogenic substrates. However, considering that this field is in its infancy, we believe that similar design principles and experimental protocols could also be used for developing future 'chemical transducers', which may be used to alter the response of cells to environmental signals or to provide them with new properties. If such changes will also result in therapeutic effects, these developments may lead to artificial signal transduction therapy, which relies on drugs that can mediate unnatural protein-protein communication.3
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde von der Minerva-Stiftung, der HFSP-Organisation und einen Europäischen Forschungsrat Grant (Starting Grant 338.265) unterstützt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Referenzen
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, 'turn-on' fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten