Method Article
Kappa (VK) için Antikor Bağlama Özgünlük Hafif Zincir içeren İnsan (IgM) Antikorlar: Polysialic Asit (PSA) bir Vaka Çalışması olarak NCAM Bağlı
Bu Makalede
Özet
We present a protocol to identify protein moieties containing antigens for human and mouse IgM antibodies with specific kappa (Vκ) light chains. This protocol is not limited to IgM class antibodies but applies to all immunoglobulin isotypes that target their antigen with sufficiently high affinity during immunoprecipitations.
Özet
Antibodies of the IgM isotype are often neglected as potential therapeutics in human trials, animal models of human diseases as well as detecting agents in standard laboratory techniques. In contrast, several human IgMs demonstrated proof of efficacy in cancer models and models of CNS disorders including multiple sclerosis (MS) and amyotrophic lateral sclerosis (ALS). Reasons for their lack of consideration include difficulties to express, purify and stabilize IgM antibodies, challenge to identify (non-protein) antigens, low affinity binding and fundamental knowledge gaps in carbohydrate and lipid research.
This manuscript uses HIgM12 as an example to provide a detailed protocol to detect antigens by Western blotting, immunoprecipitations and immunocytochemistry. HIgM12 targets polysialic acid (PSA) attached to the neural cell adhesion molecule (NCAM). Early postnatal mouse brain tissue from wild type (WT) and NCAM knockout (KO) mice lacking the three major central nervous system (CNS) splice variants NCAM180, 140 and 120 was used to evaluate the importance of NCAM for binding to HIgM12. Further enzymatic digestion of CNS tissue and cultured CNS cells using endoneuraminidases led us to identify PSA as the specific binding epitope for HIgM12.
Giriş
IgM izo türü antikorların kanser ve merkezi sinir sistemi bozukluklarının 1-7 dahil olmak üzere çeşitli hastalıkların tedavisi için büyük terapötik potansiyeli göstermektedir. Vollmers 'grubu tümöre özel biyolojik veya apoptotik yollar 4,8,9 indükleyerek kötü huylu hücreleri öldürmek mümkün olan aktif terapötik olarak potansiyel kullanımı için kanserli hastalarda çeşitli antikorlar tespit edilmiştir. İlginç bir şekilde, terapötik potansiyeli olan tüm tanımlanan antikorlar, IgM izo türünün ve "doğal otoantikorlar" (yakalar) grubuna aittir.
Benzer şekilde, Rodriguez grup fare ve multipl skleroz (MS) bir model Kronik miyelin kaybetmiş omurilik lezyonları yeniden miyelin oluşumunu teşvik insan antikorları tespit edilmiştir. Anti-kanser etkilere sahip antikorlar ile aynıdır, her remiyelinasyon teşvik antikorlar yakalar ve IgM izo 1,6,7,10 arasında. saptanabilir IGMS için kesin antijenler de saptanmamış olanBen klinik çalışmalar MS hastalarında 11 şu anda Faz insan remiyelinizasyon teşvik antikor rHIgM22 dahil olmak üzere, d. Akademik ortamda ve sanayi 11 ortaklığı ile hem lipit ve karbonhidrat araştırma alanında uzmanlar tarafından tekrarlanan çabalarına rağmen, rHIgM22 en antijen başarılı olmamıştır tanımlamaya çalışır. IgM antikorları ile çalışmak için IgG antikorlarının antijenler tanımlamak için kullanılan standart teknikler başarısızlığı bu antikorlar en olası hedef karbonhidrat ya da lipid antijenleri için özel yöntemler geliştirmek için önemli bir ihtiyaç tanımlar.
Bu yazının odak noktası insan rejeneratif antikor HIgM12 ve antijeni tanımlamak için kullanılan deneysel prosedürler olduğunu. Antikor HIgM12 Waldenström makroglobulinemisi hastalardan tespit edilmiştir, in vitro 12-14 nörit gelişimini uyarır ve nöral hücre adhezyon molekülü (PSA-NCA bağlı polysialic asit (PSA) hedefM) 15,16. HIgM12 ALS 17 bir fare modelinde ömrünü uzatır ve Theiler ensefalomiyelit virüsü murin (TMEV) ile enfekte olan fareler, fonksiyonel iyi sonuçlar alınabilir. Intraperitoneal, tek bir düşük doz antikor 18 enjekte sonra Özellikle, HIgM12 küçük ve orta çapı omurilik aksonlarının sekiz haftalık kronik demiyelinize fare ve gittikçe artan sayıda spontan yatay ve dikey motor aktivitesini uyarır.
Nöral hücre adhezyon molekülü (NCAM) süper nöronlar, glia, iskelet kası, ve doğal öldürücü hücreler 19-25 hücre yüzeyi üzerinde eksprese edilen immünoglobülin (Ig) 'in bir glikoproteindir. NCAM180, NCAM140 ve NCAM120 olarak adlandırılan üç ana NCAM izoformları kendi sitoplazmik alanında yalnızca değişir birincil transkriptin seçenek dilim varyantı bulunmaktadır. CNS içindeki, NCAM uzun negatif yüklü sialik asit homopolimerleri majör polisialilatlanmış molekülü (>% 95) 'dir. Polysialic birn> 10 ile cid PSA denir ama daha kısa oligomerik yapılar da biyolojik ilgili olduğunu mevcuttur. MSS ifade Diğer polisialilatlanmış proteinler SynCAM1 26, Nöropilin-2 (NRP-2) 27,28 ve bir sodyum kanal alt birimi 25 (inceleme için 29 bakınız).
Burada tarif edilen yöntemler bağımsız antikorun izotipini (örneğin, IgG, IgM spesifik kappa (VK) hafif zincirler (insan antikorları ve fare antikorları için VκI hafif zincirler için VκI, VκIII ya VκIV hafif zincirleri) içeren insan ve fare immünoglobulin Antigen tanımlanmasına izin , IgA, IgD veya IgE). Bu sınırlama, IgM izo türü antikorların ile imüno-protein L agaroz kullanımına dayanmaktadır. Alternatif stratejiler Inc fazla IgM antikorları, bu yöntemin uygulanabilirliği genişletebilmemiz mannoz bağlayıcı lektinler kovalent boncuk agaroz ile bağlantılı sekonder IgG anti-IgM antikorları içerebilirlambda (λ) hafif zincirleri olan luding (tartışmaya bakınız). 1. 30: sağlıklı bireylerden elde edilen IgM λ hafif zincirlerin kıyasla sadece serum IgM VK hafif zincirlerinin oranı 1.5 bulunmaktadır.
Ayırmak zenginleştirmek ve immünolojik belirli molekülleri 31 algılamak için buraya kullanılan kromatografik metodolojisine dayanan, tüm antijenler, en az bir küçük protein etki alanı dahil gerekmektedir. Antikorun spesifik bağlama epitopu içinde veya (glikoproteinler, lipoproteinler örneğin,) proteini etki alanı dışında olabilir. potansiyel aday listesini daraltmak için ilgili, HIgM12 için spesifik antijen tanımlamak için kullanılan ilk biyokimyasal adımlar, bu yöntemde en önemli adımlardır. Hücre tipi özel hazırlıklar ve hücre morfolojisi tabanlı karakterizasyonları glial hücreler için tarif edilmiştir ama bu metodoloji içinde veya MSS dışındaki diğer hücre tiplerini karşılamak için çıkarım olabilir.
acil varAntikor hedefler karbonhidrat ya da lipit yapılardır terapötik özellikle durumlarda farklı insan bozukluklar için potansiyel (IgM antijenlerin çoğunluğu) ile IgM antikorlarının artan sayıda uygulanabilir, yeni ya da değiştirilmiş teknikleri geliştirmek gerekir.
Protokol
Hayvan protokolleri ve prosedürleri Sağlık kılavuzların National Institutes göre yapılan ve Mayo Clinic kurumsal hayvan bakımı ve kullanımı komiteleri (Mayo IACUC protokol numarası # A51912) tarafından onaylanmıştır.
1. Genel CNS Doku Hazırlanması
- heterozigot geçerek, heterozigot NCAM fareler ve yabani tip (WT) littermates (C57 / BL6) (nazikçe Dr Lynn Landmesser, Case Western Reserve Üniversitesi, Cleveland, Ohio tarafından sağlanan) C57 / BL6 arka plan üzerinde NCAM eksik (KO) fareler oluşturun. NCAM KO farelerde Genotipleme önce 32-34 tarif edilmiş ve daha ayrıntılı olarak açıklanmayacaktır.
Not: 1.2 Adımları - 1.6 İsteğe bulunmaktadır.
- Ameliyat öncesinde, bir pentobarbital çözeltiyi uygulamaya (Hazır: 25 mg / ml; erken doğum sonrası ilgili erginleri için pentobarbital 50/100 ul) periton içine enjekte (27 gauge iğne ve 1 ml ileşırınga).
- 2 dakika bekleyin ya da hayvanın kadar anestezi cerrahi uçağı ulaşmıştır. anestezi cerrahi düzlemi korumak için, her operasyon esnasında gerekli olduğu şekilde ek anestezisi uygular. Anestezi derinliğini belirlemek için ayak tutam yanıt yöntemini kullanın. Hayvanlar devam etmeden önce tepkisiz olmalıdır.
- sadece göğüs kafesine altında kabuklarıyla ve karın duvarından 1 cm lateral insizyon - 0.5 yapın. Dikkatle diyaframdan karaciğeri ayırın. kavisli, künt makas kullanarak diyafram küçük bir kesi yapmak. plevra boşluğuna maruz göğüs kafesinin tüm uzunluğu boyunca diyafram kesi devam edin.
- dikkatle akciğerleri yerinden, göğüs kafesinin bir tarafı boyunca eğri, künt makas yerleştirin ve köprücük kemiği ile göğüs kafesinin kadar içinden bir kesim yapmak. karşı tarafta da benzer bir kesim olun. uzakta sternum Kaldırma dikkatlice kalp bağlayarak herhangi bir dokuyu kırpın.
- hayvana bir kesi yapmak'Mümkün olduğunca geniş bir çıkış oluşturmak için iris makas kullanarak sağ atrium s. Yavaş yavaş hayvanın sol ventrikül içine, fosfat tamponlu tuzlu su (PBS), 10 ml enjekte (kırmızı ışık, akış hızı: 1 mL / dakika) ile 27 ölçü iğne ile donatılmış 10 ml'lik bir şırınga ile. doku yıkımını önlemek için perfüzyon sırasında basınç / PBS akışını artırmak etmeyin.
- cerrahi makas kullanarak neonatal fareler başını kesmek.
- Bir forseps ile göz yuvalarını kapma ve omurga içine küçük bir makas sokarak beyin çıkarın. kulak seviyesinde öne doğru kafatası kesti. Soyma geri kafatası ve yavaşça buz üzerine buz soğukluğunda kesme ortamı 10 ml (Tablo 1) ile dolu bir 60 mm Petri kabı içine beyin yerleştirin. 1.5 ml mikrosantrifüj tüp içinde her beyin yerleştirin ve hemen kuru buz üzerinde saklamak (-79 ºC).
- buz üzerinde temiz bir jilet kullanarak dondurulmuş beyninden beyincik ve beyin sapı İnsizyon. doku çözdürme önlemek için hızlı bir şekilde çalışın.
- tartmakDondurulmuş beyin, buz üzerinde 15 ml tüp içinde koymak ve ul liziz tamponu 150 ug beyin dokusu nihai konsantrasyona kadar buz soğukluğunda lizis tamponu (Tablo 1 e bakınız) ilave edilir. Cerebra'ya kalan için tekrarlayın. adımlar 1.9 için her zaman buz üzerinde beyinleri tutun - 1.11.
- 27-gauge iğne (10 kez) ile donatılmış bir 5 ml şırıngaya ile toz haline getirildi, 1 ml pipet ucu (10 kez) ile toz haline getirilerek liziz tamponunda beyinleri homojenize edilir. tam doku lizis izin vermek için buz üzerinde 30 dakika daha beyin lizatları inkübe edin.
- (4 ° C'de 10 dakika boyunca 19,000 x g'de dört kez) deterjan çözünmeyen malzeme ve beyin seri santrifüjleme yoluyla lipidler çıkarın. Sil (beyaz) miyelin ve pelet içeren hücre döküntüsü ama her bir santrifüj aşamasında sonra süpernatant saklayın. Kısım beyin lizatları ve mağaza -80 ºC de.
Cerebra bir "Pull-down" Ajan İnsan IGMS (HIgM12 ve İzotip Kontrol IgM) kullanma 2. imünoWT l lizatlarında ve NCAM KO Farelerinde
- Protein L Agaroz boncuk hazırlama 9,35,36
- BSA (Tablo 1 e bakınız) dahil olmak üzere, bir IP tampon maddesi 200 ml hazırlayın. BSA içermeyen aynı IP tampon maddesi bir 200 ml hazırlayın.
- immünopresipitasyon reaksiyonu transferi 1.5 ml mikrosantrifüj tüp içine 200 ul pipet kullanarak protein L Agaroz bulamaç 100 ul başına. vorteks proteini L agaroz boncuklar yapın! IP tampon maddesi 1 ml ilave edilir, her bir tüp (Tablo 1 e bakınız). Protein L agaroz ve inversiyon aracılığıyla elle IP tampon (beş kez) karıştırın.
- bir tezgah üstü santrifüj içinde yıkayın proteini L agaroz taneleri santrifüjleme ile dört kez (1.000 x g, 2 dakika, 25 ° C). Agaroz pelet bozmadan 200 ul pipet kullanarak süpernatant çıkar. Tekrarlama yıkama 2.1.2 üç 2.1.3 ilave kez yineleyin.
- 4 ° C'de gece boyunca bir silindir üzerine taze eklenen IP tampon maddesi 1 ml Protein L agaroz dengelenmesi.
- Western lekeleme, antikor-antijen-agaroz L kompleks oluşumu ve antijen tespit
- 4 ° C'de, bir silindir üzerinde bir gece boyunca, 1.5 ml mikrosantrifüj tüpü içinde IgM antikoru (HIgM12) 20 ug buz soğukluğunda bir IP tampon maddesi 1 ml liz beyin dokusunda (~ 200 ul lizat) 30 mg inkübe edin.
- 1000 xg, 4 ° C'de 2 dakika süreyle bir tezgah üstü santrifüj içinde (adım 2.1.4 itibaren) Protein L agaroz boncuk aşağı doğru döndürün. Agaroz pelet bozmadan 200 ul pipet kullanarak süpernatant atın. 1 ml pipet kullanılarak protein L agaroza (adım 2.2.1 arasında) soğutulmuş bir antikor-beyin lizat solüsyonu ekleyin.
- 4 ° C'de, bir silindir üzerinde 2 saat için antikor-antijen proteini L agaroz süspansiyon inkübe edin. 2 dakika, 4 ° C '1000 xg'de santrifüjleme ile L agaroz bağlı antikor-antijen kompleksinin yıkayın. Dikkatlice pelet bozmadan süpernatan atılır ve% 0.2 BSA ihtiva eden buzla soğutulmuş bir IP tampon maddesi 1 ml.
- % 0.2 BSA ve BSA olmayan buz soğukluğunda bir IP tamponu kullanılarak iki kez daha ihtiva eden buzla soğutulmuş bir IP tamponu kullanılarak yıkama aşamasından, bir kez daha tekrarlayın.
- 2 dakika, 4 ºC 1000 xg'de L agaroz bağlı antikor-antijen kompleksi aşağı doğru döndürün. Tamamen birinci çözelti, 50 ul, 10 ul pipet ardından Protein L agaroz pelet üzerine bırakılır ~ kadar 200 ul pipet kullanarak süpernatant atılır. buz üzerinde örnekleri tutun.
- IP elüsyon tamponu 40 ul ekle 95 ° C 'de 5 dakika boyunca 1.5 ml mikrosantrifüj tüpleri, parmakla hafifçe vurma tüpler 6 kez ve ısı başı (Tablo 1 e bakınız). 2 dakika boyunca buz üzerinde örnekleri koyun ve 13.000 xg, 4 ° C'de 30 saniye boyunca aşağı doğru döndürün.
- pelet bozmadan yeni bir 1.5 ml mikrosantrifüj tüp içine 10 ul pipet (~ 35 ul toplam) kullanarak süpernatant aktarın. İç boru duvarında edilen örnek bir miktar aşağı doğru durulama ile protein L agaroz boncuklar yokluğunu onaylamak.
Not: "Granül"Protein L agaroz boncuklar açıkça varsa görebilir. - Protein L agaroz boncuklar varsa, 13.000 xg'de bir 30 saniye örnek aşağı spin ve tüp temizlemek için süpernatant aktarın. Hiçbir agaroz boncuklar saptanabilir kadar adımı tekrarlayın.
- Yük 10 - bir Tris / glisin / SDS tampon sisteminde, SDS-poliakrilamid jeli üzerinde oyuk başına yıkandı, örnekleri 20 ul (Tablo 1 e bakınız).
Not: - 8.6 x 6.7 x 0.1 cm) kullanın% 7.5 ya da 4 PSA-NCAM veya NCAM izoformlarının (jel boyutları (G x U x kalınlık tespiti için kuyu başına 50 ul yükleme hacmi ile% 20 gradyan jelleri. - Masa üstü 100 V de yaklaşık 1 saat boyunca çalıştırmak jeller (1.74 U / cm2). Diğer ferahlatıcı Bu aşamada 37,38 için gerekli değildir.
- PVDF transfer proteinlerinin (poliviniliden florür) membran soğuk transfer tamponu kullanılarak 100 V de soğuk bir odada 2.5 saat (1.74 U / cm2) için (gözenek boyutu 0.45 um) (5-10 ° C) (Tablo 1 e bakınız).
- Blok membranlar wi,% 10 (ağırlık / hacim), bir tezgah üstü orbital çalkalayıcı üzerinde 25 ° C'de 1 saat süre ile, PBS-T içinde kuru süt tozu, PBS içinde% 5 BSA birincil antikor ile bir gece boyunca 10 PBS-T ile dakika ve prob iki kez membranları yıkamak soğuk oda bir orbital çalkalayıcıda t.
- 25 ° C'de kısa bir süre fazla PBS-T ile ertesi sabah, yıkama membranlar bir kez 10 dakika orbital bir karıştırıcı üzerinde her biri (80 rpm) PBS-T ile 3 kez yıkanmasından sonra (kapak ve kap içerir) (Bütün yıkama adımları 25 gerçekleştirilir ºC).
- İkincil antikor ekleyin (yaban turpu peroksidaz (HRP) HIgM12 anti-insan anti-IgM antikoru () (seyreltme 1 ile konjüge edilmiş: bir orbital çalkalayıcı üzerinde 25 ° C'de 1 saat süreyle, PBS-T içinde% 5 kuru süt tozu 30.000) (70 rpm ).
- Yıkama zarların 25 ° C'de kısa bir süre fazla PBS-T ile bir kez 10 dakika orbital bir karıştırıcı üzerinde her biri (80 rpm) PBS-T ile 3 kez yıkanmasından sonra (kapak ve kap içerir) (Bütün yıkama adımları 25 ° C'de gerçekleştirilir) .
- soğutulmuş geliştirilmiş chemiluminescen 1 ml karıştırın25 ° C'de (mini blot başına) B bileşeni (Oksitleyici reaktif), 1 ml CE HRP substratı bileşen A (Luminol reaktifi).
- (Çok kenarlarında tutunuz) fazla sıvıyı çıkarmak için bir kağıt havlu üzerine membranlar aktarmak için plastik forseps kullanabilir. geri kaplara kağıt havlu ve koyun membran ile kuru konteynerler (her membranın için bir tane). Hemen, her membran önceden karıştırılmış zenginleştirilmiş kimyasal aydınlatma HRP alt-tabaka (bileşik A + B) (aşama 2.2.16.) 2 ml ilave edilir ve bir orbital çalkalayıcı (90 rpm) 25 ° C'de 2 dakika süreyle inkübe edin. Emin olun membranlar eşit kimyasal parıltı maddesi ile nemlendirilir.
- şeffaf plastik kovan içine aktarın membranlar ve kağıt havlu ile fazla sıvı ve hava kabarcıkları. Bir film kaseti plastik kovan içinde membranlar koyun ve sonunda kasete plastik kol bantlayın. Kaseti kapatın.
- Karanlık içine kaset, film zamanlayıcı ve makas alın. Her fi sağ üst köşesinde kestioryantasyon amaçlı lm, farklı zaman aralıklarında için (farklı) filmleri (10 sn, 1 dk, 10 dk) ortaya çıkarmak ve film geliştirici filmleri gelişir.
NCAM 39 ekinde PSA 3. Endoneuraminidase-NF Sindirim
- Tablo 2'de 39 de gösterildiği gibi, doğum sonrası gün (P) 7 ağırlık fareler ve P7 NCAM KO farelerden Özet lize beyin dokusu endoneuraminidase-NF (endo-NF) kullanılarak buz üzerinde 2 saat boyunca (adım 1.12 hazırlanabilir).
- Aşama 3,1 (Tablo 2) - Her bir boru (6 1), 4x Laemmli numune tampon maddesi 5 ul ekle.
- 4 yük örnekleri -% 20 gradyan SDS-poliakrilamid jel ve tekrar 2.2.19 için 2.2.10 adımları. PBS içinde% 5 BSA HIgM12 (1 ug / ml), ticari olarak temin edilebilen bir anti-PSA mAb (klon 2-2B) (1 ug / ml) ve β-aktin antikoru (yükleme kontrolü) (1 ug / ml) ile tarama sistemi membranları -T.
Rat ve Fare MSS Kültürler 4. hazırlanması
- Cam lameller hazırlanması
- Cam kap kullanılarak bir duman başlığı içinde, 16 saat - 4 - 60 ° C 50 1 M HCI asitle yıkama 25 mm'lik cam lamelleri. zaman Hafifçe girdapladıktan ile lamelleri çalkalayın.
- Yıkama cam yoğun damıtılmış su (3x) lamelleri. yığılmış lamelleri arasında asit yıkamak için emin olun.
- % 100 etanol içinde lamelleri durulayın ve bir hücre kültürü kaputu Parafilm onları kurutun. Bir gün kullanılmadan önce, bir fırın içinde 100 ° C 'de kapaklı bir cam kap içinde 24 saat için cam lamelleri ısıtın.
- 37 ° C 'de 1 saat süre ile, steril su içinde 40 ug / ml poli-D-lizin, 3 ml 6 oyuklu çanağı ve kat cam lameller koyun.
- Steril su ile iki kez yıkanır, hücre kültürü başlık altında tamamen kurumasını ve 20 dakika, UV ışığı uygulanır.
- CNS Hücreleri için Doku Kültürü Plastik Hazırlanması
- 3 ile kaplayın 60 mm hücre kültürü yemekleri ya da 75 cm 2 doku kültürü şişeleriml veya 10 ml olarak, 37 ° C 'de 1 saat süre ile, steril su içinde / ml poli-D-lizin 40 ug.
- Iki kez su ile yıkama, hücre kültürü başlık altında tamamen kurumasını ve 20 dakika, UV ışığı uygulanır.
- Sıçan karışık Glia İzolasyon 40
- IACUC CO 2 gaz kaynağı (tam otomatize) ile kemirgen ötenazi odasını onaylı yenidoğan sıçan anestezisi. Hayvanın yanıtsızlık belirlemek için ayak tutam yanıt yöntemini kullanın. (- Bir seferde 10 yavru 6) yenidoğan Sprague Dawley sıçan (P0P1) başını kesmek.
- Bir forseps ile göz yuvalarını kapma ve omurga içine küçük bir makas sokarak beyin çıkarın. kulak seviyesinde öne doğru kafatası kesti. Soyma geri kafatası ve yavaşça (Tablo 1 e bakınız), buz üzerinde buz soğukluğunda kesme ortamı 10 ml ile dolu bir 60 mm Petri kabı içine beyin yerleştirin.
- (- 10 yavrular 6) sıçan yavrular kalan için tekrarlayın. 4.3.7 - adımlar 4.3.2 için buz üzerinde doku tutun.
- İki beyin hemisfer içine orta hat boyunca beyni bölmek ve daha sonra koku ampuller, bazal serebral korteks altındaki ganglionlar ve Dumont forseps ile hipokampus kesti. Buz üzerinde orta diseksiyon içeren temiz bir Petri kabındaki izole serebral korteks yerleştirin.
- bir korteksi alın. Bir diseksiyon mikroskobu altında ince ipuçları ile forseps ile meninks çıkarın.
- Kalan korteks ile tekrarlayın. buz üzerinde bir temiz Petri kabı içine tüm zarları serbest korteks yerleştirin.
- 60 mm Petri kabındaki tüm yavruların kortikal hemisferlerin birleştirin ve parçaları kıyılmış 1 mm içine beyin dokusunun zar steril bir jilet kullanın.
- steril, kaplanmamış 500 mililitrelik bir cam kabın içine 10 ml pipet kullanılarak kıyılmış beyin dokusu aktarın ve sıçan beyin başına buz soğukluğunda kesme ortamı 10 ml. Sıçan beyin başına HBSS 9 ml HBSS (Hank dengeli tuz çözeltisi) (5 mg / ml tripsin) tripsin çözeltisinin 1 ml eklenirken yavaşça şişeyi girdap. 2 ekleDNaz I çözeltisi (1 mg / ml) ve MgSO 4 çözelti içinde toplam hacminin% 2 toplam hacminin% (HBSS% 3.82 MgSO 4 (a / h)), beyin dokusu süspansiyonuna yavaşça girdap.
- 37 ° C'de 30 dakika boyunca bir dönme çalkalayıcıda nazik çalkalama altında Trypsinize dokusudur. Emin doku parçaları bu adımı sırasında yüzen ve alt tortu yok olun. Gerekirse hızını dönen artırın.
- % 10 (h / h) nihai konsantrasyona kadar fetal sığır serumu (FBS) ilave edin ve 10 sn için şişeye 10 kez dönen karıştırılır. 15 dakika boyunca buzlu su içinde doku süspansiyonu soğutun. Girdap yavaşça beş kez her saniye min şişeyi.
- Yavaşça 200 x g'de, 4 ° C'de 5 dakika boyunca 25 ml, 50 mi pipetler ve santrifüj kullanılarak steril bir 50 ml tüp içine doku süspansiyonu aktarın.
- , 0.4 mi MgSO 4 çözeltisi Süpernatant atılır ve yavaşça 15 fetal sığır serumu, 5 ml ile takviye edilmiş buz soğukluğunda kesme ortamının ml dijeste CNS doku tekrar süspansiyon (% 3.82HBSS MgSO 4) olarak ve DNase I (1 mg / mi) 1.6 mi.
- iki steril 15 ml tüpler içinde eşit bölünmüş doku süspansiyonu (~ 10 mL) ekstrakte edildi ve yavaş yavaş süspansiyon, bulanık / sütlü hale gelene kadar, 10 ml bir pipet (10 kez) ile toz haline getirin. Bir sonraki tüp işlenirken buz üzerinde asılı hücreleri tutun. sindirilmiş MSS kalan tüpün dibine tortu dokular kadar 3 dakika bekleyin. Aktarım süpernatant pelet fraksiyonu bozmadan 50 ml tüp temizlemek için.
- İsteğe bağlı olarak, 40 mikron hücre süzgecinden bulanık süpernatantlar geçmek ve buz üzerinde steril 50 ml tüpler içine sonuçlanan tek bir hücre süspansiyonu birleştirir.
- 200 xg, 4 ° C'de 5 dakika boyunca hücre bulamaç Spin.
- orta diseksiyon ~ 2 ml hücre pelet üstünde kalana kadar yavaşça 10 ml pipet kullanarak süpernatant kaldırmak.
- 50 ml tüpler (~ 10 kat) hafifçe vurun hücre topakları. Yavaş yavaş ısınmaya büyüme ortamı 5 mL hücre süspansiyonu hafifçe (Tablo 1 e bakınız)El tüpü dönen.
- İsteğe bağlı olarak, görünür doku kümeleri ya da DNA kümeleri halinde açık DNaz I çözeltisi ve MgSO 4 solüsyonunun buz üzerinde bir 10 dakika daha DNaz adımı 4.3.12 tekrarlayın. Girdap tüp elle 5 kez her saniye dk.
- Levha 50,000 6 oyuklu tabakta 400 ul büyüme ortamında bir su birikintisi 25 mm cam lamel ortalama hücre ve hücreler, bir hücre kültürü inkübatöründe (% 5 CO2, 37 ° C) 'de 30 dakika süreyle tutunma sağlar.
- Konfluent (24 içinde - 48 kaplama sonrası saat) 60 mm hücre kültürü yemekleri ve 75 cm 2 doku kültürü şişeleri, plaka 500.000 hücreleri (60 mm çanak) ya da 2 milyon hücre (75 cm 2 şişeler).
- Yavaşça 2 ml ekleyin (göz başına 25 mm cam lamelleri 6-çukurlu tabak), 3 ml (60 mm tabaklar) ya da her bir sıcak büyüme ortamında 10 ml (75 cm 2 şişe) de. bir gecede inkübe hücreleri ve ertesi sabah orta tamamen değişir. Sonra orta her gün (vb 3. gün, günde 5 gün 7) değiştirin.
Yok hayırte: - 48 saat sonra kaplama Sıçan karışık glia kültürleri 24 immünsitokimya veya biyokimya için kullanıma hazırdır.
- Fare Karışık Glial Kültürleri
- 4.3.1 4.3.6 için bölümlerde açıklanan yenidoğan sıçan beyinlerinde diseksiyonu, C57 / BL6 arka plan ile P0 yenidoğan WT ve NCAM KO fareler başını kesmek beyinleri kaldırmak ve buz diseksiyon orta onları koymak için Özdeş (bakınız Tablo 1). her zaman buz üzerinde doku tutun.
- İki beyin hemisfer içine orta hat boyunca beyni bölmek ve daha sonra koku ampuller, bazal serebral korteks altındaki ganglionlar ve Dumont forseps ile hipokampus kesti. buz üzerinde HBSS içeren temiz bir Petri kabındaki izole serebral korteks yerleştirin.
- bir korteksi alın. Bir diseksiyon mikroskobu altında ince ipuçları ile forseps ile meninks çıkarın. Kalan korteks ile tekrarlayın. buz üzerinde bir temiz Petri kabı içine tüm zarları serbest korteks yerleştirin.
- kortikal hemisphe aktarınAyrı, steril 15 ml tüpler içinde her fareden 1 mi pipetle Res. Her beyne 1.2 ml buz gibi soğuk diseksiyon orta ekleyin ve mekanik kadar o 2 kez pipetleme ve 1 ml pipet kullanarak aşağı beyin dokusunu bozar.
- 150 ul papain çözeltisi (PBS içerisinde 10 mg / ml), 100 ul DNaz I çözeltisi (HBSS içindeki 1 mg / ml) ve her bir beyin için 50 ul MgSO 4 (HBSS% 3.82) ilave edin ve parmak hafifçe vurarak karıştırın.
- su banyosunda 37 ºC 'de 30 dakika boyunca beyin süspansiyonu inkübe ve beyin süspansiyonlar parmak Flicking tarafından her saniye dakika karıştırın. , Tüp başına FBS 1 ml ilave edilir karıştırın ve buz üzerinde 10 dakika boyunca doku süspansiyonu soğutmak.
- 200 xg, 4 ° C'de 4 dakika için beyin dokusu Spin ve MgSO DNaz I çözeltisinin 70 ul (1 mg / HBSS mi) ve 30 ul desteklenmiş buz soğukluğunda kesme tamponu 1 ml 4 çözeltisi, doku pelletini (HBSS 3.82%).
- Bir kullanarak beyin dokusuna çiğnemek FBS kaplı 1 ml pipet(~ 5 kez) yüzer bulanık hale gelinceye kadar. 40 mikron hücre süzgecinden süpernatant Pass ve buz üzerinde temiz bir tüp içine aktarın.
- 200 xg, 4 ° C'de 5 dakika boyunca santrifüj ile karıştırılır glial hücreler pelet. ortamın aspire yüzer 100 ul kadar ul hücre peleti üstüne bırakılır. Parmakla kaydırma (~ 5 kez) ve sıcak bir fare büyüme ortamı 1 ml ilave ile yeniden süspanse hücre topağı (Tablo 1 e bakınız).
- İsteğe bağlı olarak, görünür hücre kümeleri ve parçalanmış hücreleri çözülür / yavaşça aşağı hücre süspansiyonu yukarı ve (beş kez) pipetleme DNA çöktürülmüş.
- 4.3.21 - PDL-kaplı cam lamelleri ya da 60 mm yemekleri plaka fare karışık glial hücreler adımlarda 4.3.19 açıklandığı gibi. Sıcak fare büyüme ortamı ve daha sonra her gün ertesi sabah hücreleri yıkayın. kaplama 72 saat sonra - Fare karışık glia immünsitokimya 48 kullanıma hazırdır.
- Sıçan Mikroglia İzolasyon
- Kültür sıçan karışıkbüyüme ortamında 75 cm2 doku kültürü şişelerinde glia 10 gün boyunca (bakınız Tablo 1). 1 saat süre ile 140 rpm'de bir hücre kültürü inkübatöründe (% 5 CO2, 37 ° C) içinde döner bir karıştırıcı üzerinde karışık glial kültürlerden mikroglial hücre kümeleri devre çalkalayın.
- Karışık glia kültürlerinden mikroglia-ihtiva eden üst sıvıyı çıkarın 40 mikronluk bir hücre süzgecinden geçmek ve steril 50 ml tüpler içinde bir hücre süspansiyonu tutun.
Not: Mikroglial kültürler az kirletici OPC ve çok az astrositler ile bu aşamadan sonra tipik olarak>% 95 saf. - İsteğe bağlı olarak, gelecekte mikroglial sallamak-off için karışık glia kültürleri üzerinde büyüme orta yerine. Genellikle karışık glial kültürlerden (haftada) birden mikroglial sarsıntı-off gerçekleştirin.
- İsteğe bağlı olarak, saflık% 95 daha yüksek bir plaka, 100 mm Petri kaplarına göre mikroglia içeren süpernatan (aşama 4.5.2) 10 ml alma ve 37 ° C 'de, 30 dakika için bir hücre kültürü inkübatöründe inkübe edilmesi. Sadece microglastrositler ve OPC süpernatant kalırken ia, Petri eklenecektir.
- Yavaşça saat yönünde ve saat yönünün tersine hücre kültürü kaputu (beş kez her biri) Petri kapları sallayın. Aspire hücre kültürü ortamı tam ve büyüme ortamına, 10 ml ile değiştirin. Ortaya çıkan mikroglia kültürleri% 98 saf> vardır.
- DMEM içinde 7 gün boyunca kültür mikroglia% 1 FBS ve% 1 penisilin / streptomisin ile takviye edilmiştir.
- Sıçan OPC / oligodendrosit İzolasyon
- Zenginleştirilmiş OPC kültürleri 1 saat süre ile 140 rpm'de bir hücre kültürü inkübatöründe (% 5 CO2, 37 ° C) olan bir döner çalkalayıcı üzerinde 75 cm2 şişelerde büyüme 10 günlük karışık glial kültürlerden ilk mikroglial hücreleri sıyrılarak elde etmek için. mikroglia sadece içeren süpernatant atın veya mikroglia özel deneyler (adım 5.5) için kullanın.
- 10 ml büyüme ortamı ile mikrogliyal içeren süpernatant değiştirin ve karışık glial kültürlerin silkeleyin200 rpm'de (% 5 CO2, 37 ° C) bir dönme çalkalayıcıda 18 saat daha.
- Karışık glia kültürlerinden microglia- ve OPC içeren süpernatant toplayın ve 40 mikron hücre süzgecinden geçer. steril 50 ml tüplerde hücre süspansiyonu toplanır.
- İsteğe bağlı olarak, gelecekte OPC shake-off için karışık glia kültürleri üzerinde büyüme orta yerine.
Not: OPC düşük verim ile de olsa, astrositik besleyici katmanlar üzerinde çoğalmaya devam eder ve sarsılmış-off olabilir ikinci ve üçüncü kez (haftada). - Levha microglia- 100 mm Petri kaplarına süpernatan OPC ihtiva eden ve 37 ° C 'de 30 dakika boyunca hücre kültürü inkübatöründe inkübe 10 mi. OPC ve astrositler süpernatant kalırken mikroglia, Petri eklenecektir.
- Yavaşça saat yönünde ve saat yönünün tersine bir hücre kültürü kaputu (5 kez her) Petri kapları sallayın. Hücre kültürü inkübatör bir seferde sadece bir kaç Petri kapları çıkartın (mikroglia Pet itibaren yerinden oynatmamaya başlayacaksoğutucu ortamda iyice çalkalanır ri yemekler).
- Toplamak ve 50 ml'lik tüplere OPC-ihtiva eden üst sıvıyı birleştirir. İsteğe bağlı olarak, mikroglia özgü deneylerde kullanılmak üzere Petri tabaklarına kültür ortamı ilave edin.
- İsteğe bağlı olarak, daha da OPC preparatlarda mikroglia ölçüde düşürmek için taze Petri kapları ile bir kez adımları 5.6.5 ve 5.6.6 tekrar OPC kültürleri saflığını geliştirmek için.
- 250 xg, 4 ° C'de 5 dakika süreyle santrifüj zenginleştirilmiş OPC içeren süpernatant aşağı doğru döndürün. Yavaşça hücre pelletini bozmadan süpernatant aspire. pelet üzerine yüzer 3 ml boş ve parmakla kaydırma (10 kez) OPC yeniden süspanse başlar.
- (- 10 kez 5), 10 ml bir pipet kullanarak yavaşça çiğnemek OPC hücre kümeleri.
- Hücre sayımı ve 6 oyuklu tabakta 400 ul büyüme ortamında bir su birikintisi 25 mm cam lamel (PDL kaplı) başına 50.000 OPC plaka ve hücreler, bir hücre kültürü inkübatöründe 30 dakika süreyle tutunma sağlar (% 5 CO2, 376 ° C). Yavaşça her bir sıcak proliferasyon ortamında (bakınız Tablo 1) 2 ml ekleyin. proliferasyon ortam 3 ml 1.500.000 OPC - 60 mm'lik bir hücre kültür kaplarına, levha 1 PDL kaplanabilir.
- Dikkatle OPC kaplama sonrası taze çoğalması ortamı 3 saat ile çoğalma ortamı FBS içeren replace (düzgün takılı emin OPC olun ve orta değişimi sırasında yerinden etmeyin). Değişim orta ikinci günde.
Not: Sıçan OPC kültürleri, tipik olarak astrositler, ardından ana kirletici hücre tipi olarak mikroglia ile% 90 saf olan bu protokolü kullanılarak hazırlandı.
İlköğretim Glial Hücreler HIgM12 Kullanılması 5. İmmünositokimya
- HIgM12, anti-PSA mAb, ve Hücre tipi WT ve NCAM KO fareler ile İlköğretim Glial hücreler spesifik Belirteçler kullanarak Triple-etiket İmmünofloresan
- Canlı hücre koşullar altında, etiket% 60 birleşen fare PDL-kaplı yetiştirilen WT ve NCAM KO farelerden alınan glia kültürleri karışıkHIgM12 (10 ug / ml) ve PBS içinde bir anti-PSA mAb (klon 2-2B) (10 ug / ml) ile 25 mm'lik cam lamelleri, 30 dakika boyunca 4 ° C'de% 10 FBS ile takviye edilmiştir.
- buz soğukluğunda PBS ile her seferinde% 10 FBS ile takviye edilmiş 20 sn için hücreler üç kez yıkayın ve 25 ° C'de 15 dakika boyunca PBS içinde% 4 paraformaldehid, pH 7.4 ile sabitleyin.
- PBS ile her seferinde% 10 FBS ile takviye edilmiş 1 dakika boyunca sabit hücreler iki kez yıkayın ve 25 ° C'de 2 dakika boyunca PBS pH 7.4 içinde% 0.1 Triton-X100 ile hücrelerin geçirgenliği. Soğuk odada 4 ° C'de gece boyunca% 10 FBS ile desteklenmiş 1 dakika boyunca iki kez hücreleri yıkayın ve glial belirteçler GFAP (astrositler) veya PBS IBA-1 (mikroglia) (1 mcg / ml) ile etiketlemek.
- Orta 31 montaj DAPI içeren dahil standart immünfloresan koşulları ile devam edin.
Not: Kullanım floresan insan için ikincil antikor (HIgM12) ve fare (anti-PSA mAb, klon 2 - 2B) olarak fab 2 fragmanları etiketli IGMS şiddetle tavsiye edilir. - fl al60X ya 100X büyütmede uorescent ve görüntüler. aynı tüm görüntüleri ve süreç görüntüler için aynı cihaz ayarlarını kullanın.
- Birincil Antikor olarak HIgM12 kullanarak ENDO-NF-tedavi WT Glia Hücre İmmünofloresan Etiketleme
- Neurobasal A'da 3 gün için büyütülmüştür Kültür WT fare karışık glia PDL kaplı 25 mm'lik cam lameller üzerine,% 10 FBS ve B27 eki (1:50) ile takviye edilmiştir. 1 ml kültür ortamına endo-NF (30 ug / ml) ilave edilir ve bir hücre kültürü inkübatöründe gece inkübe (37 ° C,% 5 CO2).
- 5.1.1 5.1.5 adımlar açıklandığı gibi etiket hücreleri HIgM12 ve fiksasyon ve permeabilization sonra iç astrositik işaretleyici GFAP soğuk yaşıyor. 60X veya 100X büyütmede floresan görüntü almak. Tüm görüntüler için aynı enstrüman ayarları kullanın ve aynı süreç.
Sonuçlar
Bu bölüm, CNS'de insan IgM-spesifik PSA antijenler inceleyerek elde edilebilir sonuçlarının örneklerini göstermektedir. biyokimyasal ortamlarda ve floresan immünsitokimya spesifik VK hafif zincirleri içeren insan IgM antikorlarının kullanılması gösterilmektedir.
HIgM12 serebral beyin lizatları antijenine imüno ve Western lekeleri bir tespit maddesi (birincil antikor) gibi davranır. Ne izotop kontrol antikoru ne agaroz L boncuk aşağı çekme (Şekil 1) özgüllüğünü gösteren benzer bir antijen, immünopresipitasyon. VT ve NCAM KO farelerinden MSS lizatları kullanılarak Western blotlar PSA ihtiva eden NCAM (Şekil 2A) için HIgM12 bağlayıcı özgünlüğünü göstermektedir. Endo-NF kullanılarak WT farelerin merkezi sinir sistemi dokusu enzimatik sindirimi HIgM12 için spesifik bağlama epitopu (Şekil 2B olarak NCAM bağlı PSA tanımlar). Bu tarifnamede belirtilen yöntemi kullanarak, yüksek saflıkta IBA-1-pozitif fare mikroglial kültürleri (Şekil 3) elde edilir. Ticari olarak temin edilebilen anti-PSA antikoru (klon 2-2B) sabit hücre yüzeyi ya da iç PSA havuzları etiket ve floresan mikroskopisi ile IBA-1 pozitif mikroglial hücreler permeabilize değildir. HIgM12 saflaştırılmış sıçan mikroglia hücre yüzey antijenleri etiket yok mikroglia 16,41 PSA-NCAM hiçbir hücre yüzey ifadesi raporları önceden yayınlanmış literatürde, tutarlı. İlginç bir şekilde, özel organel (Şekil 3) ile sınırlı olmayan bir hücre içi bölgesi, sabit ve permeabilize mikroglia sonuçları, perinükleer örüntüsü HIgM12 markalama. Sonuçlar Golgi 41 seviyesinde mikroglia PSA SynCAM hedefleyen anti-PSA IgG antikoru (klon 735) 26, kullanılarak elde edilen ters düşer.
mikroglia aksine, HIgM12ve canlı hücre koşulları (Şekil 4) karşı oldukça Zenginleştirilmiş Sıçan OPC kültürlerinde A2B5 hedef hücre yüzey antijenleri. OPC kültürleri mikroglial hücreleri kirletici ~% 5 ihtiva eder. 5 GFAP-pozitif astrositler HIgM12 ve anti-PSA mAb (klon 2-2B) arasında bir hemen hemen aynı hücre yüzeyi boyama desen (Şekil 5A) göstermektedir Şekil. Endo-NF-sindirilmiş WT astrositlerin immünofloresan markalama HIgM12 astrositik PSA (Şekil 5B) varlığını gösterir kullanılarak kontrol ile muamele edilmiş WT astrositler tampon ile karşılaştırıldığında. In vivo olarak, PSA-pozitif astrositler mevcudiyeti, yine de teyit edilmesi gerekir.

Şekil 1:. HIgM12 bir HIgM12 kullanarak üç aylık farelerin toplam beyin lizattan imüno asyonlar Ajan "aşağı çekme", insan izotip kontrol HIGM gibi davranırSadece "aşağı çekme" ajan olarak 126 veya agaroz L boncuk. Ayrıştırılan proteinler HIgM12 karşı problanmış membranlı Western lekeleme ile çalıştırılmıştır. (- 73 kDa ~ 65) IGMS ağır zincir ilave olarak 200 kDa - HIgM12 kaplı boncuklar elüt proteinlerin molekül ağırlıkları 160 aralığında idi. Bu rakam J. modifiye edilmiş Neurochem. 15. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
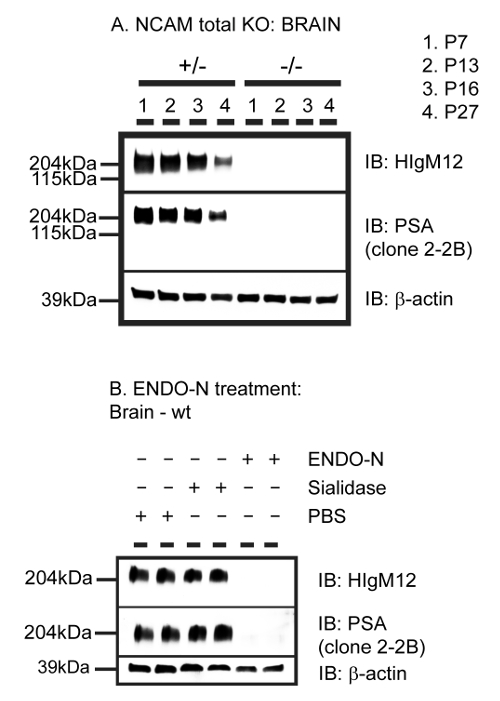
Şekil 2: HIgM12 Polysialic Asit (PSA) NCAM üzerinde Parçası Hedefler. P7, P13, P16 ve P27 NCAM A. Beyin homojenatlarında KO fareler ve heterozigot yavru kontrolleri HIgM12, PSA ve p-aktin yükleme kontrolü olarak karşı probed membran ile Western lekeleri çalıştırıldı toplam. B. 10 ug, pH 6.5 ile muamele edilmiştir endoneuraminidase N (endo-H) (ekzo) α2-3 polysialic asit polimeri özgüllük (siyalidaz) ile nöraminidaz veya PBS gece boyunca 37 ºC, Western lekeleme çiftli olarak çalıştırın ve yükleme kontrolü olarak HIgM12, PSA ve β-aktin karşı probed. Bu rakam J. modifiye edilmiş Neurochem. 15. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
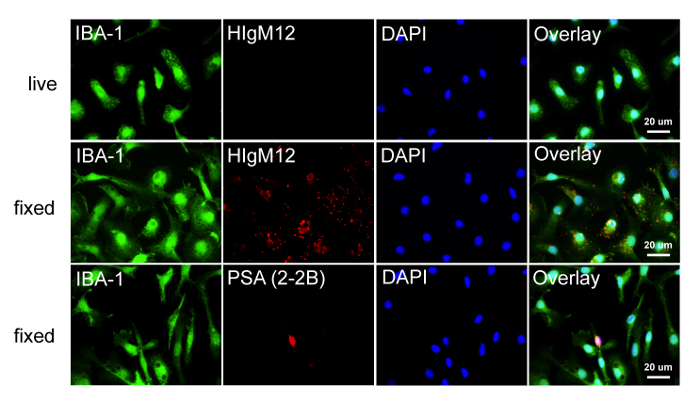
Şekil 3:. Sıçan mikroglia üzerinde PSA yokluğu Sıçan mikroglia poli-D-lizin kaplı cam lamelleri 48 saat süreyle kültüre edildi HIgM12 Etiketleme bir eksikliği ile Aynalı ve ya HIgM12 veya HIgM12 veya anti-ile tespit sonrasında buz üzerinde canlı olarak etiketlenmiş -PSA mAb (klon 2-2B). Hücreler, T idiRiple mikroglia işaretleyici IBA-1 (yeşil), HIgM12 / PSA (kırmızı) ve DAPI (mavi) ile etiketlenmiş. Görüntüler mikroglial hücre HIgM12 (üst sıra) kullanarak bağlama yüzeyi ve anti-PSA eksikliği primer sıçan mikroglia (alt satırdaki) hücre yüzeyinde ve iç mağazalara (klon 2-2B) bağlanma eksikliği göstermektedir. Bipolar morfolojisi ve IBA-1 boyanma olmaması dayanarak, küçük PSA-pozitif hücre (alt sıra) OPC olduğu öne sürüldü. Sabit hücrelerde, HIgM12 boyama özel organellere sınırlı değildi ve non-spesifik bağlayıcı (orta sıra) kabul edildi noktalı, perinükleer desen sonuçlandı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
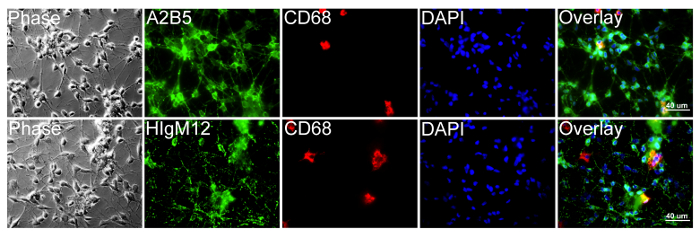
Şekil 4: HIgM12 Rat OPC Hücre Yüzey PSA-NCAM Hedefler Rat OPC ve mikroglia cultu vardı.HIgM12 ya A2B5 (yeşil), iç makrofaj / monosit işaretleme CD68 ile buz canlı etiketli poli-D-lisin kaplamalı cam lamel ve üç ile ilgili çoğalma ortamı içinde 4 gün boyunca, kırmızı (klon ED-1) (kırmızı) ve DAPI (mavi) . Görüntüler OPC işaretleyici A2B5 (üst sıra) ve birkaç CD68-pozitif mikroglia ile HIgM12 (alt sıra) (~% 5) için hücre popülasyonları majorly olumlu göstermektedir. Faz kontrast ve DAPI görüntüleri her nüfus için hücre bütünlüğü ve hücre sayıları ortaya çıkarmak için ilave edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 5: HIgM12 ve anti-PSA mAb Fare Karışık Glia bir Astrositik ICSI'nin ko-etiket. WT ve NCAM A. Fare karışık glial hücreler astrositler, oligodendrosit-soy hücreleri ve microg içeren KO hayvanlar toplamlia 3 gün kültürlendi ve HIgM12 (yeşil), anti-PSA mAb (klon 2-2B) (kırmızı) ve daha sonra astrositik markör GFAP (mor) ve DAPI (mavi) ile buz üzerinde canlı etiketli. HIgM12 ve anti-PSA GFAP-pozitif WT astrositler üzerinde sanal özdeş boyanma paterni ortaya ama NCAM KO farelerden elde kültürlü astrositler bağlama yoksundur. Bu rakam J. modifiye edilmiş A. altında açıklanan ve (nazik Dr Martina Muehlenhoff tarafından sağlanan) endoneuraminidase-NF veya PBS kontrolü ile gecede tedavi olarak Neurochem. 15. B. Karışık glia aynı kültüre edildi. Hücreler HIgM12 (yeşil) ve daha sonra, iç belirteçler GFAP (kırmızı) ve DAPI (mavi) boyanmış buz canlı etiketlenmiştir. HIgM12 PBS-kumanda üzerindeki hücre yüzey antijenleri karışık glial kültürlerin tedavi değil endoneuraminidase-NF karışık glia tedavi hedefliyor. Bu rakam JNSCI 16 modifiye edilmiştir. Plkolaylık, bu rakamın büyük halini görmek için buraya tıklayın.
Tüm resimler aynı enstrüman ayarları kullanılarak 60X büyütmede çekilen ve aynı işlendi.

Tablo 1:. Tampon ve Çözüm Tarifler Bu tabloyu indirmek için tıklayınız.
| CNS dokusu | Endo-UF / PBS | liziz tamponu | Toplam ses | |
| 1. WT fare | 67 ug (0.45 ul) | 2 ul (12 ug) endo-NF | 7.55 ul | 10 ul |
| 2. WT fare | 67 ug (0.45 ul) | 2 ul PBS | 7.55 ul | 10 ul |
| 3. WT fare | 67 ug (0.45 ul) | Resim PBS veya endo-NF | 9.55 ul | 10 ul |
| 4. NCAM KO fare | 67 ug (0.45 ul) | 2 ul (12 ug) endo-NF | 7.55 ul | 10 ul |
| 5. NCAM KO fare | 67 ug (0.45 ul) | 2 ul PBS | 7.55 ul | 10 ul |
| 6. NCAM KO fare | 67 ug (0.45 ul) | Resim PBS veya endo-NF | 9.55 ul | 10 ul |
Tablo 2: P7 WT ve NCAM KO farelerin MSS dokusunun ENDO-NF sindirim.
Tartışmalar
İnsan doğal IgM oto-antikorları imünoterapiler için adaylar çekicidir ve kanser ve merkezi sinir sistemi bozukluklarının 1-7 de dahil olmak üzere çeşitli hastalıkların tedavisi için terapötik bir potansiyel göstermiştir. Avantajlı bir şekilde, bu antikorlar, nötralize edici antikorların üretimi esas etkin terapötik dozu ve etkinliğini azaltır bir bağışıklık karşılığını ortaya olmaz. Önemli olarak, terapötik potansiyeli olan tüm antikorlar IgM izo türünün edilmiş ve NAb repertuar 3-5,8,9,37,40,42-45 ait olan. IgM antikorlarının potansiyel klinik uygulama için önemli bir engel, birçok durumda belirlenmiş değildir antigenleri, tanımlanmasıdır. IgG antikorları için kullanılan standart teknikler çoğu zaman bir IgM en antijeni belirlemek için geçerli değildir.
Bu protokol, hayvan modellerinde etkili rejeneratif insan IgM antikoru HIgM12 için antijen olarak PSA NCAM tanımlanmasını açıklarMS ve ALS 15-18. kullanılan yöntem ne olursa olsun, antikorun izotipi, VκI hafif zincirleri belirli bir VK hafif zincirlerin VκI, VκIII ve VκIV ve fare antikorları ile insan antikorları esas olarak uygulanabilir.
Bu protokolde en önemli nokta, afinite kromatografisi uygulamalarında IgM antikorlarının kullanılmasıdır. Daha özel olarak ise, başarılı bir antikorları izole etmek için veya karmaşık doku ya da hücre kültürü lizatlarının üzerinden bir antijen ettirecek İmmüno açılan maddeler olarak hareket etmeleri gerekmektedir. Zenginleştirilmiş antijen parçacıkları izotip kontrol antikorları arasında İmmüno göre ve ardından kütle spektrometrisi ile farklılıkların analiz edilebilir. Bir temel gereksinim ya da bu aşama sınırlama proteini L agaroza antikor bağlanmasını sağlamak için doğru bir antikor VK hafif zincir ve ana bilgisayar (insan, fare) varlığıdır. agaroza bağlanmış manan bağlayıcı proteinin kullanımı (aynı zamanda called yerine protein L agaroz) lektin mannoz bağlayan özel VK hafif zincirleri olmadan IGMS immünopresipitasyon için potansiyel bir alternatiftir. Arnold et al., 35 tarafından belirtildiği gibi, ancak, antijene bağlı IgM antikorları IgM kendi antijenine bağlandığı sonra, hedef glıkan erişilemez hale görünen ve manan-bağlayıcı proteine bağlanmazlar. Bu bulgulara dayalı olarak manan-bağlayıcı protein antijen yüklü IgM 35 molekülleri immünopresipitasyon bir bağlayıcı matris olarak kullanılamaz. Diğer potansiyel alternatifler ikincil agaroz bağlı anti-IgM IgG antikorları 46,47 veya yüzey aktif manyetik boncuk 48 kullanım kullanımı olabilir. IGMS karşı IgG antikorları ilgili antijen ile elute edilen antikor ölçüde azaltmak için A veya agaroz G agaroz kimyasal olarak çapraz bağlanmış olabilir. başarılı bir şekilde tespit antijenleri ile bağlantılı olarak IgM immüno farklı varyantları arasında uygun bir karşılaştırma IEn asyonlar izole ya da antijenleri daha fazla ilgi olmadan IGMS tüketmek için yapıldı çünkü zor. Buna ek olarak, IGMS kullanılarak imüno esas olarak saflaştırılmış antijenleri 49 antikor maruz önceden bilinen etkileri tek bir antijen teyit etmek için kullanıldı. Başlangıç malzemesi 50 ile karşılaştırıldığında çökeltilir IgM moleküllerinin - (% 15 10), insan IGMS karşı agaroz çiftli IgG'lerin bir dezavantajı çok düşük bir verim elde edilmiştir. Bunun aksine, yüzey aktif manyetik boncuk başarılı skrapi ile ilişkili fibriller 48 immünopresipitasyon IgM dahil olmak üzere farklı izotiplerin antikorlarının uygulanmıştır. Bu yöntem, özel bir kappa (VK) veya lambda (λ) zincir ya da belirli bir ana bilgisayar ile sınırlı değildir ve büyük ölçüde İmmüno kullanılan IgM antikorlarının daha geniş bir spektrumda olabilir.
protokol önemli bir adım, bir det olarak işlev antikorun yeteneğiWestern blotlar ya da başka bir tarama platformlarında antikor (birinci antikor) ecting. Başarılı antikorlar, antijen iyonik olmayan bir ya da muhtemelen iyonik deterjanlar varlığında bağlanma sağlamak için yeterli derecede yüksek afiniteye sahip, antijen hedeflemelidir. Yüksek afinite antikorları afinite olgunlaşmış IgG antikorları arasında yaygın, ama nispeten biyokimyasal ayarlarında ajanları tespit olduğunca az piyasada mevcut IgM antikorları vardır nedenlerinden biri olan IgM izo, antikorların arasında daha az yaygındır. antikorların yüksek bağlanma eğilimi moleküler antijenlerin İmmüno ve Western lekeleme için bir gerekliliktir. Deterjan konsantrasyonlarını veya IP tamponlar ve lizis tampon deterjanların yokluğu düşürücü, Fab alanı üzerinden, düşük afiniteli antikorlar ile hedef antijen sağlar. Bunun aksine olarak, Fc kısmına ile Protein L agaroz hedef antikorun kabiliyeti önemli ölçüde farklı deterjan konsantre ve aralığında izotip kontrolleri arasında etkilenmezyerel yönetim bu. Bununla birlikte, liziz tamponu ve IP tampon maddesi içinde düşük bir deterjan konsantrasyonu hücre membran bozulması ve spesifik moleküllerin izole önler. Benzer bir şekilde, Western Blot yıkama tampon içinde düşük bir deterjan konsantrasyonu (örneğin, PBS-T) düşük afiniteli antikorların antijen bağlama sağlar ama aynı zamanda spesifik olmayan bağlanma artar ve bu nedenle bir seçenek değildir.
bir antijen proteini çekirdek varlığı bu yöntem için bir gerekliliktir. Posttranslasyonel modifikasyonlar (örneğin, glikoproteinler, lipoproteinler) ve değişikliğe uğratılmamış protein, ancak tek başına lipitler veya karbonhidrat sahip proteinler, Western blotlar da tespit edilebilir. Deterjan varlığında veya yokluğunda, doku ya da hücre lisatlanndan lipidler (örneğin, sfingolipitler) immünopresipitasyon mümkün değildir. Aynı zamanda deterjanlar bozmak için gerekli olan süre deterjanlar ve lipid fiziko-kimyasal özellikleri, seçici bir lipit-antikor etkileşimi sağlamak için çok benzerdiriçin membranlar spesifik moleküllerin seçici izolasyon sağlamak için. bir protein çekirdeğinin olmaması bizim en iyi bilgi, sadece karbonhidrat oluşan İmmüno, için, daha önce rapor edilmemiştir. IgM antikorları sıklıkla mutlaka bir protein birimine bağlantılı değildir karbonhidrat ve glikolipitler, hedef, çünkü bu özellikle ilgili olur. Diğer kromatografik teknikler, bir protein çekirdek yokluğunda, lipidler ve karbohidratlar ayrılması ve immünolojik tespiti için gereklidir. Örneğin, TLC plakası (immüno-TLC) ile daha sonra bir antikor tespiti hücresel lipidlerin ince tabaka kromatografisi (TLC), 51,52 uygulanabilir.
Diğer anti-PSA antikorlar ticari olarak temin edilebilen bir anti-PSA IgM gibi HIgM12 kıyasla daha önceki çalışmalar ve sonuç olarak tarif edilmiştir (klon 2-2B). PSA alanında en çok kullanılan antikor fare monoc olarak mevcut bir IgG antikoru (klon 735) olanlonal veya tavşan poliklonal antikoru 53. Bu anti-PSA IgG antikor mikroglial hücreleri 41 dahil olmak üzere farklı MSS hücre tipleri üzerinde SynCAM ve NCAM üzerinde PSA algılar. Anti-PSA IgG antikoru tersine, insan IgM antikorları HIgM12, HIgM42 ve anti-PSA fare IgM (klon 2-2B) farelerinde çeşitli embriyonik ve erken doğum sonrası aşamada SynCAM PSA hedef yapamaz (ancak NCAM üzerine) olarak 15, non-polisialilatlanmış SynCAM ise kolayca saptanabilir. Kullanılan IgM antikorları da mikroglial hücreleri (Şekil 3 + 4) üzerine PSA tespit etmek mümkün değildir. izotiplerle arasında gözlemlenen farkların için olası bir açıklama, anti-PSA IgG'ye IgM antikorlarının bağlanması potansiyel olarak daha düşük bir afinite ile birlikte, PSA-NCAM seviyelerine göre düşük PSA SynCAM seviyeleri olabilir. Bu hipotezi test etmek için, 15. E17 WT yavru içinde HIgM12 akıtılan antijenler kullanılarak sonraki Western blot dansitometri tarafından tespit edilen IGMS ağır zincir ile karşılaştırıldığında PSA-NCAM "aşağı çekti" benzer şiddetleri gösterdi bir ölçüde PSA-NCAM immunoprecipitated kontrolleri. Bu sonuç, hedef PSA HIgM12 en azından yeterli bir yakınlık önerdi. WT yavru aksine HIgM12 NCAM KO hayvanlarda SynCAM bağlı PSA tespit etmedi kontrol eder. Aynı sonuçlar, insan anti-PSA IgM HIgM42 kullanılarak İmmüno elde edilmiştir. HIgM12 ve HIgM42, hem de fare anti-PSA IgM (klon 2-2B) embriyonik ve doğum sonrası gelişim aşamalarında VT ve NCAM KO hayvanlardan Western lekeleme SynCAM PSA hedef yapamaz. Düşük afiniteleri yalnız olası görünmektedir özellikle 15 CNS doku (oyuk başına 0.1 ug CNS dokusu) küçük miktarlarda kullanılarak Western lekeleme ile NCAM bağlı PSA tespit etmek için gerekli olan HIgM12 düşük bir miktar (0.1 ug / ml) verilenÜç farklı yöntemler HIgM12 PSA-SynCAM algılama tam olmaması sorumludur.
Anti-PSA IgM antikorları ve sık sık yayınlanan anti-PSA IgG antikoru (klon 735) arasında önemli farklılıklar vardır sonucuna vardık. piyasada mevcut anti-PSA IgM antikorları HIgM12 zaten farklı hastalık modellerinde etkinliğini kanıtlamıştır çünkü bu özellikle ilginçtir antiPSA IgG antikoru 735 ile elde edilen sonuçları doğrulamak için geçmişte daha sık kullanılan değildi neden belli değildir. diğer anti-PSA IgM antikorları benzer terapötik etkilere sahip olabilir iken, anti-PSA IgG antikoru (klon 735) MS ve ALS modellerinde benzer terapötik sonucu olup olmadığını belirsizliğini koruyor.
Kısaca, burada açıklanan yöntemler, MS için potansiyel klinik denemeler ve muhtemelen diğer nörodejeneratif hastalıklar desteklemek için rejeneratif insan antikoru HIgM12 antijeni belirlemek için temel olarak kullanılmıştır. karınca tanımlanmasıbiyolojik aktivite ile antikorlar için igens etki mekanizmalarını anlamak için önemli bir adımdır. Bu, şu anda insan denemelerinde güvenlik ve etkinlik için test edilen pek çok monoklonal antikorlar bağlamında özellikle uygun olur. Bugüne kadar klinik olarak test IgM antikorlarının sayısı küçük olsa da, bu antikor 1-10,37,40,42-45 terapötik potansiyelini vurgulayan çalışmalar artan sayısı ile birlikte hibridom teknolojisindeki son gelişmeler, yeni ve gelişmesini çağrısı protein-olmayan IgM antijenlerin belirlenmesi için değiştirilmiş yöntemler uygulanabilir.
Açıklamalar
Patents for antibodies that promote remyelination and CNS repair are issued and owned by Mayo Clinic. Authors have a potential conflict of interest.
Teşekkürler
Bu çalışma Sağlık (R01 GM092993, R01 ve R21 NS048357 NS073684) National Institutes of hibe ile desteklenmiştir, Ulusal Bilim Vakfı (KARİYER Ödülü), Biyoteknoloji Minnesota Ortaklığı Ödülü ve Tıbbi Genomik, Ulusal Multipl Skleroz Derneği (CA1060A) ve klinik ve Translational Bilim Mayo Clinic Merkezi (CCaTS). Yazarlar Applebaum, Hilton, Peterson ve Sanford Vakıflar, Ay ve Marilyn Parkı Müdürlüğü Fonu ve McNeilus ailesinden destek için minnettarım.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Fisher Scientific | MT-10-013-CVRF | HIGH GLUCOSE, with glutamine, with sodium pyruvate, 500 ml |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | 500 ml, L-glutamine, sodium pyruvate, high glucose |
| Penicillin-Streptomycin | Life Technologies | 15140-122 | 10,000 U/mL, 100 ml |
| N-2 Supplement (100X) | Life Technologies | 17502-048 | 5 ml |
| B-27 Supplement (50X) | Life Technologies | 17504-044 | serum free, 10 ml |
| Fetal Bovine Serum - Optima | Atlanta Biologicals | S12450 | 500 ml |
| STERILE WATER FOR IRRIGATION | Baxter Healthcare | #2F7114 | USP-1000 ml, 12/CA |
| Poly-D-lysine hydrobromide | Sigma | P7886-50MG | D-Lys-(D-Lys)n-D-Lys · xHBr, Molecular Weight 30,000-70,000 g/mol, 50 mg |
| bovine serum albumin fraction V | Sigma | A-3294-100G | heat shock fraction, protease free, pH 7, purity 98%, 100 g |
| D-(+)-Glucose | Sigma | G5767-500G | C6H12O6, Molecular Weight: 180.16 g/mol, ACS reagent, 500 g |
| Trypsin from bovine pancreas | Sigma | T9935-100mg | essentially salt-free, lyophilized powder, =9,000 BAEE units/mg protein, |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025-150KU | Type IV, lyophilized powder, =2,000 Kunitz units/mg protein |
| Recombinant Rat FGF basic Protein | R&D systems | 3339-FB-025 | BSA as a carrier protein, 25 ug, lyophilized, >95%, 16.2 kDa |
| Recombinant Rat PDGF-AA Protein | R&D systems | 1055-AA-50 | carrier free, 50 ug, lypphilized, >97%, E.coli-derived, 12.5 kDa |
| Neurobasal-A | Life Technologies | 10888-022 | 500 ml, No Glutamine, No Aspartic Acid, No Glutamic Acid |
| Paraformaldehyde | Sigma | P6148-1KG | crystalline, 1 kg, reagent grade, Molecular Weight 30.03 g/mol (as monomer) |
| Tris[hydroxymethyl]aminomethane (Tris bas | Biorad | #1610719 | 1 kg, 99.8% pure, powder |
| Sodium Dodecyl Sulfate (SDS) | Biorad | #1610302 | 1 kg, powder |
| Glycine | Fisher Scientific | BP-381-5 | C2H5NO2, Molecular weight: 75.07 g/mol, White crystalline Powder, 5 kg |
| Sodium chloride | Sigma | S7653-5KG | NaCl, Molecular Weight: 58.44 g/mol, 5 kg |
| Sodium phosphate monobasic | Sigma | S0751-500G | NaH2PO4, Molecular Weight: 119.98 g/mol, 500 g |
| Phosphate-buffered Solution 1X (PBS) | Cellgro | MT-21-040-CV | Without Calcium and Magnesium, 6 x 500 ml |
| Falcon 60mm TC-Treated Cell Culture Dish | Corning Life Sciences | #353002 | 60 mm Cell Culture Dish, TC-treated polystyrene, 20/pack, sterile |
| Falcon 60 mm x 15 mm Petri dish | Corning Life Sciences | #351007 | Not TC-Treated Bacteriological Petri Dish, 20/Pack |
| 6 well cell culture plates | Corning Costar | CLS3516 | 6 well, flat bottom (Individually wrapped), gamma-irradiated, growth area 9.5 c |
| 75cm² tissue culture flask | Corning Life Sciences | 430720U | 75cm² U-Shaped Canted Neck Cell Culture Flask with Plug Seal Cap |
| Pierce™ Protein L Plus Agarose | ThermoFisher Scientific | #20520 | 2 ml, crosslinked 6% beaded agarose (CL-6B), binding capacity: 10 to 20 mg IgG |
| 4-20% Mini-PROTEAN TGX Precast Gel | Biorad | 456-1094 | 10-well, 50 µl, for use with Mini-PROTEAN electrophoresis cells |
| Immobilon-P Membrane | Millipore | IPVH00010 | PVDF, 0.45 µm, 26.5 cm x 3.75 m roll |
| Anti-Polysialic Acid-NCAM Antibody, clone | Millipore | MAB5324 | 50 microliters, Host: mouse, monoclonal IgM |
| XT sample buffer (Western blot) | Biorad | #1610791 | 10 ml, 4 x premixed protein sample buffer |
| 2-mercaptoethanol | Biorad | #1610710 | 25 ml, 98 % pure, 14.2 M |
| Endoneuraminidase-N (Endo-N) | ABC Scientific | ABC0020 | 50 microliters, 200 µg/ml, 3500 U/mg |
| 25 mm glass coverslips | Fisher Scientific | 12-545-102 | Circles No. 1; Thickness: 0.13 to 0.17mm; Size: 25mm |
| HEPES buffer solution | ThermoFisher Scientific | 15630-080 | 100 ml, 1M |
| Hanks' Balanced Salt Solution 1X (HBSS) | Cellgro | MT-21-022-CV | 500 ml, without Calcium, Magnesium, Phenol Red |
| Papain | Worthington Biochemical Cooperation | LS003119 | lyophilized powder, 100 mg |
| Magnesiumsulfate | Sigma | M-2643-500G | powder, 500 g |
| L-Glutamine | Gibco | #25030-081 | 100 ml, 200 mM |
Referanslar
- Asakura, K., Miller, D. J., Pease, L. R. Targeting of IgMkappa antibodies to oligodendrocytes promotes CNS remyelination. J Neurosci. 18 (19), 7700-7708 (1998).
- Bieber, A. J., Warrington, A., Asakura, K. Human antibodies accelerate the rate of remyelination following lysolecithin-induced demyelination in mice. Glia. 37 (3), 241-249 (2002).
- Vollmers, H. P., Brandlein, S. Natural antibodies and cancer. J Autoimmun. 29 (4), 295-302 (2007).
- Vollmers, H. P., Brandlein, S. Natural antibodies and cancer. N Biotechnol. 25 (5), 294-298 (2009).
- Vollmers, P. H., Brandlein, S. Natural monoclonal antibodies and cancer. Recent Pat Anticancer Drug Discov. 3 (2), 84-87 (2008).
- Warrington, A. E., Asakura, K., Bieber, A. J. Human monoclonal antibodies reactive to oligodendrocytes promote remyelination in a model of multiple sclerosis. Proc Natl Acad Sci. 97 (12), 6820-6825 (2000).
- Warrington, A. E., Bieber, A. J., Ciric, B. A recombinant human IgM promotes myelin repair after a single, very low dose. J Neurosci Res. 85 (5), 967-976 (2007).
- Brandlein, S., Pohle, T., Ruoff, N. Natural IgM antibodies and immunosurveillance mechanisms against epithelial cancer cells in humans. Cancer Res. 63 (22), 7995-8005 (2003).
- Pohle, T., Brandlein, S., Ruoff, N. Lipoptosis: tumor-specific cell death by antibody-induced intracellular lipid accumulation. Cancer Res. 64 (11), 3900-3906 (2004).
- Miller, D. J., Sanborn, K. S., Katzmann, J. A. Monoclonal autoantibodies promote central nervous system repair in an animal model of multiple sclerosis. J Neuro. 14 (10), 6230-6238 (1994).
- Warrington, A. E., Bieber, A. J., Van Keulen, V. Neuron-binding human monoclonal antibodies support central nervous system neurite extension. J Neuropathol Exp Neurol. 63 (5), 461-473 (2004).
- Xu, X., Warrington, A. E., Wright, B. R. A human IgM signals axon outgrowth: coupling lipid raft to microtubules. J Neurochem. 119 (1), 100-112 (2011).
- Xu, X., Wittenberg, N. J., Jordan, L. R. A patterned recombinant human IgM guides neurite outgrowth of CNS neurons. Sci Rep. 3, 2267 (2013).
- Watzlawik, J. O., Kahoud, R. J., Ng, S. Polysialic acid as an antigen for monoclonal antibody HIgM12 to treat multiple sclerosis and other neurodegenerative disorders. J Neurochem. 134 (5), 865-878 (2015).
- Watzlawik, J. O., Painter, M. M., Wootla, B. A human anti-polysialic acid antibody as a potential treatment to improve function in multiple sclerosis patients. J Nat Sci. 1 (8), (2015).
- Xu, X., Denic, A., Jordan, L. R. A natural human IgM that binds to gangliosides is therapeutic in murine models of amyotrophic lateral sclerosis. Dis Model Mech. 8 (8), 831-842 (2015).
- Denic, A., Macura, S. I., Warrington, A. E. A single dose of neuron-binding human monoclonal antibody improves spontaneous activity in a murine model of demyelination. PLoS One. 6 (10), e26001 (2011).
- Lanier, L. L., Chang, C., Azuma, M. Molecular and functional analysis of human natural killer cell-associated neural cell adhesion molecule (N-CAM/CD56). J Immunol. 146 (12), 4421-4426 (1991).
- Moore, S. E., Thompson, J., Kirkness, V. Skeletal muscle neural cell adhesion molecule (N-CAM): changes in protein and mRNA species during myogenesis of muscle cell lines. J Cell Biol. 105 (3), 1377-1386 (1987).
- Pollerberg, E. G., Sadoul, R., Goridis, C. Selective expression of the 180-kD component of the neural cell adhesion molecule N-CAM during development. J Cell Biol. 101 (5 Pt 1), 1921-1929 (1985).
- Seilheimer, B., Persohn, E., Schachner, M. Neural cell adhesion molecule expression is regulated by Schwann cell-neuron interactions in culture. J Cell Biol. 108 (5), 1909-1915 (1989).
- Trotter, J., Bitter-Suermann, D., Schachner, M. Differentiation-regulated loss of the polysialylated embryonic form and expression of the different polypeptides of the neural cell adhesion molecule by cultured oligodendrocytes and myelin. J Neuro Res. 22 (4), 369-383 (1989).
- Yazaki, T., Asou, H., Arimoto, K. Decrease of NCAM expression and astrocyte-neurone interaction in long-term cultured astrocytes. Neuroreport. 6 (8), 1085-1088 (1995).
- Zuber, C., Lackie, P. M., Catterall, W. A. Polysialic acid is associated with sodium channels and the neural cell adhesion molecule N-CAM in adult rat brain. J Biol Chem. 267 (14), 9965-9971 (1992).
- Galuska, S. P., Rollenhagen, M., Kaup, M. Synaptic cell adhesion molecule SynCAM 1 is a target for polysialylation in postnatal mouse brain. Proc Natl Acad Sci. 107 (22), 10250-10255 (2010).
- Curreli, S., Arany, Z., Gerardy-Schahn, R. Polysialylated neuropilin-2 is expressed on the surface of human dendritic cells and modulates dendritic cell-T lymphocyte interactions. J Biol Chem. 282 (42), 30346-30356 (2007).
- Rollenhagen, M., Buettner, F. F., Reismann, M. Polysialic acid on neuropilin-2 is exclusively synthesized by the polysialyltransferase ST8SiaIV and attached to mucin-type o-glycans located between the b2 and c domain. J Biol Chem. 288 (32), 22880-22892 (2013).
- Schnaar, R. L., Gerardy-Schahn, R., Hildebrandt, H. Sialic acids in the brain: gangliosides and polysialic acid in nervous system development, stability, disease, and regeneration. Physiol Rev. 94 (2), 461-518 (2014).
- Abe, M., Goto, T., Kosaka, M. Differences in kappa to lambda (kappa:lambda) ratios of serum and urinary free light chains. Clin Exp Immunol. 111 (2), 457-462 (1998).
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Cremer, H., Lange, R., Christoph, A. Inactivation of the N-CAM gene in mice results in size reduction of the olfactory bulb and deficits in spatial learning. Nature. 367 (6462), 455-459 (1994).
- Polo-Parada, L., Bose, C. M., Plattner, F. Distinct roles of different neural cell adhesion molecule (NCAM) isoforms in synaptic maturation revealed by analysis of NCAM 180 kDa isoform-deficient mice. J Neurosci. 24 (8), 1852-1864 (2004).
- Tomasiewicz, H., Ono, K., Yee, D. Genetic deletion of a neural cell adhesion molecule variant (N-CAM-180) produces distinct defects in the central nervous system. Neuron. 11 (6), 1163-1174 (1993).
- Arnold, J. N., Wormald, M. R., Suter, D. M. Human serum IgM glycosylation: identification of glycoforms that can bind to mannan-binding lectin. J Biol Chem. 280 (32), 29080-29087 (2005).
- Bjorck, L., Protein, L. A novel bacterial cell wall protein with affinity for Ig L chains. J Immunol. 140 (4), 1194-1197 (1988).
- Vollmers, H. P., Dammrich, J., Hensel, F. Differential expression of apoptosis receptors on diffuse and intestinal type stomach carcinoma. Cancer. 79 (3), 433-440 (1997).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci. 76 (9), 4350-4354 (1979).
- Stummeyer, K., Dickmanns, A., Muhlenhoff, M. Crystal structure of the polysialic acid-degrading endosialidase of bacteriophage K1F. Nat. Struct. Mol. Biol. 12 (1), 90-96 (2005).
- Vollmers, H. P., Dammrich, J., Ribbert, H. Apoptosis of stomach carcinoma cells induced by a human monoclonal antibody. Cancer. 76 (4), 550-558 (1995).
- Werneburg, S., Muhlenhoff, M., Stangel, M. Polysialic acid on SynCAM 1 in NG2 cells and on neuropilin-2 in microglia is confined to intracellular pools that are rapidly depleted upon stimulation. Glia. 63 (7), 1240-1255 (2015).
- Brandlein, S., Rauschert, N., Rasche, L. The human IgM antibody SAM-6 induces tumor-specific apoptosis with oxidized low-density lipoprotein. Mol Cancer Ther. 6 (1), 326-333 (2007).
- Vollmers, H. P., Hensel, F., Hermann, R. Tumor-specific apoptosis induced by the human monoclonal antibody SC-1: a new therapeutical approach for stomach cancer. Oncol Rep. 5 (1), 35-40 (1998).
- Vollmers, H. P., O'Connor, R., Muller, J. SC-1, a functional human monoclonal antibody against autologous stomach carcinoma cells. Cancer Res. 49 (9), 2471-2476 (1989).
- Vollmers, H. P., Zimmermann, U., Krenn, V. Adjuvant therapy for gastric adenocarcinoma with the apoptosis-inducing human monoclonal antibody SC-1: first clinical and histopathological results. Oncol Rep. 5 (3), 549-552 (1998).
- Nakano, K., Yasuda, K., Shibuya, H. ANNALS EXPRESS: Transient human anti-mouse antibody generated with immune enhancement in a carbohydrate antigen 19-9 immunoassay after surgical resection of recurrent cancer. Ann Clin Biochem. , (2016).
- Pettingill, P., Kramer, H. B., Coebergh, J. A. Antibodies to GABAA receptor alpha1 and gamma2 subunits: clinical and serologic characterization. Neurology. 84 (12), 1233-1241 (2015).
- Morel, N., Simon, S., Frobert, Y. Selective and efficient immunoprecipitation of the disease-associated form of the prion protein can be mediated by nonspecific interactions between monoclonal antibodies and scrapie-associated fibrils. J Biol Chem. 279 (29), 30143-30149 (2004).
- Lobo, P. I., Schlegal, K. H., Vengal, J. Naturally occurring IgM anti-leukocyte autoantibodies inhibit T-cell activation and chemotaxis. J Clin Immunol. 30, S31-S36 (2010).
- Lobo, P. I., Schlegel, K. H., Spencer, C. E. Naturally occurring IgM anti-leukocyte autoantibodies (IgM-ALA) inhibit T cell activation and chemotaxis. J Immunol. 180 (3), 1780-1791 (2008).
- Wikstrand, C. J., Fredman, P., Svennerholm, L. Detection of glioma-associated gangliosides GM2, GD2, GD3, 3'-isoLM1 3',6'-isoLD1 in central nervous system tumors in vitro and in vivo using epitope-defined monoclonal antibodies. Prog Brain Res. 101, 213-223 (1994).
- Hamilton, W. B., Helling, F., Lloyd, K. O. Ganglioside expression on human malignant melanoma assessed by quantitative immune thin-layer chromatography. Int J Cancer. 53 (4), 566-573 (1993).
- Galuska, S. P., Oltmann-Norden, I., Geyer, H. Polysialic acid profiles of mice expressing variant allelic combinations of the polysialyltransferases ST8SiaII and ST8SiaIV. J Biol Chem. 281 (42), 31605-31615 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır