Method Article
Anticuerpo especificidad de unión de Kappa (VK) Humanos (IgM) de luz que contiene la cadena-: Ácido polisiálico (PSA) unido a NCAM como un estudio de caso
En este artículo
Resumen
We present a protocol to identify protein moieties containing antigens for human and mouse IgM antibodies with specific kappa (Vκ) light chains. This protocol is not limited to IgM class antibodies but applies to all immunoglobulin isotypes that target their antigen with sufficiently high affinity during immunoprecipitations.
Resumen
Antibodies of the IgM isotype are often neglected as potential therapeutics in human trials, animal models of human diseases as well as detecting agents in standard laboratory techniques. In contrast, several human IgMs demonstrated proof of efficacy in cancer models and models of CNS disorders including multiple sclerosis (MS) and amyotrophic lateral sclerosis (ALS). Reasons for their lack of consideration include difficulties to express, purify and stabilize IgM antibodies, challenge to identify (non-protein) antigens, low affinity binding and fundamental knowledge gaps in carbohydrate and lipid research.
This manuscript uses HIgM12 as an example to provide a detailed protocol to detect antigens by Western blotting, immunoprecipitations and immunocytochemistry. HIgM12 targets polysialic acid (PSA) attached to the neural cell adhesion molecule (NCAM). Early postnatal mouse brain tissue from wild type (WT) and NCAM knockout (KO) mice lacking the three major central nervous system (CNS) splice variants NCAM180, 140 and 120 was used to evaluate the importance of NCAM for binding to HIgM12. Further enzymatic digestion of CNS tissue and cultured CNS cells using endoneuraminidases led us to identify PSA as the specific binding epitope for HIgM12.
Introducción
Los anticuerpos del isotipo IgM demuestran gran potencial terapéutico para el tratamiento de diversas enfermedades incluyendo el cáncer y trastornos del SNC 1-7. El grupo Vollmers 'identificado numerosos anticuerpos en pacientes con cáncer para su uso potencial como biomarcadores específicos de tumores o agentes terapéuticos activos que son capaces de matar a las células malignas mediante la inducción de vías de apoptosis 4,8,9. Curiosamente, todos los anticuerpos identificados con potencial terapéutico son del isotipo IgM y pertenecen al grupo de "autoanticuerpos naturales" (BSA).
Del mismo modo, el grupo de los Rodríguez identificó anticuerpos de ratón y humanos que estimulan la remielinización en las lesiones de la médula espinal crónica desmielinizadas en modelos de esclerosis múltiple (MS). Idéntica a anticuerpos con efectos anti-cáncer, todos los anticuerpos de remielinización promotoras son NAbs y del isotipo IgM 1,6,7,10. Los antígenos precisas para IgM más identificados son todavía undetermined incluyendo el anticuerpo remielinización de promoción humana rHIgM22, actualmente en Fase I de ensayos clínicos para pacientes con EM 11. A pesar de los repetidos esfuerzos de los expertos en el campo de la investigación lípidos y carbohidratos, tanto en el ámbito académico y en asociación con la industria 11, los intentos para identificar antígenos de rHIgM22 no han tenido éxito. El fracaso de las técnicas estándar que se utilizan para identificar los antígenos de anticuerpos IgG para trabajar con los anticuerpos IgM identifica una necesidad crítica para refinar los métodos específicos para estos anticuerpos que los antígenos de hidratos de carbono o lípidos objetivo más probable.
El enfoque de este manuscrito es el anticuerpo humano regenerativa HIgM12 y los procedimientos experimentales utilizados para identificar a su antígeno. Anticuerpo HIgM12 se identificó a partir de pacientes con macroglobulinemia de Waldenstrom, estimula el crecimiento de neuritas in vitro 12-14 y dianas de ácido polisiálico (PSA) unido a la molécula de adhesión celular neural (PSA-NCAM) 15,16. HIgM12 extiende vida útil en un modelo de ratón de la ELA 17 y mejora el resultado funcional en el virus de la encefalomielitis murina de Theiler (TMEV) los ratones infectados. En concreto, HIgM12 estimula la actividad motora horizontal y vertical espontánea en ratones y aumenta crónicamente mielina números de diámetro pequeño y mediano axones de la médula espinal ocho semanas después de una sola dosis baja de intraperitoneal, inyectó el anticuerpo 18.
La molécula de adhesión celular neural (NCAM) es una glicoproteína de la inmunoglobulina (Ig) expresado superfamilia en la superficie celular de las neuronas, glia, músculo esquelético, y células asesinas naturales 19-25. Las tres isoformas principales NCAM denominados NCAM180, NCAM140, y NCAM120, son variantes de empalme alternativo de un transcrito primario que varían sólo en su dominio citoplásmico. En el CNS, NCAM es la molécula principal polisialilada (> 95%) con, homopolímeros de ácido siálico con carga negativa de largo. polisiálico unacid con n> 10 se denomina PSA pero existen estructuras oligoméricas más cortos que también son biológicamente relevantes. Otras proteínas polisialiladas expresadas en el CNS son SynCAM1 26, neuropilina 2 (NRP-2) 27,28 y una subunidad del canal de sodio 25 (para revisión ver 29).
Los métodos descritos aquí permiten la identificación de antígenos para las inmunoglobulinas humanas y de ratón que contienen (cadenas ligeras VκI, VκIII o VκIV de anticuerpos humanos y las cadenas ligeras VκI para anticuerpos de ratón) específicos kappa (VK) cadenas ligeras independientemente del isotipo del anticuerpo (por ejemplo, IgG, IgM , IgA, IgD o IgE). Esta limitación se basa en el uso de la proteína L agarosa para inmunoprecipitaciones con anticuerpos del isotipo IgM. Estrategias alternativas pueden incluir lectinas de unión a manosa y anticuerpos secundarios IgG anti-IgM unidos covalentemente a perlas de agarosa, que pueden ampliar la aplicabilidad de este método a más anticuerpos IgM incLuding aquellos con cadenas ligeras lambda (λ) (véase el debate). Las proporciones de cadenas ligeras en suero IgM VK en comparación con las cadenas ligeras λ IgM derivadas de individuos sanos son 1,5: 1 30.
Sobre la base de la metodología usada aquí cromatográfico para separar, enriquecer y detectar ciertas moléculas inmunológicamente 31, se requiere que todos los antígenos de incluir por lo menos un dominio de proteína pequeña. Epítopo de unión específica del anticuerpo puede estar dentro o fuera del dominio de la proteína (por ejemplo, en glicoproteínas, lipoproteínas). pasos bioquímicos iniciales utilizadas para identificar el antígeno específico para HIgM12, correspondiente a reducir la lista de posibles candidatos, son los pasos más cruciales en este método. tipo de células preparaciones específicas y caracterizaciones basadas en la morfología celular se describen por las células gliales, pero esta metodología se pueden extrapolar para dar cabida a otros tipos de células dentro o fuera del SNC.
Existe una urgentenecesidad de desarrollar técnicas nuevas o modificadas aplicables para el creciente número de anticuerpos IgM con potencial terapéutico para diferentes trastornos humanos, en particular en aquellos casos (la mayoría de los antígenos IgM), donde los objetivos de anticuerpos son estructuras de carbohidratos o lípidos.
Protocolo
protocolos y procedimientos con animales se realizaron de acuerdo con los Institutos Nacionales de Salud y aprobados por los comités de cuidado animal y el uso institucional de la Clínica Mayo (Mayo número de protocolo de IACUC # A51912).
1. Preparación de Tejidos general sobre el SNC
- Generar ratones NCAM deficiente (KO) en C57 / Bl6 fondo (amablemente proporcionado por el Dr. Lynn Landmesser, Case Western Reserve University, Cleveland, Ohio), los ratones NCAM heterocigotos y de tipo salvaje (WT) de camada (C57 / Bl6) mediante el cruce de los heterocigotos. Genotipado de los ratones NCAM KO fue descrito previamente 32-34 y no se explicará con más detalle.
Nota: Los pasos 1.2 a 1.6 son opcionales.
- Antes de la cirugía, administrar una solución de pentobarbital (Stock: 25 mg / ml; 50/100 l de pentobarbital para estadios adultos respectivos postnatales tempranas) mediante inyección intraperitoneal (aguja de calibre 27 y 1 mljeringuilla).
- Espere 2 min o hasta que el animal ha alcanzado un plano quirúrgico de anestesia. Administrar anestesia adicional según sea necesario durante el curso de cada operación para mantener un plano quirúrgico de anestesia. Utilice el método pinch-respuesta del dedo del pie para determinar la profundidad de la anestesia. Los animales deben ser insensibles antes de continuar.
- Hacer un 0,5 - 1 cm de la incisión lateral a través del tegumento y la pared abdominal justo debajo de la caja torácica. Con cuidado, separar el hígado del diafragma. Hacer una pequeña incisión en la membrana utilizando una curva, tijeras de punta roma. Continuar la incisión diafragma a lo largo de toda la longitud de la caja torácica para exponer la cavidad pleural.
- Coloque curvos, tijeras de punta roma a lo largo de un lado de la caja torácica, desplazando cuidadosamente los pulmones, y haga un corte a través de la caja torácica hasta la clavícula. Haga un corte similar en el lado contralateral. El levantamiento del esternón distancia, Recortar con precisión el tejido que conecta al corazón.
- Hacer una incisión en el animalEs por aurícula derecha usando tijeras iris para crear tan grande una salida posible. inyectar lentamente 10 ml de solución salina tamponada con fosfato (PBS) en el ventrículo izquierdo del animal (luz roja; velocidad de flujo: 1 ml / min) mediante el uso de una jeringa de 10 ml equipada con una aguja de calibre 27. No aumente el flujo / PBS presión durante la perfusión para evitar la destrucción del tejido.
- Decapitar a ratones recién nacidos mediante el uso de tijeras quirúrgicas.
- Retire el cerebro por el acaparamiento de las cuencas de los ojos con un fórceps y mediante la inserción de una pequeña tijera en la columna vertebral. Cortar el cráneo hacia la parte delantera a nivel del oído. Despegue del cráneo y suavemente coloque el cerebro en un plato de 60 mm Petri llena con 10 ml de medio de disección enfriado en hielo en hielo (Tabla 1). Coloque cada cerebro en un tubo de microcentrífuga de 1,5 ml y almacenar inmediatamente en hielo seco (-79 ºC).
- Incisión en el cerebelo y el tallo cerebral de cerebros congelados utilizando una hoja de afeitar limpia en hielo. Trabajar con rapidez para evitar la descongelación del tejido.
- Pesar elcerebro congelado, puso en un tubo de 15 ml en hielo y añadir tampón de lisis enfriado con hielo (véase la Tabla 1) a una concentración final de 150 mg de tejido cerebral por l de tampón de lisis. Repita para cerebros restante. Mantener el cerebro en el hielo en todo momento para los pasos 1.9 - 1.11.
- Homogeneizar cerebros en tampón de lisis por trituración a través de una punta de pipeta de 1 ml (10 veces) seguido de trituración a través de una jeringa de 5 ml equipada con una aguja de calibre 27 (10 veces). Incubar lisados cerebrales de otros 30 min en hielo para permitir la lisis completa de tejido.
- Eliminar el material y el cerebro lípidos insoluble en detergente mediante centrifugación en serie (cuatro rondas a 19.000 xg durante 10 min a 4 ° C). Descartar (blanco) de la mielina y los residuos celulares que contienen pellets, pero mantienen el sobrenadante después de cada etapa de la centrifugación. Alícuotas de lisados de cerebro y almacenar a -80 ºC.
2. Uso de inmunoprecipitaciones IgM humana (HIgM12 y control de isotipo IgM) como un "pull-down" Agente de Cerebral Los lisados de WT y ratones KO NCAM
- Proteína L agarosa del grano Preparación 9,35,36
- Preparar 200 ml de tampón de IP incluyendo BSA (ver Tabla 1). Preparar otros 200 ml del mismo tampón IP sin BSA.
- Por inmunoprecipitación reacción de transferencia de 100 l de suspensión de proteína L agarosa usando una pipeta de 200 l en un tubo de microcentrífuga de 1,5 ml. NO proteínas vórtice perlas de agarosa L! Añadir 1 ml de tampón de IP (véase la Tabla 1) a cada tubo. Mezclar la proteína L agarosa y tampón IP manualmente a través de la inversión (cinco veces).
- Lavado de la proteína L agarosa cuatro veces por centrifugación en una centrífuga de mesa (1.000 xg, 2 min, 25 ° C). Tome el sobrenadante con una pipeta de 200 l, sin alterar el sedimento de agarosa. Repita la limpieza de los pasos 2.1.2 a 2.1.3 de tres veces más.
- Equilibrar la proteína L agarosa en 1 ml de tampón de IP recién añadido en un rodillo durante la noche a 4 ºC.
- Antígeno-anticuerpo-agarosa L Formación de complejos y la detección de antígenos en transferencias Western
- Incubar 30 mg de tejido cerebral se lisaron (~ 200 lisado l) en 1 ml de tampón IP helado con 20 g de anticuerpo IgM (HIgM12) en un tubo de microcentrífuga de 1,5 ml durante la noche sobre un rodillo a 4 ºC.
- Centrifugar perlas de agarosa de proteína L (de la etapa 2.1.4) en una centrífuga de sobremesa durante 2 minutos a 1000 xg, 4 ° C. Descartar el sobrenadante con una pipeta de 200 l, sin alterar el sedimento de agarosa. Añadir la solución enfriada anticuerpo-cerebro lisado (de la etapa 2.2.1) a la proteína L agarosa usando una pipeta de 1 ml.
- Se incuba el antígeno-anticuerpo suspensión de proteína L agarosa durante 2 horas en un rodillo a 4 ºC. Lavar el complejo anticuerpo-antígeno unido a agarosa L a través de centrifugación a 1000 xg durante 2 min, 4 ° C. desechar con cuidado el sobrenadante sin alterar el sedimento y se añade 1 ml de tampón de IP frío con hielo que contenía 0,2% de BSA.
- Repita el paso de lavado una vez más usando tampón IP fría con hielo que contenía 0,2% de BSA y otras dos veces usando tampón IP helado sin BSA.
- Centrifugar complejo anticuerpo-antígeno unido a agarosa L a 1.000 xg durante 2 min, 4 ° C. Desechar el sobrenadante completamente primero usando una pipeta de 200 l hasta ~ 50 l de solución se dejan en la parte superior de la pastilla de agarosa proteína L seguido de una pipeta de 10 l. Mantener las muestras en hielo.
- Añadir 40 l de tampón de elución IP (ver Tabla 1) por 1,5 ml tubos de microcentrífuga, tubos flick del dedo 6 veces y calor durante 5 minutos a 95 ºC. Poner las muestras en hielo durante 2 min y centrifugar durante 30 segundos a 13.000 xg, 4 ° C.
- Transferir el sobrenadante con una pipeta de 10 l (~ 35 l en total) en un tubo nuevo de microcentrífuga de 1,5 ml sin perturbar el sedimento. Confirmar la ausencia de cuentas de Proteína L de agarosa de un enjuague en una pequeña cantidad de muestra eluida a la pared del tubo interior.
Nota: "granular"perlas de agarosa de proteína L son claramente visibles si está presente. - Si perlas de proteína L agarosa están presentes, centrifugar la muestra durante 30 segundos a 13.000 xg y transferir el sobrenadante para limpiar el tubo. Repita el paso hasta que no son detectables perlas de agarosa.
- Carga de 10 - 20 l de muestras eluidas por pocillo en gel de SDS-poliacrilamida en un sistema tampón Tris / glicina / SDS (véase la Tabla 1).
Nota: Use un 7,5% o 4 - 20% en geles de gradiente con 50 l de volumen de carga por pocillo para la detección de isoformas NCAM (dimensiones de gel (W x L x espesor de PSA-NCAM o: 8,6 x 6,7 x 0,1 cm). - Geles para ejecutar ~ 1 hora a 100 V (1,74 V / cm 2) en la mesa de trabajo. No se requiere refrigeración adicional para este paso 37,38.
- Proteínas de transferencia de PVDF (fluoruro de polivinilideno) membrana (tamaño de poro de 0,45 micras) durante 2,5 horas en la cámara frigorífica a 100 V (1,74 V / cm 2) utilizando tampón de transferencia en frío (de 5 - 10 ° C) (ver Tabla 1).
- membranas de bloque wITH 10% (w / v) leche en polvo en PBS-T durante 1 hora a 25 ºC en un agitador orbital de mesa, lavar las membranas dos veces durante 10 minutos con PBS-T y la sonda durante la noche con anticuerpo primario en 5% de BSA en PBS T en un agitador orbital en el cuarto frío.
- A la mañana siguiente las membranas de lavado una vez brevemente con un exceso de PBS-T a 25 ºC (incluye tapa y el recipiente), seguido de 3 lavados con PBS-T durante 10 min cada uno en un agitador orbital (80 rpm) (todos los pasos de lavado se realizan a 25 ºC).
- Añadir anticuerpo secundario (peroxidasa de rábano (HRP) conjugado con anticuerpo anti-humano anti-IgM (por HIgM12) (dilución 1: 30.000) en 5% de leche en polvo en PBS-T durante 1 hora a 25 ºC en un agitador orbital (70 rpm ).
- membranas Lavado ampliamente una vez brevemente con un exceso de PBS-T a 25 ºC (incluyen tapa y el recipiente), seguido de 3 lavados con PBS-T durante 10 min cada uno en un agitador orbital (80 rpm) (todos los pasos de lavado se realizan a 25 ºC) .
- Mezclar 1 ml de chemiluminescen mejorado refrigeradace HRP componente de sustrato A (reactivo luminol mejorado) con 1 ml de componente B (reactivo oxidante) (por mini-blot) a 25 ºC.
- El uso de fórceps de plástico para transferir las membranas en una toalla de papel para eliminar el exceso de líquido (sostenerlos en los mismos bordes). contenedores secos con toallas de papel y membranas volver a poner en los contenedores (uno para cada membrana). Inmediatamente añadir 2 ml del sustrato pre-mezclado aumento de quimioluminiscencia HRP (compuesto A + B) (paso 2.2.16.) A cada membrana y se incuba durante 2 min a 25 ºC en un agitador orbital (90 rpm). Hacer que las membranas estén uniformemente humedecidos por el reactivo de quimioluminiscencia.
- membranas de transferencia en una funda de plástico transparente y eliminar el exceso de líquido y de aire burbujas con toallas de papel. Ponga las membranas en la manga de plástico en un casete de película y, finalmente, la cinta de la funda de plástico en el cassette. Cierre la bandeja.
- Tome la cinta, película, temporizador y tijeras en el cuarto oscuro. Cortar esquina superior derecha de cada film para fines de orientación, exponer (diferentes) películas para diferentes períodos de tiempo (10 seg, 1 min, 10 min) y desarrollar películas en un revelador de la película.
3. Endoneuraminidase NF-La digestión de PSA unido a NCAM 39
- Recopilación tejido cerebral se lisaron desde el día postnatal (P) 7 ratones WT y ratones KO P7 NCAM (preparado a partir del paso 1,12) durante 2 horas en hielo usando endoneuraminidase-NF (endo-NF) como se ilustra en la Tabla 2 39.
- Añadir 5 l de tampón de muestra Laemmli 4x a cada tubo (1 - 6) de la etapa 3.1 (Tabla 2).
- Cargar las muestras en un 4 - gradiente de gel de poliacrilamida-SDS al 20% y repita los pasos 02/02/10 a 02/02/19. membranas de sonda con HIgM12 (1 mg / ml), disponible en el mercado anti-PSA mAb (clon 2-2B) (1 mg / ml) y el anticuerpo (control de carga) β-actina (1 mg / ml) en 5% de BSA en PBS -T.
4. Preparación de la rata y el ratón culturas del SNC
- Preparación de cubreobjetos de vidrio
- Ácido-lavado cubreobjetos de vidrio de 25 mm en 1 M HCl a 50 - 60 ºC durante 4 - 16 h en una campana de extracción utilizando un recipiente de vidrio. Agite cubreobjetos de vez en cuando a través de movimientos circulares suaves.
- Wash vidrio cubreobjetos extensivamente en agua destilada (3 x). Asegúrese de lavar el ácido entre cubreobjetos apilados.
- Enjuague cubreobjetos en etanol al 100% y secarlos en Parafilm en una campana de cultivo de células. Un día antes de su uso, calentar los portaobjetos de vidrio durante 24 horas en un recipiente de vidrio con tapa a 100 ºC en un horno.
- Ponga cubreobjetos de vidrio en placa de 6 pocillos y cubrir con 3 ml de 40 mg / ml de poli-D-lisina en agua estéril durante 1 hora a 37 ºC.
- Lavar dos veces con agua estéril, secar completamente bajo campana de cultivo celular y aplicar la luz UV durante 20 min.
- Preparación del cultivo de tejidos de plástico para las células del SNC
- Escudo 60 mm placas de cultivo celular o de 75 cm 2 frascos de cultivo de tejidos con 3ml ml o 10, respectivamente, de 40 g / poli-D-lisina ml en agua estéril durante 1 hora a 37 ºC.
- Lavar dos veces con agua, secar completamente bajo campana de cultivo celular y aplicar la luz UV durante 20 min.
- Rata mezclado Aislamiento Glia 40
- Anestesiar ratas recién nacidas en IACUC aprobado cámara de eutanasia de roedores con el suministro de gas CO 2 (totalmente automatizada). Utilice el método pinch-respuesta del dedo del pie para determinar la falta de respuesta del animal. Decapitar neonatal de ratas Sprague Dawley (P0P1) (6 - 10 crías a la vez).
- Retire el cerebro por el acaparamiento de las cuencas de los ojos con un fórceps y mediante la inserción de una pequeña tijera en la columna vertebral. Cortar el cráneo hacia la parte delantera a nivel del oído. Despegue del cráneo y suavemente coloque el cerebro en una placa de Petri de 60 mm lleno con 10 ml de medio de disección fría con hielo en hielo (ver Tabla 1).
- Repita este procedimiento para las crías de rata restante (6 - 10 PUP). Mantener el tejido en hielo durante los pasos 4.3.2 - 4.3.7.
- Divida el cerebro a lo largo de la línea media en dos hemisferios cerebrales y posteriormente cortar bulbos olfativos, los ganglios basales por debajo de la corteza cerebral y el hipocampo con pinzas Dumont. Coloque la corteza cerebral aislada en una placa de Petri que contiene limpia disección medio en hielo.
- Tome una corteza. Retire las meninges con pinzas con puntas finas debajo de un microscopio de disección.
- Repita con las cortezas restantes. Coloque todos cortezas-meninges libres en un plato de Petri limpia en hielo.
- Combinar hemisferios corticales de todos los cachorros en una placa de Petri de 60 mm y el uso de una cuchilla de afeitar estéril para dado el tejido cerebral en 1 mm piezas picadas.
- Transferir el tejido cerebral picada usando una pipeta de 10 ml en un matraz de vidrio sin recubrimiento estéril, 500 ml y añadir 10 ml de medio de disección enfriado en hielo por cerebro de rata. Agitar suavemente el frasco mientras que la adición de 1 ml de solución de tripsina en HBSS (solución salina equilibrada de Hank) (5 mg / ml de tripsina) a 9 ml de HBSS por el cerebro de rata. Añadir 2% Del volumen total en solución de DNasa I (1 mg / ml) y 2% del volumen total de solución de MgSO 4 (3,82% MgSO 4 en HBSS (w / v)) a la suspensión de tejido cerebral y agitar suavemente.
- Trypsinize tejido bajo agitación suave en un agitador de rotación durante 30 minutos a 37 ºC. Hacer piezas de tejido estén flotando durante este paso y no se sedimentan al fondo. Aumentar la velocidad de rotación, si es necesario.
- Añadir suero bovino fetal (FBS) a una concentración final de 10% (v / v) y se mezcla por agitación del matraz de 10 veces durante 10 s. Enfriar suspensión de tejido en agua helada durante 15 min. Remolino matraz suavemente cinco veces cada segundo min.
- transferir suavemente la suspensión de tejido en estériles tubos de 50 ml utilizando 25 ml o 50 ml pipetas y centrifugar durante 5 min a 200 xg, 4 ° C.
- Desechar el sobrenadante y resuspender suavemente el tejido del SNC digerido en 15 ml de medio de disección enfriado en hielo suplementado con 5 ml de suero bovino fetal, 0,4 ml de solución de MgSO 4 (3,82%MgSO 4 en HBSS) y 1,6 ml de DNasa I (1 mg / ml).
- suspensión de tejido divide por igual en dos tubos de 15 ml estériles (~ 10 ml cada uno) y lentamente se tritura usando una pipeta de 10 ml (10 veces) hasta que la suspensión se vuelve turbia / lechosa. Mantener las células en suspensión en hielo mientras se procesa el siguiente tubo. Espere 3 min hasta que queda digerido CNS tejidos sedimento al fondo del tubo. Transferir el sobrenadante a un tubo de 50 ml limpiar sin molestar a la fracción del sedimento.
- Opcionalmente, pasar sobrenadantes turbios a través de filtro de células de 40 micrones y combinar la suspensión de una sola célula resultante en recipientes estériles de 50 ml tubos en hielo.
- Girar la suspensión de células durante 5 min a 200 xg, 4 ° C.
- quitar con cuidado el sobrenadante utilizando una pipeta de 10 ml hasta que se dejan ~ 2 ml de medio de disección en la parte superior del pellet de células.
- Finger sedimentos celulares película en tubos de 50 ml (~ 10 veces). Añadir lentamente 5 ml de medio de crecimiento caliente (véase la Tabla 1) a la suspensión celular mientras suavementemano agitando el tubo.
- Opcionalmente, repita el paso DNasa 4.3.12 para un 10 minutos adicionales en hielo con una solución de DNasa I fresco y MgSO 4 solución al en el caso de agrupaciones de tejido visibles o grumos de ADN. tubo de turbulencia manual 5 veces cada segundo min.
- Plate 50.000 células por cubreobjetos de vidrio de 25 mm en un charco de 400 l medio de crecimiento en una placa de 6 pocillos y se dejaron las células se unieran durante 30 min en un incubador de cultivo celular (5% de CO 2, 37 ºC).
- Para confluente (dentro de 24 - 48 horas después de la siembra) placas de cultivo celular de 60 mm y 75 cm 2 frascos de cultivo de tejidos, placa de 500.000 células (60 mm placa) o 2 millones de células (75 cm 2 frascos).
- Añadir con cuidado 2 ml (por pocillo, cubreobjetos de vidrio de 25 mm de plato de 6 pocillos), 3 ml (platos 60 mm) o 10 ml (75 cm 2 frascos) de medio de crecimiento caliente a cada pocillo. Se incuban las células durante la noche y cambio de medio completo la mañana siguiente. A continuación, cambie medio cada dos días (día 3, día 5, día 7, etc.).
Note: Rat cultivos mixtos glia están listos para usar para inmunocitoquímica o bioquímica de 24 - 48 horas después de la siembra.
- Los cultivos de ratón mixta gliales
- Idéntica a la disección de los cerebros de ratas neonatales descritos en las secciones 4.3.1 a 4.3.6, decapitar neonatales ratones WT y KO NCAM P0 con el fondo C57 / Bl6, retire el cerebro y los puso en medio de disección fría con hielo (ver Tabla 1). Mantener el tejido en hielo en todo momento.
- Divida el cerebro a lo largo de la línea media en dos hemisferios cerebrales y posteriormente cortar bulbos olfativos, los ganglios basales por debajo de la corteza cerebral y el hipocampo con pinzas Dumont. Coloque la corteza cerebral aislada en una placa de Petri que contiene HBSS limpia en hielo.
- Tome una corteza. Retire las meninges con pinzas con puntas finas debajo de un microscopio de disección. Repita con las cortezas restantes. Coloque todos cortezas-meninges libres en un plato de Petri limpia en hielo.
- Transferir hemisphe corticalres con pipeta 1 ml de cada ratón en distintos estériles, tubos de 15 ml. Añadir 1,2 ml de medio de disección fría con hielo para cada cerebro y alterar mecánicamente el tejido cerebral pipeteando 2 veces hacia arriba y hacia abajo usando una punta de pipeta de 1 ml.
- Añadir 150 l solución de papaína (10 mg / ml en PBS), 100 l solución de DNasa I (1 mg / ml en HBSS) y 50 l MgSO 4 (3,82% en HBSS) a cada cerebro y mezclar con un movimiento rápido dedo.
- Incubar la suspensión de cerebro durante 30 minutos a 37 ºC en un baño de agua y mezclar suspensiones de cerebro cada segundo minuto a chasquear los dedos. Añadir 1 ml de FBS por tubo, mezclar y enfriar la suspensión de tejido durante 10 minutos en hielo.
- Centrifugar el tejido cerebral durante 4 min a 200 xg, 4 ºC y resuspender el sedimento de tejido en 1 ml de tampón de disección enfriado en hielo suplementado con 70 l de solución de DNasa I (1 mg / ml en HBSS) y 30 l MgSO4 solución (3,82% en HBSS).
- Se tritura el tejido cerebral usando una FBS recubierto de punta de la pipeta 1 ml(~ 5 veces) hasta que el sobrenadante se vuelve turbia. Pasar el sobrenadante a través de un filtro de células de 40 micrones y transferir a un tubo limpio en hielo.
- Precipitar las células gliales mixtos a través de la centrifugación durante 5 min a 200 xg, 4 ° C. Aspirar el sobrenadante hasta ~ 100 l de medio se dejan en la parte superior del pellet de células. Resuspender el sedimento celular por el dedo que chasquea (~ 5 veces) y añadir 1 ml de medio de crecimiento ratón caliente (véase la Tabla 1).
- Opcionalmente, se disuelve grupos de células visibles y células lisadas / ADN precipitado pipeteando suavemente la suspensión celular arriba y abajo (cinco veces).
- Placa de ratón las células gliales mixtos sobre cubreobjetos de vidrio recubiertos con PDL o placas de 60 mm como se describe en los pasos 4.3.19 - 4.3.21. Lavar las células a la mañana siguiente con un medio de crecimiento ratón cálido y posteriormente cada dos días. Ratón glía mixta está listo para usar para inmunocitoquímica 48 - 72 horas después de la siembra.
- El aislamiento de rata microglia
- rata cultivo mixtoglía en 75 cm 2 frascos de cultivo de tejidos en medio de crecimiento (véase la Tabla 1) durante 10 días. Agitar de grupos de células microgliales de cultivos gliales mixtos en un agitador de rotación dentro de una incubadora de cultivo celular (5% de CO 2, 37 ºC) a 140 rpm durante 1 hr.
- Quitar el sobrenadante que contiene microglia a partir de cultivos mixtos de la glia, pasarla a través de un filtro de células de 40 micras y mantener la suspensión de células en tubos de 50 ml estériles.
NOTA: Los cultivos microgliales son típicamente> 95% de pureza después de este paso con pocos OPCs contaminantes y muy pocos astrocitos. - Opcionalmente, reemplace medio de crecimiento en cultivos mixtos glia para futuras sacudidas offs microgliales. Típicamente realizar múltiples sacudidas offs microgliales (una vez por semana) a partir de cultivos mixtos gliales.
- Opcionalmente, para obtener el grado de pureza superior placa 95% 10 ml del sobrenadante que contenía microglia-(etapa 4.5.2) por 100 mm placas de Petri y se incuban en una incubadora de cultivo celular durante 30 minutos a 37 ºC. Sólo microglia adjuntará a placas de Petri, mientras que los astrocitos y los OPC permanecen en el sobrenadante.
- Agitar suavemente placas de Petri sentido horario y antihorario (cinco veces cada uno) en la campana de cultivo celular. Aspirar medio de cultivo celular completamente y reemplazar con 10 ml de medio de crecimiento. Culturas resultantes microglia son> 98% de pureza.
- microglia Cultura para un máximo de 7 días en DMEM suplementado con FBS al 1% y 1% de penicilina / estreptomicina.
- OPC rata / Aislamiento de oligodendrocitos
- Para obtener cultivos de OPC altamente enriquecido sacuden las células microgliales primero de 10 días de edad mezcla de culturas gliales cultivadas en 75 cm 2 frascos en un agitador de rotación dentro de un incubador de cultivo celular (5% de CO 2, 37 ºC) a 140 rpm durante 1 hr. Desechar la microglía única que contiene sobrenadante o el uso para experimentos de microglia específica (véase el paso 5.5).
- Reemplazar el sobrenadante que contiene microglial con medio de cultivo de 10 ml y sacudirse mezcla de culturas gliales paraotro 18 hr en un agitador de rotación a 200 rpm (5% de CO 2, 37 ºC).
- Se recoge el sobrenadante que contiene microglia- y OPC-glia a partir de cultivos mixtos y pasar a través de un filtro de células de 40 micrones. Recoger la suspensión de células en tubos de 50 ml estériles.
- Opcionalmente, reemplace medio de crecimiento en cultivos mixtos glia para futuras OPC agitar-offs.
Nota: Los OPC siguen proliferando en capas de alimentación y los astrocitos se pueden sacudir-off una segunda y una tercera vez (una vez por semana), aunque con rendimientos más bajos. - Plate 10 ml de la microglia- y OPC-que contiene sobrenadante en 100 mm placas de Petri y se incuban en la incubadora de cultivo celular durante 30 minutos a 37 ºC. La microglía se unirá a las placas de Petri, mientras que los OPC y astrocitos permanecen en el sobrenadante.
- Agitar suavemente placas de Petri sentido horario y antihorario (5 veces cada uno) en una campana de cultivo celular. Saque sólo unas pocas placas de Petri en un momento de la incubadora de cultivo celular (microglia comenzarán desalojando a partir de PETri platos cuando se agita vigorosamente en un medio más frío).
- Reunir y combinar el sobrenadante que contiene OPC-en tubos de 50 ml. Opcionalmente, añadir medio de cultivo a placas de Petri para su uso en experimentos de microglia específica.
- Opcionalmente, para aumentar aún más la pureza de los cultivos de OPC repetir los pasos 5.6.5 y 5.6.6 una vez con platos frescos de Petri para reducir la extensión de la microglia en preparados OPC.
- Centrifugar enriquecido sobrenadante que contiene OPC-en centrifugar durante 5 min a 250 xg, 4 ° C. Se aspira suavemente el sobrenadante sin alterar el sedimento celular. Deja 3 ml del sobrenadante en la parte superior de la pastilla y empezar a resuspender OPCs con un movimiento rápido dedo (10 veces).
- triturado en suavemente los racimos de células OPC mediante el uso de una pipeta de 10 ml (5 - 10 veces).
- Recuento de células y la placa 50.000 OPCs por 25 mm cubreobjetos de vidrio (PDL-recubierto) en un charco de medio de crecimiento 400 l en una placa de 6 pocillos y se dejaron las células se unieran durante 30 min en un incubador de cultivo celular (5% de CO 2, 376; C). Añadir con cuidado 2 ml de medio de proliferación caliente (véase la Tabla 1) a cada pocillo. Para PDL recubierto placas de cultivo celular de 60 mm, placa 1 - 1500000 OPC en 3 ml de medio de proliferación.
- Vuelva a colocar cuidadosamente contenía FBS medio de proliferación con medio de proliferación nuevo máximo de 3 horas después de la siembra las OPC (asegurarse de que los OPC conectados correctamente y no se desprenden durante el cambio de medio). medio de intercambio cada dos días.
NOTA: Los cultivos Rata OPC preparados usando este protocolo son generalmente un 90% puro con microglia como el principal tipo celular contaminante, seguido por los astrocitos.
5. El uso de inmunocitoquímica HIgM12 en células gliales Primaria
- La inmunofluorescencia etiqueta Triple usando HIgM12, anti-PSA mAb, y el tipo de célula marcadores específicos en las células gliales primaria de WT y KO ratones NCAM
- En condiciones de células vivas, la etiqueta 60% confluente de ratón mezclado cultivos gliales a partir de ratones WT y NCAM KO cultivadas en PDL-revestido25 mm cubreobjetos de vidrio con HIgM12 (10 mg / ml) y anti-PSA mAb (clon 2-2B) (10 mg / ml) en PBS suplementado con 10% FBS a 4 ºC durante 30 min.
- Lavar las células tres veces durante 20 segundos cada uno con PBS enfriado en hielo suplementado con 10% FBS y fijar con paraformaldehído al 4% en PBS, pH 7,4 durante 15 minutos a 25 ºC.
- Lavar las células dos veces fijos durante 1 min cada uno con PBS suplementado con 10% de FBS y permeabilizar las células con 0,1% de Triton-X100 en PBS, pH 7,4 durante 2 minutos a 25 ºC. Lavar las células dos veces durante 1 min y la etiqueta con marcadores gliales GFAP (astrocitos) o IBA-1 (microglia) (1 mg / ml) en PBS suplementado con FBS al 10% durante la noche a 4 ° C en la cámara frigorífica.
- Proceder con condiciones estándar, incluyendo inmunofluorescencia DAPI-31 que contiene medio de montaje.
Nota: El uso de la etiqueta fluorescente Fab 2 fragmentos como anticuerpos secundarios para humanos (HIgM12) y de ratón (anti-PSA mAb, clon 2 - 2B) IgM es muy recomendable. - tome flimágenes fluorescentes en 60X o el aumento de 100X. Utilizar los mismos ajustes del instrumento para todas las imágenes y procesar imágenes de forma idéntica.
- Inmunofluorescencia etiquetado de tratados con ENDO-NF células WT Glia utilizando HIgM12 como anticuerpo primario
- Cultura WT ratón glía mezclado crecido durante 3 días en un Neurobasal suplementado con 10% de SFB y suplemento B27 (1:50) en el PDL recubiertas con cubreobjetos de vidrio de 25 mm. Añadir ENDO-NF (30 g / ml) al medio de cultivo 1 ml y se incuba durante la noche en una incubadora de cultivo celular (37 ° C, 5% de CO 2).
- Las células de la etiqueta viven en el frío con HIgM12 y GFAP marcador de los astrocitos interna después de la fijación y permeabilización como se describe en los pasos 5.1.1 a 5.1.5. Tomar imágenes fluorescentes en 60X o el aumento de 100X. Utilizar los mismos ajustes del instrumento para todas las imágenes y procesar de forma idéntica.
Resultados
Esta sección ilustra ejemplos de los resultados que se pueden obtener mediante el estudio de PSA-antígenos IgM específicos de humanos en el SNC. Se muestra el uso de anticuerpos IgM humanos que contienen cadenas específicas de luz VK en la configuración bioquímicos y por inmunocitoquímica fluorescente.
HIgM12 inmunoprecipita su antígeno a partir de lisados de cerebro cerebrales y actúa como un agente (anticuerpo primario) detectar en transferencias de Western. Ni el anticuerpo de control de isotipo ni L perlas de agarosa inmunoprecipitan un antígeno similar, lo que demuestra la especificidad de la tira hacia abajo (Figura 1). Transferencias de Western utilizando lisados de SNC de ratones WT y NCAM KO demuestran la especificidad de unión a HIgM12-NCAM que contiene PSA-(Figura 2A). La digestión enzimática del tejido del SNC de ratones WT utilizando ENDO-NF identifica PSA unido a NCAM como el epítopo de unión específica para HIgM12 (Figura 2B). Utilizando el método descrito en el presente documento, se obtienen ratas IBA-1-positivo microglial culturas de alta pureza (Figura 3). anticuerpo anti-PSA comercialmente disponible (clon 2-2B) no etiqueta de la superficie celular o en las piscinas interiores, en el PSA fija y permeabiliza las células microgliales IBA-1-positivas por microscopía fluorescente. En consonancia con la literatura publicada con anterioridad, que informa ninguna expresión en la superficie celular de PSA-NCAM en la microglía 16,41 HIgM12 no etiqueta antígenos de superficie celular de rata microglia purificados. Curiosamente, el etiquetado de los resultados HIgM12 microglia fijos y permeabilized en una intracelular, patrón perinuclear que no se limita a orgánulos específicos (Figura 3). Los resultados están en contraste con los obtenidos utilizando un anticuerpo anti-PSA IgG (clon 735) 26, que se dirige PSA-SynCAM en microglia en el nivel de la Golgi 41.
En contraste con microglia, HIgM12y antígenos de superficie de células diana A2B5 en cultivos de OPC rata altamente enriquecido en condiciones de células vivas (Figura 4). Culturas OPC contienen ~ 5% contaminación de las células microgliales. La figura 5 ilustra un patrón casi idéntico de la superficie celular tinción entre HIgM12 y anti-PSA mAb (clon 2-2B) en GFAP-positivas astrocitos (Figura 5A). Inmunofluorescencia etiquetado de los astrocitos WT digeridos-ENDO-NF en comparación con el tampón astrocitos WT tratados con control usando HIgM12 demuestra la presencia de PSA astrocitos (Figura 5B). La presencia de astrocitos de PSA-positivo in vivo todavía tiene que ser confirmado.

Figura 1: HIgM12 actúa como un "pull-down" Agente de inmunoprecipitaciones inmunoprecipitaciones del lisado total del cerebro de los ratones de tres meses de edad, utilizando HIgM12, control de isotipo humano HIGM.126 o L agarosa cuentas solamente como agentes de "pull down". Las proteínas eluidas se llevaron a cabo en las transferencias Western sondadas con las membranas contra HIgM12. Los pesos moleculares de las proteínas eluidas de perlas recubiertas con HIgM12 estaban en el rango de 160 a 200 kDa, además de la cadena pesada de IgM (~ 65-73 kDa). Esta cifra ha sido modificado a partir de J. . Neurochem 15. Haga clic aquí para ver una versión más grande de esta figura.
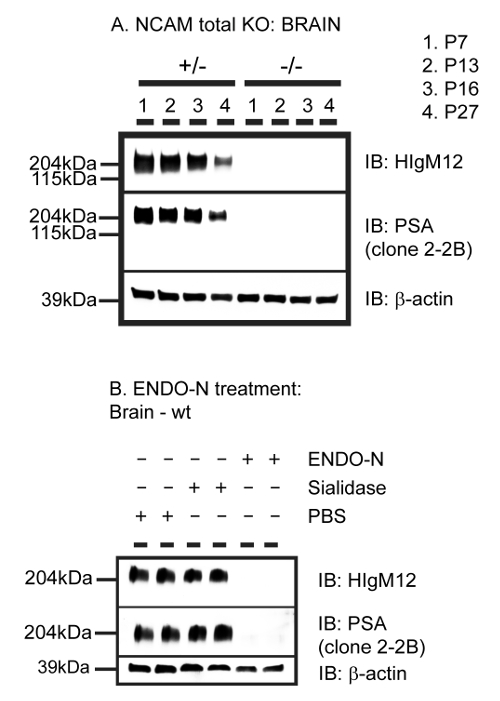
Figura 2: HIgM12 Objetivos del ácido polisiálico (PSA) Resto de NCAM. A. homogeneizados de cerebro de P7, P13, P16 y P27 NCAM total de ratones KO y los controles de la misma camada heterocigóticos se llevaron a cabo en las transferencias Western sondadas con las membranas contra HIgM12, PSA y β-actina como control de carga. B. 10 g de adulto WT lisado de cerebro de ratón en 1% de NP40 en PBS, pH 6,5 se trató con endoneuraminidase N (endo-N) (exo) neuraminidasa con α2-3 especificidad polímero de ácido polisiálico (sialidasa) o PBS durante la noche a 37 ºC, se ejecutan como dobletes en transferencias de Western y se sondearon contra HIgM12, PSA y β-actina como control de carga. Esta cifra ha sido modificado a partir de J. . Neurochem 15. Haga clic aquí para ver una versión más grande de esta figura.
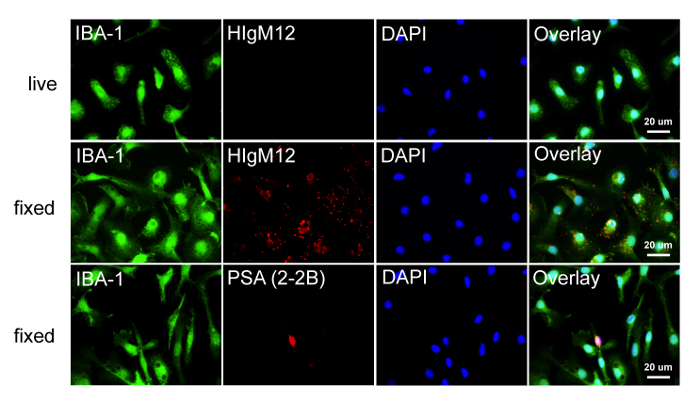
Figura 3: La ausencia de PSA en la rata La microglía se refleja en la falta de HIgM12 Etiquetado microglia rata se cultivaron durante 48 h en cubreobjetos de vidrio recubiertos con poli-D-lisina y bien marcada en vivo en el hielo con HIgM12 o después de la fijación con HIgM12 o anti. -Sal mAB (clon 2-2B). Las células fueron tRiple marcada con marcador de microglia IBA-1 (verde), HIgM12 / PSA (rojo) y DAPI (azul). Las imágenes muestran la falta de superficie de la célula microglial unión usando HIgM12 (fila superior) y la falta de anti-PSA de unión (clon 2-2B) a la superficie celular y los almacenes internos en microglia rata primaria (fila inferior). Sobre la base de la morfología bipolar y la ausencia de IBA-1 tinción, se sugirió la pequeña celda de PSA-positivos (fila inferior) para ser un OPC. En las células fijas, HIgM12 tinción dio lugar a un patrón punteado, perinuclear que no se limita a orgánulos específicos y se consideró la unión no específica (fila central). Por favor, haga clic aquí para ver una versión más grande de esta figura.
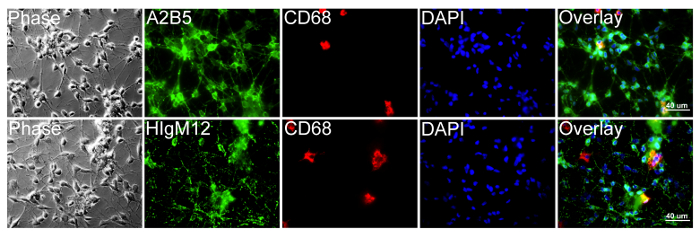
Figura 4: HIgM12 dianas celulares de superficie PSA-NCAM de rata OPC OPC rata y microglia fueron cultu.rojo durante 4 días en medio de proliferación sobre cubreobjetos de vidrio recubiertos con poli-D-lisina y triples marcados en vivo en el hielo con HIgM12 o A2B5 (verde), macrófagos interna / monocitos marcador CD68 (clon ED-1) (rojo) y DAPI (azul) . Las imágenes muestran las poblaciones de células mayormente positivo para A2B5 marcador de OPC (fila superior) y HIgM12 (fila inferior) con pocas microglia CD68-positivo (~ 5%). Se añadieron imágenes de contraste de fase y DAPI para revelar la integridad celular y el número de células de cada población. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 5: HIgM12 y mAb anti-PSA co-etiquetar una subpoblación astrocíticos ratón Mixta glía. A. mouse células gliales mixtos de WT y KO NCAM total de animales que contienen los astrocitos, oligodendrocitos células de linaje y microglia se cultivaron durante 3 días y se marcó en vivo en el hielo con HIgM12 (verde), anti-PSA MAB (clon 2-2B) (rojo) y posteriormente para astrocıtico marcador GFAP (púrpura) y DAPI (azul). HIgM12 y anti-PSA revelan un patrón de tinción idéntico virtual en astrocitos GFAP WT-positivas, pero la falta de unión de astrocitos en cultivo de ratones NCAM KO. Esta cifra ha sido modificado a partir de J. Neurochem. 15. B. glía mixtos se cultivaron de forma idéntica como se describe en A. y tratados durante la noche con endoneuraminidase-NF (amablemente proporcionado por el Dr. Martina Muehlenhoff) o control PBS. Las células se marcaron en vivo en hielo con HIgM12 (verde) y posteriormente se tiñeron para los marcadores de GFAP interna (rojo) y DAPI (azul). HIgM12 se dirige a los antígenos de la superficie celular en PBS-control tratados mezcla de culturas gliales pero no endoneuraminidase-NF tratados glía mixta. Esta cifra ha sido modificado a partir de 16 JNSCI. Plaliviar clic aquí para ver una versión más grande de esta figura.
Todas las imágenes fueron tomadas en la ampliación 60X utilizando los mismos ajustes del instrumento y se procesan de forma idéntica.

Tabla 1:. Buffer y solución Recetas Por favor, haga clic aquí para descargar la tabla.
| tejido del SNC | ENDO-NF / PBS | tampón de lisis | Volumen total | |
| 1. ratón WT | 67 g (0,45 l) | 2 l (12 mg) ENDO-NF | 7,55 l | 10 l |
| 2. ratón WT | 67 g (0,45 l) | 2 l de PBS | 7,55 l | 10 l |
| 3. ratón WT | 67 g (0,45 l) | no PBS o ENDO-NF | 9,55 l | 10 l |
| 4. NCAM ratón KO | 67 g (0,45 l) | 2 l (12 mg) ENDO-NF | 7,55 l | 10 l |
| 5. NCAM ratón KO | 67 g (0,45 l) | 2 l de PBS | 7,55 l | 10 l |
| 6. NCAM ratón KO | 67 g (0,45 l) | no PBS o ENDO-NF | 9,55 l | 10 l |
Tabla 2: digestión ENDO-NF de tejido del SNC de ratones WT y P7 NCAM KO.
Discusión
Autoanticuerpos IgM naturales humanos son atractivos candidatos para inmunoterapias y han demostrado potencial terapéutico para el tratamiento de diversas enfermedades incluyendo el cáncer y trastornos del SNC 1-7. Ventajosamente, estos anticuerpos no provocar una respuesta inmune en el que la generación de anticuerpos neutralizantes reduce sustancialmente la dosis terapéutica efectiva y eficacia. Es importante destacar que todos los anticuerpos con potencial terapéutico han sido del isotipo IgM y pertenecen al repertorio NAb 3-5,8,9,37,40,42-45. Un obstáculo importante para el potencial aplicación clínica de los anticuerpos IgM es la identificación de sus antígenos, que todavía no se determinaron en muchos casos. Las técnicas estándar empleadas para anticuerpos IgG a menudo no son aplicables para identificar el antígeno de una IgM.
Este protocolo describe la identificación de PSA-NCAM como el antígeno para el anticuerpo IgM humano regenerativa HIgM12, eficaces en modelos animalesde la esclerosis múltiple y ALS 15-18. La metodología utilizada es principalmente aplicable a todos los anticuerpos humanos con cadenas específicas de luz VK VκI, VκIII y VκIV y anticuerpos de ratón con cadenas ligeras VκI, independientemente de isotipo de anticuerpo.
El paso más crítico en este protocolo es el uso de anticuerpos IgM en aplicaciones de cromatografía de afinidad. Más específicamente, se requieren anticuerpos exitosas para actuar como agentes desplegables en inmunoprecipitaciones para aislar o enriquecer un antígeno de complejos tejido o células de la cultura lisados. fracciones de antígeno enriquecidos pueden compararse con las inmunoprecipitaciones de anticuerpos de control de isotipo y posteriormente analizados para diferencias por espectrometría de masas. Un requisito esencial o limitación de este paso es la presencia del anticuerpo correcta VK cadena ligera y host (humana, de ratón) para permitir la unión a la proteína L agarosa anticuerpo. El uso de la proteína de unión a manosa unida a agarosa (también called lectina de unión a manosa) en lugar de la proteína L agarosa es una alternativa potencial para inmunoprecipitar las IgM específicas sin cadenas ligeras VK. Sin embargo, como se indica por Arnold et al. 35, los anticuerpos IgM unido al antígeno no se unen a la proteína de unión a manano, como los glicanos objetivo parecen ser inaccesible una vez que el IgM se ha unido a su antígeno. Basándose en estos hallazgos manano-proteína de unión no se puede utilizar como una matriz de unión para inmunoprecipitar el antígeno cargado IgM moléculas 35. Otras alternativas posibles podrían ser el uso de anticuerpos anti-IgM IgG de agarosa unida secundarias 46,47 o el uso de perlas magnéticas activados en superficie 48. anticuerpos IgG dirigidos contra IgM podrían ser químicamente reticulada a agarosa o agarosa A G con el fin de reducir la extensión de anticuerpo eluido junto con el antígeno de interés. Una comparación adecuada entre las diferentes variantes de inmunoprecipitación IgM con respecto a los antígenos identificados con éxito iEs difícil porque la mayoría de las inmunoprecipitaciones se realizaron para aislar o agotar las IgM sin más interés en sus antígenos. Además, inmunoprecipitaciones utilizando las IgM se utilizaron principalmente para confirmar un solo antígeno ya conocido o esperado con la exposición de anticuerpos a los antígenos purificados 49. Una desventaja de las IgG de agarosa acoplada dirigido contra IgM humana es un rendimiento muy bajo (10 a 15%) de moléculas de IgM en suero inmunoprecipitada en comparación con el material de partida 50. Por el contrario, perlas magnéticas activados en superficie se aplicaron con éxito a anticuerpos de diferentes isotipos, incluyendo IgM para inmunoprecipitar fibrillas asociadas a la tembladera 48. Este método no se limita a kappa específico (VK) o cadenas lambda (λ) o un huésped particular y puede ampliar sustancialmente el espectro de anticuerpos IgM utilizados en las inmunoprecipitaciones.
Otro paso importante en el protocolo es la capacidad del anticuerpo para funcionar como un deteja anticuerpo (anticuerpo primario) en las transferencias Western u otras plataformas de cribado. anticuerpos exitosos deben dirigirse a su antígeno con afinidad suficientemente alta para permitir la unión del antígeno en presencia de detergentes no iónicos o posiblemente iónicos. anticuerpos de alta afinidad son comunes entre los anticuerpos IgG por afinidad madurada, pero menos común entre anticuerpos del isotipo IgM, que es una de las razones por las que hay relativamente pocos anticuerpos IgM disponibles en el comercio como agentes de detección en la configuración de bioquímicos. unión de los anticuerpos de alta afinidad es un requisito para las inmunoprecipitaciones de antígenos moleculares y de transferencia Western. La reducción de concentraciones de detergente o la ausencia completa de detergentes en buffers IP y tampones de lisis permite antígeno dirigido por anticuerpos de baja afinidad a través de su dominio Fab. Por el contrario, la capacidad del anticuerpo para dirigir la proteína L agarosa a través de su porción Fc no se ve afectada sustancialmente entre los controles de isotipo en un rango de diferentes concen detergentestraciones. Sin embargo, baja concentración de detergente en tampón de lisis y el tampón de IP impide disrupción de la membrana celular y el aislamiento de moléculas específicas. Del mismo modo, una baja concentración de detergente en tampones de lavado Western blot (por ejemplo, PBS-T) permite la unión de anticuerpos de baja afinidad de antígeno, pero al mismo tiempo aumenta la unión no específica y por lo tanto no es una opción.
La presencia de un núcleo de proteína de antígeno es otro requisito para este método. Las proteínas con modificaciones postraduccionales (por ejemplo, glicoproteínas, lipoproteínas) y las proteínas no modificadas, pero no los lípidos individuales o hidratos de carbono, son detectables en transferencias de Western. No es posible para inmunoprecipitar los lípidos (por ejemplo, esfingolípidos) a partir de tejido o células lisados en presencia o ausencia de detergentes. Las propiedades físico-químicas de los detergentes y los lípidos son demasiado similares como para permitir interacciones selectivas de lípidos-anticuerpo, mientras que al mismo tiempo los detergentes son esenciales para interrumpirmembranas con el fin de permitir el aislamiento selectivo de moléculas específicas. Para nuestro mejor conocimiento, inmunoprecipitaciones exclusivamente compuestos por hidratos de carbono, en ausencia de un núcleo de proteína, no se han informado anteriormente. Esto se vuelve particularmente relevante ya que los anticuerpos IgM con frecuencia se dirigen a los hidratos de carbono y glicolípidos, que no están necesariamente vinculados a una unidad de proteína. Se requieren otros técnicas cromatográficas para la identificación y separación inmunológica de los lípidos y los hidratos de carbono en ausencia de un núcleo de proteína. Por ejemplo, cromatografía en capa fina (TLC) de los lípidos celulares con la detección posterior de anticuerpos sobre la placa de TLC (inmuno-TLC) se puede implementar 51,52.
Otros anticuerpos anti-PSA se han descrito en los estudios y resultados previos en comparación con HIgM12 así como la disponible comercialmente anti-PSA IgM (clon 2-2B). El anticuerpo más comúnmente utilizado en el campo de PSA es un anticuerpo IgG (clon 735) disponible como Monoc ratónlonal o anticuerpo policlonal de conejo 53. Este anticuerpo IgG anti-PSA PSA detecta en SynCAM y NCAM en diferentes tipos de células del sistema nervioso central, incluyendo las células microgliales 41. En contraste con el anticuerpo anti-PSA IgG, anticuerpos IgM humanos HIgM12, HIgM42 y el anti-PSA IgM de ratón (clon 2-2B) no son capaces de apuntar a PSA en SynCAM (pero en NCAM) en diversas etapas postnatales embrionarias y temprano en ratones , mientras SynCAM no polisialilada es fácilmente detectable 15. Los anticuerpos IgM se utilizan también no son capaces de detectar PSA en las células microgliales (Figuras 3 + 4). Una posible explicación para las diferencias observadas entre los isotipos de anticuerpos puede ser bajos niveles de PSA-SynCAM comparación con los niveles de PSA-NCAM en combinación con la unión de anticuerpos IgM en comparación con el anti-PSA IgG afinidad potencialmente menor. Para probar esta hipótesis, se realizó inmunoprecipitaciones en animales KO NCAM en estado embrionario E17 con grandes cantidades de SynCAM presente y utilizamos HIgM12 como un "agente de pull-down" 15. En E17 WT camada controles HIgM12 inmunoprecipitado PSA-NCAM en una medida que mostró intensidades similares de "derribada" PSA-NCAM en comparación con la IgM de cadena pesada como se detectó por densitometría de transferencia de Western usando posterior antígenos eluidas. Este resultado sugiere al menos una afinidad suficiente de HIgM12 a su destino PSA. En contraste con WT camada controla HIgM12 no detectó PSA unido a SynCAM en los animales KO NCAM. Se obtuvieron resultados idénticos en inmunoprecipitaciones usando el anticuerpo anti-PSA IgM HIgM42. HIgM12 y HIgM42, así como el ratón anti-PSA IgM (clon 2-2B) fueron incapaces de dirigirse a PSA en SynCAM en transferencias de Western de los animales WT y NCAM KO en las etapas de desarrollo embrionario y postnatal. Teniendo en cuenta la baja cantidad de HIgM12 requerida (0,1 g / ml) para detectar específicamente PSA unido a NCAM en transferencias de Western utilizando pequeñas cantidades de tejido del SNC (0,1 g CNS tejido por pocillo) 15 que parece ser poco probable que las bajas afinidades solo sonresponsable de la completa falta de detección PSA-SynCAM por HIgM12 en tres métodos diferentes.
Llegamos a la conclusión de que existen diferencias significativas entre los anticuerpos anti-PSA IgM y el anticuerpo anti-IgG de PSA publicada frecuencia (clon 735). No está claro por qué los anticuerpos anti-PSA comerciales de IgM no se han utilizado con mayor frecuencia en el pasado para confirmar los resultados obtenidos con el anticuerpo IgG antiPSA 735. Esto es particularmente interesante porque HIgM12 ya ha demostrado su eficacia en diversos modelos de enfermedad. Mientras que otros anticuerpos anti-PSA IgM pueden tener efectos terapéuticos similares no queda claro si el anticuerpo anti-PSA IgG (clon 735) tiene un resultado terapéutico similar en modelos de MS y ALS.
En resumen, los métodos descritos aquí se utilizan principalmente para identificar el antígeno de los anticuerpos humanos HIgM12 regenerativas para apoyar posibles ensayos clínicos para MS y posiblemente otras enfermedades neurodegenerativas. La identificación de la hormigaigens de anticuerpos con actividad biológica constituye un paso esencial para entender su mecanismo de acción. Esto se vuelve particularmente relevante en el contexto de numerosos anticuerpos monoclonales que actualmente se prueban para la seguridad y eficacia en ensayos humanos. Mientras que el número de anticuerpos IgM clínicamente probados hasta la fecha es pequeño, los recientes avances en la tecnología de hibridomas, junto con un creciente número de estudios que destacan el potencial terapéutico de esta clase de anticuerpos 1-10,37,40,42-45 insta al desarrollo de nuevos o métodos modificados aplicable para identificar antígenos IgM no proteicos.
Divulgaciones
Patents for antibodies that promote remyelination and CNS repair are issued and owned by Mayo Clinic. Authors have a potential conflict of interest.
Agradecimientos
Este trabajo fue apoyado por becas de los Institutos Nacionales de Salud (R01 GM092993, R01 NS048357 y R21 NS073684), la Fundación Nacional de Ciencia (concesión de carrera), el Premio de Minnesota Asociación de Biotecnología y Genómica Médica, la Sociedad Nacional de Esclerosis (CA1060A) y el Centro para la Ciencia Clínica Mayo Clínica y traslacional (CCATS). Los autores reconocen el apoyo de las fundaciones Applebaum, Hilton, Peterson y Sanford, la Luna y Marilyn Parque Fondo de Consejero y la familia McNeilus.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM | Fisher Scientific | MT-10-013-CVRF | HIGH GLUCOSE, with glutamine, with sodium pyruvate, 500 ml |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | 500 ml, L-glutamine, sodium pyruvate, high glucose |
| Penicillin-Streptomycin | Life Technologies | 15140-122 | 10,000 U/mL, 100 ml |
| N-2 Supplement (100X) | Life Technologies | 17502-048 | 5 ml |
| B-27 Supplement (50X) | Life Technologies | 17504-044 | serum free, 10 ml |
| Fetal Bovine Serum - Optima | Atlanta Biologicals | S12450 | 500 ml |
| STERILE WATER FOR IRRIGATION | Baxter Healthcare | #2F7114 | USP-1000 ml, 12/CA |
| Poly-D-lysine hydrobromide | Sigma | P7886-50MG | D-Lys-(D-Lys)n-D-Lys · xHBr, Molecular Weight 30,000-70,000 g/mol, 50 mg |
| bovine serum albumin fraction V | Sigma | A-3294-100G | heat shock fraction, protease free, pH 7, purity 98%, 100 g |
| D-(+)-Glucose | Sigma | G5767-500G | C6H12O6, Molecular Weight: 180.16 g/mol, ACS reagent, 500 g |
| Trypsin from bovine pancreas | Sigma | T9935-100mg | essentially salt-free, lyophilized powder, =9,000 BAEE units/mg protein, |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025-150KU | Type IV, lyophilized powder, =2,000 Kunitz units/mg protein |
| Recombinant Rat FGF basic Protein | R&D systems | 3339-FB-025 | BSA as a carrier protein, 25 ug, lyophilized, >95%, 16.2 kDa |
| Recombinant Rat PDGF-AA Protein | R&D systems | 1055-AA-50 | carrier free, 50 ug, lypphilized, >97%, E.coli-derived, 12.5 kDa |
| Neurobasal-A | Life Technologies | 10888-022 | 500 ml, No Glutamine, No Aspartic Acid, No Glutamic Acid |
| Paraformaldehyde | Sigma | P6148-1KG | crystalline, 1 kg, reagent grade, Molecular Weight 30.03 g/mol (as monomer) |
| Tris[hydroxymethyl]aminomethane (Tris bas | Biorad | #1610719 | 1 kg, 99.8% pure, powder |
| Sodium Dodecyl Sulfate (SDS) | Biorad | #1610302 | 1 kg, powder |
| Glycine | Fisher Scientific | BP-381-5 | C2H5NO2, Molecular weight: 75.07 g/mol, White crystalline Powder, 5 kg |
| Sodium chloride | Sigma | S7653-5KG | NaCl, Molecular Weight: 58.44 g/mol, 5 kg |
| Sodium phosphate monobasic | Sigma | S0751-500G | NaH2PO4, Molecular Weight: 119.98 g/mol, 500 g |
| Phosphate-buffered Solution 1X (PBS) | Cellgro | MT-21-040-CV | Without Calcium and Magnesium, 6 x 500 ml |
| Falcon 60mm TC-Treated Cell Culture Dish | Corning Life Sciences | #353002 | 60 mm Cell Culture Dish, TC-treated polystyrene, 20/pack, sterile |
| Falcon 60 mm x 15 mm Petri dish | Corning Life Sciences | #351007 | Not TC-Treated Bacteriological Petri Dish, 20/Pack |
| 6 well cell culture plates | Corning Costar | CLS3516 | 6 well, flat bottom (Individually wrapped), gamma-irradiated, growth area 9.5 c |
| 75cm² tissue culture flask | Corning Life Sciences | 430720U | 75cm² U-Shaped Canted Neck Cell Culture Flask with Plug Seal Cap |
| Pierce™ Protein L Plus Agarose | ThermoFisher Scientific | #20520 | 2 ml, crosslinked 6% beaded agarose (CL-6B), binding capacity: 10 to 20 mg IgG |
| 4-20% Mini-PROTEAN TGX Precast Gel | Biorad | 456-1094 | 10-well, 50 µl, for use with Mini-PROTEAN electrophoresis cells |
| Immobilon-P Membrane | Millipore | IPVH00010 | PVDF, 0.45 µm, 26.5 cm x 3.75 m roll |
| Anti-Polysialic Acid-NCAM Antibody, clone | Millipore | MAB5324 | 50 microliters, Host: mouse, monoclonal IgM |
| XT sample buffer (Western blot) | Biorad | #1610791 | 10 ml, 4 x premixed protein sample buffer |
| 2-mercaptoethanol | Biorad | #1610710 | 25 ml, 98 % pure, 14.2 M |
| Endoneuraminidase-N (Endo-N) | ABC Scientific | ABC0020 | 50 microliters, 200 µg/ml, 3500 U/mg |
| 25 mm glass coverslips | Fisher Scientific | 12-545-102 | Circles No. 1; Thickness: 0.13 to 0.17mm; Size: 25mm |
| HEPES buffer solution | ThermoFisher Scientific | 15630-080 | 100 ml, 1M |
| Hanks' Balanced Salt Solution 1X (HBSS) | Cellgro | MT-21-022-CV | 500 ml, without Calcium, Magnesium, Phenol Red |
| Papain | Worthington Biochemical Cooperation | LS003119 | lyophilized powder, 100 mg |
| Magnesiumsulfate | Sigma | M-2643-500G | powder, 500 g |
| L-Glutamine | Gibco | #25030-081 | 100 ml, 200 mM |
Referencias
- Asakura, K., Miller, D. J., Pease, L. R. Targeting of IgMkappa antibodies to oligodendrocytes promotes CNS remyelination. J Neurosci. 18 (19), 7700-7708 (1998).
- Bieber, A. J., Warrington, A., Asakura, K. Human antibodies accelerate the rate of remyelination following lysolecithin-induced demyelination in mice. Glia. 37 (3), 241-249 (2002).
- Vollmers, H. P., Brandlein, S. Natural antibodies and cancer. J Autoimmun. 29 (4), 295-302 (2007).
- Vollmers, H. P., Brandlein, S. Natural antibodies and cancer. N Biotechnol. 25 (5), 294-298 (2009).
- Vollmers, P. H., Brandlein, S. Natural monoclonal antibodies and cancer. Recent Pat Anticancer Drug Discov. 3 (2), 84-87 (2008).
- Warrington, A. E., Asakura, K., Bieber, A. J. Human monoclonal antibodies reactive to oligodendrocytes promote remyelination in a model of multiple sclerosis. Proc Natl Acad Sci. 97 (12), 6820-6825 (2000).
- Warrington, A. E., Bieber, A. J., Ciric, B. A recombinant human IgM promotes myelin repair after a single, very low dose. J Neurosci Res. 85 (5), 967-976 (2007).
- Brandlein, S., Pohle, T., Ruoff, N. Natural IgM antibodies and immunosurveillance mechanisms against epithelial cancer cells in humans. Cancer Res. 63 (22), 7995-8005 (2003).
- Pohle, T., Brandlein, S., Ruoff, N. Lipoptosis: tumor-specific cell death by antibody-induced intracellular lipid accumulation. Cancer Res. 64 (11), 3900-3906 (2004).
- Miller, D. J., Sanborn, K. S., Katzmann, J. A. Monoclonal autoantibodies promote central nervous system repair in an animal model of multiple sclerosis. J Neuro. 14 (10), 6230-6238 (1994).
- Warrington, A. E., Bieber, A. J., Van Keulen, V. Neuron-binding human monoclonal antibodies support central nervous system neurite extension. J Neuropathol Exp Neurol. 63 (5), 461-473 (2004).
- Xu, X., Warrington, A. E., Wright, B. R. A human IgM signals axon outgrowth: coupling lipid raft to microtubules. J Neurochem. 119 (1), 100-112 (2011).
- Xu, X., Wittenberg, N. J., Jordan, L. R. A patterned recombinant human IgM guides neurite outgrowth of CNS neurons. Sci Rep. 3, 2267 (2013).
- Watzlawik, J. O., Kahoud, R. J., Ng, S. Polysialic acid as an antigen for monoclonal antibody HIgM12 to treat multiple sclerosis and other neurodegenerative disorders. J Neurochem. 134 (5), 865-878 (2015).
- Watzlawik, J. O., Painter, M. M., Wootla, B. A human anti-polysialic acid antibody as a potential treatment to improve function in multiple sclerosis patients. J Nat Sci. 1 (8), (2015).
- Xu, X., Denic, A., Jordan, L. R. A natural human IgM that binds to gangliosides is therapeutic in murine models of amyotrophic lateral sclerosis. Dis Model Mech. 8 (8), 831-842 (2015).
- Denic, A., Macura, S. I., Warrington, A. E. A single dose of neuron-binding human monoclonal antibody improves spontaneous activity in a murine model of demyelination. PLoS One. 6 (10), e26001 (2011).
- Lanier, L. L., Chang, C., Azuma, M. Molecular and functional analysis of human natural killer cell-associated neural cell adhesion molecule (N-CAM/CD56). J Immunol. 146 (12), 4421-4426 (1991).
- Moore, S. E., Thompson, J., Kirkness, V. Skeletal muscle neural cell adhesion molecule (N-CAM): changes in protein and mRNA species during myogenesis of muscle cell lines. J Cell Biol. 105 (3), 1377-1386 (1987).
- Pollerberg, E. G., Sadoul, R., Goridis, C. Selective expression of the 180-kD component of the neural cell adhesion molecule N-CAM during development. J Cell Biol. 101 (5 Pt 1), 1921-1929 (1985).
- Seilheimer, B., Persohn, E., Schachner, M. Neural cell adhesion molecule expression is regulated by Schwann cell-neuron interactions in culture. J Cell Biol. 108 (5), 1909-1915 (1989).
- Trotter, J., Bitter-Suermann, D., Schachner, M. Differentiation-regulated loss of the polysialylated embryonic form and expression of the different polypeptides of the neural cell adhesion molecule by cultured oligodendrocytes and myelin. J Neuro Res. 22 (4), 369-383 (1989).
- Yazaki, T., Asou, H., Arimoto, K. Decrease of NCAM expression and astrocyte-neurone interaction in long-term cultured astrocytes. Neuroreport. 6 (8), 1085-1088 (1995).
- Zuber, C., Lackie, P. M., Catterall, W. A. Polysialic acid is associated with sodium channels and the neural cell adhesion molecule N-CAM in adult rat brain. J Biol Chem. 267 (14), 9965-9971 (1992).
- Galuska, S. P., Rollenhagen, M., Kaup, M. Synaptic cell adhesion molecule SynCAM 1 is a target for polysialylation in postnatal mouse brain. Proc Natl Acad Sci. 107 (22), 10250-10255 (2010).
- Curreli, S., Arany, Z., Gerardy-Schahn, R. Polysialylated neuropilin-2 is expressed on the surface of human dendritic cells and modulates dendritic cell-T lymphocyte interactions. J Biol Chem. 282 (42), 30346-30356 (2007).
- Rollenhagen, M., Buettner, F. F., Reismann, M. Polysialic acid on neuropilin-2 is exclusively synthesized by the polysialyltransferase ST8SiaIV and attached to mucin-type o-glycans located between the b2 and c domain. J Biol Chem. 288 (32), 22880-22892 (2013).
- Schnaar, R. L., Gerardy-Schahn, R., Hildebrandt, H. Sialic acids in the brain: gangliosides and polysialic acid in nervous system development, stability, disease, and regeneration. Physiol Rev. 94 (2), 461-518 (2014).
- Abe, M., Goto, T., Kosaka, M. Differences in kappa to lambda (kappa:lambda) ratios of serum and urinary free light chains. Clin Exp Immunol. 111 (2), 457-462 (1998).
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Cremer, H., Lange, R., Christoph, A. Inactivation of the N-CAM gene in mice results in size reduction of the olfactory bulb and deficits in spatial learning. Nature. 367 (6462), 455-459 (1994).
- Polo-Parada, L., Bose, C. M., Plattner, F. Distinct roles of different neural cell adhesion molecule (NCAM) isoforms in synaptic maturation revealed by analysis of NCAM 180 kDa isoform-deficient mice. J Neurosci. 24 (8), 1852-1864 (2004).
- Tomasiewicz, H., Ono, K., Yee, D. Genetic deletion of a neural cell adhesion molecule variant (N-CAM-180) produces distinct defects in the central nervous system. Neuron. 11 (6), 1163-1174 (1993).
- Arnold, J. N., Wormald, M. R., Suter, D. M. Human serum IgM glycosylation: identification of glycoforms that can bind to mannan-binding lectin. J Biol Chem. 280 (32), 29080-29087 (2005).
- Bjorck, L., Protein, L. A novel bacterial cell wall protein with affinity for Ig L chains. J Immunol. 140 (4), 1194-1197 (1988).
- Vollmers, H. P., Dammrich, J., Hensel, F. Differential expression of apoptosis receptors on diffuse and intestinal type stomach carcinoma. Cancer. 79 (3), 433-440 (1997).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci. 76 (9), 4350-4354 (1979).
- Stummeyer, K., Dickmanns, A., Muhlenhoff, M. Crystal structure of the polysialic acid-degrading endosialidase of bacteriophage K1F. Nat. Struct. Mol. Biol. 12 (1), 90-96 (2005).
- Vollmers, H. P., Dammrich, J., Ribbert, H. Apoptosis of stomach carcinoma cells induced by a human monoclonal antibody. Cancer. 76 (4), 550-558 (1995).
- Werneburg, S., Muhlenhoff, M., Stangel, M. Polysialic acid on SynCAM 1 in NG2 cells and on neuropilin-2 in microglia is confined to intracellular pools that are rapidly depleted upon stimulation. Glia. 63 (7), 1240-1255 (2015).
- Brandlein, S., Rauschert, N., Rasche, L. The human IgM antibody SAM-6 induces tumor-specific apoptosis with oxidized low-density lipoprotein. Mol Cancer Ther. 6 (1), 326-333 (2007).
- Vollmers, H. P., Hensel, F., Hermann, R. Tumor-specific apoptosis induced by the human monoclonal antibody SC-1: a new therapeutical approach for stomach cancer. Oncol Rep. 5 (1), 35-40 (1998).
- Vollmers, H. P., O'Connor, R., Muller, J. SC-1, a functional human monoclonal antibody against autologous stomach carcinoma cells. Cancer Res. 49 (9), 2471-2476 (1989).
- Vollmers, H. P., Zimmermann, U., Krenn, V. Adjuvant therapy for gastric adenocarcinoma with the apoptosis-inducing human monoclonal antibody SC-1: first clinical and histopathological results. Oncol Rep. 5 (3), 549-552 (1998).
- Nakano, K., Yasuda, K., Shibuya, H. ANNALS EXPRESS: Transient human anti-mouse antibody generated with immune enhancement in a carbohydrate antigen 19-9 immunoassay after surgical resection of recurrent cancer. Ann Clin Biochem. , (2016).
- Pettingill, P., Kramer, H. B., Coebergh, J. A. Antibodies to GABAA receptor alpha1 and gamma2 subunits: clinical and serologic characterization. Neurology. 84 (12), 1233-1241 (2015).
- Morel, N., Simon, S., Frobert, Y. Selective and efficient immunoprecipitation of the disease-associated form of the prion protein can be mediated by nonspecific interactions between monoclonal antibodies and scrapie-associated fibrils. J Biol Chem. 279 (29), 30143-30149 (2004).
- Lobo, P. I., Schlegal, K. H., Vengal, J. Naturally occurring IgM anti-leukocyte autoantibodies inhibit T-cell activation and chemotaxis. J Clin Immunol. 30, S31-S36 (2010).
- Lobo, P. I., Schlegel, K. H., Spencer, C. E. Naturally occurring IgM anti-leukocyte autoantibodies (IgM-ALA) inhibit T cell activation and chemotaxis. J Immunol. 180 (3), 1780-1791 (2008).
- Wikstrand, C. J., Fredman, P., Svennerholm, L. Detection of glioma-associated gangliosides GM2, GD2, GD3, 3'-isoLM1 3',6'-isoLD1 in central nervous system tumors in vitro and in vivo using epitope-defined monoclonal antibodies. Prog Brain Res. 101, 213-223 (1994).
- Hamilton, W. B., Helling, F., Lloyd, K. O. Ganglioside expression on human malignant melanoma assessed by quantitative immune thin-layer chromatography. Int J Cancer. 53 (4), 566-573 (1993).
- Galuska, S. P., Oltmann-Norden, I., Geyer, H. Polysialic acid profiles of mice expressing variant allelic combinations of the polysialyltransferases ST8SiaII and ST8SiaIV. J Biol Chem. 281 (42), 31605-31615 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados