Method Article
Tavan Kültürlerde Olgun adipositlerinde ve dediferansiyonunu ile İnsan adipoz Kök Hücre Üretimi
Bu Makalede
Özet
Mature adipocytes may represent an abundant source of stem cells through dedifferentiation, which leads to a homogenous population of fibroblast-like cells. Collagenase digestion is used to isolate mature adipocytes from human fat. The goal of our protocol is to obtain multipotent, dedifferentiated fat cells from human mature adipocytes.
Özet
Mature adipocytes have been shown to reverse their phenotype into fibroblast-like cells in vitro through a technique called ceiling culture. Mature adipocytes can also be isolated from fresh adipose tissue for depot-specific characterization of their function and metabolic properties. Here, we describe a well-established protocol to isolate mature adipocytes from adipose tissues using collagenase digestion, and subsequent steps to perform ceiling cultures. Briefly, adipose tissues are incubated in a Krebs-Ringer-Henseleit buffer containing collagenase to disrupt tissue matrix. Floating mature adipocytes are collected on the top surface of the buffer. Mature cells are plated in a T25-flask completely filled with media and incubated upside down for a week. An alternative 6-well plate culture approach allows the characterization of adipocytes undergoing dedifferentiation. Adipocyte morphology drastically changes over time of culture. Immunofluorescence can be easily performed on slides cultivated in 6-well plates as demonstrated by FABP4 immunofluorescence staining. FABP4 protein is present in mature adipocytes but down-regulated through dedifferentiation of fat cells. Mature adipocyte dedifferentiation may represent a new avenue for cell therapy and tissue engineering.
Giriş
In vitro dedifferentiation of mature adipocytes is achieved through a technique called ceiling culture1. Because of their natural tendency to float in aqueous solutions, isolated mature adipocytes adhere to the surface of an inverted flask fully filled with culture medium. Over a few days, cells modify their spherical morphology and become fibroblast-like cells. The resulting cells, called dedifferentiated fat (DFAT) cells, are multipotent2. Research articles on adipocyte dedifferentiation, especially on human cells, are limited. However, they have already provided interesting information regarding multipotency, cell phenotype and replicative capacity of DFAT cells2. Mature adipocytes originating from various fat compartments have been successfully dedifferentiated including those originating from human visceral and subcutaneous adipose tissues2-4. In addition to these depots, Kishimoto and collaborators sampled adipose tissue from the buccal fat pads and dedifferentiated adipocytes into DFAT cells5. Matsumoto and collaborators successfully generated subcutaneous DFAT cells from patients covering a wide range of ages, and the majority of cells had a high proliferative rate and less than 6% of senescence even after 10 passages in culture2.
DFAT cells have been successfully re-differentiated into several lineages, including adipogenic, osteogenic, chondrogenic and neurogenic lineages2,3,6. These cells express several embryonic stem cell markers such as Nanog and the four identified pluripotent factors Oct4, c-myc, Klf4 and Sox23. They also express markers specific to each of the three germ layers7. In addition, DFAT cells are similar to Bone Marrow-derived Mesenchymal Stem Cells (BM-derived MSC) based on their epigenetic signature3. Exploiting the stem cell capacity of DFAT cells, many groups have investigated their potential to treat or improve various diseases8,9. Improvements of pathologic conditions, such as infracted cardiac tissue, spinal cord injury and urethral sphincter dysfunction, have been observed with DFAT cell injections in rat models of disease10-12.
In addition to the stem cell properties of DFAT cells, they may represent a new cellular model for adipocyte physiology studies. The 3T3-L1 cell line is often used for this purpose as these cells differentiate into adherent, lipid-storing adipocytes under adipogenic stimulation13. However, these cells originate from mouse embryo tissue13. Also, depot-specificity cannot be investigated with this model and it may not fully reflect human adipocyte physiology14. Other laboratories work with isolated adipose cells from murine fat depots, but fat distribution is not dimorphic in mice and anatomical configuration of the rodent's abdominal cavity prevents from extrapolating directly to humans15. In order to study adipocytes in the context of the physiopathology of human obesity, consideration of body fat distribution and fat depot-specific differences has become essential16. Some limitations of primary preadipocyte cultures, including cell quantities obtained from adipose tissue biopsy samples and their senescence after a few passages in culture, created the need for alternate models. Perrini and collaborators investigated depot-specificity in gene expression of DFAT cells originating from visceral and subcutaneous fat and compared them to adipose-derived stem cells (ASC) from the same fat depot. They demonstrated that differences in gene expression and function where mainly found between depots than between cell types, suggesting that DFAT cells are physiologically close to ASC from the same depot. DFAT cells may represent an interesting alternative to available models for studies on fat distribution in the pathophysiology of human obesity. Moreover, ceiling culture is a promising method to obtain adult stem cells for tissue engineering purposes.
Here, we describe collagenase digestion, a widely-used technique to isolate mature adipocytes from the subcutaneous and/or visceral fat samples17, and the subsequent steps to perform ceiling culture and dedifferentiate these cells into multipotent, fibroblast-like cells.
Protokol
Etik deyimi: Proje öncesinde hasta alımına IUCPQ Araştırma Etik Kurulu tarafından onaylanmıştır. Bu haber / video amaçla, 2 hastada dokuların elde: 1) 57 kg BMI ile 50,7 kg / m 2 ve 2) 35 yaşındaki kadın hasta bir BMI ile 62 yaşındaki erkek hasta, / 2 m. Deneyler hem yağ bölmeleri ile yapılabilir, ancak bu videonun amacı için bir yağ bölmeye sınırlı kalmıştır. Videonun teknik özellikleri, hastanın 1 ile yapıldı ve FABP4 immünofloresan hasta 2 dediferansiye hücreleri ile gerçekleştirildi.
1. Örnek İşleme
- Laparoskopik obezite cerrahisi sırasında omentum ve deri altı yağ bölmelerden yağ dokusu toplamak için cerrahlara isteyin.
- Çabuk oda sıcaklığında laboratuvara yağ numuneleri getirmek ve hemen işleme.
- Steril olmayan bir atmosferde, laboratuarda sindirim yapın.hücreler daha sonra kültür odasına aktarılır ve, steril koşullar altında kültive edilir. Kontaminasyonu önlemek için, sindirim önce distile ve filtre su ile KRH tampon hazırlamak ve bir filtrasyon (0.22 um filtresi) ile izleyin. Şişeye ve plaka hazırlanması için hücre kültürü kaputu etanol önce transferi ile iyice temizleyin tüpler.
- Önceden ağırlıklı çanak ve kayıt ağırlığı yağ dokusu yerleştirin. Parafine önce en az 24 saat boyunca oda sıcaklığında% 10 formalin tamponu içinde her bir doku numunesi (yaklaşık 1 cm2), bir parça düzeltildi. Immünohistokimyası deneyler için bu gömülü örneği (gösterilmemiştir tekniği) kullanın.
- (- Teknik gösterilmemiştir örneğin, gen ekspresyonu) bütün yağ dokuları üzerinde ileri çalışmalar için -80 ° C'de depolamadan önce sıvı azot içinde bir 50 ml tüp ve flash dondurularak başka bir parça yerleştirin.
2. kollajenaz sindirimi
- 50 ml'lik tu kalan yağ dokusu parçası yerleştirinsindirim için olabilir.
- Sindirme tüpü numunenin gramı başına kolajenaz (350 U / ml) ile takviye edilmiş KRH-WB 4 ml ilave edilir.
- Makasla yağ dokusu kıyma.
- 45 dakikalık bir kuluçka süresinin (en fazla 1 saat), bir çalkalayıcıda olmak üzere 37 ° C, 90 rpm, en fazla, kıyılmış adipoz doku süspansiyonu yerleştirin.
Adipositlerinde ve preadipositlerin 3. saflaştırılması
- Bir plastik geniş şişenin içine örgü 400 uM naylondan yağ birkaç parçaları ile saydam çözelti dökülür.
- Cımbız ile, naylon örgü hücre hazırlama ovmak ve KRH-WB 5 ml suyla yıkayın.
- Incelikle içinde plastik boru ve boru ucunda bağlı bir 60cc şırınga ile bir 50 ml tüp içine süzüldü hücre süspansiyonu aktarın.
- Olgun adipositlerle süspansiyon hücreleri yüzdürme ile tampon üst ulaşmasını sağlayan, yaklaşık 10 dakika bekletin.
- Yavaş yavaş 60cc enjektörler kullanılarak tüpün altındaki tampon aspirege emme.
- KRH-WB 20 ml yıkama ekleyin. 2 ek yıkama için adım 3.4 tekrarlayın.
- Hücre miktarına bağlı olarak, 5 ya da 10 ml'lik bir son hacme adiposit süspansiyon getirmek için tampon toplayın. 5. bölümünde adımlarla takibi.
- Arzu edildiği takdirde ayrıca, birinci hücre kültürü santrifüj ile 60cc şırınga (3000 rpm, RT, 5 dk) ile toplanmış tampon stromal vasküler kısmını kurtarma (tekniği gösterilmemiştir).
4. Olgun Adiposit Hücre Sayısı
- Yük bir sayım odasında (hemositometre) hafifçe sarsıldı adiposit süspansiyonu 10 ul. Dört nüsha olarak hücre sayısını yapın.
- Izole olgun hücrelerin sayısını hesaplayın.
T-25 şişesi içine 5. Olgun Adiposit farksızlaşma
- DMEM / F12-20% buzağı serumu ile hacminin ¾ 25 cm 2 doku kültürü şişesi doldurun.
- Hücre sayımı göre, balona 500.000 olgun hücreleri dökün.
- Tam ortam ile 50 ml tüp kullanarak balon doldurun ve mümkün olduğu kadar çok kabarcıklarını çıkarmak.
- Şişenin üzerindeki unvented kapağı vidalayın.
- Kontaminasyonu önlemek için inkübasyon öncesinde etanol ile şişeyi temizleyin.
- Hücresel yapışmayı bozabilir kültür hareketi önlemek için dokunmadan baş aşağı bir hafta boyunca şişeyi inkübe.
- Ters kültür 7 gün balon tersine önce, hafifçe ani hareketlerinden kaçınmak, şişeyi işlemek ve aspirasyon şişeye tüm orta kaldırmak.
- DMEM-F12-20% buzağı serumu 12 ml ekleyin ve standart tekniklerle hücreleri yetiştirmek. Filtre edilmiş, havalandırmalı kapak şişeye ilave edilebilir.
6 yuvalı plaka içine 6. Olgun Adiposit farksızlaşma
- 6 gözlü bir plakanın her bir alt kısmında bir lamel yerleştirin
- Her lamel üstüne ½ "plastik burcu ekleyin.
- % 20 dana serumu-DMEM ortamı 8 ml ile kuyu doldurun.
- Her plastik burç üzerinde bir lamel koyun.
- Slayt ve slayt altında hücresinin enjekte edilmesi için bir tüp (oyuk başına 50,000 hücre) ile pipet ucu yerleştirin.
- Bir hafta boyunca% 5 CO2 ile 37 ° C 'de bir standart hücre kültürü inkübatöründe inkübe edin.
- Her bir göze% 20 dana serumu ile takviye edilmiş bir ortam 2 ml ihtiva eden ve takip kültüre ilişik hücrelerle Arka lamel.
- Hücreler immunfloresan dahil olmak üzere birçok amaçlar için dediferansiyonunu geçiren ile lamel kullanın (tekniği gösterilmemiştir).
Sonuçlar
Başlıca morfolojik değişimler dediferansiyasyon (Şekil 1) sırasında adipositleri olgun oluşur. Şekil 2'de gösterildiği gibi, farklılaşma bozukluğunun geçiren hücreler, floresan analizi için bir anti-FABP4 antikor ile boyandı. Fibroblast-benzeri hücrelerin bir çoğunluğu bu görülmemiştir yuvarlak morfoloji olan hücreler FABP4 proteini ifade etmiştir. Dediferansiyasyon sonra, DFAT hücreleri birkaç geçişleri için standart prosedürler ile yetiştirilebilir. İnsan omental ve deri altına DFAT hücre çizgileri için 15 kanallarına ulaşmak mümkün olmuştur (veriler gösterilmemiştir).
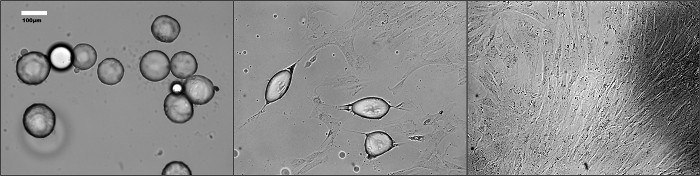
4 gün sonra (B), 7 gün kültür. Resimleri 12 günde (C) 'de bir süre (A) boyunca, olgun adipositlerin dedifferentiating Şekil 1. morfolojisi, bir faz-kontrast mikroskobunun ile inkübasyon sırasında farklı zaman noktalarında alınmıştıre. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
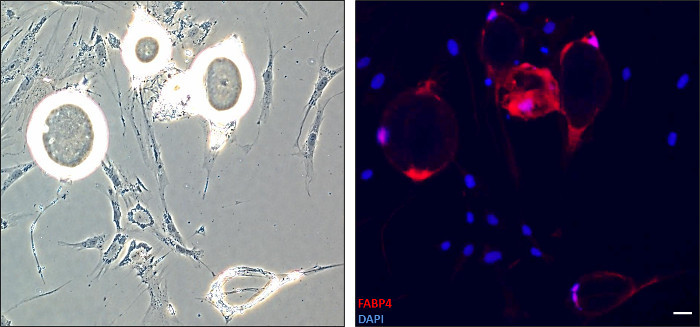
Adipositlerde FABP4 protein Şekil 2. Algılama dediferansiyonunu geçiren. Hücreler, farklılaşmanın giderilmesi için 13 gün sonra sabit ve immünofloresans anti-FABP4 antikor ile boyandı. Çekirdekler DAPI boyama ile görüntülendi. Sol: immünoflüoresans karşılık gelen aydınlık görüntü. Sağ: Birleştirilmiş görüntü gösterilir (FABP4-kırmızı, çekirdekler-mavi-10X). Uzatılmış hücreler ise yuvarlak morfoloji ekspres FABP4, olgun bir adiposit işaretleyici ile adipozitler artık bunu ifade. Ölçek çubuğu: 1 adet = 0.25mm bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
Tartışmalar
Tavan kültür tekniği ile olgun adipositlerin farksızlaşma yerli yağ dokusunun küçük bir örnek adipoz kök hücreleri elde etmek yeni bir yaklaşımdır. Deneyimlerimize ve diğerleri 2 bu göre, bir gram doku 25 cm2 bir balon plaka ve homojenliği Poloni ve arkadaşları 3 ile gösterilmiştir olan DFAT hücre popülasyonu elde etmek için yeterlidir. Adiposit farksızlaşma bağımsız olarak yaş, cinsiyet ve diğer özellikleri, herhangi bir donörden alınan hücrelerle mümkün görünüyor. DFAT elde çıkan nüfus arasında, bir kaç yuvarlak veya tamamen farksızlaştığı vermedi kısmen uzatılmış hücreler kalır. Onlar tripsin-medya karışımı yüzer gibi bu hücreler genellikle kültür geçitten atılır.
Bu hücrelerin multipotency kurulmuş ve hücre tedavisi 2,3 için onların kullanımını destekler. Bunların yüksek çoğalma kapasitesi de rapor edilmiştir ki bu ikök hücre uygulamaları 2 için hücre kültürü sa değerli yönü. İnsan DFAT hücreleri ile yapılan çalışmalar, bu da tekrar eden ve farklılaşma kapasitesi 18 göre aynı donörden ASC daha etkili olabileceğini göstermiştir. Son zamanlarda vaka çalışması DFAT hücreleri adipositler ve osteoblast içine ayırt etmek daha verimli ve aynı birey, obezite ve diyabet 18 ile bir donörden ASC daha yüksek telomeraz düzeyleri olduğunu desteklemektedir. Böylece, tavan kültürünün kullanımı zaten kullanılan ASC daha verimli yağ kök hücreleri sağlayabilir. Bununla birlikte, ilave deneyler açıkça bu noktayı belirlemek için önemlidir.
Bizim 6-yuvalı plaka tavan kültürü tekniği farksızlaşma prosesinin bir çalışma sağlar. Hücrelerin en az sayıda kaplanmış ve spesifik zaman noktalarında çalışma sağlar edilebilir. Örneğin, adipositler underg gelen immünofloresan gerçekleştirmek için bir 6-yuvalı plaka mikroskop lamı toplananmeler farksızlaşma (Şekil 2). Veya floresan olmayan, miscroscopy Sahne, dediferansiyasyon çeşitli yönlerini değerlendirmek için büyük önem taşımaktadır.
Kök hücre uygulamaları yanı sıra, DFAT hücreler fizyolojik çalışmalar için ilginç bir modelini temsil eder. Sadece bir kaç çalışmada, gen ekspresyonu ve her iki hücre tipinde işlevlerini incelenmiştir. Aynı yağ bölmeden kısa, ASC ve DFAT gen ifadesi ve salgılanması 4 benzerlikler gösterdi. Aynı vericiden alınan ASC ve DFAT arasında daha fazla karşılaştırmalar gereklidir.
Sonuç olarak, biz adipoz doku kollajenaz sindirim köklü teknik ve tavan kültür tekniği kullanılarak insan adipoz dokudan DFAT hücreleri elde etmek için nasıl bu teknik raporda göstermek. Bizim orijinal 6-plaka formatı daha yaygın kullanılan şişe yöntemi büyük populasyona üretimi için izin verir ise farksızlaşma süreci hakkında bilgi artırmaya yardımcı olabilirDFAT hücre saplamalar. Bu protokolün en önemli kısıtlılığı, hasta yazılı ve bilgilendirilmiş onam elde etmek için bir ameliyat ekibi ve etik yönetimi ile işbirliği dayanan insan yağ dokusu erişim olduğunu. Olgun hücreler manipülasyon önlemleri gerektiren son derece duyarlıdır. Bu en iyi sonuçları elde etmek için, protokol, özellikle T-25flask olarak kaplama için adipositlerin sayısı ve 6-yuvalı plaka formatı optimize edilmiş ve önemli bir ek modifikasyonlar ya da sorun beklenebilir.
Açıklamalar
The authors declare no conflict of interest.
Teşekkürler
This study was supported by Natural Sciences and Engineering Research Council of Canada Discovery Grant (371697-2011, AT). The authors want to acknowledge the help of bariatric surgeons Drs S. Biron, F-S. Hould, S. Lebel, O. Lescelleur, P. Marceau as well as Christine Racine and Caroline Gagnon from the IUCPQ Tissue Bank. We thank Mr Jacques Cadorette from the IUCPQ’s audiovisual services for video shooting and editing.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bovine serum albumine | Sigma | A7906 | |
| Adenosine | Sigma | A4036 | |
| Ascorbic acid | Sigma | A0278 | |
| NaCl | Any brand can be used | ||
| KCl | Any brand can be used | ||
| CaCl2 | Any brand can be used | ||
| MgCl2 | Any brand can be used | ||
| KH2PO4 | Any brand can be used | ||
| HEPES | Any brand can be used | ||
| Glucose | Any brand can be used | ||
| Type I collagenase | Worthington Biochemical Corp | LS-004196 | |
| DMEM/F-12, HEPES, no phenol red | Gibco-Life Technologies | 11039-021 | Add to medium : 20% calf serum, gentamicin (50 µg/ml) and fungizone (2.5 µg/ml) |
| Calf Serum, iron supplemented, from formula-fed calves | Sigma | C8056-500 ml | |
| 1/2 In plastic bushing | Iberville | 2704-CP | SKU:1000120918 (Home Depot) |
| Liquid nitrogen | Linde | ||
| Formalin soluton, neutral buffered, 10% | SIGMA | HT501128 | |
| Sterile tweezers | |||
| Sterile scissors | |||
| 60 cc syringes | BD Syringe | ||
| Plastic tubing | |||
| Krebs-Ringer-Henseleit stock buffer (KRH) | Prepare stock buffer as following: 25 mM HEPES pH 7.6, 125 mM NaCl, 3.73 mM KCl, 5 mM CaCl2.2H2O, 2.5 mM MgCl2.6H2O, 1 mM K2HPO4. Adjust pH to 7.4. | ||
| Krebs-Ringer-Henseleit-Working Buffer (KRH-WB) | Add the following components freshly to KRH buffer: 4% bovine serum albumin, 5 mM glucose, 0.1 µM adenosine, 560 µM ascorbic acid | ||
| KRH-WB supplemented with Type I collagenase | Add 350 U/ml of Type I collagenase | ||
| T25 unvented cap tissue culture flask | Sarsted or other brand | ||
| 6-well tissue culture plate | BD Falcon or other brand | ||
| Microscope cover glass 22x22 | Fisherbrand | 12-542-B | |
| Sterile beakers |
Referanslar
- Zhang, H. H., Kumar, S., Barnett, A. H., Eggo, M. C. Ceiling culture of mature human adipocytes: use in studies of adipocyte functions. J Endocrinol. 164 (2), 119-128 (2000).
- Matsumoto, T., et al. Mature adipocyte-derived dedifferentiated fat cells exhibit multilineage potential. J Cell Physiol. 215 (1), 210-222 (2008).
- Poloni, A., et al. Human dedifferentiated adipocytes show similar properties to bone marrow-derived mesenchymal stem cells. Stem Cells. 30 (5), 965-974 (2012).
- Perrini, S., et al. Differences in gene expression and cytokine release profiles highlight the heterogeneity of distinct subsets of adipose tissue-derived stem cells in the subcutaneous and visceral adipose tissue in humans. PLoS One. 8 (3), e57892(2013).
- Kishimoto, N., et al. The osteoblastic differentiation ability of human dedifferentiated fat cells is higher than that of adipose stem cells from the buccal fat pad. Clin Oral Investig. , (2013).
- Kou, L., et al. The phenotype and tissue-specific nature of multipotent cells derived from human mature adipocytes. Biochem Biophys Res Commun. 444 (4), 543-548 (2014).
- Jumabay, M., et al. Pluripotent stem cells derived from mouse and human white mature adipocytes. Stem Cells Transl Med. 3 (2), 161-171 (2014).
- Sugawara, A., Sato, S. Application of dedifferentiated fat cells for periodontal tissue regeneration. Hum Cell. 27 (1), 12-21 (2014).
- Kikuta, S., et al. Osteogenic effects of dedifferentiated fat cell transplantation in rabbit models of bone defect and ovariectomy-induced osteoporosis. Tissue Eng Part A. 19 (15-16), 1792-1802 (2013).
- Obinata, D., et al. Transplantation of mature adipocyte-derived dedifferentiated fat (DFAT) cells improves urethral sphincter contractility in a rat model. Int J Urol. 18 (12), 827-834 (2011).
- Jumabay, M., et al. Dedifferentiated fat cells convert to cardiomyocyte phenotype and repair infarcted cardiac tissue in rats. J Mol Cell Cardiol. 47 (5), 565-575 (2009).
- Ohta, Y., et al. Mature adipocyte-derived cells, dedifferentiated fat cells (DFAT), promoted functional recovery from spinal cord injury-induced motor dysfunction in rats. Cell Transplant. 17 (8), 877-886 (2008).
- Moreno-Navarrete, J. M. F. -r Ch. 2. Adipose Tissue Biology. Symonds, M. E. , Springer. 17-38 (2012).
- Poulos, S. P., Dodson, M. V., Hausman, G. J. Cell line models for differentiation: preadipocytes and adipocytes. Exp Biol Med (Maywood. 235 (10), 1185-1193 (2010).
- Casteilla, L., Penicaud, L., Cousin, B., Calise, D. Choosing an adipose tissue depot for sampling: factors in selection and depot specificity). Methods Mol Biol. 456, 23-38 (2008).
- Tchernof, A., Despres, J. P. Pathophysiology of human visceral obesity: an update. Physiol Rev. 93 (1), 359-404 (2013).
- Rodbell, M. Metabolism of Isolated Fat Cells. I. Effects of Hormones on Glucose Metabolism and Lipolysis. J Biol Chem. 239, 375-380 (1964).
- Watson, J. E., et al. Comparison of Markers and Functional Attributes of Human Adipose-Derived Stem Cells and Dedifferentiated Adipocyte Cells from Subcutaneous Fat of an Obese Diabetic Donor. Adv Wound Care. 3 (3), 219-228 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır