Method Article
Генерация жировой стволовых клеток через дедифференцировка зрелые адипоциты в потолочных культур
В этой статье
Резюме
Mature adipocytes may represent an abundant source of stem cells through dedifferentiation, which leads to a homogenous population of fibroblast-like cells. Collagenase digestion is used to isolate mature adipocytes from human fat. The goal of our protocol is to obtain multipotent, dedifferentiated fat cells from human mature adipocytes.
Аннотация
Mature adipocytes have been shown to reverse their phenotype into fibroblast-like cells in vitro through a technique called ceiling culture. Mature adipocytes can also be isolated from fresh adipose tissue for depot-specific characterization of their function and metabolic properties. Here, we describe a well-established protocol to isolate mature adipocytes from adipose tissues using collagenase digestion, and subsequent steps to perform ceiling cultures. Briefly, adipose tissues are incubated in a Krebs-Ringer-Henseleit buffer containing collagenase to disrupt tissue matrix. Floating mature adipocytes are collected on the top surface of the buffer. Mature cells are plated in a T25-flask completely filled with media and incubated upside down for a week. An alternative 6-well plate culture approach allows the characterization of adipocytes undergoing dedifferentiation. Adipocyte morphology drastically changes over time of culture. Immunofluorescence can be easily performed on slides cultivated in 6-well plates as demonstrated by FABP4 immunofluorescence staining. FABP4 protein is present in mature adipocytes but down-regulated through dedifferentiation of fat cells. Mature adipocyte dedifferentiation may represent a new avenue for cell therapy and tissue engineering.
Введение
In vitro dedifferentiation of mature adipocytes is achieved through a technique called ceiling culture1. Because of their natural tendency to float in aqueous solutions, isolated mature adipocytes adhere to the surface of an inverted flask fully filled with culture medium. Over a few days, cells modify their spherical morphology and become fibroblast-like cells. The resulting cells, called dedifferentiated fat (DFAT) cells, are multipotent2. Research articles on adipocyte dedifferentiation, especially on human cells, are limited. However, they have already provided interesting information regarding multipotency, cell phenotype and replicative capacity of DFAT cells2. Mature adipocytes originating from various fat compartments have been successfully dedifferentiated including those originating from human visceral and subcutaneous adipose tissues2-4. In addition to these depots, Kishimoto and collaborators sampled adipose tissue from the buccal fat pads and dedifferentiated adipocytes into DFAT cells5. Matsumoto and collaborators successfully generated subcutaneous DFAT cells from patients covering a wide range of ages, and the majority of cells had a high proliferative rate and less than 6% of senescence even after 10 passages in culture2.
DFAT cells have been successfully re-differentiated into several lineages, including adipogenic, osteogenic, chondrogenic and neurogenic lineages2,3,6. These cells express several embryonic stem cell markers such as Nanog and the four identified pluripotent factors Oct4, c-myc, Klf4 and Sox23. They also express markers specific to each of the three germ layers7. In addition, DFAT cells are similar to Bone Marrow-derived Mesenchymal Stem Cells (BM-derived MSC) based on their epigenetic signature3. Exploiting the stem cell capacity of DFAT cells, many groups have investigated their potential to treat or improve various diseases8,9. Improvements of pathologic conditions, such as infracted cardiac tissue, spinal cord injury and urethral sphincter dysfunction, have been observed with DFAT cell injections in rat models of disease10-12.
In addition to the stem cell properties of DFAT cells, they may represent a new cellular model for adipocyte physiology studies. The 3T3-L1 cell line is often used for this purpose as these cells differentiate into adherent, lipid-storing adipocytes under adipogenic stimulation13. However, these cells originate from mouse embryo tissue13. Also, depot-specificity cannot be investigated with this model and it may not fully reflect human adipocyte physiology14. Other laboratories work with isolated adipose cells from murine fat depots, but fat distribution is not dimorphic in mice and anatomical configuration of the rodent's abdominal cavity prevents from extrapolating directly to humans15. In order to study adipocytes in the context of the physiopathology of human obesity, consideration of body fat distribution and fat depot-specific differences has become essential16. Some limitations of primary preadipocyte cultures, including cell quantities obtained from adipose tissue biopsy samples and their senescence after a few passages in culture, created the need for alternate models. Perrini and collaborators investigated depot-specificity in gene expression of DFAT cells originating from visceral and subcutaneous fat and compared them to adipose-derived stem cells (ASC) from the same fat depot. They demonstrated that differences in gene expression and function where mainly found between depots than between cell types, suggesting that DFAT cells are physiologically close to ASC from the same depot. DFAT cells may represent an interesting alternative to available models for studies on fat distribution in the pathophysiology of human obesity. Moreover, ceiling culture is a promising method to obtain adult stem cells for tissue engineering purposes.
Here, we describe collagenase digestion, a widely-used technique to isolate mature adipocytes from the subcutaneous and/or visceral fat samples17, and the subsequent steps to perform ceiling culture and dedifferentiate these cells into multipotent, fibroblast-like cells.
протокол
Заявление по этике: проект был одобрен Комитетом по этике научно-исследовательского IUCPQ заключения до набора пациентов. Для целей настоящей статьи / видео, мы получили ткани от 2 пациентов: 1) 62-летний пациент с ИМТ 50,7 кг / м 2 и 2) 35-летняя женщина пациента с ИМТ 57 кг / м 2. Эксперименты может быть сделано с обеих жира отсеков, но были ограничены одной жира отсека для целей этого видео. Технические аспекты видео были выполнены с пациентом 1 и FABP4 иммунофлюоресценции была выполнена с дедифференцированных клеток от пациента 2.
1. Пример обработки
- Задать хирургов, чтобы собрать жировой ткани из сальника и подкожной клетчатки отсеков во время лапароскопической хирургии ожирения.
- Быстро довести образцы жировой в лабораторию при комнатной температуре и обрабатывают немедленно.
- Выполните пищеварение в лаборатории, в нестерильной обстановке.Клетки, в конечном счете быть переведен в культуральной комнате и культивировали в стерильных условиях. Чтобы избежать загрязнения, подготовить KRH буфер дистиллированной и отфильтрованной воды, а затем в фильтрации (0,22 мкм фильтр) до пищеварения. Тщательно чистые пробирки с этанолом предварительного передачи в капот культуре клеток на колбу и подготовки пластины.
- Поместите жировой ткани на предварительно взвешенный блюдо и записи веса. Fix небольшой кусочек каждого образца ткани (менее 1 см 2) в 10% буфера формалина при комнатной температуре в течение по крайней мере 24 часа до парафин. Используйте этот встроенный образец для иммуногистохимии экспериментов (техника не показано).
- Поместите другую часть в 50-мл пробирку и флэш-замораживание в жидком азоте перед хранением при -80 ° С для дальнейших исследований на всю жировой ткани (например, экспрессии генов - метод не показан).
2. Коллагеназа Пищеварение
- Поместите оставшиеся жировой ткани кусок в 50 мл Тубыть для пищеварения.
- Добавить 4 мл KRH-WB с добавкой коллагеназы (350 ЕД / мл) на грамм образца в пробирку пищеварения.
- Фарш жировой ткани с помощью ножниц.
- Поместите фарш жировой ткани подвеску в шейкере, 37 ° C, 90 оборотов в минуту максимум, для 45-минутной инкубации (максимум 1 час).
3. Очистка адипоцитов и преадипоциты
- Вылейте полупрозрачный решение с несколько кусков жира через 400 мкм нейлоновой сеткой в пластиковом стакане.
- С помощью пинцета, руб клеточный препарат на нейлоновую сетку и промыть 5 мл KRH-WB.
- Тонко передачи отфильтрованного клеточной суспензии в 50 мл пробирку с пластиковой трубки в ней, и 60 мл шприц прикрепленной на конце трубы.
- Пусть подвеска с зрелые адипоциты стоять в течение примерно 10 мин, позволяя клеткам, чтобы достичь вершины буфера путем размещения.
- Медленно аспирата буфер в нижней части трубки с помощью 60 мл СиринGE всасывания.
- Добавить 20 мл KRH-WB мыть. Повторите процедуру с шага 3.4 2 дополнительных промывок.
- Собирают буфер довести адипоцитов суспензии до конечного объема 5 или 10 мл, в зависимости от количества клеток. Проводить с шагом в разделе 5.
- Восстановление стромальных-сосудистой фракции из буфера собранных с 60 мл шприцом центрифугированием (3000 оборотов в минуту, РТ, 5 мин) для дальнейшего первичной культуры клеток при желании (метод не показан).
4. Зрелые Adipocyte сотовый Граф
- Добавить 10 мкл осторожно встряхивают адипоцитов, взвешенная в счетной камере (гемоцитометре). Выполните подсчет клеток в четырех.
- Рассчитать количество изолированных зрелых клеток.
5. Зрелые Adipocyte дедифференцировки в Т-25 колбу
- Заполните 25 см 2 культуре ткани колбу ¾ объема с DMEM / F12-20% телячьей сыворотки.
- По количеству клеток, залить 500 000 зрелых клеток в колбе.
- Заполните флягу полностью с помощью 50 мл трубку со средой и удалить как много пузырьков, как это возможно.
- Винт в закрытой крышки на колбу.
- Очистите колбу с этанолом до инкубации, чтобы избежать загрязнения.
- Выдержите колбу с ног на голову в течение недели, не касаясь его, чтобы избежать движения в культуре, которые могут нарушить клеточный приверженность.
- До вспять колбу 7 дней перевернутой культуры, мягко манипулировать колбу и удалить все среды в колбе путем аспирации, избегая резких движений.
- Добавить 12 мл DMEM,-F12-20% сыворотки теленка, и культивируют клетки с помощью стандартных методов. Фильтруют, вентилируемые колпачок может быть добавлен в колбу.
6. Зрелые Adipocyte дедифференцировки в 6-луночного планшета
- Поместите покровное на дно каждой лунки 6-луночного планшета с
- Добавить ½ "пластмассовую втулку на верхней части каждой покровное.
- Заполните скважин с 8 мл 20% телячьей сыворотки DMEM-среде.
- Положите покровное на каждом пластмассовую втулку.
- Вставка пипетки наконечник между стеклом и трубки для введения клеток в слайде (50000 клеток на лунку).
- Планшеты инкубируют в стандартном инкубаторе для клеточных культур при 37 ° С с 5% СО 2 в течение недели.
- Обратный покровное с прикрепленными клеток в каждую лунку, содержащую 2 мл среды с добавкой 20% телячьей сыворотки и проводить культуры.
- Использование покровное с клетки подвергаются дедифференцировку для нескольких целей, включая иммунофлюоресценции (метод не показан).
Результаты
Основные морфологические изменения происходят в зрелые адипоциты в течение дедифференцировки (рисунок 1). Как показано на фиг.2, клетки, проходящие дедифференцировку окрашивали анти-антитела FABP4 для флуоресцентного анализа. Клетки с круглым морфологии выразил белка FABP4 в то время как большинство фибробластоподобных клеток не сделал. После дедифференцировки, DFAT клетки могут быть выращены с помощью стандартных процедур нескольких местах. Мы смогли достичь более 15 проходов для человека сальниковой и подкожных клеточных линий DFAT (данные не показаны).
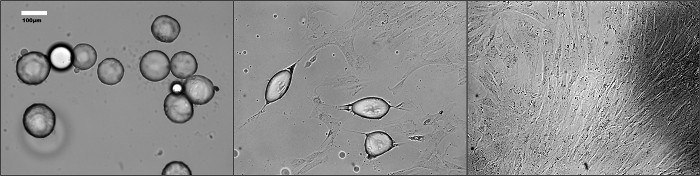
Рисунок 1. Морфология dedifferentiating зрелые адипоциты в течение долгого времени (A) на 4 дня (б) по 7 дней и (С) в 12 дней культуры. Фотографии были сделаны в разных временных точках при инкубации с использованием фазово-контрастного microscopе. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
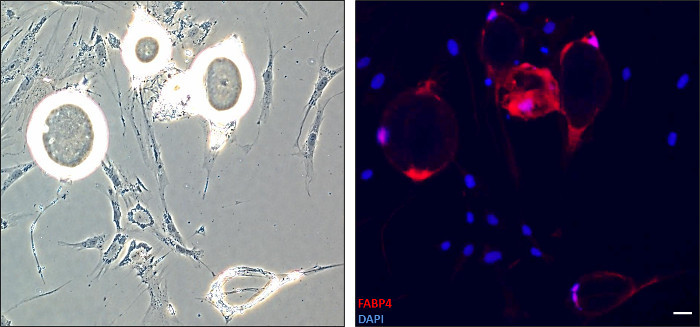
Рисунок 2. Обнаружение FABP4 белка в адипоцитах проходит дедифференцировку. Клетки фиксировали через 13 дней дифференцировке и окрашивали анти-антитела FABP4 для иммунофлуоресценции. Ядра визуализировали с окрашивания DAPI. Слева: Светлое образ, соответствующий иммунофлюоресценции. Справа: На объединенном изображении показано (FABP4-красный, ядер-сине-10X). Адипоциты с круглым морфологии экспресс FABP4, зрелой адипоцитов маркера, в то время как удлиненных клеток больше не выразить. Масштабная линейка: 1 единица = 0,25 Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Обсуждение
Дедифференцировка зрелых адипоцитов с техникой потолок культуры является новый подход для получения жировой стволовых клеток из небольшого образца родной жировой ткани. Основываясь на нашем опыте и опыте других 2, один грамм ткани достаточно пластине 25-см 2 колбу и получить население DFAT ячеек, для которых однородность была подтверждена результатами Полони и сотрудников 3. Adipocyte дедифференцировка представляется возможным с клетками из любой донор, независимо от их возраста, пола и других характеристик. Среди полученной популяции DFAT получены, остается несколько круглых или частично удлиненные клетки, которые не в полной мере дедифференцируются. Эти клетки, как правило, отбрасывают через проход культуры, как они плавают в смеси трипсин-носителя.
Мультипотентность этих клеток устанавливается и поддерживает их использование в клеточной терапии 2,3. Их высокая пролиферативная способность Сообщалось также, что яSA важный аспект культуры клеток для стволовых клеток Приложения 2. Исследования с клетками человека DFAT указали, что они могут быть более эффективными, чем ASC от того же донора, в зависимости от их репликативной и дифференциации мощностью 18. Недавнее исследование случай подтверждают, что DFAT клетки более эффективно дифференцировать в адипоциты и остеобласты, и имели более высокие уровни теломеразы, чем ASC от того же человека, донора с ожирением и сахарным диабетом 18. Таким образом, использование потолочной культуры может обеспечить более эффективные жировой стволовых клеток, чем уже используемой ASC. Тем не менее, дополнительные эксперименты необходимы, чтобы четко оценить эту точку зрения.
Наша методика пластина потолок культура 6-а позволяет для изучения самого процесса дедифференцировки. Минимальное количество клеток может быть покрыты и позволяет для изучения конкретных временных точках. Например, мы собрали стекло микроскопа от 6-луночного планшета для выполнения иммунофлюоресценции из адипоцитов, undergйти дедифференцировка (Рисунок 2). Выполнение miscroscopy, с или без флуоресценции, является весьма актуальным для оценки различных аспектов дедифференцировки.
В дополнение к стволовых клеток приложений, DFAT клетки могут представлять собой интересную модель для физиологических исследований. Только несколько исследований исследовали экспрессию и функции обоих типов клеток генов. Короче говоря, ASC и DFAT из того же жира отсеке показали сходство в экспрессии генов и секреции 4. Еще сравнения между ASC и DFAT от того же донора необходимо.
В заключение, мы покажем в этом техническом докладе, как получить DFAT клетки из человеческой жировой ткани, используя устоявшуюся технику жировой ткани коллагеназы пищеварения и технику потолок культуры. Наш первоначальный формат пластина 6-а, может помочь повысить уровень знаний о процессе дедифференцировки в то время как более широко используется метод колбу позволяет для генерации больших популяций DFAT клеток. Основным недостатком этого протокола является доступ к жировой ткани, которая опирается на сотрудничество с хирургическая бригада и этики управления, чтобы получить пациента письменное информированное согласие. Зрелые клетки очень чувствительны, которая требует мер предосторожности в манипуляции. Мы оптимизировали протокол, в частности, число адипоцитов, чтобы быть покрыты в Т-25flask и формат 6-луночный планшет, чтобы получить оптимальные результаты и никаких серьезных дополнительные модификации или устранения не могут быть предусмотрены.
Раскрытие информации
The authors declare no conflict of interest.
Благодарности
This study was supported by Natural Sciences and Engineering Research Council of Canada Discovery Grant (371697-2011, AT). The authors want to acknowledge the help of bariatric surgeons Drs S. Biron, F-S. Hould, S. Lebel, O. Lescelleur, P. Marceau as well as Christine Racine and Caroline Gagnon from the IUCPQ Tissue Bank. We thank Mr Jacques Cadorette from the IUCPQ’s audiovisual services for video shooting and editing.
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine serum albumine | Sigma | A7906 | |
| Adenosine | Sigma | A4036 | |
| Ascorbic acid | Sigma | A0278 | |
| NaCl | Any brand can be used | ||
| KCl | Any brand can be used | ||
| CaCl2 | Any brand can be used | ||
| MgCl2 | Any brand can be used | ||
| KH2PO4 | Any brand can be used | ||
| HEPES | Any brand can be used | ||
| Glucose | Any brand can be used | ||
| Type I collagenase | Worthington Biochemical Corp | LS-004196 | |
| DMEM/F-12, HEPES, no phenol red | Gibco-Life Technologies | 11039-021 | Add to medium : 20% calf serum, gentamicin (50 µg/ml) and fungizone (2.5 µg/ml) |
| Calf Serum, iron supplemented, from formula-fed calves | Sigma | C8056-500 ml | |
| 1/2 In plastic bushing | Iberville | 2704-CP | SKU:1000120918 (Home Depot) |
| Liquid nitrogen | Linde | ||
| Formalin soluton, neutral buffered, 10% | SIGMA | HT501128 | |
| Sterile tweezers | |||
| Sterile scissors | |||
| 60 cc syringes | BD Syringe | ||
| Plastic tubing | |||
| Krebs-Ringer-Henseleit stock buffer (KRH) | Prepare stock buffer as following: 25 mM HEPES pH 7.6, 125 mM NaCl, 3.73 mM KCl, 5 mM CaCl2.2H2O, 2.5 mM MgCl2.6H2O, 1 mM K2HPO4. Adjust pH to 7.4. | ||
| Krebs-Ringer-Henseleit-Working Buffer (KRH-WB) | Add the following components freshly to KRH buffer: 4% bovine serum albumin, 5 mM glucose, 0.1 µM adenosine, 560 µM ascorbic acid | ||
| KRH-WB supplemented with Type I collagenase | Add 350 U/ml of Type I collagenase | ||
| T25 unvented cap tissue culture flask | Sarsted or other brand | ||
| 6-well tissue culture plate | BD Falcon or other brand | ||
| Microscope cover glass 22x22 | Fisherbrand | 12-542-B | |
| Sterile beakers |
Ссылки
- Zhang, H. H., Kumar, S., Barnett, A. H., Eggo, M. C. Ceiling culture of mature human adipocytes: use in studies of adipocyte functions. J Endocrinol. 164 (2), 119-128 (2000).
- Matsumoto, T., et al. Mature adipocyte-derived dedifferentiated fat cells exhibit multilineage potential. J Cell Physiol. 215 (1), 210-222 (2008).
- Poloni, A., et al. Human dedifferentiated adipocytes show similar properties to bone marrow-derived mesenchymal stem cells. Stem Cells. 30 (5), 965-974 (2012).
- Perrini, S., et al. Differences in gene expression and cytokine release profiles highlight the heterogeneity of distinct subsets of adipose tissue-derived stem cells in the subcutaneous and visceral adipose tissue in humans. PLoS One. 8 (3), e57892(2013).
- Kishimoto, N., et al. The osteoblastic differentiation ability of human dedifferentiated fat cells is higher than that of adipose stem cells from the buccal fat pad. Clin Oral Investig. , (2013).
- Kou, L., et al. The phenotype and tissue-specific nature of multipotent cells derived from human mature adipocytes. Biochem Biophys Res Commun. 444 (4), 543-548 (2014).
- Jumabay, M., et al. Pluripotent stem cells derived from mouse and human white mature adipocytes. Stem Cells Transl Med. 3 (2), 161-171 (2014).
- Sugawara, A., Sato, S. Application of dedifferentiated fat cells for periodontal tissue regeneration. Hum Cell. 27 (1), 12-21 (2014).
- Kikuta, S., et al. Osteogenic effects of dedifferentiated fat cell transplantation in rabbit models of bone defect and ovariectomy-induced osteoporosis. Tissue Eng Part A. 19 (15-16), 1792-1802 (2013).
- Obinata, D., et al. Transplantation of mature adipocyte-derived dedifferentiated fat (DFAT) cells improves urethral sphincter contractility in a rat model. Int J Urol. 18 (12), 827-834 (2011).
- Jumabay, M., et al. Dedifferentiated fat cells convert to cardiomyocyte phenotype and repair infarcted cardiac tissue in rats. J Mol Cell Cardiol. 47 (5), 565-575 (2009).
- Ohta, Y., et al. Mature adipocyte-derived cells, dedifferentiated fat cells (DFAT), promoted functional recovery from spinal cord injury-induced motor dysfunction in rats. Cell Transplant. 17 (8), 877-886 (2008).
- Moreno-Navarrete, J. M. F. -r Ch. 2. Adipose Tissue Biology. Symonds, M. E. , Springer. 17-38 (2012).
- Poulos, S. P., Dodson, M. V., Hausman, G. J. Cell line models for differentiation: preadipocytes and adipocytes. Exp Biol Med (Maywood. 235 (10), 1185-1193 (2010).
- Casteilla, L., Penicaud, L., Cousin, B., Calise, D. Choosing an adipose tissue depot for sampling: factors in selection and depot specificity). Methods Mol Biol. 456, 23-38 (2008).
- Tchernof, A., Despres, J. P. Pathophysiology of human visceral obesity: an update. Physiol Rev. 93 (1), 359-404 (2013).
- Rodbell, M. Metabolism of Isolated Fat Cells. I. Effects of Hormones on Glucose Metabolism and Lipolysis. J Biol Chem. 239, 375-380 (1964).
- Watson, J. E., et al. Comparison of Markers and Functional Attributes of Human Adipose-Derived Stem Cells and Dedifferentiated Adipocyte Cells from Subcutaneous Fat of an Obese Diabetic Donor. Adv Wound Care. 3 (3), 219-228 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены