Method Article
Génération de tissu adipeux humain cellules souches par dédifférenciation des adipocytes matures dans les cultures de plafond
Dans cet article
Résumé
Mature adipocytes may represent an abundant source of stem cells through dedifferentiation, which leads to a homogenous population of fibroblast-like cells. Collagenase digestion is used to isolate mature adipocytes from human fat. The goal of our protocol is to obtain multipotent, dedifferentiated fat cells from human mature adipocytes.
Résumé
Mature adipocytes have been shown to reverse their phenotype into fibroblast-like cells in vitro through a technique called ceiling culture. Mature adipocytes can also be isolated from fresh adipose tissue for depot-specific characterization of their function and metabolic properties. Here, we describe a well-established protocol to isolate mature adipocytes from adipose tissues using collagenase digestion, and subsequent steps to perform ceiling cultures. Briefly, adipose tissues are incubated in a Krebs-Ringer-Henseleit buffer containing collagenase to disrupt tissue matrix. Floating mature adipocytes are collected on the top surface of the buffer. Mature cells are plated in a T25-flask completely filled with media and incubated upside down for a week. An alternative 6-well plate culture approach allows the characterization of adipocytes undergoing dedifferentiation. Adipocyte morphology drastically changes over time of culture. Immunofluorescence can be easily performed on slides cultivated in 6-well plates as demonstrated by FABP4 immunofluorescence staining. FABP4 protein is present in mature adipocytes but down-regulated through dedifferentiation of fat cells. Mature adipocyte dedifferentiation may represent a new avenue for cell therapy and tissue engineering.
Introduction
In vitro dedifferentiation of mature adipocytes is achieved through a technique called ceiling culture1. Because of their natural tendency to float in aqueous solutions, isolated mature adipocytes adhere to the surface of an inverted flask fully filled with culture medium. Over a few days, cells modify their spherical morphology and become fibroblast-like cells. The resulting cells, called dedifferentiated fat (DFAT) cells, are multipotent2. Research articles on adipocyte dedifferentiation, especially on human cells, are limited. However, they have already provided interesting information regarding multipotency, cell phenotype and replicative capacity of DFAT cells2. Mature adipocytes originating from various fat compartments have been successfully dedifferentiated including those originating from human visceral and subcutaneous adipose tissues2-4. In addition to these depots, Kishimoto and collaborators sampled adipose tissue from the buccal fat pads and dedifferentiated adipocytes into DFAT cells5. Matsumoto and collaborators successfully generated subcutaneous DFAT cells from patients covering a wide range of ages, and the majority of cells had a high proliferative rate and less than 6% of senescence even after 10 passages in culture2.
DFAT cells have been successfully re-differentiated into several lineages, including adipogenic, osteogenic, chondrogenic and neurogenic lineages2,3,6. These cells express several embryonic stem cell markers such as Nanog and the four identified pluripotent factors Oct4, c-myc, Klf4 and Sox23. They also express markers specific to each of the three germ layers7. In addition, DFAT cells are similar to Bone Marrow-derived Mesenchymal Stem Cells (BM-derived MSC) based on their epigenetic signature3. Exploiting the stem cell capacity of DFAT cells, many groups have investigated their potential to treat or improve various diseases8,9. Improvements of pathologic conditions, such as infracted cardiac tissue, spinal cord injury and urethral sphincter dysfunction, have been observed with DFAT cell injections in rat models of disease10-12.
In addition to the stem cell properties of DFAT cells, they may represent a new cellular model for adipocyte physiology studies. The 3T3-L1 cell line is often used for this purpose as these cells differentiate into adherent, lipid-storing adipocytes under adipogenic stimulation13. However, these cells originate from mouse embryo tissue13. Also, depot-specificity cannot be investigated with this model and it may not fully reflect human adipocyte physiology14. Other laboratories work with isolated adipose cells from murine fat depots, but fat distribution is not dimorphic in mice and anatomical configuration of the rodent's abdominal cavity prevents from extrapolating directly to humans15. In order to study adipocytes in the context of the physiopathology of human obesity, consideration of body fat distribution and fat depot-specific differences has become essential16. Some limitations of primary preadipocyte cultures, including cell quantities obtained from adipose tissue biopsy samples and their senescence after a few passages in culture, created the need for alternate models. Perrini and collaborators investigated depot-specificity in gene expression of DFAT cells originating from visceral and subcutaneous fat and compared them to adipose-derived stem cells (ASC) from the same fat depot. They demonstrated that differences in gene expression and function where mainly found between depots than between cell types, suggesting that DFAT cells are physiologically close to ASC from the same depot. DFAT cells may represent an interesting alternative to available models for studies on fat distribution in the pathophysiology of human obesity. Moreover, ceiling culture is a promising method to obtain adult stem cells for tissue engineering purposes.
Here, we describe collagenase digestion, a widely-used technique to isolate mature adipocytes from the subcutaneous and/or visceral fat samples17, and the subsequent steps to perform ceiling culture and dedifferentiate these cells into multipotent, fibroblast-like cells.
Protocole
Déclaration éthique: Le projet a été approuvé par le Comité éthique de la recherche de IUCPQ avant le recrutement des patients. Aux fins de cet article / vidéo, nous avons obtenu deux tissus de patients: 1) un patient de 62 ans avec un IMC de 50,7 kg / m 2 et 2) à 35 ans, patiente avec un IMC de 57 kg / m 2. Des expériences peuvent être réalisées avec les deux compartiments de graisse, mais ont été limitées à un compartiment graisse aux fins de cette vidéo. Les aspects techniques de la vidéo ont été réalisées avec le patient 1 et FABP4 immunofluorescence a été effectuée avec des cellules dédifférenciées du patient 2.
Traitement de l'échantillon 1.
- Poser chirurgiens de recueillir le tissu adipeux des compartiments de gras de coiffe et sous-cutanée au moment de la chirurgie bariatrique laparoscopique.
- Vite, apportez des échantillons de tissu adipeux au laboratoire à température ambiante et traiter immédiatement.
- Effectuer digestion en laboratoire, dans une atmosphère non stérile. Leles cellules seront finalement transférés à la chambre de culture et cultivés dans des conditions stériles. Pour éviter la contamination, préparer tampon KRH avec de l'eau distillée et filtrée et suivre par une filtration (filtre de 0,22 pm) avant la digestion. Nettoyer soigneusement les tubes avec de l'éthanol avant le transfert dans la hotte de culture cellulaire pour flacon et la préparation de la plaque.
- Placez le tissu adipeux sur un plat pré-pondérée et le poids fiche. Correction d'un petit morceau de chaque échantillon de tissu (moins de 1 cm 2) dans un tampon de formaline à 10% à température ambiante pendant au moins 24 h avant inclusion dans la paraffine. Utilisez cet exemple intégré pour les expériences d'immunohistochimie (technique non représenté).
- Placez un autre morceau dans un tube de 50 ml et le flash-gel dans l'azote liquide avant de le ranger à -80 ° C pour de nouvelles études sur les tissus adipeux entiers (par exemple, l'expression des gènes - technique non représenté).
2. digestion à la collagénase
- Placez le morceau de tissu adipeux restant dans un ml tu 50être pour la digestion.
- Ajouter 4 ml de KRH-WB supplémenté avec de la collagénase (350 U / ml) par gramme d'échantillon dans le tube de digestion.
- Émincer le tissu adipeux avec des ciseaux.
- Placez suspension de tissu adipeux hachée dans un shaker, 37 ° C, 90 min au maximum, pour une incubation de 45 minutes (maximum 1 heure).
3. Purification des adipocytes et préadipocytes
- Verser la solution translucide avec quelques morceaux de graisse à travers un nylon 400 uM maillage dans un bécher en plastique.
- Avec des pincettes, frotter la préparation de cellules sur le filet de nylon et laver avec 5 ml de KRH-WB.
- Délicatement transférer la suspension cellulaire filtré dans un tube de 50 ml avec le tube en plastique et dans une seringue de 60 cc attaché à l'extrémité de la tubulure.
- Que la suspension avec adipocytes matures reposer pendant environ 10 min, ce qui permet aux cellules d'atteindre le sommet de la mémoire tampon par flottation.
- Aspirer lentement le tampon au fond du tube en utilisant 60cc Syrinaspiration ge.
- Ajouter 20 ml de KRH-WB pour se laver. Répétez l'étape 3.4 pour 2 lavages supplémentaires.
- Recueillir le tampon pour amener la suspension d'adipocytes à un volume final de 5 ou 10 ml, selon la quantité de cellules. Poursuivre avec les étapes de la section 5.
- Récupérer la fraction stroma-vasculaire de la mémoire tampon recueillies avec la seringue 60cc par centrifugation (3000 rpm, RT, 5 min) pour de plus amples culture de cellules primaires si désiré (technique non représenté).
4. adipocyte mature Cell Count
- Charge 10 pi de suspension doucement secoué adipocytaire dans une chambre de comptage (hémocytomètre). Effectuer le nombre de cellules en quatre exemplaires.
- Calculer le nombre de cellules matures isolés.
5. âge mûr adipocytes Dédifférenciation en flacon T-25
- Remplir une 25 cm 2 flacon de culture tissulaire à ¾ du volume avec du DMEM / F12-20% de sérum de veau.
- Selon le nombre de cellules, verser 500 000 cellules matures dans le ballon.
- Remplissez complètement le ballon en utilisant un tube de 50 ml avec un milieu et enlever autant de bulles que possible.
- Visser le bouchon sur le flacon non ventilé.
- Nettoyez le ballon avec de l'éthanol avant l'incubation pour éviter la contamination.
- Incuber le flacon tête en bas pendant une semaine sans le toucher pour éviter tout mouvement dans la culture qui peut perturber l'adhésion cellulaire.
- Avant d'inverser le ballon à 7 jours de culture inversé, manipuler délicatement le ballon et enlever tout milieu dans la fiole par aspiration, en évitant les mouvements brusques.
- Ajouter 12 ml de DMEM-F12-20% de sérum de veau et cultiver des cellules avec des techniques standards. A, bouchon à évent filtré peut être introduit dans le ballon.
6. âge mûr adipocytes Dédifférenciation dans une plaque à 6 puits
- Déposer une lamelle couvre-objet sur le fond de chaque puits d'une plaque à 6 puits
- Ajouter un ½ "bague en plastique sur le dessus de chaque lamelle.
- Remplir les puits avec 8 ml de 20% de milieu DMEM-sérum de veau.
- Mettez une lamelle sur chaque bague en plastique.
- Insérer la pointe de la pipette entre la coulisse et le tube d'injecter des cellules sous la diapositive (50 000 cellules par puits).
- Incuber les plaques dans un incubateur de culture cellulaire standard à 37 ° C avec 5% de CO 2 pendant une semaine.
- Lamelle inverse avec cellules attachées dans chaque puits de culture contenant 2 ml de milieux supplémentés avec du sérum de veau à 20% et de poursuivre.
- Utilisation de cellules subissant une lamelle dédifférenciation à plusieurs fins, y compris immunofluorescence (technique non représenté).
Résultats
Changements morphologiques importants se produisent en adipocytes matures au cours dédifférenciation (Figure 1). Comme le montre la Figure 2, les cellules subissant une dédifférenciation ont été colorées avec un anticorps anti-FABP4 pour l'analyse de fluorescence. Les cellules avec une morphologie ronde ont exprimé la protéine FABP4 alors que la majorité des cellules de fibroblastes n'a pas fait. Après dédifférenciation, DFAT cellules peuvent être cultivées avec des procédures standard pour plusieurs passages. Nous avons été en mesure d'atteindre plus de 15 passages pour omental humain que de lignées cellulaires sous-cutanés DFAT (données non présentées).
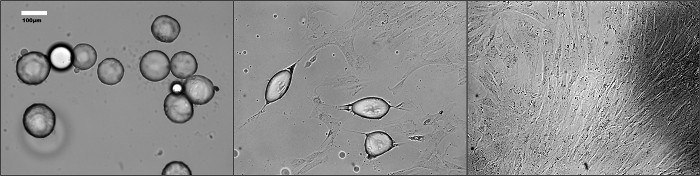
Figure 1. Morphologie des dé-différencier adipocytes matures au fil du temps (A) à quatre jours (B) à sept jours et (C) à 12 jours de culture. Les photos ont été prises à différents points de temps pendant l'incubation en utilisant un microscop à contraste de phasee. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
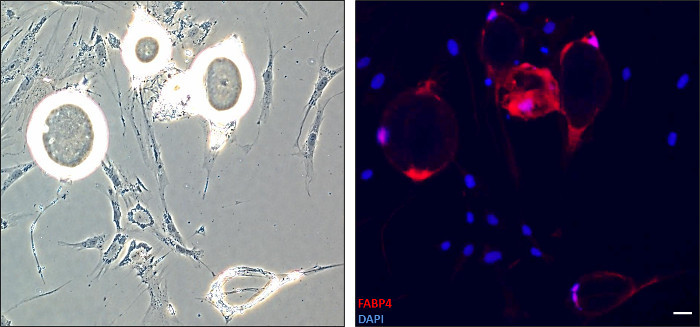
Figure 2. Détection de la protéine FABP4 dans les adipocytes en cours de dédifférenciation. Les cellules ont été fixées après 13 jours de dédifférenciation et colorées avec un anticorps anti-FABP4 pour immunofluorescence. Noyaux ont été visualisés avec coloration DAPI. Gauche: l'image de fond clair immunofluorescence correspondant. Droit: L'image fusionnée est montré (FABP4-rouge, noyaux-bleu-10X). Adipocytes ayant une morphologie ronde FABP4 express, un marqueur de adipocyte mature, tandis que les cellules ne sont plus allongés exprimer. Barre d'échelle: 1 unité = 0,25 Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Dédifférenciation des adipocytes matures avec la technique de culture de plafond est une nouvelle approche pour obtenir des cellules souches du tissu adipeux d'un petit échantillon de tissu adipeux natif. Basé sur notre expérience et celle des autres deux, un gramme de tissu est suffisante à l'assiette 2 flacon de 25 cm et d'obtenir une population de cellules DFAT pour lesquels l'homogénéité a été démontrée par Poloni et collaborateurs 3. Adipocyte dédifférenciation semble possible avec des cellules de tout donateur, indépendamment de leur âge, le sexe et d'autres caractéristiques. Dans la population résultante de DFAT obtenu, il reste un peu de cellules rondes ou allongées partie qui n'a pas entièrement dédifférencient. Ces cellules sont habituellement mis au rebut à travers le passage de la culture, ils flottent dans le mélange trypsine-media.
Multipotence de ces cellules est établie et prend en charge leur utilisation pour la thérapie cellulaire 2,3. Leur grande capacité de prolifération a également été signalé, ce qui iSA aspect précieux de culture cellulaire pour les applications de cellules souches 2. Études avec des cellules humaines DFAT ont indiqué qu'ils peuvent être plus efficaces que les ASC du même donneur, en fonction de leur capacité de réplicative et la différenciation 18. Une étude de cas récente soutient que les cellules DFAT étaient plus efficaces de se différencier en adipocytes et ostéoblastes, et avaient des niveaux plus élevés que la télomérase ASC du même individu, un donneur à l'obésité et le diabète 18. Ainsi, l'utilisation de la culture de plafond peut fournir des cellules souches adipeuses plus efficaces que l'ASC déjà utilisé. Cependant, des expériences supplémentaires sont nécessaires pour évaluer clairement ce point.
Notre 6 puits technique de culture du plafond de la plaque permet l'étude du processus de dédifférenciation lui-même. Un nombre minimal de cellules peut être plaqué et permet l'étude des points de temps spécifiques. Par exemple, nous avons recueilli la lame de microscope à partir d'une plaque à 6 puits pour effectuer immunofluorescence par les adipocytes undergdédifférenciation oing (figure 2). Exécution miscroscopy, avec ou sans fluorescence, est très pertinente pour évaluer divers aspects de dédifférenciation.
En plus de souches applications cellulaires, les cellules DFAT peuvent représenter un modèle intéressant pour les études physiologiques. Seules quelques études ont examiné l'expression et les fonctions des deux types de cellules gène. En bref, ASC et DFAT du même compartiment de graisse a montré des similitudes dans l'expression des gènes et la sécrétion 4. Plus de comparaisons entre les ASC et DFAT d'un même donneur sont nécessaires.
En conclusion, nous montrons dans ce rapport technique comment obtenir des cellules DFAT partir de tissu adipeux humain en utilisant la technique bien établie du tissu adipeux digestion de collagénase tissulaire et la technique de culture de plafond. Notre format original de plaque de 6 puits peut aider à accroître les connaissances sur le processus de dédifférenciation alors que la méthode du flacon plus communément utilisé permet la génération de grandes populations de cellules DFAT. La principale limite de ce protocole est l'accès aux tissus adipeux humain qui repose sur la collaboration avec une équipe de gestion de la chirurgie et de l'éthique d'obtenir le consentement écrit et éclairé du patient. Cellules matures sont très sensible qui nécessite des précautions dans la manipulation. Nous avons optimisé le protocole, en particulier le nombre des adipocytes être plaqué dans le T-25flask et le format de plaque à 6 puits, pour obtenir des résultats optimaux et aucune modification ou dépannage supplémentaires majeur peut être prévu.
Déclarations de divulgation
The authors declare no conflict of interest.
Remerciements
This study was supported by Natural Sciences and Engineering Research Council of Canada Discovery Grant (371697-2011, AT). The authors want to acknowledge the help of bariatric surgeons Drs S. Biron, F-S. Hould, S. Lebel, O. Lescelleur, P. Marceau as well as Christine Racine and Caroline Gagnon from the IUCPQ Tissue Bank. We thank Mr Jacques Cadorette from the IUCPQ’s audiovisual services for video shooting and editing.
matériels
| Name | Company | Catalog Number | Comments |
| Bovine serum albumine | Sigma | A7906 | |
| Adenosine | Sigma | A4036 | |
| Ascorbic acid | Sigma | A0278 | |
| NaCl | Any brand can be used | ||
| KCl | Any brand can be used | ||
| CaCl2 | Any brand can be used | ||
| MgCl2 | Any brand can be used | ||
| KH2PO4 | Any brand can be used | ||
| HEPES | Any brand can be used | ||
| Glucose | Any brand can be used | ||
| Type I collagenase | Worthington Biochemical Corp | LS-004196 | |
| DMEM/F-12, HEPES, no phenol red | Gibco-Life Technologies | 11039-021 | Add to medium : 20% calf serum, gentamicin (50 µg/ml) and fungizone (2.5 µg/ml) |
| Calf Serum, iron supplemented, from formula-fed calves | Sigma | C8056-500 ml | |
| 1/2 In plastic bushing | Iberville | 2704-CP | SKU:1000120918 (Home Depot) |
| Liquid nitrogen | Linde | ||
| Formalin soluton, neutral buffered, 10% | SIGMA | HT501128 | |
| Sterile tweezers | |||
| Sterile scissors | |||
| 60 cc syringes | BD Syringe | ||
| Plastic tubing | |||
| Krebs-Ringer-Henseleit stock buffer (KRH) | Prepare stock buffer as following: 25 mM HEPES pH 7.6, 125 mM NaCl, 3.73 mM KCl, 5 mM CaCl2.2H2O, 2.5 mM MgCl2.6H2O, 1 mM K2HPO4. Adjust pH to 7.4. | ||
| Krebs-Ringer-Henseleit-Working Buffer (KRH-WB) | Add the following components freshly to KRH buffer: 4% bovine serum albumin, 5 mM glucose, 0.1 µM adenosine, 560 µM ascorbic acid | ||
| KRH-WB supplemented with Type I collagenase | Add 350 U/ml of Type I collagenase | ||
| T25 unvented cap tissue culture flask | Sarsted or other brand | ||
| 6-well tissue culture plate | BD Falcon or other brand | ||
| Microscope cover glass 22x22 | Fisherbrand | 12-542-B | |
| Sterile beakers |
Références
- Zhang, H. H., Kumar, S., Barnett, A. H., Eggo, M. C. Ceiling culture of mature human adipocytes: use in studies of adipocyte functions. J Endocrinol. 164 (2), 119-128 (2000).
- Matsumoto, T., et al. Mature adipocyte-derived dedifferentiated fat cells exhibit multilineage potential. J Cell Physiol. 215 (1), 210-222 (2008).
- Poloni, A., et al. Human dedifferentiated adipocytes show similar properties to bone marrow-derived mesenchymal stem cells. Stem Cells. 30 (5), 965-974 (2012).
- Perrini, S., et al. Differences in gene expression and cytokine release profiles highlight the heterogeneity of distinct subsets of adipose tissue-derived stem cells in the subcutaneous and visceral adipose tissue in humans. PLoS One. 8 (3), e57892(2013).
- Kishimoto, N., et al. The osteoblastic differentiation ability of human dedifferentiated fat cells is higher than that of adipose stem cells from the buccal fat pad. Clin Oral Investig. , (2013).
- Kou, L., et al. The phenotype and tissue-specific nature of multipotent cells derived from human mature adipocytes. Biochem Biophys Res Commun. 444 (4), 543-548 (2014).
- Jumabay, M., et al. Pluripotent stem cells derived from mouse and human white mature adipocytes. Stem Cells Transl Med. 3 (2), 161-171 (2014).
- Sugawara, A., Sato, S. Application of dedifferentiated fat cells for periodontal tissue regeneration. Hum Cell. 27 (1), 12-21 (2014).
- Kikuta, S., et al. Osteogenic effects of dedifferentiated fat cell transplantation in rabbit models of bone defect and ovariectomy-induced osteoporosis. Tissue Eng Part A. 19 (15-16), 1792-1802 (2013).
- Obinata, D., et al. Transplantation of mature adipocyte-derived dedifferentiated fat (DFAT) cells improves urethral sphincter contractility in a rat model. Int J Urol. 18 (12), 827-834 (2011).
- Jumabay, M., et al. Dedifferentiated fat cells convert to cardiomyocyte phenotype and repair infarcted cardiac tissue in rats. J Mol Cell Cardiol. 47 (5), 565-575 (2009).
- Ohta, Y., et al. Mature adipocyte-derived cells, dedifferentiated fat cells (DFAT), promoted functional recovery from spinal cord injury-induced motor dysfunction in rats. Cell Transplant. 17 (8), 877-886 (2008).
- Moreno-Navarrete, J. M. F. -r Ch. 2. Adipose Tissue Biology. Symonds, M. E. , Springer. 17-38 (2012).
- Poulos, S. P., Dodson, M. V., Hausman, G. J. Cell line models for differentiation: preadipocytes and adipocytes. Exp Biol Med (Maywood. 235 (10), 1185-1193 (2010).
- Casteilla, L., Penicaud, L., Cousin, B., Calise, D. Choosing an adipose tissue depot for sampling: factors in selection and depot specificity). Methods Mol Biol. 456, 23-38 (2008).
- Tchernof, A., Despres, J. P. Pathophysiology of human visceral obesity: an update. Physiol Rev. 93 (1), 359-404 (2013).
- Rodbell, M. Metabolism of Isolated Fat Cells. I. Effects of Hormones on Glucose Metabolism and Lipolysis. J Biol Chem. 239, 375-380 (1964).
- Watson, J. E., et al. Comparison of Markers and Functional Attributes of Human Adipose-Derived Stem Cells and Dedifferentiated Adipocyte Cells from Subcutaneous Fat of an Obese Diabetic Donor. Adv Wound Care. 3 (3), 219-228 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon