Method Article
Yumuşak Agar koloni formasyon deneyi
Bu Makalede
Özet
The soft agar colony formation assay is a method used to confirm cellular anchorage-independent growth in vitro. The goal of this protocol is to illustrate a stringent method for the detection of the tumorigenic potential of transformed cells and the tumor suppressive effects of proteins on transformed cells.
Özet
Anchorage-independent growth is the ability of transformed cells to grow independently of a solid surface, and is a hallmark of carcinogenesis. The soft agar colony formation assay is a well-established method for characterizing this capability in vitro and is considered to be one of the most stringent tests for malignant transformation in cells. This assay also allows for semi-quantitative evaluation of this capability in response to various treatment conditions. Here, we will demonstrate the soft agar colony formation assay using a murine lung carcinoma cell line, CMT167, to demonstrate the tumor suppressive effects of two members of the Wnt signaling pathway, Wnt7A and Frizzled-9 (Fzd-9). Concurrent overexpression of Wnt7a and Fzd-9 caused an inhibition of colony formation in CMT167 cells. This shows that expression of Wnt7a ligand and its Frizzled-9 receptor is sufficient to suppress tumor growth in a murine lung carcinoma model.
Giriş
Yumuşak Agar koloni formasyon deneyi yaygın in vitro hücresel dönüşümü değerlendirmek için kullanılan bir tekniktir. Tarihsel olarak, Puck ve diğ., 1956 yılında bir deney, klonojenik analiz, koloniler 1 oluşturmak için hücre yeteneğini değerlendirmek için kullanıldı. Bu teknikte, hücreler, kültür plakası üzerine dağıtılmıştır ve gerektiğinde büyüme faktörleri temin etmek üzere "besleyici" hücreler ya da şartlandırılmış ortam varlığında yetiştirilir. Bu tekniğin sınırlama sadece koloni oluşumu ile ilgili bilgi verdi oldu. Normal hücreler nedeniyle anoikis 2 olarak apoptotik ölümden belirli bir tür için, ankrajdan bağımsız büyüme engellenir. Bununla birlikte, dönüştürülmüş hücreler, bir alt-tabakaya bağlanma olmaksızın, büyüme yeteneği ve bölme vardır. Bu kavram yararlanmak için, araştırmacılar yumuşak agar koloni formasyonu testi geliştirdi. Yumuşak Agar koloni formasyon deneyi yana sp gidermek için, daha yakın yıllarda, değiştirilmişecific ihtiyaçları. Bir varyasyon yüksek verimli koloni sayımı için izin florometrık boya dahil edilmesini içerir. Başka bir varyasyon proteini ya da DNA numuneleri gerekli olduğunda koloni oluşumu ile işaretlemeden sonra yaşayabilir hücreler bulunmaya izin vermek için özel bir agar çözeltisi kullanılmasını içerir.
Geleneksel yumuşak agar koloni formasyon deneyi, hücreler, hücre kültür ortamı ile karıştırılmış yumuşak agar, bir başka tabaka üzerinde bulunur, hücre kültür ortamı ile karıştırılmış, yumuşak bir agar tabakası içinde yetiştirilen ama agar daha yüksek bir konsantrasyonunu ihtiva eden edilir. Bu kültür plakasına yapışmasını hücreleri engeller, ama görünür koloniler oluşturmak üzere hücrelerin transforme sağlar. Bu tekniğin arkasındaki mantık, normal hücrelerin büyümesine ve bölmek mümkün hücre dışı matris temas hücreye bağlı olmasıdır. Tersine, dönüştürülmüş hücrelerin büyümesine ve ne olursa olsun, çevresini bölmek yeteneğine sahiptir. Bu nedenle, bir ankrajdan bağımsız bir şekilde bunların koloni oluşturabilme özelliklerini hücreleri ° C,onsidered dönüştürülmüş ve kanserojen olması. Bu yöntemin genel amacı, bir yarı-niceliksel ve sıkı şekilde hücreler, bu yeteneği ölçmektir.
Wnt sinyal yolu embriyogenezin kritik ve genellikle tumorigenezden 3-6'da de-regüle olduğunu. Wnt sinyal ile ilişkili birden fazla yol vardır. Kanonik yolu transkripsiyonel koaktivatör beta-katenin üzerindeki etkileri aracılığıyla Wnt sinyalizasyon ve aşağı gen transkripsiyonu düzenlenmesini içerir. Wnts aynı zamanda, örneğin, bir kaç kurallı olmayan yollar aracılığıyla sinyal, endoplazmik retikulum 8 kalsiyum salınımını regüle iskelet yapısı 7 içinde yer alan elemanları düzenleyen düzlemsel hücre kutup yolu, ve Wnt-kalsiyum yolağı. Wnt ligandlar Frizzled reseptörlere bağlanma yoluyla faaliyetlerini gösterirler. Birkaç Wnts akciğer kanserinde yukarı-regüle edilmesi gösterilmiş olmasına rağmen, Wnt7a olmayan Smal aşağı-regüle edilmesi gösterilmiştirpromotör metilasyonu ile 9 l hücreli akciğer kanseri. Wnt7a olmayan bir kurallı yolu aracılığıyla bir tümör baskılayıcı olarak Fzd9 ve eylemleri bağlar. Wnt-7a ve FZD-9 restorasyonu küçük hücreli olmayan akciğer kanseri hücreleri 10 büyümesini inhibe eder. Wnt7a / Fzd9 etkileri ERK-5, sırayla, peroksizom proliferatörünün aktive ettiği reseptör γ yi (PPARy), 11,12 aktivasyonu ile aracılık eder. Burada, Wnt7a ve Fzd9 fazla sentezlenmesi bir murin akciğer karsinoma hücre çizgisinin ankrajdan bağımsız büyümenin bastırılması ile sonuçlandığı göstermektedir. Murin CMT167 hücreleri, C57BL / lcrf farelerde 13 bir akciğer karsinomu elde edilmiştir ve kalıcı bir şekilde Wnt7A ve Fzd9 ile transfekte edilmiştir. Wnt7A ve Fzd9 aşırı ekspresyonu nicel PCR (Q-PCR) ile Wnt7A ve Fzd9 aşırı ifadesinin işlevselliği ile teyit edildi PPARy alt baş aktivasyonu sureti ile teyit edilmiştir.
Protokol
Materyaller ve Reaktifler 1. hazırlanması
- Etiket, bir doku kültürü içinde her bir oyuğa her bir hücre hattı veya bir durum için uygun bir 6-yuvalı plaka tedavi araştırılmaktadır.
- Toz ortamın 1 g ve 50 ml lik bir son hacme kadar deiyonize su içinde bir sodyum bikarbonat, 0.2 g çözülmesiyle 2x hücre kültürü ortamı hazırlayın.
- Sterilize etmek için bir 0.2 mikron filtre içinden bu orta geçirin.
- Ilgi konusu hücre çizgisinin normal kültür için gerekli ek bileşenler ekleyin. Örneğin,% 10 FBS ve% 1 penisilin / streptomisin solüsyonu ile takviye edilmiş RPMI 1640 ortamı içinde CMT 167 hücre çizgisi büyür. Kullanmak için sıcak su banyosu içinde 37 ° C'ye ısınmaya orta önce.
- Eğer söz konusu hücre çizgisinin, normal hücre kültürü için olduğu gibi ayrı ayrı 1x hücre kültür ortamı hazırlayın.
- Deiyonize su asil agar 100 ml 1 g ekleyerek% 1 asil agar hazırlayın.
NOT: Noble Agar yalnız ajitasyon tamamen çözülür olmaz. - Hazırlamak% 0.6 deiyonize edilmiş su, 100 ml ağarla 0.6 g eklenerek ağarla. Her iki agar solüsyonları, uzun süreli depolama için kapatılabilir bir kapak 100 ml bir cam şişe içinde yapılabilir.
- Sterilize etmek asil agar karışımları otoklavlayın. Bu karışımlar, önceden yapılmış ve 4 ° C'de saklandı, ancak, agar tamamen çözülene kadar Deney zamanında yeniden ısıtılması gerekmektedir edilebilir.
- 1000 ml nihai hacme kadar H2O PO 4 HPO 4 1x PBS (8 gr NaCl, 0.2 g KCI, 1.44 g 2 Na 1 mg / ml'lik bir stok solüsyonu yaparak nitro mavi tetrazolyum klorür çözeltisi hazırlanmakta ve 0.24 g KH 2 ). Bu, örneğin koloni boyamak için deney sonunda kullanılacaktır.
Agar Alt Katmanı 2. Kaplama
- Yaklaşık 1-2 dakika boyunca% 1 asil agar ve mikrodalga şişesinin kapağını gevşetin. Bir mikrodalga ısıtırken, üzerine kaynar önlemek için yakından çözümünün takipçisi. Aralıklı karıştırma sırasında, ısıtma, Devamagar tamamen çözülene ve kadar çözelti açıktır.
NOT: ısıttıktan sonra şişeyi işlemek için ısıya dayanıklı eldiven kullanın. Aksi takdirde yanığına veya ciddi yaralanmalara neden olabilir. - Sıcak musluk suyu (42 ° C) ile dolu bir buz kovası erimiş agar çözeltisi ve önceden ısıtılmış 2x kültür ortamı yerleştirin. Ayrıca sıcak su ile buz kovası bir tüp tutucu bir 50 ml konik tüp yerleştirin. Sonraki adımlar için hücre kültürü kaputu kova aktarın.
- Agar alt tabaka için, bir 6-yuvalı plaka içinde çukur başına bir agar karışımı, orta, 1.5 ml gerekir.
- Karışımının yeterli bir miktarını temin etmek üzere, her bir 6-yuvalı plaka için 12 ml 'lik bir toplam hazırlar.
- 50 ml'lik konik tüpe kültür ortamı 6 ml ve% 1 asal ağar çözeltisi daha sonra 6 ml ekleyerek başlayın.
- Karıştırmak için konik tüpü birkaç kez ters çevirin. Tempolu bir tempoda çalışan yumuşak ağar erken sertleşmesine engel olacaktır.
- 5 ml serolojik pi karışımın içine yaklaşık 5.5 ml çizinPette.
- Hava kabarcıkları her kuyuya, bu karışımın 1.5 ml kaplanmasından önce pipet sütunun üstüne yükselmesine izin verir. Plaka kuyuların içine herhangi bir hava kabarcığı birikmesini önlemek için dikkatli kullanın.
- Plakaları kapak ve ağar karışım 30 dakika için, hücre kültürü kaputu, oda sıcaklığında katılaşacağı için olanak sağlar.
3. Kaplama Agar İçeren Hücreleri Üst Katman
- Agar alt tabaka katılaştıktan sonra, üst tabakanın hazırlanmasını başlar.
- (Tripsin 1 ml örneğin orta 4 ml) kültür ortamı içinde 5, 15 ml konik bir tüp içinde: İlk olarak, tripsinizasyon ile hasat hücreleri ve onları: 1 seyreltin.
- Hücre sayımı ve bu süre zarfında, bir nihai hücre süspansiyonunu hazırlamak için oyuk başına gerekli olan hücre sayısını hesaplayın. Bu sayı, hücre tipine bağlı olarak değişecektir. 5,000 hücre / sıra bir başlangıç noktası kullanmak ve gerektiği gibi ayarlayın. Bu hücre sayısı için, örneğin, her bir wel (6667 hücre / ml'lik bir hücre süspansiyonunu hazırlamakL Bu süspansiyonun 0.75 ml ve 1.5 ml toplam hacim için agar 0.75 ml alır; 5,000 olan bir nihai toplam hücre sayısı) 2: hücrelerin konsantrasyonu da 1 seyreltilir.
- 6 gözlü bir plakanın her bir kuyucuğu başına gerekli olan hücre süspansiyonu hacmi tekrar 1,5 ml olacaktır. 6 plaka başına 12 ml toplam ek hücre süspansiyonu hazırlayın.
- Yukarıdaki gibi, bir mikrodalga% 0.6 agar çözeltisi eritin ve bir tüp tutucuya 50 ml konik bir tüp ve Adım 3,3 nihai hücre süspansiyonu ile birlikte sıcak su ihtiva eden buz kovası içine koyun.
- Sonraki adımlar için hücre kültürü kaputu erimiş% 0.6 agar ile buz kovası aktarın.
- 6-çukurlu plaka başına 12 ml'lik toplam hacim hazırlanması, 1: 1 oranında% 0.6 agar ve hücre süspansiyonu karıştırılır. 1.5 mi oyuk başına gerekli olacak, fakat ek olarak, yukarıda yapılmalıdır.
- Pipet 50 ml konik bir tüp içine hücre süspansiyonu 6 ml.
- Sonra, tüpe% 0.6 agar, 6 ml ilave ediniz.
NOT: Bu karışımın sıcaklığı olmalıdırerken sertleşmesine önlemek ve hücre canlılığını maksimize etrafında 42 ° C tuttu. - Pipet hücreleri dağıtmak için bu karışımı 2-3x, hızlı çalışma, daha sonra 5 ml serolojik pipet karışımın içine 5.5 ml kadar çizin.
- Herhangi bir hava kabarcığı her kuyuya, bu karışımın 1.5 ml kaplanmasından önce pipet sütunun üstüne yükselmesine izin verir. Plaka kuyuların içine herhangi bir hava kabarcığı birikmesini önlemek için dikkatli kullanın.
- Hücre / agar karışımı, 37 ° C sıcaklıkta nemlendirilmiş bir hücre kültürü inkübatöründe yerleştirmeden önce, 30 dakika süre ile, hücre kültürü kaputu, oda sıcaklığında katılaşacağı için izin verin.
- Yeterli koloni oluşumu için gereken süre, yaklaşık 21 gün, tipik olarak, her bir hücre hattı için değişir.
- Büyüme ortamının bir tabaka kuruma önlemek için üst agar tabakası üzerine muhafaza edilmelidir. Haftada iki kez ortam ilave 100 ul bu amaç için yeterlidir.
4. Plakaları Boyama ve Sayma Kolonileri
- 200 eklenerek Leke hücreleri _6; ve 37 ° C'de gece boyunca plakalar kuluçkaya nitro mavi tetrazolyum klorür solüsyonu ilave edin.
- Koloniler lekeli sonra, bir görüntüleme kullanılarak kuyuların fotoğraflarını çekmek ve görüntü analiz yazılımı kullanarak kolonileri saymayın.
Sonuçlar
Bizim yumuşak agar koloni formasyon deneyi ile gösterildiği gibi CMT167 hücrelerinde Wnt7A ve Fzd9 ekspresyonu tümör bastırılmasında etkindir. Başlangıçta, biz Wnt7A ve Fzd9 mRNA CMT167 hücrelerinde düşük seviyelerde eksprese olduğunu göstermek üzere, Q-PCR kullanılmıştır. MLE-12 hücreleri, bir SV40 ile dönüştürülmüş faregiller akciğer epitelyal hücre hattı (Şekil 1) ile karşılaştırıldığında CMT167 hücreleri, endojen Wnt7A ve Fzd9 düşük seviyeleri göstermişlerdir. Daha sonra, iki retrovirütik aşın vektörler Wnt7A ve Fzd9 (CMT LL Wnt7a / Fzd9) her iki ifade eden dengeli bir hücre dizisi oluşturmak için Wnt7A (LNCX-Wnt7A) ve Fzd9 (LPCX-Fzd9) insan yapıları ifade eden CMT167 hücreleri transfekte edildi. Bu hücre hattı (Şekil 2) Q-PCR ile Wnt7A ve Fzd9 ifadesini teyit etmiştir. Daha önceki çalışmalar gösterildiği gibi, PPARy Wnt7A / Fzd9 sinyallemenin bir alt efektörüdür. Wnt sinyal yolları çeşitlidir. Bu nedenle, belirli Wnt ve FZD reseptörünün doğru ifadesi ve aktivasyon eşek olmalıdırÇevrede Wnt / FZD çifti ile aktive olduğu bilinen bir alt akışın kullanılarak sed. Wnt7A ve Fzd9 için PPARy bu nedenle seçildi. Bir PPARy tepki elementi içeren bir lusiferaz raportör yapısı ile boş vektörler (LNCX / LPCX) ya da Wnt7A / Fzd9 aşırı ifade CMT167 hücreleri transfekte edildi. Biz CMT167 LL Wnt7A / Fzd9 hücre hattı neredeyse altı kat artmış PPAR-RE aktivitesini (Şekil 3) olduğunu gösterdi. In vitro Wnt7A ve Fzd9 tümör baskılayıcı aktivitesi teyit etmek için, daha önce belirtildiği gibi, son olarak, bir yumuşak agar koloni formasyon deneyi gerçekleştirilmiştir. CMT167 vektörü ve ifade Wnt7A / Fzd9 stabil hücre hatları, yumuşak agar plakalarına kaplanmıştır ve 2-3 hafta boyunca koloni oluşturmak için izin verildi ifade. Wnt7A ve Fzd9 (Şekil 4) tümör baskılayıcı işlevi gösteren, vektör-transfekte edilmiş hücreler ile karşılaştırıldığında CMT167 LL Wnt7A / Fzd9 hücrelerinin önemli ölçüde daha az koloniler oluşturulmuştur. Resimlerde, tüm plakalar alınmış ve colonie edildis bir kamera ve görüntüleme yazılımı kullanılarak sayıldı.

Şekil 1: MLE-12 hücreleri ile karşılaştırıldığında CMT167 hücrelerinde Wnt7A ve Fzd9 mRNA seviyelerinin azalması Q-PCR analizi, GAPDH normalize Wnt7a ve Fzd9 mRNA seviyelerini belirlemek için gerçekleştirilmiştir.. CME167 murin akciğer karsinoma hücrelerinde düzeyleri 1.0 normalize hangi MLE-12 SV40-değiştirilmiş murin akciğer epitel hücrelerinde olanlar ile karşılaştırılmıştır. CMT167 hücreleri MLE-12 hücreleri ile karşılaştırıldığında Wnt7a (A) ve Fzd9 (B) mRNA düşük seviyeleri göstermişlerdir.

Şekil 2:. CMT167 LL Wnt7a / Fzd9 dengeli hücre çizgisi içinde Wnt7a / Fzd9 aşırı ekspresyonu Wnt7A / Fzd9 sabit bir aşırı ekspresyonu, insan yapılan, bir LN kullanılarak yapılmıştır CX retroviral vektörü. Q-PCR, Wnt7A ve Fzd9 uygulandı ve mRNA düzeyleri boş vektör ile trasfekte edilmiş hücreler ve Wnt7A / Fzd9 aşırı eksprese eden hücrelere de GAPDH normalize edildi. CMT167 LL Wnt7a / Fzd9 hücreleri Wnt7a (A) ve Fzd9 (B) mRNA yüksek seviyelerini ifade etti.
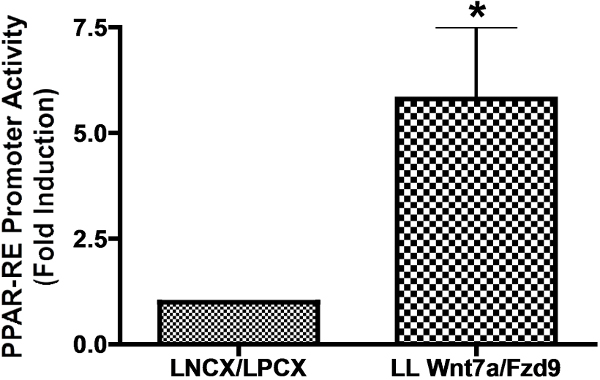
Şekil 3: CMT167 Wnt7a / Fzd9 stabil aşırı ifade eden hücre soyu sergiler, PPAR-RE promotör aktivitesi artmış CMT167 LL Wnt7a / Fzd9 veya boş vektör CMT167 LNCX / LPCX sabit bir aşırı ifade eden hücreler, Lipofektamin reaktifi kullanılarak bir PPAR yanıt elementi yükseltici lusiferaz plasmidi ile transfekte edilmiştir.. Promoter etkinliği, hızlandırıcı aktivitesi 1,0 göre normalize edildi vektör-transfekte edilmiş hücreler ile karşılaştırıldığında nicelleştirilmiştir. CMT167 LL Wnt7a / Fzd9 sabit bir aşırı ifade eden hücreler PPARy hızlandırıcı aktivitesinde yaklaşık altı katlık bir artış göstermiştir.

Şekil 4:. Hücrelerini aşırı eksprese eden hücrelerini aşırı eksprese eden vektör ifade CMT167 LNCX / LPCX hücreleri ve CMT167 LL Wnt7a / Fzd9 Yumuşak Ağar koloni formasyon deneyi vektör salgılayan CMT167 LNCX / LPCX hücreleri ve CMT167 LL Wnt7A / Fzd9 yumuşak agar kolonisi sırasının oluşumu ile kaplandı Protokol başına deney, yukarıda tarif edildiği. CMT167 LL Wnt7A / Fzd9 koloni oluşumu belirgin bir azalma göstermiştir. Her hücre hattı için koloniler gösteren Temsilcisi kuyular. Kuyuların resmi, üç bağımsız deneyi temsil etmektedir.
Tartışmalar
Sinyal gönderme proteinleri, tümör baskılayıcı fonksiyonu in vitro teyit de zordur. Bu özelliği araştırmak için mevcut en sıkı deneylerden biri yumuşak agar koloni formasyonu testtir. Burada, stabil bir şekilde, parental CMT167 hücre hattına göre Wnt7a ve Fzd9 aşırı ifade eden bir murin akciğer karsinoma hücre soyu kullanılarak, yumuşak agar koloni formasyon deneyi gösterdik.
Yumuşak agar tahlil ilgili dikkate alınması gereken birkaç önemli nokta vardır. Bu tahlilde en önemli nokta hücreleri kaplama edilir. Hücre sayımı doğru olmalıdır ve Agar çözeltisi çok sıcak olmamalıdır. Hiçbir koloniler oluşursa, hücreler stres ısı nedeniyle zarar görmüş olabilir. Bu durumda, tahlil, mümkün olduğu kadar 42 ° C'ye yakın agar sıcaklığı tutmak için önlemlerin alınması, tekrarlanmalıdır. Seçenek olarak ise, hücrelerin daha fazla sayıda kaplama olabilir.
Yumuşak agar tahlil için birkaç sınırlamalar vardır.Böyle bir sınırlama, tamamlanması için 2-3 hafta sürer olmasıdır. Bir diğeri tamamlandığında hücre alımı için izin vermiyor olmasıdır. Bu tekniğin modifikasyonları hücreleri tahlil tamamlanması üzerine DNA veya protein için hasat edilmesi için izin vermek için özel agar çözüm yollarına başvurmaktadır. Alternatif yöntemler, yüksek verimli bir deney için izin vermek için flüorometrik boya kullanır. Bununla birlikte, geleneksel yumuşak agar koloni formasyonu tahlil ankraj bağımsız hücre büyümesi onaylanması için en titiz testlerden biri olarak kalır.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This study was supported by a Merit Award from the U.S. Department of Veterans Affairs, and an NIH grant R01CA1385282522717 to RW.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cancer Cell Line of Interest | Sigma-Aldrich | 10032302 | CMT-167 Cells |
| Powdered RPMI 1640 Medium | Gibco | 31800-089 | Used to prepare 2x cell culture medium. |
| Liquid RPMI 1650 Medium | Cellgro | 10-040-CV | Referred to as 1x cell culture medium. |
| Fetal Bovine Serum | HyClone | SH30910.03 | Used to supplement cell culture medium. |
| Penicillin/Streptomycin | CellGro | 30-002-Cl | Used in cell culture medium. |
| Difco Noble Agar | BD Biosciences | 214230 | Used to prepare 1.0% and 0.6% agar. |
| Sodium Bicarbonate | Fisher | BP-328-1 | Used in 2x cell culture medium. |
| Trypsin | Cellgro | 25-050-Cl | |
| Sterile Bottle-Top Filters | Fisher | 09-761-126 | Used to sterile filter 2x medium. |
| Lipofectamine Reagent | Invitrogen | 18324-020 | Used in PPAR-RE luciferase assay. |
| 6-well Plates Tissue-culture Treated | |||
| 37 °C/5% CO2 Incubator | |||
| Chemi-Doc Imager | Bio-Rad | Used to take pictures of colonies. | |
| Quantity One Software | Bio-Rad | Used to count cell colonies. | |
| 15 ml Conical Tubes | |||
| 50 ml Conical Tubes | |||
| 250 ml Erlenmeyer Flasks | |||
| Microwave | |||
| 5 ml Serological Pipettes | |||
| Pipette Aid | |||
| Micropipette | |||
| Hemacytometer w/ cover slip | |||
| Pipette Tips | |||
| Inverted Light Microscope | |||
| Centrifuge | |||
| Heat-Resistant Gloves | |||
| Saran Wrap | |||
| Ice Bucket |
Referanslar
- Puck, T. T., Marcus, P. I., Cieciura, S. J. Clonal growth of mammalian cells in vitro; growth characteristics of colonies from single HeLa cells with and without a feeder layer. J Exp Med. 103, 273-283 (1956).
- Taddei, M. L., Giannoni, E., Fiaschi, T., Chiarugi, P. Anoikis: an emerging hallmark in health and diseases. The Journal of pathology. 226, 380-393 (2012).
- Wend, P., Holland, J. D., Ziebold, U., Birchmeier, W. Wnt signaling in stem and cancer stem cells. Semin Cell Dev Biol. 21, 855-863 (2010).
- Reya, T., et al. A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature. 423, 409-414 (2003).
- Klaus, A., Birchmeier, W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 8, 387-398 (2008).
- Clevers, H. Wnt/beta-catenin signaling in development and disease. Cell. 127, 469-480 (2006).
- Takahashi-Yanaga, F., Kahn, M. Targeting Wnt signaling: can we safely eradicate cancer stem cells. Clin Cancer Res. 16, 3153-3162 (2010).
- De, A. Wnt/Ca2+ signaling pathway: a brief overview. Acta Biochim Biophys Sin (Shanghai). 43, 745-756 (2011).
- Tennis, M. A., Vanscoyk, M. M., Wilson, L. A., Kelley, N., Winn, R. A. Methylation of Wnt7a is modulated by DNMT1 and cigarette smoke condensate in non-small cell lung cancer). PLoS One. 7, (2012).
- Winn, R. A., et al. Restoration of Wnt-7a expression reverses non-small cell lung cancer cellular transformation through frizzled-9-mediated growth inhibition and promotion of cell differentiation. J Biol Chem. 280, 19625-19634 (2005).
- Winn, R. A., et al. Antitumorigenic effect of Wnt 7a and Fzd 9 in non-small cell lung cancer cells is mediated through ERK-5-dependent activation of peroxisome proliferator-activated receptor gamma. J Biol Chem. 281, 26943-26950 (2006).
- Tennis, M. A., et al. Sprouty-4 inhibits transformed cell growth, migration and invasion, and epithelial-mesenchymal transition, and is regulated by Wnt7A through PPARgamma in non-small cell lung cancer. Mol Cancer Res. 8, 833-843 (2010).
- Steele, J. G., Rowlatt, C., Sandall, J. K., Franks, L. M. Cell surface properties of high- and low-metastatic cell lines selected from a spontaneous mouse lung carcinoma. Int J Cancer. 32, 769-779 (1983).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır