Method Article
Die Soft-Agar Koloniebildungstest
In diesem Artikel
Zusammenfassung
The soft agar colony formation assay is a method used to confirm cellular anchorage-independent growth in vitro. The goal of this protocol is to illustrate a stringent method for the detection of the tumorigenic potential of transformed cells and the tumor suppressive effects of proteins on transformed cells.
Zusammenfassung
Anchorage-independent growth is the ability of transformed cells to grow independently of a solid surface, and is a hallmark of carcinogenesis. The soft agar colony formation assay is a well-established method for characterizing this capability in vitro and is considered to be one of the most stringent tests for malignant transformation in cells. This assay also allows for semi-quantitative evaluation of this capability in response to various treatment conditions. Here, we will demonstrate the soft agar colony formation assay using a murine lung carcinoma cell line, CMT167, to demonstrate the tumor suppressive effects of two members of the Wnt signaling pathway, Wnt7A and Frizzled-9 (Fzd-9). Concurrent overexpression of Wnt7a and Fzd-9 caused an inhibition of colony formation in CMT167 cells. This shows that expression of Wnt7a ligand and its Frizzled-9 receptor is sufficient to suppress tumor growth in a murine lung carcinoma model.
Einleitung
Die Koloniebildung in Weichagar-Assay ist eine Technik häufig verwendet, um Zelltransformation in vitro zu bewerten. Historisch weiterer Assay, der klonogenen Assay von Puck et al. 1956 wurde verwendet, um die Fähigkeit der Zellen, um Kolonien zu bilden, 1 auszuwerten. In dieser Technik wurden die Zellen auf eine Kulturplatte verteilt und in Gegenwart von "Feeder" Zellen oder konditioniertes Medium die notwendigen Wachstumsfaktoren bereitzustellen gewachsen. Die Einschränkung dieser Technik war, dass es nur zur Verfügung gestellten Informationen über die Koloniebildung. Normale Zellen werden von verankerungsunabhängiges Wachstum gehindert, aufgrund einer bestimmten Art von apoptotischen Tod rief anoikis 2. Jedoch haben transformierten Zellen die Fähigkeit zu wachsen und sich zu teilen, ohne die Bindung an ein Substrat. Um auf diesem Konzept profitieren, entwickelten Forscher die Soft-Agar Koloniebildungstest. Die Koloniebildung in Weichagar-Assay seit modifiziert wurden, in den letzten Jahren zu sp adressierenecific Bedürfnisse. Eine Variante beinhaltet Einbau von fluorimetrischen Farbstoff für Hochdurchsatz-Koloniezählung zu ermöglichen. Eine weitere Variation ist die Verwendung von spezialisierten Agar-Lösung, um abgerufen zu der lebensfähigen Zellen nach der Koloniebildung zu ermöglichen, wenn Protein oder DNA-Proben notwendig.
Im herkömmlichen Koloniebildung in Weichagar-Assay werden die Zellen in einer Schicht von weichem Agar mit Zellkulturmedium, das auf einer anderen Schicht aus weichem Agar, auch mit Zellkulturmedium gemischt aufliegt gemischt angebaut, aber mit einer höheren Konzentration von Agar. Dies verhindert, dass Zellen aus dem Kulturplatte haften, noch erlaubt transformierten Zellen zu sichtbaren Kolonien zu bilden. Das Grundprinzip hinter dieser Technik ist, dass normale Zellen abhängen Zelle an extrazelluläre Matrixkontakt in der Lage, zu wachsen und zu verteilen. Umgekehrt transformierten Zellen die Fähigkeit haben, zu wachsen und sich zu teilen, unabhängig von ihrer Umgebung. Daher Zellen in der Lage, Kolonien in einer Verankerung unabhängig bilden waren considered transformiert und krebserregend. Das Gesamtziel dieses Verfahrens ist es, diese Funktion in Zellen in einem semi-quantitative und strenge Weise zu messen.
Der Wnt-Signalweg ist entscheidend in der Embryogenese und in der Tumorgenese 3-6 häufig dereguliert. Es gibt verschiedene Wege mit Wnt-Signalweg verbunden. Die kanonische Weg beinhaltet Wnt-Signalisierung und die Regulierung der Transkription stromabwärts über ihre Auswirkungen auf die transkriptionale Koaktivator beta-catenin. Wnts Signal auch durch einige nicht-kanonische Wege, beispielsweise die planare Zellpolarität Weg, die Elemente in Zytoskelettstruktur 7 beteiligt regelt, und der Wnt-Signalweg Calcium, die Freisetzung von Calcium aus dem endoplasmatischen Retikulum 8 regelt. Wnt-Liganden üben ihre Wirkung durch Bindung Frizzled-Rezeptoren. Obwohl mehrere Wnts wurde gezeigt, dass bei Lungenkrebs hochreguliert werden, hat sich gezeigt, Wnt7a in nicht-Smal herunterreguliert werden,l kleinzelligem Lungenkrebs durch Promotormethylierung 9. Wnt7a bindet FZD9 und wirkt als Tumorsuppressor durch eine nicht-kanonische Weg. Wiederherstellung der Wnt-7a und Frizzled-9 hemmt das Wachstum von nicht-kleinzelligen Lungenkrebszellen 10. Die Wirkungen von Wnt7a / FZD9 werden durch die Aktivierung von ERK-5, die wiederum aktiviert Peroxisom-Proliferator-aktivierten Rezeptor γ (PPAR) 11,12 vermittelt. Hier zeigen wir, dass die Überexpression von Wnt7a und FZD9 resultiert in der Unterdrückung des verankerungsunabhängigen Wachstums von einem murinen Lungenkarzinom-Zelllinie. Murine CMT167 Zellen wurden aus einem Lungenkarzinom in C57BL / lcrf Mäusen 13 abgeleitet und wurden stabil mit Wnt7a und FZD9 transfiziert. Eine Überexpression von Wnt7a und FZD9 wurden durch quantitative-PCR (Q-PCR) und der Funktionalität Wnt7a und FZD9 Expression bestätigt wurde durch nachgeschaltete Aktivierung von PPAR & ggr bestätigt.
Protokoll
1. Herstellung von Materialien und Reagenzien
- Beschriften Sie jede Vertiefung einer Gewebekultur behandelt 6-Well-Platte passend für jede Zelllinie oder der Zustand untersucht.
- Vorbereitung 2x Zellkulturmedium durch Auflösen von 1 g Pulver Medium und 0,2 g Natriumbicarbonat in entionisiertem Wasser auf ein Endvolumen von 50 ml.
- Geben dieses Medium durch ein 0,2-um-Filter sterilisiert.
- Hinzufügen zusätzlicher Komponenten für normale Kultur der Zelllinie von Interesse erforderlich ist. Zum Beispiel wachsen CMT 167 Zelllinie in RPMI 1640-Medium mit 10% FBS und 1% Penicillin / Streptomycin-Lösung ergänzt. Warme Medium auf 37 ° C in heißes Wasserbad vor der Verwendung.
- Bereiten 1x Zellkulturmedium getrennt, wie Sie es für die normale Zellkultur der Zelllinie von Interesse.
- Bereiten Sie 1% Edel Agar durch Zugabe von 1 g edlen Agar auf 100 ml VE-Wasser.
HINWEIS: Edel-Agar nicht vollständig unter Rühren alleine lösen. - Vorbereiten0,6% edle Agar durch Zugabe von 0,6 g Edel Agar in 100 ml entionisiertem Wasser. Beide Lösungen können Agar in 100 ml Glasflaschen mit verschließbarem Deckel für Langzeitlagerung erfolgen.
- Autoklaven wird das edle Agar Mischungen zu sterilisieren. Diese Gemische können im Voraus hergestellt werden und bei 4 ° C gelagert, sondern sollte zum Zeitpunkt des Experiments wieder erhitzt, bis Agar vollständig gelöst werden.
- Vorbereitung Nitroblautetrazoliumchlorid Lösung durch Herstellung einer 1 mg / ml Stammlösung in 1x PBS (8 g NaCl, 0,2 g KCl, 1,44 g Na 2 HPO 4 und 0,24 g KH 2 PO 4 in H 2 O auf ein Endvolumen von 1000 ml ). Dies wird am Ende des Experiments werden die Kolonien zu färben.
2. Überzug der Bodenschicht aus Agar
- Lösen Sie die Schutzkappe auf der Flasche von 1% Edel Agar und Mikrowelle für ca. 1-2 min. Unter Erhitzen in einer Mikrowelle, überwachen die Lösung eng zu vermeiden Überkochen. Weiter Heizung, beim Mischen mit Unterbrechungen,bis Agar vollständig gelöst und die Lösung klar ist.
HINWEIS: Verwenden Sie hitzebeständige Handschuhe, um Kolben nach dem Erhitzen zu behandeln. Geschieht dies nicht, kann Verbrennungen oder schweren Verletzungen führen. - Zeigen geschmolzen Agarlösung und vorgewärmten 2x Kulturmedium in einem Eiskübel mit heißem Leitungswasser (42 ° C) gefüllt. Legen auch eine 50 ml konischen Röhrchen in einem Rohrhalter im Eiskübel mit heißem Wasser. Übertragen Sie Eimer, um die Zellkultur Kapuze für nachfolgende Schritte.
- Für die untere Schicht aus Agar, benötigen Sie 1,5 ml einer Mischung aus Agar und Medium pro Vertiefung einer 6-Well-Platte.
- Um eine ausreichende Menge der Mischung zu gewährleisten, bereiten insgesamt 12 ml pro 6-Well-Platte.
- Gestartet durch Zugabe von 6 ml Kulturmedium, zu dem 50 ml konischen Röhrchen und dann 6 ml der 1% Edel Agarlösung.
- Kehren Sie die konischen Rohr mehrmals, um zu mischen. Arbeiten bei flottem Tempo wird ein vorzeitiges Aushärten des Soft-Agar zu verhindern.
- Auszuarbeiten etwa 5,5 ml Mischung in eine 5 ml serologische piPette.
- Lassen Sie die Luftblasen nach oben von Pipettensäule vor Hinterlegung 1,5 ml dieser Mischung in jedes Well steigen. Seien Sie vorsichtig, um die Ablagerung von Luftblasen in die Plattenvertiefungen zu vermeiden.
- Die Platten abdecken und lassen Agar Gemisch bei Raumtemperatur verfestigt, in Zellkulturhaube, für 30 min.
3. Überzug der oberen Schicht der Agar enthaltenden Zellen
- Nachdem die untere Schicht aus Agar sich verfestigt hat, beginnen Herstellung der oberen Schicht.
- Zuerst Ernte die Zellen durch Trypsinierung und verdünnte sie 1: 5 in Kulturmedium (zB 1 ml Trypsin, 4 ml Medium) in eine 15 ml konischen Röhrchen.
- Zählen von Zellen und die Berechnung der Anzahl der benötigten Zellen pro Vertiefung, um eine Zellsuspension zu dieser Zeit vorzubereiten. Diese Zahl wird je nach Zelltyp variieren. Verwenden 5.000 Zellen / Well als Ausgangspunkt und nach Bedarf anpassen. Aus diesem Zellzahl, können Sie eine Zellsuspension von 6667 Zellen / ml vorbereiten würde (dh jeden well werden 0,75 ml dieser Suspension und 0,75 ml des Agar mit einem Gesamtvolumen von 1,5 ml zu erhalten; 2 für eine endgültige Gesamtzellzahl von 5000): die Konzentration der Zellen wird auch 1 verdünnt werden.
- Das Volumen, die pro Vertiefung einer Platte mit 6 Vertiefungen Zellsuspension wird erneut 1,5 ml betragen. Bereiten Sie zusätzliche Zellsuspension in Höhe von 12 ml pro 6-Well-Platte.
- Schmelz 0,6% Agar-Lösung in einer Mikrowelle, wie oben und setzen in Eis Eimer mit heißem Wasser zusammen mit einem 50 ml konischen Röhrchen in einem Rohrhalter und der Zellsuspension aus Schritt 3.3.
- Übertragen Sie die Eiskübel mit geschmolzenem 0,6% Agar, um die Zellkultur Kapuze für nachfolgende Schritte.
- Mischungs 0,6% Agar und Zellsuspension in einem Verhältnis 1: 1, Herstellung eines Gesamtvolumens von 12 ml pro Platte mit 6 Vertiefungen. 1,5 ml pro Vertiefung wird erforderlich sein, aber Extra sollte wie oben durchgeführt werden.
- Pipette 6 ml der Zellsuspension in 50 ml konischen Röhrchen.
- Dann 6 ml 0,6% Agar in das Röhrchen.
HINWEIS: Die Temperatur dieser Mischung mussgehalten etwa 42 ° C, um ein vorzeitiges Härten zu vermeiden und das Überleben der Zelle zu maximieren. - Schnell arbeiten, Pipetten diese Mischung 2-3x um Zellen zu verteilen, dann erarbeiten 5,5 ml Mischung in eine 5 ml serologische Pipette.
- Lassen Sie eventuell vorhandene Luftblasen, um zum Anfang der Pipettensäule vor Hinterlegung 1,5 ml dieser Mischung in jedes Well steigen. Seien Sie vorsichtig, um die Ablagerung von Luftblasen in die Plattenvertiefungen zu vermeiden.
- Erlauben Zelle / Agar Gemisch bei Raumtemperatur, bevor sie in eine 37 ° C befeuchteten Zellkulturbrutschrank zu verfestigen, in Zellkulturhaube, für 30 min.
- Die angemessene Koloniebildung erforderliche Zeit variiert für jede Zelllinie, typischerweise etwa 21 Tage.
- Eine Schicht aus Wachstumsmedium sollte über die obere Agar-Schicht, um ein Austrocknen zu verhindern, aufrechterhalten werden. 100 ul Medium zweimal wöchentlich hinzugefügt ist für diesen Zweck ausreichend.
4. Die Färbung der Platten und das Zählen der Kolonien
- Flecken Zellen durch Zugabe von 200 _6; l Nitroblau-Tetrazolium-Chlorid-Lösung pro Well über Nacht bei 37 ° C inkubiert Platten.
- Sobald Kolonien gefärbt sind, fotografieren von Brunnen mit einem Imager und zählen Kolonien mit Bildanalyse-Software.
Ergebnisse
Der Ausdruck Wnt7a und FZD9 in CMT167 Zellen wirksam ist Tumorsuppression wie unsere Koloniebildung in Weichagar-Assay veranschaulicht. Vorbereitend, Q-PCR verwendeten wir zu zeigen, dass Wnt7a und FZD9 mRNA sind in geringen Mengen in CMT167 Zellen exprimiert. CMT167 Zellen zeigten geringe endogene Wnt7a und FZD9 Vergleich zu MLE-12-Zellen, eine SV40-transformierte murine Lungen-Epithel-Zelllinie (1). Dann transfiziert CMT167 Zellen mit zwei retroviralen Vektoren, die Überexpression menschlichen Konstrukte Wnt7a (LNCX-Wnt7a) und FZD9 (LPCX-FZD9), um eine stabile Zelllinie, die sowohl Wnt7a und FZD9 (CMT LL Wnt7a / FZD9) zum Ausdruck bringt. Wir bestätigten die Expression von Wnt7a und FZD9 durch Q-PCR in dieser Zelllinie (Figur 2). Da unsere bisherige Arbeit gezeigt hat, ist PPAR ein nachgeschalteter Effektor Wnt7a / FZD9 Signalisierung. Wnt Signalwege sind vielfältig. Deshalb muss die richtige Expression und Aktivierung eines bestimmten Wnt und seine Frizzled-Rezeptor Eseln seinSed mit einem nachgeschalteten Effektor, der dafür bekannt ist, durch den Wnt / Frizzled-Paar von Interesse aktiviert werden. Für Wnt7a und FZD9 wurde PPAR aus diesem Grund gewählt. Wir transfizierten CMT167 überexprimierenden Zellen leer Vektoren (LNCX / LPCX) oder Wnt7a / FZD9 mit einem Luciferase-Reporterkonstrukt, das eine PPAR-Response-Element. Wir haben gezeigt, dass unsere CMT167 LL Wnt7a / FZD9 Zelllinie hatte fast versechsfacht PPAR-RE-Aktivität (Abbildung 3). Schließlich wird, wie zuvor erwähnt, die Tumorsuppressor-Aktivität Wnt7a und FZD9 in vitro zu bestätigen, führten wir eine Weichagar-Koloniebildungs-Assay. CMT167 Vektor exprimieren und Wnt7a / FZD9 exprimierenden stabilen Zelllinien wurden auf weichen Agarplatten und dürfen Kolonien für zwei bis drei Wochen zu bilden. CMT167 LL Wnt7a / FZD9 Zellen gebildet deutlich weniger Kolonien, wenn sie Vektor transfizierten Zellen verglichen, die die Tumorsuppressor-Funktion Wnt7a und FZD9 (Abbildung 4). Bilder wurden von allen Platten genommen und Colonies wurden mit einem Bildwandler und Bildbearbeitungssoftware gezählt.

Abbildung 1: Vergleich zu MLE-12-Zellen Erniedrigte Wnt7a und FZD9 mRNA in CMT167 Zellen Q-PCR-Analyse wurde durchgeführt, um mRNA-Spiegel von Wnt7a und FZD9 normiert auf GAPDH bestimmen.. Levels in CME167 murinen Lungenkarzinomzellen wurden mit denen in MLE-12 SV40-transformierte murine Lungenepithelzellen, die auf 1,0 normiert wurden verglichen. CMT167 Zellen zeigten niedrigere Wnt7a (A) und FZD9 (B) mRNA im Vergleich zu MLE-12-Zellen.

Abbildung 2:. Die Überexpression von Wnt7a / FZD9 in CMT167 LL Wnt7a / FZD9 stabile Zelllinie Wnt7a / FZD9 stabile Überexpression menschliche Konstrukte wurden unter Verwendung eines LN gemacht CX retroviraler Vektor. Q-PCR wurde für Wnt7a und FZD9 geführt und mRNA-Spiegel wurden normalisiert auf GAPDH in leeren Vektor transfizierten Zellen und in Wnt7a / FZD9 überexprimierenden Zellen. CMT167 LL Wnt7a / FZD9 Zellen exprimiert hohe Wnt7a (A) und FZD9 (B) mRNA.
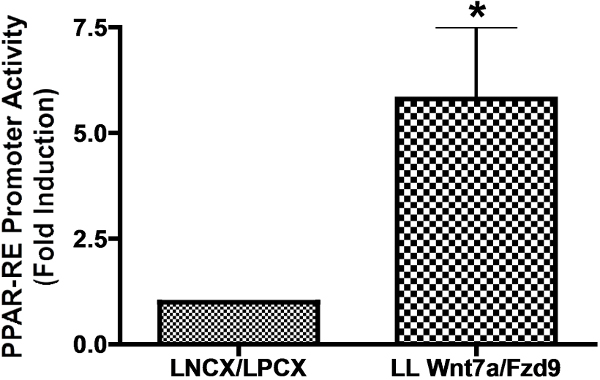
Figur 3: CMT167 Wnt7a / FZD9 stabil überexprimierende Zelllinie eine erhöhte PPAR-RE Promotoraktivität CMT167 LL Wnt7a / FZD9 oder leerem Vektor CMT167 LNCX / LPCX stabile überexprimierenden Zellen wurden mit einem PPAR-Response-Element-Promotor-Luciferase-Plasmid unter Verwendung von Lipofectamin-Reagens transfiziert.. Promotor-Aktivität wurde verglichen mit Vektor transfizierten Zellen, in denen die Promotoraktivität auf 1,0 normalisiert quantifiziert. CMT167 LL Wnt7a / FZD9 stabile überexprimierenden Zellen zeigten eine etwa sechsfache Erhöhung der PPAR-Promotoraktivität.

Fig. 4: Koloniebildung in Weichagar-Assay von Vektor-exprimierenden CMT167 LNCX / LPCX Zellen und CMT167 LL Wnt7a / FZD9 überexprimierenden Zellen Vektor exprimierenden CMT167 LNCX / LPCX Zellen und CMT167 LL Wnt7a / FZD9 überexprimierenden Zellen wurden in eine Koloniebildung in Weichagar plattiert Assay pro oben beschriebenen Protokoll. CMT167 LL Wnt7a / FZD9 Zellen zeigten eine deutliche Abnahme der Koloniebildung. Repräsentative Vertiefungen, die Kolonien für jede Zelllinie. Bild von Brunnen sind repräsentativ für drei unabhängige Experimente.
Diskussion
In vitro Bestätigung tumorsuppressive Funktion von Signalproteinen, ist schwierig. Eine der härtesten Tests zur Verfügung, um diese Eigenschaft zu untersuchen ist die Soft-Agar Koloniebildungstest. Hier haben wir die Koloniebildung in Weichagar-Assay unter Verwendung eines Maus-Lungenkarzinom-Zelllinie stabil überexprimieren Wnt7a und FZD9 Vergleich zu seinem Eltern CMT167 Zelllinie dargestellt.
Es gibt mehrere wichtige Punkte zu berücksichtigen hinsichtlich der Soft-Agar-Assays. Der wichtigste Schritt in diesem Assay wird Ausplattieren der Zellen. Zellzahlen müssen genau sein, und die Agar-Lösung darf nicht zu heiß sein. Wenn keine Kolonien gebildet sind, können die Zellen wurden durch Hitzebelastung beschädigt. In dieser Situation sollte der Test wiederholt werden, wobei Vorkehrungen zur Agar Temperatur nahe 42 ° C zu halten. Alternativ kann eine größere Anzahl von Zellen plattiert werden.
Es gibt einige Einschränkungen bei der Soft-Agar-Assays.Eine solche Einschränkung ist, dass sie zwei bis drei Wochen für die Fertigstellung. Ein weiterer Grund ist, dass es nicht zur Zellentnahme nach Abschluss ermöglichen. Modifikationen dieser Technik beschäftigen Fach Agar Lösungen ermöglichen Zellen für DNA oder Protein-Assay nach Beendigung geerntet werden. Alternative Methoden verwenden auch fluorometrische Farbstoff für Hochdurchsatz-Tests zu ermöglichen. Dennoch bleibt die traditionelle Koloniebildung in Weichagar-Assay als eine der strengsten Tests zur Bestätigung der verankerungsunabhängigen Zellwachstum.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This study was supported by a Merit Award from the U.S. Department of Veterans Affairs, and an NIH grant R01CA1385282522717 to RW.
Materialien
| Name | Company | Catalog Number | Comments |
| Cancer Cell Line of Interest | Sigma-Aldrich | 10032302 | CMT-167 Cells |
| Powdered RPMI 1640 Medium | Gibco | 31800-089 | Used to prepare 2x cell culture medium. |
| Liquid RPMI 1650 Medium | Cellgro | 10-040-CV | Referred to as 1x cell culture medium. |
| Fetal Bovine Serum | HyClone | SH30910.03 | Used to supplement cell culture medium. |
| Penicillin/Streptomycin | CellGro | 30-002-Cl | Used in cell culture medium. |
| Difco Noble Agar | BD Biosciences | 214230 | Used to prepare 1.0% and 0.6% agar. |
| Sodium Bicarbonate | Fisher | BP-328-1 | Used in 2x cell culture medium. |
| Trypsin | Cellgro | 25-050-Cl | |
| Sterile Bottle-Top Filters | Fisher | 09-761-126 | Used to sterile filter 2x medium. |
| Lipofectamine Reagent | Invitrogen | 18324-020 | Used in PPAR-RE luciferase assay. |
| 6-well Plates Tissue-culture Treated | |||
| 37 °C/5% CO2 Incubator | |||
| Chemi-Doc Imager | Bio-Rad | Used to take pictures of colonies. | |
| Quantity One Software | Bio-Rad | Used to count cell colonies. | |
| 15 ml Conical Tubes | |||
| 50 ml Conical Tubes | |||
| 250 ml Erlenmeyer Flasks | |||
| Microwave | |||
| 5 ml Serological Pipettes | |||
| Pipette Aid | |||
| Micropipette | |||
| Hemacytometer w/ cover slip | |||
| Pipette Tips | |||
| Inverted Light Microscope | |||
| Centrifuge | |||
| Heat-Resistant Gloves | |||
| Saran Wrap | |||
| Ice Bucket |
Referenzen
- Puck, T. T., Marcus, P. I., Cieciura, S. J. Clonal growth of mammalian cells in vitro; growth characteristics of colonies from single HeLa cells with and without a feeder layer. J Exp Med. 103, 273-283 (1956).
- Taddei, M. L., Giannoni, E., Fiaschi, T., Chiarugi, P. Anoikis: an emerging hallmark in health and diseases. The Journal of pathology. 226, 380-393 (2012).
- Wend, P., Holland, J. D., Ziebold, U., Birchmeier, W. Wnt signaling in stem and cancer stem cells. Semin Cell Dev Biol. 21, 855-863 (2010).
- Reya, T., et al. A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature. 423, 409-414 (2003).
- Klaus, A., Birchmeier, W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 8, 387-398 (2008).
- Clevers, H. Wnt/beta-catenin signaling in development and disease. Cell. 127, 469-480 (2006).
- Takahashi-Yanaga, F., Kahn, M. Targeting Wnt signaling: can we safely eradicate cancer stem cells. Clin Cancer Res. 16, 3153-3162 (2010).
- De, A. Wnt/Ca2+ signaling pathway: a brief overview. Acta Biochim Biophys Sin (Shanghai). 43, 745-756 (2011).
- Tennis, M. A., Vanscoyk, M. M., Wilson, L. A., Kelley, N., Winn, R. A. Methylation of Wnt7a is modulated by DNMT1 and cigarette smoke condensate in non-small cell lung cancer). PLoS One. 7, (2012).
- Winn, R. A., et al. Restoration of Wnt-7a expression reverses non-small cell lung cancer cellular transformation through frizzled-9-mediated growth inhibition and promotion of cell differentiation. J Biol Chem. 280, 19625-19634 (2005).
- Winn, R. A., et al. Antitumorigenic effect of Wnt 7a and Fzd 9 in non-small cell lung cancer cells is mediated through ERK-5-dependent activation of peroxisome proliferator-activated receptor gamma. J Biol Chem. 281, 26943-26950 (2006).
- Tennis, M. A., et al. Sprouty-4 inhibits transformed cell growth, migration and invasion, and epithelial-mesenchymal transition, and is regulated by Wnt7A through PPARgamma in non-small cell lung cancer. Mol Cancer Res. 8, 833-843 (2010).
- Steele, J. G., Rowlatt, C., Sandall, J. K., Franks, L. M. Cell surface properties of high- and low-metastatic cell lines selected from a spontaneous mouse lung carcinoma. Int J Cancer. 32, 769-779 (1983).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten