Method Article
Gelişmekte Embriyonik Fare Kalp Vana Bölgesi'nde Protein İzolasyonu
Bu Makalede
Özet
The analysis of protein expression in young embryonic mouse valves has been hampered by the limited tissue available. This manuscript provides a protocol for preparing protein from developing embryonic mouse valve regions for western blot analysis.
Özet
Western blot analysis is a commonly employed technique for detecting and quantifying protein levels. However, for small tissue samples, this analysis method may not be sufficiently sensitive to detect a protein of interest. To overcome these difficulties, we examined protocols for obtaining protein from adult human cardiac valves and modified these protocols for the developing early embryonic mouse counterparts. In brief, the mouse embryonic aortic valve regions, including the aortic valve and surrounding aortic wall, are collected in the minimal possible volume of a Tris-based lysis buffer with protease inhibitors. If required based on the breeding strategy, embryos are genotyped prior to pooling four embryonic aortic valve regions for homogenization. After homogenization, an SDS-based sample buffer is used to denature the sample for running on an SDS-PAGE gel and subsequent western blot analysis. Although the protein concentration remains too low to quantify using spectrophotometric protein quantification assays and have sample remaining for subsequent analyses, this technique can be used to successfully detect and semi-quantify phosphorylated proteins via western blot from pooled samples of four embryonic day 13.5 mouse aortic valve regions, each of which yields approximately 1 μg of protein. This technique will be of benefit for studying cell signaling pathway activation and protein expression levels during early embryonic mouse valve development.
Giriş
Protein ekspresyon seviyelerini belirlemek ve ölçmek için güçlü olmak bir hayvan ve hücre tabanlı deneyler için standart bir tekniktir. Ancak rağmen uzun süreli bir anda civciv ve fare hem de 1,2 immünohistokimya ile sınırlıdır gelişimi sırasında, bu özel doku içindeki protein ifadesi değerlendirilmesi, erken dönemde embriyo gelişimi kalp kapağı ilgi. En model organizmaların (örneğin, civciv ve fare) gelişmekte vanaları protein ifadesini nicel zorluk parçası elde edilebilir protein miktarını sınırlayan vanalar, küçük boyutu. Böylece, kantitatif analiz için, araştırmacılar genellikle müteakip kantitatif PCR veya mikroarray analizi 2-5 RNA ekstraksiyon ve amplifikasyon güveniyor. Bununla birlikte, RNA ve protein ekspresyon seviyeleri 6 tamamen bağıntılı değildir, bu nedenle RNA ekspresyonu odaklanan herhangi bir sinyal meydana gelen pek çok değişiklik sıkı bir hesap sağlayamazgelişmeler sırasında çeşitli zamanlarda yol. Mevcut metodolojisinde bu sınırı dayanarak, bu prosedürün amacı güvenilir önemli olan çeşitli sinyal yollarında meydana gelen değişikliklere kantitatif analiz için gelişmekte embriyonik fare kalp kapak bölgelerden proteinin yeterli miktarda elde etmek için bir protokol geliştirmek oldu Bu doku olgunlaşması.
Embriyonik vanalar zaten yaygın RNA izolasyonu ve sonraki gen ekspresyon analizi 2-5 için fareden disseke edilir. Ancak bu çalışmalar, akış aşağı sinyali etkileyebilir translasyon sonrası protein modifikasyonları yer tespit algılanmasını izin vermez yolu aktivasyonunun, bir sinyalleme okuma olarak gen ekspresyonu ile sınırlı kalmıştır. Bir başlangıç noktası olarak RNA izolasyon teknikleri kullanarak, ilgi konusu bölgelerin kesme ile başladı. Bizim faiz fosforillenmiş proteinleri tespit Çünkü sinyalizasyon pat göstergesidir olduğunuaort kapak geliştirme (E13.5-14.5) belirli bir süre boyunca Hway aktivitesi, bu fosfat içermeyen Tris tamponu içinde bütün tahlil yapıldı ve fosfataz ve proteaz inhibitörleri ile bir Tris-bazlı liziz tamponunda valfleri toplanır. Bizim özel durumda, sadece aort kapak bölgeleri toplandı, ancak pulmoner kapak bölgesi kolaylıkla aynı anda elde edilebilir. Valf bölgeleri, homojenize edilir ve şu anda yetişkin kalp valf 7 protein ifadesini incelemek için kullanılan bir numune tampon maddesi ile birleştirildi. Küçük örnek hacimleri (örneğin, 2 ul) kullanılarak ve aynı genotipi ile embriyolardan valf bölgeleri bir araya getirerek, biz embriyonik günde 13.5 8 de fosforlu ve fosforillenmemiş proteinleri tespit başardık. Valf bölgeler dondurulmuş ve lizis tamponunda saklanabilir için araya önce gerekirse, embriyolar genotiplenmiştir edilebilir.
Bu teknik, hücre signalin değerlendirmek için kullanılabilir araçları kümesi genişletmektedirg gelişimi sırasında yollar ve özellikle gelişmekte olan kalp kapakçıkları için, immünohistokimyaya nicel bir iltifat sağlar. Bu teknik gelişim kardiyoloji değil, aynı zamanda sınırlı bir doku ihtiva eden bölümleri ile ilgili erken evre embriyoları ile çalışan tüm gelişim biyolojistlere sadece yararlı olacaktır.
Protokol
NOT: Tüm deneyler Chapel Hill'deki North Carolina Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından kabul edildi.
1. Tüketim Aort Kapağı
- Ilgi embriyonik aşaması için onaylanmış bir ötenazi tekniği kullanılarak, arzu edilen gelişme embriyonik gün (E) yavrular ile hamile bir fareyi euthanize.
- Hamile kadın karnı sterilize etmek için% 70 etanol kullanın. Uzak iç organlardan alt karın yukarı ve cilt ve kas kaldırın ve uterin boynuz erişime izin vermek için açık dişinin alt karın boşluğuna teşrih.
- Uterin boynuzu almak için, forseps forseps ile serviks ve dikkatlice kesilmiş kaudal tutun. Yerinde boynuz tutan herhangi bir bağ dokusu kesme, uterin boynuz kaldırın ve fallop ile uterin horn kavşak keserek kaldırma işlemini tamamlamak.
- Bir Petri kabı içeren col disseke uterin boynuz yerleştirmekd 0.1 M Tris tamponu (pH 7.6) ve gerektiği gibi yıkayın. Sonra, açık uzunluğu-bilge embriyonik keselerinin maruz uterin boynuzu kesti.
- Embriyo göstermek için, plasenta ve embriyo kavşağında bir embriyonik kese kesip ve embriyo serbest göbek damarları kesilmiş. Soğuk 0.1 M Tris tampon içeren ikinci bir Petri kabındaki kesilen embriyo yerleştirin. Sonraki embriyo için hazır olana kadar buz kalan undissected embriyolar ile ilk Petri dönün.
- Embriyonun içinde göğüs duvarı erişimi geliştirmek için, embriyoyu başını kesmek. Genotipleme gerekli ise, kaldırma ve buz üzerine yerleştirilir, bir Eppendorf tüpü içinde ilave bir doku parçası kaydedin.
- Sırtında embriyo yerleştirin ve ön ayakları yakınında, göğüs kafesinin yan boyunca dikey göğüs duvarı kesti ve yatay diyafram üstü kalp görselleştirmek için. Ardından, kalp maruz göğüs duvarı açın.
- Büyük damarların boyunca yüksek tutmak için forseps kullanarak, forseps kullanarak kalp kaldırın ve aşağıdaki damarları kesilmiş.n kalbi boşaltmak için forseps yukarıdaki kesti. Akciğer damarlarında kesilmemiş kalırsa, akciğerler kalp ile kaldırılmış olabilir ve devam etmeden önce çıkarılmalıdır.
- Kesme ve valfın seviyesinden pulmoner arter çıkarmak; Burada tarif edilen embriyonik aşamada, pulmoner arter kapak bölgesinden, ayrımda yardım eden, hafif opaktır. Sadece pulmoner kapak altına indi trabeküler ventriküler miyokard kaçınarak ve bu bölge de ilgi ise adımda 1.10 açıklandığı gibi toplamak. Burada ve bir sonraki aşamada önce, liziz tamponu içinde toplama uzak ilgilenilen bölgesinde aşırı Tris tamponu çizmek için kılcal hareketi vardır.
- Dikkatle vananın seviyesinden, aort kapak aort distalinden kaldırmak; pulmoner arter gibi, aort, uzaklaştırılması yardım, bu embriyonik aşamada biraz opak kalır. Tekrar trabeküle ventriküler miyokard kaçınarak, sadece aort kapak altında kesilmiş ve aktarmakBuz üzerinde proteaz ve fosfataz inhibitörlerini ihtiva eden (Malzeme tabloda tarif edilmiştir) 2 ul liziz tamponu ile bir Eppendorf tüpüne, forseps kullanılarak valf.
- Vanalar ayrı Eppendorf tüp her bir valfi toplayarak, tüm embriyolardan kesilip edilene kadar tekrarlayın 1,6-1,10 adımları. Tüm embriyolar aynı genotipi varsa, tüm supap tek bir Eppendorf tüpü içinde toplanabilir.
- Genotipleme birlikte havuz valflarına belirlemek için gerçekleştirilecekse, hemen bir sonraki kullanıma kadar -80 ° C'de lisis tamponu içinde örnekleri yer. Numuneler daha sonra (adım 2.1.1) genotipleme sonra toplanmış olabilir.
2. Protein Ekstraksiyonu
- 1 dakika tüpün altındaki liziz tamponunda dokuları toplamak için 13.100 x g buz ve santrifüj üzerine toplanır dokuları çözülme.
- Embriyolar genotiplendirilmiştir, hafifçe toplamak ve havuz lizis tamponu benzer genotipler ile embriyolar valf bölgeleri içeren bir pipet kullanın. Güçlü bir b sağlamakörnek önerilir başına, E 13.5 embriyolardan 3-4 kapak bölgeleri birleştirilmelidir.
- Tüm embriyolar aynı genotipi ve tüm valf bölgeler Aşama 1,10 araya getirilerek durumunda Adım 2.2 'de tarif edildiği gibi, örneğin tamamına lize.
- Elde edilen birleştirilmiş numune miktarını kontrol edin ve 40 ul bir toplam hacim liziz tampon eklemek; Daha sonra, bozabilir ve Eppendorf tüpleri 5 mm paslanmaz çelik boncuklar kullanarak örnekleri homojenize. Üreticinin talimatlarına uygun olarak, 50 Hz'de 2-4 dakika için lize edici çalıştırın. Kısaca Spin tüpler, çözünmeyen enkaz geride bırakarak yeni tüplere (~ 13.100 1 dakika xg), ve transfer örnekleri.
- Hazırlama ve bu Eslami ve ark 9 gibi bir protokol izlenerek, SDS-PAGE ve Western blot analizi daha sonra aktarım için ayrı örnekler. Bir yükleme kontrol proteini için Kurutma protein miktar tayini için önemlidir.
Sonuçlar
Bu hazırlık tekniği kullanarak, E13.5 embriyolar tek aort kapak bölgelerinde fosforile Smad 1,5,8 (pSmad) tespit başardık. Şekil 1A'da gösterildiği gibi, hatta bir tek valf bölgesinden izole edilmiş protein bir hafif pSmad grubu tespit etmek için yeterlidir. Sinyal yoğunluğu bir araya getirilmiş, kapak bölgelerinin sayısı artar. Önemli olarak, pSmad / β-aktin oran, farklı örnek boyutları (Şekil 1C) boyunca hemen hemen sabit kalır. Nedeniyle mevcut düşük protein seviyeleri, aynı leke soyuldu edilemez ve toplam Smad için yeniden sondaj. Bununla birlikte, ayrı bir toplam Smad 1 benek gösteren ve β-aktin aynı sentezlenme modelini (Şekil 1B) göstermektedir.
Bu valf bölgeler ventriküler miyokard kirletici neredeyse tamamen yoksun bulunmaktadır. Sağ ventrikül örnekleri ile birlikte bu hazırlık tekniği kullanarak, ventric tespit koyamadıkaort kapak bölgelerde ular myokardiyumu işaretleyici ANP, bu işaretleyici kolayca ventrikül tespit edildi ise (Şekil 2). Bundan başka, ventrikül işaretleyici miyosin hafif zincir 2V hali hazırda, ventriküler numunede saptanamayan fakat bu aort kapak bölgelerinde ancak saptanabilir. Bu sonuçlar diseksiyon kesinliğe destekler.
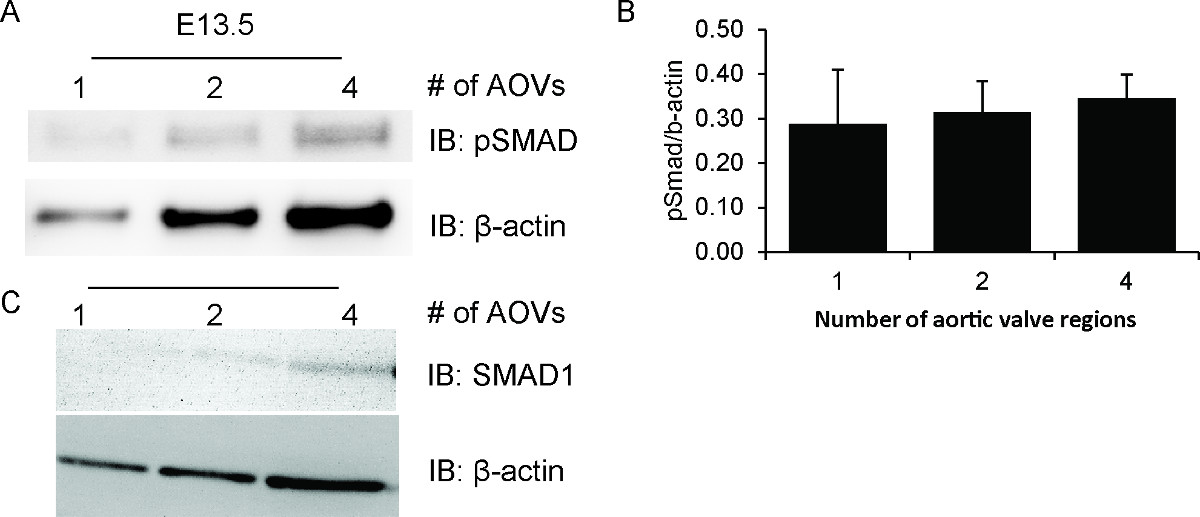
Embriyonik aort kapak bölgelerinde Şekil 1, Smad fosforilasyon. Örnekler 1 ila 4, numune başına valf bölgeler arasında değişen bir araya getirilmiş, embriyonik fare aort kapak bölgelerin sayısındaki artış ile hazırlanmıştır. Her bir numune, 25-28 ul toplam hacim içinde tüm valf bölge (ler) olarak izole edilen tüm proteinleri içerir. Hazırlanan dokular daha sonra fosforile Smad1,5,8 (pSmad) (A için western blot analizine tabi tutulmuştur) Toplam Smad1 (C) ve β-aktin (A, C). Protein Lumigen ECL derece ve UVM VisionWorks yazılımı ile görüntülendi kullanılarak tespit edildi. PSmad ve β-aktin bant yoğunluğu ImageJ yazılımı kullanılarak (B) sayısal olarak, başlangıç malzemesinin miktarı ile orantılıdır. Sunulan veriler ortalama ve iki ayrı lekelerinin standart sapma. , bu rakamın büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
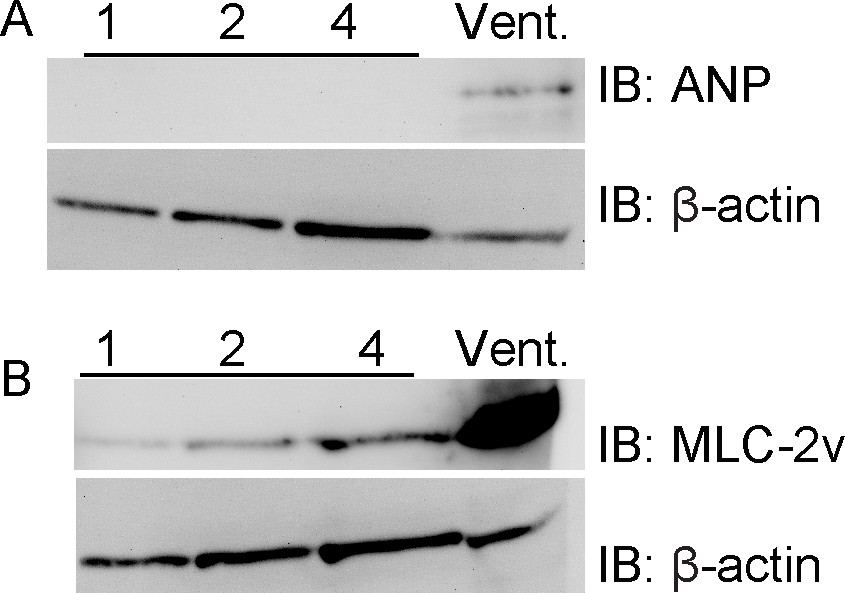
Şekil 2. Aort kapak bölgeler ventrikül myokard işaretleri ifade yok. Numuneler, ya da bir ile 1 ila numune başına 4 supap bölgelere kadar, toplanmış embriyonik fare aort kapak bölgelerin sayısındaki artış ile hazırlanmıştırsağ ventrikül örnek. Şekil 1 'de tarif edilen ve ventriküler miyokardın için lekelenir olarak Numune işlenmiştir ANP (A) ve miyosin hafif zincir (MLC), -2v (B) işaretler. ANP tamamen ventriküler numuneye sınırlandırılmıştır ve MLC 2v ventriküler numune ile karşılaştırıldığında çok daha düşük seviyelerde ifade edilir. β-aktin, bir yükleme kontrolü olarak gösterilmiştir.
Tartışmalar
Kalp kapak bölgeleri erken embriyonik fare protein seviyelerini ölçmek ve civciv yeteneği vana gelişimi için kritik hücresel sinyal olayları anlamak için ek bir araç sağlar. Burada tarif Bizim protokol standart protein izolasyon prosedürlerinin büyük ölçüde farklı değildir. Ancak, bazı önemli adımları değiştirerek, biz başarıyla derece küçük örneklem büyüklükleri fosforile proteinleri almış. Bu sonucu elde etmek için, aşağıdaki aşamalar, özel bir önem taşımaktadır. Bu kaliteli protein elde edilir sağlamak için, buz üzerinde olsun ya da eğer gerekli ise, fosfataz inhibitörleri proteaz varlığında, buz gibi soğuk tampon kullanılarak ve soğutulmuş örnekleri tutmak için çok önemlidir. Ayrıca, küçük örnek hacimlerini işlemek için tasarlanmış bir cihaz ile homojen hale yeterli hücre zarlarını bozmak için gereklidir. Hatta bu önlemler ile, protein elde edilen verim, bir spektrofotometre ile Bradford tahlili ile tespit etmek için çok düşük olabilirya da hala bir protein ölçümü kiti ve daha sonraki analizler için kullanılabilir örnek var. Her aort kapak bölge 7 aort kapak bölgeleri havuzu ve ölçümü için tüm örnek kullanılarak yaklaşık 1 mikrogram protein içerdiğini belirlemek başardık. Bu sınırlamaya rağmen, yeterli protein öncesinde nicelikleme eksikliği temel bir yükleme kontrolü yapar rağmen, fosforlu ve fosforilatlanmamış proteinleri tespit etmek için elde edilir. Bize bile zar defalarca sıyırma sonra bunu tespit için izin bir yüksek bolluk protein, çünkü biz özellikle β-aktin kullanılmıştır; moleküler ağırlığı ilgi bizim proteinlerin farklıydı; ve her yerde ifade edilir. Toplanmış numunelerin farklı sayıda ile bir deneme Western blot diğer gelişme aşamalarında veya ilgi duyulan diğer küçük dokular için embriyonik kalp kapak bölgeleri biriyle birleştirilebilir gerekir kaç dokuları belirlemek için tavsiye edilir. Buna ek olarak, en az üç t birleştirilmesi tavsiyeHer bir protein numune için numuneler kesilmiş sorun dokuların büyüklüğü, hem de her bir embriyo diseksiyon önce buz üzerinde doymuş zaman uzunluğu değişkenlik için hesap. Ilgi protein bile örnekleri havuzlama sonra western blot ile tespit edilemezse, numune hacminin azaltılması ve tüm potansiyel protein tespiti için kullanılabilir olmasını sağlamak için homojenizasyon süresi artan öneririz. Buna ek olarak, proteaz inhibitörleri de sabit olmayan veya kolaylıkla bozulmuş proteinler için diseksiyon sırasında buz soğukluğunda Tris tamponu ilave edilebilir. İlgili protein, birincil antikor inkübasyona veya alt algılama yöntemi ayarlanması oldukça düşük bir seviyede, deney batı benek kısmı sırasında ek sorun giderme, en ifade edilirse, görsel yardımcı olabilir.
Kanıtlar (örneğin, immünohistokimya veya in situ hibridizasyon) ilgi konusu bir proteini kalp kapakçıklarının ve Etraftaki içinde hem de sentezlendiğini ortaya koymaktadır takdirdemiyokard nding, aort veya pulmoner arter myokardiyumu, tungsten iğne ile ayrı hafifçe alay bile E12.5 embriyolar 5 vanalarına alınabilir. Bu ek bir adım önemli teknik zorluk diseksiyon süresini uzatmak ve katacak Çünkü, biz sadece gerektiği gibi istihdam öneririz. Bizim orijinal çalışmada, Smad fosforilasyon sadece vana mezenkimi değişmiş olduğunu gösteren bir immünohistokimyasal analizi ile başladı; dolayısıyla, biz batı lekesi yoluyla ortaya herhangi bir fark valf mezenşimin 8 ifadede değişiklikler nedeniyle olduğunu emindik. Gelişmekte çıkış yolu vanalar gibi ANP veya MLC-2v olarak ventriküler myokard-spesifik antikor kullanarak ventriküler kontaminasyon için bir kontrol lekesini performans, büyük arterlerin ve ventriküllerin kavşağında oturup çünkü Ayrıca, tavsiye edilir.
Vanalar gelişim sırasında dramatik bir yeniden yapılanmaya tabi, çünkü biz şu sahne özgü r teklifminderleri / kapaklarının ve çevresindeki doku için ecommendations. Erken minderler (E9.5-11.5) için, çıkış yolu ve atriyoventriküler minderleri hem kolay nedeniyle miyokardın 10 translusensi için görsel ve disseke edilir; Bununla birlikte, bu embriyolar, küçük ve kesme iğneler yerine Forseps ve microscissors tavsiye edilir. Orta kademe farklılaşma (E12.5-14.5), 10, semilunar vanalar için (yani, aort ve pulmoner arter vanalar) daha kolay erişilebilir atriyoventriküler kapaklara göre daha olacaktır (yani, mitral ve triküspid kapaklar). Aorta ve pulmoner arter septating ve bu zaman dilimi 11,12 sırasında döner çünkü Ancak, semilunar kapaklar dikkatlice disseke edilmelidir. Dikkat dikkat aort ve pulmoner arter tabanının dönme verilmelidir ve bu arterler arasındaki orta nokta sürekli olarak tespit edilmelidir. Vana olgunlaşma ve yoğunlaşma sonraki aşamalarında (atDaha sonra E15.5 ve) 10, mitral ve triküspid kapaklar ventriküller içindeki uzak alay edilebilir; Ancak, semilunar kapaklar daha kolay erişilebilir olmalıdır.
Western blot analizi biyopsi boyutunu büyük yetişkin kalp valf 13, protein ekspresyon seviyelerini ölçmek için uzun süredir bir tekniktir. Buna karşılık, erken evredeki embriyonik ücretsiz analizleri izole edilmiş mRNA küçük bir miktar başlangıç olarak analiz dan önce amplifiye edilebilir transkripsiyon PCR, protein ekspresyonunu tespit etmek veya ters çevirmek için niceliksel olmayan imünohistokimya ya da üzerinde odaklanmıştır. Bunlar şu anda çalışan teknikler sinyalizasyon ve gen ifadesi değişiklikleri ile ilgili bazı önemli bilgileri sağlar, ancak kantitatif protein düzeylerini değerlendirmek için yetenek eksikliği. Bu protokol ile, şimdi nicel mRNA ekspresyon verileri ve immünohistokimyasal analizler ile ilişkili kantitatif protein ifadesi veri ekleyebilirsiniz.
Bu protokol iltifat embriyonik kalp kapakçıklarının ve görüntüleme protein ekspresyonu mRNA izole edilmesi için teknikler kurulmuştur. Bu nedenle, bu birleştirme teknikleri protein modifikasyonu çeviri-sonrası mRNA'dan, üst tarafına daha etkin bir şekilde analiz ve aşağı-regülasyonu sinyal yollarının sağlayacaktır. Bundan başka, bu yöntem halen kullanılan immünohistokimya teknikleri artıracaktır protein ekspresyonunun nicelik, izin verir. Birlikte, bu teknik kalp kapakçıklarının ilgilenen veya kantitatif batı leke analizi için diğer özellikle küçük doku eksplantlarını hazırlamak herhangi bir araştırmacı için ilgi olacağına inanıyoruz.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We would like to thank Andrea Portbury and Davin Townley-Tilson for critical reading of the manuscript and the NIH (grant # R01HL061656) for funding support.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Timed-pregnant mouse | To be dissected at the embryonic stage of interest | ||
| Stereoscopic microscope | Nikon | SMZ645 | |
| 0.1 M Tris, pH 7.6 | |||
| Microscissors | Fine Science Tools | 15003-08 | |
| Fine forceps, #5 | Fine Science Tools | 11251-30 | |
| Dissecting needle holders | Ted Pella Inc. | 13560 | |
| Dissecting needles | Ted Pella Inc. | 13561-10 | |
| Micropipette, 20 μl, with tips | |||
| Lysis buffer | 50 mM Tris-HCl, pH 7.5, 150 mM NaCl, 5 mM EDTA, 1% Triton | ||
| PhosSTOP | Roche | 4906845001 | Add 1 tablet to 10 ml lysis buffer |
| TissueLyser LT | Qiagen | 85600 | |
| Stainless steel beads | Qiagen | 69989 | |
| Microcentrifuge |
Referanslar
- Wirrig, E. E., Hinton, R. B., Yutzey, K. E. Differential expression of cartilage and bone-related proteins in pediatric and adult diseased aortic valves. J Mol Cell Cardiol. 50, 561-569 (2011).
- Chakraborty, S., et al. Twist1 promotes heart valve cell proliferation and extracellular matrix gene expression during development in vivo and is expressed in human diseased aortic valves. Dev Biol. 347, 167-179 (2010).
- Lee, M. P., Yutzey, K. E. Twist1 directly regulates genes that promote cell proliferation and migration in developing heart valves. PLoS One. 6 (e29758), (2011).
- Peacock, J. D., Huk, D. J., Ediriweera, H. N., Lincoln, J. Sox9 transcriptionally represses Spp1 to prevent matrix mineralization in maturing heart valves and chondrocytes. PLoS One. 6 (e26769), (2011).
- Chakraborty, S., Cheek, J., Sakthivel, B., Aronow, B. J., Yutzey, K. E. Shared gene expression profiles in developing heart valves and osteoblast progenitor cells. Physiol Genomics. 35, 75-85 (2008).
- Vogel, C., Marcotte, E. M. Insights into the regulation of protein abundance from proteomic and transcriptomic analyses. Nat Rev Genet. 13, 227-232 (2012).
- Meng, X., et al. Expression of functional Toll-like receptors 2 and 4 in human aortic valve interstitial cells: potential roles in aortic valve inflammation and stenosis. Am J Physiol Cell Physiol. 294, 29-35 (2008).
- Dyer, L. A., Wu, Y., Moser, M., Patterson, C. BMPER-induced BMP signaling promotes coronary artery remodeling. Developmental Biology. 386, 385-394 (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Garside, V. C., Chang, A. C., Karsan, A., Hoodless, P. A. Co-ordinating Notch, BMP, and TGF-beta signaling during heart valve development. Cell Mol Life Sci. 70, 2899-2917 (2013).
- Jiang, X., Rowitch, D. H., Soriano, P., McMahon, A. P., Sucov, H. M. Fate of the mammalian cardiac neural. Development. 127, 1607-1616 (2000).
- Scherptong, R. W., et al. Morphogenesis of outflow tract rotation during cardiac development: the pulmonary push concept. Dev Dyn. 241, 1413-1422 (2012).
- Mohler, E. R., Adam 3rd, L. P., McClelland, P., Graham, L., Hathaway, D. R. Detection of osteopontin in calcified human aortic valves. Arterioscler Thromb Vasc Biol. 17, 547-552 (1997).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır