Method Article
Внутриклеточная фосфофлоу-цитометрия ксенотрансплантатов пациентов с острым миелоидным лейкозом
В этой статье
Резюме
В данной работе описан метод, основанный на фосфофлоу-цитометрии, для анализа передачи сигналов по путям mTORC1, JAK/STAT5 и MAPK в клетках острого миелоидного лейкоза человека, ксенотрансплантированных мышам и полученных из аспиратов костного мозга. Уровни p-STAT5, p-4EBP1, p-RPS6 и p-ERK1/2 одновременно измеряются с помощью спектрального проточного цитометра нового поколения с высокой чувствительностью.
Аннотация
Чтобы адаптироваться и противостоять одобренным методам лечения, клетки острого миелоидного лейкоза (ОМЛ) активируют специфические молекулярные пути, которые приводят к изменениям экспрессии генов, уровня белка и активности. Сообщается, что в этом протоколе используется подход к исследованию мишеней, фосфорилированных после онкогенной передачи сигналов при ОМЛ: p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) и p-ERK1/2 (Thr202/Tyr204). Этот метод позволяет оценить, как эти пути — основные регуляторы поддержания стволовости, уклонения от иммунитета, синтеза белка и адаптации к окислительному и метаболическому стрессу — модулируются одним или несколькими исследуемыми соединениями в клетках костного мозга, полученных от живых мышей путем аспирации до и после фазы лечения. Этот минимально инвазивный метод сохраняет целостность клеток и снижает стресс по сравнению с методами дробления костей, которые могут вызвать повреждение и потенциально повлиять на результаты эксперимента. Для оптимизации внутриклеточного окрашивания антител для проточного цитометрического анализа был разработан протокол с использованием фиксации параформальдегида и пермеабилизации метанола. Такой подход обеспечивает высокую точность окрашивания и минимизирует фоновый шум, что позволяет надежно обнаруживать внутриклеточные сигнальные маркеры. Одним из основных преимуществ этого протокола является разработка многопараметрической панели антител, позволяющей одновременно оценивать четыре пути в одном образце. С помощью спектрального проточного цитометра нового поколения с высокой чувствительностью наблюдались динамические сдвиги в активации путей в зависимости от условий лечения по сравнению с исходными уровнями до обработки у тех же мышей. Эта методология позволяет проводить точный in vivo анализ модуляции сигнальных путей в образцах костного мозга ксенотрансплантата, полученных от пациента, не требуя эвтаназии животных, предоставляя ценную информацию об адаптивных механизмах клеток ОМЛ, а также может служить руководством для оценки терапевтических стратегий, направленных на нацеливание на эти пути для преодоления резистентности.
Введение
Острый миелоидный лейкоз (ОМЛ) – это агрессивное гематологическое злокачественное новообразование, характеризующееся накоплением незрелых миелоидных клеток-предшественников в костном мозге и периферической крови. Это нарушает нормальный кроветворение, что приводит к опасной для жизни цитопении и системным осложнениям. Несмотря на то, что достижения в области химиотерапевтических схем, таргетной терапии и трансплантации гемопоэтических стволовых клеток улучшили исходы для некоторых пациентов, в целом 5-летняя выживаемость остается на уровне около 30%, с худшим прогнозом у пожилых пациентов или пациентов с неблагоприятными генетическимипрофилями. Существенной проблемой в лечении ОМЛ является частое появление лекарственной устойчивости, которая способствует рецидиву и неэффективности лечения2. Это подчеркивает важность более глубокого понимания молекулярных и клеточных механизмов, определяющих прогрессирование и терапевтическую резистентность ОМЛ.
Для решения этой проблемы представлен новый метод аспирации костного мозга в сочетании с мультиплексной внутриклеточной фосфофлоу-цитометрией, предлагающий мощный инструмент для исследования внутриклеточных сигнальных путей в моделях ксенотрансплантата (PDX), полученных от пациента при ОМЛ (Рисунок 1A, B). Хотя аспирация костного мозга в моделях PDXбыла описана ранее3, этот протокол был оптимизирован для сохранения лейкозных клеток для анализа фосфолоу. Общая цель этого метода заключается в том, чтобы обеспечить минимально инвазивную процедуру, которая будет применима в продольном отношении во время прогрессирования лейкемии и терапевтического ответа с разрешением одной клетки. Позволяя повторно брать пробы у одного и того же животного, этот метод обеспечивает более точное представление эволюции болезни при лечении. Обоснование разработки этого метода заключается в необходимости динамической оценки внутриклеточной сигнализации в клетках ОМЛ с высоким разрешением. Традиционные методы, такие как вестерн-блоттинг, требуют большого количества клеток, не имеют разрешения для одной клетки и мультиплексирования4. Напротив, фосфофлоуточная цитометрия сохраняет клеточную гетерогенность и позволяет обнаруживать множественные фосфорилированные сигнальные белки в различных лейкозныхсубпопуляциях5, предлагая ключевые сведения об активации путей в ответ на лечение ОМЛ.
Центральное место в биологии ОМЛ занимают сигнальные пути, которые регулируют клеточную пролиферацию, выживание и метаболическую адаптацию, включая митоген-активируемую протеинкиназу (MAPK), механистическую мишень рапамицинового комплекса 1 (mTORC1) и сигнальные пути Janus Kinase/Signal Transducer and Activator of Transcription 5 (JAK/STAT5). Помимо их роли в пролиферации и выживании лейкозных клеток, эти пути также играют важную роль в ключевых онкогенных процессах, таких как поддержание стволовых клеток, уклонение от иммунитета и адаптация к окислительному и метаболическомустрессу. В дополнение к содействию росту и выживанию клеток, перекрестные взаимодействия между этими путями координируют важнейшие процессы, такие как транскрипция, трансляция и клеточный метаболизм, позволяя клеткам ОМЛ поддерживать свой рост и сопротивляться апоптотическим сигналам, даже в условиях терапевтических вмешательств 6,7 (рис. 1A).
Путь MAPK, который включает в себя ключевые эффекторы, такие как p-ERK1/2 (киназа, регулируемая внеклеточными сигналами 1/2), играет решающую роль в интеграции внеклеточных сигналов, таких как факторы роста и цитокины, для регуляции пролиферации и выживания клеток. Активация ERK1/2 происходит через каскад RAS (Rat Sarcoma)-RAF (Rapid Accelerated Fibrosarcoma)-MEK (MAPK/ERK Kinase)-ERK, где RAS-GTP рекрутирует RAF, что приводит к последовательному фосфорилированию MEK1/2, а затем ERK1/2 в Thr202/Tyr204. После фосфорилирования ERK1/2 димеризуется и перемещается в ядро, где фосфорилирует факторы транскрипции, такие как MYC (гомолог вирусного онкогена миелоцитоматоза), ELK1 (белок ETS Like-1) и AP-1 (белок-активатор-1), способствуя пролиферации клеток, блоку дифференцировки и выживанию. При ОМЛ мутации в FLT3 (fms-подобная тирозинкиназа 3), RAS или KIT часто приводят к конститутивной активации ERK 9,10 (рис. 1A).
Мутации в FLT3, RAS или KIT также вызывают повышение регуляции передачи сигналов mTORC1, что способствует росту ОМЛ и терапевтической резистентности, поддерживая онкогенные процессы, такие как метаболическая перестройка, модуляция синтеза белка, биогенез рибосом и аутофагия11. Регулируя трансляцию мРНК, mTORC1 способствует выработке онкогенных белков и других важных факторов для прогрессирования ОМЛ. Ключевая группа субстратов mTORC1 включает 4E-BPs (эукариотический фактор инициации 4E-связывающие белки). В своем гипофосфорилированном состоянии 4E-BPs связываются с eIF4E (эукариотический фактор инициации 4E), ингибируя cap-зависимую трансляцию. Фосфорилирование 4E-BP1 в Thr37/46 с помощью mTORC1 вызывает высвобождение eIF4E, что позволяет инициировать трансляцию ключевых онкогенных мРНК, таких как MYC, CCND1 (циклин D1) и MCL-1 (миелоидноклеточный лейкоз 1), тем самым способствуя пролиферации и выживаемости лейкемии 8,12. Кроме того, фосфорилирование RPS6 в Ser240/244, опосредованное S6K1 (бета-1-киназой рибосомального белка S6) после mTORC1, усиливает биогенез рибосом и трансляцию мРНК, увеличивая синтез белков, необходимых для метаболической адаптации, стрессоустойчивости ибыстрой пролиферации8,13. Примечательно, что активность mTORC1 тесно связана с метаболической адаптацией, что является важнейшей стратегией выживания, используемой клетками ОМЛ в условиях терапевтического стресса 13,14,15 (рис. 1A).
Путь JAK/STAT5 является еще одной важной сигнальной осью при ОМЛ, особенно в случаях с мутациями, влияющими на рецепторы цитокинов или сигнальные медиаторы, такие как JAK2, FLT3 и CALR (кальретикулин)16,17. STAT5 активируется в ответ на передачу сигналов цитокинов через рецепторы, такие как FLT3 и JAK2. После связывания лиганда ассоциированные янус-киназы (JAKs) фосфорилируют STAT5 в Tyr694. Фосфорилированный STAT5 димеризуется и перемещается в ядро, где связывается со специфическими последовательностями ДНК для регуляции транскрипции генов, участвующих в выживании, пролиферациии дифференцировке клеток. При ОМЛ конститутивная активация STAT5, часто обусловленная мутациями в FLT3 или JAK2, приводит к стойкой экспрессии генов, способствующих лейкемогенезу18 (рис. 1A).
Помимо их индивидуального вклада, эти пути сходятся, чтобы регулировать как транскрипцию, так и трансляцию, формируя протеом клеток ОМЛ таким образом, чтобы способствовать выживанию и резистентности. В частности, трансляция мРНК становится ключевым фактором в патофизиологии ОМЛ, поскольку она обеспечивает быстрое производство онкогенных белков и факторов реагирования на стресс, которые позволяют клеткам ОМЛ адаптироваться к вызовам окружающей среды и избегать эффектов таргетной терапии. Нарушение регуляции трансляционных механизмов, таких как эукариотические факторы инициации (эИФ) или рибосомные белки, было связано с терапевтической резистентностью и плохим прогнозом при ОМЛ19. Подробное исследование роли путей MAPK, mTORC1 и JAK/STAT5 в транскрипционной и трансляционной регуляции имеет важное значение для получения всестороннего понимания молекулярных механизмов, лежащих в основе прогрессирования и резистентности к ОМЛ. Такие выводы имеют решающее значение для выявления новых биомаркеров ответа на лечение и разработки новых терапевтических стратегий, нацеленных на эти пути преодоления резистентности. В данной статье представлен протокол, специально разработанный для исследования этих сигнальных сетей в моделях ксенотрансплантатов (PDX), полученных от пациента при ОМЛ.
Одним из ключевых преимуществ этого протокола является интеграция аспирации костного мозга с внутриклеточной фосфофлоу-цитометрией, что позволяет проводить динамическую и минимально инвазивную оценку активации сигнального пути в моделях ксенотрансплантата (PDX), полученных от пациента, при ОМЛ. Это особенно ценно для мониторинга статуса активации ключевых путей, таких как MAPK, mTORC1 и JAK/STAT5, в ответ на таргетную терапию. Комбинация этих методов позволяет получить всестороннее понимание биологии ОМЛ с высоким разрешением, что в конечном итоге способствует разработке более эффективных терапевтических стратегий.
протокол
Следующие эксперименты были проведены с одобрения Комитета по уходу за животными Университета Макгилла (CIHR PJT-186019) и Институционального наблюдательного совета Еврейской больницы общего профиля (11-047). В этом протоколе самцам мышей NOD-scid IL2Rg^null-3/GM/SF (NSGS) в возрасте от 8 недель до 6 месяцев и весом 20-30 г ранее были пересажены клетки ОМЛ, полученные от пациента. Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Аспирация костного мозга
ВНИМАНИЕ: Следует соблюдать меры предосторожности при использовании игл.
- Периоперационная анальгезия: за 1-4 ч до аспирации костного мозга мышам подкожно вводят 0,1 мг/кг бупренорфина с замедленным высвобождением. Это обеспечивает обезболивание в течение 72 часов после процедуры.
- Подготовьте операционную зону под ламинарным проточным колпаком с помощью хирургической прокладки, триммера для волос, нагревательной лампы и всего необходимого материала для аспирации костного мозга (шприцы 25 г, микроцентрифужные пробирки объемом 1,5 мл, содержащие 0,5 мл PBS на льду, 70% изопропаноловые тампоны). Закрепите носовой конус для ингаляции изофлураном с помощью клейкой ленты (рисунок 2А).
- Подготовьте два шприца по 25 г для каждого аспирата, один для прокола кости («сухая игла») и один, ступица которого была промыта PBS для аспирации («промытая игла»).
- Обезболите мышь с помощью ингаляции изофлурана, доставляемого сертифицированным вапорайзером, в соответствии с инструкциями производителя и ветеринарными рекомендациями. Местные процедуры могут отличаться. Для справки, этот протокол соответствовал стандартным операционным процедурам Университета Макгилла для анестезии мышей20.
- Подтвердите глубину анестезии по отсутствию реакции на защемление ноги и расслаблению мышц. Нанесите ветеринарную мазь на глаза, чтобы предотвратить сухость, пока животное находится под анестезией. Непрерывно контролируйте частоту дыхания во время анестезии.
- Побрейте всю ногу в том месте, где будет производиться аспирация, с помощью триммера для волос. Продезинфицируйте место аспирации (бедренную кость) антисептической прокладкой, пропитанной изопропиловым спиртом (рисунок 2Б).
- Обнажить суставную поверхность бедренной кости, где находится место прокола, путем сгибания колена и иммобилизации ноги с помощью недоминантной руки. Поместите большой палец на большеберцовую кость, указательный палец на бедренную кость, а средний палец, стабилизируя все на внешней стороне двух костей (рисунок 2C).
ПРИМЕЧАНИЕ: Обеспечьте очень стабильное положение ноги с помощью недоминирующей руки, чтобы предотвратить любое движение ноги во время аспирации, которое может привести к неудаче или травме. Если иммобилизация ноги нестабильна, измените положение руки и повторите попытку перед любым проколом. - Во время иммобилизации недоминантной рукой снова продезинфицируйте область колена изопропиловым спиртом (рис. 2C), чтобы убрать оставшиеся волосы и улучшить визуализацию костной структуры.
- Используйте первый сухой шприц 25 G для создания отверстия в бедренной суставной поверхности, расположив его в середине бедренного сустава и вращая его без принуждения (Рисунок 2D, E). Убедитесь, что игла шприца полностью выровнена (отклонение 0°) с продольной осью бедренной кости для правильного ввода в костный мозг.
ПРИМЕЧАНИЕ: Поддерживайте это выравнивание, чтобы обеспечить плавный вход, не вызывая ненужного повреждения окружающих тканей. Когда игла входит в середину бедренной кости, небольшое снижение сопротивления свидетельствует об успешном проникновении в полость костного мозга (рисунок 2F). Избегайте приложения чрезмерного усилия к игле на этом этапе, так как это может привести к потере правильного выравнивания, перелому или травме. При использовании вращательного сверлильного движения шансы на то, что игла будет следовать по пути наименьшего сопротивления и правильно войдет в бедренную полость, выше. Игла, правильно расположенная внутри бедренной кости, должна оставаться вертикальной, даже когда рука, держащая ее, удалена. - Оказавшись в костном мозге, постепенно извлеките шприц, вращая его (рисунок 2G), и вставьте второй промытый шприц в отверстие, сделанное первой иглой (рисунок 2H, I).
ПРИМЕЧАНИЕ: Второй шприц используется, потому что первый часто блокируется костью во время сверления. - Подайте вакуум на шприц, вставленный в бедренную кость, осторожно вращая и постепенно извлекая шприц. Примерно 10-20 мкл костного мозга должно быть видно в пределах ступицы шприца (рис. 2J).
ПРИМЕЧАНИЕ: При необходимости осторожно переместите иглу внутрь кости для оптимизации извлечения костного мозга. - Переведите костный мозг, промыв содержимое шприца в охлажденную микроцентрифужную пробирку, содержащую 500 мкл PBS (рис. 2K). Оставайтесь на льду и как можно скорее приступайте к шагам 2-3.
- Слегка надавите на место прокола в течение 30 с с помощью тампона изопропанола, чтобы остановить кровотечение (Рисунок 2L).
- Поместите мышь в чистую клетку для восстановления, утепленную с помощью нагревательной лампы. Следите за дыханием и подвижностью до тех пор, пока животное не придет в себя и полностью не восстановится, прежде чем помещать его в общие клетки с остальными мышами. Проверьте наличие признаков кровотечения.
2. Окрашивание живыми/мертвыми и поверхностными маркерами
ПРИМЕЧАНИЕ: Держите клетки на льду на протяжении всей процедуры. Готовьте мастер-смеси растворов для окрашивания антител (для шага 2.4 и шага 2.7) до этапа 2 и этапа 3, сохраняя их при температуре 4°С защищенным от света уровнем. Приготовьте свежий 1,6% раствор формальдегида (шаг 3.1) и 100% раствор метанола при температуре -20 °C (шаг 3.6).
- Подсчитайте жизнеспособные клетки с помощью йодида акридина оранжевого/пропидия (AO/PI) с помощью счетчика клеток21.
- Переложите соответствующий объем для 1 миллиона клеток в новую пробирку объемом 1,5 мл. Если объема недостаточно, возьмите весь объем. Объедините оставшиеся клетки и аликвоту в 3 повторяющиеся пробирки (по 1 М каждая) для окрашивания по изотипу контроля и 1 пробирку для неокрашенного контроля.
- Центрифугируйте ячейки при давлении 500 x g в течение 5 минут при 4°C. Аккуратно отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы аспирации.
- Добавьте 200 мкл на образец раствора флуоресцентного окрашивания клеток, разведенного в 1/100 в PBS, чтобы пометить мертвые клетки. Аккуратно ресуспендируйте клетки с помощью пипетки. Проделайте то же самое с дополнительными пробирками для окрашивания для контроля изотипа.
- Выдерживать на льду в течение 10 минут в защищенном от света месте.
- Центрифугируйте клетки при давлении 500 x g в течение 5 минут при 4 °C. Аккуратно отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
- Добавьте 100 мкл на образец антитела hCD45-BUV395, разведенного в 1/100 в PBS, содержащем 2% фетальной бычьей сыворотки, для мечения гемопоэтических клеток человека. Проделайте то же самое с дополнительными трубками, оставленными для контроля изотипа.
- Выдерживать на льду в течение 15 минут в защищенном от света месте. Немедленно переходите к шагу 3.
3. Фиксация и пермеабилизация
- Приготовьте свежий 1,6% раствор формальдегида/PBS: Для каждого образца смешайте 29,5 мкл 37% стокового раствора формальдегида + 970,5 мкл PBS (учьте некоторый дополнительный объем в качестве меры предосторожности). Храните 1,6% раствор формальдегида/PBS при комнатной температуре.
ВНИМАНИЕ: С формальдегидом следует обращаться в химическом колпаке и утилизировать в соответствии с правилами безопасности учреждения. - Центрифугируйте клетки при давлении 500 x g в течение 5 минут при 4 °C. Отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
- Ресуспендировать в 1 мл 1,6% раствора формальдегида/PBS.
- Выдерживать 10 минут при комнатной температуре, в защищенном от света месте.
- Центрифугируйте клетки при давлении 500 x g в течение 5 минут при 4 °C. Отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
- Добавьте 1 мл 100% метанола, охлажденного при -20 °C, непосредственно в пробирку.
- Образцы инкубировать при температуре -20 °C в течение 30 минут в защищенном от света месте.
ПРИМЕЧАНИЕ: На этом этапе можно хранить фиксированные и проникнутые клетки при температуре -80 °C в течение одного месяца перед анализом.
4. Окрашивание фосфолоу
ПРИМЕЧАНИЕ: Следующую панель антител валидировали с помощью проточного цитометра, оснащенного следующими лазерами: 320 нм, 355 нм, 405 нм, 488 нм, 561 нм, 637 нм и 808 нм. Эта панель должна быть повторно проверена, если используются разные цитометры с разными настройками лазера и детектора.
- Приготовьте раствор мастер-смеси антител со следующими разведениями в коммерчески доступном буфере для окрашивания (табл. 1), рассчитав объем 50 мкл для каждого образца. Хранить при температуре 4 °C в защищенном от света месте.
- Для промывки (шаги 4.8, 4.10) держите PBS на льду (2 мл для каждой пробы).
- Приготовьте второй исходный раствор смеси для контрольных изотипов, которые технические репликации будут воспроизводить в буфере для окрашивания (табл. 1), рассчитав объем 50 мкл для каждого образца. Хранить при температуре 4 °C в защищенном от света месте. Для технической воспроизводимости рекомендуется использовать как минимум два контрольных образца изотипа.
- Центрифугируйте элементы на этапе 3.7 при 500 x g в течение 5 минут при 4 °C. Отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
ПРИМЕЧАНИЕ: После фиксации и пермеабилизации клетки могут казаться более прозрачными. - Добавьте 50 мкл раствора смеси антител (шаг 4.1) или раствор смеси контроля изотипа (шаг 4.2). Аккуратно ресуспендируйте клетки с помощью пипетки.
- Инкубируйте все образцы в течение ночи при температуре 4 °C в защищенном от света месте.
- Центрифугируйте ячейки при давлении 500 x g в течение 5 мин при 4 °C. Отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
- Промойте 1000 μL PBS, аккуратно взвесив с помощью пипетки.
- Центрифугируйте ячейки при давлении 500 x g в течение 5 мин при 4 °C. Отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
- Проведите вторую промывку 1000 мкл PBS, аккуратно восстановив суспензию с помощью пипетки.
- Центрифугируйте ячейки при давлении 500 x g в течение 5 мин при 4 °C. Отсадите и выбросьте надосадочную жидкость с помощью вакуумной системы.
- Ресуспендируйте образцы в 200 мкл PBS. Перенос в пробирки или планшеты FACS для анализа с помощью проточной цитометрии (рис. 3).
- Приготовьте одноцветные компенсационные регуляторы с гранулами, инкубируя 0,1 мкл каждого антитела с компенсационными гранулами, в соответствии с инструкциями производителя (см. Таблицу материалов).
Результаты
Экспериментальный дизайн направлен на мониторинг состояния фосфорилирования выбранных представляющих интерес белков в различные моменты времени, например, через 1 день до начала лечения и через 15 дней после начала лечения. Этот исходный уровень служит критически важным контролем для проверки достоверности последующих изменений в активации сигнальных путей после лечения. После пятнадцати дней лечения проводится второе сравнение для оценки модуляции путей у обработанных мышей по сравнению с контрольной группой, получавшей носители (рис. 4). Этот двухэтапный подход позволяет отличить эффекты, вызванные лечением, от исходной вариабельности.
Для этого исследования была использована мышиная модель AML PDX. Мышам трансплантировали полученные от пациента клетки ОМЛ, характеризующиеся следующими мутациями: DNMT3AMR882H с вариантной фракцией аллеля (VAF) 48%, NPM1W288fs VAF 36%, FLT3ITD VAF 10% и IDH2R140Q VAF 44%. После трансплантации было отведено три недели для роста опухоли, прежде чем начать лечение. Мышей, которым трансплантировали PDX с мутантным мутантом FLT3, в течение 15 дней проводили лечение по одной из трех схем: плацебо, гилтеритиниб (15 мг/кг в день) или комбинация венетоклакса (50 мг/кг в день), 5-азацитидина (2,5 мг/кг в день) и цедаризудина (3 мг/кг в день) (рисунок 4A).
Что касается полученных результатов, следует отметить, что лечение по схеме на основе венетоклакса привело к значительному усилению фосфорилирования STAT5 и RPS6, что позволяет предположить, что эти пути способствуют резистентности к терапии (рис. 4E). Напротив, гилтеритиниб, препарат, нацеленный на FLT3, не снижал статус фосфорилирования мутантных эффекторов FLT3. Возможно, что в испытанном образце ОМЛ присутствие дополнительных вторичных мутаций, отличных от FLT3-ITD (например, IDH2), способствует активации этих путей, или что лечение препаратом в течение двух недель приводит к селективной элиминации клеток ОМЛ со сниженной сигнализацией. Поскольку все анализируемые фосфопротеины являются гейтированными из одной и той же клеточной популяции, можно сравнить активацию фосфопротеинов. В этом эксперименте самая сильная корреляция в окрашивании фосфопротеинов, по-видимому, наблюдается между p-STAT5 и p-RPS6 (дополнительный рисунок 1A), которые в этой экспериментальной группе активируются после лечения (рисунок 4E). По-видимому, существует меньшая связь между p-STAT5 и p-ERK (дополнительный рисунок 1B). Важно отметить, что размер клеток (оцененный с помощью FSC-A) не является основным фактором общей положительности p-STAT5, что подчеркивает, что окрашивание положительного результата является не просто продуктом размера клеток (дополнительный рисунок 1C). Эта экспериментальная структура позволяет всесторонне оценить влияние этих методов лечения на модуляцию сигнального пути.
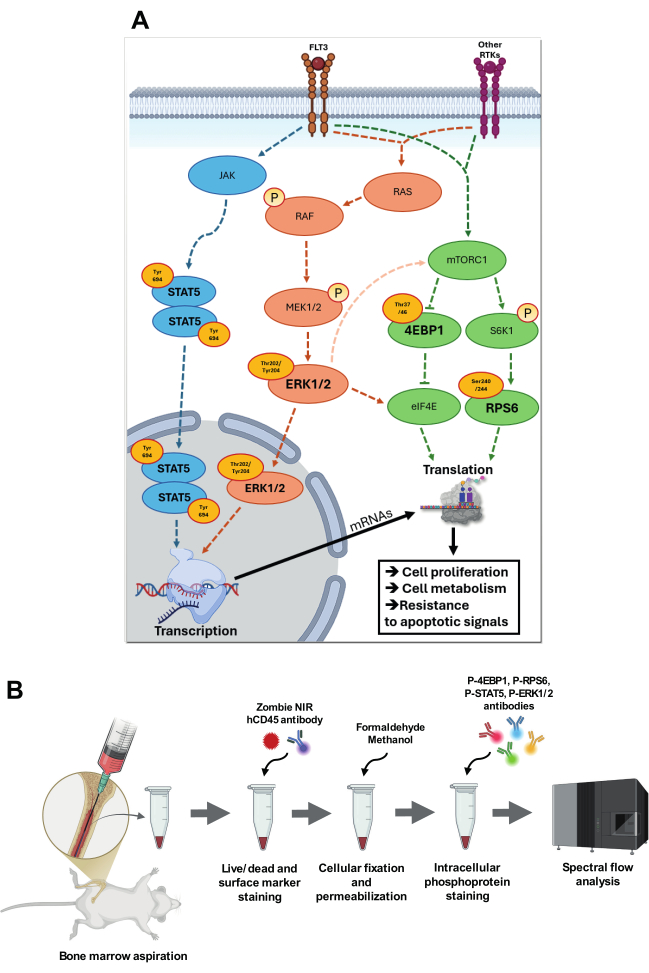
Рисунок 1: Визуализация целевых сигнальных путей и стратегия их анализа. (A) Обзор сигнальных путей, включающих p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) и p-ERK1/2 (Thr202/Tyr204). В пути p-STAT5 JAK подвергается аутофосфорилированию, увеличивая свою каталитическую активность, затем фосфорилирует специфические остатки тирозина, создавая сайты стыковки для белков STAT. Фосфорилированный STAT5 (Tyr694) гомодимеризуется и транслоцируется в ядро, где связывается со специфическими STAT-чувствительными элементами в промоторных областях генов-мишеней. В каскаде RAS-RAF-MEK-ERK аутофосфорилирование рецептора FLT3 или других рецепторных тирозинкиназ (RTKs) при связывании с лигандом приводит к обмену GDP на GTP на RAS, тем самым активируя RAS. Активированный RAS-GTP рекрутирует RAF к плазматической мембране, где RAF претерпевает конформационное изменение и становится активным. Затем RAF фосфорилирует и активирует MEK1/2, киназу двойной специфичности, которая, в свою очередь, фосфорилирует ERK в остатках Thr202/Tyr204. Активированный ERK1/2 транслоцируется в ядро, где фосфорилирует специфические факторы транскрипции. ERK1/2 также способен, через промежуточные сигнальные пути, увеличивать активность mTORC1 и фосфорилировать eIF4E в определенных сайтах для увеличения трансляционной активности. Активируемый питательными веществами и факторами роста через FLT3 и другие RTK, mTORC1 фосфорилирует следующие мишени, такие как S6K1 и 4E-BP1. S6K1, в свою очередь, фосфорилирует RPS6, что усиливает функцию рибосом и активизирует трансляцию. Гиперфосфорилирование 4E-BP1 высвобождает eIF4E, что позволяет собрать комплекс инициации трансляции eIF4F и активировать cap-зависимую трансляцию. Все эти пути активно участвуют в ОМЛ, способствуя приобретенным адаптациям за счет увеличения пролиферации клеток, метаболизма и устойчивости к сигналам апоптоза. (B) представлены основные этапы протокола аспирации костного мозга и внутриклеточного окрашивания фосфолоу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Визуализация критических этапов во время процедуры аспирации костного мозга. Операционная зона и необходимые материалы устанавливаются под ламинарным проточным колпаком. После анестезии методом ингаляции изофлураном (А) бедренная суставная поверхность подготавливается к аспирации (В,С). Бедренная кость прокалывается первым шприцем, выровненным по середине бедренной кости (D). Очень важно избегать сильного давления на иглу и вместо этого выполнять вращательное сверлильное движение; Обычно этого достаточно для того, чтобы игла проделала перфорацию поверхности кости и прошла по пути бедренной полости. Далее костный мозг отсасывается с помощью второго шприца через место прокола (I,J). После переноса аспирата костного мозга в микроцентрифужную пробирку (K) применяется мягкое давление, чтобы остановить кровотечение в области (L), и мышь помещается в теплую и чистую клетку для восстановления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
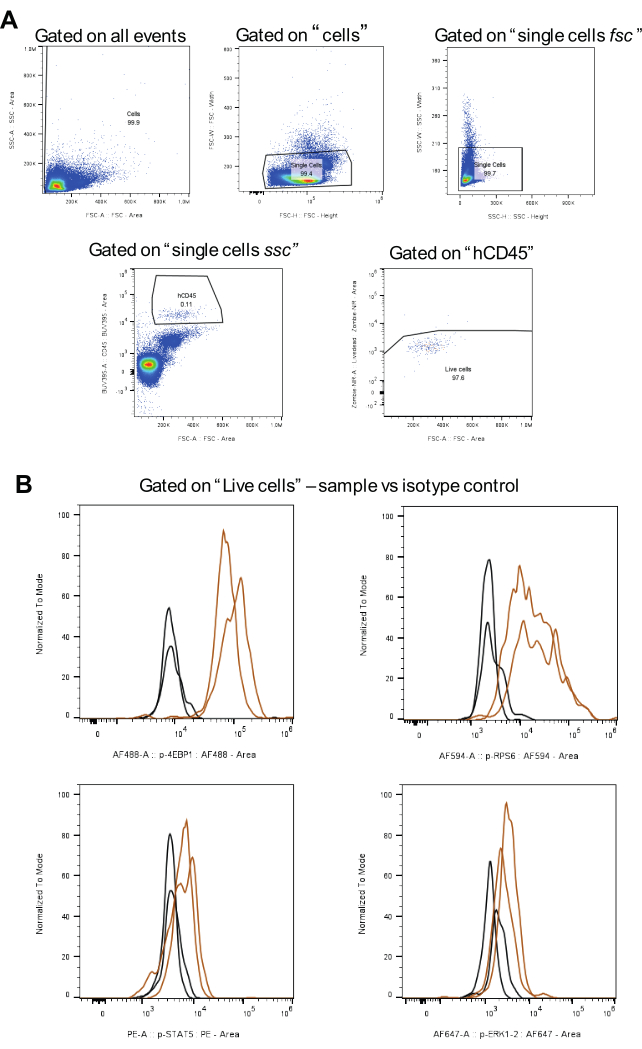
Рисунок 3: Рабочий процесс для анализа стратегии стробирования, включая управление изотипами. (A) представляет собой стратегии гейтирования для живых клеток, исключения дублетов и hCD45-положительных клеток ОМЛ. (B) показывает сигналы для каждого фосфопротеина коричневым цветом и контрольной группы изотипа черным цветом (два биологических повтора). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
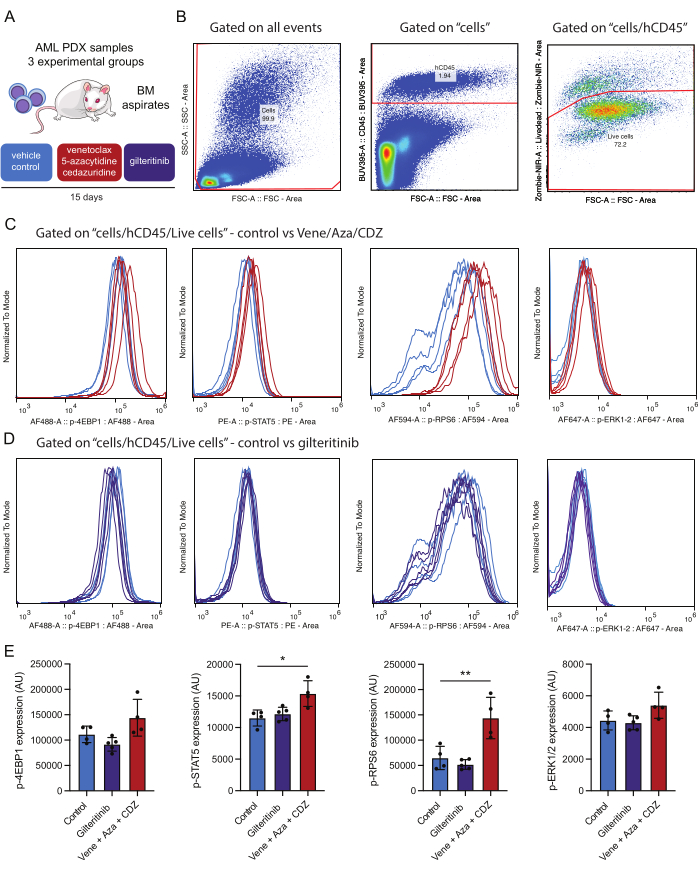
Рисунок 4: Рабочий процесс для обнаружения и анализа внутриклеточных фосфопротеинов после иммуноконстатирования жизнеспособных клеток ОМЛ костного мозга. (A) Мышей NSG-SGM3, привитых донорскими пациентами клетками ОМЛ, лечили носителем (контроль) или венетоклаксом, 5-азацитидином и цедазуридином (vene/aza/CDZ) или гилтеритинибом. Через 15 дней были обработаны аспираты костного мозга (КМ). (B) представляет собой стратегию гейтирования для анализа жизнеспособных клеток ОМЛ (например, hCD45/Zombie-NIR положительных) через 15 дней после лечения. (C,D) представляют собой нормализацию сигнала для каждого из фосфоантител, как показано, в 10 000 клетках ОМЛ, выделенных от мышей, получавших венетоклакс/5-азацитидин/цедазуридин или носитель (В) или гилтеритиниб или носитель (С). Следы представляют собой сигналы в клетках ОМЛ, выделенных от контрольной мыши, обработанной носителем (светло-голубой), vene/aza/CDZ (красный) или гилтеритинибом (фиолетовый). (E) Гистограмма представляет собой среднее значение изменений интенсивности окрашивания для каждого фосфопротеина, протестированного на живых клетках AML CD45+ человека от трех мышей и SD. Полосы погрешности представляют собой стандартное отклонение. Звездочками обозначены достоверные различия в интенсивности окрашивания по данным ANOVA со значениями p ниже 0,05 (*) и 0,01 (**). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Антитело | Флуорохром | Разбавление |
| p-RPS6 (Ser240/244) | АФ594 | 1/50 |
| p-4EBP1 (Thr37/46) | АФ488 | 1/50 |
| p-STAT5 (Tyr694) | ПЭ | 1/100 |
| p-Erk1/2 (Thr202/Tyr204) | АФ647 | 1/100 |
| Контроль IgG у кроликов | АФ594 | 1/50 |
| Контроль IgG у кроликов | АФ488 | 1/50 |
| Контроль IgG у кроликов | ПЭ | 1/100 |
| Контроль IgG у кроликов | АФ647 | 1/100 |
Таблица 1: Список оптимизированных разведений для антител.
Дополнительный рисунок 1: Сравнение p-STAT5, p-RPS6, p-ERK1/2 и FSC-A в репрезентативной выборке AML PDX. На этом рисунке показан пример взаимосвязи между p-STAT5, p-ERK и p-RPS6 у мыши "E9" на 15-й день лечения венетоклаксом/5-азацитидином/цедазуридином (результат на рисунке 4C). В этом образце наиболее сильная корреляция в окрашивании фосфопротеинов, по-видимому, наблюдается между p-STAT5 и p-RPS6 (A), которые в этой экспериментальной группе активируются после лечения (рис. 4E). По-видимому, существует меньшая связь между p-STAT5 и p-ERK (B). Важно отметить, что размер клеток (оцененный с помощью FSC-A) не является основным фактором общей положительности p-STAT5, что подчеркивает, что окрашивание положительного результата является не просто продуктом размера клеток (C). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Критические шаги
Использование иммунологических методов при изучении сложных сигнальных путей путем специфического обнаружения фосфопротеинов требует, чтобы экспериментальные переменные строгоконтролировались22, подготовка образцов была тщательной, а для валидации использовались дополнительные методы. Интеграция этих практик обеспечивает воспроизводимость, точность и надежность данных, что в конечном итоге способствует более надежным биологическим выводам. Эти усилия не только повышают научную строгость метода, но и расширяют его применимость в комплексных исследованиях клеточной сигнализации и регуляции. Надлежащая анестезия и бережное обращение имеют решающее значение для минимизации физиологического стресса, который может значительно изменить результаты экспериментов, особенно в исследованиях, посвященных иммунным реакциям или сигнальным путям. Обеспечение надлежащих протоколов обезболивания еще больше помогает поддерживать благополучие животных, предотвращая стресс, связанный с болью, который может повлиять на данные. Поддержание асептических условий во время процедуры жизненно важно для предотвращения инфекций, которые могут привести к воспалительным реакциям и потенциально исказить результаты эксперимента. Это включает в себя стерилизацию оборудования, использование чистых перчаток и тщательную дезинфекцию места аспирации.
Фосфорилированные белки обладают высокой чувствительностью к дефосфорилированию фосфатазами при манипуляциях с биологическими образцами22,23. Для сохранения состояний фосфорилирования во время обработки необходима немедленная фиксация. Были протестированы два различных метода фиксации/пермеабилизации: набор цитофикс/цитоперм и общий метод формальдегид/метанол, описанный в протоколе. Среди них метод на основе метанола обеспечил более чистые результаты с более яркими флуоресцентными сигналами, что делает его предпочтительным выбором. После фиксации образцы могут храниться кратковременно при температуре -20 °C или длительное время при -80 °C. В экспериментах фиксированные образцы, хранившиеся до трех месяцев при температуре -80 °C, дали стабильные результаты. Для окрашивания антител ночная инкубация может повысить точность, особенно при тонких сдвигах фосфорилирования, хотя это зависит от конкретного эксперимента и исследуемых эффектов препарата. Более короткая инкубация продолжительностью 1 ч также была испытана на льду, защищенном от света, что в некоторых случаях дало приемлемые результаты. Для обеспечения точной оценки фонового шума рекомендуется использовать элементы управления изотипами в качестве эталона для неспецифического связывания, как показано на рисунке 3.
Модификации и устранение неисправностей техники
Чтобы развить технические навыки, слушатели в нашей группе отрабатывают технику введения иглы на усыпленных мышах, где правильность размещения может быть подтверждена вскрытием. Процедура работы с живыми животными наиболее эффективно выполняется двумя операторами, при этом один из них может сосредоточиться на стремлениях, в то время как помощник занимается задачами мониторинга животных и обработки образцов. В редких случаях, когда невозможно получить аспирацию после нескольких попыток, рекомендуется прервать процедуру, поскольку риск травмы увеличивается с каждой попыткой. Не менее важен постпроцедурный мониторинг животных. Наблюдение за признаками инфекции, боли или стресса обеспечивает благополучие мышей и надежность исследования. Жилищные условия должны способствовать выздоровлению, с соответствующими постельными принадлежностями и питанием, чтобы свести к минимуму внешние факторы стресса.
Для проточного цитометрического анализа рекомендуется обрабатывать все фиксированные и консервированные образцы из разных дней аспирации костного мозга одновременно. Изменения в регидратации и окрашивании образца из-за различий в днях обработки или операторах могут повлиять на чувствительность флуоресценции, регистрируемую цитометром. Чтобы обеспечить стабильные результаты, оптимизируйте настройки напряжения цитометра, чтобы все окрашенные образцы оставались в пределах диапазона обнаружения, прежде чем продолжить. Конъюгированный с Alexa Fluor 488 белок p-4EBP1 демонстрирует самую высокую яркость среди маркеров на этой панели, что делает его надежным эталоном для установки максимальной дальности обнаружения. Хотя панель антител, представленная в этом протоколе, не требовала коррекции компенсации, она может варьироваться в зависимости от используемого спектрального проточного цитометра.
Ограничения
Одним из основных ограничений этого метода является количество клеток, извлекаемых во время аспирации костного мозга. Чтобы получить надежные результаты, важно окрашивать достаточное количество клеток, чтобы проанализировать минимум около 10 000 клеток в образце. Анализ слишком малого количества клеток может привести к значительным различиям между выборками, что поставит под угрозу точность и интерпретируемость данных. Обеспечение достаточного количества клеток имеет решающее значение для надежных и воспроизводимых механистических исследований.
Для анализа данных применяется стратегия стробирования, показанная на рисунке 3A . Во-первых, после исключения дублетов, представляющие интерес клетки идентифицируют с помощью человеческого антитела к CD45 в сочетании с BUV395. Далее стробирование для живых клеток производится с помощью Zombie NIR. Наконец, для каждого фосфопротеина рассчитывается медиана интенсивности флуоресценции (MFI) (рис. 3B). Все клетки, проанализированные на все фосфорилированные белки, были скобированы с использованием одной и той же стратегии, что обеспечило согласованность и сопоставимость между популяциями клеток ОМЛ.
Еще одним ограничением этого метода является возможность фонового шума, который может возникнуть из-за связывания неспецифических антител, недостаточной промывки, автофлуоресценции клеток или неправильной пермеабилизации. Это может повлиять на специфичность сигнала и снизить точность анализа фосфолоу-цитометрии. Пользователям, столкнувшимся с этими проблемами, рекомендуется провести дополнительный этап промывки для снижения фонового шума, а для минимизации неспецифического связывания можно использовать реагенты, блокирующие Fc. Кроме того, флуоресценция мертвых клеток может повлиять на результаты, что делает необходимым использование красителей для повышения жизнеспособности. Важно отметить, что для точного анализа количество анализируемых клеток должно быть не менее 500 клеток AML, чтобы обеспечить надежные и воспроизводимые результаты. Также важно убедиться, что во время окрашивания используется одинаковое количество клеток, чтобы сохранить однородность образцов. Несмотря на эти ограничения, тщательная оптимизация элементов управления и стратегий стробирования может повысить надежность метода.
Значение методики
Методика аспирации костного мозга уже опубликована3; Тем не менее, обновленная методика включена в этот протокол с пояснением, подчеркивающим два преимущества: улучшенная иммобилизация и использование двухигольчатого подхода для повышения точности и стабильности аспирации костного мозга, предотвращая любые проблемы с блокировкой иглы костными фрагментами. Для лонгитюдных исследований аспирация бедренной кости может быть выполнена несколько раз, что является мощным методом отслеживания биологических изменений с течением времени у отдельных животных. Между аспирациями на одной и той же бедренной кости рекомендуется минимальный интервал в один месяц, чтобы обеспечить достаточное заживление кости и регенерацию костного мозга. При использовании контралатеральной бедренной кости достаточно более короткого интервала в одну неделю, чтобы убедиться, что мышь восстановилась от последствий анальгезии и анестезии без внесения чрезмерного стресса или физиологической изменчивости.
В целом, этот комбинированный метод аспирации костного мозга мышей и проточной цитометрии дает ценную информацию о ключевых сигнальных путях, включая JAK/p-STAT5, mTORC1/p-4EBP1, mTORC1/p-RPS6 и MEK/p-ERK1/2. Эти пути играют важную роль в резистентности к лечению при ОМЛ. Этот метод позволяет повторно брать пробы у одного и того же животного, что позволяет в режиме реального времени отслеживать прогрессирование заболевания и реакцию на терапию на уровне отдельных клеток.
Фосфофлоуточная цитометрия фиксирует события фосфорилирования и сохраняет клеточную гетерогенность 4,23,24. Это делает его особенно ценным для понимания динамических клеточных реакций на терапию в конкретных лейкозных субпопуляциях.
Будущие приложения
Этот протокол представляет собой ценный инструмент для изучения основных механизмов адаптации к лечению и возникновения резистентности при ОМЛ, прокладывая путь к более глубокому пониманию и потенциальным терапевтическим достижениям. Будущие исследования могут объединить этот подход с транскриптомикой или протеомикой одиночных клеток для дальнейшего анализа молекулярных механизмов, вызывающих резистентность и прогрессирование заболевания. Кроме того, применение этого метода к другим гематологическим злокачественным новообразованиям или воспалительным заболеваниям может расширить его влияние в трансляционных исследованиях.
Совершенствуя этот протокол и устраняя его ограничения, этот подход может стать стандартным методом изучения передачи сигналов фосфопротеинов при гематологических заболеваниях, что в конечном итоге поможет в разработке более эффективных терапевтических стратегий. В заключение следует отметить, что этот протокол представляет собой ценный инструмент для изучения основных механизмов адаптации к лечению и возникновения резистентности при ОМЛ, прокладывая путь к более глубокому пониманию и потенциальному терапевтическому прогрессу.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами на переходный период для ЛГ и ФЭМ от Фонда Коула, а также грантами от Канадского общества лейкемии и лимфомы и Канадского института исследований в области здравоохранения (PJT-186019) для ЛГ и ФЭМ. FEM является клиническим ученым FRSQ Junior 2, а ЛГ - младшим научным сотрудником FRSQ 2. VG имеет докторскую стипендию от Фонда Коула. Рисунок 1 был создан с помощью BioRender в соответствии с лицензионным соглашением. Графики проточной цитометрии были сгенерированы с помощью программного обеспечения FlowJo. Особая благодарность доктору Колину Кристу и Виктории Ричард за предоставленный доступ к их клинике для животных.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
Ссылки
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены