Method Article
急性骨髄性白血病患者由来異種移植の細胞内リン酸化流サイトメトリー
要約
ここでは、マウスに異種移植され、骨髄穿刺から得られた急性ヒト骨髄性白血病細胞におけるmTORC1、JAK/STAT5、およびMAPK経路の下流のシグナル伝達を分析するためのリン酸化流サイトメトリーベースの方法について説明します。p-STAT5、p-4EBP1、p-RPS6、p-ERK1/2の各レベルを、高感度の次世代スペクトルフローサイトメーターを用いて同時に測定します。
要約
承認された治療法に適応し、抵抗するために、急性骨髄性白血病(AML)細胞は、遺伝子発現、タンパク質レベル、および活性の変化につながる特定の分子経路を活性化します。このプロトコルでは、AMLの発がん性シグナル伝達の下流でリン酸化される標的を調査するアプローチが報告されています:p-STAT5(Tyr694)、p-4EBP1(Thr37/46)、p-RPS6(Ser240/244)、およびp-ERK1/2(Thr202/Tyr204)。この方法により、これらの経路(幹細胞性の維持、免疫回避、タンパク質合成、酸化ストレスや代謝ストレスへの適応の主要な調節因子)が、治療段階の前後に吸引して生きたマウスから採取した骨髄細胞の1つ以上の試験済み化合物によってどのように調節されるかを評価できます。この低侵襲法は、損傷を誘発し、実験結果に影響を与える可能性のある骨砕技術と比較して、細胞の完全性を維持し、ストレスを軽減します。フローサイトメトリー解析のための細胞内抗体染色を最適化するために、パラホルムアルデヒド固定とメタノール透過処理を用いたプロトコールを開発しました。このアプローチにより、高い染色精度が保証され、バックグラウンドノイズが最小限に抑えられるため、細胞内シグナル伝達マーカーの信頼性の高い検出が可能になります。このプロトコルの主な利点の1つは、マルチパラメトリック抗体パネルの開発であり、同じサンプル内の4つの経路を同時に評価できます。高感度の次世代スペクトルフローサイトメーターを用いて、同じマウスで治療前のベースラインレベルと比較して、治療条件に応じて経路活性化のダイナミックなシフトが観察されました。この方法論により、動物を安楽死させることなく、患者由来の異種移植骨髄サンプルにおけるシグナル伝達経路の調節をin vivo で正確に解析することができ、AML細胞の適応メカニズムに関する貴重な洞察を得るとともに、これらの経路を標的とする治療戦略の評価を導くことができます。
概要
急性骨髄性白血病(AML)は、骨髄および末梢血に未熟な骨髄前駆細胞が蓄積することを特徴とする侵攻性の血液悪性腫瘍です。これにより、正常な造血が妨げられ、生命を脅かす血球減少症や全身性合併症を引き起こします。化学療法レジメン、標的療法、造血幹細胞移植の進歩により、一部の患者の転帰は改善されましたが、全体として、5年生存率は約30%にとどまり、高齢の患者や遺伝子プロファイルが悪い患者の予後は悪化しています1。AMLの管理における大きな課題は、薬剤耐性の頻繁な出現であり、これが再発と治療の失敗の一因となっています2。このことは、AMLの進行と治療耐性を促進する分子および細胞メカニズムをより深く理解することの重要性を強調しています。
この課題に対処するために、骨髄穿刺とマルチプレックス細胞内リン酸化フローサイトメトリーを組み合わせた新しい方法が提示され、AML患者由来異種移植片(PDX)モデルの細胞内シグナル伝達経路を調査するための強力なツールが提供されます(図1A、B)。PDXモデルにおける骨髄穿刺は以前にも説明されていますが3、このプロトコルは、ホスホフロー分析のために白血病細胞を保存するように最適化されています。この方法の全体的な目標は、白血病の進行と治療反応中に縦断的に適用可能な低侵襲手順を単一細胞の分解能で提供することです。この手法では、同じ動物から繰り返しサンプリングを行うことで、治療中の疾患の進行をより正確に表現することができます。この技術の開発の背後にある理論的根拠は、AML細胞における細胞内シグナル伝達の高解像度で動的な評価の必要性にあります。ウェスタンブロッティングなどの従来の方法では、多数のセルが必要であり、シングルセルの分解能がなく、マルチプレックス化ができませんでした4。対照的に、ホスホフローサイトメトリーは細胞の不均一性を保持し、異なる白血病亜集団における複数のリン酸化シグナル伝達タンパク質の検出を可能にし5、AML治療に応答した経路活性化に関する重要な洞察を提供します。
AMLの生物学の中心となるのは、マイトジェン活性化プロテインキナーゼ(MAPK)、ラパマイシン複合体1のメカニズム標的(mTORC1)、ヤヌスキナーゼ/シグナルトランスデューサーおよび転写活性化因子5(JAK/STAT5)シグナル伝達経路など、細胞の増殖、生存、代謝適応を調節するシグナル伝達経路です。これらの経路は、白血病細胞の増殖と生存における役割を超えて、幹細胞性の維持、免疫回避、酸化ストレスや代謝ストレスへの適応などの主要な発がんプロセスにも大きく関与しています4。これらの経路間のクロストークは、細胞の増殖と生存を促進するだけでなく、転写、翻訳、細胞代謝などの重要なプロセスを調整することで、AML細胞が治療介入に直面しても増殖を維持し、アポトーシスシグナルに抵抗することを可能にします6,7(図1A)。
p-ERK1/2(Extracellular signal-regulated kinase 1/2)などの主要なエフェクターを含むMAPK経路は、成長因子やサイトカインなどの細胞外シグナルの統合に重要な役割を果たし、細胞の増殖と生存を調節します。ERK1/2の活性化は、RAS(ラット肉腫)-RAF(Rapidly Accelerated Fibrosarcoma)-MEK(MAPK/ERK Kinase)-ERKカスケードを介して起こり、RAS-GTPがRAFをリクルートし、MEK1/2、次にThr202/Tyr204でのERK1/2の連続的なリン酸化につながります。リン酸化されると、ERK1/2は二量体化して核に転座し、MYC(骨髄細胞腫症ウイルスがん遺伝子ホモログ)、ELK1(ETS Like-1タンパク質)、AP-1(活性化タンパク質-1)などの転写因子をリン酸化し、細胞増殖、分化ブロック、および生存を促進します8。AMLでは、FLT3(fms様チロシンキナーゼ3)、RAS、またはKITの変異により、しばしば構成的ERK活性化が起こります9,10(図1A)。
FLT3、RAS、またはKITの変異もmTORC1シグナル伝達のアップレギュレーションを引き起こし、代謝再配線、タンパク質合成の調節、リボソーム生合成、オートファジーなどの発がんプロセスをサポートすることにより、AMLの増殖と治療抵抗性を可能にします11。mTORC1は、mRNA翻訳の制御を通じて、発がん性タンパク質やAMLの進行に不可欠なその他の因子の産生を促進します。mTORC1基質の主要なグループには、4E-BP(真核生物の開始因子4E結合タンパク質)が含まれます。低リン酸化状態では、4E-BPはeIF4E(真核生物の開始因子4E)に結合し、キャップ依存性翻訳を阻害します。mTORC1によるThr37/46での4E-BP1のリン酸化は、eIF4Eの放出を引き起こし、MYC、CCND1(Cyclin D1)、MCL-1(骨髄性白血病1)などの主要な発がん性mRNAの翻訳の開始を可能にし、それによって白血病の増殖と生存を促進します8,12。さらに、Ser240/244でのRPS6リン酸化は、mTORC1の下流のS6K1(リボソームタンパク質S6キナーゼβ-1)によって媒介され、リボソームの生合成とmRNA翻訳を促進し、代謝適応、ストレス耐性、および急速な増殖に必要なタンパク質の合成を増加させます8,13。特に、mTORC1活性は、治療ストレス下でAML細胞が採用する重要な生存戦略である代謝適応と密接に関連しています13,14,15(図1A)。
JAK/STAT5経路は、AMLにおけるもう一つの重要なシグナル伝達軸であり、特にサイトカイン受容体に影響を与える突然変異や、JAK2、FLT3、CALR(カルレティキュリン)などのシグナル伝達メディエーターを有する場合において16,17。STAT5は、FLT3やJAK2などの受容体を介したサイトカインシグナル伝達に応答して活性化されます。リガンドが結合すると、関連ヤヌスキナーゼ(JAK)はTyr694でSTAT5をリン酸化します。リン酸化STAT5は二量体化して核に転座し、そこで特定のDNA配列に結合して、細胞の生存、増殖、および分化に関与する遺伝子の転写を調節します8。AMLでは、STAT5の構成的活性化は、多くの場合、FLT3またはJAK2の変異によるもので、白血病発生を促進する遺伝子の持続的な発現につながります18(図1A)。
これらの経路は、個々の寄与を超えて、転写と翻訳の両方を調節するために収束し、生存と耐性を促進する方法でAML細胞のプロテオームを形成します。特に、mRNA翻訳は、AML細胞が環境課題に適応し、標的療法の影響を回避することを可能にする発癌性タンパク質とストレス応答因子の迅速な産生を可能にするため、AMLの病態生理学における重要な要素として浮上しています。真核生物の開始因子(eIF)やリボソームタンパク質などの翻訳機構の調節不全は、AML19の治療抵抗性と予後不良に関与しています。転写および翻訳調節におけるMAPK、mTORC1、およびJAK/STAT5経路の役割の詳細な調査は、AMLの進行と耐性の根底にある分子メカニズムを包括的に理解するために不可欠です。このような洞察は、治療反応の新しいバイオマーカーを特定し、これらの経路を標的にして耐性を克服する新しい治療戦略を設計するために重要です。この記事では、AML患者由来異種移植片(PDX)モデルでこれらのシグナル伝達ネットワークを調査するために特別に設計されたプロトコルを提供します。
このプロトコルの主な利点の 1 つは、骨髄吸引と細胞内リン酸化サイトメトリーの統合であり、AML 患者由来異種移植片 (PDX) モデルにおけるシグナル伝達経路の活性化を動的かつ低侵襲的に評価できることです。これは、標的療法に応答したMAPK、mTORC1、JAK/STAT5などの主要な経路の活性化状態をモニタリングするために特に価値があります。これらの技術を組み合わせることで、AML生物学の包括的かつ高解像度の理解を得ることができ、最終的にはより効果的な治療戦略の開発に役立ちます。
プロトコル
以下の実験は、マギル大学動物管理委員会(CIHR PJT-186019)およびユダヤ総合病院の施設審査委員会(11-047)の承認を得て実施しました。このプロトコルでは、8週齢から6ヶ月齢、体重20〜30gの雄のNOD-scid IL2Rg^null-3/GM/SF(NSGS)マウスに、以前にヒト患者由来のAML細胞を移植しました。本試験で使用した試薬および装置の詳細は、 材料表に記載されています。
1.骨髄穿刺
注意: 針の使用を取り巻く安全上の注意に従う必要があります。
- 周術期鎮痛:骨髄穿刺の1〜4時間前に、マウスに0.1 mg / kgのブプレノルフィン徐放性を皮下注射します(皮下)。これにより、処置後最大72時間の鎮痛が保証されます。
- 椎弓パッド、ヘアトリマー、加熱ランプ、および骨髄吸引に必要なすべての材料(25 Gシリンジ、氷上に0.5 mLのPBSを含む1.5 mLの微量遠心チューブ、70%イソプロパノール綿棒)を使用して、層流フードの下の手術領域を準備します。粘着テープを使用して、イソフルラン吸入用のノーズコーンを固定します(図2A)。
- 吸引物ごとに 2 つの 25 G シリンジを準備し、1 つは骨穿刺用 (「ドライ ニードル」) 用、もう 1 つは吸引用にハブが PBS でフラッシュされた (「フラッシュ ニードル」) です。
- 認定された気化器によるイソフルラン吸入を使用してマウスを麻酔します、製造元の指示と獣医のガイドラインに従って。現地の手続きは異なる場合があります。参考までに、このプロトコルは、マウス麻酔20に関するマギル大学の標準操作手順に従っています。
- 足のピンチや筋肉の弛緩に対する反応の欠如 による 麻酔の深さを確認します。動物が麻酔下にある間の乾燥を防ぐために、獣医軟膏を目に塗ります。麻酔中の呼吸数を継続的に監視します。
- ヘアトリマーを使用して吸引が行われる脚全体を剃ります。吸引部位(大腿骨)をイソプロピルアルコールで飽和させた消毒パッドで消毒します(図2B)。
- 穿刺部位が位置する大腿骨の関節面を、膝を曲げて利き手ではない手で脚を固定することにより露出させます。親指を脛骨に、人差し指を大腿骨に、中指を合わせて、2つの骨の外側のすべてを安定させます(図2C)。
注意: 誤嚥中の脚の動きが故障や怪我につながるのを防ぐために、利き手ではない手を使用して脚の非常に安定した位置決めを確保してください。脚の固定が安定していない場合は、穿刺する前に手の位置を変えて再試行してください。 - 利き手ではない手で固定しながら、膝の部分をイソプロピルアルコール(図2C)で再度消毒し、残りの毛を遠ざけて骨構造の視覚化を改善します。
- 最初の乾いた25Gシリンジを使用して、大腿骨関節の中央に配置し、無理に回転させることにより、大腿骨関節面に穴を開けます(図2D、E)。シリンジの針が大腿骨の縦軸と完全に位置合わせされている(0°ずれている)ことを確認して、骨髄に正しく入ります。
注意: この位置合わせを維持して、周囲の組織に不必要な損傷を与えることなくスムーズに侵入できるようにします。針が大腿骨の中央に入ると、抵抗がわずかに減少すると、骨髄腔への浸透が成功したことを示します(図2F)。このステップで針に過度の力を加えると、正しい位置合わせが失われたり、骨折したり、外傷したりする可能性があるため、避けてください。回転式ドリルモーションを使用すると、針が最も抵抗の少ない経路をたどり、大腿骨腔に正しく入る可能性が高くなります。大腿骨の内側に適切に配置された針は、それを保持している手が取り除かれても垂直に保たれる必要があります。 - 骨髄に入ったら、シリンジを回転させて徐々に取り外し(図2G)、2番目のフラッシュシリンジを最初の針でできた穴に挿入します(図2H、I)。
注:最初のシリンジは穴あけ中に骨によって塞がれることが多いため、2番目のシリンジが使用されます。 - 大腿骨内に挿入したシリンジに真空を当てながら、シリンジをゆっくりと回転させ、徐々に引き抜きます。シリンジのハブ内に約10〜20μLの骨髄が見えるはずです(図2J)。
注:必要に応じて、骨髄抽出を最適化するために、骨内で針をゆっくりと進めます。 - シリンジの内容物を500μLのPBSが入った冷却マイクロ遠心チューブに洗い流して骨髄に移します(図2K)。氷の上を保ち、できるだけ早くステップ2〜3に進んでください。
- イソプロパノールスワブを使用して穿刺部位に30秒間穏やかな圧力をかけ、出血を止めます(図2L)。
- マウスを、加温ランプを使用して温めた清潔なリカバリーケージに入れます。動物が目を覚まし、完全に回復するまで呼吸と可動性を監視してから、他のマウスと一緒に共同ケージに入れます。出血の兆候がないか確認してください。
2. 生/死者および表面マーカーの染色
注:手順全体を通して細胞を氷上に保ちます。ステップ2およびステップ3の前に、抗体染色溶液(ステップ2.4およびステップ2.7用)のマスターミックスを調製し、4°Cに保って光から保護します。新鮮な1.6%ホルムアルデヒド溶液(ステップ3.1)と-20°Cに保った100%メタノール溶液(ステップ3.6)を調製します。
- アクリジンオレンジ/ヨウ化プロピジウム(AO/PI)とセルカウンター21を用いて生存細胞をカウントする。
- 100万個の細胞に適切な量を新しい1.5 mLチューブに移します。ボリュームが十分でない場合は、ボリューム全体を取ります。残りの細胞をプールし、分注をアイソタイプコントロール染色用の3つの複製チューブ(各1 M)と未染色コントロール用のチューブ1つにプールします。
- 細胞を500 x g で4°Cで5分間遠心分離します。 上清はやさしく吸引し、真空吸引システムを使用して廃棄します。
- PBSで1/100に希釈した蛍光細胞染色液のサンプルあたり200 μLを添加し、死細胞を標識します。ピペットで細胞を穏やかに再懸濁します。アイソタイプコントロール染色用の予備チューブでも同じことを行います。
- 光から保護された氷上で10分間インキュベートします。
- 細胞を500 x g で4°Cで5分間遠心分離します。 穏やかに吸引し、真空システムを使用して上清を捨てます。
- ヒト造血細胞を標識するために、2%ウシ胎児血清を含むPBSで1/100に希釈したhCD45-BUV395抗体のサンプルあたり100 μLを添加します。アイソタイプコントロール用に保管されている余分なチューブについても同じことを行います。
- 光から保護された氷上で15分間インキュベートします。すぐに手順 3 に進みます。
3. 固定と透過化
- 新しい1.6%ホルムアルデヒド/PBS溶液を調製する:すべてのサンプルについて、29.5μLの37%ホルムアルデヒドストック溶液+970.5μLのPBSを混合します(予防措置として、いくらかの追加容量を考慮してください)。1.6%ホルムアルデヒド/ PBS溶液を室温で保管してください。
注意: ホルムアルデヒドは化学フードで取り扱われ、施設の安全規制に従って廃棄する必要があります。 - 細胞を500 x gで4°Cで5分間遠心分離します。 真空システムを使用して上清を吸引して廃棄します。
- 1.6%ホルムアルデヒド/PBS溶液1mLに再懸濁します。
- 光から保護した室温で10分間インキュベートします。
- 細胞を500 x g で4°Cで5分間遠心分離します。 真空システムを使用して上清を吸引して廃棄します。
- -20°Cで冷やした100%メタノール1mLを直接チューブに加えます。
- サンプルを-20°Cで30分間インキュベートし、光から保護します。
注:この時点で、固定および透過処理された細胞を-80°Cで最大1ヶ月間分析前に保存することが可能です。
4. ホスホフロー染色
注:以下の抗体パネルは、320 nm、355 nm、405 nm、488 nm、561 nm、637 nm、および808 nmのレーザーを搭載したフローサイトメーターを使用して検証しました。このパネルは、異なるサイトメーターを異なるレーザーおよび検出器セットアップで使用する場合は、再検証する必要があります。
- 市販の染色バッファー(表1)に以下の希釈液で抗体マスターミックス溶液を調製し、各サンプルの容量を50 μLと計算します。光から保護して4°Cに保ちます。
- 洗浄(ステップ4.8、4.10)の場合は、PBSを氷上に保ちます(サンプルごとに2 mL)。
- アイソタイプコントロールのテクニカルレプリケートを染色バッファー(表1)で行い、各サンプルの容量を50 μLと計算して、2つ目のマスターミックス溶液を調製します。光から保護して4°Cに保ちます。技術的な再現性のために、最低2つのアイソタイプコントロールサンプルが推奨されます。
- ステップ3.7の細胞を500 x g で4°Cで5分間遠心分離します。 真空システムを使用して上清を吸引して廃棄します。
注:固定および透過処理後、細胞はより半透明に見える場合があります。 - 50 μLの抗体ミックス溶液(ステップ4.1)またはアイソタイプコントロールミックス溶液(ステップ4.2)を添加します。ピペットで細胞を穏やかに再懸濁します。
- すべてのサンプルを4°Cで一晩インキュベートし、光から保護します。
- 細胞を500 x g で5分間、4°Cで遠心分離します。 真空システムを使用して上清を吸引して廃棄します。
- 1000 μLのPBSでピペットで穏やかに再懸濁して洗浄します。
- 細胞を500 x g で5分間、4°Cで遠心分離します。 真空システムを使用して上清を吸引して廃棄します。
- 1000 μLのPBSで2回目の洗浄を行い、ピペットで穏やかに再懸濁します。
- 細胞を500 x g で5分間、4°Cで遠心分離します。 真空システムを使用して上清を吸引して廃棄します。
- サンプルを200 μLのPBSに再懸濁します。FACSチューブまたはプレートに移し、フローサイトメトリーを使用して分析します(図3)。
- 製造元の指示に従って、各抗体をコンペンセーションビーズで0.1 μLインキュベートすることにより、ビーズを使用した単色コンペンセーションコントロールを調製します( 材料表を参照)。
結果
この実験デザインは、治療開始前1日と治療開始後15日など、さまざまな時点における対象タンパク質のリン酸化状態をモニタリングすることを目的としています。このベースラインは、治療後のシグナル伝達経路活性化のその後の変化の信憑性を検証するための重要なコントロールとして機能します。15日間の治療後、2回目の比較を行い、治療したマウスとビヒクルで処理した対照の経路調節を評価します(図4)。この 2 段階のアプローチにより、治療誘発効果とベースラインの変動性を区別することができます。
この研究では、AML PDXマウスモデルを使用しました。マウスには、変異対立遺伝子分画(VAF)が48%の DNMT3AMR882H 、 NPM1W288fs VAFが36%、 FLT3ITD VAFが10%、 IDH2R140Q VAFが44%の変異を特徴とする患者由来のAML細胞を移植しました。移植後、治療を開始する前に腫瘍の成長に3週間の猶予が与えられた。FLT3変異体移植PDXマウスは、プラセボ、ギルテリチニブ(15 mg / kg日)、またはベネトクラクス(50 mg / kg日)、5-アザシチジン(2.5 mg / kg日)、およびセダリズジン(3 mg / kg日)の3つのレジメンのいずれかで15日間治療されました(図4A)。
得られた結果に関して、ベネトクラクスベースのレジメンによる治療がSTAT5およびRPS6リン酸化を有意に増強したことに言及することは注目に値し、これらの経路が治療抵抗性に寄与することを示唆しています(図4E)。対照的に、FLT3を標的とする薬剤であるギルテリチニブは、変異型FLT3エフェクターのリン酸化状態を低下させませんでした。試験したAML検体では、FLT3-ITD以外の追加の二次変異(IDH2など)の存在がこれらの経路の活性化に寄与している、または2週間にわたる薬物治療により、シグナル伝達が減少したAML細胞の選択的排除につながる可能性がある。分析したすべてのリン酸化タンパク質は同じ細胞集団からゲートされているため、リン酸化タンパク質の活性化を比較することができます。この実験では、リン酸化タンパク質染色における最も強い相関関係は、p-STAT5とp-RPS6の間にあるようです(補足図1A)。これらは両方とも、処理後にこの実験グループでアップレギュレーションされます(図4E)。p-STAT5とp-ERKの間には、より小さな関係があるようです(補足図1B)。重要なことに、細胞サイズ(FSC-Aを使用して評価)は全体的なp-STAT5陽性率に大きく寄与しておらず、染色陽性が単に細胞サイズの産物ではないことが強調されています(補足図1C)。この実験フレームワークにより、シグナル伝達経路の調節に対するこれらの治療の影響を包括的に評価できます。
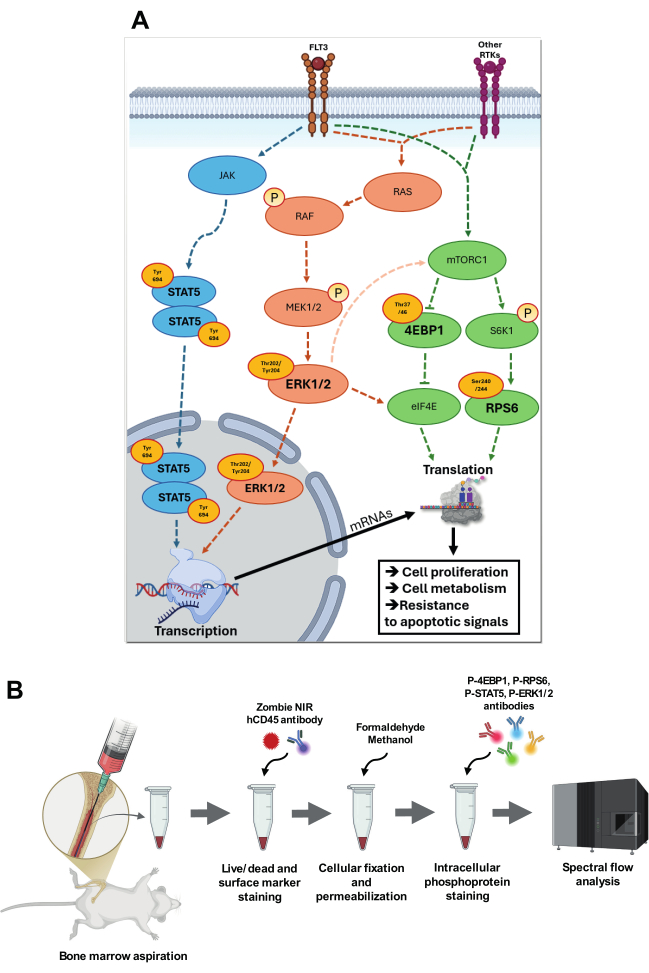
図1:標的シグナル伝達経路の可視化とその解析戦略。 (A)p-STAT5(Tyr694)、p-4EBP1(Thr37/46)、p-RPS6(Ser240/244)、およびp-ERK1/2(Thr202/Tyr204)が関与するシグナル伝達経路の概要。p-STAT5経路では、JAKは自己リン酸化を受けて触媒活性を高め、特定のチロシン残基をリン酸化してSTATタンパク質のドッキング部位を作り出します。リン酸化STAT5(Tyr694)は、ホモ二量体化して核内に移動し、標的遺伝子のプロモーター領域にある特定のSTAT応答性要素に結合します。RAS-RAF-MEK-ERKカスケードでは、リガンド結合時にFLT3受容体または他の受容体チロシンキナーゼ(RTK)が自己リン酸化されると、RAS上のGDPとGTPが交換され、RASが活性化されます。活性化されたRAS-GTPはRAFを原形質膜に動員し、そこでRAFは構造変化を受けて活性化します。その後、RAFは二重特異性キナーゼであるMEK1/2をリン酸化して活性化し、さらにThr202/Tyr204残基でERKをリン酸化します。活性化されたERK1/2は核内に移動し、そこで特定の転写因子をリン酸化します。ERK1/2は、中間シグナル伝達経路を通じて、mTORC1活性を増加させ、特定の部位でeIF4Eをリン酸化して翻訳活性を高めることもできます。mTORC1は、FLT3やその他のRTKを介して栄養素や成長因子によって活性化され、S6K1や4E-BP1などの下流の標的をリン酸化します。次に、S6K1はRPS6をリン酸化し、リボソーム機能を強化して翻訳を活性化します。4E-BP1の過剰リン酸化はeIF4Eを放出し、翻訳開始複合体eIF4Fの集合とキャップ依存性翻訳の活性化を可能にします。これらの経路はすべてAMLに深く関与しており、細胞の増殖、代謝、およびアポトーシスシグナルに対する抵抗性を高めることにより、獲得的適応に貢献しています。(B)骨髄吸引および細胞内ホスホフロー染色結合プロトコルの主なステップを示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:骨髄穿刺処置中の重要なステップの視覚化。 手術領域と必要な材料は、層流フードの下に設置されます。イソフルラン吸入 (A) による麻酔後、大腿骨関節面は吸引 (B、C) のために準備されます。大腿骨は、大腿骨の中央に配置された最初の注射器によって穿刺されます(D)。針に強い圧力を加えることを避け、代わりに回転式の穴あけ動作を実行することが重要です。これは通常、針が骨の表面を穿孔し、大腿骨腔の経路をたどるのに十分です。次に、骨髄を 2 本目の注射器で穿刺部位 (I、J) を通して吸引します。骨髄穿刺液を微量遠心チューブ(K)に移した後、その領域(L)の出血を止めるために穏やかな圧力を加え、マウスを温かく清潔なケージに入れて回復させます。 この図の拡大版を表示するには、ここをクリックしてください。
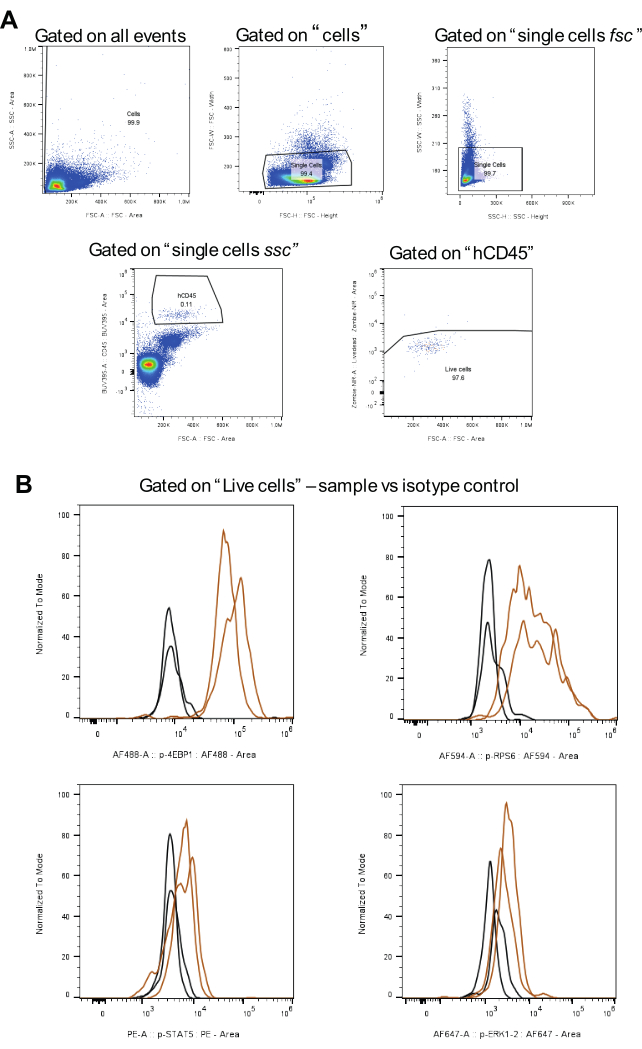
図3:アイソタイプコントロールを含むゲーティング戦略分析のワークフロー。 (A)は、生細胞、ダブレットの排除、およびhCD45陽性AML細胞のゲーティング戦略を表しています。(B)は、各リン酸化タンパク質のシグナルを茶色で、アイソタイプコントロールのシグナルを黒色(2つの生物学的複製)で示しています。 この図の拡大版を表示するには、ここをクリックしてください。
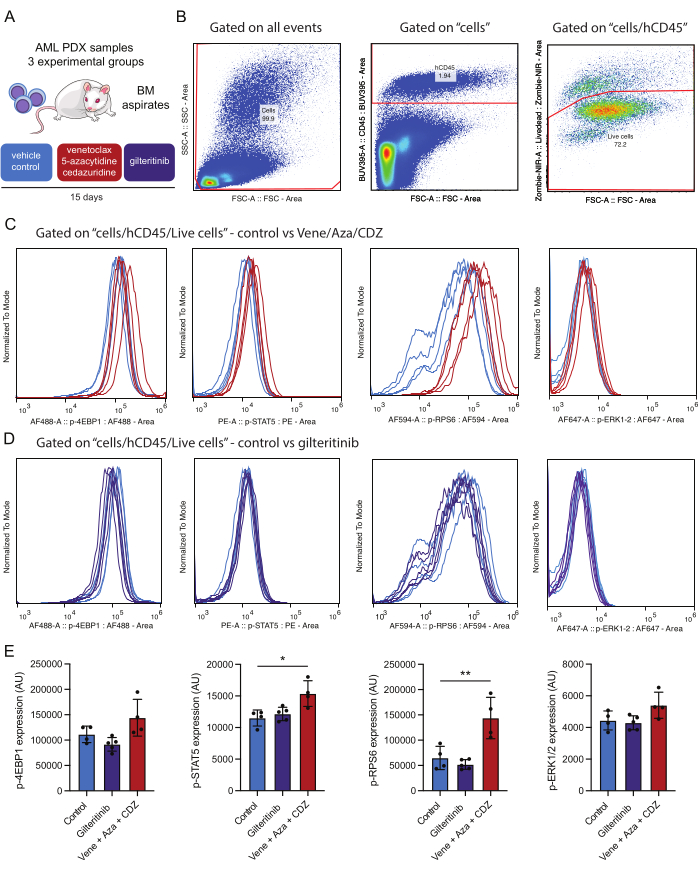
図4:生存骨髄AML細胞の免疫状態後の細胞内リン酸化タンパク質の検出と分析のためのワークフロー (A)患者提供のAML細胞を移植したNSG-SGM3マウスを、ビヒクル(コントロール)またはベネトクラクス、5-アザシチジン、およびセダズリジン(ベネ/アザ/CDZ)またはギルテリチニブで処理しました。15日後、骨髄(BM)吸引物が処理されました。(B)は、治療の15日後に生存可能なAML細胞(例:hCD45/Zombie-NIR陽性)を分析するためのゲーティング戦略を表しています。(C,D)は、ベネトクラクス/5-アザシチジン/セダズリジンまたはビヒクル(B)またはギルテリチニブまたはビヒクル(C)で処理したマウスから単離された10,000個のAML細胞における、示されている各リン酸化抗体のシグナルの正常化を表す。トレースは、ビヒクル(水色)、vene/aza/CDZ(赤)、またはギルテリチニブ(紫)で処理した対照マウスから単離されたAML細胞のシグナルを表しています。(E)ヒストグラムは、3匹のマウスとSDの生きたヒトAML CD45+ 細胞で試験した各リン酸化タンパク質の染色強度の平均値の変化を表しています。エラーバーは標準偏差を表しています。アスタリスクは、 p 値が0.05(*)および0.01(**)未満のANOVAによって評価された染色強度の有意差を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
| 抗体 | 蛍光色素 | 希釈 |
| p-RPS6 (Ser240/244) | AF594 | 1/50 |
| p-4EBP1 (Thr37/46) | AF488 | 1/50 |
| P-STAT5 (Tyr694) | PEの | 1/100 |
| p-ERK1/2 (Thr202/Tyr204) | AF647 | 1/100 |
| ウサギIgGコントロール | AF594 | 1/50 |
| ウサギIgGコントロール | AF488 | 1/50 |
| ウサギIgGコントロール | PEの | 1/100 |
| ウサギIgGコントロール | AF647 | 1/100 |
表1:抗体の最適化された希釈液のリスト。
補足図1: 代表的なAML PDXサンプルにおけるp-STAT5、p-RPS6、p-ERK1/2、およびFSC-Aの比較。この図は、ベネトクラクス/5-アザシチジン/セダズリジンによる治療の15日目におけるマウス「E9」のp-STAT5、p-ERK、およびp-RPS6の関係の例を示しています( 図4Cの結果)。このサンプルでは、リン酸化タンパク質染色における最も強い相関関係は、p-STAT5とp-RPS6(A)の間にあるようで、処理後にこの実験グループで両方ともアップレギュレーションされます(図4E)。p-STAT5とp-ERKの間には、より小さな関係があるようです(B)。重要なことに、細胞サイズ(FSC-Aを使用して評価)は、全体的なp-STAT5陽性率に大きく寄与しておらず、染色陽性が単に細胞サイズ(C)の積ではないことが強調されています。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
重要なステップ
リン酸化タンパク質の特異的検出による複雑なシグナル伝達経路の研究において免疫学的手法を使用するには、実験変数を厳密に制御し22、サンプル調製を綿密に行い、検証のために補完的な技術を採用する必要がある。これらのプラクティスを統合することで、データの再現性、精度、堅牢性が確保され、最終的には生物学的な結論の信頼性が向上します。これらの取り組みにより、この分析法の科学的な厳密性が向上するだけでなく、細胞のシグナル伝達と制御の複雑な研究への適用性も広がります。適切な麻酔と穏やかな取り扱いは、特に免疫応答やシグナル伝達経路に焦点を当てた研究では、実験結果を大幅に変える可能性のある生理学的ストレスを最小限に抑えるために重要です。適切な鎮痛プロトコルを確保することで、データに支障をきたす可能性のある痛みに関連するストレスを防ぎながら、動物福祉を維持するのにさらに役立ちます。手術中に無菌状態を維持することは、炎症反応を引き起こし、実験結果を混乱させる可能性のある感染症を防ぐために不可欠です。これには、機器の滅菌、清潔な手袋の使用、および吸引部位の徹底的な消毒が含まれます。
リン酸化タンパク質は、生体試料の操作中にホスファターゼによる脱リン酸化に対して非常に感受性が高い22,23。処理中にリン酸化状態を保持するには、即時の固定が不可欠です。2つの異なる固定/透過化方法、すなわちサイトフィックス/サイトパームキットと、プロトコルで概説されている一般的なホルムアルデヒド/メタノール法を試験しました。これらの中で、メタノールベースの方法は、より明るい蛍光シグナルでよりクリーンな結果を提供し、好ましい選択肢となりました。固定後、サンプルは-20°Cで短期保存することも、-80°Cで長期保存することもできます。 実験では、固定サンプルを-80°Cで最大3か月間保存すると、一貫した結果が得られました。抗体染色では、一晩インキュベーションすることで、特に微妙なリン酸化の変化に対して精度を高めることができますが、これは特定の実験や調査中の薬物効果によって異なります。また、光から保護された氷上での1時間のインキュベーションも試験し、場合によっては許容できる結果が得られました。バックグラウンドノイズの正確な評価を確実にするために、図3に示すように、アイソタイプコントロールを非特異的結合のリファレンスとして推奨します。
技術の変更とトラブルシューティング
本研究室では、技術力を高めるために、安楽死マウスに針挿入技術を実践し、解剖により適切な配置を確認することができます。生きた動物の手技は、2人のオペレーターが最も効率的に行い、1人は願望に集中でき、アシスタントは動物のモニタリングとサンプルの取り扱いのタスクに専念します。まれに、数回の試行で誤嚥を得ることができない場合、試行するたびに怪我のリスクが高まるため、手順を中止することをお勧めします。動物の処置後のモニタリングも同様に重要です。感染、痛み、ストレスの兆候を観察することで、マウスの健康と研究の信頼性を確保することができます。住宅環境は、外部からのストレス要因を最小限に抑えるための適切な寝具と栄養を備えた回復をサポートする必要があります。
フローサイトメトリー解析では、異なる骨髄吸引日からのすべての固定サンプルと保存されたサンプルを同時に処理することが推奨されます。取り扱い日数やオペレーターの違いによるサンプルの再水和と染色のばらつきは、サイトメーターで検出される蛍光感度に影響を与える可能性があります。一貫した結果を得るには、サイトメーターの電圧設定を最適化して、すべての染色サンプルを検出範囲内に維持してから続行してください。Alexa Fluor 488標識p-4EBP1タンパク質は、このパネルのマーカーの中で最も高い輝度を示し、最大検出範囲を設定するための信頼性の高いリファレンスとなっています。このプロトコールで提示された抗体パネルは補正調整を必要としませんでしたが、これは使用するスペクトルフローサイトメーターによって異なる場合があります。
制限
この技術の主な制限の1つは、骨髄穿刺中に抽出される細胞の数です。信頼性の高い結果を得るためには、サンプルあたり最低約10,000個の細胞を分析するのに十分な細胞を染色することが不可欠です。解析する細胞が少なすぎると、サンプル間で大きなばらつきが生じ、データの精度と解釈可能性が損なわれる可能性があります。適切な数の細胞を確保することは、堅牢で再現性のある機構研究にとって重要です。
データ分析には、 図 3A に示すゲーティング戦略が適用されます。まず、ダブレットを除外した後、BUV395と結合したヒトCD45抗体を用いて目的の細胞を同定する。次に、Zombie NIRを使用して生細胞のゲーティングを行います。最後に、各リン酸化タンパク質について、蛍光強度の中央値(MFI)を計算します(図3B)。すべてのリン酸化タンパク質について分析したすべての細胞を同じ戦略を使用してゲートし、AML細胞集団間の一貫性と比較可能性を確保しました。
この方法の別の制限は、非特異的抗体の結合、不十分な洗浄、細胞自家蛍光、または不適切な透過処理から生じるバックグラウンドノイズの可能性です。これはシグナルの特異性に影響を与え、ホスホフローサイトメトリー解析の精度を低下させる可能性があります。これらの問題に遭遇したユーザーには、バックグラウンドノイズを低減するために追加の洗浄ステップが推奨され、Fcブロッキング試薬を使用して非特異的結合を最小限に抑えることができます。さらに、死細胞の蛍光は結果を妨げる可能性があるため、生存率色素の使用が不可欠です。重要なことは、正確な解析のためには、信頼性と再現性のある結果を得るために、解析する細胞の数を500個未満にしないことです。また、サンプル間の一貫性を維持するために、染色中に同数の細胞を使用するようにすることも重要です。これらの制限にもかかわらず、制御とゲーティング戦略を慎重に最適化することで、分析法の信頼性を高めることができます。
技術の意義
骨髄穿刺技術はすでに発表されています3;ただし、このプロトコルには、2つの利点を強調する説明が含まれています:固定化の改善と骨髄吸引の精度と一貫性を高めるための2本針アプローチの使用、骨片による針の閉塞の問題を防ぎます。縦断的研究では、大腿骨吸引を複数回行うことができ、個々の動物の生物学的変化を経時的に追跡する強力な方法を提供します。同じ大腿骨の吸引の間には、十分な骨治癒と骨髄の再生を可能にするために、最低1か月の回復間隔が推奨されます。対側大腿骨を使用する場合、マウスが過度のストレスや生理学的変動を引き起こすことなく鎮痛および麻酔の影響から回復したことを確認するには、1週間の短い間隔で十分です。
全体として、このマウス骨髄穿刺とフローサイトメトリーを組み合わせた技術は、JAK/p-STAT5、mTORC1/p-4EBP1、mTORC1/p-RPS6、MEK/p-ERK1/2などの主要なシグナル伝達経路に関する貴重な洞察を提供します。これらの経路は、AMLの治療抵抗性に重要な役割を果たします。この技術により、同じ動物から繰り返しサンプリングを行うことができ、疾患の進行と治療反応をシングルセルレベルでリアルタイムにモニタリングすることができます。
ホスホフローサイトメトリーは、リン酸化イベントを捕捉し、細胞の不均一性を維持します4,23,24。このことは、特定の白血病亜集団における治療に対する細胞の動的応答を理解するために特に価値があります。
将来のアプリケーション
このプロトコルは、治療適応の根本的なメカニズムとAMLにおける耐性の出現を研究するための貴重なツールを提供し、より深い洞察と潜在的な治療の進歩への道を開きます。将来の研究では、このアプローチをシングルセルトランスクリプトミクスまたはプロテオミクスと統合して、耐性と疾患の進行を促進する分子メカニズムをさらに分析する可能性があります25。さらに、この方法を他の血液悪性腫瘍や炎症性疾患に適用することで、トランスレーショナルリサーチへの影響が広がる可能性があります。
このプロトコルを改良し、その限界に対処することにより、このアプローチは血液疾患におけるリン酸化タンパク質シグナル伝達を研究するための標準的な方法となり、最終的にはより効果的な治療戦略の開発に役立つ可能性があります。結論として、このプロトコルは、治療適応の根本的なメカニズムとAMLにおける耐性の出現を研究するための貴重なツールを提供し、より深い洞察と潜在的な治療の進歩への道を開きます。
開示事項
著者は何も開示していません。
謝辞
この研究は、Cole FoundationからのLHおよびFEMの移行助成金、およびLeukemia and Lymphoma Society of CanadaおよびCanadian Institutes for Health Research(PJT-186019)からのLHおよびFEMへの助成金によって支援されました。VGは、コール財団から博士号を取得しています。 図1 は、ライセンス契約に基づいてBioRenderを使用して作成されました。フローサイトメトリープロットは、FlowJoソフトウェアを使用して作成しました。コリン・クリスト博士とビクトリア・リチャード博士には、彼らの動物手術施設へのアクセスを許可してくださったことに特に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
参考文献
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved