Method Article
Citometria intracellulare a fosfoflusso di pazienti con leucemia mieloide acuta Xenotrapianti derivati da pazienti
In questo articolo
Riepilogo
Qui, viene descritto un metodo basato sulla citometria a fosfoflusso per analizzare la segnalazione a valle delle vie mTORC1, JAK/STAT5 e MAPK in cellule di leucemia mieloide umana acuta xenotrapiantate in topi e ottenute da aspirati di midollo osseo. I livelli di p-STAT5, p-4EBP1, p-RPS6 e p-ERK1/2 vengono misurati simultaneamente utilizzando un citometro a flusso spettrale di nuova generazione ad alta sensibilità.
Abstract
Per adattarsi e resistere ai trattamenti approvati, le cellule di leucemia mieloide acuta (LMA) attivano specifici percorsi molecolari che portano a cambiamenti nell'espressione genica, nei livelli di proteine e nell'attività. In questo protocollo, è stato riportato un approccio per esplorare bersagli fosforilati a valle della segnalazione oncogenica nella LMA: p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) e p-ERK1/2 (Thr202/Tyr204). Questo metodo consente di valutare come questi percorsi - i principali regolatori del mantenimento della staminalità, dell'evasione immunitaria, della sintesi proteica e dell'adattamento allo stress ossidativo e metabolico - siano modulati da uno o più composti testati in cellule del midollo osseo raccolte da topi vivi mediante aspirazione prima e dopo la fase di trattamento. Questo metodo minimamente invasivo preserva l'integrità cellulare e riduce lo stress rispetto alle tecniche di frantumazione ossea, che possono indurre danni e potenzialmente influenzare i risultati sperimentali. Per ottimizzare la colorazione intracellulare degli anticorpi per l'analisi citofluorimetrica, è stato sviluppato un protocollo che utilizza la fissazione con paraformaldeide e la permeabilizzazione con metanolo. Questo approccio garantisce un'elevata precisione di colorazione e riduce al minimo il rumore di fondo, consentendo un rilevamento affidabile dei marcatori di segnalazione intracellulare. Uno dei principali vantaggi di questo protocollo è lo sviluppo di un pannello anticorpale multiparametrico, che consente la valutazione simultanea dei quattro percorsi all'interno dello stesso campione. Utilizzando un citometro a flusso spettrale di nuova generazione ad alta sensibilità, sono stati osservati cambiamenti dinamici nell'attivazione del percorso a seconda delle condizioni di trattamento rispetto ai livelli basali pre-trattamento negli stessi topi. Questa metodologia consente un'analisi precisa in vivo della modulazione della via di segnalazione in campioni di midollo osseo xenotrapianto derivati da pazienti senza richiedere l'eutanasia degli animali, fornendo preziose informazioni sui meccanismi adattativi delle cellule AML e può guidare la valutazione di strategie terapeutiche volte a colpire queste vie per superare la resistenza.
Introduzione
La leucemia mieloide acuta (LMA) è una neoplasia ematologica aggressiva caratterizzata dall'accumulo di cellule progenitrici mieloidi immature nel midollo osseo e nel sangue periferico. Ciò interrompe la normale emopoiesi, portando a citopenia pericolosa per la vita e complicanze sistemiche. Sebbene i progressi nei regimi chemioterapici, nelle terapie mirate e nel trapianto di cellule staminali ematopoietiche abbiano migliorato gli esiti per alcuni pazienti, nel complesso i tassi di sopravvivenza a 5 anni rimangono intorno al 30%, con una prognosi peggiore nei pazienti più anziani o in quelli con profili genetici avversi1. Una sfida significativa nella gestione della LMA è la frequente comparsa di resistenza ai farmaci, che contribuisce alla recidiva e al fallimento del trattamento2. Ciò sottolinea l'importanza di acquisire una comprensione più profonda dei meccanismi molecolari e cellulari che guidano la progressione e la resistenza terapeutica della LMA.
Per affrontare questa sfida, viene presentato un nuovo metodo per l'aspirazione del midollo osseo accoppiato alla citometria a fosfoflusso intracellulare multiplex, che offre un potente strumento per studiare le vie di segnalazione intracellulare nei modelli di xenotrapianto di pazienti con LMA (PDX) (Figura 1A, B). Sebbene l'aspirazione del midollo osseo nei modelli PDX sia stata precedentemente descritta3, questo protocollo è stato ottimizzato per preservare le cellule leucemiche per l'analisi del fosfoflusso. L'obiettivo generale di questo metodo è fornire una procedura minimamente invasiva che sia applicabile longitudinalmente durante la progressione della leucemia e la risposta terapeutica con risoluzione a singola cellula. Consentendo il campionamento ripetuto dallo stesso animale, questa tecnica offre una rappresentazione più accurata dell'evoluzione della malattia in trattamento. Il razionale alla base dello sviluppo di questa tecnica risiede nella necessità di una valutazione dinamica ad alta risoluzione della segnalazione intracellulare nelle cellule AML. I metodi tradizionali, come il Western blotting, richiedono un numero elevato di cellule, mancano di risoluzione a singola cella e multiplexing4. Al contrario, la citometria a fosfoflusso preserva l'eterogeneità cellulare e consente il rilevamento di più proteine di segnalazione fosforilate in distinte sottopopolazioni leucemiche5, offrendo informazioni chiave sull'attivazione del percorso in risposta ai trattamenti per LMA.
Al centro della biologia della LMA ci sono le vie di segnalazione che regolano la proliferazione cellulare, la sopravvivenza e l'adattamento metabolico, tra cui la proteina chinasi attivata dal mitogeno (MAPK), il bersaglio meccanicistico del complesso rapamicina 1 (mTORC1) e le vie di segnalazione Janus Kinase/Signal Transducer and Activator of Transcription 5 (JAK/STAT5). Oltre al loro ruolo nella proliferazione e nella sopravvivenza delle cellule leucemiche, queste vie sono anche coinvolte in modo critico in processi oncogenici chiave come il mantenimento della staminalità, l'evasione immunitaria e l'adattamento allo stress ossidativo e metabolico4. Oltre a promuovere la crescita e la sopravvivenza cellulare, il cross-talk tra queste vie orchestra processi critici come la trascrizione, la traduzione e il metabolismo cellulare, consentendo alle cellule AML di sostenere la loro crescita e resistere ai segnali apoptotici, anche a fronte di interventi terapeutici 6,7 (Figura 1A).
La via MAPK, che include effettori chiave come p-ERK1/2 (Extracellular signal-regulated kinase 1/2), svolge un ruolo cruciale nell'integrazione di segnali extracellulari, come fattori di crescita e citochine, per regolare la proliferazione e la sopravvivenza cellulare. L'attivazione di ERK1/2 avviene attraverso la cascata RAS (Sarcoma di Rato)-RAF (Fibrosarcoma Rapidamente Accelerato)-MEK (MAPK/ERK Kinase)-ERK, dove RAS-GTP recluta RAF, portando alla fosforilazione sequenziale di MEK1/2 e poi di ERK1/2 a Thr202/Tyr204. Una volta fosforilata, ERK1/2 dimerizza e trasloca nel nucleo, dove fosforila fattori di trascrizione come MYC (Myelocytomatosis viral oncogene homolog), ELK1 (ETS Like-1 Protein) e AP-1 (Activator Protein-1), promuovendo la proliferazione cellulare, il blocco della differenziazione e la sopravvivenza8. Nella LMA, le mutazioni in FLT3 (tirosin-chinasi 3 simile a fms), RAS o KIT provocano frequentemente l'attivazione costitutiva di ERK 9,10 (Figura 1A).
Le mutazioni in FLT3, RAS o KIT causano anche l'upregolazione della segnalazione di mTORC1, che consente la crescita della LMA e la resistenza terapeutica supportando processi oncogenici come il ricablaggio metabolico, la modulazione della sintesi proteica, la biogenesi dei ribosomi e l'autofagia11. Attraverso la regolazione della traduzione dell'mRNA, mTORC1 facilita la produzione di proteine oncogeniche e di altri fattori essenziali per la progressione della LMA. Un gruppo chiave di substrati di mTORC1 include 4E-BP (proteine leganti il fattore di iniziazione eucariotico 4E). Nel loro stato ipofosforilato, i 4E-BP si legano a eIF4E (fattore di iniziazione eucariotico 4E), inibendo la traduzione cap-dipendente. La fosforilazione di 4E-BP1 a Thr37/46 da parte di mTORC1 provoca il rilascio di eIF4E, consentendo l'inizio della traduzione per mRNA oncogenici chiave, come MYC, CCND1 (ciclina D1) e MCL-1 (leucemia a cellule mieloidi 1), promuovendo così la proliferazione leucemica e la sopravvivenza 8,12. Inoltre, la fosforilazione di RPS6 a Ser240/244, mediata da S6K1 (proteina ribosomiale S6 chinasi beta-1) a valle di mTORC1, migliora la biogenesi dei ribosomi e la traduzione dell'mRNA, aumentando la sintesi delle proteine necessarie per l'adattamento metabolico, la resistenza allo stress e la rapida proliferazione 8,13. In particolare, l'attività di mTORC1 è strettamente legata all'adattamento metabolico, una strategia di sopravvivenza critica impiegata dalle cellule AML sotto stress terapeutico 13,14,15 (Figura 1A).
La via JAK/STAT5 è un altro asse di segnalazione cruciale nella LMA, in particolare nei casi con mutazioni che interessano i recettori delle citochine o i mediatori di segnalazione come JAK2, FLT3 e CALR (calreticulina)16,17. STAT5 viene attivato in risposta alla segnalazione delle citochine attraverso recettori come FLT3 e JAK2. Dopo il legame con il ligando, le Janus chinasi (JAK) associate fosforilano STAT5 a Tyr694. STAT5 fosforilato dimerizza e trasloca nel nucleo, dove si lega a specifiche sequenze di DNA per regolare la trascrizione di geni coinvolti nella sopravvivenza, proliferazione e differenziazione cellulare8. Nella LMA, l'attivazione costitutiva di STAT5, spesso dovuta a mutazioni in FLT3 o JAK2, porta all'espressione persistente dei geni che promuovono la leucemogenesi18 (Figura 1A).
Al di là dei loro contributi individuali, questi percorsi convergono per regolare sia la trascrizione che la traduzione, modellando il proteoma delle cellule AML in modi che promuovono la sopravvivenza e la resistenza. In particolare, la traduzione dell'mRNA sta emergendo come un fattore chiave nella fisiopatologia della LMA, in quanto consente la rapida produzione di proteine oncogeniche e fattori di risposta allo stress che consentono alle cellule AML di adattarsi alle sfide ambientali ed eludere gli effetti delle terapie mirate. La disregolazione dei meccanismi di traduzione, come i fattori di iniziazione eucariotici (eIF) o le proteine ribosomiali, è stata implicata nella resistenza terapeutica e nella prognosi infausta nellaLMA 19. Un'indagine dettagliata sui ruoli delle vie MAPK, mTORC1 e JAK/STAT5 nella regolazione trascrizionale e traduzionale è essenziale per ottenere una comprensione completa dei meccanismi molecolari alla base della progressione e della resistenza alla LMA. Tali intuizioni sono fondamentali per identificare nuovi biomarcatori di risposta al trattamento e progettare nuove strategie terapeutiche che mirano a questi percorsi per superare la resistenza. Questo articolo fornisce un protocollo specificamente progettato per studiare queste reti di segnalazione in modelli di xenotrapianto derivato da pazienti con LMA (PDX).
Uno dei principali vantaggi di questo protocollo è l'integrazione dell'aspirazione del midollo osseo con la citometria a fosfoflusso intracellulare, consentendo una valutazione dinamica e minimamente invasiva dell'attivazione della via di segnalazione nei modelli di xenotrapianto (PDX) derivati da pazienti con LMA. Ciò è particolarmente utile per monitorare lo stato di attivazione di percorsi chiave come MAPK, mTORC1 e JAK/STAT5 in risposta a terapie mirate. La combinazione di queste tecniche consente l'acquisizione di una comprensione completa e ad alta risoluzione della biologia della LMA, aiutando in ultima analisi lo sviluppo di strategie terapeutiche più efficaci.
Protocollo
I seguenti esperimenti sono stati eseguiti con l'approvazione del Comitato per la cura degli animali della McGill University (CIHR PJT-186019) e del Comitato di revisione istituzionale del Jewish General Hospital (11-047). In questo protocollo, topi maschi NOD-scid IL2Rg^null-3/GM/SF (NSGS), di età compresa tra 8 settimane e 6 mesi e del peso di 20-30 g, sono stati precedentemente trapiantati con cellule AML umane derivate da pazienti. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Aspirazione del midollo osseo
ATTENZIONE: Devono essere seguite le precauzioni di sicurezza relative all'uso degli aghi.
- Analgesia perioperatoria: 1-4 ore prima dell'aspirazione del midollo osseo, iniettare nei topi per via sottocutanea (c.s.) 0,1 mg/kg di buprenorfina a lento rilascio. Ciò garantisce l'analgesia fino a 72 ore dopo la procedura.
- Preparare l'area chirurgica sotto la cappa a flusso laminare con un tampone chirurgico, un tagliacapelli, una lampada riscaldante e tutto il materiale necessario per l'aspirazione del midollo osseo (siringhe da 25 G, provette per microcentrifuga da 1,5 ml contenenti 0,5 ml di PBS su ghiaccio, tamponi isopropanolo al 70%). Fissare il cono per l'inalazione di isoflurano utilizzando del nastro adesivo (Figura 2A).
- Preparare due siringhe da 25 G per ogni aspirato, una per la puntura ossea ("ago secco") e una il cui mozzo è stato lavato con PBS per l'aspirazione ("ago lavato").
- Anestetizzare il topo utilizzando l'inalazione di isoflurano erogato da un vaporizzatore certificato, secondo le istruzioni del produttore e le linee guida veterinarie. Le procedure locali possono variare. Come riferimento, questo protocollo seguiva le procedure operative standard della McGill University per l'anestesia del topo20.
- Confermare la profondità dell'anestesia attraverso la mancanza di risposta al pizzicamento del piede e al rilassamento muscolare. Applicare un unguento veterinario sugli occhi per prevenire la secchezza mentre l'animale è sotto anestesia. Monitorare continuamente la frequenza respiratoria durante l'anestesia.
- Radere tutta la gamba dove verrà eseguita l'aspirazione utilizzando il tagliacapelli. Disinfettare il sito di aspirazione (femore) con un tampone antisettico imbevuto di alcol isopropilico (Figura 2B).
- Esporre la superficie articolare del femore, dove si trova il sito di puntura, piegando il ginocchio e immobilizzando la gamba utilizzando la mano non dominante. Posiziona il pollice sulla tibia, l'indice sul femore e il medio, stabilizzando il tutto sul lato esterno delle due ossa (Figura 2C).
NOTA: Garantire un posizionamento molto stabile della gamba utilizzando la mano non dominante per evitare qualsiasi movimento della gamba durante l'aspirazione che possa causare guasti o lesioni. Se l'immobilizzazione della gamba non è stabile, riposizionare la mano e riprovare prima di qualsiasi puntura. - Durante l'immobilizzazione con la mano non dominante, disinfettare nuovamente l'area del ginocchio con alcol isopropilico (Figura 2C) per allontanare i peli rimanenti e migliorare la visualizzazione della struttura ossea.
- Utilizzare la prima siringa asciutta da 25 G per creare un foro nella superficie articolare femorale posizionandola al centro dell'articolazione del femore e ruotandola senza forzare (Figura 2D,E). Assicurarsi che l'ago della siringa sia completamente allineato (deviazione di 0°) con l'asse longitudinale del femore per entrare correttamente nel midollo.
NOTA: Mantenere questo allineamento per garantire un ingresso regolare senza causare danni inutili ai tessuti circostanti. Quando l'ago entra nel centro dell'osso femorale, una leggera diminuzione della resistenza indica una penetrazione riuscita nella cavità del midollo (Figura 2F). Evitare di applicare una forza eccessiva sull'ago in questa fase, poiché potrebbe causare la perdita del corretto allineamento, fratture o traumi. Utilizzando un movimento rotatorio di perforazione, le probabilità che l'ago segua il percorso di minor resistenza ed entri correttamente nella cavità femorale. Un ago posizionato correttamente all'interno del femore dovrebbe rimanere verticale anche quando la mano che lo tiene viene rimossa. - Una volta nel midollo, rimuovere gradualmente la siringa ruotandola (Figura 2G) e inserire la seconda siringa lavata nel foro praticato dal primo ago (Figura 2H,I).
NOTA: Viene utilizzata una seconda siringa perché la prima è spesso bloccata dall'osso durante la perforazione. - Applicare il vuoto sulla siringa inserita all'interno del femore ruotando delicatamente ed estraendo gradualmente la siringa. Circa 10-20 μL di midollo osseo dovrebbero essere visibili all'interno del mozzo della siringa (Figura 2J).
NOTA: Se necessario, far avanzare delicatamente l'ago all'interno dell'osso per ottimizzare l'estrazione del midollo. - Trasferire il midollo osseo versando il contenuto della siringa nella provetta da microcentrifuga refrigerata contenente 500 μl di PBS (Figura 2K). Mantieni il ghiaccio e procedi con i passaggi 2-3 il prima possibile.
- Applicare una leggera pressione sul sito di puntura per 30 s con un tampone di isopropanolo per fermare qualsiasi sanguinamento (Figura 2L).
- Metti il mouse in una gabbia di recupero pulita riscaldata con una lampada riscaldante. Monitorare la respirazione e la mobilità fino a quando l'animale non è sveglio e completamente recuperato prima di metterlo in gabbie comuni con il resto dei topi. Verificare la presenza di segni di sanguinamento.
2. Colorazione di marcatori vivi/morti e superficiali
NOTA: Mantenere le cellule in ghiaccio durante l'intera procedura. Preparare miscele master di soluzioni coloranti con anticorpi (per la fase 2.4 e la fase 2.7) prima della fase 2 e della fase 3, mantenendole a 4 °C al riparo dalla luce. Preparare una soluzione fresca di formaldeide all'1,6% (fase 3.1) e una soluzione di metanolo al 100% mantenendo a -20 °C (fase 3.6).
- Contare le cellule vitali utilizzando l'arancio acridina/ioduro di propidio (AO/PI) con il contatore di cellule21.
- Trasferire il volume appropriato per 1 milione di cellule in una nuova provetta da 1,5 mL. Se il volume non è sufficiente, prendere l'intero volume. Raggruppare le cellule rimanenti e aliquotare in 3 provette replicate (1 M ciascuna) per la colorazione di controllo isotipica e 1 provetta per il controllo non colorato.
- Centrifugare le celle a 500 x g per 5 min a 4°C. Aspirare delicatamente ed eliminare il surnatante utilizzando un sistema di aspirazione a vuoto.
- Aggiungere 200 μl per campione di soluzione di colorazione cellulare fluorescente diluita 1/100 in PBS per marcare le cellule morte. Risospendere delicatamente le cellule con la pipetta. Fai lo stesso con i tubi extra per la colorazione con controllo isotipico.
- Incubare su ghiaccio per 10 minuti al riparo dalla luce.
- Centrifugare le celle a 500 x g per 5 minuti a 4 °C. Aspirare delicatamente ed eliminare il surnatante utilizzando un sistema a vuoto.
- Aggiungere 100 μl per campione di anticorpo hCD45-BUV395 diluito 1/100 in PBS contenente il 2% di siero fetale bovino per marcare le cellule ematopoietiche umane. Fai lo stesso con i tubi extra conservati per i controlli isotipici.
- Incubare su ghiaccio per 15 minuti al riparo dalla luce. Procedere immediatamente al passaggio 3.
3. Fissazione e permeabilizzazione
- Preparare una soluzione fresca di formaldeide/PBS all'1,6%: per ogni campione, miscelare 29,5 μl di soluzione madre di formaldeide al 37% + 970,5 μl di PBS (tenere conto di un volume extra per precauzione). Conservare la soluzione di formaldeide/PBS all'1,6% a temperatura ambiente.
ATTENZIONE: La formaldeide deve essere maneggiata in una cappa chimica e smaltita in conformità con le norme di sicurezza istituzionali. - Centrifugare le celle a 500 x g per 5 minuti a 4 °C. Aspirare ed eliminare il surnatante utilizzando un sistema a vuoto.
- Risospendere in 1 mL di soluzione di formaldeide/PBS all'1,6%.
- Incubare per 10 minuti a temperatura ambiente, al riparo dalla luce.
- Centrifugare le celle a 500 x g per 5 minuti a 4 °C. Aspirare ed eliminare il surnatante utilizzando un sistema a vuoto.
- Aggiungere 1 mL di metanolo al 100% raffreddato a -20 °C direttamente nella provetta.
- Incubare i campioni a -20 °C per 30 minuti al riparo dalla luce.
NOTA: A questo punto, è possibile conservare le cellule fissate e permeabilizzate a -80 °C fino a un mese prima dell'analisi.
4. Colorazione al fosfoflusso
NOTA: Il seguente pannello di anticorpi è stato convalidato utilizzando il citometro a flusso dotato dei seguenti laser: 320 nm, 355 nm, 405 nm, 488 nm, 561 nm, 637 nm e 808 nm. Questo pannello deve essere riconvalidato se vengono utilizzati citometri diversi con diverse configurazioni di laser e rivelatori.
- Preparare una soluzione di miscela master di anticorpi con le seguenti diluizioni in un tampone di colorazione disponibile in commercio (Tabella 1), calcolando un volume di 50 μl per ogni campione. Conservare a 4 °C al riparo dalla luce.
- Per i lavaggi (passaggi 4.8, 4.10), tenere il PBS in ghiaccio (2 ml per ogni campione).
- Preparare una seconda soluzione di master mix per le repliche tecniche di controllo isotipologico nel tampone di colorazione (Tabella 1), calcolando un volume di 50 μL per ogni campione. Conservare a 4 °C al riparo dalla luce. Per la riproducibilità tecnica si raccomanda un minimo di due campioni di controllo isotipo.
- Centrifugare le celle dal passaggio 3.7 a 500 x g per 5 minuti a 4 °C. Aspirare ed eliminare il surnatante utilizzando un sistema a vuoto.
NOTA: Dopo la fissazione e la permeabilizzazione, le cellule possono apparire più traslucide. - Aggiungere 50 μl di soluzione di miscela di anticorpi (fase 4.1) o di soluzione di miscela di controllo isotipo (fase 4.2). Risospendere delicatamente le cellule con una pipetta.
- Incubare tutti i campioni per una notte a 4 °C al riparo dalla luce.
- Centrifugare le celle a 500 x g per 5 min a 4 °C. Aspirare ed eliminare il surnatante utilizzando un sistema a vuoto.
- Lavare con 1000 μL di PBS ririspendendo delicatamente con la pipetta.
- Centrifugare le celle a 500 x g per 5 min a 4 °C. Aspirare ed eliminare il surnatante utilizzando un sistema a vuoto.
- Eseguire un secondo lavaggio con 1000 μL di PBS risospendendo delicatamente con la pipetta.
- Centrifugare le celle a 500 x g per 5 min a 4 °C. Aspirare ed eliminare il surnatante utilizzando un sistema a vuoto.
- Risospendere i campioni in 200 μL di PBS. Trasferimento in provette o piastre FACS per l'analisi mediante citometria a flusso (Figura 3).
- Preparare i controlli di compensazione monocolore con le microsfere incubando 0,1 μl di ogni anticorpo con le microsfere di compensazione, secondo le istruzioni del produttore (vedere la Tabella dei materiali).
Risultati
Il disegno sperimentale mira a monitorare lo stato di fosforilazione di proteine selezionate di interesse in diversi punti temporali, ad esempio 1 giorno prima dell'inizio del trattamento e 15 giorni dopo l'inizio del trattamento. Questa linea di base funge da controllo critico per verificare la veridicità dei successivi cambiamenti nell'attivazione della via di segnalazione dopo il trattamento. Dopo quindici giorni di trattamento, viene eseguito un secondo confronto per valutare la modulazione del percorso nei topi trattati rispetto ai controlli trattati con veicolo (Figura 4). Questo approccio in due fasi consente di distinguere gli effetti indotti dal trattamento dalla variabilità basale.
Per questo studio è stato utilizzato un modello murino AML PDX. I topi sono stati trapiantati con cellule AML derivate da pazienti caratterizzate dalle seguenti mutazioni: DNMT3AMR882H con una frazione allelica variante (VAF) del 48%, NPM1W288fs VAF 36%, FLT3ITD VAF 10% e IDH2R140Q VAF 44%. Dopo il trapianto, sono state concesse tre settimane per la crescita del tumore prima di iniziare il trattamento. I topi PDX trapiantati con mutazione FLT3 sono stati trattati per quindici giorni con uno dei tre regimi: placebo, gilteritinib (15 mg/kg al giorno) o una combinazione di venetoclax (50 mg/kg al giorno), 5-azacitidina (2,5 mg/kg al giorno) e cedarizudina (3 mg/kg al giorno) (Figura 4A).
Per quanto riguarda i risultati ottenuti, è degno di nota menzionare che il trattamento con un regime a base di venetoclax ha portato a un aumento significativo della fosforilazione di STAT5 e RPS6, suggerendo che queste vie contribuiscono alla resistenza alla terapia (Figura 4E). Al contrario, gilteritinib, un farmaco che ha come bersaglio FLT3, non ha ridotto lo stato di fosforilazione degli effettori FLT3 mutanti. È possibile che nel campione di LMA testato, la presenza di ulteriori mutazioni secondarie diverse da FLT3-ITD (ad esempio, IDH2) contribuisca all'attivazione di queste vie o che il trattamento farmacologico nell'arco di due settimane porti all'eliminazione selettiva delle cellule AML con diminuzione della segnalazione. Poiché tutte le fosfoproteine analizzate provengono dalla stessa popolazione cellulare, è possibile confrontare l'attivazione delle fosfoproteine. In questo esperimento, la correlazione più forte nella colorazione delle fosfoproteine sembra essere tra p-STAT5 e p-RPS6 (Figura 1A supplementare), che sono entrambe sovraregolate in questo gruppo sperimentale dopo il trattamento (Figura 4E). Sembra esserci una minore relazione tra p-STAT5 e p-ERK (Figura supplementare 1B). È importante sottolineare che la dimensione delle cellule (valutata utilizzando FSC-A) non è un fattore determinante per la positività complessiva di p-STAT5, evidenziando che la positività alla colorazione non è semplicemente un prodotto delle dimensioni delle cellule (Figura 1C supplementare). Questo quadro sperimentale consente una valutazione completa degli effetti di questi trattamenti sulla modulazione della via di segnalazione.
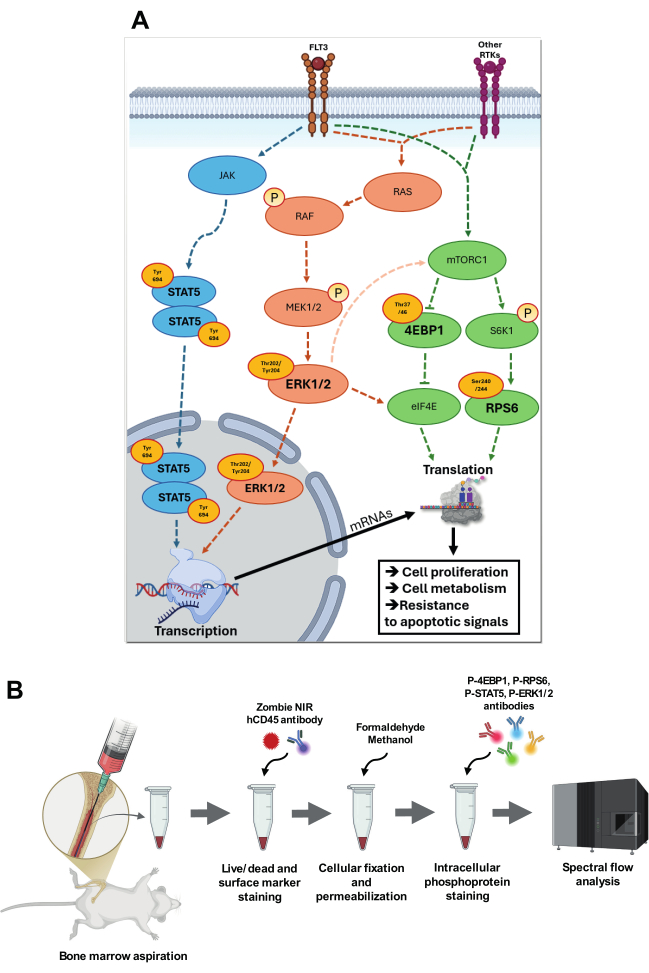
Figura 1: Visualizzazione delle vie di segnalazione target e della strategia per la loro analisi. (A) Panoramica delle vie di segnalazione che coinvolgono p-STAT5 (Tyr694), p-4EBP1 (Thr37/46), p-RPS6 (Ser240/244) e p-ERK1/2 (Thr202/Tyr204). Nella via p-STAT5, JAK subisce autofosforilazione, aumentando la sua attività catalitica, quindi fosforila specifici residui di tirosina, creando siti di aggancio per le proteine STAT. STAT5 fosforilato (Tyr694) omodimerizza e trasloca nel nucleo, dove si lega a specifici elementi sensibili a STAT nelle regioni promotrici dei geni bersaglio. Nella cascata RAS-RAF-MEK-ERK, l'autofosforilazione del recettore FLT3 o di altre tirosin-chinasi recettoriali (RTK) in seguito al legame del ligando porta allo scambio di GDP per GTP su RAS, attivando così RAS. Il RAS-GTP attivato recluta RAF nella membrana plasmatica, dove RAF subisce un cambiamento conformazionale e diventa attivo. RAF quindi fosforila e attiva MEK1/2, una chinasi a doppia specificità, che a sua volta fosforila ERK ai residui di Thr202/Tyr204. ERK1/2 attivato trasloca nel nucleo, dove fosforila specifici fattori di trascrizione. ERK1/2 è anche in grado, attraverso vie di segnalazione intermedie, di aumentare l'attività di mTORC1 e di fosforilare eIF4E in siti specifici per aumentare l'attività di traduzione. Attivato da nutrienti e fattori di crescita attraverso FLT3 e altri RTK, mTORC1 fosforila bersagli a valle come S6K1 e 4E-BP1. S6K1, a sua volta, fosforila RPS6, che migliora la funzione dei ribosomi e attiva la traduzione. L'iperfosforilazione di 4E-BP1 rilascia eIF4E, consentendo l'assemblaggio del complesso di inizio della traduzione eIF4F e l'attivazione della traduzione cap-dipendente. Tutte queste vie sono altamente coinvolte nella LMA, contribuendo agli adattamenti acquisiti aumentando la proliferazione cellulare, il metabolismo e la resistenza ai segnali apoptotici. (B) presenta le fasi principali del protocollo accoppiato di aspirazione del midollo osseo e colorazione intracellulare con fosfoflusso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Visualizzazione delle fasi critiche durante la procedura di aspirazione del midollo osseo. L'area chirurgica e i materiali necessari sono allestiti sotto una cappa a flusso laminare. Dopo l'anestesia per inalazione di isoflurano (A), la superficie articolare femorale viene preparata per l'aspirazione (B,C). L'osso femorale viene perforato da una prima siringa allineata al centro dell'osso femorale (D). È fondamentale evitare di applicare una forte pressione all'ago ed eseguire invece un movimento di perforazione rotatorio; Questo di solito è sufficiente affinché l'ago penetri la superficie dell'osso e segua il percorso della cavità femorale. Successivamente, il midollo osseo viene aspirato con una seconda siringa attraverso il sito di puntura (I,J). Dopo aver trasferito l'aspirato di midollo osseo in una provetta da microcentrifuga (K), viene applicata una leggera pressione per fermare l'emorragia nell'area (L) e il topo viene posto in una gabbia calda e pulita per il recupero. Clicca qui per visualizzare una versione più grande di questa figura.
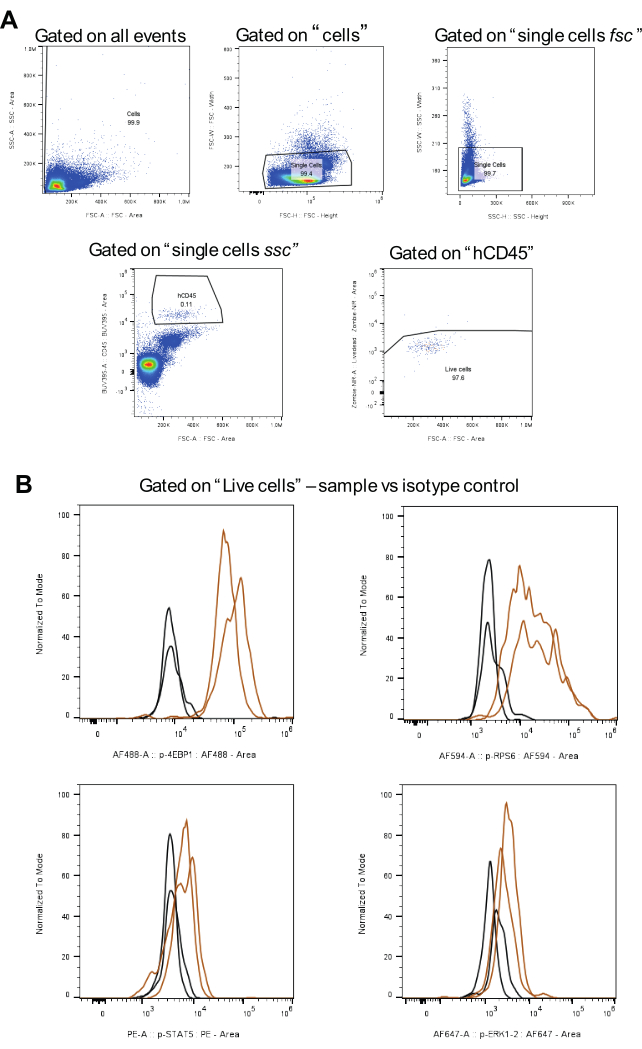
Figura 3: Flusso di lavoro per l'analisi della strategia di gating, compresi i controlli isotipici. (A) rappresenta le strategie di gating per le cellule vive, l'esclusione dei doppietti e le cellule AML hCD45-positive. (B) mostra segnali per ogni fosfoproteina nel marrone e controlli isotipici nel nero (due repliche biologiche). Clicca qui per visualizzare una versione più grande di questa figura.
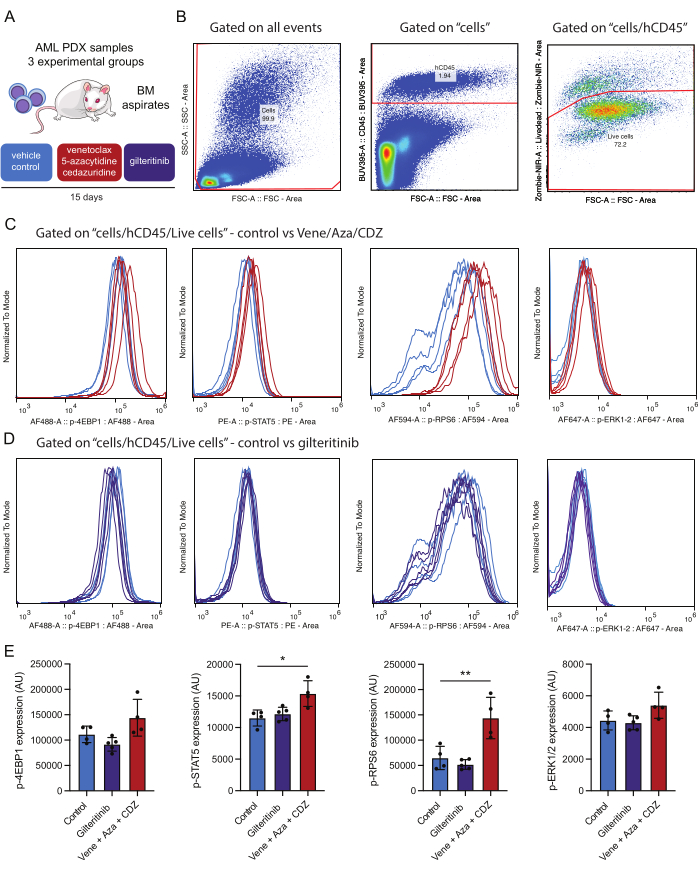
Figura 4: Flusso di lavoro per la rilevazione e l'analisi delle fosfoproteine intracellulari dopo immuno-dichiarazione di cellule AML vitali del midollo osseo. (A) I topi NSG-SGM3 trapiantati con cellule AML donate dal paziente sono stati trattati con veicolo (controllo) o venetoclax, 5-azacitidina e cedazuridina (vene/aza/CDZ) o gilteritinib. Dopo 15 giorni, gli aspirati di midollo osseo (BM) sono stati processati. (B) rappresenta la strategia di gating per l'analisi di cellule AML vitali (ad es. hCD45/Zombie-NIR positive) 15 giorni dopo il trattamento. (C,D) rappresentano la normalizzazione del segnale per ciascuno dei fosfoanticorpi come indicato, in 10.000 cellule AML isolate da topi trattati con venetoclax/5-azacitidina/cedazuridina o veicolo (B) o gilteritinib o veicolo (C). Le tracce rappresentano i segnali nelle cellule AML isolate dal topo di controllo trattate con veicolo (azzurro), vene/aza/CDZ (rosso) o gilteritinib (viola). (E) L'istogramma rappresenta le variazioni del valore medio delle intensità di colorazione per ciascuna fosfoproteina testata su cellule umane vive di AML CD45+ da tre topi e SD. Le barre di errore rappresentano la deviazione standard. Gli asterischi indicano differenze significative nelle intensità di colorazione valutate dall'ANOVA con valori p inferiori a 0,05 (*) e 0,01 (**). Clicca qui per visualizzare una versione più grande di questa figura.
| Anticorpo | Fluorocromo | Diluizione |
| p-RPS6 (Ser240/244) | AF594 | 1/50 |
| p-4EBP1 (Thr37/46) | AF488 | 1/50 |
| p-STAT5 (Tyr694) | PE | 1/100 |
| p-ERK1/2 (THR202/TYR204) | AF647 | 1/100 |
| Controllo delle IgG di coniglio | AF594 | 1/50 |
| Controllo delle IgG di coniglio | AF488 | 1/50 |
| Controllo delle IgG di coniglio | PE | 1/100 |
| Controllo delle IgG di coniglio | AF647 | 1/100 |
Tabella 1: Elenco delle diluizioni ottimizzate per gli anticorpi.
Figura supplementare 1: Confronto tra p-STAT5, p-RPS6, p-ERK1/2 e FSC-A in un campione rappresentativo di AML PDX. Questa figura mostra un esempio della relazione tra p-STAT5, p-ERK e p-RPS6 nel topo "E9" al giorno 15 di trattamento con venetoclax/5-azacitidina/cedazuridina (risultato dalla Figura 4C). In questo campione, la correlazione più forte nella colorazione delle fosfoproteine sembra essere tra p-STAT5 e p-RPS6 (A), che sono entrambi sovraregolati in questo gruppo sperimentale dopo il trattamento (Figura 4E). Sembra esserci una minore relazione tra p-STAT5 e p-ERK (B). È importante sottolineare che la dimensione delle cellule (valutata utilizzando FSC-A) non è un fattore importante per la positività complessiva di p-STAT5, evidenziando che la positività alla colorazione non è semplicemente un prodotto della dimensione delle cellule (C). Clicca qui per scaricare questo file.
Discussione
Passaggi critici
L'uso di tecniche immunologiche nello studio di vie di segnalazione complesse attraverso la rilevazione specifica di fosfoproteine richiede che le variabili sperimentali siano strettamente controllate22, che la preparazione del campione sia meticolosa e che vengano impiegate tecniche complementari per la validazione. L'integrazione di queste pratiche garantisce la riproducibilità, la precisione e la robustezza dei dati, contribuendo in ultima analisi a conclusioni biologiche più affidabili. Questi sforzi non solo migliorano il rigore scientifico del metodo, ma ne ampliano anche l'applicabilità in studi complessi sulla segnalazione e la regolazione cellulare. Un'anestesia adeguata e una manipolazione delicata sono fondamentali per ridurre al minimo lo stress fisiologico, che può alterare significativamente i risultati sperimentali, in particolare negli studi incentrati sulle risposte immunitarie o sulle vie di segnalazione. Garantire protocolli analgesici appropriati aiuta ulteriormente a mantenere il benessere degli animali, prevenendo lo stress correlato al dolore che potrebbe interferire con i dati. Mantenere condizioni asettiche durante la procedura è fondamentale per prevenire le infezioni, che possono portare a risposte infiammatorie e potenzialmente confondere i risultati sperimentali. Ciò comporta la sterilizzazione delle attrezzature, l'uso di guanti puliti e la disinfezione accurata del sito di aspirazione.
Le proteine fosforilate sono altamente suscettibili alla defosforilazione da parte delle fosfatasi durante la manipolazione di campioni biologici22,23. Per preservare gli stati di fosforilazione durante la lavorazione, è essenziale una fissazione immediata. Sono stati testati due diversi metodi di fissazione/permeabilizzazione: un kit cytofix/cytoperm e il comune metodo formaldeide/metanolo descritto nel protocollo. Tra questi, il metodo basato sul metanolo ha fornito risultati più puliti con segnali di fluorescenza più luminosi, rendendolo la scelta preferita. Dopo la fissazione, i campioni possono essere conservati a breve termine a -20 °C o a lungo termine a -80 °C. Negli esperimenti, i campioni fissati conservati per un massimo di tre mesi a -80 °C hanno prodotto risultati coerenti. Per la colorazione degli anticorpi, un'incubazione notturna può migliorare l'accuratezza, soprattutto per sottili cambiamenti di fosforilazione, sebbene ciò dipenda dall'esperimento specifico e dagli effetti del farmaco oggetto di indagine. È stata inoltre testata un'incubazione più breve di 1 ora su ghiaccio, al riparo dalla luce, che ha prodotto risultati accettabili in alcuni casi. Per garantire una valutazione accurata del rumore di fondo, si raccomanda di controllare gli isotipi come riferimento per il legame non specifico, come mostrato nella Figura 3.
Modifiche e risoluzione dei problemi della tecnica
Per sviluppare le competenze tecniche, i tirocinanti del nostro gruppo praticano la tecnica di inserimento dell'ago su topi soppressi, dove il corretto posizionamento può essere confermato dalla dissezione. La procedura dell'animale vivo viene eseguita in modo più efficiente da due operatori, uno dei quali può concentrarsi sulle aspirazioni mentre un assistente è dedicato ai compiti di monitoraggio degli animali e alla manipolazione dei campioni. Nei rari casi in cui non è possibile ottenere un'aspirazione dopo diversi tentativi, è consigliabile interrompere la procedura poiché il rischio di lesioni aumenta ad ogni tentativo. Il monitoraggio post-procedura degli animali è altrettanto importante. L'osservazione dei segni di infezione, dolore o stress garantisce il benessere dei topi e l'affidabilità dello studio. Le condizioni abitative dovrebbero favorire il recupero, con lettiere e nutrizione adeguate per ridurre al minimo i fattori di stress esterni.
Per l'analisi citofluorimetrica, si consiglia di elaborare contemporaneamente tutti i campioni fissati e conservati provenienti da diversi giorni di aspirazione del midollo osseo. Le variazioni nella reidratazione e nella colorazione del campione dovute a differenze nei giorni di manipolazione o negli operatori possono influenzare la sensibilità alla fluorescenza rilevata dal citometro. Per garantire risultati coerenti, ottimizzare le impostazioni di tensione del citometro per mantenere tutti i campioni colorati all'interno dell'intervallo di rilevamento prima di procedere. La proteina p-4EBP1 coniugata con Alexa Fluor 488 mostra la luminosità più elevata tra i marcatori di questo pannello, il che la rende un riferimento affidabile per l'impostazione dell'intervallo di rilevamento massimo. Sebbene il pannello anticorpale presentato in questo protocollo non richieda aggiustamenti di compensazione, questo può variare a seconda del citometro a flusso spettrale utilizzato.
Limitazioni
Uno dei principali limiti di questa tecnica è il numero di cellule estratte durante l'aspirazione del midollo osseo. Per garantire risultati affidabili, è essenziale colorare un numero sufficiente di cellule per analizzare un minimo di circa 10.000 cellule per campione. L'analisi di un numero insufficiente di cellule può portare a variazioni significative tra i campioni, compromettendo l'accuratezza e l'interpretabilità dei dati. Garantire un numero adeguato di celle è fondamentale per studi meccanicistici robusti e riproducibili.
Per l'analisi dei dati, viene applicata la strategia di gating illustrata nella Figura 3A . In primo luogo, dopo aver escluso i doppietti, le cellule di interesse vengono identificate utilizzando un anticorpo CD45 umano accoppiato con BUV395. Successivamente, il gating per le cellule vive viene eseguito utilizzando Zombie NIR. Infine, l'intensità mediana della fluorescenza (MFI) viene calcolata per ciascuna fosfoproteina (Figura 3B). Tutte le cellule analizzate per tutte le proteine fosforilate sono state gated utilizzando la stessa strategia, garantendo coerenza e comparabilità tra le popolazioni di cellule AML.
Un'altra limitazione di questo metodo è il potenziale rumore di fondo, che può derivare dal legame di anticorpi aspecifici, dal lavaggio insufficiente, dall'autofluorescenza cellulare o dalla permeabilizzazione impropria. Ciò può influire sulla specificità del segnale e ridurre l'accuratezza dell'analisi della citometria a fosfoflusso. Per gli utenti che riscontrano questi problemi, si consiglia un ulteriore passaggio di lavaggio per ridurre il rumore di fondo e i reagenti che bloccano l'FC possono essere utilizzati per ridurre al minimo il legame non specifico. Inoltre, la fluorescenza delle cellule morte può interferire con i risultati, rendendo essenziale l'uso di coloranti vitali. È importante sottolineare che, per un'analisi accurata, il numero di cellule analizzate non deve essere inferiore a 500 cellule AML per garantire risultati affidabili e riproducibili. È inoltre importante assicurarsi che durante la colorazione venga utilizzato un numero simile di cellule per mantenere la coerenza tra i campioni. Nonostante queste limitazioni, un'attenta ottimizzazione dei controlli e delle strategie di gating può migliorare l'affidabilità del metodo.
Significato della tecnica
La tecnica di aspirazione del midollo osseo è già stata pubblicata3; Tuttavia, in questo protocollo è inclusa una tecnica aggiornata con una spiegazione che evidenzia due vantaggi: una migliore immobilizzazione e l'uso di un approccio a due aghi per migliorare la precisione e la coerenza nell'aspirazione del midollo osseo, prevenendo qualsiasi problema di blocco dell'ago con frammenti ossei. Per gli studi longitudinali, l'aspirazione femorale può essere eseguita più volte, fornendo un metodo potente per monitorare i cambiamenti biologici nel tempo nei singoli animali. Si raccomanda un intervallo di recupero minimo di un mese tra le aspirazioni sullo stesso femore per consentire una sufficiente guarigione ossea e la rigenerazione del midollo osseo. Quando si utilizza il femore controlaterale, un intervallo più breve di una settimana è sufficiente per garantire che il topo si sia ripreso dagli effetti dell'analgesia e dell'anestesia senza introdurre stress eccessivo o variabilità fisiologica.
Nel complesso, questa tecnica combinata di aspirazione del midollo osseo murino e citometria a flusso fornisce preziose informazioni sulle principali vie di trasduzione del segnale, tra cui JAK/p-STAT5, mTORC1/p-4EBP1, mTORC1/p-RPS6 e MEK/p-ERK1/2. Questi percorsi svolgono un ruolo significativo nella resistenza al trattamento nella LMA. Questa tecnica consente di effettuare campionamenti ripetuti dallo stesso animale, consentendo il monitoraggio in tempo reale della progressione della malattia e della risposta alla terapia a livello di singola cellula.
La citometria a fosfoflusso cattura gli eventi di fosforilazione e preserva l'eterogeneità cellulare 4,23,24. Ciò lo rende particolarmente prezioso per comprendere le risposte cellulari dinamiche alla terapia in specifiche sottopopolazioni leucemiche.
Applicazioni future
Questo protocollo fornisce uno strumento prezioso per studiare i meccanismi alla base dell'adattamento al trattamento e l'emergere della resistenza nella LMA, aprendo la strada a intuizioni più approfondite e potenziali progressi terapeutici. Studi futuri potrebbero integrare questo approccio con la trascrittomica o la proteomica a singola cellula per analizzare ulteriormente i meccanismi molecolari che guidano la resistenza e la progressione della malattia25. Inoltre, l'applicazione di questo metodo ad altre neoplasie ematologiche o condizioni infiammatorie potrebbe ampliarne l'impatto nella ricerca traslazionale.
Perfezionando questo protocollo e affrontando i suoi limiti, questo approccio potrebbe diventare un metodo standard per lo studio della segnalazione delle fosfoproteine nelle malattie ematologiche, aiutando in ultima analisi lo sviluppo di strategie terapeutiche più efficaci. In conclusione, questo protocollo fornisce uno strumento prezioso per studiare i meccanismi alla base dell'adattamento al trattamento e l'emergere della resistenza nella LMA, aprendo la strada a intuizioni più approfondite e potenziali progressi terapeutici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da sovvenzioni di transizione per LH e FEM dalla Cole Foundation e da sovvenzioni della Leukemia and Lymphoma Society of Canada e del Canadian Institutes for Health Research (PJT-186019) a LH e FEM. FEM è uno scienziato clinico FRSQ Junior 2 e LH è uno scienziato FRSQ Junior 2. VG è titolare di una borsa di dottorato della Cole Foundation. Figure 1 è stato creato con BioRender in base a un contratto di licenza. I grafici di citometria a flusso sono stati generati utilizzando il software FlowJo. Un ringraziamento speciale al Dr. Colin Crist e Victoria Richard per aver concesso l'accesso alla loro struttura di chirurgia animale.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringes 25G x 5/8 TW | BD Biosciences | #309626 | Syringes for bone marrow aspiration |
| 1.7 mL Microcentrifuge Tubes | FroggaBio | #LMCT1.7B | To aliquot the cells recovered by bone marrow aspiration |
| BD Horizon Brilliant Stain Buffer | BD Biosciences | #563794 | For staining processes |
| Buprenorphine | Fidelis Animal Health | Ethiqa XR | Analgesia for mice |
| CellDrop FL Unlimited | FroggaBio | #CellDrop FL- UNLTD | For cell count |
| D-PBS | Wisent Inc. | #311-425-CL | Media for cells recovered by bone marrow aspiration |
| Eppendorf Centrifuge 5427 R | Millipore Sigma | #EP5429000260 | |
| Fetal Bovine Serum Heat Inactivated Premium CA | Wisent Inc. | #090-450 | For staining processes |
| Formaldehyde solution | Millipore Sigma | #F1635 | Cells Permeabilization |
| humanCD45 [HI30] antibody | BD Biosciences | #563792 | Antibody coupled with BUV395 |
| ID7000 Spectral Cell Analyzer | Sony | Spectral flow cytometer analyzer | |
| Isoflurane 99.9% liquid | McKesson | #803250 | Anesthesia for mice |
| Isospire (isoflurane) Inhalation Anesthetic | Dechra | Anesthesia for mice | |
| Live/dead AO/PI | FroggaBio | CD-AO/PI-1.5 | For cell count |
| Live/dead Zombie NIR | BioLegend+B6:C12 | #423106 | For spectral flow cytometry |
| Methanol solution | Millipore Sigma | #179957 | Cells Fixation |
| P-4EBP1 (Thr37/46) [236B4] antibody | Cell Signaling Technology | #2846 | Antibody coupled with Alexa Fluor 488 |
| p-Erk1/2 (Thr202/Tyr204) [197G2] antibody | Cell Signaling Technology | #13148 | Antibody coupled with Alexa Fluor 647 |
| p-RPS6 (Ser240/244) [D68F8] antibody | Cell Signaling Technology | #9468 | Antibody coupled with Alexa Fluor 594 |
| p-STAT5 (Tyr694) [D47E7] antibody | Cell Signaling Technology | #14603 | Antibody coupled with PE |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2975 | Antibody coupled with Alexa Fluor 488 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #2985 | Antibody coupled with Alexa Fluor 647 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #8760 | Antibody coupled with Alexa Fluor 594 |
| Rabbit IgG Control [DA1E] | Cell Signaling Technology | #5742S | Antibody coupled with PE |
| Sanitizing wipes | United Canada | #UCDWPR-9022 | Disinfection for bone marrow aspiration |
Riferimenti
- Ferrara, F., Schiffer, C. A. Acute myeloid leukaemia in adults. Lancet. 381 (9865), 484-495 (2013).
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Chung, Y. R., Kim, E., Abdel-Wahab, O. Femoral bone marrow aspiration in live mice. J Vis Exp. (89), e51660(2014).
- Haas, A., Weckbecker, G., Welzenbach, K. Intracellular Phospho-Flow cytometry reveals novel insights into TCR proximal signaling events. A comparison with Western blot. Cytometry A. 73 (9), 799-807 (2008).
- Perbellini, O., Cavallini, C., Chignola, R., Galasso, M., Scupoli, M. T. Phospho-specific flow cytometry reveals signaling heterogeneity in t-cell acute lymphoblastic leukemia cell lines. Cells. 11 (13), 2072(2022).
- Kornblau, S. M., et al. Simultaneous activation of multiple signal transduction pathways confers poor prognosis in acute myelogenous leukemia. Blood. 108 (7), 2358-2365 (2006).
- Perl, A. E. The role of targeted therapy in the management of patients with AML. Hematology Am Soc Hematol Educ Program. 2017 (1), 54µ65(2017).
- Márton, A., et al. The roles of phosphorylation of signaling proteins in the prognosis of acute myeloid leukemia. Pathol Oncol Res. 30, 1611747(2024).
- Levis, M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013. Hematology Am Soc Hematol Educ Program. 2013, 220-226 (2013).
- Roux, P. P., Topisirovic, I. Signaling pathways involved in the regulation of mRNA translation. Mol Cell Biol. 38 (12), e00070-e00118 (2018).
- Nepstad, I., Hatfield, K. J., Grønningsæter, I. S., Reikvam, H. The PI3K-Akt-mTOR signaling pathway in human Acute Myeloid Leukemia (AML) Cells. Int J Mol Sci. 21 (8), ijms21082907(2020).
- Jia, X., Zhou, H. Phospho-eIF4E: A new target for acute myeloid leukemia. Curr Protein Pept Sci. 22 (4), 328-335 (2021).
- Ghosh, J., Kapur, R. Role of mTORC1-S6K1 signaling pathway in regulation of hematopoietic stem cell and acute myeloid leukemia. Exp Hematol. 50, 13-21 (2017).
- Park, H. J., et al. Therapeutic resistance in acute myeloid leukemia cells is mediated by a novel ATM/mTOR pathway regulating oxidative phosphorylation. Elife. 11, 79940(2022).
- Oki, T., et al. Imaging dynamic mTORC1 pathway activity in vivo reveals marked shifts that support time-specific inhibitor therapy in AML. Nat Commun. 12 (1), 245(2021).
- Lee, H. J., Daver, N., Kantarjian, H. M., Verstovsek, S., Ravandi, F. The role of JAK pathway dysregulation in the pathogenesis and treatment of acute myeloid leukemia. Clin Cancer Res. 19 (2), 327-335 (2013).
- Liu, A. C. H., et al. Targeting STAT5 signaling overcomes resistance to IDH Inhibitors in acute myeloid leukemia through suppression of stemness. Cancer Res. 82 (23), 4325-4339 (2022).
- Sung, P. J., Sugita, M., Koblish, H., Perl, A. E., Carroll, M. Hematopoietic cytokines mediate resistance to targeted therapy in FLT3-ITD acute myeloid leukemia. Blood Adv. 3 (7), 1061-1072 (2019).
- Song, P., Yang, F., Jin, H., Wang, X. The regulation of protein translation and its implications for cancer. Signal Transduct Target Ther. 6 (1), 68(2021).
- This Standard Operating Procedure (SOP) describes methods for anesthetizing mice. , McGill University. https://www.mcgill.ca/research/files/research/110-mouse_anesthesia-2024-06-17.pdf (2024).
- Tech Team Tips: Preparing a Sample with AO/PI. , DeNovix. https://www.denovix.com/webinars/tech-team-tips-preparing-a-sample-with-ao-pi (2021).
- Suni, M. A., Maino, V. C. Flow cytometric analysis of cell signaling proteins. Methods Mol Biol. 717, 155-169 (2011).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Chen, W., Luu, H. S. Immunophenotyping by multiparameter flow cytometry. Methods Mol Biol. 1633, 51-73 (2017).
- Perez, O. D., Nolan, G. P. Phospho-proteomic immune analysis by flow cytometry: From mechanism to translational medicine at the single-cell level. Immunol Rev. 210, 208-228 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon