Method Article
Адцептивная модель передачи ревматоидного артрита у мышей
В этой статье
Резюме
В данной работе мы сообщаем о протоколе, устанавливающем мышиную модель ревматоидного артрита (РА) путем адоптивного переноса CD4+ Т-клеток от мышей SKG, обеспечивая быстрый и надежный экспериментальный инструмент для изучения иммунологических механизмов, патологического прогрессирования и разработки новых методов лечения РА.
Аннотация
Ревматоидный артрит (РА) — это хроническое системное аутоиммунное воспалительное заболевание, которое может привести к повреждению суставов, деформациям, инвалидности и даже смерти. Из-за сложной этиологии и гетерогенной клинической картины современные стратегии лечения остаются недостаточными для эффективного контроля прогрессирования заболевания, особенно для достижения ранней диагностики и предоставления персонализированной терапии. Поэтому разработка новых терапевтических подходов имеет решающее значение. Для достижения этой цели необходимы надежные животные модели для исследования патогенеза РА. В настоящее время используется несколько животных моделей РА, в том числе модель коллаген-индуцированного артрита (CIA), модель K/BxN и мышь SKG. Хотя эти модели могут успешно имитировать иммунные механизмы и клинические проявления РА, каждая из них имеет заметные ограничения.
В этом протоколе мы описываем процесс создания мышиной модели РА путем адоптивного переноса CD4+ Т-клеток от мышей SKG. По сравнению с обычными моделями, эта модель обеспечивает более короткое время укоренения и более высокий уровень заболеваемости (100%) у мышей C57BL/6. Он относительно экономически эффективен, включает в себя простые процедуры и надежно воспроизводит Т-клеточные иммунные реакции, обеспечивая превосходный экспериментальный контроль и воспроизводимость. Мы провели всестороннюю оценку модели, оценив клинический фенотип, такой как симптомы суставов. При клинической оценке фенотипа мы наблюдали значительный отек суставов и воспалительные реакции. Кроме того, используя технологию ПЦР для измерения уровней экспрессии ключевых факторов транскрипции, мы обнаружили, что эта модель эффективно моделирует иммунные реакции, опосредованные Т-клетками, и ключевые патологические особенности РА. С помощью этой модели исследователи могут лучше моделировать Т-клеточный иммунный ответ и ключевые патологические особенности РА, тем самым обеспечивая надежный и эффективный экспериментальный инструмент для изучения иммунных механизмов и патологического прогрессирования, а также разработки новых методов лечения РА.
Введение
РА является хроническим системным аутоиммунным воспалительным заболеванием, которое поражает примерно 1% населения мира, вызывая высокую заболеваемость и тяжелое социально-экономическое бремя 1,2. Заболевание характеризуется стойким воспалением синовиальной оболочки, разрушением хряща и эрозией костей, что в конечном итоге приводит к деформации суставов, инвалидности и, в тяжелых случаях, к преждевременной смерти 3,4,5. Патогенез РА включает в себя взаимодействие генетических, экологических и иммунных факторов, ключевыми особенностями которых являются аномальная активация клеточного иммунитета, чрезмерное высвобождение провоспалительных цитокинов и нарушение иммунной толерантности 6,7. В этом процессе аутореактивные Т-клетки, в частности CD4+ Т-клетки, как ключевые движущие силы иммунной регуляции, напрямую способствуют патологическому прогрессированию РА через несколько механизмов.
Т-хелперные клетки (Th)1 продуцируют интерферон-гамма (ИФН-γ), который активирует макрофаги и синовиальные фибробласты, что приводит к высвобождению фактора некроза опухоли (TNF)-α и интерлейкина (IL)-6 и вызывает синовит. Клетки Th17 секретируют IL-17, который способствует активации синовиальных клеток и остеокластов, усугубляя разрушение хряща и эрозию костей 8,9. Кроме того, CD4+ Т-клетки усиливают воспалительные реакции, активируя В-клетки с помощью костимулирующих сигналов, индуцируя выработку антител к цитруллинированным белкам (ACPA) и ревматоидных факторов (RF)10. Между тем, дефекты функции и снижение количества Treg-клеток являются ключевыми причинами иммунного дисбаланса при РА, что приводит к неконтролируемому воспалению11,12. Из-за сложной этиологии и гетерогенной клинической картины ранняя диагностика затруднена, а современное лечение РА неудовлетворительно. Поэтому разработка новых терапевтических подходов имеет решающее значение. Надежные животные модели имеют решающее значение для изучения патогенеза РА, чтобы получить более глубокое понимание потенциальных механизмов РА и изучить новые стратегии лечения.
Традиционные модели РА, такие как модели ЦРУ и мышей K/BxN 13,14,15, способствуют улучшению нашего понимания РА. Однако эти модели имеют существенные ограничения. Например, модель CIA на мышах C57BL/6 имеет низкий процент успеха и длительный период индукции, что снижает ее полезность в определенных экспериментальных условиях. Аналогичным образом, несмотря на то, что модель K/BxN является ценной, она является дорогостоящей в установлении и имеет ограничения в воспроизведении сложной патологии человеческого РА, в частности, взаимодействий между иммунными клетками и цитокинами.
Чтобы устранить эти ограничения, мы разработали новую мышиную модель РА путем переноса CD4+ Т-клеток от мышей SKG с фоном C57BL/6 к иммунокомпетентным мышам C57BL/6 в сочетании с маннан-индуцированной иммунной активацией. Эта модель эффективно воспроизводит ключевые особенности РА, в том числе опосредованные Т-клетками иммунные реакции и основные патологические характеристики, такие как воспаление синовиальной оболочки и эрозия суставов, предлагая при этом преимущества в воспроизводимости, простоте и экономической эффективности. Мы подробно изложили методологию создания этой модели, которая включает в себя генерацию мышей SKG на фоне C57BL/6, выделение CD4+ Т-клеток из мышей SKG, их адоптивный перенос и последующую индукцию маннаном. Кроме того, мы описываем клинические и гистологические критерии, используемые для оценки тяжести артрита, обеспечивая его надежность и воспроизводимость. Последовательно имитируя иммунные реакции, опосредованные Т-клетками, и фундаментальные патологические особенности РА, эта модель служит надежным и эффективным экспериментальным инструментом для изучения иммунных механизмов, прогрессирования заболевания и разработки новых методов лечения РА.
протокол
Все экспериментальные процедуры в этом исследовании строго соответствовали рекомендациям, изложенным в «Руководстве Национальных институтов здравоохранения по уходу и использованию лабораторных животных», включая животноводство, экспериментальные операции и эвтаназию, и были одобрены Комитетом по этике животных Медицинского колледжа Тунцзи Хуачжунского университета науки и технологии.
1. Животные
- Поколение мышей SKG (фон C57BL/6)
- Стратегия редактирования генов
- Разработать специфическую направляющую РНК (гРНК), нацеленную на ген ZAP70 (последовательность гРНК: 5'-CAGCCCACGAGCGAATGCCCTGG-3') и провести редактирование генов с помощью системы CRISPR/Cas9. Сконструируйте донорскую ДНК с мутацией ZAP70(W163C) для обеспечения точной инкорпорации-n мутации (здесь, CAGGCCCCACACAGGTGGAGAAGCTCATTG
CTACCACAGCCCGAGCGAATGCCCТГ
CTATCACAGCAGCCTGACTCGTGAGGAG
GCCGAGCGCAAACTCTATTCCGGCCA).
Примечание: ГРНК направляет белок Cas9 к определенному участку гена ZAP70 для точного разрезания. Подчеркнутое основание в последовательности донорской ДНК указывает на мутировавшие основания. Эта мутация соответствует мутации W163C (TGG→TGC) в белке ZAP70, который находится в критическом функциональном домене.
- Разработать специфическую направляющую РНК (гРНК), нацеленную на ген ZAP70 (последовательность гРНК: 5'-CAGCCCACGAGCGAATGCCCTGG-3') и провести редактирование генов с помощью системы CRISPR/Cas9. Сконструируйте донорскую ДНК с мутацией ZAP70(W163C) для обеспечения точной инкорпорации-n мутации (здесь, CAGGCCCCACACAGGTGGAGAAGCTCATTG
- Инъекция микрошприца
- Используйте микроинъекцию для введения мРНК, гРНК и донорской ДНК Cas9 в оплодотворенные яйцеклетки мыши C57BL/6. Совместно вводите белок Cas9 и гРНК, чтобы они расщепляли ген ZAP70 и вставляли мутацию ZAP70 (W163C) посредством гомологичной рекомбинации. Пересадите введенные оплодотворенные яйцеклетки псевдобеременным самкам мышей, подождите примерно 20 дней и определите родившихся мышей как поколение F0. Определите генотипы с помощью ПЦР-амплификации и секвенирования (см. шаг 1.1.5.3).
- Генотипирование мышей поколения F0
- Проведите ПЦР и секвенирование на мышах поколения F0 для подтверждения приобретения мутации ZAP70 (W163C) (см. шаг 1.1.5.3).
Примечание: Мыши поколения F0 являются химерными из-за быстрого расщепления эмбриона. У них может отсутствовать стабильная генетическая передача. Внедряйте серийное разведение для создания стабильных линий.
- Проведите ПЦР и секвенирование на мышах поколения F0 для подтверждения приобретения мутации ZAP70 (W163C) (см. шаг 1.1.5.3).
- Сбор и генотипическая идентификация мышей поколения F1
- Скрещивание F0-положительных мышей с мышами дикого типа C57BL/6J для получения мышей поколения F1 и выполнение генотипирования с помощью ПЦР и секвенирования для получения мышей SKG (предыстория C57BL/6; см. шаг 1.1.5.4).
- Методы генотипирования на основе ПЦР для поколений F0 и F1
- Стерильными ножницами отрежьте кусок 0,5 см от хвоста.
- Извлеките ДНК мыши с помощью набора для экстракции геномной ДНК животных.
- Для F0 готовят следующую реакционную систему ПЦР: 13,2 мкл ddH2O, 2 мкл ПЦР-буфера, 2 мкл 2,5 мМ dNTP, по 0,5 мкл каждого из прямых (5'-GATGCCTAGGTGGGGGGTTCC-3') и обратных (5'-ACTTGCCTACGCTACTGCTCTACA-3') праймеров (10 пмоль/мкл), 0,8 мкл ДНК-полимеразы и 1 мкл геномной ДНК (50-100 нг/мкл), выделенных из хвостов мышей, для конечного объема реакции 20 μл. Провести амплификацию генов с помощью следующей программы ПЦР: 94 °C в течение 3 мин; 98 °C в течение 15 с, 58 °C в течение 15 с и 68 °C в течение 1 мин, в течение 35 циклов; 68 °C в течение 5 мин; держать при температуре 12 °C.
- Для F1 готовят следующую реакционную систему ПЦР: 14,9 мкл ddH2O, 2 мкл 10x Taq ПЦР-буфера, 1 мкл 2,5 мМ dNTP, по 0,5 мкл каждого из прямых (5'-GATGCCTAGGTGGGGGGTTCC-3') и обратных (5'-ACTTGCCTACTACGCTACTGCTCTACA-3') праймеров (10 пмоль/мкл), 0,1 мкл Taq ДНК-полимеразы и 1 мкл геномной ДНК (50-100 нг/мкл), выделенных из хвостов мышей, для конечного объема реакции 20 μл. Проводят амплификацию генов с помощью следующей программы ПЦР: 94 °C в течение 5 мин; 94 °C в течение 30 с, 58 °C в течение 30 с, 72 °C в течение 1 мин, повторяется в течение 35 циклов; 72 °C в течение 5 мин; держать при температуре 12 °C.
- Запустите электрофорез для подтверждения ожидаемого размера изделий.
- Секвенирование продуктов ПЦР для проверки как генотипа, так и конкретной мутации.
- Стратегия редактирования генов
- Подбор мышей-доноров и реципиентов
- Выберите мышей SKG в возрасте 6-8 недель (самцов или самок) в качестве донорских мышей.
- Выберите мышей C57BL/6 в возрасте 6-8 недель (предпочтительно самку для получения стабильных экспериментальных результатов) в качестве мышей-реципиентов.
- Размещение мышей C57BL/6 и SKG (в возрасте 6-8 недель) в условиях SPF в индивидуально вентилируемых клетках. Обеспечьте свободный доступ к корму с SPF и стерильной воде в течение 12-часового цикла свет/темнота. Акклиматизируйте мышей за 1 неделю до начала экспериментов.
2. Выделение и очистка CD4+ Т-клеток у мышей SKG
- Усыпьте мышей SKG под стерильным ламинарным колпаком с использованием асфиксии CO2 . Погрузите мышей в 75% спирт на 5 минут для дезинфекции. Располагайте селезенку в брюшной полости, а также лимфатические узлы (паховые и подколенные) в паховой и подколенной областях. Осторожно рассеките селезенку и лимфатические узлы с помощью стерильных щипцов и ножниц и сразу же перенесите их на предварительно охлажденный PBS.
- Поместите селезенку и лимфатические узлы в отдельные чашки Петри. Продавите ткани через клеточное сетчатое фильтр 70 мкм с помощью поршня стерильного шприца и постепенно добавляйте 10-12 мл предварительно охлажденного PBS для получения однородной клеточной суспензии. Пропустите клеточную суспензию через тот же клеточный фильтр 70 мкм в центрифужную пробирку объемом 15 мл, затем центрифугируйте при 300 × г в течение 7 мин при 4 °C. Выбросьте надосадочную жидкость и сохраните клеточную гранулу.
- Проведите окрашивание трипановым синим для оценки жизнеспособности клеток. Посчитайте клетки и убедитесь, что жизнеспособность составляет ≥90%.
- Отрегулируйте концентрацию клеток до 1 ×10 8 клеток/мл с помощью буфера, входящего в комплект для выделения CD4+ Т-клеток.
- Перелейте 100 мкл клеточной суспензии (107 клеток) в новую пробирку. Добавьте 10 мкл биотина-антител-коктейля, тщательно перемешайте и выдерживайте на льду в течение 15 минут.
- Подвешивайте бусины с помощью вихревых движений на максимальной скорости. Добавьте 10 μл суспензии стрептавидина в гранулах, хорошо перемешайте и выдерживайте на льду в течение 15 минут.
- Добавьте 2,5 мл буфера, входящего в комплект для выделения CD4+ Т-клеток, и поместите пробирку в магнит на 5 минут.
- Осторожно перелейте жидкость (целевые клетки) из пробирки в новую стерильную пробирку, затем центрифугируйте при 4 °C, 300 × г в течение 5 мин. Выбросьте надосадочную жидкость и сохраните клеточную гранулу.
- Добавьте достаточное количество стерильного раствора PBS для корректировки концентрации клеток до 2 × 106 клеток/мл и оставьте суспензию на льду для последующего использования.
- Используйте проточную цитометрию для оценки чистоты отсортированных клеток (дополнительный рисунок S1). Рассчитайте чистоту клеток следующим образом: (Количество CD4+ Т-клеток / Общее количество клеток) × 100%. Убедитесь, что чистота составляет ≥90%16.
3. Адоптивный перенос CD4+ Т-клеток
- Обезболите мышей C57BL/6 2-3% изофлураном, достигнув глубины анестезии, при которой мыши теряют всякую подвижность, но сохраняют нормальное спонтанное дыхание.
- Аккуратно очистите внутренний кантус (уголок глаза) мыши стерильным ватным тампоном, чтобы удалить выделения и волосы, обнажив вену.
- Обездвижите мышь вручную. Наберите 200 мкл суспензии CD4+ Т-клеток (2 × 10,5-5 × 10,5 клеток на мышь) в шприц объемом 1 мл. Введите иглу под углом 10-15° во внутреннюю кантальную вену, обеспечивая точное размещение. Медленно и равномерно вводите клеточную суспензию в течение 10-15 с.
- После извлечения иглы аккуратно надавите на внутреннюю область кантала стерильным ватным тампоном в течение 3-5 с, чтобы предотвратить кровотечение.
- Поместите мышь в тихую, сухую и чистую клетку для наблюдения до тех пор, пока она полностью не придет в сознание, со стабильным дыханием и без аномального поведения (например, подергивания или внезапной смерти). Переместите мышь в стандартный каркас после подтверждения стабильного послеоперационного состояния.
ПРИМЕЧАНИЕ: Поскольку внутренняя кантальная вена имеет небольшой размер, бережное обращение и контролируемая скорость инфузии имеют решающее значение для предотвращения разрыва вены или блокировки клеток, вызванной чрезмерной скоростью. - Запишите детали инфузии и пометьте мышей модельной и контрольной групп (по четыре животных в группе), чтобы избежать путаницы в последующих экспериментах. Вводите CD4+ Т-клетки для моделирования мышей и не лечите контрольных мышей. Убедитесь, что все мыши являются мышами-реципиентами.
4. Стимуляция и индукция маннана
- Проводят индукцию маннаном на 4-е сутки (через 72 ч после инфузии CD4+ Т-клеток). Примените одни и те же условия индукции ко всем экспериментальным и контрольным мышам.
- Взвесьте порошок маннана и растворите его в стерильном PBS до концентрации 100 мг/мл.
- Держите мышь правильно, чтобы обнажить ее брюшную полость. Продезинфицируйте кожу 75% спиртом и определите место инъекции (~1 см в сторону от средней линии живота).
- Тщательно перемешайте раствор маннана и наберите соответствующий объем (20-30 мг на одну мышь) в шприц объемом 1 мл. Введите иглу под углом 45° в брюшную полость и медленно вводите раствор, чтобы обеспечить равномерное распределение. Медленно извлеките иглу и аккуратно прижмите место инъекции стерильным ватным тампоном в течение нескольких секунд, чтобы предотвратить протекание или инфицирование.
- Поместите инъекционную мышь в тихую и чистую клетку и внимательно следите за ней в течение 5-10 минут, чтобы убедиться в отсутствии утечки в месте инъекции, вздутия живота или аномального дыхания.
- Подробно запишите детали инъекции для каждой мыши.
5. Измерения
- Наблюдение за клиническим фенотипом
- Оценка симптомов артрита
- Проводите совместную оценку каждые 3 дня после индукции маннана. Осмотрите все суставы передних и задних конечностей, уделяя особое внимание коленным, голеностопным, лучезапястным и пальцевым суставам. Оцените тяжесть артрита по стандартным критериям (Таблица 1)17. Записывайте и сравнивайте общие баллы в каждый момент времени, чтобы оценить прогрессирование артрита.
- Оценка симптомов артрита
- Регистрация патологических особенностей тканей
- После месяца индукции маннана усыпьте мышей под стерильным ламинарным капюшоном с использованием удушения CO2 (в соответствии с рекомендациями этического комитета), закрепите мышь на поролоновой доске и обнажите задние конечности. Разрежьте кожу, начиная с лодыжки, и отклеивайте вверх, чтобы обнажить мышцы и суставы. Определите голеностопный сустав (между большеберцовой/малоберцовой и таранной костями) и плюснефаланговые суставы (между плюсневыми и проксимальными фалангами) и рассеките эти суставы для гистологического анализа и подготовки парафиновых срезов.
- Зафиксируйте иссеченные ткани в 4% формалине на 72 ч, затем перенесите их на 10% этилендиаминтетрауксусную кислоту (ЭДТА, pH 7,4) на 4 недели декальцинации для обеспечения полной декальцинации.
- После декальцинации промойте ткани PBS, чтобы удалить остатки фиксатора, а затем обезвожьте ткани с помощью градуированного этанола (75%, 80%, 95%, 100%).
ПРИМЕЧАНИЕ: Формалин может раздражать глаза, кожу и дыхательные пути. Его следует обрабатывать в вытяжном шкафу. - Погрузите салфетку в парафин с помощью машины для заделки парафина. С помощью микротома разрежьте внедренную ткань на ломтики толщиной 4 мкм. Поместите секции в водяную баню с температурой 40 °C с дистиллированной водой.
- Перенесите и просушите срезы. Разместите секции на стеклянных предметных стеклах. Высушите их в течение ночи при комнатной температуре (RT). Храните предметные стекла в RT для окрашивания.
- Окрашивание гематоксилином и эозином (H&E)
- Поместите горки в духовку при температуре 60 °C на 2 часа, чтобы удалить парафин.
- При комнатной температуре погрузите предметные стекла в следующей последовательности на 5 мин каждая: ксилол → ксилол → 100% этанол → 100% этанол → 95% этанол → 80% этанол → 75% этанол. Промыть в дистиллированной воде в течение 2 минут.
- Последовательно окрасьте предметные стекла в раствор гематоксилина в течение 5 минут, промойте в деионизированной воде в течение 2 минут, затем обработайте 0,1% нашатырным спиртом в течение 1 минуты, промойте в течение 3 x 2 минут в деионизированной воде, окрасьте эозином в течение 1 минуты и, наконец, промойте в деионизированной воде в течение 2 минут.
- Погрузите предметные стекла на 5 минут каждый в 80% этанол → 95% этанол → 100% этанол → ксилол → ксилол.
- Высушите слайды на воздухе естественным образом и закрепите с помощью нейтральной смолы.
- Safranin O-Fast Зеленое окрашивание
- Депарафинизируйте срезы парафина до состояния воды и покрасьте их с помощью набора для окрашивания Ван Гизона. После окрашивания смонтируйте предметные стекла с нейтральной смолой и сделайте снимки под микроскопом (подготовлено в шаге 5.2.5).
- Изменения в Т-клетках и цитокинах
- Удалите селезенку из мыши с помощью стерильных хирургических инструментов.
- Извлеките общую РНК из ткани селезенки с помощью набора для экстракции РНК в соответствии с инструкциями производителя. Количественно оцените концентрацию и чистоту РНК с помощью спектрофотометра и убедитесь, что соотношение A260/A280 находится в диапазоне от 1,8 до 2,0.
- Синтезируйте кДНК из выделенной РНК с помощью набора для обратной транскрипции. Следуйте протоколу производителя для настройки реакции и условий цикла. Храните кДНК при температуре -20 °C для последующего количественного ПЦР-анализа.
- Проведение количественной ПЦР: Измерение относительных уровней экспрессии мРНК Tbx21, Gata3, Il-17 и Foxp3 в ткани селезенки измеряли с помощью количественной ПЦР на основе SYBR Green в реакциях объемом 10 мкл, содержащих: 5 мкл 2x мастер-смеси SYBR Green, по 0,2 мкл прямых и обратных праймеров (10 мкМ; последовательности в таблице 2), 0,5-1 мкл кДНК (50-100 нг/мкл), и вода без нуклеаз к объему. Используйте следующие условия термоциклирования: начальная денатурация при 95 °C в течение 30 с, затем 40 циклов при 95 °C в течение 10 с и 60 °C в течение 30 с, с анализом кривой расплава (65-95 °C). Нормализуйте уровни экспрессии до Gapdh с помощью метода 2(-ΔΔCt).
- Выделение сыворотки крови и анализ цитометрической матрицы гранул (КБА)
- Соберите кровь у мыши с помощью орбитального забора крови методом энуклеации, переложите кровь в пробирку для сбора, покрытую антикоагулянтом, и дайте ей постоять при комнатной температуре в течение 30 минут. Свернувшуюся кровь центрифугировать при температуре 4 °C, 1 000 × г в течение 15 минут, тщательно собрать надосадочную жидкость (сыворотку) и хранить при температуре -80 °C до анализа.
- Определите уровни экспрессии IL-6, IL-10, IL-17, TNF-α и IFN-γ в сыворотке крови с помощью набора CBA в соответствии с инструкцией производителя.
- Удалите селезенку из мыши с помощью стерильных хирургических инструментов.
Результаты
Клиническая оценка отека суставов и частоты заболеваемости у мышей
На рисунке 1 показана клиническая оценка отека суставов и частота заболеваемости у модельных мышей. Результаты показывают, что у всех мышей в модельной группе развилось заболевание (n = 4), с частотой заболеваемости 100%. Баллы в модельной группе значительно выросли, показали кратковременное облегчение на второй неделе, а затем выросли в течение 6 недель.
Проявление отечности суставов у мышей
Суставы мышей модельной группы демонстрируют значительное утолщение и отек, при этом заметный отек и утолщение также наблюдаются в передних и задних конечностях (рис. 2).
Патологические результаты голеностопных суставов мышей
Патологические результаты показывают, что по сравнению с контрольной группой, мыши модельной группы демонстрируют значительное утолщение синовиальной оболочки в голеностопных суставах, разрыв в кости и выраженную агрегацию воспалительных клеток (рис. 3, рис. 4 и рис. 5).
Сывороточные Т-клеточные воспалительные факторы
По сравнению с контрольной группой, мыши модельной группы показали достоверное повышение сывороточных уровней IL-10 (7,51 против 2,15 пг/мл), TNF (78,83 против 13,11 пг/мл), IL-17 (101,6 против 12,64 пг/мл) и ИФН-γ (5,15 против 1,90 пг/мл) (p < 0,05). IL-6 также достоверно увеличился по сравнению с контрольной группой (15,59 против 6,27 пг/мл) (p = 0,05, рис. 6).
Изменения в подмножествах Т-клеток Th1/2/17 и Tregs в селезенке
Уровни экспрессии мРНК Tbx21 (Th1), Gata3 (Th2), Il-17 (Th17) и Foxp3 (Tregs) были измерены для оценки изменений в субпопуляциях Т-клеток в селезенке. Эти гены кодируют ключевые факторы транскрипции и цитокины, которые определяют дифференцировку и функцию соответствующих подмножеств Т-клеток. По сравнению с контрольной группой, мыши модельной группы показали достоверно повышенную экспрессию мРНК Tbx21 (1,68 против 0,61) и Il-17 (26,30 против 0,75) в селезенке (p < 0,05) относительно референсного гена Gapdh.
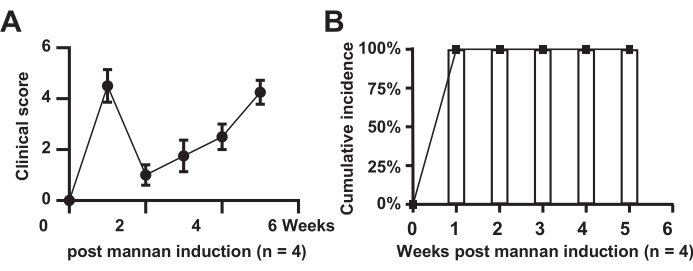
Рисунок 1: Клиническая оценка отека суставов. (А) мыши модельной группы; (B) Кумулятивная заболеваемость среди мышей модельной группы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Проявления отека суставов у контрольной и модельной мышей (n = 4). (A-C) Репрезентативные изображения оценок отека лап и суставов (0,2,4) в контрольной и модельной группах мышей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
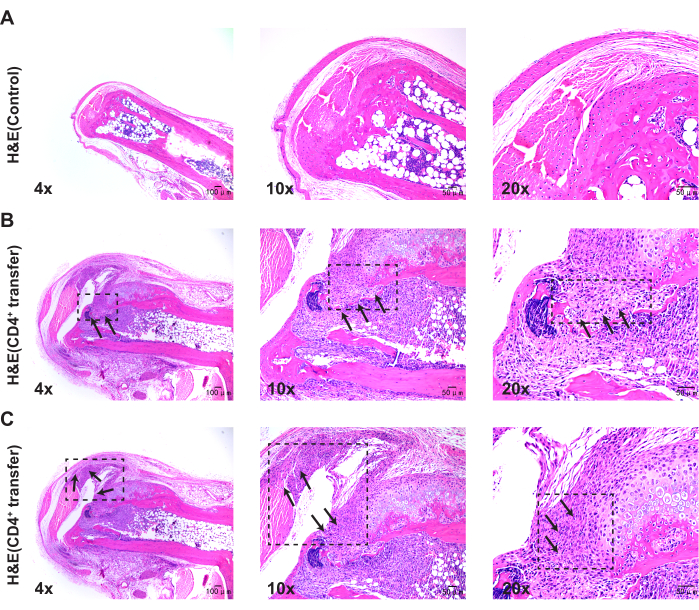
Рисунок 3: Гистологические изменения в голеностопных суставах мышей контрольной и модельной групп, наблюдаемые при окрашивании гематоксилин-эозином. (A) Голеностопный сустав контрольной мыши; (B) Разрыв в кости голеностопного сустава мышиной модельной группы; (C) Синовиальная пролиферация в голеностопном суставе мышей модельной группы. Масштабные линейки = 50 μм (первая колонка), 100 μм (вторая и третья колонки). Изображения на рисунках 3B и 3C сделаны одной и той же мышью, демонстрируя различные патологические фенотипы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Различия в толщине синовиальных суставов голеностопного сустава между контрольной группой и мышами модельной группы (p < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
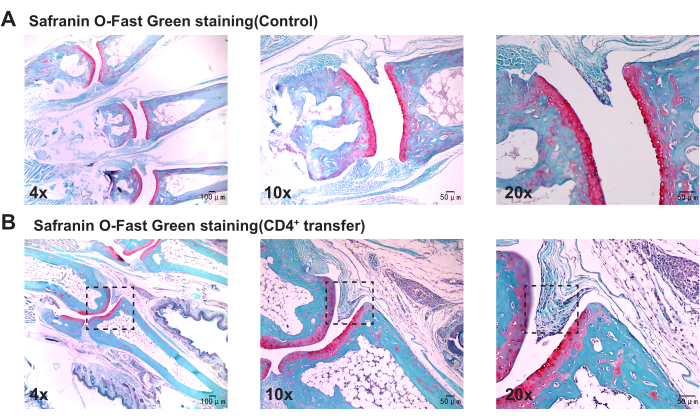
Рисунок 5: Гистологические изменения в голеностопных суставах мышей контрольной и модельной групп, наблюдаемые при окрашивании Safranin O-Fast Green. (A) Голеностопный сустав мышей контрольной группы; (Б) Синовиальная пролиферация в голеностопном суставе мышей модельной группы. Масштабные линейки = 50 μм (первая колонка), 100 μм (вторая и третья колонки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Изменения воспалительных факторов, связанных с Т-клетками, и подмножеств у мышей контрольной и модельной групп. (А) экспрессия воспалительных факторов, связанных с Т-клетками, в сыворотке крови мышей контрольной и модельной групп и (В) изменения в субпопуляциях Т-клеток Th1/2/17 и Tregs в селезенке. *p < 0,05, **p < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Счёт | Отек (диапазон 0-4) | Эритема (диапазон 0-2) |
| 0 | Никакой | Никакой |
| 1 | Любая цифра | незначительный |
| 2 | Лапа | Крайний |
| 3 | Запястье/голеностопный сустав | |
| 4 | Конечность целиком |
Таблица 1: Критерии оценки артрита. Чтобы оценить артрит, каждая конечность оценивается в соответствии с отеком и эритемой, при этом каждой конечности присваивается оценка от 0 до 6. Баллы для всех четырех конечностей суммируются, чтобы получить общую оценку артрита для каждой мыши.
| Последовательности праймеров | |
| Имя Oligo | Последовательность от 5' до 3' |
| Тбх21-Форвард | AGCAAGGAGCGAATGTT |
| Tbx21-Реверс | GGGTGGACATATAAGCGGTTC |
| Гата3-Форвард | CTCGGCCATTCGTACATGGAA |
| Gata3-Реверс | GGATACCTCTGCACCGTAGC |
| Ил-17А-Форвард | TTTAACTCCCTTGGCGCAAAA |
| Ил-17А-Реверс | CTTTCCCTCCGCATTGACAC |
| Фоск3-Форвард | CCCTGACCTCAAAACCAAG |
| Foxp3-Реверс | GTGTGACTGCATGACTAACTTTGA |
| Гапдх-Форвард | GGTTGTCTCCTGCGACTTCA |
| Гапд-реверс | TGGTCCAGGGTTTCTTACTCC |
Таблица 2: Список последовательностей праймеров.
Дополнительный рисунок S1: Стратегия стробирования для сортировки CD4+ Т-клеток методом проточной цитометрии. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Развитие РА тесно связано с аномальной инфильтрацией иммунных клеток в синовиальной ткани, где нерегулируемая активация этих иммунных клеток приводит к высвобождению различных провоспалительных цитокинов, которые в дальнейшем способствуют повреждению синовиальных и суставных структур18,19. Несколько животных моделей РА были широко оценены, в том числе модель CIA, модель K/BxN и мыши SKG 13,20,21. Несмотря на то, что эти модели успешно воспроизводят иммунные механизмы и клинические проявления РА, все они имеют существенные ограничения. Например, модель CIA на мышах C57BL/6 имеет более низкий процент успеха, более длительный период начала и значительное влияние окружающей среды и экспериментальных условий, что делает ее менее практичной в определенных экспериментальных условиях. Мыши SKG представляют собой мышиную модель RA, основанную на мутации гена ZAP-70, которая вызывает резкую аномалию в передаче сигналов Т-клеточного рецептора (TCR) и индуцирует аутоиммунный артрит22. Однако эта модель дорога, и на воспроизводимость экспериментальных результатов легко влияют условия индукции. K/BxN является моделью наследственного артрита, вызванного совместной активностью Т- и В-клеток, проявляющих выраженный иммунный ответ23. Тем не менее, построение этой модели является дорогостоящим, а ее специфичность ограничена, что приводит к ограниченному иммунному ответу, который не может полностью охватить многогранный патологический процесс РА человека. Поэтому большое значение имеет разработка животной модели, способной воспроизводить ключевые патологические особенности РА, отвечать различным экспериментальным требованиям и обеспечивать высокую воспроизводимость.
В этом исследовании мы представляем метод создания модели РА через адоптивный перенос адаптивных CD4+ Т-клеток от мышей SKG. Построение этой модели основано на отборе CD4+ Т-клеток у мышей SKG с фоном C57/BL6 и индукции маннана, что обеспечивает успех модели. Широко известно, что мыши SKG на фоне BALB/c являются носителями спонтанной мутации гена ZAP70 (W163C), которая вызывает аномальный отбор сигналов TCR, приводящий к высокосамореактивным Т-клеткам24. Это приводит к чрезмерной активации Т-клеток и возникновению синовита и разрушения суставов, тем самым имитируя ключевые патологические процессы РА, такие как восстановление синовиальной оболочки и активация иммунных клеток25,26. Клинические особенности мышей SKG очень похожи на таковые у пациентов с РА человека.
Чтобы ввести эту мутацию в фон C57BL/6, мы использовали технологию CRISPR/Cas9 для успешной генерации модели мыши с фоном C57BL/6 SKG, несущей мутацию ZAP70 (W163C). CRISPR/Cas9 обеспечивает высокую точность и эффективность, позволяя целенаправленно вводить желаемую мутацию при сохранении низкой скорости нецелевого вставки или нежелательных генетических модификаций, связанных с традиционными методами случайной индукции, тем самым обеспечивая стабильность и уникальность модели27,28. Что еще более важно, этот метод также значительно сокращает время, необходимое для построения модели, повышая как управляемость, так и эффективность разработки моделей. Используя эту модель, мы можем точно воспроизвести Т-клеточный синовит и совместную деструкцию РА на фоне C57BL/6. По сравнению с фоном BALB/C у традиционных мышей SKG, модельные мыши на фоне C57BL/6 имеют более широкое применение в иммунологических исследованиях и могут быть легче комбинированы с другими трансгенными моделями (например, Rag1-/- или IL17-/-). Это делает их подходящими для изучения роли мутации ZAP70 в развитии РА и других аутоиммунных заболеваний, таких как системная красная волчанка или рассеянный склероз.
Основываясь на ключевой роли29,30 CD4+ Т-клеток в активации РА, мы выбрали их в качестве ключевых медиаторов. Т-клетки являются основными движущими силами иммунных реакций при РА и могут напрямую вызывать повреждение синовиальной оболочки, активируя субпопуляции эффекторов Th1/Th1731, в зависимости от воспалительных факторов, таких как IL-6, IL-17 и TNF-α 32,33. Являясь ключевыми медиаторами иммунной регуляции, CD4+ Т-клетки секретируют провоспалительные цитокины, запуская и поддерживая воспалительный каскад, который приводит к синовиальной пролиферации и повреждению суставов, тем самым непосредственно способствуя патологическому прогрессированию РА. Они играют важную роль в оказании помощи В-клеткам в производстве специфических антител (например, ACPA)34. Между тем, типичным гистопатологическим признаком синовиальной оболочки РА является агрегация CD4+ Т-клеток. Некоторые гены главного комплекса гистосовместимости (MHC) класса II, особенно «общие эпитопы», связанные с изотипом антиген-DR лейкоцитов человека (HLA-DR), считаются тесно связанными с патогенезом RA35. Кроме того, стратегия блокирования костимуляции Т-клеток цитотоксическим Т-лимфоцит-ассоциированным антигеном 4 (CTLA4)-Ig продемонстрировала значительную клиническую эффективность при РА36. Кроме того, индукция маннана служит мощным активатором для модели, способствуя активации компонентов врожденного иммунитета, таких как дендритные клетки и макрофаги37. Этот шаг еще больше способствует активации CD4+ Т-клеток и иммунным реакциям, значительно увеличивая атаку иммунной системы на собственные ткани, тем самым моделируя патологические особенности иммунной дисрегуляции и повреждения синовиальной оболочки при РА.
После завершения модельной индукции мы провели систематическую верификацию модельной группы по нескольким параметрам, включая клиническую оценку отека суставов, патологическую валидацию (наблюдение за патологией тканей синовита и особенностями разрушения суставов) и иммунологическую валидацию (экспрессию клеток Th1/2/17 и Treg в сыворотке крови и селезенке). Результаты показали, что наша модель успешно реплицировала Т-клеточный синовит и разрушение суставов при РА, индуцируя характерную иммунную активацию и синовиальные патологические изменения, согласующиеся с основными патофизиологическими механизмами РА, со 100% распространенностью. Примечательно, что в нашей модели клинический показатель опухших суставов у мышей достигает пика через 1 неделю, показывает заметное снижение на второй неделе, а затем постепенно снова повышается на более поздних стадиях, что не совсем соответствует типичному течению заболевания, наблюдаемому вобычных животных моделях артрита. Это может быть связано с тем, что через 1 неделю после индукции иммунная система у модельных мышей находится в интенсивно активированной начальной фазе при введении маннана, что приводит к пику воспаления суставов. На второй неделе иммунная регуляция и механизмы самовосстановления приводят к временному облегчению клинических симптомов. По мере прогрессирования заболевания иммунная толерантность постепенно ослабевает, а иммунный ответ вновь усиливается, что проявляется постепенным ухудшением состояния на более поздних стадиях.
Несмотря на то, что эта модель относительно проста по сравнению с другими моделями, все же есть несколько ключевых моментов, которые необходимо учитывать в процессе моделирования. Во-первых, активность и чистота CD4+ Т-клеток мышей SKG составляют основу успеха модели. Чистота ячеек должна превышать 90% для обеспечения согласованности и достоверности экспериментальных результатов. Во-вторых, скорость инъекции в медиальную кантальную вену должна тщательно контролироваться, чтобы избежать разрыва вены из-за слишком быстрой инъекции или утечки клеток из-за слишком медленной инъекции. Кроме того, решающее значение имеет выбор дозы для клеток. Слишком низкая доза может привести к неудаче модели, в то время как слишком высокая доза может вызвать неспецифические воспалительные реакции. Поэтому в процессе моделирования следует внимательно следить за общим состоянием мышей, а любые аномальные симптомы должны регистрироваться незамедлительно, чтобы обеспечить плавный ход эксперимента и научную обоснованность данных.
По сравнению с обычными моделями, эта модель имеет более короткий период приживаемости, достигает более высокого уровня заболеваемости у мышей C57BL/6 и остается относительно экономичной и простой в эксплуатации. Перенос аутореактивных CD4+ Т-клеток точно воспроизводит Т-клеточные иммунные реакции и фиксирует ключевые патологические особенности РА, такие как отек и повреждение суставов. Более того, его клинические проявления хорошо согласуются с проявлениями РА человека, предлагая более достоверное отражение клинических и патологических процессов РА. Кроме того, комбинация инфузии медиальной кантальной вены и индукции маннана еще больше улучшает управляемость модели и экспериментальную стабильность, делая ее высоковоспроизводимой и обеспечивая превосходный экспериментальный контроль. Конечно, у этой модели все же есть ограничения. В основном он сосредоточен на иммунных реакциях, управляемых Т-клетками; моделирование совместных ролей В-клеточных ответов антител и других иммунных клеток (таких как естественные киллеры (NK) клетки и Treg-клетки) является недостаточным, что затрудняет полное представление многоклеточных патологических механизмов РА. Тем не менее, эта мышиная модель РА остается стабильной и надежной моделью на животных, предоставляя исследователям лучшую платформу для моделирования иммунных реакций, опосредованных Т-клетками, и основных патологических особенностей РА. Эта модель позволяет исследователям глубоко погрузиться в иммунные механизмы и патологическое прогрессирование РА, предоставляя важные экспериментальные данные и инструменты для разработки новых методов лечения, в частности, для понимания иммунной дисрегуляции, вызванной Т-клетками, и определения терапевтических мишеней.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана грантами Национального фонда естественных наук Китая (82270903, 82401588 и 81974254) и Китайского фонда постдокторантуры (2024M751019).
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose | Yeasen | 10208ES60 | Preparing agarose gel for use in DNA electrophoresis experiments |
| Anhydrous ethanol | Shanghai HuShi Laboratory Instruments Co., Ltd. | 100009218 | Dehydrating and fixative agent |
| ZAP 70 primers | Tsingke | Primers used for detecting ZAP70 gene expression, commonly used in PCR experiments for genotyping mice | |
| 0.5 M EDTA solution (pH = 7.4) | Biosharp | R00521 | Used for decalcification to ensure the quality of tissue sections and staining for calcium-containing tissues, while maintaining the structural integrity of the tissue |
| 1.5 mL enzyme-free ep tubes | LABSELECT | MCT-001-150-S | Used for a variety of experiments such as sample storage, centrifugal separation, etc |
| 2x Q3 SYBR qPCR Master Mix (Universal) | ToloBio | 22204 | Used for performing highly specific and highly sensitive qPCR reactions. |
| 2x Magic Green Taq SuperMix | TOLOBIO | 21502-04 | Buffer solution for pre-electrophoresis |
| 4% Formaldehyde (paraformaldehyde) solution | Biosharp | BL539A | Used as a fixative to preserve tissue structure and cellular morphology, providing stable and well-preserved samples for subsequent staining steps |
| Animal tissue/cell total RNA isolation kit | Servicebio | MPC2409122 | Extraction of total RNA from animal tissues/cells |
| BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit | BD Biosciences | 560485 | Measure the expression of Th1/2/17 cytokines in mouse serum. |
| Cell Culture dish | LABSELECT | 12211 | A container for cell fluid from the spleen and lymph nodes |
| Dimethylbenzene | China National Pharmaceutical Group Chemical Reagents Co., Ltd. | 10023418 | Used as a deparaffinizing and clearing agent |
| Easyfive six-port cell counting chamber | CytoEasy | N3EF110 | Used for cell counting |
| Enhanced Safranin O-Fast Green staining solution for cartilage. | Solarbio | G1371 | Stain cartilage and bone tissues to observe pathological changes in the joint area. |
| Glass slide | CITOTEST | 188105 | Basic support for tissue slicing |
| Hematoxylin staining solution | Servicebio | G1005-1 | Dying |
| Hematoxylin staining solution | Servicebio | G1001 | Dying |
| Low-speed refrigerated centrifuge | Cence | F14300021010004 | It is used for centrifugation and precipitation |
| Mannan | Sigma | m7504 | Activator for the model.Dissolve in sterile PBS at 2 mg/mL, mix thoroughly, and filter through a 0.22 μm membrane to eliminate any particles or possible sources of contamination. |
| MojoSort Magnet | Biolengend | 480019 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice |
| MojoSort Mouse CD4 T Cell Isolation Kit | Biolengend | 480033 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice . Use a negative selection method that directly binds to the CD4 molecule to isolate CD4+ T cells, preserving the integrity of surface antigens without affecting CD4 molecule functionality, making it suitable for CD4+ T cell infusion experiments. |
| Nano-300 | ALLSHENG | AS-11020-00 | Accurate detection of nucleic acids, proteins, and cellular solutions |
| Neutral resin mounting agent | Biosharp | BL704A | Fix and preserve stained tissue sections |
| Paraffin microtome | KEDEE | KD-3389 | Used for paraffin sections |
| Phosphate-buffered saline (PBS) | Pricella | WHB824P281 | Used as a buffer solvent or cleaning agent, |
| Sterile cell filter (70 µm) | Biosharp | BS-70-CS | Remove large impurities or aggregated cell clusters from the cell suspension to ensure sample purity and cell uniformity |
| Sterile syringe (1 mL) | Lingyang Medical Apparatus | 20241020 | Injection into the inner canthal vein |
| Tabletop high-speed microrefrigerated centrifuge | SCILOGEX | S1010E | Used for centrifugation and precipitation |
| TEA Buffer (50x) | Yeasen | 60116ES76 | Stabilizes pH, helps protect and preserve molecules like DNA and RNA, used in electrophoresis experiments |
| ToloScript All-in-one RT EasyMix for qPCR | ToloBio | 22107 | Used to convert RNA templates into cDNA, facilitating subsequent gene expression analysis, qPCR, and other molecular biology experiments. |
| Transefer Pipettes | BIOFIL | 240515-133-A | Used for transferring solutions |
| Trypan blue dye solution | Biosharp | 7009529 | Commonly used for cell viability assays, helps differentiate live cells from dead cells |
Ссылки
- Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: A systematic analysis of the global burden of disease study. Lancet Rheumatol. 5 (10), e594-e610 (2021).
- Radu, A. F., Bungau, S. G. Management of rheumatoid arthritis: An overview. Cells. 10 (11), 2857(2021).
- Di Matteo, A., Bathon, J. M., Emery, P. Rheumatoid arthritis. Lancet. 402 (10416), 2019-2033 (2023).
- Bernard, L., et al. Management of patients with rheumatoid arthritis by telemedicine: Connected monitoring. A randomized controlled trial. Joint Bone Spine. 89 (5), 105368(2022).
- Jang, S., Kwon, E. J., Lee, J. J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells. Int J Mol Sci. 23 (2), 905(2022).
- Daikh, D. I. Rheumatoid arthritis: Evolving recognition of a common disease. Best Pract Res Clin Rheumatol. 36 (1), 101740(2022).
- Bhamidipati, K., Wei, K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 36 (1), 101742(2022).
- Meyer, A., Parmar, P. J., Shahrara, S. Significance of IL-7 and IL-7R in RA and autoimmunity. Autoimmun Rev. 21 (7), 103120(2022).
- Yu, X., et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRS ligands on human fibroblast-like synoviocytes-a potential immunopathological mechanism for joint inflammation in rheumatoid arthritis. Int Immunopharmacol. 82, 106356(2020).
- Wu, X., et al. Single-cell sequencing of immune cells from anticitrullinated peptide antibody positive and negative rheumatoid arthritis. Nat Commun. 12 (1), 4977(2021).
- Wei, X., Niu, X. T follicular helper cells in autoimmune diseases. J Autoimmun. 134, 102976(2023).
- Mcelwee, M. K., Dileepan, T., Mahmud, S. A., Jenkins, M. K. The CD4+ T cell repertoire specific for citrullinated peptides shows evidence of immune tolerance. J Exp Med. 220 (12), e20230209(2023).
- Ahmed, S., et al. Dual inhibition of glycolysis and glutaminolysis for synergistic therapy of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 176(2023).
- Wu, J., et al. Tnf antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models. Nat Commun. 13 (1), 676(2022).
- Huo, F., Hou, J., Zhu, Y., Feng, Z. ferroptosis inducer ike ameliorate pulmonary fibrosis in collagen-induced arthritis (CIA) mice via decreasing the expression of IL-6, CCL5 and CXCL9. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 40 (2), 114-120 (2024).
- Sun, H., et al. ID2 exacerbates the development of rheumatoid arthritis by increasing IFN-γ production in CD4+ T cells. Clin Transl Med. 15 (3), e70242(2025).
- Murayama, M. A., et al. CTRP6 is an endogenous complement regulator that can effectively treat induced arthritis. Nat Commun. 6, 8483(2015).
- Kadura, S., Raghu, G. Rheumatoid arthritis-interstitial lung disease: Manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 30 (160), 210011(2021).
- Mueller, A. L., et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies. Cells. 10 (11), 3017(2021).
- Sun, H., et al. Gut commensal parabacteroides distasonis alleviates inflammatory arthritis. Gut. 72 (9), 1664-1677 (2023).
- Li, Z. Y., Zhou, J. J., Luo, C. L., Zhang, L. M. Activation of tgr5 alleviates inflammation in rheumatoid arthritis peripheral blood mononuclear cells and in mice with collagen II-induced arthritis. Mol Med Rep. 20 (5), 4540-4550 (2019).
- Mccarthy, E. E., et al. Endogenous antigens shape the transcriptome and TCR repertoire in an autoimmune arthritis model. J Clin Invest. 135 (2), e174647(2024).
- Chen, J., et al. Annexin A1 attenuates cardiac diastolic dysfunction in mice with inflammatory arthritis. Proc Natl Acad Sci U S A. 118 (38), e2020385118(2021).
- Owada, T., et al. LAT1-specific inhibitor ameliorates severe autoimmune arthritis in skg mouse. Int Immunopharmacol. 109, 108817(2022).
- Zhang, A., et al. Nrf2 activation improves experimental rheumatoid arthritis. Free Radic Biol Med. 207, 279-295 (2023).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- Van Hees, M., et al. New approaches to moderate CRISPR-Cas9 activity: Addressing issues of cellular uptake and endosomal escape. Mol Ther. 30 (1), 32-46 (2022).
- Tyumentseva, M., Tyumentsev, A., Akimkin, V. CRISPR/Cas9 landscape: Current state and future perspectives. Int J Mol Sci. 24 (22), 16077(2023).
- Wu, F., et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol. 12, 750753(2021).
- Dunlap, G., et al. Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium. Nat Commun. 15 (1), 4991(2024).
- Okamoto, K., Takayanagi, H. Effect of T cells on. Bone. 168, 116675(2023).
- Wang, X. Q., et al. Dopamine D2 receptor on CD4+ T cells is protective against inflammatory responses and signs in a mouse model of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 87(2023).
- Wang, X. Q., Liu, Y., Cai, H. H., Peng, Y. P., Qiu, Y. H. Expression of tyrosine hydroxylase inCD4+ T cells contributes to alleviation of Th17/Treg imbalance in collagen-induced arthritis. Exp Biol Med (Maywood). 241 (18), 2094-2103 (2016).
- Anaparti, V., et al. Increased frequency of TIGIT+ CD4 T cell subset in autoantibody-positive first-degree relatives of patients with rheumatoid arthritis. Front Immunol. 13, 932627(2022).
- Lei, Y., et al. Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis. Nat Commun. 15 (1), 113(2024).
- Jinno, S., et al. Comparison of retention of biologics in Japanese patients with elderly-onset rheumatoid arthritis-the answer cohort study. Rheumatology (Oxford). 64 (2), 509-516 (2025).
- Hagert, C., et al. Rapid spread of mannan to the immune system, skin and joints within 6 hours after local exposure. Clin Exp Immunol. 196 (3), 383-391 (2019).
- Cheng, W. J., et al. Deer velvet antler extracts exert anti-inflammatory and anti-arthritic effects on human rheumatoid arthritis fibroblast-like synoviocytes and distinct mouse arthritis. Am J Chin Med. 50 (6), 1617-1643 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены