Method Article
نموذج نقل بالتبني لالتهاب المفاصل الروماتويدي في الفئران
In This Article
Summary
هنا ، نبلغ عن بروتوكول ينشئ نموذج فأر التهاب المفاصل الروماتويدي (RA) من خلال النقل بالتبني لخلايا CD4 + T من فئران SKG ، مما يوفر أداة تجريبية سريعة وموثوقة للتحقيق في الآليات المناعية ، والتقدم المرضي ، وتطوير علاجات جديدة لالتهاب المفاصل الروماتويدي .
Abstract
التهاب المفاصل الروماتويدي (RA) هو اضطراب التهابي مناعي ذاتي مزمن جهازي قد يؤدي إلى تلف المفاصل والتشوهات والإعاقة وحتى الموت. نظرا لمسببات المرض المعقدة والعرض السريري غير المتجانس ، لا تزال استراتيجيات العلاج الحالية غير كافية في التحكم الفعال في تطور المرض ، لا سيما في تحقيق التشخيص المبكر وتقديم العلاجات الشخصية. لذلك ، فإن تطوير مناهج علاجية جديدة أمر بالغ الأهمية. لتحقيق ذلك ، تعد النماذج الحيوانية الموثوقة ضرورية للتحقيق في التسبب في التهاب المفاصل الروماتويدي. حاليا ، يتم استخدام العديد من النماذج الحيوانية لالتهاب المفاصل الروماتويدي ، بما في ذلك نموذج التهاب المفاصل الناجم عن الكولاجين (CIA) ، ونموذج K / BxN ، وفأر SKG. على الرغم من أن هذه النماذج يمكن أن تحاكي بنجاح آليات المناعة والمظاهر السريرية لالتهاب المفاصل الروماتويدي ، إلا أن لكل منها قيودا ملحوظة.
في هذا البروتوكول ، نصف عملية إنشاء نموذج فأر RA من خلال النقل بالتبني لخلايا CD4 + T من فئران SKG. بالمقارنة مع النماذج التقليدية ، يوفر هذا النموذج وقتا أقصر للتأسيس ومعدل حدوث أعلى (100٪) في الفئران C57BL / 6. إنه فعال من حيث التكلفة نسبيا ، ويتضمن إجراءات مباشرة ، ويكرر بشكل موثوق الاستجابات المناعية بوساطة الخلايا التائية ، مما يضمن تحكما تجريبيا فائقا وقابلية للتكاثر. أجرينا تقييما شاملا للنموذج ، وقمنا بتقييم النمط الظاهري السريري مثل أعراض المفاصل. من خلال تقييم النمط الظاهري السريري ، لاحظنا تورما كبيرا في المفاصل واستجابات التهابية. بالإضافة إلى ذلك ، باستخدام تقنية تفاعل البوليميراز المتسلسل لقياس مستويات التعبير عن عوامل النسخ الرئيسية ، وجدنا أن هذا النموذج يحاكي بشكل فعال الاستجابات المناعية بوساطة الخلايا التائية والسمات المرضية الرئيسية لالتهاب المفاصل الروماتويدي. باستخدام هذا النموذج ، يمكن للباحثين محاكاة الاستجابة المناعية بوساطة الخلايا التائية والسمات المرضية الرئيسية لالتهاب المفاصل الروماتويدي بشكل أفضل ، وبالتالي توفير أداة تجريبية موثوقة وفعالة لدراسة آليات المناعة والتقدم المرضي وتطوير علاجات جديدة لالتهاب المفاصل الروماتويدي.
Introduction
التهاب المفاصل الروماتويدي هو مرض التهابي مناعي ذاتي مزمن وجهازي يصيب ما يقرب من 1٪ من سكان العالم ، مما يسبب اعتلال المراضة وعبء اجتماعي واقتصادي ثقيل1،2. يتميز المرض بالتهاب زليلي مستمر ، وتدمير الغضاريف ، وتآكل العظام ، مما يؤدي في النهاية إلى تشوهات المفاصل ، والإعاقات ، وفي الحالات الشديدة ، الموت المبكر3،4،5. يتضمن التسبب في التهاب المفاصل الروماتويدي التفاعل بين العوامل الوراثية والبيئية والمناعية ، مع ميزات رئيسية بما في ذلك التنشيط غير الطبيعي للمناعة الخلوية ، والإفراط في إطلاق السيتوكينات المؤيدة للالتهابات ، وتعطيل التحمل المناعي6،7. في هذه العملية ، تعمل الخلايا التائية ذاتية التفاعل ، وخاصة الخلايا التائية CD4 + ، كمحركات رئيسية لتنظيم المناعة ، على تعزيز التقدم المرضي لالتهاب المفاصل الروماتويدي بشكل مباشر من خلال آليات متعددة.
تنتج الخلايا التائية المساعدة (Th) 1 إنترفيرون جاما (IFN-γ) ، والذي ينشط البلاعم والخلايا الليفية الزليلية ، مما يؤدي إلى إطلاق عامل نخر الورم (TNF) -α والإنترلوكين (IL) -6 والتسبب في التهاب الغشاء المفصلي. تفرز خلايا Th17 IL-17 ، مما يعزز تنشيط الخلايا الزليلية وناقضات العظم ، مما يؤدي إلى تفاقم تدمير الغضاريف وتآكل العظام8،9. بالإضافة إلى ذلك ، تعمل خلايا CD4 + T على تضخيم الاستجابات الالتهابية عن طريق تنشيط الخلايا البائية من خلال إشارات التحفيز المشترك ، مما يؤدي إلى إنتاج الأجسام المضادة للبروتين المضاد للسيترولين (ACPA) والعوامل الروماتويدية (RF) 10. وفي الوقت نفسه ، تعد العيوب في الوظيفة وانخفاض عدد خلايا Treg من الأسباب الرئيسية لعدم التوازن المناعي في التهاب المفاصل الروماتويدي ، مما يؤدي إلى التهاب غير منضبط11،12. نظرا للمسببات المعقدة والعرض السريري غير المتجانس ، فإن التشخيص المبكر صعب ، والعلاج الحالي لالتهاب المفاصل الروماتويدي غير مرض. لذلك ، فإن تطوير مناهج علاجية جديدة أمر بالغ الأهمية. تعتبر النماذج الحيوانية الموثوقة ضرورية للتحقيق في التسبب في التهاب المفاصل الروماتويدي لاكتساب فهم أعمق للآليات المحتملة لالتهاب المفاصل الروماتويدي واستكشاف استراتيجيات علاج جديدة.
تساهم نماذج RA التقليدية ، مثل نماذج الماوس CIA و K / BxN13،14،15 ، في تحسين فهمنا ل RA. ومع ذلك ، تظهر هذه النماذج قيودا كبيرة. على سبيل المثال ، يتمتع نموذج وكالة المخابرات المركزية في الفئران C57BL / 6 بمعدل نجاح منخفض وفترة تحريض طويلة ، مما يقلل من فائدته في بعض الإعدادات التجريبية. وبالمثل ، على الرغم من أن نموذج K / BxN ذو قيمة ، إلا أنه مكلف وله قيود في تكرار الأمراض المعقدة لالتهاب المفاصل الروماتويدي البشري ، لا سيما التفاعلات بين الخلايا المناعية والسيتوكينات.
لمعالجة هذه القيود ، قمنا بتطوير نموذج فأر RA جديد عن طريق نقل خلايا CD4 + T من الفئران SKG ذات خلفية C57BL / 6 إلى فئران C57BL / 6 ذات الكفاءة المناعية ، بالاشتراك مع التنشيط المناعي الناجم عن المانان. يكرر هذا النموذج بشكل فعال السمات الرئيسية لالتهاب المفاصل الروماتويدي ، بما في ذلك الاستجابات المناعية بوساطة الخلايا التائية والخصائص المرضية الأساسية مثل الالتهاب الزليلي وتآكل المفاصل ، مع تقديم مزايا في التكاثر والبساطة والفعالية من حيث التكلفة. حددنا منهجية مفصلة لإنشاء هذا النموذج ، والتي تتضمن توليد فئران SKG على خلفية C57BL / 6 ، وعزل خلايا CD4 + T من فئران SKG ، ونقلها بالتبني ، والتحريض اللاحق بواسطة مانان. بالإضافة إلى ذلك ، نصف المعايير السريرية والنسيجية المستخدمة لتقييم شدة التهاب المفاصل ، وضمان موثوقيته وقابليته للتكاثر. من خلال محاكاة الاستجابات المناعية بوساطة الخلايا التائية باستمرار والسمات المرضية الأساسية لالتهاب المفاصل الروماتويدي ، يعمل هذا النموذج كأداة تجريبية قوية وفعالة للتحقيق في آليات المناعة وتطور المرض وتطوير علاجات جديدة لالتهاب المفاصل الروماتويدي.
Protocol
اتبعت جميع الإجراءات التجريبية في هذه الدراسة بدقة المبادئ التوجيهية المنصوص عليها في "دليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر" ، بما في ذلك تربية والعمليات التجريبية والقتل الرحيم ، وتمت الموافقة عليها من قبل لجنة أخلاقيات التابعة لكلية الطب تونغجي ، جامعة هواتشونغ للعلوم والتكنولوجيا.
1.
- توليد الفئران SKG (خلفية C57BL / 6)
- استراتيجية تحرير الجينات
- صمم دليلا محددا للحمض النووي الريبي (gRNA) يستهدف جين ZAP70 (تسلسل gRNA: 5'-CAGCCCACGAGGGAATGCCCTGG-3') وإجراء تحرير الجينات باستخدام نظام CRISPR / Cas9. صمم الحمض النووي للمتبرع بطفرة ZAP70 (W163C) لضمان دمج دقيق للطفرة (هنا ، CAGGCCCCACAGGGAGAGCTCATTG
CTACCACAGCCCACGAGGGCCCCتيراغرام
جTATCACAGCAGCCTGACTCGTGAGGAG
GCCGAGCGCAAACTCTATTCCGGCCCA).
ملاحظة: يوجه gRNA بروتين Cas9 إلى الموقع المحدد لجين ZAP70 للقطع الدقيق. تشير القاعدة المسطرة في تسلسل الحمض النووي للمتبرع إلى قواعد متحولة. تتوافق هذه الطفرة مع طفرة W163C (TGG→TGC) في بروتين ZAP70 ، الموجود في مجال وظيفي حرج.
- صمم دليلا محددا للحمض النووي الريبي (gRNA) يستهدف جين ZAP70 (تسلسل gRNA: 5'-CAGCCCACGAGGGAATGCCCTGG-3') وإجراء تحرير الجينات باستخدام نظام CRISPR / Cas9. صمم الحمض النووي للمتبرع بطفرة ZAP70 (W163C) لضمان دمج دقيق للطفرة (هنا ، CAGGCCCCACAGGGAGAGCTCATTG
- حقن الحقنة المجهرية
- استخدم الحقن المجهري لإدخال Cas9 mRNA و gRNA والحمض النووي المتبرع في بيض الفأر C57BL / 6 المخصب. شارك في حقن بروتين Cas9 و gRNA بحيث يشقوا جين ZAP70 ويدخلون طفرة ZAP70 (W163C) عن طريق إعادة التركيب المتماثل. زرع البويضات المخصبة المحقونة في إناث الفئران الحوامل الزائفة ، وانتظر حوالي 20 يوما ، وقم بتعيين الفئران المولودة على أنها جيل F0. تحديد الأنماط الجينية من خلال تضخيم تفاعل البوليميراز المتسلسل وتسلسله (انظر الخطوة 1.1.5.3).
- التنميط الجيني لفئران الجيل F0
- قم بإجراء تفاعل البوليميراز المتسلسل والتسلسل على فئران الجيل F0 لتأكيد اكتساب طفرة ZAP70 (W163C) (انظر الخطوة 1.1.5.3).
ملاحظة: فئران الجيل F0 خيالية بسبب الانقسام الجيني السريع. قد تفتقر إلى الانتقال الجيني المستقر. تنفيذ التربية التسلسلية لإنشاء خطوط مستقرة.
- قم بإجراء تفاعل البوليميراز المتسلسل والتسلسل على فئران الجيل F0 لتأكيد اكتساب طفرة ZAP70 (W163C) (انظر الخطوة 1.1.5.3).
- اكتساب وتحديد النمط الجيني لفئران الجيل F1
- قم بتربية الفئران الإيجابية F0 مع الفئران من النوع البري C57BL / 6J للحصول على فئران من جيل F1 ، وإجراء التنميط الجيني عبر تفاعل البوليميراز المتسلسل والتسلسل للحصول على فئران SKG (خلفية C57BL / 6 ؛ انظر الخطوة 1.1.5.4).
- طرق التنميط الجيني المستندة إلى تفاعل البوليميراز المتسلسل لأجيال F0 و F1
- استقطاب قطعة 0.5 سم من الذيل بمقص معقم.
- استخرج الحمض النووي للفأر باستخدام مجموعة أدوات استخراج الحمض النووي الجيني للحيوانات.
- بالنسبة ل F0 ، قم بإعداد نظام تفاعل تفاعل البوليميراز المتسلسل التالي: 13.2 ميكرولتر من ddH2O ، 2 ميكرولتر من المخزن المؤقت PCR ، 2 ميكرولتر من 2.5 ملي مولار dNTP ، 0.5 ميكرولتر من كل من البادئات الأمامية (5'-GATGCCTAGGGGTGGGGTTCC-3') والعكسية (5'-ACTTGCCTACGCTACTGCTCTACA-3') (10 pmol / μL) ، 0.8 ميكرولتر من بوليميراز الحمض النووي ، و 1 ميكرولتر من الحمض النووي الجيني (50-100 نانوغرام / ميكرولتر) المستخرجة من ذيول الفأر ، لحجم تفاعل نهائي يبلغ 20 ميكرولتر. قم بإجراء تضخيم الجينات باستخدام برنامج PCR التالي: 94 درجة مئوية لمدة 3 دقائق ؛ 98 درجة مئوية لمدة 15 ثانية ، و 58 درجة مئوية لمدة 15 ثانية ، و 68 درجة مئوية لمدة دقيقة واحدة ، لمدة 35 دورة ؛ 68 درجة مئوية لمدة 5 دقائق ؛ استمر في 12 درجة مئوية.
- بالنسبة ل F1 ، قم بإعداد نظام تفاعل تفاعل البوليميراز المتسلسل التالي: 14.9 ميكرولتر من ddH2O ، 2 ميكرولتر من 10x Taq PCR buffer ، 1 ميكرولتر من 2.5 ملي مولار dNTP ، 0.5 ميكرولتر من كل من البادئات الأمامية (5'-GATGCCTAGGGGGGGTTCC-3') والعكسية (5'-ACTTGCCTACGCTACTGCTCTACA-3') (10 pmol / μL) ، 0.1 ميكرولتر من بوليميراز Taq DNA ، و 1 ميكرولتر من الحمض النووي الجيني (50-100 نانوغرام / ميكرولتر) المستخرجة من ذيول الفأر ، لحجم تفاعل نهائي يبلغ 20 ميكرولتر. قم بإجراء تضخيم الجينات باستخدام برنامج PCR التالي: 94 درجة مئوية لمدة 5 دقائق ؛ 94 درجة مئوية لمدة 30 ثانية ، 58 درجة مئوية لمدة 30 ثانية ، 72 درجة مئوية لمدة دقيقة واحدة ، تتكرر لمدة 35 دورة ؛ 72 درجة مئوية لمدة 5 دقائق ؛ استمر في 12 درجة مئوية.
- قم بتشغيل الرحلان الكهربائي لتأكيد المنتجات ذات الحجم المتوقع.
- تسلسل منتجات تفاعل البوليميراز المتسلسل للتحقق من كل من النمط الجيني والطفرة المحددة.
- استراتيجية تحرير الجينات
- اختيار الفئران المانحة والمتلقية
- اختر فئران SKG التي يبلغ عمرها 6-8 أسابيع (ذكر أو إناث) كفئران متبرعة.
- اختر الفئران C57BL / 6 التي يبلغ عمرها 6-8 أسابيع (يفضل أن تكون أنثى للحصول على نتائج تجريبية متسقة) كفئران متلقية.
- منزل الفئران C57BL / 6 و SKG (6-8 أسابيع) تحت ظروف SPF في أقفاص جيدة التهوية بشكل فردي. توفير الوصول المجاني إلى التغذية من الدرجة SPF والمياه المعقمة في دورة إضاءة / ظلام لمدة 12 ساعة. تأقلم الفئران لمدة أسبوع واحد قبل بدء التجارب.
2. عزل وتنقية الخلايا التائية CD4 + من فئران SKG
- قم بالقتل الرحيم لفئران SKG تحت غطاء تدفق رقائقي معقم باستخدام اختناق ثاني أكسيد الكربون2 . اغمر الفئران في 75٪ كحول لمدة 5 دقائق لتطهيرها. حدد موقع الطحال في تجويف البطن وكذلك الغدد الليمفاوية (الأربية والمأبضية) في المناطق الأربية والمأبضية. قم بتشريح الطحال والغدد الليمفاوية بعناية باستخدام ملقط ومقص معقم ونقلها على الفور إلى PBS المبردة مسبقا.
- ضع الطحال والغدد الليمفاوية في أطباق بتري منفصلة. اضغط على الأنسجة من خلال مصفاة خلية 70 ميكرومتر باستخدام مكبس حقنة معقمة ، وأضف تدريجيا 10-12 مل من PBS المبرد مسبقا لتشكيل تعليق خلوي موحد. قم بتمرير معلق الخلية من خلال نفس مصفاة الخلية 70 ميكرومتر إلى أنبوب طرد مركزي سعة 15 مل ، ثم جهاز الطرد المركزي عند 300 × جم لمدة 7 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية واحتفظ بحبيبات الخلية.
- قم بإجراء تلطيخ التريبان الأزرق لتقييم صلاحية الخلية. عد الخلايا وتأكد من أن قابلية البقاء ≥90٪.
- اضبط تركيز الخلية على 1 × 108 خلايا / مل باستخدام المخزن المؤقت المتوفر في مجموعة عزل الخلايا التائية CD4 + .
- انقل 100 ميكرولتر من معلق الخلية (107 خلايا) إلى أنبوب جديد. أضف 10 ميكرولتر من كوكتيل البيوتين والأجسام المضادة ، واخلطه جيدا ، واحتضنه على الثلج لمدة 15 دقيقة.
- أعد تعليق الخرزات عن طريق الدوامة بأقصى سرعة. أضف 10 ميكرولتر من معلق حبة Streptavidin ، واخلطه جيدا ، واحتضنه على الثلج لمدة 15 دقيقة.
- أضف 2.5 مل من المخزن المؤقت المتوفر في مجموعة عزل الخلايا التائية CD4 + وضع الأنبوب في المغناطيس لمدة 5 دقائق.
- اسكب السائل (الخلايا المستهدفة) بحذر من الأنبوب في أنبوب معقم جديد ، ثم جهاز الطرد المركزي عند 4 درجات مئوية ، 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية واحتفظ بحبيبات الخلية.
- أضف كمية كافية من محلول PBS المعقم لضبط تركيز الخلية إلى 2 × 106 خلايا / مل واحتفظ بالتعليق على الجليد لاستخدامه لاحقا.
- استخدم قياس التدفق الخلوي لتقييم نقاء الخلايا التي تم فرزها (الشكل التكميلي S1). احسب نقاء الخلية على النحو التالي: (عدد خلايا CD4 + T / إجمالي عدد الخلايا) × 100٪. تأكد من أن النقاء هو ≥90٪ 16.
3. النقل بالتبني لخلايا CD4 + T
- تخدير الفئران C57BL / 6 ب 2٪ -3٪ إيزوفلوران ، وتصل إلى عمق التخدير حيث تفقد الفئران كل حركتها ولكنها تحتفظ بالتنفس التلقائي الطبيعي.
- نظف الكانثوس الداخلي (زاوية العين) للفأر برفق بقطعة قطن معقمة لإزالة الإفرازات والشعر ، مما يؤدي إلى تعريض الوريد.
- شل حركة الماوس باليد. اسحب 200 ميكرولتر من معلق الخلايا التائية CD4 + (2 × 105-5 × 105 خلايا لكل ماوس) في حقنة سعة 1 مل. أدخل الإبرة بزاوية 10-15 درجة في الوريد الكانثال الداخلي ، مما يضمن وضعه بدقة. حقن تعليق الخلية ببطء وبشكل متساو على مدى 10-15 ثانية.
- بعد سحب الإبرة ، اضغط برفق على منطقة الكانتال الداخلية بقطعة قطن معقمة لمدة 3-5 ثوان لمنع النزيف.
- ضع الفأر في قفص هادئ وجاف ونظيف للمراقبة حتى يستعيد وعيه تماما ، مع تنفس مستقر وعدم وجود سلوك غير طبيعي (مثل الوخز أو الموت المفاجئ). انقل الماوس إلى قفص سكني قياسي بعد التأكد من حالة ما بعد الجراحة المستقرة.
ملاحظة: نظرا لأن الوريد الكانثال الداخلي صغير ، فإن التعامل اللطيف وسرعة التسريب المتحكم فيها أمران حاسمان لتجنب تمزق الوريد أو انسداد الخلايا الناجم عن السرعة المفرطة. - سجل تفاصيل التسريب وقم بتسمية الفئران النموذجية والمجموعة الضابطة (أربعة لكل مجموعة) لمنع الارتباك في التجارب اللاحقة. قم بإدارة خلايا CD4+ T لنمذجة الفئران ، واترك الفئران الضابطة دون علاج. تأكد من أن جميع الفئران هي فئران متلقية.
4. تحفيز وتحريض المانان
- إجراء تحريض المانان في اليوم 4 (72 ساعة بعد ضخ الخلايا التائية CD4 + ). تطبيق نفس شروط الحث على جميع الفئران التجريبية والفئران الضابطة.
- قم بوزن مسحوق المانان وقم بإذابه في PBS معقم بتركيز 100 مجم / مل.
- امسك الماوس بشكل صحيح لفضح بطنه. تطهير الجلد بالكحول بنسبة 75٪ وتحديد موقع الحقن (~ 1 سم على جانب خط الوسط البطني).
- امزج محلول المانان جيدا وارسم الحجم المناسب (20-30 مجم لكل فأر) في حقنة سعة 1 مل. أدخل الإبرة بزاوية 45 درجة في التجويف البريتوني وحقن المحلول ببطء لضمان التوزيع المتساوي. اسحب الإبرة ببطء واضغط برفق على موقع الحقن بقطعة قطن معقمة لبضع ثوان لمنع التسرب أو العدوى.
- ضع الماوس المحقون في قفص هادئ ونظيف ، وراقبه عن كثب لمدة 5-10 دقائق للتأكد من عدم وجود تسرب في موقع الحقن أو انتفاخ البطن أو التنفس غير الطبيعي.
- سجل تفاصيل الحقن لكل ماوس بالتفصيل.
5. القياسات
- ملاحظة النمط الظاهري السريري
- تسجيل أعراض التهاب المفاصل
- إجراء تقييمات مشتركة كل 3 أيام بعد تحريض المانان. افحص جميع المفاصل في الأطراف الأمامية والخلفية ، مع إيلاء اهتمام خاص لمفاصل الركبة والكاحل والمعصم والأصابع / إصبع القدم. قم بتسجيل شدة التهاب المفاصل باستخدام المعايير القياسية (الجدول 1) 17. سجل وقارن مجموع الدرجات في كل نقطة زمنية لتقييم تطور التهاب المفاصل.
- تسجيل أعراض التهاب المفاصل
- تسجيل السمات المرضية للأنسجة
- بعد شهر من تحريض المانان ، قم بالقتل الرحيم للفئران تحت غطاء تدفق رقائقي معقم باستخدام اختناق ثاني أكسيد الكربون2 (باتباع إرشادات اللجنة الأخلاقية) ، وقم بتأمين الفأر على لوح رغوي ، وفضح الأطراف الخلفية. شق الجلد بدءا من الكاحل وقشره لأعلى لكشف العضلات والمفاصل. تحديد مفصل الكاحل (بين الظنبوب / الشظية والكحل) ومفاصل مشط القدم (بين مشط القدم والكتائب القريبة) وتشريح هذه المفاصل للتحليل النسيجي وإعداد أقسام البارافين.
- قم بإصلاح الأنسجة المستأصلة في 4٪ فورمالين لمدة 72 ساعة ، ثم انقلها إلى 10٪ حمض الإيثيلين ديامين تترا أسيتيك (EDTA ، درجة الحموضة 7.4) لمدة 4 أسابيع من إزالة الكلس لضمان إزالة الكلس الكامل.
- بعد إزالة الكلس ، اغسل الأنسجة باستخدام PBS لإزالة أي مثبت متبقي ثم قم بتجفيف الأنسجة من خلال سلسلة إيثانول متدرجة (75٪ ، 80٪ ، 95٪ ، 100٪).
ملاحظة: يمكن أن يهيج الفورمالين العينين والجلد والجهاز التنفسي. يجب التعامل معها في غطاء الدخان. - قم بتضمين الأنسجة في البارافين باستخدام آلة تضمين البارافين. استخدم ميكروتوم لتقسيم الأنسجة المضمنة إلى شرائح بسمك 4 ميكرومتر. قم بتعويم الأقسام في حمام مائي 40 درجة مئوية يحتوي على ماء مقطر.
- نقل وجفف الأقسام. ضع الأقسام على شرائح زجاجية. جففها طوال الليل في درجة حرارة الغرفة (RT). قم بتخزين الشرائح في RT للتلطيخ.
- تلطيخ الهيماتوكسيلين والإيوسين (H & E)
- ضع الشرائح في فرن 60 درجة مئوية لمدة ساعتين لإزالة البارافين.
- في درجة حرارة الغرفة ، اغمر الشرائح في التسلسل التالي لمدة 5 دقائق لكل منها: الزيلين → الزيلين → 100٪ إيثانول → 100٪ إيثانول → 95٪ إيثانول → 80٪ إيثانول → 75٪ إيثانول. اشطفها بالماء المقطر لمدة 2 دقيقة.
- قم بتلطيخ الشرائح بالتتابع في محلول الهيماتوكسيلين لمدة 5 دقائق ، ثم اشطفها بالماء منزوع الأيونات لمدة دقيقتين ، ثم عالجها ب 0.1٪ أمونيا لمدة دقيقة واحدة ، اشطفها لمدة 3 × 2 دقيقة في الماء منزوع الأيونات ، وصمة عار باليوزين لمدة دقيقة واحدة ، وأخيرا اشطفها بالماء منزوع الأيونات لمدة دقيقتين.
- اغمر الشرائح لمدة 5 دقائق في 80٪ إيثانول → 95٪ إيثانول → 100٪ إيثانول → زيلين → زيلين.
- جفف الشرائح بالهواء بشكل طبيعي وقم بتثبيتها براتنج محايد.
- تلطيخ سافرانين أو فاست أخضر
- قم بإزالة البارافينات من أقسام البارافين إلى الماء وصخها باستخدام مجموعة بقع Van Gieson. قم بتركيب الشرائح براتنج محايد بعد تلطيخها والتقط الصور تحت المجهر (أعد في الخطوة 5.2.5).
- التغيرات في الخلايا التائية والسيتوكينات
- قم بإزالة الطحال من الفأر باستخدام أدوات جراحية معقمة.
- استخرج الحمض النووي الريبي الكلي من أنسجة الطحال باستخدام مجموعة استخراج الحمض النووي الريبي وفقا لتعليمات الشركة المصنعة. حدد تركيز الحمض النووي الريبي ونقاءه باستخدام مقياس الطيف الضوئي وتأكد من أن نسبة A260 / A280 تتراوح بين 1.8 و 2.0.
- قم بتصنيع (كدنا) من الحمض النووي الريبي المستخرج باستخدام مجموعة نسخ عكسي. اتبع بروتوكول الشركة المصنعة لإعداد التفاعل وظروف ركوب الدراجات. قم بتخزين (كدنا) عند -20 درجة مئوية لتحليل qPCR اللاحق.
- إجراء qPCR: قياس مستويات التعبير النسبية عن mRNA ل Tbx21 و Gata3 و Il-17 و Foxp3 في أنسجة الطحال باستخدام qPCR المستند إلى SYBR Green في تفاعلات 10 ميكرولتر تحتوي على: 5 ميكرولتر من 2x SYBR Green المزيج الرئيسي ، 0.2 ميكرولتر لكل من الاشعال الأمامية والعكسية (10 ميكرومتر ؛ التسلسلات في الجدول 2) ، 0.5-1 ميكرولتر (50-100 نانوغرام / ميكرولتر) ، والماء الخالي من النوكلياز إلى الحجم. استخدم ظروف التدوير الحراري التالية: التمسخ الأولي عند 95 درجة مئوية لمدة 30 ثانية ، متبوعا ب 40 دورة من 95 درجة مئوية لمدة 10 ثوان و 60 درجة مئوية لمدة 30 ثانية ، مع تحليل منحنى الذوبان (65-95 درجة مئوية). تطبيع مستويات التعبير إلى Gapdh باستخدام طريقة 2 (-ΔΔCt ).
- تحليل عزل المصل ومصفوفة حبة القياس الخلوي (CBA)
- اجمع الدم من الفأر باستخدام جمع الدم المداري بطريقة الاستئصال ، وانقل الدم إلى أنبوب تجميع مغلف بمضادات التخثر ، واتركه في درجة حرارة الغرفة لمدة 30 دقيقة. قم بالطرد المركزي للدم المتخثر عند 4 درجات مئوية ، 1,000 × جم لمدة 15 دقيقة ، واجمع المادة الطافية (المصل) بعناية ، وقم بتخزينها عند -80 درجة مئوية حتى التحليل.
- حدد مستويات التعبير عن IL-6 و IL-10 و IL-17 و TNF-α و IFN-γ في المصل باستخدام مجموعة CBA وفقا لتعليمات الشركة المصنعة.
- قم بإزالة الطحال من الفأر باستخدام أدوات جراحية معقمة.
النتائج
التصنيف السريري لتورم المفاصل ومعدل الإصابة في الفئران
يوضح الشكل 1 التصنيف السريري لتورم المفاصل ومعدل الإصابة في الفئران النموذجية. تشير النتائج إلى أن جميع الفئران في المجموعة النموذجية أصيبت بالمرض (ن = 4) ، بمعدل حدوث 100٪. زادت الدرجات في المجموعة النموذجية بشكل ملحوظ ، وأظهرت ارتياحا قصيرا في الأسبوع الثاني ، وارتفعت لاحقا على مدى 6 أسابيع.
مظهر تورم المفاصل في الفئران
تظهر مفاصل الفئران من المجموعة النموذجية سماكة وتورم كبيرين ، مع تورم وسماكة ملحوظ لوحظ أيضا في الأطراف الأمامية والخلفية (الشكل 2).
النتائج المرضية لمفاصل الكاحل الفأر
تشير النتائج المرضية إلى أنه بالمقارنة مع المجموعة الضابطة ، تظهر الفئران في المجموعة النموذجية سماكة كبيرة في الغشاء الزليلي في مفاصل الكاحل ، وانقطاعا في العظام ، وتجميعا ملحوظا للخلايا الالتهابية (الشكل 3 ، الشكل 4 ، والشكل 5).
العوامل الالتهابية المرتبطة بالخلايا التائية في الدم
بالمقارنة مع المجموعة الضابطة ، أظهرت الفئران في المجموعة النموذجية زيادات كبيرة في مستويات مصل IL-10 (7.51 مقابل 2.15 بيكوغرام / مل) ، TNF (78.83 مقابل 13.11 بيكوغرام / مل) ، IL-17 (101.6 مقابل 12.64 بيكوغرام / مل) ، و IFN-γ (5.15 مقابل 1.90 بيكوغرام / مل) (ص < 0.05). كما زاد IL-6 بشكل ملحوظ مقارنة بالمجموعة الضابطة (15.59 مقابل 6.27 بيكوغرام / مل) (ص = 0.05 ، الشكل 6).
التغييرات في المجموعات الفرعية للخلايا التائية Th1 / 2/17 و Tregs في الطحال
تم قياس مستويات تعبير الرنا المرسال ل Tbx21 (Th1) و Gata3 (Th2) و Il-17 (Th17) و Foxp3 (Tregs) لتقييم التغيرات في المجموعات الفرعية للخلايا التائية في الطحال. تقوم هذه الجينات بتشفير عوامل النسخ الرئيسية والسيتوكينات التي تحدد تمايز ووظيفة المجموعات الفرعية للخلايا التائية الخاصة بها. بالمقارنة مع المجموعة الضابطة ، أظهرت الفئران في المجموعة النموذجية زيادة ملحوظة في تعبير mRNA ل Tbx21 (1.68 مقابل 0.61) و Il-17 (26.30 مقابل 0.75) في الطحال (ص < 0.05) بالنسبة للجين المرجعي Gapdh.
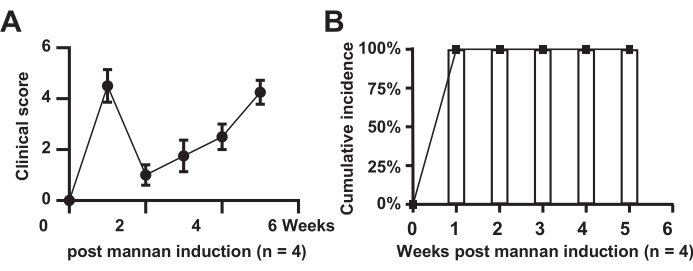
الشكل 1: التهديف السريري لتورم المفاصل. (أ) الفئران من المجموعة النموذجية؛ (ب) الوقوع التراكمي في الفئران المجموعة النموذجية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مظاهر تورم المفاصل في الفئران الضابطة والنموذجية (ن = 4). (A-C) صور تمثيلية لدرجات تورم المخلب والمفاصل (0،2،4) في مجموعات التحكم والنماذج للفئران. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
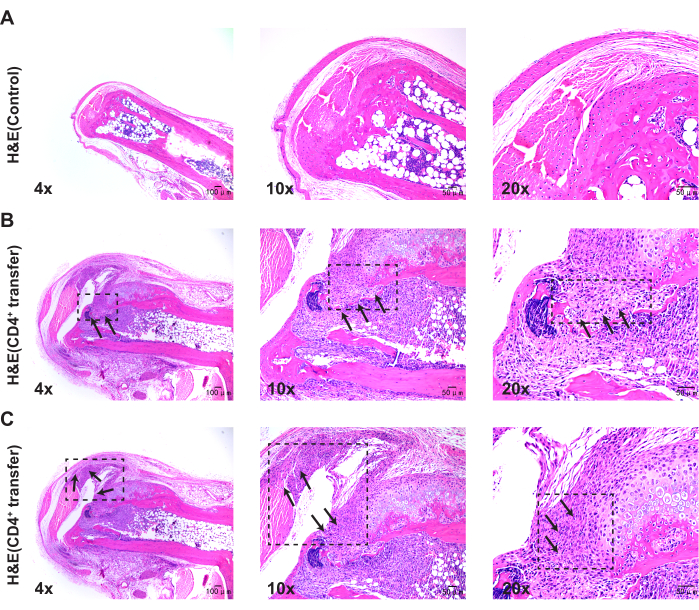
الشكل 3: التغيرات النسيجية في مفاصل الكاحل للفئران الضابطة والمجموعة النموذجية التي لوحظت مع تلطيخ الهيماتوكسيلين يوزين. (أ) التحكم في مفصل الكاحل للفأر. (ب) انقطاع في عظم مفصل كاحل الفأر للمجموعة النموذجية؛ (ج) التكاثر الزليلي في مفصل كاحل الفأر للمجموعة النموذجية. أشرطة المقياس = 50 ميكرومتر (العمود الأول) ، 100 ميكرومتر (العمودين الثاني والثالث). الصور في الشكل 3B و 3C مأخوذة من نفس الماوس ، مما يدل على أنماط ظاهرية مرضية مختلفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الاختلافات في السماكة الزليلية لمفاصل الكاحل بين المجموعة الضابطة وفئران المجموعة النموذجية (ص < 0.05). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
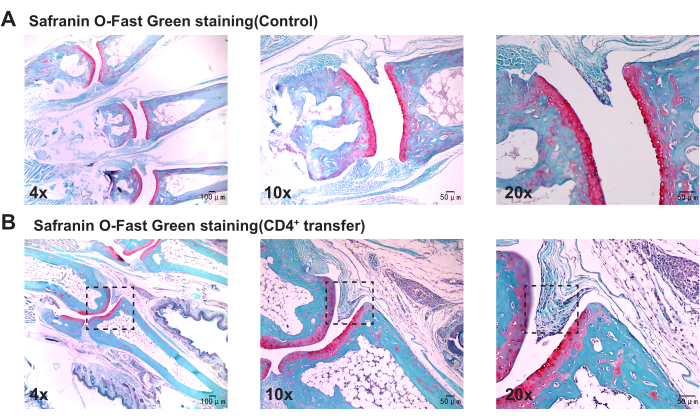
الشكل 5: التغيرات النسيجية في مفاصل الكاحل لفئران المجموعة الضابطة والنموذجية التي لوحظت مع تلطيخ Safranin O-Fast Green. (أ) مفصل الكاحل لفأر المجموعة الضابطة. (ب) التكاثر الزليلي في مفصل الكاحل لفأر المجموعة النموذجية. أشرطة المقياس = 50 ميكرومتر (العمود الأول) ، 100 ميكرومتر (العمودين الثاني والثالث). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: التغيرات في العوامل الالتهابية المرتبطة بالخلايا التائية والمجموعات الفرعية في الفئران الضابطة والمجموعة النموذجية. (أ) التعبير عن العوامل الالتهابية المرتبطة بالخلايا التائية في مصل الفئران الضابطة والمجموعة النموذجية و (ب) التغيرات في المجموعات الفرعية للخلايا التائية Th1 / 2/17 و Tregs في الطحال. * ص < 0.05 ، ** ص < 0.01. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نقاط | تورم (النطاق 0-4) | حمامي (النطاق 0-2) |
| 0 | اي | اي |
| 1 | أي رقم | طفيف |
| 2 | مخلب | متطرف |
| 3 | المعصم / الكاحل | |
| 4 | طرف كامل |
الجدول 1: معايير تسجيل التهاب المفاصل. لتسجيل التهاب المفاصل ، يتم تسجيل كل طرف وفقا للتورم والحمامي ، مع تخصيص درجة 0-6 لكل طرف. يتم جمع درجات جميع الأطراف الأربعة لتوليد إجمالي درجة التهاب المفاصل لكل فأر.
| تسلسل التمهيدي | |
| اسم أوليغو | التسلسل من 5 إلى 3 |
| Tbx21 إلى الأمام | AGCAAGGAGCGAATGTT |
| Tbx21-عكس | GGGTGGACATATAAGCGGTTC |
| جاتا 3 إلى الأمام | CTCGGCCATTCGTACATGGAA |
| جاتا 3 - عكس | GGATACCTCTGCACCGTAGC |
| Il-17A-إلى الأمام | TTTAACTCCCTTGGCGCAAAA |
| Il-17A-عكس | CTTTCCCTCCGCATTGACAC |
| Foxp3 إلى الأمام | CCCTTGACCTCAAACCAAG |
| Foxp3 - عكس | GTGTGACTGCATGACTAACTTTGA |
| جاب إلى الأمام | GGTTGTCTCCTGCGACTTCA |
| Gapdh-عكس | TGGTCCAGGGTTTCTTACTCC |
الجدول 2: قائمة تسلسل التمهيدي.
الشكل التكميلي S1: استراتيجية البوابات لفرز الخلايا التائية CD4 + عن طريق قياس التدفق الخلوي. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يرتبط تطور التهاب المفاصل الروماتويدي ارتباطا وثيقا بتسلل الخلايا المناعية غير الطبيعي في الأنسجة الزليلية ، حيث يؤدي التنشيط غير المنظم لهذه الخلايا المناعية إلى إطلاق العديد من السيتوكينات المؤيدة للالتهابات ، والتي تساهم بشكل أكبر في تلف الهياكل الزليلية والمفاصل18،19. تم تقييم العديد من نماذج RA على نطاق واسع ، بما في ذلك نموذج وكالة المخابرات المركزية ، ونموذج K / BxN ، وفئران SKG13،20،21. في حين أن هذه النماذج تكرر بنجاح الآليات المناعية والمظاهر السريرية لالتهاب المفاصل الروماتويدي ، إلا أن جميعها لها قيود كبيرة. على سبيل المثال ، يتمتع نموذج وكالة المخابرات المركزية في الفئران C57BL / 6 بمعدل نجاح أقل ، وفترة ظهور أطول ، ويتأثر بشكل كبير بالظروف البيئية والتجريبية ، مما يجعله أقل عملية في بعض الإعدادات التجريبية. تمثل الفئران SKG نموذجا للفأر RA يعتمد على طفرة جينية ZAP-70 ، والتي تسبب شذوذا مفاجئا في إشارات مستقبلات الخلايا التائية (TCR) وتحفز التهاب المفاصل المناعيالذاتي 22. ومع ذلك ، فإن هذا النموذج مكلف ، وتتأثر قابلية تكرار النتائج التجريبية بسهولة بظروف الحث. K / BxN هو نموذج التهاب المفاصل الوراثي الناجم عن النشاط التعاوني للخلايا التائية والبائية ، مما يظهر استجابة مناعية واضحة23. ومع ذلك ، فإن بناء هذا النموذج مكلف ، وخصوصيته مقيدة ، مما يؤدي إلى استجابة مناعية محدودة لا يمكنها التقاط العملية المرضية متعددة الأوجه لالتهاب المفاصل الروماتويدي البشري بالكامل. لذلك ، من الأهمية بمكان تطوير نموذج حيواني يمكنه تكرار السمات المرضية الرئيسية لالتهاب المفاصل الروماتويدي ، وتلبية المتطلبات التجريبية المختلفة ، وضمان قابلية عالية للتكاثر.
في هذه الدراسة ، نقدم طريقة لإنشاء نموذج RA من خلال النقل المعتمد لخلايا CD4 + T التكيفية من فئران SKG. يعتمد بناء هذا النموذج على اختيار خلايا CD4 + T من فئران SKG ذات خلفية C57 / BL6 وتحريض مانان ، وهي عملية تضمن نجاح النموذج. من المعروف على نطاق واسع أن فئران SKG على خلفية BALB / c تحمل طفرة جينية تلقائية ZAP70 (W163C) ، مما يتسبب في اختيار إشارات TCR غير طبيعي ، مما يؤدي إلى خلايا تائية شديدة التفاعلذاتيا 24. ينتج عن هذا التنشيط المفرط للخلايا التائية وظهور التهاب الغشاء المفصلي وتدمير المفاصل ، وبالتالي محاكاة العمليات المرضية الرئيسية لالتهاب المفاصل الروماتويدي مثل الإصلاح الزليلي وتنشيط الخلايا المناعية25،26. تشبه السمات السريرية لفئران SKG إلى حد كبير تلك الخاصة بمرضى التهاب المفاصل الروماتويدي البشري.
لإدخال هذه الطفرة في خلفية C57BL / 6 ، استخدمنا تقنية CRISPR / Cas9 لإنشاء نموذج ماوس Skg بخلفية C57BL / 6 بنجاح يحمل طفرة ZAP70 (W163C). يوفر CRISPR / Cas9 دقة وكفاءة عالية ، مما يتيح الإدخال المستهدف للطفرة المطلوبة مع الحفاظ على معدل منخفض من الإدراج خارج الهدف أو التعديلات الجينية غير المرغوب فيها المرتبطة بطرق الحث العشوائي التقليدية ، وبالتالي ضمان استقرار النموذج وتفرده27،28. والأهم من ذلك ، أن هذه التقنية تقلل أيضا بشكل كبير من الوقت اللازم لبناء النموذج ، مما يعزز كل من إمكانية التحكم وكفاءة تطوير النموذج. باستخدام هذا النموذج ، يمكننا تكرار التهاب الغشاء المفصلي بوساطة الخلايا التائية وتدمير المفاصل لالتهاب المفاصل الروماتويدي بدقة على خلفية C57BL / 6. بالمقارنة مع خلفية BALB / C في فئران SKG التقليدية ، فإن الفئران النموذجية على خلفية C57BL / 6 لها قابلية تطبيق أوسع في البحوث المناعية ويمكن دمجها بسهولة أكبر مع النماذج المعدلة وراثيا الأخرى (على سبيل المثال ، Rag1 - / - أو IL17 - /-). هذا يجعلها مناسبة للتحقيق في دور طفرة ZAP70 في التهاب المفاصل الروماتويدي وأمراض المناعة الذاتية الأخرى مثل الذئبة الحمامية الجهازية أو التصلب المتعدد.
بناء على الدور المحوري29,30 لخلايا CD4 + T في تنشيط RA ، اخترناها كوسطاء رئيسيين. الخلايا التائية هي الدوافع الأساسية للاستجابات المناعية في التهاب المفاصل الروماتويدي ويمكن أن تسبب الضرر الزليلي بشكل مباشر عن طريق تنشيط المجموعات الفرعية المستجيب Th1 / Th1731 ، اعتمادا على العوامل الالتهابية مثل IL-6 و IL-17 و TNF-α32،33. كوسطاء محوريين لتنظيم المناعة ، تفرز خلايا CD4 + T السيتوكينات المؤيدة للالتهابات ، مما يؤدي إلى الشلال الالتهابي ويحافظ عليه ، مما يؤدي إلى التكاثر الزليلي وتلف المفاصل ، وبالتالي يعزز بشكل مباشر التقدم المرضي لالتهاب المفاصل الروماتويدي. إنها مفيدة في مساعدة الخلايا البائية في إنتاج أجسام مضادة محددة (على سبيل المثال ، ACPA) 34. وفي الوقت نفسه ، فإن السمة النسيجية المرضية النموذجية لغشاء روماتويا الروماتويدي هي تجميع الخلايا التائية CD4 +. تعتبر بعض جينات مركب التوافق النسيجي الرئيسي من الفئة الثانية (MHC) ، وخاصة "الحلقات المشتركة" المتعلقة بالنمط المنظور لمستضد الكريات البيض البشرية (HLA-DR) ، مرتبطة ارتباطا وثيقا بالتسبب في RA35. علاوة على ذلك ، أظهرت استراتيجية منع التحفيز المشترك للخلايا التائية مع المستضد 4 المرتبط بالخلايا الليمفاوية التائية السام للخلايا (CTLA4) -Ig فعالية سريرية كبيرة في RA36. بالإضافة إلى ذلك ، يعمل تحريض المانان كمنشط قوي للنموذج ، مما يعزز تنشيط المكونات المناعية الفطرية مثل الخلايا المتغصنة والضامة37. تسهل هذه الخطوة أيضا تنشيط الخلايا التائية CD4 + والاستجابات المناعية ، مما يزيد بشكل كبير من هجوم الجهاز المناعي على الأنسجة الذاتية ، وبالتالي محاكاة السمات المرضية لخلل التنظيم المناعي والضرر الزليلي في التهاب المفاصل الروماتويدي.
بعد الانتهاء من تحريض النموذج ، أجرينا تحققا منهجيا لمجموعة النموذج باستخدام معلمات متعددة ، بما في ذلك التسجيل السريري لتورم المفاصل ، والتحقق المرضي (مراقبة أمراض أنسجة التهاب الغشاء المفصلي وخصائص تدمير المفاصل) ، والتحقق المناعي (التعبير عن خلايا Th1 / 2/17 و Treg في المصل والطحال). أظهرت النتائج أن نموذجنا نجح في تكرار التهاب الغشاء المفصلي بوساطة الخلايا التائية وتدمير المفاصل في التهاب المفاصل الروماتويدي ، مما أدى إلى تنشيط المناعة المميز والتغيرات المرضية الزليلية المتوافقة مع الآليات الفيزيولوجية المرضية الرئيسية لالتهاب المفاصل الروماتويدي ، بمعدل انتشار 100٪. من الجدير بالذكر أنه في نموذجنا ، تظهر درجة المفصل المتورم السريري للفئران في أسبوع واحد انخفاضا ملحوظا في الأسبوع الثاني ، ثم ترتفع تدريجيا مرة أخرى في مراحل لاحقة ، وهو ما لا يتماشى تماما مع المسار النموذجي للمرض الذي لوحظ في النماذج الحيوانية التقليدية لالتهاب المفاصل38. قد يكون هذا بسبب أنه في أسبوع واحد بعد التحريض ، يكون الجهاز المناعي في الفئران النموذجية في مرحلة أولية منشطة بشكل مكثف عن طريق حقن مانان ، مما يؤدي إلى ذروة التهاب المفاصل. في الأسبوع الثاني ، يؤدي التنظيم المناعي وآليات التعافي الذاتي إلى تخفيف مؤقت للأعراض السريرية. مع تقدم المرض ، يتضاءل التحمل المناعي تدريجيا ، ويتم إعادة تكثيف الاستجابة المناعية ، ويتجلى ذلك في التدهور التدريجي للحالة في مراحل لاحقة.
على الرغم من أن هذا النموذج بسيط نسبيا مقارنة بالنماذج الأخرى ، إلا أنه لا تزال هناك العديد من النقاط الرئيسية التي يجب معالجتها أثناء عملية النمذجة. أولا ، يشكل نشاط ونقاء خلايا CD4 + T من فئران SKG الأساس لنجاح النموذج. يجب أن يتجاوز نقاء الخلايا 90٪ لضمان اتساق وموثوقية النتائج التجريبية. ثانيا ، يجب التحكم بعناية في سرعة الحقن في الوريد الكاثال الإنسي لتجنب تمزق الوريد من الحقن بسرعة كبيرة أو تسرب الخلية من الحقن ببطء شديد. علاوة على ذلك ، فإن اختيار جرعة الخلية أمر بالغ الأهمية. قد تؤدي الجرعة المنخفضة جدا إلى فشل النموذج ، في حين أن الجرعة العالية جدا يمكن أن تؤدي إلى استجابات التهابية غير محددة. لذلك ، أثناء عملية النمذجة ، يجب مراقبة الحالة العامة للفئران عن كثب ، ويجب تسجيل أي أعراض غير طبيعية على الفور لضمان التقدم السلس للتجربة والصلاحية العلمية للبيانات.
بالمقارنة مع النماذج التقليدية ، فإن هذا النموذج له فترة إنشاء أقصر ، ويحقق معدل حدوث أعلى في الفئران C57BL / 6 ، ويظل فعالا من حيث التكلفة نسبيا وسهل التشغيل. يؤدي اعتماد نقل خلايا CD4 + T ذاتية التفاعل إلى إعادة إنتاج الاستجابات المناعية بوساطة الخلايا التائية بدقة ويلتقط السمات المرضية الرئيسية لالتهاب المفاصل الروماتويدي ، مثل تورم المفاصل وتلفها. علاوة على ذلك ، تتوافق مظاهره السريرية بشكل جيد مع تلك الموجودة في التهاب المفاصل الروماتويدي البشري ، مما يوفر انعكاسا أكثر أصالة للعمليات السريرية والمرضية لالتهاب المفاصل الروماتويدي. علاوة على ذلك ، فإن الجمع بين تسريب الوريد الكاثال الإنسي وتحريض المانان يحسن من إمكانية التحكم في النموذج واستقراره التجريبي ، مما يجعله قابلا للتكرار بدرجة كبيرة ويوفر تحكما تجريبيا ممتازا. بالطبع ، لا يزال هذا النموذج له قيود. يركز بشكل أساسي على الاستجابات المناعية التي تحركها الخلايا التائية. إن محاكاة الأدوار التعاونية لاستجابات الأجسام المضادة بوساطة الخلايا البائية والخلايا المناعية الأخرى (مثل الخلايا القاتلة الطبيعية (NK) وخلايا Treg) غير كافية ، مما يجعل من الصعب تمثيل الآليات المرضية متعددة الخلايا لالتهاب المفاصل الروماتويدي بشكل كامل. ومع ذلك ، يظل نموذج فأر RA هذا نموذجا حيوانيا مستقرا وموثوقا به ، مما يوفر للباحثين منصة أفضل لمحاكاة الاستجابات المناعية بوساطة الخلايا التائية والسمات المرضية الرئيسية لالتهاب المفاصل الروماتويدي. يسمح هذا النموذج للباحثين بالتعمق في آليات المناعة والتقدم المرضي لالتهاب المفاصل الروماتويدي ، مما يوفر أدلة وأدوات تجريبية مهمة لتطوير علاجات جديدة ، لا سيما في فهم خلل التنظيم المناعي الذي يحركه الخلايا التائية وتحديد الأهداف العلاجية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من خلال منح من المؤسسة الوطنية للعلوم الطبيعية في الصين (82270903 و 82401588 و 81974254) ومؤسسة علوم ما بعد الدكتوراه الصينية (2024M751019).
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Yeasen | 10208ES60 | Preparing agarose gel for use in DNA electrophoresis experiments |
| Anhydrous ethanol | Shanghai HuShi Laboratory Instruments Co., Ltd. | 100009218 | Dehydrating and fixative agent |
| ZAP 70 primers | Tsingke | Primers used for detecting ZAP70 gene expression, commonly used in PCR experiments for genotyping mice | |
| 0.5 M EDTA solution (pH = 7.4) | Biosharp | R00521 | Used for decalcification to ensure the quality of tissue sections and staining for calcium-containing tissues, while maintaining the structural integrity of the tissue |
| 1.5 mL enzyme-free ep tubes | LABSELECT | MCT-001-150-S | Used for a variety of experiments such as sample storage, centrifugal separation, etc |
| 2x Q3 SYBR qPCR Master Mix (Universal) | ToloBio | 22204 | Used for performing highly specific and highly sensitive qPCR reactions. |
| 2x Magic Green Taq SuperMix | TOLOBIO | 21502-04 | Buffer solution for pre-electrophoresis |
| 4% Formaldehyde (paraformaldehyde) solution | Biosharp | BL539A | Used as a fixative to preserve tissue structure and cellular morphology, providing stable and well-preserved samples for subsequent staining steps |
| Animal tissue/cell total RNA isolation kit | Servicebio | MPC2409122 | Extraction of total RNA from animal tissues/cells |
| BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit | BD Biosciences | 560485 | Measure the expression of Th1/2/17 cytokines in mouse serum. |
| Cell Culture dish | LABSELECT | 12211 | A container for cell fluid from the spleen and lymph nodes |
| Dimethylbenzene | China National Pharmaceutical Group Chemical Reagents Co., Ltd. | 10023418 | Used as a deparaffinizing and clearing agent |
| Easyfive six-port cell counting chamber | CytoEasy | N3EF110 | Used for cell counting |
| Enhanced Safranin O-Fast Green staining solution for cartilage. | Solarbio | G1371 | Stain cartilage and bone tissues to observe pathological changes in the joint area. |
| Glass slide | CITOTEST | 188105 | Basic support for tissue slicing |
| Hematoxylin staining solution | Servicebio | G1005-1 | Dying |
| Hematoxylin staining solution | Servicebio | G1001 | Dying |
| Low-speed refrigerated centrifuge | Cence | F14300021010004 | It is used for centrifugation and precipitation |
| Mannan | Sigma | m7504 | Activator for the model.Dissolve in sterile PBS at 2 mg/mL, mix thoroughly, and filter through a 0.22 μm membrane to eliminate any particles or possible sources of contamination. |
| MojoSort Magnet | Biolengend | 480019 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice |
| MojoSort Mouse CD4 T Cell Isolation Kit | Biolengend | 480033 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice . Use a negative selection method that directly binds to the CD4 molecule to isolate CD4+ T cells, preserving the integrity of surface antigens without affecting CD4 molecule functionality, making it suitable for CD4+ T cell infusion experiments. |
| Nano-300 | ALLSHENG | AS-11020-00 | Accurate detection of nucleic acids, proteins, and cellular solutions |
| Neutral resin mounting agent | Biosharp | BL704A | Fix and preserve stained tissue sections |
| Paraffin microtome | KEDEE | KD-3389 | Used for paraffin sections |
| Phosphate-buffered saline (PBS) | Pricella | WHB824P281 | Used as a buffer solvent or cleaning agent, |
| Sterile cell filter (70 µm) | Biosharp | BS-70-CS | Remove large impurities or aggregated cell clusters from the cell suspension to ensure sample purity and cell uniformity |
| Sterile syringe (1 mL) | Lingyang Medical Apparatus | 20241020 | Injection into the inner canthal vein |
| Tabletop high-speed microrefrigerated centrifuge | SCILOGEX | S1010E | Used for centrifugation and precipitation |
| TEA Buffer (50x) | Yeasen | 60116ES76 | Stabilizes pH, helps protect and preserve molecules like DNA and RNA, used in electrophoresis experiments |
| ToloScript All-in-one RT EasyMix for qPCR | ToloBio | 22107 | Used to convert RNA templates into cDNA, facilitating subsequent gene expression analysis, qPCR, and other molecular biology experiments. |
| Transefer Pipettes | BIOFIL | 240515-133-A | Used for transferring solutions |
| Trypan blue dye solution | Biosharp | 7009529 | Commonly used for cell viability assays, helps differentiate live cells from dead cells |
References
- Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: A systematic analysis of the global burden of disease study. Lancet Rheumatol. 5 (10), e594-e610 (2021).
- Radu, A. F., Bungau, S. G. Management of rheumatoid arthritis: An overview. Cells. 10 (11), 2857(2021).
- Di Matteo, A., Bathon, J. M., Emery, P. Rheumatoid arthritis. Lancet. 402 (10416), 2019-2033 (2023).
- Bernard, L., et al. Management of patients with rheumatoid arthritis by telemedicine: Connected monitoring. A randomized controlled trial. Joint Bone Spine. 89 (5), 105368(2022).
- Jang, S., Kwon, E. J., Lee, J. J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells. Int J Mol Sci. 23 (2), 905(2022).
- Daikh, D. I. Rheumatoid arthritis: Evolving recognition of a common disease. Best Pract Res Clin Rheumatol. 36 (1), 101740(2022).
- Bhamidipati, K., Wei, K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 36 (1), 101742(2022).
- Meyer, A., Parmar, P. J., Shahrara, S. Significance of IL-7 and IL-7R in RA and autoimmunity. Autoimmun Rev. 21 (7), 103120(2022).
- Yu, X., et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRS ligands on human fibroblast-like synoviocytes-a potential immunopathological mechanism for joint inflammation in rheumatoid arthritis. Int Immunopharmacol. 82, 106356(2020).
- Wu, X., et al. Single-cell sequencing of immune cells from anticitrullinated peptide antibody positive and negative rheumatoid arthritis. Nat Commun. 12 (1), 4977(2021).
- Wei, X., Niu, X. T follicular helper cells in autoimmune diseases. J Autoimmun. 134, 102976(2023).
- Mcelwee, M. K., Dileepan, T., Mahmud, S. A., Jenkins, M. K. The CD4+ T cell repertoire specific for citrullinated peptides shows evidence of immune tolerance. J Exp Med. 220 (12), e20230209(2023).
- Ahmed, S., et al. Dual inhibition of glycolysis and glutaminolysis for synergistic therapy of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 176(2023).
- Wu, J., et al. Tnf antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models. Nat Commun. 13 (1), 676(2022).
- Huo, F., Hou, J., Zhu, Y., Feng, Z. ferroptosis inducer ike ameliorate pulmonary fibrosis in collagen-induced arthritis (CIA) mice via decreasing the expression of IL-6, CCL5 and CXCL9. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 40 (2), 114-120 (2024).
- Sun, H., et al. ID2 exacerbates the development of rheumatoid arthritis by increasing IFN-γ production in CD4+ T cells. Clin Transl Med. 15 (3), e70242(2025).
- Murayama, M. A., et al. CTRP6 is an endogenous complement regulator that can effectively treat induced arthritis. Nat Commun. 6, 8483(2015).
- Kadura, S., Raghu, G. Rheumatoid arthritis-interstitial lung disease: Manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 30 (160), 210011(2021).
- Mueller, A. L., et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies. Cells. 10 (11), 3017(2021).
- Sun, H., et al. Gut commensal parabacteroides distasonis alleviates inflammatory arthritis. Gut. 72 (9), 1664-1677 (2023).
- Li, Z. Y., Zhou, J. J., Luo, C. L., Zhang, L. M. Activation of tgr5 alleviates inflammation in rheumatoid arthritis peripheral blood mononuclear cells and in mice with collagen II-induced arthritis. Mol Med Rep. 20 (5), 4540-4550 (2019).
- Mccarthy, E. E., et al. Endogenous antigens shape the transcriptome and TCR repertoire in an autoimmune arthritis model. J Clin Invest. 135 (2), e174647(2024).
- Chen, J., et al. Annexin A1 attenuates cardiac diastolic dysfunction in mice with inflammatory arthritis. Proc Natl Acad Sci U S A. 118 (38), e2020385118(2021).
- Owada, T., et al. LAT1-specific inhibitor ameliorates severe autoimmune arthritis in skg mouse. Int Immunopharmacol. 109, 108817(2022).
- Zhang, A., et al. Nrf2 activation improves experimental rheumatoid arthritis. Free Radic Biol Med. 207, 279-295 (2023).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- Van Hees, M., et al. New approaches to moderate CRISPR-Cas9 activity: Addressing issues of cellular uptake and endosomal escape. Mol Ther. 30 (1), 32-46 (2022).
- Tyumentseva, M., Tyumentsev, A., Akimkin, V. CRISPR/Cas9 landscape: Current state and future perspectives. Int J Mol Sci. 24 (22), 16077(2023).
- Wu, F., et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol. 12, 750753(2021).
- Dunlap, G., et al. Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium. Nat Commun. 15 (1), 4991(2024).
- Okamoto, K., Takayanagi, H. Effect of T cells on. Bone. 168, 116675(2023).
- Wang, X. Q., et al. Dopamine D2 receptor on CD4+ T cells is protective against inflammatory responses and signs in a mouse model of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 87(2023).
- Wang, X. Q., Liu, Y., Cai, H. H., Peng, Y. P., Qiu, Y. H. Expression of tyrosine hydroxylase inCD4+ T cells contributes to alleviation of Th17/Treg imbalance in collagen-induced arthritis. Exp Biol Med (Maywood). 241 (18), 2094-2103 (2016).
- Anaparti, V., et al. Increased frequency of TIGIT+ CD4 T cell subset in autoantibody-positive first-degree relatives of patients with rheumatoid arthritis. Front Immunol. 13, 932627(2022).
- Lei, Y., et al. Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis. Nat Commun. 15 (1), 113(2024).
- Jinno, S., et al. Comparison of retention of biologics in Japanese patients with elderly-onset rheumatoid arthritis-the answer cohort study. Rheumatology (Oxford). 64 (2), 509-516 (2025).
- Hagert, C., et al. Rapid spread of mannan to the immune system, skin and joints within 6 hours after local exposure. Clin Exp Immunol. 196 (3), 383-391 (2019).
- Cheng, W. J., et al. Deer velvet antler extracts exert anti-inflammatory and anti-arthritic effects on human rheumatoid arthritis fibroblast-like synoviocytes and distinct mouse arthritis. Am J Chin Med. 50 (6), 1617-1643 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved