Method Article
Ein adoptives Transfermodell der rheumatoiden Arthritis bei Mäusen
In diesem Artikel
Zusammenfassung
Hier berichten wir über ein Protokoll, das ein Mausmodell für rheumatoide Arthritis (RA) durch adoptiven Transfer von CD4+ T-Zellen von SKG-Mäusen etabliert und ein schnelles und zuverlässiges experimentelles Werkzeug zur Untersuchung der immunologischen Mechanismen, des pathologischen Fortschreitens und der Entwicklung neuer Therapien für RA bietet.
Zusammenfassung
Rheumatoide Arthritis (RA) ist eine chronische, systemische Autoimmunerkrankung, die zu Gelenkschäden, Deformitäten, Behinderungen und sogar zum Tod führen kann. Aufgrund der komplexen Ätiologie und des heterogenen klinischen Erscheinungsbildes sind die derzeitigen Behandlungsstrategien nach wie vor unzureichend, um das Fortschreiten der Erkrankung wirksam zu kontrollieren, insbesondere bei der Früherkennung und der Bereitstellung personalisierter Therapien. Daher ist die Entwicklung neuartiger Therapieansätze von entscheidender Bedeutung. Um dies zu erreichen, sind zuverlässige Tiermodelle unerlässlich, um die Pathogenese der RA zu untersuchen. Derzeit werden mehrere Tiermodelle der RA verwendet, darunter das Kollagen-induzierte Arthritis-Modell (CIA), das K/BxN-Modell und die SKG-Maus. Obwohl diese Modelle die Immunmechanismen und klinischen Manifestationen der RA erfolgreich nachahmen können, weisen sie jeweils bemerkenswerte Einschränkungen auf.
In diesem Protokoll beschreiben wir den Prozess der Etablierung eines RA-Mausmodells durch den adoptiven Transfer von CD4+ T-Zellen aus SKG-Mäusen. Im Vergleich zu herkömmlichen Modellen bietet dieses Modell eine kürzere Etablierungszeit und eine höhere Inzidenzrate (100%) bei C57BL/6-Mäusen. Es ist relativ kostengünstig, erfordert unkomplizierte Verfahren und repliziert zuverlässig T-Zell-vermittelte Immunantworten, wodurch eine überlegene experimentelle Kontrolle und Reproduzierbarkeit gewährleistet wird. Wir führten eine umfassende Evaluierung des Modells durch und bewerteten den klinischen Phänotyp, wie z. B. Gelenksymptome. Bei der klinischen Phänotyp-Beurteilung beobachteten wir signifikante Gelenkschwellungen und Entzündungsreaktionen. Darüber hinaus fanden wir unter Verwendung der PCR-Technologie zur Messung der Expressionsniveaus wichtiger Transkriptionsfaktoren heraus, dass dieses Modell die T-Zell-vermittelte Immunantwort und wichtige pathologische Merkmale der RA effektiv simuliert. Mit diesem Modell können Forscher die T-Zell-vermittelte Immunantwort und wichtige pathologische Merkmale der RA besser simulieren und bieten so ein zuverlässiges und effektives experimentelles Werkzeug für die Untersuchung von Immunmechanismen und pathologischem Verlauf sowie die Entwicklung neuartiger Therapien für RA.
Einleitung
RA ist eine chronische, systemische autoimmune Entzündungserkrankung, von der etwa 1 % der Weltbevölkerung betroffen ist und die eine hohe Morbidität und eine hohe sozioökonomische Belastung verursacht 1,2. Die Krankheit ist gekennzeichnet durch anhaltende Synovialentzündungen, Knorpelzerstörung und Knochenerosion, die letztendlich zu Gelenkdeformitäten, Behinderungen und in schweren Fällen zum vorzeitigen Tod führen 3,4,5. Die Pathogenese der RA beinhaltet das Zusammenspiel von genetischen, Umwelt- und Immunfaktoren, wobei zu den wichtigsten Merkmalen eine abnormale Aktivierung der zellulären Immunität, eine übermäßige Freisetzung von proinflammatorischen Zytokinen und eine Störung der Immuntoleranz gehören 6,7. In diesem Prozess fördern autoreaktive T-Zellen, insbesondere CD4+ T-Zellen, als Schlüsselfaktoren der Immunregulation, das pathologische Fortschreiten der RA durch mehrere Mechanismen direkt.
T-Helferzellen (Th)1-Zellen produzieren Interferon-gamma (IFN-γ), das Makrophagen und Synovialfibroblasten aktiviert, was zur Freisetzung von Tumornekrosefaktor (TNF)-α und Interleukin (IL)-6 führt und Synovitis verursacht. Th17-Zellen sezernieren IL-17, das die Aktivierung von Synovialzellen und Osteoklasten fördert und die Knorpelzerstörung und Knochenerosion verschlimmert 8,9. Darüber hinaus verstärken CD4+ T-Zellen Entzündungsreaktionen, indem sie B-Zellen durch co-stimulatorische Signale aktivieren und die Produktion von anti-citrullinierten Protein-Antikörpern (ACPA) und Rheumafaktoren (RF) induzieren10. In der Zwischenzeit sind Funktionsstörungen und eine Verringerung der Anzahl von Treg-Zellen die Hauptgründe für ein Immunungleichgewicht bei RA, das zu einer unkontrollierten Entzündung führt11,12. Aufgrund der komplexen Ätiologie und des heterogenen klinischen Erscheinungsbildes ist eine frühzeitige Diagnose schwierig und die derzeitige Behandlung der RA unbefriedigend. Daher ist die Entwicklung neuartiger Therapieansätze von entscheidender Bedeutung. Zuverlässige Tiermodelle sind entscheidend für die Untersuchung der Pathogenese von RA, um ein tieferes Verständnis der potenziellen Mechanismen von RA zu erlangen und neue Behandlungsstrategien zu erforschen.
Traditionelle RA-Modelle, wie die CIA- und K/BxN-Mausmodelle 13,14,15, tragen dazu bei, unser Verständnis von RA zu verbessern. Diese Modelle weisen jedoch erhebliche Einschränkungen auf. Zum Beispiel hat das CIA-Modell in C57BL/6-Mäusen eine niedrige Erfolgsrate und eine lange Induktionszeit, was seinen Nutzen in bestimmten experimentellen Umgebungen verringert. Auch wenn das K/BxN-Modell wertvoll ist, ist es kostspielig zu etablieren und weist Einschränkungen bei der Replikation der komplexen Pathologie der menschlichen RA auf, insbesondere der Wechselwirkungen zwischen Immunzellen und Zytokinen.
Um diese Einschränkungen zu beheben, haben wir ein neuartiges RA-Mausmodell entwickelt, indem wir CD4+ T-Zellen von SKG-Mäusen mit einem C57BL/6-Hintergrund in immunkompetente C57BL/6-Mäuse übertragen haben, in Kombination mit einer Mannan-induzierten Immunaktivierung. Dieses Modell repliziert effektiv die Schlüsselmerkmale der RA, einschließlich T-Zell-vermittelter Immunantworten und wesentlicher pathologischer Merkmale wie Synovialentzündung und Gelenkerosion, und bietet gleichzeitig Vorteile in Bezug auf Reproduzierbarkeit, Einfachheit und Kosteneffizienz. Wir haben eine detaillierte Methodik zur Etablierung dieses Modells skizziert, die die Erzeugung von SKG-Mäusen auf dem C57BL/6-Hintergrund, die Isolierung von CD4+ T-Zellen aus SKG-Mäusen, ihren adoptiven Transfer und die anschließende Induktion durch Mannan umfasst. Darüber hinaus beschreiben wir die klinischen und histologischen Kriterien, die zur Beurteilung des Schweregrads der Arthritis herangezogen werden, um ihre Zuverlässigkeit und Reproduzierbarkeit zu gewährleisten. Durch die konsequente Nachahmung von T-Zell-vermittelten Immunantworten und den grundlegenden pathologischen Merkmalen der RA dient dieses Modell als robustes und effizientes experimentelles Werkzeug zur Untersuchung der Immunmechanismen, des Krankheitsverlaufs und der Entwicklung neuer Therapien für RA.
Protokoll
Alle experimentellen Verfahren in dieser Studie folgten strikt den Richtlinien des "National Institutes of Health Guide for the Care and Use of Laboratory Animals", einschließlich Tierhaltung, Versuchsbetrieb und Euthanasie, und wurden von der Tierethikkommission des Tongji Medical College der Huazhong University of Science and Technology genehmigt.
1. Tiere
- Generierung von SKG-Mäusen (C57BL/6 Hintergrund)
- Strategie der Gen-Editierung
- Entwicklung einer spezifischen Guide-RNA (gRNA), die auf das ZAP70-Gen abzielt (gRNA-Sequenz: 5'-CAGCCCACGAGCGAATGCCCTGG-3') und Durchführung einer Geneditierung mit dem CRISPR/Cas9-System. Entwerfen Sie eine Spender-DNA mit der ZAP70(W163C)-Mutation, um eine präzise Inkorporation-n der Mutation zu gewährleisten (hier CAGGCCCCACAGGTGGAGAAGCTCATTG
CTACCACAGCCCACGAGCGAATGCCCTG
CTATCACAGCAGCCTGACTCGTGAGGAG
GCCGAGCGCAAACTCTATTCCGGCCA).
HINWEIS: Die gRNA leitet das Cas9-Protein an die spezifische Stelle des ZAP70-Gens , um ein präzises Schneiden zu ermöglichen. Die unterstrichene Base in der DNA-Sequenz des Spenders weist auf mutierte Basen hin. Diese Mutation entspricht der W163C-Mutation (TGG→TGC) im ZAP70-Protein, das sich in einer kritischen funktionellen Domäne befindet.
- Entwicklung einer spezifischen Guide-RNA (gRNA), die auf das ZAP70-Gen abzielt (gRNA-Sequenz: 5'-CAGCCCACGAGCGAATGCCCTGG-3') und Durchführung einer Geneditierung mit dem CRISPR/Cas9-System. Entwerfen Sie eine Spender-DNA mit der ZAP70(W163C)-Mutation, um eine präzise Inkorporation-n der Mutation zu gewährleisten (hier CAGGCCCCACAGGTGGAGAAGCTCATTG
- Injektion für Mikrospritzen
- Verwenden Sie Mikroinjektion, um Cas9-mRNA, gRNA und Spender-DNA in befruchtete C57BL/6-Mauseier einzuführen. Co-injizieren das Cas9-Protein und die gRNA, so dass sie das ZAP70-Gen spalten und die ZAP70(W163C)-Mutation über homologe Rekombination einfügen. Transplantieren Sie die injizierten befruchteten Eizellen in pseudoschwangere weibliche Mäuse, warten Sie etwa 20 Tage und bezeichnen Sie die geborenen Mäuse als F0-Generation. Identifizierung von Genotypen durch PCR-Amplifikation und Sequenzierung (siehe Schritt 1.1.5.3).
- Genotypisierung von Mäusen der F0-Generation
- PCR und Sequenzierung an Mäusen der F0-Generation durchführen, um den Erwerb der ZAP70 (W163C)-Mutation zu bestätigen (siehe Schritt 1.1.5.3).
HINWEIS: Mäuse der F0-Generation sind aufgrund der schnellen embryonalen Spaltung chimär. Es kann sein, dass es ihnen an einer stabilen genetischen Übertragung mangelt. Führen Sie eine serielle Züchtung durch, um stabile Linien zu etablieren.
- PCR und Sequenzierung an Mäusen der F0-Generation durchführen, um den Erwerb der ZAP70 (W163C)-Mutation zu bestätigen (siehe Schritt 1.1.5.3).
- Gewinnung und genotypische Identifizierung von Mäusen der F1-Generation
- Züchten Sie F0-positive Mäuse mit Wildtyp-Mäusen vom Typ C57BL/6J, um Mäuse der F1-Generation zu erhalten, und führen Sie eine Genotypisierung mittels PCR und Sequenzierung durch, um SKG-Mäuse zu erhalten (C57BL/6-Hintergrund; siehe Schritt 1.1.5.4).
- PCR-basierte Genotypisierungsmethoden für F0- und F1-Generationen
- Schneiden Sie ein 0,5 cm langes Stück mit einer sterilen Schere aus dem Schwanz heraus.
- Extrahieren Sie Maus-DNA mit einem tierischen DNA-Extraktionskit.
- Bereiten Sie für F0 das folgende PCR-Reaktionssystem vor: 13,2 μl ddH2O, 2 μl PCR-Puffer, 2 μl 2,5 mM dNTP, je 0,5 μl Vorwärts- (5'-GATGCCTAGGTGGGTGGGGGGCCCC-3') und Rückwärtsprimer (5'-ACTTGCCTACGCTACTGCTCTACA-3') (10 pmol/μl), 0,8 μl DNA-Polymerase und 1 μl genomische DNA (50-100 ng/μl), die aus Mausschwänzen extrahiert wurde. für ein endgültiges Reaktionsvolumen von 20 μl. Führen Sie die Genamplifikation mit dem folgenden PCR-Programm durch: 94 °C für 3 Minuten; 98 °C für 15 s, 58 °C für 15 s und 68 °C für 1 min, für 35 Zyklen; 68 °C für 5 min; Bei 12 °C halten.
- Bereiten Sie für F1 das folgende PCR-Reaktionssystem vor: 14,9 μl ddH2O, 2 μl 10x Taq-PCR-Puffer, 1 μl 2,5 mM dNTP, je 0,5 μl Vorwärts- (5'-GATGCCTAGGTGGGTGGGGGGTTCC-3') und umgekehrte (5'-ACTTGCCTACGCTACTGCTCTACA-3') Primer (10 pmol/μl), 0,1 μl Taq-DNA-Polymerase und 1 μl genomische DNA (50-100 ng/μl), die aus Mausschwänzen extrahiert wurde. für ein endgültiges Reaktionsvolumen von 20 μl. Führen Sie die Genamplifikation mit dem folgenden PCR-Programm durch: 94 °C für 5 Minuten; 94 °C für 30 s, 58 °C für 30 s, 72 °C für 1 min, wiederholt für 35 Zyklen; 72 °C für 5 min; Bei 12 °C halten.
- Führen Sie eine Elektrophorese durch, um Produkte der erwarteten Größe zu bestätigen.
- Sequenzieren Sie die PCR-Produkte, um sowohl den Genotyp als auch die spezifische Mutation zu verifizieren.
- Strategie der Gen-Editierung
- Auswahl von Spender- und Empfängermäusen
- Wählen Sie SKG-Mäuse aus, die 6-8 Wochen alt sind (männlich oder weiblich) als Spendermäuse.
- Wählen Sie als Empfängermäuse C57BL/6-Mäuse aus, die 6-8 Wochen alt sind (vorzugsweise weiblich für konsistente experimentelle Ergebnisse).
- Haltung von C57BL/6- und SKG-Mäusen (6-8 Wochen alt) unter LSF-Bedingungen in individuell beatmeten Käfigen. Bieten Sie freien Zugang zu Futter in SPF-Qualität und sterilem Wasser in einem 12-stündigen Hell-Dunkel-Zyklus. Akklimatisieren Sie die Mäuse 1 Woche lang, bevor Sie mit den Experimenten beginnen.
2. Isolierung und Aufreinigung von CD4+ T-Zellen aus SKG-Mäusen
- Euthanasieren Sie die SKG-Mäuse unter einer sterilen Laminar-Flow-Haube unter Verwendung von CO2 -Erstickung. Tauchen Sie die Mäuse zur Desinfektion 5 Minuten lang in 75%igen Alkohol. Lokalisieren Sie die Milz in der Bauchhöhle sowie die Lymphknoten (Leisten- und Kniekehle) in der Leisten- und Kniekehleregion. Präparieren Sie Milz und Lymphknoten vorsichtig mit einer sterilen Pinzette und Schere und überführen Sie sie sofort in vorgekühltes PBS.
- Legen Sie die Milz und die Lymphknoten in separate Petrischale. Drücken Sie das Gewebe mit dem Kolben einer sterilen Spritze durch ein 70-μm-Zellsieb und fügen Sie nach und nach 10-12 ml vorgekühltes PBS hinzu, um eine einheitliche Zellsuspension zu bilden. Geben Sie die Zellsuspension durch dasselbe 70-μm-Zellsieb in ein 15-ml-Zentrifugenröhrchen und zentrifugieren Sie sie dann bei 300 × g für 7 min bei 4 °C. Entsorgen Sie den Überstand und behalten Sie das Zellpellet.
- Führen Sie eine Trypanblau-Färbung durch, um die Lebensfähigkeit der Zellen zu beurteilen. Zählen Sie die Zellen und bestätigen Sie, dass die Lebensfähigkeit ≥90 % beträgt.
- Passen Sie die Zellkonzentration mit dem im CD4+ T-Zell-Isolationskit enthaltenen Puffer auf 1 ×10 8 Zellen/ml an.
- 100 μl der Zellsuspension (107 Zellen) in ein neues Röhrchen überführen. 10 μL Biotin-Antikörper-Cocktail dazugeben, gründlich mischen und 15 min auf Eis inkubieren.
- Resuspendieren Sie die Perlen, indem Sie sie mit maximaler Geschwindigkeit wirbeln. 10 μl der Streptavidin-Bead-Suspension zugeben, gut mischen und 15 Minuten auf Eis inkubieren.
- Fügen Sie 2,5 mL des im CD4+ T-Zell-Isolationskit enthaltenen Puffers hinzu und legen Sie das Röhrchen für 5 Minuten in den Magneten.
- Gießen Sie die Flüssigkeit (Zielzellen) vorsichtig aus dem Röhrchen in ein neues steriles Röhrchen, zentrifugieren Sie dann bei 4 °C, 300 × g für 5 min. Entsorgen Sie den Überstand und behalten Sie das Zellpellet.
- Fügen Sie eine ausreichende Menge steriler PBS-Lösung hinzu, um die Zellkonzentration auf 2 × 106 Zellen/ml einzustellen, und bewahren Sie die Suspension für die spätere Verwendung auf Eis auf.
- Verwenden Sie die Durchflusszytometrie, um die Reinheit der sortierten Zellen zu beurteilen (Ergänzende Abbildung S1). Berechnen Sie die Zellreinheit als: (Anzahl der CD4+ T-Zellen / Gesamtzellzahl) × 100%. Vergewissern Sie sich, dass die Reinheit ≥90 %16 beträgt.
3. Adoptiver Transfer von CD4+ T-Zellen
- Betäuben Sie C57BL/6-Mäuse mit 2%-3% Isofluran und erreichen Sie eine Anästhesietiefe, bei der die Mäuse jegliche Beweglichkeit verlieren, aber die normale Spontanatmung beibehalten.
- Reinigen Sie den inneren Augenwinkel der Maus vorsichtig mit einem sterilen Wattestäbchen, um Sekrete und Haare zu entfernen und die Vene freizulegen.
- Legen Sie die Maus von Hand ruhig. Ziehen Sie 200 μl CD4+ T-Zellsuspension (2 × 105-5 × 105 Zellen pro Maus) in eine 1 ml-Spritze. Führen Sie die Nadel in einem Winkel von 10-15° in die innere Canthalvene ein, um eine genaue Platzierung zu gewährleisten. Injizieren Sie die Zellsuspension langsam und gleichmäßig über 10-15 s.
- Drücken Sie nach dem Zurückziehen der Nadel mit einem sterilen Wattestäbchen vorsichtig 3-5 s lang vorsichtig auf den inneren Canthalbereich, um ein Ausbluten zu vermeiden.
- Platzieren Sie die Maus zur Überwachung in einem ruhigen, trockenen und sauberen Käfig, bis sie wieder vollständig zu Bewusstsein kommt, mit stabiler Atmung und ohne abnormales Verhalten (wie Zuckungen oder plötzlicher Tod). Bewegen Sie die Maus in einen Standardgehäusekäfig, nachdem Sie den stabilen postoperativen Status bestätigt haben.
HINWEIS: Da die Vena canthal innen klein ist, sind eine schonende Handhabung und eine kontrollierte Infusionsgeschwindigkeit entscheidend, um Venenrupturen oder Zellblockaden durch zu hohe Geschwindigkeit zu vermeiden. - Notieren Sie die Infusionsdetails und beschriften Sie die Modell- und Kontrollgruppenmäuse (vier Tiere pro Gruppe), um Verwechslungen in nachfolgenden Experimenten zu vermeiden. Verabreichen Sie CD4+ T-Zellen an Modellmäuse und lassen Sie Kontrollmäuse unbehandelt. Stellen Sie sicher, dass alle Mäuse Empfängermäuse sind.
4. Stimulation und Induktion von Mannan
- Führen Sie die Mannan-Induktion an Tag 4 durch (72 h nach CD4+ T-Zell-Infusion). Wenden Sie die gleichen Induktionsbedingungen auf alle Versuchs- und Kontrollmäuse an.
- Wiegen Sie das Mannan-Pulver und lösen Sie es in sterilem PBS bis zu einer Konzentration von 100 mg/ml auf.
- Halten Sie die Maus richtig, um ihren Bauch freizulegen. Desinfizieren Sie die Haut mit 75% Alkohol und identifizieren Sie die Injektionsstelle (~1 cm seitlich der Bauchmittellinie).
- Mischen Sie die Mannanlösung gründlich und ziehen Sie das entsprechende Volumen (20-30 mg pro Maus) in eine 1-ml-Spritze. Führen Sie die Nadel in einem Winkel von 45° in die Bauchhöhle ein und injizieren Sie die Lösung langsam, um eine gleichmäßige Verteilung zu gewährleisten. Ziehen Sie die Nadel langsam zurück und drücken Sie vorsichtig mit einem sterilen Wattestäbchen einige Sekunden lang auf die Injektionsstelle, um ein Auslaufen oder eine Infektion zu verhindern.
- Legen Sie die injizierte Maus in einen ruhigen und sauberen Käfig und überwachen Sie sie 5-10 Minuten lang genau, um sicherzustellen, dass an der Injektionsstelle kein Leck, keine Blähungen im Bauchraum oder abnormale Atmung vorhanden sind.
- Notieren Sie die Injektionsdetails für jede Maus im Detail.
5. Maße
- Beobachtung des klinischen Phänotyps
- Bewertung von Arthritis-Symptomen
- Führen Sie alle 3 Tage nach der Mannan-Induktion Gelenkuntersuchungen durch. Untersuchen Sie alle Gelenke in den Vorder- und Hintergliedmaßen und achten Sie dabei besonders auf Knie-, Knöchel-, Handgelenk- und Zehengelenke. Bewerten Sie den Schweregrad der Arthritis anhand von Standardkriterien (Tabelle 1)17. Zeichnen Sie die Gesamtergebnisse zu jedem Zeitpunkt auf und vergleichen Sie sie, um das Fortschreiten der Arthritis zu bewerten.
- Bewertung von Arthritis-Symptomen
- Erfassung pathologischer Merkmale des Gewebes
- Nach einem Monat Mannan-Induktion euthanasieren Sie die Mäuse unter einer sterilen Laminar-Flow-Haube mit CO2 -Erstickung (gemäß den Richtlinien der Ethikkommission), befestigen Sie die Maus auf einer Schaumstoffplatte und legen Sie die Hinterbeine frei. Schneiden Sie die Haut ab dem Knöchel ein und schälen Sie sie nach oben, um Muskeln und Gelenke freizulegen. Identifizieren Sie das Sprunggelenk (zwischen Tibia/Fibula und Talus) und die Metatarsophalangealgelenke (zwischen Mittelfußknochen und proximalen Phalangen) und präparieren Sie diese Gelenke für die histologische Analyse und bereiten Sie Paraffinschnitte vor.
- Fixieren Sie das herausgeschnittene Gewebe 72 Stunden lang in 4 % Formalin und übertragen Sie es dann für 4 Wochen in 10 % Ethylendiamintetraessigsäure (EDTA, pH 7,4), um eine vollständige Entkalkung zu gewährleisten.
- Waschen Sie das Gewebe nach der Entkalkung mit PBS, um alle Reste des Fixiermittels zu entfernen, und dehydrieren Sie das Gewebe dann durch eine abgestufte Ethanolreihe (75 %, 80 %, 95 %, 100 %).
HINWEIS: Formalin kann Augen, Haut und Atemwege reizen. Es sollte in einem Abzug gehandhabt werden. - Betten Sie das Gewebe mit einer Paraffineinbettungsmaschine in Paraffin ein. Verwenden Sie ein Mikrotom, um das eingebettete Gewebe in 4 μm dicke Scheiben zu schneiden. Lassen Sie die Abschnitte in einem 40 °C warmen Wasserbad mit destilliertem Wasser schwimmen.
- Übertragen und trocknen Sie die Abschnitte. Legen Sie die Abschnitte auf Objektträger. Trocknen Sie sie über Nacht bei Raumtemperatur (RT). Lagern Sie die Objektträger zum Färben bei RT.
- Hämatoxylin- und Eosin-Färbung (H&E)
- Legen Sie die Objektträger für 2 h in einen 60 °C heißen Ofen, um das Paraffin zu entfernen.
- Tauchen Sie die Objektträger bei Raumtemperatur in der folgenden Reihenfolge jeweils 5 Minuten lang ein: Xylol → Xylol → 100 % Ethanol → 100 % Ethanol → 95 % Ethanol → 80 % Ethanol → 75 % Ethanol. 2 Min. in destilliertem Wasser abspülen.
- Färben Sie die Objektträger nacheinander 5 Minuten lang in Hämatoxylinlösung, spülen Sie sie 2 Minuten lang in entionisiertem Wasser, behandeln Sie sie dann 1 Minute lang mit 0,1 % Ammoniak, spülen Sie sie 3 x 2 Minuten lang in entionisiertem Wasser, färben Sie sie 1 Minute lang mit Eosin und spülen Sie sie schließlich 2 Minuten lang in entionisiertem Wasser.
- Tauchen Sie die Objektträger jeweils 5 Minuten lang in 80 % Ethanol → 95 % Ethanol → 100 % Ethanol → Xylol → Xylol.
- Trocknen Sie die Dias an der Luft und montieren Sie sie mit neutralem Harz.
- Safranin O-Fast Grün Färbung
- Entparaffinieren Sie die Paraffinabschnitte zu Wasser und färben Sie sie mit einem Van Gieson's Fleckenset. Montieren Sie die Objektträger nach dem Färben mit neutralem Harz und nehmen Sie Bilder unter dem Mikroskop auf (vorbereitet in Schritt 5.2.5).
- Veränderungen in T-Zellen und Zytokinen
- Entfernen Sie die Milz aus der Maus mit sterilen chirurgischen Instrumenten.
- Extrahieren Sie die Gesamt-RNA aus dem Milzgewebe mit einem RNA-Extraktionskit gemäß den Anweisungen des Herstellers. Quantifizieren Sie die RNA-Konzentration und -Reinheit mit einem Spektralphotometer und stellen Sie sicher, dass das Verhältnis A260/A280 zwischen 1,8 und 2,0 liegt.
- Synthetisieren Sie cDNA aus der extrahierten RNA mit einem reversen Transkriptionskit. Befolgen Sie das Protokoll des Herstellers für den Reaktionsaufbau und die Zyklusbedingungen. Lagern Sie die cDNA bei -20 °C für die nachfolgende qPCR-Analyse.
- Durchführung der qPCR: Messung der relativen mRNA-Expressionsniveaus von Tbx21, Gata3, Il-17 und Foxp3 im Milzgewebe wurde mittels SYBR Green-basierter qPCR in 10-μl-Reaktionen gemessen, die Folgendes enthielten: 5 μl 2x SYBR Green Master Mix, je 0,2 μl Vorwärts- und Rückwärtsprimer (10 μM; Sequenzen in Tabelle 2), 0,5-1 μl cDNA (50-100 ng/μl), und nukleasefreies Wasser zum Volumen. Es werden die folgenden thermischen Zyklusbedingungen verwendet: anfängliche Denaturierung bei 95 °C für 30 s, gefolgt von 40 Zyklen bei 95 °C für 10 s und 60 °C für 30 s, mit Schmelzkurvenanalyse (65-95 °C). Normalisieren Sie die Expressionsebenen auf Gapdh mit der Methode 2(-ΔΔCt).
- Serumisolierung und zytometrische Bead-Array-Analyse (CBA)
- Entnehmen Sie der Maus Blut mit der orbitalen Blutentnahme durch Enukleationsmethode, geben Sie das Blut in ein mit Antikoagulans beschichtetes Entnahmeröhrchen und lassen Sie es 30 Minuten lang bei Raumtemperatur stehen. Das geronnene Blut bei 4 °C, 1.000 × g für 15 min zentrifugieren, den Überstand (Serum) vorsichtig auffangen und bis zur Analyse bei -80 °C lagern.
- Bestimmen Sie die Expressionsniveaus von IL-6, IL-10, IL-17, TNF-α und IFN-γ im Serum mit einem CBA-Kit gemäß den Anweisungen des Herstellers.
- Entfernen Sie die Milz aus der Maus mit sterilen chirurgischen Instrumenten.
Ergebnisse
Klinische Bewertung von Gelenkschwellungen und Inzidenzrate bei Mäusen
Abbildung 1 zeigt das klinische Scoring von Gelenkschwellungen und die Inzidenzrate bei Modellmäusen. Die Ergebnisse deuten darauf hin, dass alle Mäuse in der Modellgruppe die Krankheit entwickelten (n = 4), mit einer Inzidenzrate von 100%. Die Werte in der Modellgruppe stiegen signifikant an, zeigten in der zweiten Woche eine kurze Erleichterung und stiegen anschließend über einen Zeitraum von 6 Wochen an.
Manifestation von Gelenkschwellungen bei Mäusen
Die Gelenke der Maus der Modellgruppe weisen eine signifikante Verdickung und Schwellung auf, wobei auch in den Vorder- und Hintergliedmaßen deutliche Schwellungen und Verdickungen beobachtet wurden (Abbildung 2).
Pathologische Befunde der Sprunggelenke der Maus
Pathologische Befunde deuten darauf hin, dass die Mäuse der Modellgruppe im Vergleich zur Kontrollgruppe eine signifikante Verdickung der Synovia in den Sprunggelenken, eine Diskontinuität im Knochen und eine ausgeprägte Aggregation von Entzündungszellen aufweisen (Abbildung 3, Abbildung 4 und Abbildung 5).
Serum-T-Zell-bezogene Entzündungsfaktoren
Im Vergleich zur Kontrollgruppe zeigten die Mäuse der Modellgruppe einen signifikanten Anstieg der Serumspiegel von IL-10 (7,51 vs. 2,15 pg/ml), TNF (78,83 vs. 13,11 pg/ml), IL-17 (101,6 vs. 12,64 pg/ml) und IFN-γ (5,15 vs. 1,90 pg/ml) (p < 0,05). IL-6 stieg im Vergleich zur Kontrollgruppe ebenfalls signifikant an (15,59 vs. 6,27 pg/ml) (p = 0,05, Abbildung 6).
Veränderungen der T-Zell-Untergruppen Th1/2/17 und Tregs in der Milz
Die mRNA-Expressionsniveaus von Tbx21 (Th1), Gata3 (Th2), Il-17 (Th17) und Foxp3 (Tregs) wurden gemessen, um Veränderungen in T-Zell-Untergruppen in der Milz zu beurteilen. Diese Gene kodieren für wichtige Transkriptionsfaktoren und Zytokine, die die Differenzierung und Funktion ihrer jeweiligen T-Zell-Untergruppen definieren. Im Vergleich zur Kontrollgruppe zeigten die Mäuse der Modellgruppe eine signifikant erhöhte mRNA-Expression von Tbx21 (1,68 vs. 0,61) und Il-17 (26,30 vs. 0,75) in der Milz (p < 0,05) im Vergleich zum Referenzgen Gapdh.
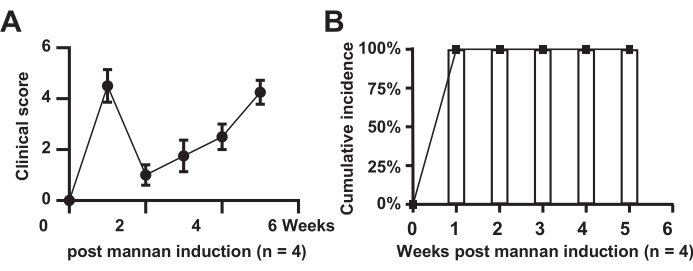
Abbildung 1: Klinisches Scoring der Gelenkschwellung. (A) Mäuse der Modellgruppe; (B) Kumulative Inzidenz in der Modellgruppe Mäuse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Manifestationen von Gelenkschwellungen bei Kontroll- und Modellmäusen (n = 4). (A-C) Repräsentative Bilder von Pfoten- und Gelenkschwellungswerten (0,2,4) in der Kontroll- und Modellgruppe von Mäusen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
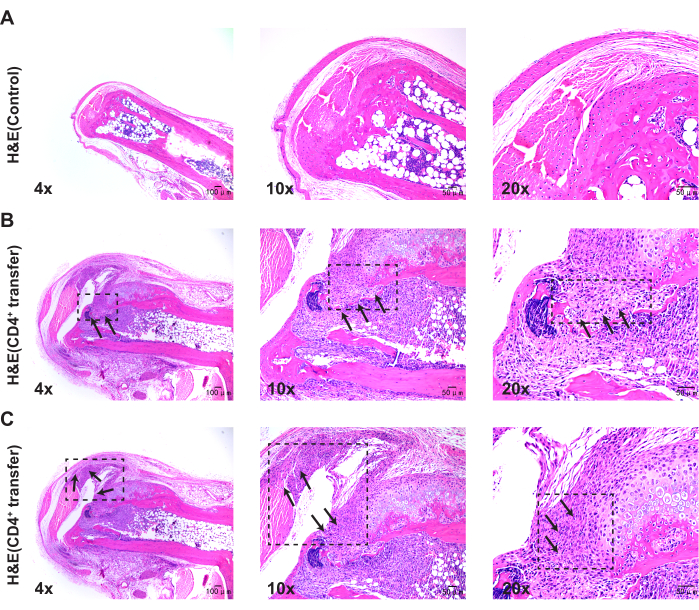
Abbildung 3: Histologische Veränderungen in den Sprunggelenken von Mäusen der Kontroll- und Modellgruppe, die mit Hämatoxylin-Eosin-Färbung beobachtet wurden. (A) Kontroll-Sprunggelenk der Maus; (B) Diskontinuität im Knochen der Modellgruppe Maus-Sprunggelenk; (C) Synoviale Proliferation in der Modellgruppe Maus-Sprunggelenk. Maßstabsleisten = 50 μm (erste Spalte), 100 μm (zweite und dritte Spalte). Die Bilder in Abb. 3B und 3C stammen von derselben Maus und zeigen unterschiedliche pathologische Phänotypen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Unterschiede in der Synovialdicke der Sprunggelenke zwischen der Kontrollgruppe und der Modellgruppe Mäuse (p < 0,05). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
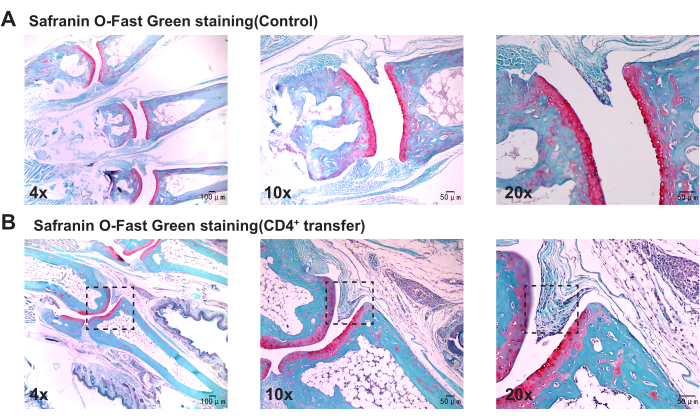
Abbildung 5: Histologische Veränderungen in den Sprunggelenken von Mäusen der Kontroll- und Modellgruppe, die mit einer Safranin O-Fast Green-Färbung beobachtet wurden. (A) Sprunggelenk der Maus der Kontrollgruppe; (B) Synoviale Proliferation im Sprunggelenk der Modellgruppe Maus. Maßstabsleisten = 50 μm (erste Spalte), 100 μm (zweite und dritte Spalte). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Veränderungen der T-Zell-bedingten Entzündungsfaktoren und Untergruppen in Mäusen der Kontroll- und Modellgruppe. (A) Expression von T-Zell-bedingten Entzündungsfaktoren im Serum von Kontroll- und Modellgruppenmäusen und (B) die Veränderungen der T-Zell-Untergruppen Th1/2/17 und Tregs in der Milz. *p < 0,05, **p < 0,01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Punktzahl | Schwellung (Bereich 0-4) | Erythem (Bereich 0-2) |
| 0 | Nichts | Nichts |
| 1 | Beliebige Ziffer | unbedeutend |
| 2 | Pfote | Extrem |
| 3 | Handgelenk/Knöchel | |
| 4 | Gesamte Extremität |
Tabelle 1: Bewertungskriterien für Arthritis. Um Arthritis zu bewerten, wird jede Extremität nach Schwellung und Erythem bewertet, wobei jeder Extremität eine Punktzahl von 0-6 zugewiesen wird. Die Werte für alle vier Gliedmaßen werden addiert, um den Gesamt-Arthritis-Score für jede Maus zu generieren.
| Primer-Sequenzen | |
| Name des Oligos | Sequenz 5' bis 3' |
| TBX21-VORWÄRTS | AGCAAGGAGCGAATGTT |
| TBX21-Rückwärts | GGGTGGACATATAAGCGGTTC |
| Gata3-Vorwärts | CTCGGCCATTCGTACATGGAA |
| Gata3-Rückwärts | GGATACCTCTGCACCGTAGC |
| IL-17A-Vorwärts | TTTAACTCCCTTGGCGCAAAA |
| IL-17A-Rückwärtsgang | CTTTCCCTCCGCATTGACAC |
| Foxp3-Vorwärts | CCCTTGACCTCAAAACCAAG |
| Foxp3-Rückwärts | GTGTGACTGCATGACTAACTTTGA |
| Gapdh-Vorwärts | GGTTGTCTCCTGCGACTTCA |
| Gapdh-Rückwärts | TGGTCCAGGGTTTCTTACTCC |
Tabelle 2: Liste der Primer-Sequenzen.
Ergänzende Abbildung S1: Gating-Strategie für die CD4+ T-Zellsortierung mittels Durchflusszytometrie. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Entwicklung von RA ist eng mit einer abnormalen Infiltration von Immunzellen im Synovialgewebe verbunden, wo die fehlregulierte Aktivierung dieser Immunzellen zur Freisetzung verschiedener entzündungsfördernder Zytokine führt, die weiter zur Schädigung von Synovial- und Gelenkstrukturen beitragen18,19. Mehrere RA-Tiermodelle wurden umfassend bewertet, darunter das CIA-Modell, das K/BxN-Modell und SKG-Mäuse 13,20,21. Obwohl diese Modelle die Immunmechanismen und klinischen Manifestationen der RA erfolgreich replizieren, weisen sie alle erhebliche Einschränkungen auf. Zum Beispiel hat das CIA-Modell in C57BL/6-Mäusen eine niedrigere Erfolgsquote, eine längere Wirkungsdauer und wird erheblich von Umwelt- und Versuchsbedingungen beeinflusst, was es in bestimmten Versuchsumgebungen weniger praktikabel macht. SKG-Mäuse stellen ein RA-Mausmodell dar, das auf einer ZAP-70-Genmutation basiert, die eine abrupte Anomalie in der Signalübertragung des T-Zell-Rezeptors (TCR) verursacht und Autoimmunarthritis induziert22. Dieses Modell ist jedoch teuer, und die Reproduzierbarkeit der experimentellen Ergebnisse wird leicht durch die Induktionsbedingungen beeinträchtigt. K/BxN ist ein erbliches Arthritismodell, das durch die kooperative Aktivität von T- und B-Zellen ausgelöst wird und eine ausgeprägte Immunantwort aufweist23. Die Erstellung dieses Modells ist jedoch kostspielig und seine Spezifität ist eingeschränkt, was zu einer begrenzten Immunantwort führt, die den vielschichtigen pathologischen Prozess der menschlichen RA nicht vollständig erfassen kann. Daher ist es von großer Bedeutung, ein Tiermodell zu entwickeln, das die wichtigsten pathologischen Merkmale der RA repliziert, verschiedene experimentelle Anforderungen erfüllt und eine hohe Reproduzierbarkeit gewährleistet.
In dieser Arbeit stellen wir eine Methode zur Etablierung eines RA-Modells durch den adoptiven Transfer von adaptiven CD4+ T-Zellen aus SKG-Mäusen vor. Die Konstruktion dieses Modells beruht auf der Selektion von CD4+ T-Zellen aus SKG-Mäusen mit einem C57/BL6-Hintergrund und der Induktion von Mannan, ein Prozess, der den Erfolg des Modells sicherstellt. Es ist weithin bekannt, dass SKG-Mäuse auf einem BALB/c-Hintergrund eine spontane ZAP70-Genmutation (W163C) tragen, die eine abnormale Selektion des TCR-Signalwegs verursacht, was zu hochgradig selbstreaktiven T-Zellen führt24. Dies führt zu einer übermäßigen T-Zell-Aktivierung und dem Auftreten von Synovitis und Gelenkzerstörung, wodurch wichtige pathologische Prozesse der RA wie die Synovialreparatur und die Aktivierung von Immunzellen nachgeahmtwerden 25,26. Die klinischen Merkmale von SKG-Mäusen ähneln stark denen von humanen RA-Patienten.
Um diese Mutation in den C57BL/6-Hintergrund einzuführen, haben wir die CRISPR/Cas9-Technologie eingesetzt, um erfolgreich ein C57BL/6-Hintergrund-SKG-Mausmodell zu generieren, das die ZAP70 (W163C)-Mutation trägt. CRISPR/Cas9 bietet eine hohe Präzision und Effizienz und ermöglicht die gezielte Einführung der gewünschten Mutation bei gleichzeitiger Beibehaltung einer geringen Rate an Off-Target-Insertion oder unerwünschten genetischen Modifikationen, die mit herkömmlichen zufälligen Induktionsmethoden verbunden sind, wodurch die Stabilität und Einzigartigkeit des Modells gewährleistetwird 27,28. Noch wichtiger ist, dass diese Technik auch den Zeitaufwand für den Modellbau erheblich reduziert, was sowohl die Kontrollierbarkeit als auch die Effizienz der Modellentwicklung verbessert. Mit diesem Modell können wir die T-Zell-vermittelte Synovitis und Gelenkzerstörung der RA vor einem C57BL/6-Hintergrund präzise replizieren. Im Vergleich zum BALB/C-Hintergrund in traditionellen SKG-Mäusen haben Modellmäuse mit einem C57BL/6-Hintergrund eine breitere Anwendbarkeit in der immunologischen Forschung und können leichter mit anderen transgenen Modellen (z.B. Rag1-/- oder IL17-/-) kombiniert werden. Damit eignen sie sich, um die Rolle der ZAP70-Mutation bei RA und anderen Autoimmunerkrankungen wie dem systemischen Lupus erythematodes oder der Multiplen Sklerose zu untersuchen.
Basierend auf der zentralen Rolle von29,30 CD4+ T-Zellen bei der RA-Aktivierung haben wir sie als Schlüsselmediatoren ausgewählt. T-Zellen sind die primären Treiber der Immunantwort bei RA und können durch Aktivierung von Th1/Th17-Effektor-Untergruppen31 direkt synoviale Schäden induzieren, abhängig von Entzündungsfaktoren wie IL-6, IL-17 und TNF-α 32,33. Als zentrale Mediatoren der Immunregulation sezernieren CD4+ T-Zellen proinflammatorische Zytokine, die die Entzündungskaskade auslösen und aufrechterhalten, die zur Synovialproliferation und Gelenkschädigung führt und so das pathologische Fortschreiten der RA direkt fördert. Sie sind maßgeblich daran beteiligt, B-Zellen bei der Produktion spezifischer Antikörper (z. B. ACPA) zu unterstützen34. Charakteristisches histopathologisches Merkmal der RA-Synovia ist die Aggregation von CD4+ T-Zellen. Bestimmte MHC-Gene (Major Histocompatibility Complex) der Klasse II, insbesondere die "gemeinsamen Epitope", die mit dem Humanen Leukozyten-Antigen-DR-Isotyp (HLA-DR) verwandt sind, gelten als eng mit der Pathogenese von RA35 verbunden. Darüber hinaus hat die Strategie der Blockierung der T-Zell-Co-Stimulation mit dem zytotoxischen T-Lymphozyten-assoziierten Antigen 4 (CTLA4)-Ig bei RA36 eine signifikante klinische Wirksamkeit gezeigt. Darüber hinaus dient die Mannan-Induktion als potenter Aktivator für das Modell und fördert die Aktivierung von angeborenen Immunkomponenten wie dendritischen Zellen und Makrophagen37. Dieser Schritt erleichtert die Aktivierung von CD4+ T-Zellen und die Immunantwort, wodurch der Angriff des Immunsystems auf das Selbstgewebe deutlich erhöht wird, wodurch die pathologischen Merkmale der Immundysregulation und der Synovialschädigung bei RA simuliert werden.
Nach Abschluss der Modellinduktion führten wir eine systematische Verifizierung der Modellgruppe anhand mehrerer Parameter durch, darunter die klinische Bewertung der Gelenkschwellung, die pathologische Validierung (Beobachtung der Synovitis-Gewebepathologie und der Merkmale der Gelenkzerstörung) und die immunologische Validierung (Expression von Th1/2/17- und Treg-Zellen in Serum und Milz). Die Ergebnisse zeigten, dass unser Modell die T-Zell-vermittelte Synovitis und Gelenkzerstörung bei RA erfolgreich replizierte und eine charakteristische Immunaktivierung und synoviale pathologische Veränderungen induzierte, die mit den wichtigsten pathophysiologischen Mechanismen der RA übereinstimmen, mit einer Prävalenzrate von 100%. Bemerkenswert ist, dass in unserem Modell der klinische Swell-Joint-Score von Mäusen nach 1 Woche seinen Höhepunkt erreicht, in der zweiten Woche eine deutliche Reduktion zeigt und dann in späteren Stadien allmählich wieder ansteigt, was nicht ganz mit dem typischen Krankheitsverlauf übereinstimmt, der in konventionellen Arthritis-Tiermodellen beobachtet wurde38. Dies kann daran liegen, dass sich das Immunsystem der Modellmäuse 1 Woche nach der Induktion in einer intensiv aktivierten Anfangsphase durch die Injektion von Mannan befindet, was zu einem Höhepunkt der Gelenkentzündung führt. In der zweiten Woche führen Immunregulations- und Selbstheilungsmechanismen zu einer vorübergehenden Linderung der klinischen Symptome. Mit fortschreitender Erkrankung nimmt die Immuntoleranz allmählich ab und die Immunantwort wird wieder intensiviert, was sich in einer allmählichen Verschlechterung des Zustands in späteren Stadien äußert.
Obwohl dieses Modell im Vergleich zu anderen Modellen relativ einfach ist, gibt es dennoch einige wichtige Punkte, die während des Modellierungsprozesses berücksichtigt werden müssen. Zunächst bilden die Aktivität und Reinheit von CD4+ T-Zellen aus SKG-Mäusen die Grundlage für den Erfolg des Modells. Die Reinheit der Zellen sollte über 90 % liegen, um die Konsistenz und Zuverlässigkeit der Versuchsergebnisse zu gewährleisten. Zweitens sollte die Geschwindigkeit der Injektion in die Vena canthalis medialis sorgfältig kontrolliert werden, um zu vermeiden, dass eine Venenruptur durch zu schnelle Injektion oder eine zu langsame Injektion von Zellleckagen verursacht wird. Darüber hinaus ist die Auswahl der Zelldosis von entscheidender Bedeutung. Eine zu niedrige Dosis kann zum Versagen des Modells führen, während eine zu hohe Dosis unspezifische Entzündungsreaktionen auslösen kann. Daher sollte während des Modellierungsprozesses der Gesamtzustand der Mäuse genau überwacht und alle abnormalen Symptome unverzüglich aufgezeichnet werden, um den reibungslosen Ablauf des Experiments und die wissenschaftliche Gültigkeit der Daten zu gewährleisten.
Im Vergleich zu herkömmlichen Modellen hat dieses Modell eine kürzere Etablierungszeit, erreicht eine höhere Inzidenzrate bei C57BL/6-Mäusen und bleibt relativ kostengünstig und einfach zu bedienen. Der Transfer von autoreaktiven CD4+ -T-Zellen reproduziert genau die T-Zell-vermittelten Immunantworten und erfasst wichtige pathologische Merkmale der RA, wie z. B. Gelenkschwellungen und -schäden. Darüber hinaus stimmen die klinischen Manifestationen gut mit denen der menschlichen RA überein und bieten eine authentischere Reflexion der klinischen und pathologischen Prozesse der RA. Darüber hinaus verbessert die Kombination aus medialer Canthalveneninfusion und Mannan-Induktion die Kontrollierbarkeit und experimentelle Stabilität des Modells weiter, wodurch es hochgradig reproduzierbar ist und eine hervorragende experimentelle Kontrolle bietet. Natürlich hat dieses Modell noch Einschränkungen. Es konzentriert sich hauptsächlich auf T-Zell-gesteuerte Immunantworten; Die Simulation der kollaborativen Rollen von B-Zell-vermittelten Antikörperantworten und anderen Immunzellen (wie z.B. natürlichen Killerzellen (NK) und Treg-Zellen) ist unzureichend, was es schwierig macht, die multizellulären pathologischen Mechanismen der RA vollständig darzustellen. Nichtsdestotrotz bleibt dieses RA-Mausmodell ein stabiles und zuverlässiges Tiermodell, das den Forschern eine bessere Plattform bietet, um T-Zell-vermittelte Immunantworten und die wichtigsten pathologischen Merkmale der RA zu simulieren. Dieses Modell ermöglicht es den Forschern, tief in die Immunmechanismen und das pathologische Fortschreiten der RA einzutauchen und liefert wichtige experimentelle Beweise und Werkzeuge für die Entwicklung neuartiger Therapien, insbesondere zum Verständnis der T-Zell-getriebenen Immundysregulation und zur Identifizierung therapeutischer Ziele.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der National Natural Science Foundation of China (82270903, 82401588 und 81974254) und der China Postdoctoral Science Foundation (2024M751019) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose | Yeasen | 10208ES60 | Preparing agarose gel for use in DNA electrophoresis experiments |
| Anhydrous ethanol | Shanghai HuShi Laboratory Instruments Co., Ltd. | 100009218 | Dehydrating and fixative agent |
| ZAP 70 primers | Tsingke | Primers used for detecting ZAP70 gene expression, commonly used in PCR experiments for genotyping mice | |
| 0.5 M EDTA solution (pH = 7.4) | Biosharp | R00521 | Used for decalcification to ensure the quality of tissue sections and staining for calcium-containing tissues, while maintaining the structural integrity of the tissue |
| 1.5 mL enzyme-free ep tubes | LABSELECT | MCT-001-150-S | Used for a variety of experiments such as sample storage, centrifugal separation, etc |
| 2x Q3 SYBR qPCR Master Mix (Universal) | ToloBio | 22204 | Used for performing highly specific and highly sensitive qPCR reactions. |
| 2x Magic Green Taq SuperMix | TOLOBIO | 21502-04 | Buffer solution for pre-electrophoresis |
| 4% Formaldehyde (paraformaldehyde) solution | Biosharp | BL539A | Used as a fixative to preserve tissue structure and cellular morphology, providing stable and well-preserved samples for subsequent staining steps |
| Animal tissue/cell total RNA isolation kit | Servicebio | MPC2409122 | Extraction of total RNA from animal tissues/cells |
| BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit | BD Biosciences | 560485 | Measure the expression of Th1/2/17 cytokines in mouse serum. |
| Cell Culture dish | LABSELECT | 12211 | A container for cell fluid from the spleen and lymph nodes |
| Dimethylbenzene | China National Pharmaceutical Group Chemical Reagents Co., Ltd. | 10023418 | Used as a deparaffinizing and clearing agent |
| Easyfive six-port cell counting chamber | CytoEasy | N3EF110 | Used for cell counting |
| Enhanced Safranin O-Fast Green staining solution for cartilage. | Solarbio | G1371 | Stain cartilage and bone tissues to observe pathological changes in the joint area. |
| Glass slide | CITOTEST | 188105 | Basic support for tissue slicing |
| Hematoxylin staining solution | Servicebio | G1005-1 | Dying |
| Hematoxylin staining solution | Servicebio | G1001 | Dying |
| Low-speed refrigerated centrifuge | Cence | F14300021010004 | It is used for centrifugation and precipitation |
| Mannan | Sigma | m7504 | Activator for the model.Dissolve in sterile PBS at 2 mg/mL, mix thoroughly, and filter through a 0.22 μm membrane to eliminate any particles or possible sources of contamination. |
| MojoSort Magnet | Biolengend | 480019 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice |
| MojoSort Mouse CD4 T Cell Isolation Kit | Biolengend | 480033 | Used for isolating and purifying CD4+ T cells from spleen, lymph nodes of mice . Use a negative selection method that directly binds to the CD4 molecule to isolate CD4+ T cells, preserving the integrity of surface antigens without affecting CD4 molecule functionality, making it suitable for CD4+ T cell infusion experiments. |
| Nano-300 | ALLSHENG | AS-11020-00 | Accurate detection of nucleic acids, proteins, and cellular solutions |
| Neutral resin mounting agent | Biosharp | BL704A | Fix and preserve stained tissue sections |
| Paraffin microtome | KEDEE | KD-3389 | Used for paraffin sections |
| Phosphate-buffered saline (PBS) | Pricella | WHB824P281 | Used as a buffer solvent or cleaning agent, |
| Sterile cell filter (70 µm) | Biosharp | BS-70-CS | Remove large impurities or aggregated cell clusters from the cell suspension to ensure sample purity and cell uniformity |
| Sterile syringe (1 mL) | Lingyang Medical Apparatus | 20241020 | Injection into the inner canthal vein |
| Tabletop high-speed microrefrigerated centrifuge | SCILOGEX | S1010E | Used for centrifugation and precipitation |
| TEA Buffer (50x) | Yeasen | 60116ES76 | Stabilizes pH, helps protect and preserve molecules like DNA and RNA, used in electrophoresis experiments |
| ToloScript All-in-one RT EasyMix for qPCR | ToloBio | 22107 | Used to convert RNA templates into cDNA, facilitating subsequent gene expression analysis, qPCR, and other molecular biology experiments. |
| Transefer Pipettes | BIOFIL | 240515-133-A | Used for transferring solutions |
| Trypan blue dye solution | Biosharp | 7009529 | Commonly used for cell viability assays, helps differentiate live cells from dead cells |
Referenzen
- Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: A systematic analysis of the global burden of disease study. Lancet Rheumatol. 5 (10), e594-e610 (2021).
- Radu, A. F., Bungau, S. G. Management of rheumatoid arthritis: An overview. Cells. 10 (11), 2857(2021).
- Di Matteo, A., Bathon, J. M., Emery, P. Rheumatoid arthritis. Lancet. 402 (10416), 2019-2033 (2023).
- Bernard, L., et al. Management of patients with rheumatoid arthritis by telemedicine: Connected monitoring. A randomized controlled trial. Joint Bone Spine. 89 (5), 105368(2022).
- Jang, S., Kwon, E. J., Lee, J. J. Rheumatoid arthritis: Pathogenic roles of diverse immune cells. Int J Mol Sci. 23 (2), 905(2022).
- Daikh, D. I. Rheumatoid arthritis: Evolving recognition of a common disease. Best Pract Res Clin Rheumatol. 36 (1), 101740(2022).
- Bhamidipati, K., Wei, K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol. 36 (1), 101742(2022).
- Meyer, A., Parmar, P. J., Shahrara, S. Significance of IL-7 and IL-7R in RA and autoimmunity. Autoimmun Rev. 21 (7), 103120(2022).
- Yu, X., et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRS ligands on human fibroblast-like synoviocytes-a potential immunopathological mechanism for joint inflammation in rheumatoid arthritis. Int Immunopharmacol. 82, 106356(2020).
- Wu, X., et al. Single-cell sequencing of immune cells from anticitrullinated peptide antibody positive and negative rheumatoid arthritis. Nat Commun. 12 (1), 4977(2021).
- Wei, X., Niu, X. T follicular helper cells in autoimmune diseases. J Autoimmun. 134, 102976(2023).
- Mcelwee, M. K., Dileepan, T., Mahmud, S. A., Jenkins, M. K. The CD4+ T cell repertoire specific for citrullinated peptides shows evidence of immune tolerance. J Exp Med. 220 (12), e20230209(2023).
- Ahmed, S., et al. Dual inhibition of glycolysis and glutaminolysis for synergistic therapy of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 176(2023).
- Wu, J., et al. Tnf antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models. Nat Commun. 13 (1), 676(2022).
- Huo, F., Hou, J., Zhu, Y., Feng, Z. ferroptosis inducer ike ameliorate pulmonary fibrosis in collagen-induced arthritis (CIA) mice via decreasing the expression of IL-6, CCL5 and CXCL9. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 40 (2), 114-120 (2024).
- Sun, H., et al. ID2 exacerbates the development of rheumatoid arthritis by increasing IFN-γ production in CD4+ T cells. Clin Transl Med. 15 (3), e70242(2025).
- Murayama, M. A., et al. CTRP6 is an endogenous complement regulator that can effectively treat induced arthritis. Nat Commun. 6, 8483(2015).
- Kadura, S., Raghu, G. Rheumatoid arthritis-interstitial lung disease: Manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 30 (160), 210011(2021).
- Mueller, A. L., et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies. Cells. 10 (11), 3017(2021).
- Sun, H., et al. Gut commensal parabacteroides distasonis alleviates inflammatory arthritis. Gut. 72 (9), 1664-1677 (2023).
- Li, Z. Y., Zhou, J. J., Luo, C. L., Zhang, L. M. Activation of tgr5 alleviates inflammation in rheumatoid arthritis peripheral blood mononuclear cells and in mice with collagen II-induced arthritis. Mol Med Rep. 20 (5), 4540-4550 (2019).
- Mccarthy, E. E., et al. Endogenous antigens shape the transcriptome and TCR repertoire in an autoimmune arthritis model. J Clin Invest. 135 (2), e174647(2024).
- Chen, J., et al. Annexin A1 attenuates cardiac diastolic dysfunction in mice with inflammatory arthritis. Proc Natl Acad Sci U S A. 118 (38), e2020385118(2021).
- Owada, T., et al. LAT1-specific inhibitor ameliorates severe autoimmune arthritis in skg mouse. Int Immunopharmacol. 109, 108817(2022).
- Zhang, A., et al. Nrf2 activation improves experimental rheumatoid arthritis. Free Radic Biol Med. 207, 279-295 (2023).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- Van Hees, M., et al. New approaches to moderate CRISPR-Cas9 activity: Addressing issues of cellular uptake and endosomal escape. Mol Ther. 30 (1), 32-46 (2022).
- Tyumentseva, M., Tyumentsev, A., Akimkin, V. CRISPR/Cas9 landscape: Current state and future perspectives. Int J Mol Sci. 24 (22), 16077(2023).
- Wu, F., et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol. 12, 750753(2021).
- Dunlap, G., et al. Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium. Nat Commun. 15 (1), 4991(2024).
- Okamoto, K., Takayanagi, H. Effect of T cells on. Bone. 168, 116675(2023).
- Wang, X. Q., et al. Dopamine D2 receptor on CD4+ T cells is protective against inflammatory responses and signs in a mouse model of rheumatoid arthritis. Arthritis Res Ther. 25 (1), 87(2023).
- Wang, X. Q., Liu, Y., Cai, H. H., Peng, Y. P., Qiu, Y. H. Expression of tyrosine hydroxylase inCD4+ T cells contributes to alleviation of Th17/Treg imbalance in collagen-induced arthritis. Exp Biol Med (Maywood). 241 (18), 2094-2103 (2016).
- Anaparti, V., et al. Increased frequency of TIGIT+ CD4 T cell subset in autoantibody-positive first-degree relatives of patients with rheumatoid arthritis. Front Immunol. 13, 932627(2022).
- Lei, Y., et al. Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis. Nat Commun. 15 (1), 113(2024).
- Jinno, S., et al. Comparison of retention of biologics in Japanese patients with elderly-onset rheumatoid arthritis-the answer cohort study. Rheumatology (Oxford). 64 (2), 509-516 (2025).
- Hagert, C., et al. Rapid spread of mannan to the immune system, skin and joints within 6 hours after local exposure. Clin Exp Immunol. 196 (3), 383-391 (2019).
- Cheng, W. J., et al. Deer velvet antler extracts exert anti-inflammatory and anti-arthritic effects on human rheumatoid arthritis fibroblast-like synoviocytes and distinct mouse arthritis. Am J Chin Med. 50 (6), 1617-1643 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten