Method Article
Ретроспективное стробирование сердца с помощью прототипа рентгеновского компьютерного томографа мелких животных
В этой статье
Резюме
Мы предоставляем исчерпывающее описание встроенного метода ретроспективного кардиологического гейтирования CrumpCAT, прототипа рентгеновского компьютерного томографа (КТ) мелких животных, разработанного и изготовленного в нашем научно-исследовательском институте.
Аннотация
CrumpCAT — это прототип рентгеновского компьютерного томографа (КТ) мелких животных, разработанный в нашем научно-исследовательском институте. КМОП-детектор с максимальной частотой кадров 29 Гц и аналогичные вольфрамовые рентгеновские источники с энергией от 50 кВ до 80 кВв широко используются в коммерчески доступных доклинических рентгеновских компьютерных приборах. Это делает описанную работу весьма актуальной для других учреждений, несмотря на общепринятое мнение о том, что эти детекторы не подходят для ограничения высоких частот сердечных сокращений мышей (~600 уд/мин). Сканер поддерживает визуализацию со средним (200 мкм) и высоким (125 мкм) разрешением, рентгеноскопию, ретроспективное респираторное гейтинг и ретроспективное кардиологическое гейтинг с итеративной или отфильтрованной проекцией изображения. Среди этих особенностей стробирование сердца является наиболее полезной функцией для изучения сердечных функций in vivo, поскольку оно эффективно устраняет размытие изображения, вызванное дыханием и движением сердца.
В данной статье мы описываем наш метод доклинической ретроспективной кардиозависированной компьютерной томографии, направленный на продвижение исследований в области анализа функции и структуры сердца in vivo . Кардиозависимый метод позволяет получить большое количество проекций за кратчайшее практическое время экспозиции (~20 мс), а затем ретроспективно извлекает дыхательные и сердечные сигналы из временных изменений в необработанных проекционных последовательностях. Эти сигналы используются для отбрасывания проекций, относящихся к фазе вдоха с высокой частотой движения дыхательного цикла, и для разделения оставшихся проекций на 12 групп, каждая из которых соответствует одной фазе сердечного цикла. Каждая группа реконструируется независимо с использованием итерационного метода для получения объемного изображения для каждой фазы сердца, в результате чего получается четырехмерный (4D) набор данных.
Эти фазовые изображения могут быть проанализированы как в совокупности, так и по отдельности, что позволяет детально оценить сердечную функцию. Мы продемонстрировали эффективность обоих подходов к функции кардиогатации прототипа сканера на основе репрезентативных результатов визуализации in vivo .
Введение
В исследованиях на мелких животных часто используется комбинация неинвазивных методов визуализации, при этом рентгеновская компьютерная томография (КТ) является важным выбором из-за ее зрелости, экономичности, скорости 1,2 и способности предоставлять дополнительную информацию наряду с другими методами, такими как позитронно-эмиссионная томография (ПЭТ)2,3 и однофотонная эмиссионная компьютерная томография (ОФЭКТ)2,4. Однако, как и другие методы визуализации, компьютерная томография подвержена физиологическим артефактам движения, вызванным биением сердца или дыханием, которые вносят размытость и ограничивают точность исследования.
Чтобы устранить это ограничение, размытие дыхания и сердечных движений может быть смягчено с помощью метода, известного как стробирование 5,6,7,8, при котором сбор данных синхронизируется с определенными фазами сердечного или дыхательного цикла (или воротами). Один из подходов к достижению этой цели, известный как перспективный стробирование 3,6, включает в себя прикрепление датчиков к животному для передачи сигналов стробирования в режиме реального времени на совместимый сканер. Несмотря на свою эффективность, этот метод является трудоемким и занимает много времени, особенно при прикреплении датчиков к груди и лапам мелких животных, таких как мыши, что ограничивает масштаб исследований. В качестве альтернативы, встроенное ретроспективное стробирование 7,9,10,11 предполагает получение данных временных рядов без использования датчиков, но путем выявления особенностей в данных, которые позволяют ретроспективно сортировать результаты на основе их фазы в сердечном или дыхательном цикле. Этот подход дает результаты, сравнимые с перспективным стробированием, но без необходимости в дополнительном оборудовании или усилиях, связанных с подключением импульсного датчика, и, следовательно, значительно упрощает экспериментальные протоколы.
В нашем методе доклинической компьютерной томографии сердца мы используем собственное ретроспективное стробирование для извлечения дыхательных и сердечных циклов из вариаций амплитуды в областях рентгеновских проекций, которые демонстрируют наиболее значительные изменения между последовательными кадрами. Чтобы облегчить этот процесс, шаблон грудной клетки мыши совместно регистрируется на первой заднепередней проекции с использованием Mutual Information12. После того, как шаблон установлен, интенсивность пикселей в окне рядом с диафрагмой суммируется для генерации суррогатного дыхательного сигнала, в то время как интенсивность пикселей вблизи миокарда суммируется для получения суррогатного сердечного сигнала. Затем эти сигналы фильтруются полосой пропускания во временной области, и каждому кадру в наборе данных присваивается дробный номер фазы (от 0 до 1) в зависимости от его дыхательной и сердечной фазы. Это позволяет выбирать или отклонять проекции в соответствии с их фазовыми значениями. Как правило, кадры, соответствующие фазе конца и выдоха дыхательного цикла (0,15 ≤ фазе < 0,85), сохраняются, в то время как кадры из фазы вдоха, где движение наиболее выражено, отбрасываются. Остальные кадры сгруппированы в 12 сердечных фаз, каждая из которых представляет 1/12 (0,083) сердечного цикла, и реконструируются в 3D-изображения с использованием итерационного метода (Ordered Subset Expectation Maximization [OSEM])13,14. Весь процесс обобщен на рисунке 1.
протокол
Протоколы экспериментов на животных были рассмотрены и одобрены Институциональным комитетом по уходу за животными и их использованию Калифорнийского университета в Лос-Анджелесе (UCLA). В этом протоколе использовались мыши C57BL/6J (8 недель, самец, 24-26 г). В этом исследовании использовался компьютерный томограф CrumpCAT (рис. 2), прототип, разработанный в нашем научно-исследовательском институте для доклинических исследований, который обеспечивает нам контроль и гибкость, необходимые для оптимизации протоколов сбора и реконструкции. Метод предполагает, что мыши, находящиеся под наркозом, будут иметь частоту сердечных сокращений не более 600 уд/мин и частоту дыхания от 20 до 180 вдохов/мин15.
1. Настройки оборудования
- Работа источника рентгеновского излучения при пиковом напряжении 50 кВ и постоянном токе 200 мкА.
- Установите объединение пикселей рентгеновской камеры на 2, а время экспозиции на наименьшее практическое значение (время экспозиции 20 мс плюс время чтения 14 мс для общего времени дискретизации 34 мс).
ПРИМЕЧАНИЕ: Опция без биннинга (группирование 1) имеет меньшую частоту кадров и, следовательно, не может использоваться для закрытой съемки. Максимальная частота кадров составляет около 30 кадров/с.
2. Подготовка животных
- Обезболивайте мышей смесью кислорода и газообразного изофлурана в концентрации 2,0%.
- Держите животных под наркозом в течение 10 минут перед компьютерной томографией, чтобы убедиться, что жизненно важные показатели стабильны и животные расслаблены, чтобы избежать любых движений тела во время сканирования. Судите о глубине анестезии мыши по отсутствию рефлекса защемления пальцев ног при сильном защемлении перепонки между пальцами ногтей.
- Для кардиозавистивной визуализации камер сердца необходимо внутривенно ввести 100 мкл контрастного вещества для КТ через хвостовую вену непосредственно перед компьютерной томографией (рис. 3A).
- Поместите мышь под наркозом в камеру компьютерной томографии (рисунок 3B).
3. Сбор данных
- Включите программу CrumpCAT.
- Незатворная компьютерная томография с высоким разрешением (125 мкм, биннинг 1) (Рисунок 4A)
- Введите идентификатор исследования в пользовательском интерфейсе.
- Выберите «Мышь Hi-Res» в раскрывающемся меню « Протокол ».
- Нажмите кнопку «Сканировать» в пользовательском интерфейсе, чтобы получить 720 проекций со временем экспозиции 80 мс/проекция.
- Незатворная компьютерная томография со средним разрешением (200 мкм, биннинг 2) (Рисунок 4B)
- Введите идентификатор исследования в пользовательском интерфейсе.
- Выберите «Стандартная мышь» в раскрывающемся меню « Протокол ».
- Нажмите кнопку «Сканирование » в пользовательском интерфейсе, чтобы получить 720 проекций с временем экспозиции 100 мс/проекция.
- Закрытая компьютерная томография (200 мкм, биннинг 2) (Рисунок 4C)
- Введите идентификатор исследования в пользовательском интерфейсе.
- Выберите «Кардиологическое стробирование » в раскрывающемся меню « Протокол ».
- Нажмите кнопку «Сканировать » в пользовательском интерфейсе и получите 21 600 проекций со временем экспозиции 20 мс/проекция.
4. Предварительная обработка данных
ПРИМЕЧАНИЕ: Шаги предварительной обработки требуются только для закрытых сборов. Все эти шаги выполняются автоматически программным обеспечением для реконструкции и не требуют вмешательства оператора.
- Извлечение сигнала
- Для совместной регистрации шаблона грудной клетки пусть небольшое изображение (шаблон), грубо представляющее грудную клетку мыши с ребрами, сердцем, легкими и печенью, будет автоматически зарегистрировано на первой рентгеновской проекции, максимизируя взаимную информацию12 между проекцией и шаблоном (рисунок 5).
ПРИМЕЧАНИЕ: В шаблоне выполняются только операции перевода, а совместно зарегистрированный шаблон используется для определения областей интереса (ROI) во всех проекциях. - Для извлечения дыхательного сигнала позвольте указать в шаблоне прямоугольный ROI (ROI-1), представляющий диафрагму и дыхательный сигнал, который должен быть сгенерирован путем суммирования интенсивностей пикселей внутри ROI-1 для каждой проекции (рис. 5).
- Для извлечения сердечного сигнала пусть в шаблоне рядом с сердцем будет обозначен второй прямоугольник ROI (ROI-2), а сердечный сигнал будет сгенерирован путем суммирования интенсивностей пикселей в ROI-2 для каждой проекции (рис. 5).
ПРИМЕЧАНИЕ: Шаблон грудной клетки регистрируется только на первой проекции, чтобы определить, какие строки и столбцы изображения (окна) должны использоваться для извлечения сигнала. Это окно достаточно широкое, чтобы охватить все проекции при условии, что животное находится в центре разумно, как в случае использования нашей кровати для животных16.
- Для совместной регистрации шаблона грудной клетки пусть небольшое изображение (шаблон), грубо представляющее грудную клетку мыши с ребрами, сердцем, легкими и печенью, будет автоматически зарегистрировано на первой рентгеновской проекции, максимизируя взаимную информацию12 между проекцией и шаблоном (рисунок 5).
- Полосовой фильтр
- Возможность создания полосового фильтра путем объединения двух функций Sinc с различными частотами среза во временной области17, которые соответствуют фильтрам нижних частот в частотной области, как описано ниже.
- Пусть программное обеспечение применит полосовой фильтр к сердечному сигналу, используя полосу частот [300, 600] мин-1 (рис. 6A).
ПРИМЕЧАНИЕ: Неотфильтрованный сердечный сигнал (Рисунок 6B) по-прежнему содержит значительный вклад дыхательных движений. - Аналогичным образом, пусть дыхательный сигнал фильтруется с использованием полосы частот [20, 300] мин-1. Высшие гармоники сохраняются для того, чтобы производить сигнал, который не является просто синусоидальным, а более четко идентифицирует две основные фазы: вдох и выдох.
Примечание: На этом этапе как дыхательные, так и сердечные сигналы могут быть легко интерполированы и рассматриваться как непрерывные функции времени с целью вычисления дробного числа фаз.
- Назначение фаз
- Программное обеспечение позволяет определить начало каждого цикла (дыхательного или сердечного), находя пересечения нуля первой производной сигнала. Каждое пересечение нуля соответствует максимуму в сигнале и знаменует начало нового цикла и окончание предыдущего. В качестве примера см. дыхательный сигнал на рисунке 7.
- Позвольте назначить дробное значение фазы (от 0 до 1) каждой проекции для каждого из двух сигналов (дыхательного или сердечного).
ПРИМЕЧАНИЕ: По определению, начальная точка имеет дробное значение фазы, равное нулю (для текущего цикла) или единице (для предыдущего цикла).
- Маски выделения
- Пусть будет создано 12 бинарных масок (по одной на фазу сердца) для выбора проекций, принадлежащих каждой фазе. Каждая маска содержит 21 600 записей (по одной на проекцию), которые имеют значение 0 или 1, что означает отклонение или сохранение этой проекции соответственно.
- Обратите внимание, что для каждой маски (фазы) программное обеспечение указывает, сохраняется ли проекция (1) или отбрасывается (0) в соответствии с ее дробным номером фазы. Для фазы 0 сохраняются проекции со значением сердечной фазы в интервале [0, 1/12]. Для фазы 1 сохраняются значения сердечной фазы в интервале [1/12, 2/12] и так далее.
- Обратите внимание, что для каждой маски (фазы) любые проекции с фазой дыхания меньше 0,15 или больше 0,85 отклоняются (0 в маске), поскольку они относятся к фазе вдоха, которая имеет наибольшее движение (рис. 8A). На рисунке 8B показано распределение сердечной фазы по проекциям в течение первых 2 с.
ПРИМЕЧАНИЕ: В этом процессе отбора не было внесено существенной систематической ошибки, поскольку количество прогнозов на фазу было относительно постоянным и составляло 1800 ± 194.
5. Реконструкция изображения
- Для нестробированной компьютерной томографии реконструируйте изображения со средним (200 мкм) или высоким (125 мкм) разрешением с использованием алгоритма обратной проекции с фильтром Feldkamp18 с фильтром Шеппа-Логана.
- Для кардиозависимых компьютерных томографов реконструируйте изображение каждой фазы сердца с использованием итерационного алгоритма OSEM13 с 12 подмножествами и 8 итерациями, принимая во внимание только выбранные проекции, участвующие в данной фазе (как указано в бинарной маске выбора фазы).
- Чтобы уменьшить шум, примените медианный фильтр после реконструкции во временном измерении (т. е. по изображениям) и световой 3D-гауссов фильтр в пространственном измерении (σ = 38 мкм).
ПРИМЕЧАНИЕ: Для реконструкции респираторно-зависимого изображения используйте все фазы сердца нечетко. Коррекция лучевого закаливания (водная коррекция) применяется к каждой конструкции.
6. Оценка изображения и количественная оценка объема левого желудочка (ЛЖ)
- Откройте изображение компьютерной томографии в программе просмотра DICOM, например Amide19 (Рисунок 9A).
- Увеличьте контрастность видимого изображения, установив значение CT (измеренное в единицах Хаунсфилда [HU]) на [-500, 500] (рис. 9A).
- Оценка качества изображения
- Нарисуйте ROI для кальцинированной области, которая определяется как область вокруг максимума со значением CT, большим или равным 85% от максимального значения HU (рис. 9B).
- Используйте отношение контраст/шум (CNR)20,21 в качестве метрики для оценки качества изображения и его способности идентифицировать небольшие структуры, такие как небольшие кальцинаты:
 ,
,
где I и σ представляют среднюю интенсивность и стандартное отклонение области: кальцификация (индекс C) или фон (индекс B).
- Количественная оценка объема левого желудочка
- Нарисуйте 3D-Freehand ROI, чтобы определить LV в каждой фазе (рис. 10A).
- Количественно оцените объем ЛЖ путем вычисления вокселей с пороговым значением CT 730 HU (рис. 10B). График объемов LV показан на рисунке 10C.
ПРИМЕЧАНИЕ: Пороговое значение CT не является абсолютным; Это зависит от используемого контрастного вещества, размера животного, штамма, состояния здоровья и времени между инъекцией и компьютерной томографией. Amide — это свободно распространяемое программное обеспечение, разработанное в нашем институте, но доступны и другие, более сложные программы просмотра изображений (например, ORS Dragonfly22).
Результаты
Сначала мы сравнили незатворные и стробированные КТ-изображения для визуализации кальциноза сердца у мышей (самцы, 30-32 г). Мышиная модель кальцификации сердца была создана путем индуцирования сердечного повреждения путем быстрого замораживания-оттаивания сердечной ткани (криотравма), как описано ранее23. При использовании протоколов компьютерной томографии без затвора кальцинаты сердца были более четко идентифицированы на изображении с высоким разрешением (125 мкм, биннинг 1) (рис. 11A). CNR составил 3,2 ± 0,3 и 4,0 ± 0,2 на изображениях со средним (200 мкм, биннинг 2) и высоким (125 мкм, биннинг 1) разрешениями соответственно. На закрытых изображениях (рис. 11B) CNR составил 4,2 ± 0,1 (только респираторно-зависимые) и 5,2 ± 0,4 (респираторные и кардиозависимые). Таким образом, респираторное гейтинг обеспечило только 5% улучшение по сравнению с изображениями с высоким разрешением (CNR 4.2 против 4.0). Напротив, сердечные ворота показали улучшение на 30% (5,2 против 4,0).
Затем мы использовали наш ретроспективный метод кардиозависированной компьютерной томографии для визуализации и количественной оценки объема ЛЖ во время сердечного цикла у мышей C57BL/6J. Чтобы лучше выявить изменение громкости ЛЖ во время сердечного цикла, цикл в виде короткого видео можно найти в дополнительном видео S1. В течение сердечного цикла объем ЛЖ в конце систолы составлял в среднем 14 ± 4 мм3 , в то время как в конце диастолы он составлял в среднем 33 ± 7 мм3 . Расчетные фракции выброса составляли в среднем 60 ± 4%. На рисунке 10C показан график объема LV для трех мышей. Кроме того, наш метод ретроспективной кардиозависированной компьютерной томографии полезен для неинвазивного мониторинга постинфарктной сердечной дисфункции на мышиных моделях острого ишемического повреждения сердца24.
Кроме того, у животных частота сердечных сокращений варьировалась от 315 до 425 уд/мин, а частота дыхания составляла от 25 до 50 вдохов/мин. Выдержки из дыхательных и сердечных сигналов, извлеченных из исходных проекций, показаны на рисунке 12. Исходный сердечный сигнал имеет меньшую амплитуду, чем дыхательный сигнал, и содержит часть дыхательного сигнала, который позже удаляется полосовым фильтром. Дополнительное видео S1 показывает бьющееся сердце и дает качественную оценку состояния сердца.

Рисунок 1: Графическая сводка по кардиоворотам. Сокращения: ЛЖ = левый желудочек; ROI = область интереса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Вид на CrumpCAT и его основные компоненты. Аббревиатура: CMOS = комплементарный металлоксидный полупроводник. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Подготовка животного происхождения. (А) Мыши вводят контрастное вещество, и (В) мышиная камера с температурой 37 °С используется для сканирования животных16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Пользовательский интерфейс программного обеспечения CrumpCAT. (A) Настройки пользовательского интерфейса для нестробированной компьютерной томографии с высоким разрешением (125 мкм, биннинг 1). (B) Настройки пользовательского интерфейса для нестробированной компьютерной томографии со средним разрешением (200 мкм, биннинг 2). (C) Настройки пользовательского интерфейса для стробированной компьютерной томографии (200 мкм, биннинг 2). Для работы со сканером пользователю необходимо: (1) ввести номер исследования, (2) выбрать протокол компьютерной томографии и (3) нажать кнопку «Сканировать ». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Шаблон грудной клетки (сердце, грудная клетка, печень), используемый для определения местоположения окон для извлечения дыхательных и сердечных сигналов. Аббревиатура: ROI = область интересов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
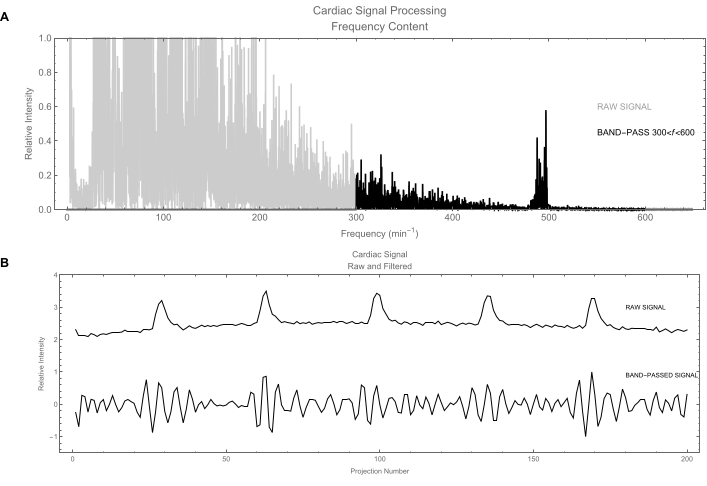
Рисунок 6: Сердечный сигнал. (А) Обработка сигнала в частотной области. Серая кривая показывает частотное содержание исходного сердечного сигнала, полученного путем вычисления его спектра мощности. Интересующие вас частоты составляют около 500 в минуту. Черная кривая показывает сигнал после применения полосового фильтра, чтобы сохранить только частоты от 300 до 600 уд/мин. (B) Вверху: График исходного сердечного сигнала во временной области. В этом сигнале преобладают дыхательные движения (большие колебания); Фактическим сердечным сигналом является слабое покачивание. Внизу: Отфильтрованная версия сердечного сигнала: дыхательный сигнал был удален, оставив чистый сердечный сигнал. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
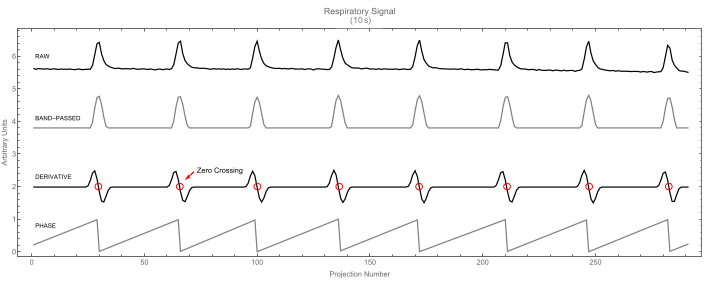
Рисунок 7: Дыхательный сигнал. Первичный дыхательный сигнал (вверху) и его полосовой вариант (второй). Производный сигнал (третий) отображается с выделением пересечений нуля. Они определяют пики дыхательного сигнала. В свою очередь, эти пики отмечают начало цикла (значение фазы 0), как показано на четвертом рисунке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
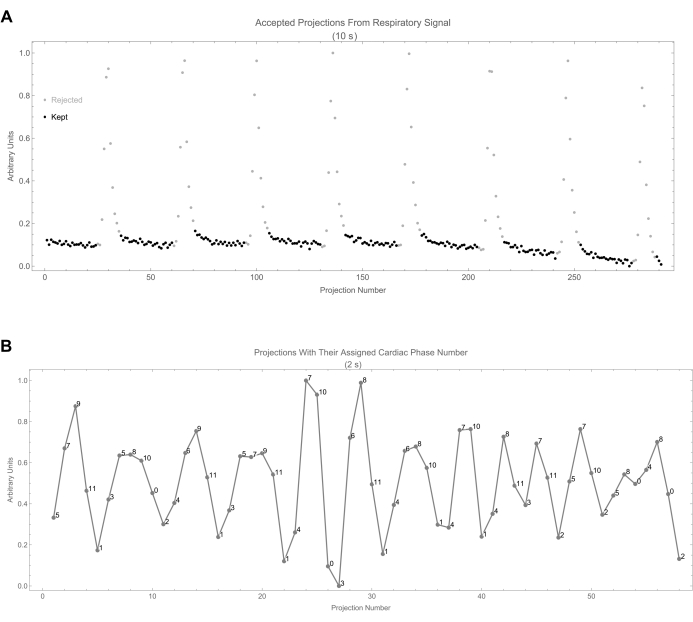
Рисунок 8: Выбор проекции. (A) Здесь показан дыхательный сигнал в зависимости от числа проекции. Принятые проекции обозначаются черными точками. (B) Показывает сердечный сигнал вместе с присвоенным сердечным фазовым номером каждой проекции. Номер фазы вычисляется на основе разницы во времени между проекцией и началом последнего цикла. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 9: Кальцинаты. (A) Файл изображения, отображаемый с помощью амида с шкалой серого и с окнами уровней CT-значений [-500, 500] HU. (Б) Процесс идентификации кальциноза: поперечный, корональный и сагиттальный виды незакрытых изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
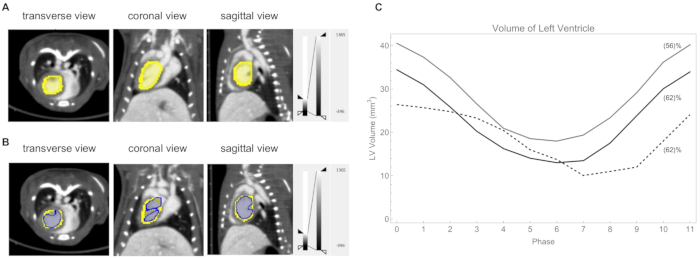
Рисунок 10: Анализ левого желудочка. (А) Левый желудочек очерчен вручную (желтый). Частота сердечных сокращений: 418 уд/мин, частота дыхания 39 вдохов/мин. (B) Порог левого желудочка при значении КТ 730 HU (синий). (В) График объема левого желудочка в каждой фазе цикла для трех мышей. Рассчитанная фракция выброса указана в скобках. Частота сердечных сокращений/дыхания у этих трех мышей составляла: серая линия 362 уд/мин и 53 вдоха/мин; черная линия 420 уд/мин и 59 вдохов/мин; пунктирная линия 315 ударов/мин и 45 вдохов/мин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 11: Сравнение отношения контраст/шум . (А) нестробированные изображения и (Б) стробированные изображения (частота сердечных сокращений: 408 уд/мин, частота дыхания: 49 вдохов/мин). Сокращения: CNR = отношение контраст/шум; R-гейт = респираторно-закрытый; C-gated = cardiac-gated. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
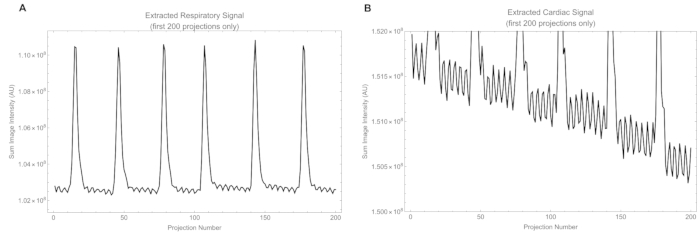
Рисунок 12: Выдержки из сигналов. (А) первичный дыхательный сигнал, полученный из интенсивности в дыхательном окне, и (В) первичный сердечный сигнал, извлеченный из интенсивности в сердечном окне. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительное видео S1: Кардиозависимый компьютерный киноцикл, показывающий изменение объема ЛЖ во время сердечного цикла у мыши. Частота сердечных сокращений: 418 уд/мин, частота дыхания: 39 вдохов/мин. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Конкретная аппаратная реализация, описанная здесь, представляет собой специально разработанную систему рентгеновской компьютерной томографии, уникальную для нашего института, но конкретный детектор широко используется в коммерчески доступных доклинических рентгеновских компьютерных приборах, что делает описанную работу актуальной для других учреждений. Эта система функционально является прототипом двух коммерчески доступных и широко используемых встроенных подсистем рентгеновской микрокомпьютерной томографии in vivo
в доклинических сканерах ПЭТ/КТ. Эти микрокомпьютерные томографы имеют общую архитектуру и производительность детектора (размер пикселя, чувствительность, DQE, частота кадров и т. д.). Этот же детектор также используется в доклинических системах ПЭТ/КТ и ОФЭКТ/КТ несколькими другими коммерческими производителями доклинических систем in vivo . Таким образом, характеристики детектора распределяются между значительной частью коммерчески доступных и установленных доклинических приборов ПЭТ/КТ и ОФЭКТ/КТ по всему миру. Таким образом, при правильном программировании все эти системы могут достигать одинаковой частоты кадров, что является критическим параметром, обеспечивающим описанную работу. В то время как большинство пользователей не имеют доступа к исходным данным для коммерчески закупаемых систем микрокомпьютерной томографии, описанная здесь работа может быть использована в качестве шаблона для пользователей и поставщиков доклинических инструментов in vivo , чтобы продемонстрировать, что возможно с ограниченным аппаратным обеспечением, уже включенным в эти инструменты.
В дополнение к детектору, вольфрамовые (W) рентгеновские источники также используются практически во всех коммерчески доступных доклинических системах ПЭТ/КТ с аналогичной алюминиевой фильтрацией, а также в рентгеновских лучах с энергией в диапазоне от 50 до 80 кВ. Термин кВп используется для описания спектра рентгеновских лучей, производимых номинальным напряжением в трубке, как пиковый потенциал напряжения, обеспечиваемый источником питания. Таким образом, самым важным параметром, различающимся между всеми этими системами, является мощность источника. В этой работе мощность источника (10 Вт) находится на нижнем уровне аналогичных источников W, используемых для доклинической визуализации in vivo . Поэтому более мощные источники должны работать как минимум так же хорошо, как в описанной работе и с меньшим шумом, или меньшим временем получения за счет повышенной дозы облучения.
Существует очень мало работ, в которых рассматривается стробирование в моделях мышей, так как общепринятое мнение заключается в том, что частота сердечных сокращений мыши (~600 ударов/мин или ~10 Гц) слишком высока для доступного оборудования. Эта частота сердечных сокращений предназначена для мышей в сознании либо в состоянии покоя, либо при полной физической нагрузке, поскольку мыши в первую очередь изменяют свою фракцию выброса и поддерживают частоту сердечных сокращений. Под наркозом частота сердечных сокращений снижается (300-500 уд/мин). Частота кадров детектора 29 Гц может полностью воспроизвести протяженность и диапазон периодического движения сердца при любой из этих скоростей. В основе лежит предположение, что нам необходимо удовлетворять критерию Найквиста для циклического движения сердца, для которого требуется частота кадров всего ~20 Гц при 600 ударах/мин (10 Гц). Конкретный OEM-детектор, который мы здесь использовали, также используется как минимум четырьмя независимыми производителями доклинических инструментов для ПЭТ/КТ, и, следовательно, эта работа действительно возможна со всеми этими инструментами.
Время рециркуляции крови у мышей составляет несколько секунд, и, как правило, требуется 2-3 минуты между введением контрастного вещества и фактическим временем начала сканирования, из-за положения животного над головой, а также из-за настройки рентгеновского и вращающегося гентри-оборудования/инициализации. Важным аспектом является то, что пользователь должен убедиться, что не откладывает начало сканирования, так как получение 21 000 проекций занимает около 10 дополнительных минут.
Продолжительность одной сердечной фазы в нашем исследовании составила от 12 до 15 мс. Учитывая, что наше время воздействия составляет 20 мс, некоторые перекрестные помехи между фазами неизбежны. Например, фаза 2 может включать от 5 до 8 мс (разделенных поровну) данных из соседних фаз (фазы 1 и 3), что потенциально может вызвать небольшое размытие в периоды быстрого движения, такие как диастола. Чтобы смягчить эту проблему, важно убедиться, что мышь правильно обезболивается, достигая частоты сердечных сокращений менее 600 уд/мин (10 Гц). Кроме того, надлежащая анестезия сведет к минимуму релаксационные движения в течение относительно длительного времени сканирования. Дозы облучения животного при стробированном и нестробном сканировании составили ~450 и 50 мГр соответственно.
Поскольку этот процесс сбора данных является компьютерным приложением в режиме реального времени, важно, чтобы программа сбора данных работала с наивысшим приоритетом и с минимальным количеством одновременных приложений. Несоблюдение этих мер предосторожности может привести к тому, что кадры изображения будут приниматься быстрее, чем компьютер может обработать, что приведет к переполнению и сбою сканирования.
Основным недостатком метода ретроспективного стробирования является то, что он отбрасывает некоторые данные, но с потерей данных можно справиться. На практике и при наличии в общей сложности 21 000 проекций данные значительно завышены в угловом направлении. Мы подтвердили, что ни на одном скане не было больших угловых зазоров, определенно намного меньших, чем расстояние в 0,5°, которое мы использовали для реконструкции изображения (720 проекций на 360°). Например, с нашей частотой кадров 29 кадров в секунду, дыханием мыши со скоростью 1/с и вето в 30% кадров, мы отклонили 8,7 кадров на вдох (т.е. размер зазора составляет 8,7 кадра)-8,7/21600 или 0,145° на промежуток. Кстати, именно поэтому был использован метод итерационной реконструкции, а не Фельдкампа. Вторичное потенциальное последствие отбрасывания данных (по сравнению с предполагаемым стробированием) заключается в том, что доза облучения может увеличиться, поскольку отсутствует аппаратный механизм затвора, блокирующий рентгеновский луч в периоды, на которые наложено вето (например, во время фазы вдоха). Однако для того, чтобы это было важным фактором, такие механизмы затвора должны быть полностью реализованы и активны во время предполагаемого стробирования.
Что касается метода реконструкции данных, то другие методы могут быть столь же хороши или даже лучше, чем наш текущий подход к OSEM, но цель этой работы не в том, чтобы получить наилучшие и наименее шумовые реконструкции. Вместо этого мы хотим продемонстрировать, что мы можем выполнить кардиологическое стробирование с помощью широко используемого детектора, который имеет относительно ограниченную частоту кадров и маломощный источник рентгеновского излучения. Мы обнаружили, что использование метода реконструкции OSEM хорошо работает в рамках ограничений нашего вычислительного оборудования и имеет хорошую рабочую реализацию.
В то же время наш метод имеет ряд преимуществ, в том числе простоту, так как не требует специального оборудования. Основным ограничивающим фактором для реализации нашего метода является максимальная частота кадров рентгеновской камеры (29 Гц) и наименьшее время экспозиции (20 мс). Камера широко используется в доклинических рентгеновских компьютерных приборах нескольких производителей и предложенный метод может быть использован с любым сканером, способным достичь этих параметров, даже не оснащенным для приема стробирующих сигналов. Кроме того, рентгеновские компьютерные томографии с менее мощными вольфрамовыми рентгеновскими источниками требуют более длительного воздействия, но не представляют собой непреодолимой проблемы. Кроме того, исследователям не требуется обширная подготовка и практика в прикреплении датчиков к мелким животным для получения информации о дыхании и пульсе, или в тонкой настройке запуска сигнала для сбора данных, как это необходимо при перспективном стробировании.
В то время как кальцинаты были видны по всем протоколам визуализации в нашем компьютерном томографе CrumpCAT, их CNR был самым высоким на стробированных изображениях, даже при более низком разрешении. Этот вывод свидетельствует о том, что сердечные ворота полезны не только для исследований, сосредоточенных на динамических аспектах бьющегося сердца, но и для исследований с участием небольших кальцинатов вблизи сердца или других анатомических частей, на которые влияет физиологическое движение, где повышенная четкость изображения имеет решающее значение.
Общее время реконструкции в ~30 раз превышает обычное время реконструкции из-за большего количества проекций и наличия 12 фаз. Тем не менее, этап обработки сигнала добавляет очень мало накладных расходов (<1%) к общему времени восстановления. Сам метод реконструкции может быть улучшен за счет использования того факта, что данные коррелируют между фазами. Совместная реконструкция (во времени) или использование методов глубокого обучения25 позволит получить изображения с меньшим уровнем шума и устранит необходимость в постреконструкционных медианных и гауссовских фильтрах.
Раскрытие информации
Доктор Ричард Ташеро является консультантом Sofie Biosciences и Xodus Imaging. Доктор Арион Ф. Хатзииоанну является основателем компании Sofie Biosciences.
Благодарности
Мы благодарим всех сотрудников Технологического центра доклинической визуализации Крампа Калифорнийского университета в Лос-Анджелесе за их помощь и поддержку. В частности, мы благодарим Микайлу Тамболин и Изабель Дэй за подготовку животных к компьютерной томографии сердца и благодарим Софию Шумилову за получение некоторых ROI левого желудочка во время исследования. Мы также благодарим докторов Арджуна Деба и Ицзе Вана (Калифорнийский университет в Лос-Анджелесе) за предоставление мышиных моделей острого ишемического повреждения сердца для микрокомпьютерной томографии кальцификации сердца. Эта работа поддержана грантом поддержки Онкологического центра NIH (2 P30 CA016042-44).
Материалы
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
Ссылки
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257 (2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019 (2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069 (2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095 (2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563 (2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. . Practical signal processing. , 81 (2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- . Dragonfly 2022.2 Available from: https://www.theobjects.com/dragonfly (2022)
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795 (2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены