Method Article
Солевой промыв для забора образцов иммунного микроокружения носа у собак
В этой статье
Резюме
Солевой раствор для промывания носа можно использовать для отбора проб иммунного микроокружения носа у собак. Поскольку этот подход является относительно неинвазивным и не разрушает ткани носа, его можно проводить серийно. Клетки и белки, собранные с помощью метода промывания носа, могут быть обработаны для различных лабораторных анализов.
Аннотация
Оценка местного иммунного микроокружения носовой полости собак может быть важна для изучения нормального состояния тканей и заболеваний, особенно тех, которые связаны с местным воспалением. Мы оптимизировали методику оценки локального иммунного микроокружения носа собак с помощью серийного промывания носа. Вкратце, когда собаки находятся под анестезией и находятся в положении лежа на грудине, предварительно подогретый стерильный физиологический раствор промывается в пораженную ноздрю с помощью гибкого мягкого резинового катетера. Обратный поток жидкости собирается в конические трубки, и этот процесс повторяется. Жидкости, содержащие вытесненные клетки и белки, объединяются, а объединенные образцы носового лаважа фильтруются через клеточное сетчатое фильтр для удаления крупного мусора и слизи. Образцы центрифугируются и клеточные гранулы выделяются для анализа. После обработки образцов анализы, которые могут последовать за промыванием носа, включают проточную цитометрию, транскриптомный анализ клеток с помощью объемного или одноклеточного секвенирования РНК и/или количественное определение цитокинов, присутствующих в жидкости для промывания.
Введение
У собак регулярно развиваются воспалительные заболевания носа на протяжении всей жизни. Основная причина острого или хронического ринита у собак может варьироваться от инфекционной (вирусной: например, грипп, парагрипп, герпесвирусы; бактериальные [например, Bordetella, микоплазмы], грибковые [например, аспергиллез, криптококкоз]; паразитарные [например, носовые клещи]) до опухолевых (например, синоназальные злокачественные новообразования, чаще всего карцинома или гистотипы саркомы) до инородных материалов (например, инородное тело, интраназальная миграция смещенных зубов) и пародонтоз. а также идиопатический воспалительный ринит у собак 1,2,3,4,5,6,7.
Помимо физикального осмотра, для оценки состояния синоназальной полости у собак с воспалением носа используются различные подходы. Процедуры визуализации могут включать рентгенограммы (стоматологической, черепной), компьютерную томографию (КТ) или магнитно-резонансную томографию (МРТ). Еще одним подходом к визуализации носовой полости является риноскопия. Забор образцов тканей может включать в себя взятие мазков из носа, образцов кисти или биопсии тканей, на основе которых может быть выполнена цитологическая и/или гистопатологическая оценка, а также сдачу образцов для грибковой или бактериальной культуры. Эти образцы могут быть получены различными способами, начиная от «слепой» выборки до риноскопии или расширенной визуализации под визуальным контролем, и приобретаться через ноздри, из носоглотки или с помощью хирургического подхода трепанации, ринотомии или синусотомии.
Промывание носа, которое включает в себя введение стерильного физиологического раствора в носовую полость, также используется для взятия проб из носовой полости собак в диагностических и терапевтических целях. Альтернативный вариант метода промывания носа, который использовался при опухолях носа, называется гидропульсацией носа, описываемой как принудительное промывание носа, которое может вытеснить большие образцы опухоли для диагностической оценки, а также обеспечить терапевтическое облегчение для улучшения клинических признаков, связанныхс раком носа.
Мы представляем здесь еще один вариант методики промывания носа с целью сбора и анализа клеток и белков иммунного микроокружения носа. Благодаря щадящему, относительно неинвазивному подходу мы оптимизировали эту технику промывания носа для серийного отбора образцов иммунного микроокружения носа. В испытаниях с участием собак с невоспаленными носовыми полостями, активной герпесвирусной инфекцией и синоназальными опухолями мы продемонстрировали полезность промывания носа для сбора и обработки образцов для последующего применения 9,10.
В данной рукописи мы описываем технику промывания носа солевым раствором для серийного отбора проб иммунного микроокружения носа у собак. Мы предоставляем детали протокола для эффективного получения образца для промывания носа с минимальным повреждением тканей, а затем обрабатываем образцы для различных анализов.
протокол
Эта процедура промывания носа была одобрена Институциональным комитетом по уходу за животными и их использованию Университета штата Колорадо и Советом по клиническому обзору (IACUC #2425). Схема метода промывания носа представлена на рисунке 1.
1. Подготовка к промыванию носа
- За день до процедуры промывания носа наполните пять шприцев объемом 20 мл стерильным физиологическим раствором (0,9% раствор хлорида натрия) и закройте колпачком. Поместите шприцы в инкубатор, установленный при температуре 37 °C, чтобы они могли нагреться в течение ночи.
2. Расположение собаки для промывания носа
- Обезболить собаку перед процедурой (например, с помощью внутривенного (IV) введения дексмедетомидина (1-4 мкг/кг) и буторфанола (0,2-0,5 мг/кг) через внутривенный катетер) с последующим введением пропофола в/в (2-5 мг/кг), титруемого до эффекта, для интубации; поддерживать анестезию с помощью 1-2% ингаляционного изофлурана для эффекта.) Подтвердите подходящую глубину анестезии, проверив пальпебральный ответ и тонус челюсти.
- Смажьте глаза, чтобы предотвратить пересыхание во время процедуры.
- Контролируйте сердечную телеметрию, артериальное давление, капнографию и показатели пульсоксиметрии на протяжении всей процедуры.
- Расположите собаку, находящуюся под наркозом, в положении лежачего за грудиной. Расположите голову собаки так, чтобы она была естественно и удобно наклонена вниз от края лечебного стола для оптимального сбора образцов для промывания носа.
- Надуйте манжету эндотрахеальной трубки, чтобы обеспечить плотное прилегание дыхательных путей.
3. Проведение промывания носа
- Разрежьте стерильный катетер из красной резины 8 FR у основания так, чтобы он плотно прилегал к одному из предварительно заполненных шприцев объемом 20 мл, содержащих теплый физиологический раствор. Измерьте стерильный катетер красного цвета таким образом, чтобы дистальный конец катетера при введении через ноздрю простирался примерно до середины носовой полости. При взятии образца опухоли носа используйте визуализацию или риноскопическое руководство, чтобы оценить расположение рострального аспекта носовой опухоли для измерения длины красного резинового катетера так, чтобы кончик простирался до рострального аспекта опухоли.
- Затем разрежьте катетер на кончике на определенную длину интраназального катетера так, чтобы кончик приземлился в соответствующем месте при введении в носовую полость. Тем не менее, предусмотрите дополнительную длину основания катетера, выходящего за пределы ноздри (длина катетера от точки фиксации шприца до входа в ноздрю, примерно 3-5 см). Нанести метку постоянным маркером на цокольный конец катетера для указания начальной точки, соответствующей входу в ноздрю; Заданная длина катетера будет охватывать интраназально, при этом кончик катетера будет расположен в нужном месте в носовой полости.
- Проведение процедуры промывания носа потребует участия двух человек. Назначьте одного человека (лицо А) ответственным за подачу катетера в носовую полость и введение лаважа, а другого человека (лицо Б) — за забор образца при его выходе из носа.
- Пусть человек А расположится перед головой собаки и под ней. С помощью рук в перчатках попросите человека А осторожно ввести кончик красного резинового катетера в медиальную сторону носовой полости и продвигать его до тех пор, пока метка на катетере не совпадет с наружной поверхностью ноздри. Во время этого процесса убедитесь, что катетер подключен к шприцу, содержащему подогретый стерильный физиологический раствор. Попросите человека Б провести коническую трубку объемом 50 мл ниже ноздри с установленным катетером.
- Человек А мягко закупоривает контралатеральную ноздрю и начинает вводить физиологический раствор в носовую полость медленным, устойчивым давлением или с помощью импульсной инфузии. Поскольку голова собаки расположена под углом вниз, человек Б собирает жидкость, которая вытекает из носовой полости под действием силы тяжести в коническую трубку объемом 50 мл.
- Повторите эту технику промывания носа в общей сложности до пяти 20 мл солевого смыва, меняя конические трубки, по мере необходимости, для сбора объединенных образцов. Запишите общий объем собранной жидкости для промывания носа по отношению к количеству физиологического раствора, введенного после завершения процедуры.
- После завершения, если собака находится под наркозом под наркозом, введите внутримышечно тот же объем атипамезола, который используется для дексмедетомидина, и дайте собаке восстановиться после анестезии. Чтобы быть осторожным, держите собаку в лежачем положении на грудине так, чтобы голова была опущена вниз, чтобы облегчить дополнительный дренаж остатков физиологического раствора из носового промыва.
4. Обработка образца для промывания носа
- Осторожно проведите вихревую и/или пипетку с образцами носового промывания, содержащимися в конических пробирках, чтобы разбить скопления мусора и клеток. Пропустите объединенные образцы промывания носа через фильтр для клеточного фильтра толщиной 70 мкм, чтобы удалить крупный мусор и слизь. Центрифугируйте образцы при давлении 300 × г в течение 5-10 минут до образования клеточной гранулы.
- Соберите надосадочную жидкость с помощью аспирации с помощью пипетки и поместите ее в чистую пробирку для анализа интересующих белков.
- Ресуспендируйте клеточные гранулы в фосфатно-солевом буфере (PBS) или предпочтительном растворе для анализа интересующих клеток.
- Чтобы очистить образцы от эритроцитов, проводят лизис хлорида аммония и калия (ACK) для сбора ядросодержащих клеток из носового лаважа11,12.
Результаты
При использовании этого метода промывания носа собранный образец будет выглядеть слегка мутным, возможно, с видимыми кусочками клеточного мусора и слизи при закручивании трубки. Образец будет считаться загрязненным периферической кровью, если процедура промывания непреднамеренно вызовет кровотечение, и образец будет окрашен в красный цвет. В то время как часть введенного физиологического раствора будет потеряна во время процедуры, отрицательный промывание будет рассмотрено, если введенный физиологический раствор не вытекает обратно из ноздри в трубку; Возможными причинами могут быть то, что головка не наклонена вниз настолько, чтобы обеспечить эффективный обратный поток, образец каудально или латерально вытекает через контралатеральную ноздрю, или красный резиновый катетер не закреплен плотно на шприце, и физиологический раствор вытекает наружу из точки соединения.
После успешного сбора образцов промывания носа у собак с раком носа ожидается количество ядросодержащих клеток в диапазоне от 1 × 106 × 106 , при этом 75-96% живых клеток. В качестве альтернативы, когда образцы промывания носа были успешно собраны у собак со здоровыми, невоспаленными носовыми полостями, количество клеток находилось в диапазоне от 7 × 105-2 × 106, с 6-16% живых клеток. Репрезентативное изображение цитологических образцов, полученных в результате взятия проб промывания носа у собак с опухолями, представлено на рисунке 2. Кроме того, на рисунке 3 представлена проточная цитометрическая оценка клеточных популяций, проанализированных из образцов промывания носа здоровых собак и собак-носителей опухолей. Можно было бы ожидать, что количество клеток и процент жизнеспособности ниже этих диапазонов будут указывать на то, что процедура промывания носа и сбор образцов не увенчались успехом. В таблице 1 обобщены результаты техники промывания носа, выполненной авторами, в отношении количества выполненных процедур, количества собак, состояния носовой полости (здоровая или с опухолью), количества ядросодержащих клеток, жизнеспособности клеток, полученных для процедуры, а также того, был ли образец промывания признан успешным или неудачным для последующего анализа. Для целей экспериментов, проведенных с образцами назального лаважа, включенными в таблицу 1, минимальный выход из числа клеток 150 000 был признан успешным сбором образцов для промывания носа.
При этой технике промывания носа для сбора клеток используется стерильный 0,9% физиологический раствор. В качестве альтернативы можно рассмотреть решение Гартмана (лактатное решение Рингера); однако образцы, собранные с помощью физиологического раствора или раствора Гартмана, должны быть протестированы, чтобы убедиться в сопоставимой жизнеспособности и результатах для интересующих клеток. Кроме того, альтернативой использованию красного резинового катетера у собак без опухоли может быть проведение промывания носа с помощью катетера Фолея. Хотя катетер Фолея не используется в представленной здесь технике промывания носа, использование катетера Фолея позволит надуть баллон на кончике катетера, окклюзируя носовую полость и предотвращая потерю жидкости каудально. Кроме того, хотя добавление гиалуронидазы в образец для промывания носа не было проверено в представленном здесь подходе, добавление гиалуронидазы в образец для промывания носа может рассматриваться как разрушение слизи, собранной в образце для промывания носа, и высвобождение большего количества клеток для анализа. Это также необходимо оптимизировать, чтобы гарантировать, что результаты не будут изменены добавлением гиалуронидазы в процедуру обработки промывания носа.
Опубликованные результаты, полученные в результате успешных процедур промывания носа, выполненных у собак, участвующих в клиническом исследовании рака у собак, представлены на рисунке 3, 10. Результаты, представленные на рисунке 3, являются результатом исследования, в котором изучалось влияние планового узлового облучения на местное иммунное микроокружение собак с синоназальными опухолями, опухоли которых облучались либо отдельно, либо в сочетании с облучением регионарных шейных лимфатических узлов. Благодаря серийному забору образцов носовой полости собак в клиническом исследовании с промыванием носа, проточный цитометрический анализ собранных клеток выявил значительное снижение популяций эффекторных Т-клеток в последний день лучевой терапии, когда регионарные лимфатические узлы облучались одновременно с синоназальной опухолью, по сравнению с собаками, получавшими лучевую терапию, направленную на опухоль, и регионарные лимфатические узлы были сохранены. Это демонстрирует полезность серийного отбора проб из носовой полости с помощью лаважа для исследования сдвигов в клеточных популяциях в разных точках и при различных условиях лечения.

Рисунок 1: Схема метода промывания носа. Подогретый стерильный физиологический раствор вводится в носовую полость собак, находящихся под наркозом, с помощью красного резинового катетера. Жидкость для промывания носа собирается в трубку, когда она вытекает из носа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Клеточный состав образца носового лаважа, взятого у собаки с опухолью носа. Репрезентативное изображение цитологических образцов, полученных в результате отбора проб из носового лаважа (500-кратное увеличение, модифицированное окрашивание по методу Райта-Гимзы). Нейтрофилы (стрелки) являются преобладающими клетками, также присутствуют несколько плоских эпителиальных клеток (стрелолист) и небольшие зрелые лимфоциты (выделены в квадратном поле). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
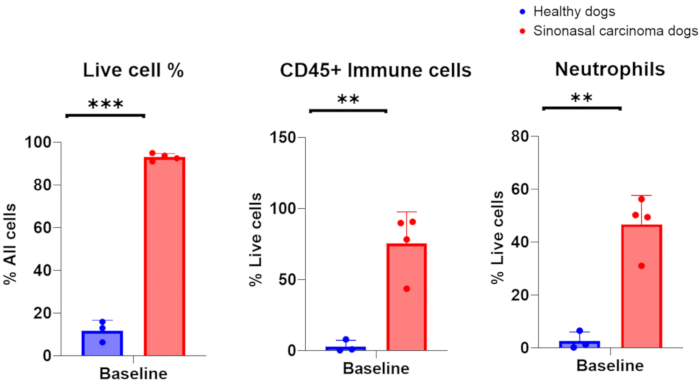
Рисунок 3. Проточный цитометрический анализ образцов промывания носа, взятых у здоровых собак и собак-носителей опухолей. Сравнение обилия живых клеток, иммунных клеток и нейтрофилов у здоровых собак (синий, n = 3) и собак с опухолевыми опухолями и синоназальной карциномой (красный, n = 4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
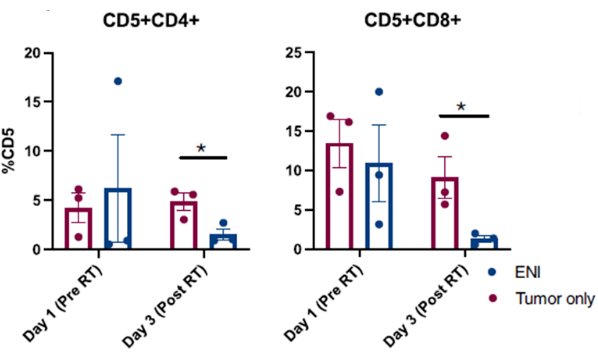
Рисунок 4: Проточный цитометрический анализ клеток, собранных из промывания носа у собак, участвующих в клиническом исследовании влияния планового узлового облучения (ЭНИ) на местное иммунное микроокружение. Количественное определение CD4 (CD5+CD4+) и CD8 (CD5+CD8+) Т-клеток из образцов носового лаважа. У собак, получавших ЭНИ одновременно с облучением опухоли (n = 3), наблюдалось значительное снижение эффекторных CD4 и CD8 Т-клеток в последний день облучения (день 3) по сравнению с собаками, получавшими облучение, направленное только на опухоль (n = 3). Эта цифра была изменена по материалам Darragh et al.10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Здоровый (n=3) | Опухолевая несущая среда (n= 19) | |
| Количество проведенных процедур | 3 | 80 |
| Количество ячеек | 0,7 х 106 - 2,8 х 106 | 1,6 х 106 - 210 х10 6; медиана: 8,7 x 106 |
| Жизнеспособность клеток | 6.3 - 15.9% | 75% - 96%; медиана: 87% |
| Процент успеха | 100% | 98.80% |
Таблица 1: Краткая информация о проведенных процедурах промывания носа и клеточных характеристиках полученных образцов.
Обсуждение
Протокол промывания носа включает в себя несколько важнейших этапов. Что касается собаки, проходящей процедуру промывания носа, собака должна находиться в достаточно глубокой плоскости анестезии, чтобы она не реагировала на установку катетера или введение лаважа. Если они реактивны под действием анестезии, это может поставить под угрозу качество и количество образцов для промывания носа, а также потенциально увеличить риск острого повреждения тканей носа из-за местной травмы от интраназального катетера или для собаки, аспирирующей жидкость для промывания мочи.
Положение головы собаки также имеет решающее значение для оптимального сбора образцов для промывания носа. Если угол наклона головы вниз недостаточен для зависимого от силы тяжести обратного потока закапанного физиологического раствора, жидкость для промывания носа может течь каудально, и образец может быть потерян через носоглотку. Кроме того, во время процедуры промывания носа важна четкая коммуникация между человеком А и лицом Б. Лицу Б может потребоваться быстрая регулировка для установки сборной трубки, поскольку жидкость вытекает из ноздри во время промывки человеком А; Видимость жидкости для промывания, поступающей в коническую трубку, может быть не совсем четкой как для лица А, так и для лица Б во время процедуры, поэтому активное общение на протяжении всего процесса является ключом к успешному сбору образцов. После того, как образец промывания носа был собран, если мы хотим сохранить жизнеспособность клеток для будущего анализа, крайне важно, чтобы клетки поддерживались в физиологическом растворе pH, таком как 0,9% физиологический раствор или 1x PBS.
В протокол промывания носа могут вноситься изменения на всех этапах сбора и обработки. Во время сбора образца глубина анестезии может быть отрегулирована таким образом, чтобы собака не реагировала на промывание носа. Это может быть достигнуто путем корректировки процентного содержания анестезирующего газа (например, изофлурана) или введения болюсного внутривенного анестетика короткого действия (например, пропофола).
Если после закапывания физиологического раствора в носовую полость в трубке собирается лишь небольшое количество жидкости, переместите голову собаки под углом вниз, чтобы она удобно лежала на краю стола, чтобы увеличить вероятность силы тяжести, позволяющей жидкости оттекать из носа. Если замечено, что жидкость оттекает из контралатеральной ноздри, плотно окклюзируйте контралатеральную ноздрю для последующих промываний. На этапе обработки, если исходное количество клеток образца невелико, повторно центрифугируйте надосадочную часть образца для сбора любых дополнительных клеток, которые могут присутствовать для увеличения общего выхода.
Существуют заметные ограничения в использовании метода промывания носа для анализа иммунного микроокружения носа у собак. При использовании этой техники образцы носового лаважа представляют собой набор поверхностных клеток и белков из носовой полости, которые легко вытесняются. Эти поверхностные клетки и белки могут быть не полностью репрезентативными для более глубоких тканей носового микроокружения собак. В настоящее время предпринимаются усилия по сравнению клеточных и белковых профилей собачьего промывания носа с образцами биопсии, чтобы определить сходства и различия в этих факторах между двумя методами отбора проб из носовой полости.
Несмотря на эти ограничения, метод промывания носа для отбора проб иммунного микроокружения носа у собак обеспечивает альтернативный подход к существующим методам. По сравнению с биопсией ткани или даже процедурой риноскопии, промывание носа является относительно неинвазивным для пациента-собаки. Сбор клеток и белков с помощью промывания носа по сравнению с биопсией тканей снижает риск клинически опасного, длительного или значительного острого кровотечения; После процедуры промывания носа также, вероятно, будет меньше местного воспаления и дискомфорта по сравнению с биопсией ткани носа. Из-за этого промывание носа может проводиться последовательно, чтобы собрать несколько образцов с течением времени для анализа. Кроме того, наблюдается большая относительная простота обработки образцов носового лаважа по сравнению с образцами биопсии тканей в отношении отделения клеточного компонента от белков в надосадочной жидкости для последующих лабораторных методов и анализов.
Метод промывания носа имеет потенциал для важного применения в областях исследований, связанных с иммунным микроокружением. В исследованиях рака был использован метод промыванияноса10 и может быть использован для документирования серийных изменений микроокружения носовой полости у собак-носителей опухолей в зависимости от условий лечения; Эти образцы промывания носа также могут оказаться ценными для корреляции сдвигов в иммунном микроокружении, чтобы лучше понять реакцию на лечение рака. Аналогичные аспекты исследования серийных изменений в назальном иммунном микроокружении могут быть изучены и исследованы в многочисленных областях ветеринарных клинических и трансляционных инфекционных и воспалительных исследований.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Описанная здесь техника промывания носа у собак была оптимизирована с помощью проектов, поддерживаемых K01 OD03109, премией CCTSI Colorado Pilot Grant Award, программой общих ресурсов Исследовательского совета колледжа CSU CVMBS и программой повышения карьеры CO HNC SPORE CA261605: Career Enhancement Program. Рисунок 1 был создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
Ссылки
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены