Method Article
Lavaggio salino per il campionamento del microambiente immunitario nasale canino
In questo articolo
Riepilogo
Il lavaggio nasale salino può essere utilizzato per campionare il microambiente immunitario nasale canino. Poiché l'approccio è relativamente non invasivo e non interrompe i tessuti nasali, può essere eseguito in serie. Le cellule e le proteine raccolte con la tecnica di lavaggio nasale possono essere processate per varie analisi di laboratorio.
Abstract
La valutazione del microambiente immunitario locale della cavità nasale canina può essere importante per studiare la normale salute dei tessuti e le condizioni di malattia, in particolare quelle associate all'infiammazione locale. Abbiamo ottimizzato una tecnica per valutare il microambiente immunitario nasale locale dei cani tramite lavaggio nasale seriale. In breve, con i cani sotto anestesia e posizionati in decubito sternale, la soluzione salina sterile preriscaldata viene lavata nella narice interessata utilizzando un catetere flessibile in gomma morbida. Il riflusso del fluido viene raccolto in tubi conici e questo processo viene ripetuto. I fluidi contenenti cellule e proteine rimosse vengono raggruppati e i campioni di lavaggio nasale raggruppati vengono filtrati attraverso un filtro cellulare per rimuovere detriti e muco di grandi dimensioni. I campioni vengono centrifugati e i pellet cellulari vengono isolati per l'analisi. Una volta che i campioni sono stati elaborati, le analisi che possono seguire il lavaggio nasale includono la citometria a flusso, l'analisi trascrittomica delle cellule tramite sequenziamento di RNA di massa o a singola cellula e/o la quantificazione delle citochine presenti nel liquido di lavaggio.
Introduzione
I cani sviluppano abitualmente condizioni nasali infiammatorie per tutta la vita. La causa alla base della rinite acuta o cronica nei cani può variare da infettiva (virale: ad esempio, influenza, parainfluenza, herpesvirus; batterica [ad esempio, Bordetella, micoplasmi], fungina [ad esempio, aspergillosi, criptococcosi]; parassitaria [ad esempio, acari nasali]) a neoplastica (ad esempio, neoplasie sinonasali, più comunemente istotipi di carcinoma o sarcoma) a materiale estraneo (ad esempio, corpo estraneo, migrazione intranasale di denti spostati) alla malattia parodontale, così come la rinite infiammatoria idiopatica canina 1,2,3,4,5,6,7.
Oltre all'esame fisico, vengono utilizzati vari approcci per valutare le condizioni della cavità sinonasale nei cani con infiammazione nasale. Le procedure di imaging possono includere radiografie (dentali, cranio), tomografia computerizzata (TC) o risonanza magnetica per immagini (MRI). Un altro approccio all'imaging della cavità nasale è la rinoscopia. Il campionamento dei tessuti può comportare l'acquisizione di tamponi nasali, campioni di spazzolino o biopsie tissutali, da cui è possibile eseguire la valutazione citologica e/o istopatologica, nonché l'invio del campione per la coltura fungina o batterica. Questi campioni possono essere ottenuti in una varietà di approcci, che vanno dal campionamento "alla cieca", alla rinoscopia guidata da immagini o all'imaging avanzato, e acquisiti attraverso le narici, dal rinofaringe o con un approccio chirurgico di trapanazione, rinotomia o sinusotomia.
La lavanda nasale, che prevede la somministrazione di soluzione fisiologica sterile nella cavità nasale, è stata utilizzata anche per il campionamento della cavità nasale canina a scopo diagnostico e terapeutico. Una versione alternativa della tecnica di lavaggio nasale che è stata utilizzata per i tumori nasali è chiamata idropulsione nasale, descritta come lavaggio nasale forzato, che può rimuovere grandi campioni tumorali per la valutazione diagnostica e fornire sollievo terapeutico per il miglioramento dei segni clinici associati al cancro nasale8.
Presentiamo qui un'altra versione della tecnica di lavaggio nasale allo scopo di raccogliere e analizzare cellule e proteine del microambiente immunitario nasale. Attraverso un approccio delicato e relativamente non invasivo, abbiamo ottimizzato questa tecnica di lavaggio nasale per il campionamento seriale del microambiente immunitario nasale. In studi che hanno coinvolto cani con cavità nasali non infiammate, infezione attiva da herpesvirus e tumori sinonasali, abbiamo dimostrato l'utilità del lavaggio nasale per la raccolta e l'elaborazione di campioni per applicazioni a valle 9,10.
In questo manoscritto, descriviamo una tecnica di lavaggio nasale salino per il campionamento seriale del microambiente immunitario nasale canino. Forniamo i dettagli del protocollo per acquisire il campione di lavaggio nasale in modo efficace con un'interruzione minima dei tessuti e quindi elaborare i campioni per una varietà di analisi.
Protocollo
Questa procedura di lavaggio nasale è stata approvata dal Comitato istituzionale per la cura e l'uso degli animali della Colorado State University e dal Comitato di revisione clinica (IACUC #2425). Uno schema del metodo di lavaggio nasale è presentato nella Figura 1.
1. Preparazione per la lavanda nasale
- Il giorno prima della procedura di lavaggio nasale, riempire cinque siringhe da 20 ml con soluzione fisiologica sterile (soluzione di cloruro di sodio allo 0,9%) e chiudere con un tappo. Metti le siringhe in un'incubatrice impostata a 37 oC in modo che possano riscaldarsi durante la notte.
2. Posizionamento del cane per il lavaggio nasale
- Anestetizzare il cane per la procedura (ad es. con iniezione endovenosa (IV) di dexmedetomidina (1-4 μg/kg) e butorfanolo (0,2-0,5 mg/kg) attraverso un catetere IV), seguita dalla somministrazione di propofol IV (2-5 mg/kg) titolato per effetto per l'intubazione; Mantenere l'anestesia con l'1-2% di isoflurano inalante per effetto.) Confermare la profondità appropriata dell'anestesia controllando la risposta palpebrale e il tono della mascella.
- Lubrificare gli occhi per evitare che si secchino durante la procedura.
- Monitorare i valori di telemetria cardiaca, pressione sanguigna, capnografia e pulsossimetria durante tutta la procedura.
- Posizionare il cane anestetizzato in decubito sternale. Posizionare la testa del cane in modo che sia inclinata in modo naturale e confortevole verso il basso rispetto al bordo del lettino per una raccolta ottimale dei campioni di lavaggio nasale.
- Gonfiare la cuffia del tubo endotracheale per garantire una tenuta ermetica delle vie aeree.
3. Esecuzione della lavanda nasale
- Tagliare un catetere sterile in gomma rossa da 8 FR alla base in modo che si adatti perfettamente a una delle siringhe preriempite da 20 ml contenenti la soluzione fisiologica calda. Misurare un catetere sterile in gomma rossa in modo che la punta distale del catetere si estenda fino a circa metà della cavità nasale quando viene introdotta attraverso la narice. Se si campiona un tumore nasale, utilizzare l'imaging o la guida rinoscopica per stimare la posizione dell'aspetto rostrale del tumore nasale per misurare la lunghezza del catetere di gomma rossa in modo che la punta si estenda fino all'aspetto rostrale del tumore.
- Quindi, tagliare il catetere sulla punta per la lunghezza definita del catetere intranasale in modo che la punta atterri nella posizione appropriata quando viene inserita nella cavità nasale. Tuttavia, lasciare una lunghezza aggiuntiva per la base del catetere che si estende all'esterno della narice (lunghezza del catetere dal punto di fissaggio della siringa all'ingresso della narice, circa 3-5 cm). Applicare un segno con un pennarello indelebile all'estremità di base del catetere per indicare il punto di partenza, corrispondente all'ingresso della narice; La lunghezza predeterminata del catetere si estenderà per via intranasale, con la punta del catetere posizionata nella posizione desiderata all'interno della cavità nasale.
- L'esecuzione della procedura di lavaggio nasale richiederà la partecipazione di due persone. Affidare a una persona (Persona A) la responsabilità di inserire il catetere nella cavità nasale e di somministrare il lavaggio e all'altra persona (Persona B) di raccogliere il campione quando esce dal naso.
- Fai posizionare la persona A davanti e sotto la testa del cane. Con le mani guantate, chiedi alla persona A di guidare delicatamente la punta del catetere di gomma rossa nella parte mediale della cavità nasale e di farlo avanzare fino a quando il segno sul catetere non si allinea con la faccia esterna della narice. Durante questo processo, assicurarsi che il catetere sia collegato alla siringa contenente la soluzione fisiologica sterile riscaldata. Chiedere alla persona B di tenere un tubo conico da 50 ml sotto la narice con il catetere in posizione.
- La persona A occlude delicatamente la narice controlaterale e inizia a infondere la soluzione salina nella cavità nasale con una pressione lenta e costante o con un'infusione pulsata. Poiché la testa del cane è posizionata con un angolo verso il basso, la persona B raccoglie il fluido che fuoriesce dalla cavità nasale per gravità nel tubo conico da 50 ml.
- Ripetere questa tecnica di lavaggio nasale per un massimo di cinque lavaggi salini da 20 ml, sostituendo le provette coniche, se necessario, per raccogliere i campioni raggruppati. Registrare il volume totale di liquido di lavaggio nasale raccolto rispetto alla quantità di soluzione salina infusa dopo il completamento della procedura.
- Una volta completato, se anestetizzato con dexmedetomidina, somministrare per via intramuscolare lo stesso volume di atipamezolo utilizzato per la dexmedetomidina e consentire al cane di riprendersi dall'anestesia. Per essere prudenti, tenere il cane in decubito sternale con la testa posizionata verso il basso per facilitare il drenaggio aggiuntivo di eventuali residui di soluzione salina dalla lavanda nasale.
4. Elaborazione del campione di lavaggio nasale
- Agitare delicatamente e/o pipettare i campioni di lavaggio nasale contenuti all'interno dei tubi conici per rompere i grumi di detriti e cellule. Far passare i campioni di lavaggio nasale raggruppati attraverso un filtro filtrante cellulare da 70 μm per rimuovere detriti e muco di grandi dimensioni. Centrifugare i campioni a 300 × g per 5-10 minuti per formare un pellet cellulare.
- Raccogliere il surnatante tramite aspirazione con una pipetta e depositarlo in una provetta pulita per l'analisi delle proteine di interesse.
- Risospendere i pellet cellulari in soluzione salina tamponata con fosfato (PBS) o in soluzione preferita per saggi cellulari di interesse.
- Per eliminare i globuli rossi dai campioni, eseguire la lisi di ammonio-cloruro-potassio (ACK) per raccogliere le cellule nucleate dal lavaggio nasale 11,12.
Risultati
Con questo metodo di lavaggio nasale, il campione raccolto apparirà leggermente torbido, possibilmente con pezzi visibili di detriti cellulari e muco quando il tubo viene fatto roteare. Un campione sarebbe considerato contaminato da sangue periferico se la procedura di lavaggio induce inavvertitamente sanguinamento e il campione si tinge di rosso. Mentre una parte della soluzione salina infusa andrà persa durante la procedura, si prenderebbe in considerazione un lavaggio negativo se la soluzione salina infusa non rifluisce dalla narice e nel tubo; Le potenziali cause potrebbero essere che la testa non è sufficientemente inclinata verso il basso per consentire un efficace riflusso, il campione è stato drenato caudalmente o lateralmente attraverso la narice controlaterale o il catetere di gomma rossa non è fissato saldamente alla siringa e la soluzione salina è fuoriuscita dal punto di connessione.
Quando i campioni di lavaggio nasale sono stati raccolti con successo da cani con cancro nasale, si prevede una conta delle cellule nucleate nell'intervallo di 1 × 10 6-200 × 106, con il 75-96% di cellule vive. In alternativa, quando i campioni di lavaggio nasale sono stati raccolti con successo da cani con cavità nasali altrimenti sane e non infiammate, la conta delle cellule è stata compresa tra 7 × 105-2 × 106, con il 6-16% di cellule vive. Un'immagine rappresentativa di campioni citologici ottenuti dal campionamento di lavaggio nasale di cani portatori di tumore è presentata nella Figura 2. Inoltre, nella Figura 3 viene presentata la valutazione citofluorimetrica delle popolazioni cellulari analizzate da campioni di lavaggio nasale di cani sani e portatori di tumore. Ci si aspetterebbe che la conta cellulare e la percentuale di vitalità inferiori a questi intervalli indichino che la procedura di lavaggio nasale e la raccolta del campione non hanno avuto successo. La Tabella 1 riassume i risultati della tecnica di lavaggio nasale eseguita dagli autori rispetto al numero di procedure eseguite, al numero di cani, alle condizioni della cavità nasale (sana o portatrice di tumore), alla resa della conta delle cellule nucleate, alla vitalità delle cellule ottenute per la procedura e al fatto che il campione di lavaggio sia stato considerato un successo o un fallimento per l'analisi a valle. Ai fini degli esperimenti eseguiti con i campioni di lavaggio nasale inclusi nella Tabella 1, una resa minima del numero di cellule di 150.000 è stata considerata una raccolta di campioni di lavaggio nasale di successo.
Con questa tecnica di lavaggio nasale, viene utilizzata soluzione fisiologica sterile allo 0,9% per raccogliere le cellule. In alternativa, si potrebbe prendere in considerazione la soluzione di Hartmann (soluzione di Ringer lattato); tuttavia, i campioni raccolti con soluzione salina o con la soluzione di Hartmann dovrebbero essere testati per garantire una vitalità e risultati comparabili per le cellule di interesse. Inoltre, un'alternativa all'uso di un catetere di gomma rossa nei cani non portatori di tumore potrebbe essere quella di eseguire il lavaggio nasale con un catetere di Foley. Sebbene non sia utilizzato nella tecnica di lavaggio nasale qui presentata, l'uso di un catetere di Foley consentirebbe il gonfiaggio del palloncino sulla punta del catetere, occludendo la cavità nasale e prevenendo la perdita di liquido caudalmente. Inoltre, sebbene non sia stato testato nell'approccio di elaborazione del lavaggio nasale qui presentato, l'aggiunta di ialuronidasi al campione di lavaggio nasale potrebbe essere considerata per rompere il muco raccolto nel campione di lavaggio nasale e liberare più cellule per l'analisi. Anche questo dovrebbe essere ottimizzato per garantire che i risultati non vengano alterati dall'aggiunta di ialuronidasi alla procedura di elaborazione del lavaggio nasale.
I risultati pubblicati ottenuti da procedure di lavaggio nasale eseguite con successo in cani arruolati in uno studio clinico sul cancro canino sono presentati nella Figura 310. I risultati presentati nella Figura 3 provengono da uno studio che indaga l'impatto dell'irradiazione linfonodale elettiva sul microambiente immunitario locale di cani con tumori sinonasali i cui tumori sono stati irradiati da soli o in combinazione con l'irradiazione regionale dei linfonodi cervicali. Attraverso il campionamento seriale della cavità nasale dei cani nello studio clinico con lavaggio nasale, l'analisi citofluorimetrica delle cellule raccolte ha rivelato una diminuzione significativa delle popolazioni di cellule T effettrici l'ultimo giorno di radioterapia quando i linfonodi regionali sono stati irradiati in concomitanza con il tumore sinonasale rispetto ai cani che hanno ricevuto radioterapia mirata al tumore e i linfonodi regionali sono stati risparmiati. Ciò dimostra l'utilità del campionamento seriale della cavità nasale con il lavaggio per studiare i cambiamenti nelle popolazioni cellulari in diversi punti e con diverse condizioni di trattamento.

Figura 1: Schema del metodo di lavaggio nasale. La soluzione salina sterile riscaldata viene infusa nella cavità nasale dei cani anestetizzati utilizzando un catetere di gomma rossa. Il liquido di lavaggio nasale viene raccolto in un tubo mentre fuoriesce dal naso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Composizione cellulare di un campione di lavaggio nasale raccolto da un cane con un tumore nasale. Immagine rappresentativa di campioni citologici ottenuti da campionamento di lavaggio nasale (ingrandimento 500x, colorazione di Wright-Giemsa modificata). I neutrofili (frecce) sono le cellule predominanti, con la presenza anche di alcune cellule epiteliali squamose (punta di freccia) e piccoli linfociti maturi (evidenziati nel riquadro quadrato). Clicca qui per visualizzare una versione più grande di questa figura.
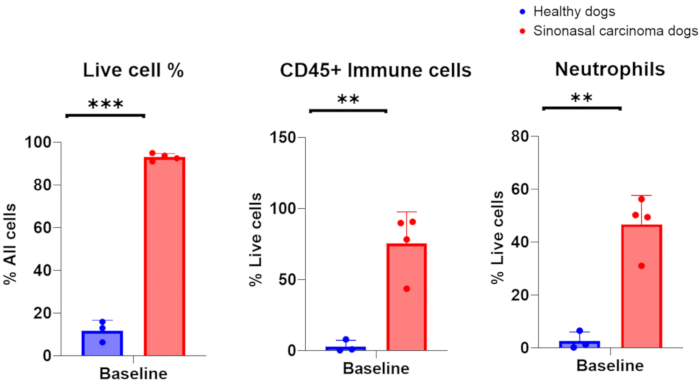
Figura 3. Analisi citofluorimetrica di campioni di lavaggio nasale prelevati da cani sani e portatori di tumore. Confronto dell'abbondanza di cellule vive, cellule immunitarie e neutrofili tra cani sani (blu, n = 3) e cani portatori di tumore con carcinoma sinonasale (rosso, n = 4). Clicca qui per visualizzare una versione più grande di questa figura.
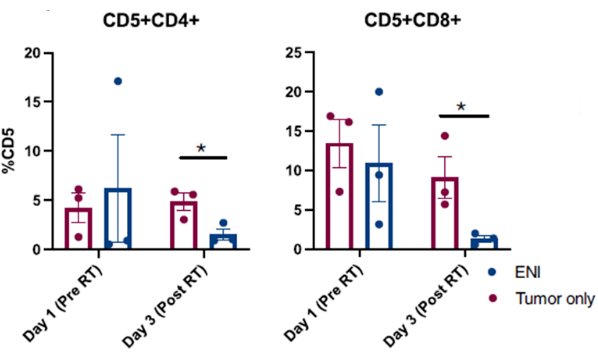
Figura 4: Analisi citofluorimetrica di cellule raccolte dal lavaggio nasale da cani arruolati in uno studio clinico che indaga l'impatto dell'irradiazione linfonodale elettiva (ENI) sul microambiente immunitario locale. Quantificazione delle cellule T CD4 (CD5+CD4+) e CD8 (CD5+CD8+) da campioni di lavaggio nasale. I cani trattati con ENI in concomitanza con l'irradiazione tumorale (n = 3) avevano cellule T effettrici CD4 e CD8 significativamente ridotte nell'ultimo giorno di radioterapia (Giorno 3) rispetto ai cani trattati con radiazioni mirate al solo tumore (n = 3). Questa cifra è stata modificata da Darragh et al.10. Clicca qui per visualizzare una versione più grande di questa figura.
| Integro (n=3) | Cuscinetto tumorale (n= 19) | |
| Numero di procedure eseguite | 3 | 80 |
| Conteggio delle celle | 0,7 x 106 - 2,8 x 106 | 1,6 x 106 - 210 x 106; mediana: 8,7 x 106 |
| Vitalità cellulare | 6.3 - 15.9% | 75% - 96%; mediana: 87% |
| Percentuale di successo | 100% | 98.80% |
Tabella 1: Riepilogo delle procedure di lavaggio nasale eseguite e delle caratteristiche cellulari dei campioni ottenuti.
Discussione
Ci sono diversi passaggi critici nel protocollo di lavaggio nasale. Per quanto riguarda il cane sottoposto alla procedura di lavaggio nasale, il cane deve trovarsi all'interno di un piano di anestesia sufficientemente profondo in modo da non reagire al posizionamento del catetere o alla somministrazione del lavaggio. Se sono reattivi in anestesia, ciò può compromettere la qualità e la quantità di raccolta del campione di lavaggio, oltre ad aumentare potenzialmente i rischi di lesione acuta del tessuto nasale a causa di traumi locali dal catetere intranasale o per il cane che aspira il liquido di lavaggio.
Anche il posizionamento della testa del cane è fondamentale per una raccolta ottimale dei campioni di lavaggio nasale. Se l'angolo verso il basso della testa è insufficiente per il riflusso dipendente dalla gravità della soluzione salina instillata, il liquido di lavaggio nasale può fluire caudalmente e il campione potrebbe essere perso attraverso il rinofaringe. Inoltre, una comunicazione chiara tra la persona A e la persona B è importante durante la procedura di lavaggio nasale. La persona B può richiedere regolazioni rapide per il posizionamento del tubo di raccolta, poiché il fluido fuoriesce dalla narice mentre la persona A sta sciacquando; La visibilità del fluido di lavaggio che scorre nel tubo conico potrebbe non essere del tutto chiara sia per la persona A che per la persona B durante la procedura, quindi la comunicazione attiva durante tutto il processo è fondamentale per il successo della raccolta del campione. Una volta raccolto il campione di lavaggio nasale, se si vuole preservare la vitalità cellulare per analisi future, è fondamentale che le cellule siano mantenute in una soluzione di pH fisiologico, come soluzione salina allo 0,9% o 1x PBS.
È possibile apportare modifiche al protocollo di lavaggio nasale durante le fasi di raccolta e lavorazione. Durante la raccolta del campione, la profondità dell'anestesia può essere regolata per garantire che il cane non reagisca alla lavanda nasale. Ciò può essere ottenuto regolando la percentuale del gas anestetico (ad es. isoflurano) o somministrando un bolo di anestetico endovenoso a breve durata d'azione (ad es. propofol).
Se dopo l'instillazione della soluzione salina nella cavità nasale, solo una piccola quantità di liquido viene raccolta nel tubo, riposizionare la testa del cane con un angolo verso il basso, in modo che poggi comodamente dal bordo del tavolo, per aumentare il potenziale di gravità per consentire al fluido di defluire dal naso. Se si nota che il liquido fuoriesce dalla narice controlaterale, occludere strettamente la narice controlaterale per i lavaggi successivi. Durante la fase di elaborazione, se il numero iniziale di cellule del campione è basso, centrifugare nuovamente la parte surnatante del campione per raccogliere eventuali cellule aggiuntive che potrebbero essere presenti per aumentare la resa totale.
Ci sono notevoli limitazioni all'utilizzo del metodo di lavaggio nasale per analizzare il microambiente immunitario nasale canino. Con questa tecnica, i campioni di lavaggio nasale sono una raccolta di cellule superficiali e proteine della cavità nasale che vengono facilmente rimosse. Queste cellule e proteine di superficie potrebbero non essere del tutto rappresentative dei tessuti più profondi del microambiente nasale canino. Sono in corso sforzi per confrontare i profili cellulari e proteici del lavaggio nasale canino con i campioni bioptici per determinare le somiglianze e le differenze in questi fattori tra le due tecniche di campionamento della cavità nasale.
Nonostante queste limitazioni, la tecnica di lavaggio nasale per il campionamento del microambiente immunitario nasale canino fornisce un approccio alternativo ai metodi esistenti. Rispetto a una biopsia tissutale o anche a una procedura di rinoscopia, il lavaggio nasale è relativamente non invasivo per il paziente canino. La raccolta di cellule e proteine tramite lavaggio nasale rispetto alla biopsia tissutale riduce i rischi di emorragia acuta clinicamente preoccupante, prolungata o significativa; Dopo la procedura di lavaggio nasale, è probabile che ci sia anche meno infiammazione locale e disagio rispetto a una biopsia del tessuto nasale. Per questo motivo, il lavaggio nasale può essere eseguito in serie per raccogliere più campioni nel tempo per le analisi. Inoltre, vi è una maggiore facilità relativa nell'elaborazione dei campioni di lavaggio nasale rispetto ai campioni di biopsia tissutale per quanto riguarda la separazione della componente cellulare dalle proteine all'interno del surnatante per i metodi e i saggi di laboratorio a valle.
Il metodo di lavaggio nasale ha il potenziale per importanti applicazioni in aree di ricerca associate al microambiente immunitario. Nella ricerca sul cancro, la tecnica del lavaggio nasale è stata utilizzata10 e può essere utilizzata per documentare cambiamenti seriali nel microambiente della cavità nasale nei cani portatori di tumore rispetto alle condizioni di trattamento; Questi campioni di lavaggio nasale possono anche rivelarsi preziosi per correlare i cambiamenti nel microambiente immunitario per comprendere meglio le risposte al trattamento del cancro. Aspetti simili dello studio dei cambiamenti seriali nel microambiente immunitario nasale possono essere esplorati e studiati per numerose aree di ricerca veterinaria, clinica e traslazionale, infettiva e infiammatoria.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
La tecnica di lavaggio nasale canino qui descritta è stata ottimizzata attraverso progetti supportati da K01 OD03109, CCTSI Colorado Pilot Grant Award, CSU CVMBS College Research Council Shared Resources Program e CO HNC SPORE CA261605: Career Enhancement Program. La Figura 1 è stata creata con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
Riferimenti
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon