Method Article
غسل المحلول الملحي لأخذ عينات من البيئة المكروية المناعية للأنف للكلاب
In This Article
Summary
يمكن استخدام غسل الأنف الملحي لأخذ عينات من البيئة المكروية المناعية للأنف للكلاب. نظرا لأن هذا النهج غير جراحي نسبيا ولا يعطل أنسجة الأنف ، فيمكن إجراؤه بشكل متسلسل. يمكن معالجة الخلايا والبروتينات التي تم جمعها من تقنية غسل الأنف لإجراء تحليلات معملية مختلفة.
Abstract
يمكن أن يكون تقييم البيئة المناعية الموحدة لتجويف أنف مهما للتحقيق في صحة الأنسجة الطبيعية والحالات المرضية ، خاصة تلك المرتبطة بالالتهاب الموضعي. لقد قمنا بتحسين تقنية لتقييم البيئة المكروية المناعية للأنف المحلية للكلاب عن طريق غسل الأنف التسلسلي. باختصار ، مع وجود تحت التخدير ووضعها في الاستلقاء القصي ، يتم شطف المحلول الملحي المعقم الدافئ مسبقا في فتحة الأنف المصابة باستخدام قسطرة مطاطية ناعمة مرنة. يتم جمع التدفق العكسي للسوائل في أنابيب مخروطية ، وتتكرر هذه العملية. يتم تجميع السوائل التي تحتوي على خلايا وبروتينات منزوعة ، ويتم ترشيح عينات غسل الأنف المجمعة من خلال مصفاة خلوية لإزالة الحطام والمخاط الكبير. يتم طرد العينات ويتم عزل كريات الخلية لتحليلها. بمجرد معالجة العينات ، تشمل التحليلات التي قد تتبع غسل الأنف قياس التدفق الخلوي ، والتحليل النسخي للخلايا عبر تسلسل الحمض النووي الريبي السائب أو أحادي الخلية ، و / أو القياس الكمي للسيتوكينات الموجودة في سائل الغسيل.
Introduction
تصاب بشكل روتيني بأمراض التهابية أنفية طوال حياتها. يمكن أن يتراوح السبب الكامن وراء التهاب الأنف الحاد أو المزمن في من المعدية (الفيروسية: على سبيل المثال ، الأنفلونزا ، نظير الأنفلونزا ، فيروسات الهربس ؛ البكتيرية [على سبيل المثال ، بورديتيلا ، الميكوبلازما] ، الفطريات [على سبيل المثال ، داء الرشاشيات ، داء المشفرات] ؛ الطفيلي [على سبيل المثال ، عث الأنف]) إلى الأورام (على سبيل المثال ، الأورام الخبيثة الجيبية ، الأكثر شيوعا الأنسجة النسيجية أو الساركوما) إلى المواد الغريبة (على سبيل المثال ، جسم غريب ، الهجرة داخل الأنف للأسنان النازحة) إلى أمراض اللثة ، وكذلك التهاب الأنف الالتهابي مجهول السبب للكلاب1،2،3،4،5،6،7.
بالإضافة إلى الفحص البدني ، يتم استخدام طرق مختلفة لتقييم حالة التجويف الجيبي العصبي في المصابة بالتهاب الأنف. قد تشمل إجراءات التصوير الصور الشعاعية (الأسنان والجمجمة) أو التصوير المقطعي المحوسب (CT) أو التصوير بالرنين المغناطيسي (MRI). طريقة أخرى لتصوير تجويف الأنف هي تنظير الأنف. يمكن أن يتضمن أخذ عينات الأنسجة الحصول على مسحات الأنف أو عينات الفرشاة أو خزعات الأنسجة ، والتي يمكن من خلالها إجراء التقييم الخلوي و / أو النسيجي المرضي ، بالإضافة إلى تقديم عينة للزراعة الفطرية أو البكتيرية. يمكن الحصول على هذه العينات في مجموعة متنوعة من الأساليب ، بدءا من أخذ العينات "العمياء" ، إلى التوجيه بالصور بتنظير الأنف أو التصوير المتقدم ، ويتم الحصول عليها من خلال الأنف ، من البلعوم الأنفي ، أو بنهج جراحي للتنقيب أو بضع الأنف أو بضع الجيوب الأنفي.
كما تم استخدام غسل الأنف ، الذي يتضمن إعطاء محلول ملحي معقم في تجويف الأنف ، لأخذ عينات من تجويف أنف لأغراض التشخيص والعلاج. يطلق على نسخة بديلة من تقنية غسل الأنف التي تم استخدامها لأورام الأنف اسم النبض المائي الأنفي ، والذي يوصف بأنه احمرار الأنف القوي ، والذي يمكن أن يزيح عينات الورم الكبيرة للتقييم التشخيصي بالإضافة إلى توفير الراحة العلاجية لتحسين العلامات السريرية المرتبطة بسرطانالأنف 8.
نقدم هنا نسخة أخرى من تقنية غسل الأنف للغرض المقصود هو جمع وتحليل الخلايا والبروتينات في البيئة المكروية المناعية للأنف. من خلال نهج لطيف وغير جراحي نسبيا ، قمنا بتحسين تقنية غسل الأنف هذه لأخذ عينات البيئة المكروية المناعية الأنفية التسلسلية. في التجارب التي شملت المصابة بتجاويف الأنف غير الملتهبة ، وعدوى فيروس الهربس النشطة ، وأورام الجيوب الأنفية ، أثبتنا فائدة غسل الأنف لجمع ومعالجة العينات للتطبيقات النهائية9،10.
في هذه المخطوطة ، نصف تقنية غسل الأنف الملحي لأخذ عينات متسلسلة من البيئة المكروية المناعية للأنف للكلاب. نحن نقدم تفاصيل البروتوكول للحصول على عينة غسل الأنف بشكل فعال مع الحد الأدنى من اضطراب الأنسجة ثم معالجة العينات لمجموعة متنوعة من التحليلات.
Protocol
تمت الموافقة على إجراء غسل الأنف هذا من قبل لجنة رعاية المؤسسي بجامعة ولاية كولورادو ومجلس المراجعة السريرية (IACUC # 2425). يتم تقديم رسم تخطيطي لطريقة غسل الأنف في الشكل 1.
1. التحضير لغسل الأنف
- في اليوم السابق لإجراء غسل الأنف ، املأ خمس محاقن سعة 20 مل بمحلول ملحي فسيولوجي معقم (محلول كلوريد الصوديوم 0.9٪) وأغلقه بغطاء. ضع المحاقن في حاضنة مضبوطة على 37 درجةمئوية حتى تسخن طوال الليل.
2. وضع لغسل الأنف
- تخدير للإجراء (على سبيل المثال ، عن طريق الحقن الوريدي (IV) من ديكسميديتوميدين (1-4 ميكروغرام / كغ) وبوتورفانول (0.2-0.5 مجم / كغ) من خلال قسطرة وريدية) ، متبوعا بإعطاء البروبوفول الوريدي (2-5 مجم / كغ) معايرة للتأثير على التنبيب ؛ الحفاظ على التخدير مع 1-2٪ من الأيزوفلوران المستنشق لتأثير.) تأكد من عمق التخدير المناسب عن طريق التحقق من الاستجابة الجفنية ونغمة الفك.
- قم بتليين العينين لمنع الجفاف أثناء العملية.
- مراقبة قيم قياس القلب عن بعد وضغط الدم وتصوير الرأسمالية وقياس التأكسج النبضي طوال العملية.
- ضع المخدر في الاستلقاء القصي. ضع رأس بحيث يكون بزاوية طبيعية ومريحة بزاوية لأسفل من حافة طاولة العلاج لجمع عينات غسل الأنف بشكل مثالي.
- قم بتضخيم سوار الأنبوب الرغامي لضمان إحكام إغلاق مجرى الهواء.
3. إجراء غسل الأنف
- قم بقص قسطرة مطاطية حمراء معقمة 8 FR في القاعدة بحيث تتناسب بشكل مريح مع إحدى المحاقن المعبأة مسبقا سعة 20 مل والتي تحتوي على المحلول الملحي الدافئ. قم بقياس قسطرة مطاطية حمراء معقمة بحيث يمتد الطرف البعيد للقسطرة إلى منتصف الطريق تقريبا إلى تجويف الأنف عند إدخاله من خلال فتحة الأنف. في حالة أخذ عينات من ورم أنفي، استخدم التصوير أو التوجيه بنظير الأنف لتقدير موقع الجانب المنقاري للورم الأنفي لقياس طول القسطرة المطاطية الحمراء بحيث يمتد الطرف إلى الجانب المنقاري للورم.
- بعد ذلك ، قم بقص القسطرة عند الطرف لطول القسطرة داخل الأنف المحدد بحيث يهبط الطرف في المكان المناسب عند إدخاله في تجويف الأنف. ومع ذلك ، اسمح بطول إضافي لقاعدة القسطرة الممتدة خارج فتحة الأنف (طول القسطرة من نقطة تثبيت المحقنة إلى مدخل فتحة الأنف ، حوالي 3-5 سم). ضع علامة بعلامة دائمة على الطرف الأساسي للقسطرة للإشارة إلى نقطة البداية ، المقابلة لمدخل فتحة الأنف ؛ يمتد طول القسطرة المحدد مسبقا داخل الأنف ، مع وضع طرف القسطرة في المكان المطلوب داخل تجويف الأنف.
- سيتطلب إجراء عملية غسل الأنف مشاركة شخصين. اجعل شخصا واحدا (الشخص أ) مسؤولا عن تغذية القسطرة في تجويف الأنف وإدارة الغسيل والشخص الآخر (الشخص ب) لجمع العينة عند خروجها من الأنف.
- اجعل الشخص أ يضع نفسه أمام رأس وتحته. بأيدي مرتدية القفازات ، اطلب من الشخص A توجيه طرف القسطرة المطاطية الحمراء برفق إلى الجانب الإنسي من تجويف الأنف وتقدمه حتى تصطف العلامة الموجودة على القسطرة مع الجانب الخارجي لفتحة الأنف. خلال هذه العملية ، تأكد من توصيل القسطرة بالمحقنة التي تحتوي على محلول ملحي معقم دافئ. اطلب من الشخص ب حمل أنبوب مخروطي سعة 50 مل أسفل فتحة الأنف مع وضع القسطرة في مكانها.
- الشخص أ يسد فتحة الأنف المقابلة برفق ويبدأ في ضخ المحلول الملحي في تجويف الأنف بضغط بطيء وثابت أو بتسريب نبضي. عندما يتم وضع رأس بزاوية هبوطية ، يقوم الشخص ب بجمع السائل الذي يخرج من تجويف الأنف عن طريق الجاذبية إلى الأنبوب المخروطي سعة 50 مل.
- كرر تقنية غسل الأنف هذه لما يصل إلى خمسة غسلات ملحية سعة 20 مل ، وتغيير الأنابيب المخروطية ، حسب الحاجة ، لجمع العينات المجمعة. سجل الحجم الإجمالي لسائل غسل الأنف الذي تم جمعه بالنسبة لكمية المحلول الملحي المنقوعة بعد الانتهاء من الإجراء.
- بمجرد الانتهاء ، إذا تم تخديره باستخدام ديكسميديتوميدين ، فقم بإعطاء نفس حجم الأتيباميزول عن طريق الحقن العضلي المستخدم في ديكسميديتوميدين ، والسماح للكلب بالتعافي من التخدير. لتوخي الحذر ، حافظ على في حالة استلقاء قصي مع وضع الرأس لأسفل لتسهيل تصريف إضافي لأي محلول ملحي متبقي من غسل الأنف.
4. معالجة عينة غسل الأنف
- قم بدوامة و / أو ماصة عينات غسل الأنف الموجودة داخل الأنابيب المخروطية برفق لتفتيت كتل الحطام والخلايا. مرر عينات غسل الأنف المجمعة عبر مرشح إجهاد خلية 70 ميكرومتر لإزالة الحطام والمخاط الكبير. الطرد المركزي للعينات عند 300 × جم لمدة 5-10 دقائق لتشكيل حبيبات خلية.
- اجمع المادة الطافية عن طريق الشفط باستخدام ماصة وقم بإيداعها في أنبوب نظيف لتحليل البروتينات ذات الأهمية.
- أعد تعليق كريات الخلايا في محلول ملحي مخزن بالفوسفات (PBS) أو المحلول المفضل لفحوصات الخلية ذات الأهمية.
- لإزالة خلايا الدم الحمراء من العينات ، قم بإجراء تحلل كلوريد الأمونيوم والبوتاسيوم (ACK) لجمع الخلايا المنواة من غسل الأنف11،12.
النتائج
باستخدام طريقة غسل الأنف هذه ، ستظهر العينة التي تم جمعها غائمة قليلا ، وربما مع قطع مرئية من الحطام الخلوي والمخاط عند تحريك الأنبوب. تعتبر العينة ملوثة بالدم المحيطي إذا أدى إجراء الغسيل إلى نزيف عن غير قصد ، وكانت العينة مشوبة باللون الأحمر. في حين أن بعض المحلول الملحي المنقوع سيفقد أثناء العملية ، سيتم النظر في الغسيل السلبي إذا لم يتدفق المحلول الملحي المنقوع مرة أخرى من فتحة الأنف إلى الأنبوب. قد تكون الأسباب المحتملة هي أن الرأس لا يميل إلى أسفل بما فيه الكفاية للسماح بالتدفق العكسي الفعال ، أو أن العينة قد تم تصريفها ذيليا أو جانبيا من خلال فتحة الأنف المقابلة ، أو أن القسطرة المطاطية الحمراء غير مثبتة بإحكام على المحقنة وتسرب المحلول الملحي إلى الخارج من نقطة الاتصال.
عندما يتم جمع عينات غسل الأنف بنجاح من المصابة بسرطان الأنف ، من المتوقع أن يكون عدد الخلايا ذات النواة في حدود 1 × 10 6-200 × 106 ، مع 75-96٪ من الخلايا الحية. بدلا من ذلك ، عندما يتم جمع عينات غسل الأنف بنجاح من ذات تجاويف الأنف الصحية وغير الملتهبة ، كان عدد الخلايا في حدود 7 × 105-2 × 106 ، مع 6-16٪ من الخلايا الحية. تظهر صورة تمثيلية للعينات الخلوية التي تم الحصول عليها من أخذ عينات غسل الأنف للكلاب الحاملة للورم في الشكل 2. بالإضافة إلى ذلك ، يتم عرض تقييم قياس التدفق الخلوي للمجموعات الخلوية التي تم تحليلها من عينات غسل الأنف للكلاب السليمة والحاملة للورم في الشكل 3. من المتوقع أن يشير عدد الخلايا والنسبة المئوية للبقاء أقل من هذه النطاقات إلى أن إجراء غسل الأنف وجمع العينات لم ينجحا. يلخص الجدول 1 نتائج تقنية غسل الأنف التي أجراها المؤلفون فيما يتعلق بعدد الإجراءات التي تم إجراؤها ، وعدد ، وحالة تجويف الأنف (السليم أو الحامل للورم) ، وإنتاجية عدد الخلايا المنواة ، وصلاحية الخلايا التي تم الحصول عليها للإجراء ، وما إذا كانت عينة الغسيل تعتبر ناجحة أو فاشلة في التحليل النهائي. لأغراض التجارب التي أجريت على عينات غسل الأنف المدرجة في الجدول 1 ، تم اعتبار الحد الأدنى لعدد الخلايا البالغ 150.000 جمع عينات ناجحة لغسل الأنف.
باستخدام تقنية غسل الأنف هذه ، يتم استخدام محلول ملحي معقم بنسبة 0.9٪ لجمع الخلايا. بدلا من ذلك ، يمكن النظر في حل هارتمان (محلول رينجر المرهب). ومع ذلك ، فإن العينات التي تم جمعها إما بالمحلول الملحي أو محلول هارتمان ستحتاج إلى الاختبار لضمان قابلية للحياة والنتائج المماثلة للخلايا ذات الأهمية. بالإضافة إلى ذلك ، يمكن أن يكون البديل لاستخدام قسطرة مطاطية حمراء في غير الحاملة للورم هو إجراء غسل الأنف باستخدام قسطرة فولي. على الرغم من عدم استخدامه في تقنية غسل الأنف المعروضة هنا ، فإن استخدام قسطرة فولي سيسمح بنفخ البالون عند طرف القسطرة ، مما يؤدي إلى انسداد تجويف الأنف ومنع فقدان السوائل الذيلي. أيضا ، على الرغم من عدم اختباره في نهج معالجة غسل الأنف المعروض هنا ، يمكن اعتبار إضافة الهيالورونيداز إلى عينة غسل الأنف لتفتيت المخاط الذي تم جمعه في عينة غسل الأنف وتحرير المزيد من الخلايا للتحليل. سيحتاج هذا أيضا إلى التحسين لضمان عدم تغيير النتائج عن طريق إضافة الهيالورونيداز إلى إجراء معالجة غسل الأنف.
يتم عرض النتائج المنشورة التي تم الحصول عليها من إجراءات غسل الأنف الناجحة التي تم إجراؤها في المسجلة في تجربة سريرية لسرطان في الشكل 3: 10. النتائج المعروضة في الشكل 3 مأخوذة من دراسة تبحث في تأثير التشعيع العقدي الاختياري على البيئة المناعية المحلية للكلاب المصابة بأورام الجيوب الأنفية التي تم تشعيع أورامها بمفردها أو بالاشتراك مع تشعيع العقدة الليمفاوية العنقية الإقليمية. من خلال أخذ العينات التسلسلية من تجويف الأنف للكلاب في التجربة السريرية مع غسل الأنف ، كشف تحليل التدفق الخلوي للخلايا التي تم جمعها عن انخفاض كبير في أعداد الخلايا التائية المستجيبة في اليوم الأخير من العلاج الإشعاعي عندما تم تشعيع الغدد الليمفاوية الإقليمية بالتزامن مع الورم الجيبي العصبي مقارنة بالكلاب التي تلقت العلاج الإشعاعي الذي يستهدف الورم وتم إنقاذ الغدد الليمفاوية الإقليمية. يوضح هذا فائدة أخذ عينات متسلسلة من تجويف الأنف مع الغسيل للتحقيق في التحولات في مجموعات الخلايا في نقاط مختلفة وبظروف علاج مختلفة.

الشكل 1: تخطيطي لطريقة غسل الأنف. يتم حقن محلول ملحي معقم دافئ في تجويف أنف المخدرة باستخدام قسطرة مطاطية حمراء. يتم جمع سائل غسل الأنف في أنبوب أثناء تصريفه من الأنف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التركيب الخلوي لعينة غسل الأنف التي تم جمعها من مصاب بورم في الأنف. صورة تمثيلية للعينات الخلوية التي تم الحصول عليها من أخذ عينات غسل الأنف (تكبير 500x ، صبغة Wright-Giemsa المعدلة). العدلات (الأسهم) هي الخلايا السائدة ، مع وجود عدد قليل من الخلايا الظهارية الحرشفية (رأس السهم) والخلايا الليمفاوية الصغيرة الناضجة (المميزة في المربع المربع). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
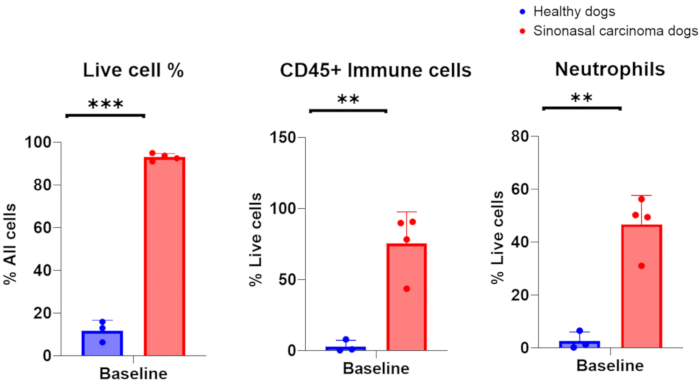
الشكل 3. تحليل قياس التدفق الخلوي لعينات غسل الأنف التي تم جمعها من السليمة والحاملة للورم. مقارنة وفرة الخلايا الحية والخلايا المناعية والعدلات بين السليمة (الأزرق ، ن = 3) الحاملة للورم المصابة بسرطان الجيوب الأنفية (أحمر ، ن = 4). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
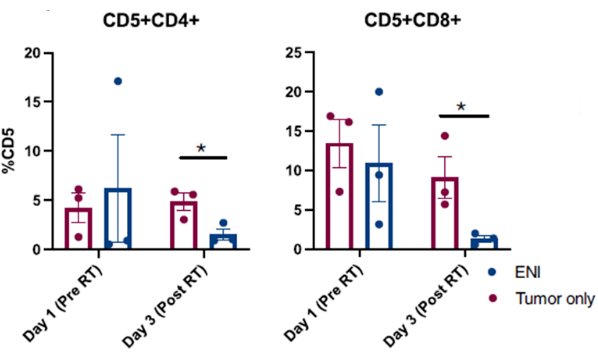
الشكل 4: تحليل قياس التدفق الخلوي للخلايا التي تم جمعها من غسل الأنف من المسجلة في تجربة سريرية تبحث في تأثير التشعيع العقدي الاختياري (ENI) على البيئة المناعية المكروية المحلية. القياس الكمي للخلايا التائية CD4 (CD5 + CD4 +) و CD8 (CD5 + CD8 +) من عينات غسل الأنف. التي عولجت ب ENI بالتزامن مع تشعيع الورم (ن = 3) قد انخفضت بشكل كبير من الخلايا التائية المستجيبة CD4 و CD8 في اليوم الأخير من الإشعاع (اليوم 3) مقارنة بالكلاب التي عولجت بالإشعاع الذي يستهدف الورم وحده (ن = 3). تم تعديل هذا الرقم من Darragh et al.10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| صحي (ن = 3) | تحمل الورم (ن = 19) | |
| عدد الإجراءات التي تم إجراؤها | 3 | 80 |
| عدد الخلايا | 0.7 × 106 - 2.8 × 106 | 1.6 × 106 - 210 × 106 ؛ المتوسط: 8.7 × 106 |
| صلاحية الخلية | 6.3 - 15.9% | 75% - 96%; المتوسط: 87٪ |
| معدل النجاح | 100% | 98.80% |
الجدول 1: ملخص إجراءات غسل الأنف التي تم إجراؤها والخصائص الخلوية للعينات التي تم الحصول عليها.
Discussion
هناك العديد من الخطوات الحاسمة في بروتوكول غسل الأنف. فيما يتعلق بالكلب الذي يخضع لعملية غسل الأنف ، يجب أن يكون ضمن مستوى عميق بما فيه الكفاية من التخدير حتى لا يتفاعل مع وضع القسطرة أو إدارة الغسيل. إذا كانت متفاعلة تحت التخدير ، فقد يضر ذلك بجودة وكمية جمع عينات الغسيل ، بالإضافة إلى احتمال زيادة مخاطر إصابة أنسجة الأنف الحادة بسبب الصدمة الموضعية من القسطرة داخل الأنف أو للكلب الذي يستنشق سائل الغسيل.
يعد وضع رأس أمرا بالغ الأهمية أيضا لجمع عينات غسل الأنف على النحو الأمثل. إذا كانت الزاوية الهابطة للرأس غير كافية للتدفق العكسي المعتمد على الجاذبية للمحلول الملحي المغرس ، فقد يتدفق سائل غسل الأنف ذيليا ، ويمكن أن تفقد العينة من خلال البلعوم الأنفي. بالإضافة إلى ذلك ، يعد التواصل الواضح بين الشخص A والشخص B أمرا مهما أثناء إجراء غسل الأنف. قد يطلب الشخص ب إجراء تعديلات سريعة لوضع أنبوب التجميع حيث يتم تصريف السائل من فتحة الأنف أثناء تنظيف الشخص أ. قد لا تكون رؤية سائل الغسيل المتدفق إلى الأنبوب المخروطي واضحة تماما لكل من الشخص A والشخص B أثناء الإجراء ، لذا فإن التواصل النشط طوال العملية هو المفتاح لجمع العينات بنجاح. بمجرد جمع عينة غسل الأنف ، إذا كان سيتم الحفاظ على صلاحية الخلية للتحليل المستقبلي ، فمن الأهمية بمكان الحفاظ على الخلايا في محلول الأس الهيدروجيني الفسيولوجي ، مثل محلول ملحي 0.9٪ أو 1x PBS.
يمكن إجراء تعديلات على بروتوكول غسل الأنف طوال مراحل الجمع والمعالجة. أثناء جمع العينات ، يمكن تعديل عمق التخدير لضمان عدم تفاعل مع غسل الأنف. يمكن تحقيق ذلك عن طريق تعديل النسبة المئوية لغاز التخدير (على سبيل المثال ، الأيزوفلوران) أو إعطاء بلعة من التخدير الوريدي قصير المفعول (على سبيل المثال ، البروبوفول).
إذا تم جمع كمية صغيرة فقط من السائل في الأنبوب بعد تقطير المحلول الملحي في تجويف الأنف ، فقم بإعادة وضع رأس بزاوية هبوطية ، بحيث يستقر بشكل مريح بعيدا عن حافة الطاولة ، لزيادة احتمالية الجاذبية للسماح للسائل بالتصريف من الأنف. إذا لوحظ أن السائل يتدفق من فتحة الأنف المقابلة ، فقم بإغلاق فتحة الأنف المقابلة بإحكام للغسيل التالي. أثناء مرحلة المعالجة ، إذا كان عدد خلايا العينة الأولي منخفضا ، فقم بإعادة الطرد المركزي للجزء الطافي من العينة لجمع أي خلايا إضافية قد تكون موجودة لزيادة العائد الإجمالي.
هناك قيود ملحوظة على استخدام طريقة غسل الأنف لتحليل البيئة المكروية المناعية للأنف للكلاب. باستخدام هذه التقنية ، تكون عينات غسل الأنف عبارة عن مجموعة من الخلايا السطحية والبروتينات من تجويف الأنف التي يمكن إزاحتها بسهولة. قد لا تكون هذه الخلايا السطحية والبروتينات ممثلة تماما للأنسجة العميقة للبيئة المكروية لأنف. تبذل الجهود لمقارنة الملامح الخلوية والبروتينية لغسل أنف بعينات الخزعة لتحديد أوجه التشابه والاختلاف في هذه العوامل بين تقنيتي أخذ عينات تجويف الأنف.
على الرغم من هذه القيود ، فإن تقنية غسل الأنف لأخذ عينات من البيئة المكروية المناعية للأنف للكلاب توفر نهجا بديلا للطرق الحالية. عند مقارنتها بخزعة الأنسجة أو حتى إجراء تنظير الأنف ، فإن غسل الأنف غير جراحي نسبيا لمريض. يقلل جمع الخلايا والبروتينات عن طريق غسل الأنف مقارنة بخزعة الأنسجة من مخاطر النزيف الحاد المثير للقلق سريريا أو المطول أو الكبير. بعد إجراء غسل الأنف ، من المحتمل أيضا أن يكون هناك التهاب موضعي وعدم راحة أقل عند مقارنته بخزعة أنسجة الأنف. لهذا السبب ، يمكن إجراء غسل الأنف بشكل متسلسل لجمع عينات متعددة بمرور الوقت لتحليلها. بالإضافة إلى ذلك ، هناك سهولة نسبية متزايدة في معالجة عينات غسل الأنف مقارنة بعينات خزعة الأنسجة فيما يتعلق بفصل المكون الخلوي عن البروتينات الموجودة داخل المادة الطافية للطرق المعملية والمقايسات النهائية.
طريقة غسل الأنف لديها القدرة على تطبيقات مهمة في مجالات البحث المرتبطة بالبيئة المكروية المناعية. في أبحاث السرطان ، تم استخدام تقنية غسل الأنف10 ويمكن استخدامها لتوثيق التغيرات المتسلسلة في البيئة المكروية لتجويف الأنف في الحاملة للورم بالنسبة لظروف العلاج ؛ قد تثبت عينات غسل الأنف هذه أيضا أنها ذات قيمة في ربط التحولات في البيئة المكروية المناعية لفهم الاستجابات لعلاج السرطان بشكل أفضل. يمكن استكشاف جوانب مماثلة للتحقيق في التغيرات المتسلسلة في البيئة المكروية المناعية الأنفية والتحقيق فيها للعديد من مجالات البحوث البيطرية والسريرية والانتقالية المعدية والالتهابية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم تحسين تقنية غسل الأنف للكلاب الموضحة هنا من خلال المشاريع التي تدعمها K01 OD03109 ، وجائزة CCTSI Colorado Pilot Grant ، وبرنامج الموارد المشتركة لمجلس أبحاث كلية CSU CVMBS ، و CO HNC SPORE CA261605: برنامج التحسين الوظيفي. تم إنشاء الشكل 1 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
References
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved