Method Article
Оптимизированная внутривенная инъекция взрослым рыбкам данио
В этой статье
Резюме
В данной работе мы представляем оптимизированный и эффективный протокол внутривенного введения клеток или фармакологических препаратов взрослым рыбкам данио, что приводит к усилению приживления клеток и увеличению выживаемости обработанных рыбок данио.
Аннотация
Внутривенная (IV) инъекция широко признана наиболее эффективным и широко используемым методом достижения системной доставки веществ в исследовательских моделях млекопитающих. Тем не менее, его применение у взрослых рыбок данио для доставки лекарств, трансплантации стволовых клеток, а также регенеративных исследований и исследований рака было ограничено из-за проблем, связанных с их маленьким размером тела и сложными кровеносными сосудами. Чтобы преодолеть эти ограничения, в прошлом были изучены альтернативные методы инъекций, такие как внутрисердечная и ретроорбитальная (РО) инъекции для трансплантации стволовых клеток взрослым рыбкам данио. Однако эти методы имеют свои недостатки, в том числе необходимость тщательных инъекционных техник или повышенный риск смертности.
В этом исследовании мы разработали усовершенствованную и оптимизированную процедуру внутривенного введения, специально предназначенную для взрослых рыбок данио, решая проблемы, связанные с их уникальной анатомией. Чтобы продемонстрировать эффективность этой методики, мы провели успешные внутривенные инъекции цельных клеток почечного мозга из рыб Tg (mpo: EGFP) и красителя FITC-декстрана взрослым рыбам каспер . Последующая визуализация введенных клеток и красителей с помощью флуоресцентного микроскопа подтвердила их успешную доставку и приживление у рыбок данио. Кроме того, мы продемонстрировали, что по сравнению с внутрисердечными инъекциями и инъекциями РО, внутривенная инъекция привела к улучшению показателей выживаемости и эффективности приживления у обработанных рыбок данио. Такой подход позволяет точно доставлять и локализовать вещества и обладает большим потенциалом для широкомасштабного скрининга лекарственных и химических веществ с использованием взрослых рыбок данио. Кроме того, возможность визуального отслеживания введенных клеток и красителей дает бесценную информацию об их приживлении, миграции и взаимодействии с тканями хозяина, что позволяет более всесторонне оценить терапевтические эффекты и биологические процессы на моделях рыбок данио.
Введение
Данио рерио (Danio rerio) стала ценным модельным организмом в биомедицинских исследованиях, в первую очередь благодаря своему генетическому сходству с человеком, при этом более 70% человеческих генов имеют аналоги данио-рерио 1,2. Это генетическое сходство в сочетании с компактными размерами рыбок данио, быстрым циклом развития и способностью к обширным генетическим манипуляциям делает их мощным инструментом для научных исследований. Эти характеристики особенно полезны для экспериментов, связанных с трансплантацией клеток, доставкой лекарств и отслеживанием клеток. Кроме того, оптическая прозрачность прозрачных личинок и специфических мутантов пигментации, таких как данио Каспер, позволяет точно визуализировать трансплантированные клетки или вещества, предлагая более эффективную и экономичную альтернативу традиционным животным моделям.
Рыбки данио широко используются для разработки моделей трансплантации рака и для проведения скрининга лекарств для лечения тяжелых заболеваний, таких как глиома, меланома, опухоли поджелудочной железы и лейкемия 3,4,5,6,7,8,9,10. Как правило, эти модели запускаются на личиночной стадии, чтобы воспользоваться незрелой иммунной системой личинок и присущей ей прозрачностью, что упрощает процесс инъекции и повышает осуществимость краткосрочных исследований. Однако использование личинок ограничивает продолжительность оценки приживления и терапевтических вмешательств 7,11. Перенос этих экспериментальных протоколов на взрослых рыбок данио создает такие проблемы, как более сложные процедуры инъекций, снижение эффективности приживления, более высокие показатели смертности и повышенная вариабельность индивидуальных реакций. Эти проблемы подчеркивают острую потребность в совершенствовании методов инъекций и доставки веществ, особенно для исследований с участием взрослых рыбок данио, которые требуют длительных периодов наблюдения.
Исторически сложилось так, что внутрисердечные инъекции12 и ретроорбитальные (РО) инъекции13 были основными методами доставки лекарств и трансплантации клеток у взрослых рыбок данио. Внутрисердечная инъекция, которая включает в себя введение веществ непосредственно в сердце, обеспечивает немедленную системную циркуляцию лекарств, но связана со значительными рисками, включая потенциальное повреждение сердца и высокую смертность. С другой стороны, инъекция обратного осмоса, которая доставляет материалы в венозный синус за глазом, также способствует быстрому системному распределению, но может быть стрессом для рыб и требует высокой точностивыполнения. Внутривенные инъекции, хорошо зарекомендовавшие себя для системной доставки веществ мышам и крысам, имеют решающее значение для исследований фармакокинетики, оценки эффективности лекарств и терапевтических вмешательств в этих моделях 15,16,17,18. В последнее время внутривенные инъекции приобрели известность в исследованиях рыбок данио, особенно в исследованиях врожденных иммунных реакций19,20 и острого повреждения почек21 у личинок данио-рерио. Тем не менее, их применение у взрослых рыбок данио остается ограниченным.
В этом исследовании мы разработали и оптимизировали процедуру внутривенной инъекции, специально предназначенную для взрослых рыбок данио, которая значительно улучшает показатели выживаемости, точность и эффективность доставки. Мы наглядно демонстрируем этот метод и предоставляем подробный протокол с использованием этой усовершенствованной методики. Мы успешно провели внутривенные инъекции клеток цельного почечного мозга (WKM) из рыбы Tg (mpo: EGFP) и красителя FITC-декстрана взрослым рыбам Casper , с подтверждением доставки и приживления, оцененным с помощью флуоресцентной микроскопии. Наши результаты показывают, что усовершенствованная техника внутривенного введения является более эффективной и последовательной по сравнению с традиционными внутрисердечными методами и методами РО. Поскольку использование рыбок данио в научных исследованиях продолжает расширяться, внедрение этой усовершенствованной техники внутривенных инъекций, вероятно, улучшит наше понимание патогенеза заболевания и ускорит разработку новых терапевтических подходов.
протокол
Все процедуры на животных были одобрены Комитетом по использованию лабораторных и исследовательских животных (CULATR) при Университете Гонконга (HKU).
1. Подготовка инъекционного материала
- Приготовьте клеточную суспензию: 0,9x PBS + 5% фетальная бычья сыворотка (FBS) + 1% пенициллин/стрептомицин (Pen/Strep).
- Стерилизуйте шприц Hamilton и прикрепленную к нему иглу (34 G, длина 10 мм, емкость 10 мкл, см. Таблицу материалов) под воздействием ультрафиолетового излучения с длиной волны 270-280 нм и экспонируйте предметы в течение 2 часов.
- Подготовьте стерилизованные ватные палочки, поролоновые диски и папиросную бумагу.
- Приготовьте смесь для анестезии, разбавив трикаин стерилизованной рыбьей водой до конечной концентрации 0,2 мг/мл.
- Для трансплантации клеток WKM рыбе Каспер за 2 дня до трансплантации вводят сублетальную дозу облучения 25 Гр, разделенную на два сеанса по 12,5 Гр каждый, проводят в один и тот же день с интервалом 7-8 ч между дозами. Для процесса облучения поместите 5-10 взрослых рыб в чашку Петри диаметром 100 мм с рыбьей водой и облучите их гамма-облучателем.
ПРИМЕЧАНИЕ: Доза была определена как сублетальная на основе анализа выживаемости после воздействия на рыбу Каспер различных уровней облучения до 35 Гр, контролируемых в течение 30 дней (Рисунок 1A). Точная продолжительность воздействия должна быть откалибрована в соответствии с настройками облучателя. Облучение не требуется для процедур, связанных только с доставкой лекарств. - Используйте лабораторный автоклавный паровой стерилизатор для стерилизации воды для рыб, предназначенных для содержания обработанных рыб (см. Таблицу материалов), чтобы предотвратить инфекции и обеспечить безопасную среду восстановления для рыб после инъекции.
ПРИМЕЧАНИЕ: Процесс стерилизации адаптирован к конкретному используемому автоклавному блоку, и мы придерживаемся рекомендаций производителя по автоклавированию жидких растворов для приготовления рыбной воды. - Приготовьте буфер для промывки игл: несколько пробирок с 75% этанолом и сверхчистой водой в микроцентрифужных пробирках объемом 1,5 мл.
- Приготовьте буфер для трансплантации, растворив FITC-Dextan (молекулярная масса: 10 000) в предварительно приготовленной клеточной суспензионной среде (0,9x PBS с 5% FBS и 1% Pen/Strep). Отрегулируйте концентрацию до 100 мкг/мл.
ПРИМЕЧАНИЕ: Этот буфер будет использоваться для инъекций, с планируемым объемом 2 мкл на одну рыбу.
2. Подготовка цельного почечного мозга к трансплантации
- Усыпьте необходимое количество рыб Tg(mpo: EGFP), погрузив их в раствор трикаина 0,4 мг/мл, следя за тем, чтобы они оставались в растворе не менее 10 минут после прекращения оперкулярного движения.
- Препарировать рыбу Tg(mpo: EGFP) для выделения и переноса костного мозга (KM) в среду клеточной суспензии в микроцентрифужной пробирке объемом 1,5 мл, как описано ранее22.
- Разукрупните клетки KM путем пипетирования и фильтрации суспензии через нейлоновое сетчатое фильтр 40 мкм.
- Центрифугируйте суспензию при 500 × г в течение 8 мин.
- Выбросьте надосадочную жидкость и повторно суспендируйте гранулу в 500 μл клеточной суспензионной среды.
- Подсчитайте клетки с помощью автоматического счетчика с аликвотой 10 мкл клеточной суспензии.
- Снова центрифугируйте при 500 × г в течение 8 мин.
- Отрегулируйте концентрацию клеток до 150 000 клеток/мкл с помощью буфера для трансплантации.
3. Процедура инъекции
- Перед инъекцией тщательно промойте шприц Hamilton 3-4 раза с 75% этанолом. Промойте шприц 3-4 раза сверхчистой водой, чтобы удалить остатки этанола.
- Вводите анестезию рыбкам данио, погружая их в смесь для анестезии до тех пор, пока они полностью не обезболится, что проявляется в уменьшении движений и потере рефлекторных реакций. После того, как рыбы будут усыплены, расположите их спинной стороной вверх, а голову — влево (Рисунок 1B). Аккуратно разложите рыбок на чистую влажную папиросную бумагу, которая поможет стабилизировать их для укола. Убедитесь, что ткань достаточно влажная, чтобы рыбка не высыхала, но не настолько влажная, чтобы вызвать скольжение.
- Крепко возьмитесь за шприц Hamilton и направьте иглу под углом ~45° к основному сосуду (каудальной вене), чтобы эффективно нацелиться на него, сводя к минимуму повреждение окружающих тканей. Для рыбки данио Капсер нацельтесь на ту часть сосуда, которая видна через его полупрозрачное тело для точного размещения иглы (Рисунок 1B). Для рыбок данио дикого типа (Тюбинген, TU) с пигментированной кожей следует выбирать первичные сосуды, которые расположены вдоль оси тела и позади анального отверстия в области первичных сосудов (рис. 1B). Осторожно и плавно введите иглу в предназначенный сосуд, вводите инъекцию (2 мкл) медленно, чтобы свести к минимуму напряжение, обеспечить оптимальное усвоение вещества, и мягко надавите на это место ватной палочкой в течение 10 с, чтобы остановить кровотечение после инъекции.
- Наблюдайте под микроскопом, чтобы подтвердить наличие сигналов GFP, обеспечивая эффективность инъекции. Убедитесь, что клетки или красители проявляются в виде зеленых сигналов внутри сосуда (рисунок 2A).
- Дайте рыбам восстановиться в только что стерилизованной воде для рыб после инъекции в течение 10 минут до перевода в статический аквариум.
- Очистите иглу, как описано ранее, между инъекциями различных реагентов.
- Чтобы предотвратить слипание клеток, каждые 10 минут взбивайте клеточную суспензию для ресуспендирования клеток.
- В течение всего периода лечения в аквариуме объемом 4 л содержится не более 15 пересаженных рыб. В качестве альтернативы можно разместить пересаженных рыб по отдельности в статических резервуарах объемом 1 л. Оснастите бак кислородным насосом и выполняйте ежедневную подмену воды, чтобы свести к минимуму риск заражения.
- Мониторинг и оценка экспрессии GFP с помощью проточной цитометрии у рыб примерно через 14 дней после трансплантации для оценки скорости приживления. Записывайте суточную смертность рыб, чтобы точно рассчитать показатели выживаемости. Выполните однофакторный ANOVA для анализа приживления и логарифмический ранговый тест для анализа выживаемости.
Результаты
Для оценки эффективности и точности различных методов инъекций взрослым рыбам каспер был проведен сравнительный анализ с использованием внутрикардиальных, RO и внутривенных техник (рис. 2A). Вводили различные количества клеток WKM из рыб Tg(mpo: EGFP), каждое из которых смешивали с красителем FITC-декстрана в концентрациях 1 × 105 и 3 × 105 клеток. Успех каждого метода определялся путем немедленной микроскопической оценки наличия сигнала GFP после инжекции. Результаты показали значительные различия в успешности доставки по всем методам. Метод внутривенного введения показал наибольшую эффективность, при этом сигналы GFP были обнаружены у 41 из 43 рыб. В отличие от этого, метод обратного осмоса показал ограниченный успех, при этом успешные инъекции наблюдались только у 3 из 37 рыб. Внутрисердечный метод достиг успешной доставки у 11 из 40 рыб (рис. 2А). Также осуществлялся контроль за выживаемостью пересаженных рыб. Рыбы, введенные с помощью АФ и внутрисердечными методами, имели значительно более низкие показатели выживаемости по сравнению с теми, кто вводился внутривенно (Рисунок 2B). Примечательно, что количество введенных клеток повлияло на выживаемость среди рыб, которым вводили внутривенно, при этом реципиенты, получавшие 3 × 105 клеток, показали лучшую выживаемость. Эти результаты подчеркивают превосходную эффективность и надежность метода внутривенной инъекции в доставке клеток и веществ взрослым рыбкам данио.
Эффективность приживления клеток WKM у рыбы-реципиента Каспера была тщательно оценена путем мониторинга сигнала GFP от трансплантированных клеток. У рыб, получавших внутривенные инъекции, сигналы GFP были обнаружены уже на третий день после трансплантации (рисунок 2C), что указывает на быстрый и эффективный процесс приживления. Напротив, у рыб, перенесших RO и внутрисердечные инъекции, наблюдалось замедленное появление сигнала GFP, что указывает на более медленную скорость приживления. К 17-му дню после трансплантации трансплантированные клетки преимущественно повторно заселили почечный мозг, при этом наиболее выраженные сигналы GFP наблюдались у рыб, которым вводили внутривенно (рис. 2C). Проточный цитометрический анализ КМ у реципиентов еще раз подтвердил эффективность метода внутривенного введения. У реципиентов, которым первоначально вводили 3 × 105 клеток внутривенно, примерно 18% клеток в KM были GFP-положительными, что аналогично пропорции, обнаруженной в почечном мозге донорской рыбы Tg(mpo: EGFP), которая не подвергалась трансплантации (рис. 2D, E). Напротив, внутрисердечная инъекция привела к образованию около 5% GFP-положительных клеток, в то время как метод RO дал только около 2% GFP-положительных клеток в почном мозге реципиентов. Кроме того, скорость приживления положительно коррелировала с количеством введенных клеток, демонстрируя, что более высокие дозы клеток приводили к большему приживлению. Эти результаты подтверждают надежность техники внутривенной инъекции в облегчении приживления клеток и последующей популяции почечного мозга.
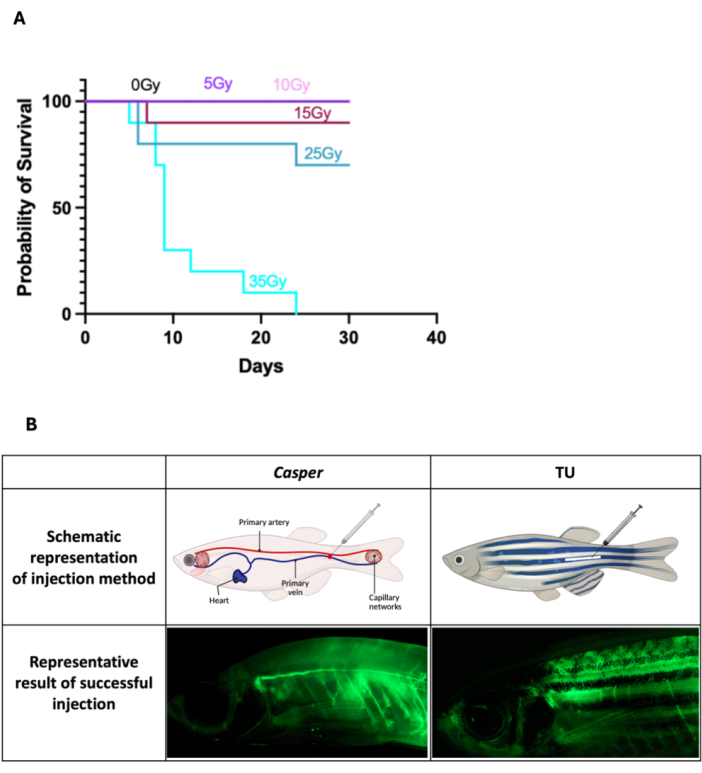
Рисунок 1: Результаты выживаемости после облучения и внутривенного введения взрослым рыбкам данио . (A) Рыбы каспер подвергались облучению до 35 Гр и контролировали выживаемость в течение 30 дней, подтвердив сублетальную дозу 25 Гр (n = 10 для всех групп). (B) Принципиальные диаграммы, иллюстрирующие места инъекции как для каспера , так и для данио-рерио TU, вместе с примерами успешно инъекционных рыб. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Сравнение ретроорбитальных, внутрисердечных и внутривенных инъекций у взрослых рыбок данио . (A) Схематические изображения и репрезентативные результаты методов RO, внутрисердечных и внутривенных инъекций у взрослых рыбок данио. Цифры в правом нижнем углу указывают на количество успешно введенных или неправильно введенных рыб по отношению к общему количеству попыток для каждого метода, сигнал GFP был проверен под флуоресцентным микроскопом сразу после инъекции. (B) Общая выживаемость реципиентов после трансплантации разного количества донорских клеток почечного мозга различными методами инъекции (IV-100K: n = 24; Внутрикардиальный - 100K: n = 10; РО-100К: n = 12; ИВ-300К: n = 20; Внутрикардиальная - 300К: n = 6; РО-300К: n = 8). (C) Наблюдение за эффективностью приживления у реципиентов после трансплантации с помощью методов РО, интракардиального и внутривенного введения (D) Репрезентативный график проточной цитометрии для GFP-положительных клеток в KM реципиентов через 17 дней после трансплантации. (E) Процент клеток GFP+ в КМ реципиентов через 17 дней после трансплантации, а также в КМ донорской рыбы Tg(mpo:EGFP) без облучения (IV-100K: n = 30; Внутрикардиальная - 100К: n = 28; РО-100К: n = 22; ИВ-300К: n = 22; Внутрикардиальная - 300K: n = 26; РО-300К: n = 18). Данные являются средними ± s.e.m. Односторонняя ANOVA была выполнена для D. Log-Rank тест был проведен для B. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001. Масштабные линейки = 1 мм (А, С). Сокращения: RO = ретроорбитальный; IV = внутривенно; GFP = зеленый флуоресцентный белок; KM = почечный мозг; SSC-A = площадь бокового пика рассеяния; FITC-A = площадь пика изотиоцианата флуоресцеина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этом исследовании мы разработали протокол внутривенного введения, адаптированный для взрослых рыбок данио, чтобы повысить точность и стабильность доставки клеток или лекарств. Важнейшим элементом этого метода является возможность локализации и визуализации первичной вены, что имеет решающее значение для точного введения веществ. В то время как полупрозрачный штамм данио-рерио Каспера рекомендуется для оптимальной видимости судна, наш протокол может быть адаптирован для использования с различными взрослыми сортами данио-рерио при условии соответствующей регулировки видимости и точности. Выбор подходящего игольчатого манометра имел важное значение для минимизации повреждения сосудов и обеспечения эффективной транспортировки веществ. Кроме того, приоритетом был комплексный постинъекционный уход, включая поддержание чистой и хорошо насыщенной кислородом воды. Эти методы не только упростили процесс инъекции, но и значительно улучшили здоровье и выживаемость рыбок данио, тем самым приведя к более надежным и воспроизводимым экспериментальным результатам.
Кроме того, мы провели сравнительный анализ техник внутрисердечных инъекций, RO и внутривенных инъекций у взрослых рыбок данио, продемонстрировав явные преимущества внутривенного метода в повышении выживаемости и содействии приживлению клеток. Несмотря на традиционное использование, внутрисердечные инъекции связаны с высокими показателями смертности13, а точность, необходимая для эффективных инъекций обратного осмоса, является сложной задачей для постоянного достижения14. Минимально инвазивный характер внутривенного введения значительно снижает стресс и физические травмы рыб, что приводит к значительному улучшению выживаемости и результатов приживления после инъекции. Кроме того, быстрая обнаруживаемость сигналов GFP на 3-й день после трансплантации у рыб, которым вводили внутривенно, еще больше подчеркивает эффективность метода в содействии эффективному приживлению клеток. Напротив, более медленное появление сигналов GFP у рыб, которым вводили интракардиальные инъекции, и почти полное отсутствие сигналов у рыб, вводимых методом РО, подчеркивают ограниченность этих альтернативных методов, что делает подход более эффективным при внутривенном введении.
В то время как метод внутривенной инъекции имеет значительные преимущества, он имеет потенциальные ограничения, такие как необходимость специализированного оборудования и обучения для достижения высокой точности. Кроме того, в то время как полупрозрачность штамма Каспера облегчает визуализацию вен, адаптация этого метода к менее прозрачным штаммам может потребовать дополнительной видимости и технологических усовершенствований. Кроме того, необходимы дальнейшие исследования для оценки долгосрочных эффектов внутривенных инъекций и оценки стабильности приживленных клеток в течение длительных периодов времени у рыбок данио, что будет иметь решающее значение для подтверждения устойчивого успеха и безопасности этого метода.
Эффективность техники внутривенных инъекций в доставке веществ в кровоток и достижении высоких уровней приживления у взрослых рыбок данио имеет несколько последствий для будущих исследований. Этот метод позволяет более эффективно использовать взрослых рыбок данио в долгосрочных исследованиях, устраняя некоторые ограничения, связанные с личиночными моделями. Надежность метода внутривенного введения повышает точность моделей для изучения сложных заболеваний и проведения скрининга лекарств, что потенциально может привести к значительному прогрессу в терапевтических стратегиях. Кроме того, успех внутривенных инъекций в достижении надежного приживления закладывает прочную основу для дальнейших исследований в области генетических манипуляций и трансплантации, что имеет важное значение для изучения генетических нарушений и иммунных реакций. Достижения в этом протоколе внутривенных инъекций готовы внести существенный вклад в исследования рыбок данио, усовершенствовав инструменты для биомедицинских исследований и ускорив прогресс в понимании и лечении заболеваний человека.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Мы благодарим Центр исследований в области сравнительной медицины (CCMR) Университета Гонконга. Благодарим госпожу Джо Ю Линг Вонг за помощь животным. Работы были поддержаны Схемой тематических исследований (T12-702/20-N), проектами Фонда исследований в области здравоохранения и медицины No08192066 и No 08193106, Совместным исследовательским планом Национального фонда естественных наук Китая (NSFC)/Совета по исследовательским грантам (RGC) 2021/22 N_HKU745/21, Национальной ключевой программой исследований и разработок Китая (2023YFA1800100) и Центром онкологии и иммунологии в рамках инициативы Health@InnoHK, финансируемой Комиссией по инновациям и технологиям. Правительство САР Гонконг, Китай (A.Y.H.L.).
Материалы
| Name | Company | Catalog Number | Comments |
| Autoclaves Steam Sterilizer | HIRAYAMA | HRG-140 | |
| Centrifuge 5424 | Eppendorf | ||
| Countess 3 Automated Cell Counter | Thermofisher | ||
| Countess II FL | Invitrogen | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-aldrich | MKCL9483 | |
| Falcon 40 µm Cell Strainer | CORNING | Blue, Sterile, Individually Packaged, 50/Case | |
| FBS, Qualified | Gibco | 26140079 | |
| FITC-Dextran (MW 10000) | MedChemExpress | 60842-46-8 | |
| Injection needle | Hamilton | HAMI207434 | 34 G, 10 mm length |
| Micro syringe | Hamilton | 7635-01 | 10 µL capacity, Model 701 RN |
| Nikon SMZ18 | |||
| PBS pH 7.4 (1x) | Gibco | 10010023 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco™ | 15070063 | 100x |
| Pipette Tips | Eppendorf | epTIPS | |
| Single Channel Pipette | Eppendorf | 05-403-151 | |
| UltraPure Distilled Water | Invitrogen | 10977015 |
Ссылки
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K., Kim, C. H. Zebrafish as an animal model for biomedical research. Exp Mol Med. 53 (3), 310-317 (2021).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8 (5), 353-367 (2007).
- Wu, J. Q., et al. Patient-derived xenograft in zebrafish embryos: a new platform for translational research in gastric cancer. J Exp Clin Cancer Res. 36 (1), 160 (2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Dis Model Mech. 9 (9), 1063-1065 (2016).
- Stoletov, K., Montel, V., Lester, R. D., Gonias, S. L., Klemke, R. High-resolution imaging of the dynamic tumor cell vascular interface in transparent zebrafish. Proc Natl Acad Sci U S A. 104 (44), 17406-17411 (2007).
- Etchin, J. P. K. J., Look, A. T. Zebrafish as a model for the study of human cancer. Methods Cell Biol. 105, 309-337 (2011).
- Khan, N., Mahajan, N. K., Sinha, P., Jayandharan, G. R. An efficient method to generate xenograft tumor models of acute myeloid leukemia and hepatocellular carcinoma in adult zebrafish. Blood Cells Mol Dis. 75, 48-55 (2019).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- He, B. L., et al. Functions of flt3 in zebrafish hematopoiesis and its relevance to human acute myeloid leukemia. Blood. 123 (16), 2518-2529 (2014).
- Wang, D., et al. Transgenic IDH2(R172K) and IDH2(R140Q) zebrafish models recapitulated features of human acute myeloid leukemia. Oncogene. 42 (16), 1331 (2023).
- Fan, R. Y., et al. Zebrafish xenograft model for studying mechanism and treatment of non-small cell lung cancer brain metastasis. J Exp Clin Cancer Res. 40 (1), 371 (2021).
- LeBlanc, J., Bowman, T. V., Zon, L. Transplantation of whole kidney marrow in adult zebrafish. J Vis Exp. (2), e159 (2007).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645 (2009).
- Benjamin, D. C., Hynes, R. O. Intravital imaging of metastasis in adult zebrafish. BMC Cancer. 17 (1), 660 (2017).
- Hilligan, K. L., et al. Intravenous administration of BCG protects mice against lethal SARS-CoV-2 challenge. J Exp Med. 219 (2), e20211862 (2022).
- Moreo, E., et al. Intravenous administration of BCG in mice promotes natural killer and T cell-mediated antitumor immunity in the lung. Nat Commun. 14 (1), 6090 (2023).
- Wang, Z., et al. Intravenous administration of IL-12 encoding self-replicating RNA-lipid nanoparticle complex leads to safe and effective antitumor responses. Sci Rep. 14 (1), 7366 (2024).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), e59295 (2019).
- Rojas, A. M., Shiau, C. E. Brain-localized and Intravenous Microinjections in the Larval Zebrafish to Assess Innate Immune Response. Bio Protoc. 11 (7), e3978 (2021).
- van Soest, J. J., et al. Comparison of static immersion and intravenous injection systems for exposure of zebrafish embryos to the natural pathogen Edwardsiella tarda. BMC Immunol. 12, 58 (2011).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous microinjections of zebrafish larvae to study acute kidney injury. J Vis Exp. (42), e2079 (2010).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. (54), e2839 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.
