Method Article
Iniezione endovenosa ottimizzata nel pesce zebra adulto
In questo articolo
Riepilogo
Qui, presentiamo un protocollo ottimizzato ed efficace per l'iniezione endovenosa di cellule o agenti farmacologici in zebrafish adulto, con conseguente aumento dell'attecchimento cellulare e aumento dei tassi di sopravvivenza del zebrafish trattato.
Abstract
L'iniezione endovenosa (IV) è ampiamente riconosciuta come il metodo più efficace e comunemente utilizzato per ottenere la somministrazione sistemica di sostanze nei modelli di ricerca sui mammiferi. Tuttavia, la sua applicazione nel pesce zebra adulto per la somministrazione di farmaci, il trapianto di cellule staminali e gli studi rigenerativi e sul cancro è stata limitata a causa delle sfide poste dalle piccole dimensioni del corpo e dagli intricati vasi sanguigni. Per superare queste limitazioni, in passato sono state esplorate tecniche di iniezione alternative come l'iniezione intracardiaca e retro-orbitale (RO) per il trapianto di cellule staminali in zebrafish adulto. Tuttavia, queste tecniche hanno i loro svantaggi, tra cui la necessità di tecniche di iniezione meticolose o l'aumento del rischio di mortalità.
In questo studio, abbiamo sviluppato una procedura di iniezione endovenosa raffinata e ottimizzata, specificamente adattata ai pesci zebra adulti, affrontando le sfide associate alla loro anatomia unica. Per dimostrare l'efficacia di questa tecnica, abbiamo eseguito con successo iniezioni endovenose di cellule di midollo renale intero da pesce Tg (mpo: EGFP) e colorante FITC-destrano in pesce Casper adulto. La successiva visualizzazione delle cellule iniettate e dei coloranti utilizzando un microscopio a fluorescenza ha confermato il successo della loro consegna e attecchimento all'interno del pesce zebra. Inoltre, abbiamo dimostrato che, rispetto alle iniezioni intracardiache e RO, l'iniezione endovenosa ha portato a un miglioramento dei tassi di sopravvivenza e dell'efficienza dell'attecchimento nel pesce zebra trattato. Questo approccio consente la somministrazione e la localizzazione precise delle sostanze e ha un grande potenziale per lo screening chimico e farmacologico su larga scala utilizzando il pesce zebra adulto. Inoltre, la capacità di tracciare visivamente le cellule e i coloranti iniettati fornisce informazioni preziose sul loro attecchimento, migrazione e interazioni con i tessuti dell'ospite, consentendo una valutazione più completa degli effetti terapeutici e dei processi biologici nei modelli di zebrafish.
Introduzione
Il pesce zebra (Danio rerio) è emerso come un prezioso organismo modello nella ricerca biomedica, principalmente a causa della sua somiglianza genetica con gli esseri umani, con oltre il 70% dei geni umani che hanno controparti di pesce zebra 1,2. Questa somiglianza genetica, combinata con le dimensioni compatte del pesce zebra, il rapido ciclo di sviluppo e la capacità di un'ampia manipolazione genetica, lo rende un potente strumento per l'esplorazione scientifica. Questi attributi sono particolarmente vantaggiosi per gli esperimenti che coinvolgono il trapianto di cellule, la somministrazione di farmaci e il tracciamento cellulare. Inoltre, la chiarezza ottica delle larve trasparenti e di specifici mutanti di pigmentazione, come il pesce zebra Casper, consente una visualizzazione precisa delle cellule o delle sostanze trapiantate, offrendo un'alternativa più efficiente ed economica ai modelli animali tradizionali.
I pesci zebra sono ampiamente utilizzati per sviluppare modelli di trapianto di cancro e per condurre screening farmacologici per malattie gravi come glioma, melanoma, tumori del pancreas e leucemia 3,4,5,6,7,8,9,10. In genere, questi modelli vengono avviati allo stadio larvale per sfruttare il sistema immunitario immaturo delle larve e la trasparenza intrinseca, che semplifica il processo di iniezione e migliora la fattibilità di studi a breve termine. Tuttavia, l'uso delle larve limita la durata della valutazione dell'attecchimento e degli interventi terapeutici 7,11. La transizione di questi protocolli sperimentali al pesce zebra adulto introduce sfide come procedure di iniezione più complesse, ridotta efficienza dell'attecchimento, tassi di mortalità più elevati e maggiore variabilità nelle risposte individuali. Queste sfide evidenziano la necessità critica di migliorare le tecniche di iniezione e di somministrazione di sostanze, in particolare per gli studi che coinvolgono pesci zebra adulti che richiedono periodi di osservazione prolungati.
Storicamente, le iniezioni intracardiache12 e retro-orbitali (RO)13 sono state le metodiche primarie per la somministrazione di farmaci e il trapianto di cellule nel pesce zebra adulto. L'iniezione intracardiaca, che comporta l'iniezione di sostanze direttamente nel cuore, garantisce l'immediata circolazione sistemica dei farmaci, ma è associata a rischi significativi, tra cui potenziali lesioni cardiache e alta mortalità. D'altra parte, l'iniezione di RO, che eroga materiali al seno venoso dietro l'occhio, favorisce anche una rapida distribuzione sistemica, ma può essere stressante per i pesci e richiede un'elevata precisione nell'esecuzione14. Le iniezioni endovenose, ben consolidate per la somministrazione sistemica di sostanze nei topi e nei ratti, sono fondamentali per gli studi di farmacocinetica, le valutazioni dell'efficacia dei farmaci e gli interventi terapeutici in questi modelli 15,16,17,18. Recentemente, le iniezioni endovenose hanno acquisito importanza nella ricerca sul pesce zebra, in particolare negli studi sulle risposte immunitarie innate19,20 e sul danno renale acuto21 nelle larve di pesce zebra. Tuttavia, la loro applicazione nel pesce zebra adulto rimane limitata.
In questo studio, abbiamo sviluppato e ottimizzato una procedura di iniezione endovenosa su misura per il pesce zebra adulto, che migliora significativamente i tassi di sopravvivenza, la precisione e l'efficienza della consegna. Dimostriamo visivamente questo metodo e forniamo un protocollo dettagliato utilizzando questa tecnica raffinata. Abbiamo somministrato con successo iniezioni endovenose di cellule di midollo renale intero (WKM) da pesci Tg (mpo: EGFP) e colorante FITC-destrano in pesci Casper adulti, con conferma del parto e dell'attecchimento valutati mediante microscopia a fluorescenza. I nostri risultati mostrano che la tecnica di iniezione endovenosa perfezionata è più efficiente e coerente rispetto ai tradizionali metodi intracardiaci e RO. Poiché l'uso del pesce zebra nella ricerca scientifica continua ad espandersi, è probabile che l'adozione di questa tecnica di iniezione endovenosa migliorata migliori la nostra comprensione della patogenesi della malattia e acceleri lo sviluppo di nuovi approcci terapeutici.
Protocollo
Tutte le procedure sugli animali sono state approvate dal Comitato per l'uso di animali da laboratorio e da ricerca (CULATR) dell'Università di Hong Kong (HKU).
1. Preparazione del materiale per iniezione
- Preparare il terreno di sospensione cellulare: 0,9x PBS + 5% siero fetale bovino (FBS) + 1% penicillina/streptomicina (Pen/Strep).
- Sterilizzare la siringa Hamilton e l'ago inserito (34 G, lunghezza 10 mm, capacità 10 μL, vedere la Tabella dei materiali) sotto luce UV con una lunghezza d'onda di 270-280 nm ed esporre gli articoli per 2 ore.
- Prepara cotton fioc sterilizzati, dischetti di schiuma e carta velina.
- Preparare la miscela per anestesia diluendo la tricaina con acqua di pesce sterilizzata a una concentrazione finale di 0,2 mg/mL.
- Per il trapianto di cellule WKM in pesci Casper , 2 giorni prima del trapianto, somministrare una dose di irradiazione subletale di 25 Gy, suddivisa in due sessioni di 12,5 Gy ciascuna, somministrate lo stesso giorno con un intervallo di 7-8 ore tra le dosi. Per il processo di irradiazione, mettere 5-10 pesci adulti in una capsula di Petri da 100 mm contenente acqua di pesce ed esporli in un irradiatore gamma.
NOTA: La dose è stata determinata come subletale sulla base di un'analisi di sopravvivenza dopo aver esposto i pesci Casper a vari livelli di irradiazione fino a 35 Gy, monitorati per 30 giorni (Figura 1A). L'esatta durata dell'esposizione deve essere calibrata in base alle impostazioni dell'irradiatore. Non è necessaria alcuna irradiazione per le procedure che prevedono solo la somministrazione di farmaci. - Utilizzare uno sterilizzatore a vapore per autoclave da laboratorio per sterilizzare l'acqua dei pesci destinata all'alloggiamento dei pesci trattati (vedere la Tabella dei materiali) per prevenire infezioni e garantire un ambiente di recupero sicuro per i pesci dopo l'iniezione.
NOTA: Il processo di sterilizzazione è personalizzato in base all'unità autoclave specifica utilizzata e aderiamo alle linee guida del produttore per la sterilizzazione in autoclave di soluzioni liquide per preparare l'acqua dei pesci. - Preparare il tampone per il lavaggio dell'ago: diverse provette di etanolo al 75% e acqua ultrapura in provette per microcentrifuga da 1,5 mL.
- Preparare il tampone per il trapianto sciogliendo FITC-destrano (peso molecolare: 10.000) nel terreno di sospensione cellulare precedentemente preparato (0,9x PBS con 5% FBS e 1% Pen/Strep). Regolare la concentrazione a 100 μg/mL.
NOTA: Questo tampone sarà utilizzato per le iniezioni, con un volume previsto di 2 μl per pesce.
2. Preparazione del midollo renale intero per il trapianto
- Sopprimere il numero necessario di pesci Tg(mpo: EGFP) immergendoli in una soluzione di tricaina da 0,4 mg/mL, assicurandosi che rimangano nella soluzione per almeno 10 minuti dopo la cessazione del movimento opercolare.
- Sezionare il pesce Tg (mpo: EGFP) per isolarlo e trasferire il midollo renale (KM) nel mezzo di sospensione cellulare all'interno di una provetta da microcentrifuga da 1,5 mL come descritto in precedenza22.
- Disaggregare le celle KM pipettando e filtrando la sospensione attraverso un filtro cellulare in nylon da 40 μm.
- Centrifugare la sospensione a 500 × g per 8 min.
- Scartare il surnatante e risospendere il pellet in 500 μl di mezzo di sospensione cellulare.
- Contare le cellule utilizzando un contatore automatico con un'aliquota di 10 μl della sospensione cellulare.
- Centrifugare nuovamente a 500 × g per 8 min.
- Regolare la concentrazione cellulare a 150.000 cellule/μL utilizzando il tampone per trapianto.
3. Procedura di iniezione
- Lavare accuratamente la siringa di Hamilton 3-4 volte con etanolo al 75% prima dell'iniezione. Sciacquare la siringa 3-4 volte con acqua ultrapura per rimuovere eventuali residui di etanolo.
- Somministrare l'anestesia al pesce zebra immergendolo nella miscela di anestesia fino a quando non è completamente anestetizzato, evidenziato da una diminuzione del movimento e dalla perdita delle risposte riflesse. Una volta che i pesci sono sedati, posizionarli con il lato dorsale rivolto verso l'alto e la testa orientata a sinistra (Figura 1B). Adagiare con cura i pesci su carta velina pulita e umida, che li aiuterà a stabilizzarli per l'iniezione. Assicurati che il fazzoletto sia sufficientemente umido da evitare che il pesce si secchi, ma non così bagnato da causare lo scivolamento.
- Afferrare saldamente la siringa di Hamilton e inclinare l'ago a ~45° rispetto al vaso primario (la vena caudale) per colpirlo efficacemente riducendo al minimo i danni ai tessuti circostanti. Per il pesce zebra Capser , mirare a una sezione del recipiente visibile attraverso il suo corpo traslucido per un posizionamento accurato dell'ago (Figura 1B). Per il pesce zebra wild-type (Tubingen, TU) con pelle pigmentata, puntare ai vasi primari che si trovano lungo l'asse del corpo e posteriormente all'ano nella regione dei vasi primari (Figura 1B). Inserire delicatamente e senza intoppi l'ago nel recipiente designato, somministrare l'iniezione (2 μL) lentamente per ridurre al minimo lo stress, garantire un assorbimento ottimale della sostanza e applicare una leggera pressione sul sito con un batuffolo di cotone per 10 s per controllare eventuali sanguinamenti dopo l'iniezione.
- Osservare al microscopio per confermare la presenza di segnali GFP, garantendo l'efficacia dell'iniezione. Verificare che le cellule o i coloranti appaiano come segnali verdi all'interno del vaso (Figura 2A).
- Lasciare che il pesce si riprenda in acqua di pesce appena sterilizzata dopo l'iniezione per 10 minuti fino al trasferimento in una vasca statica.
- Pulisca l'ago come descritto in precedenza tra un'iniezione di reagenti diversi.
- Per evitare l'aggregazione delle cellule, azionare la sospensione cellulare ogni 10 minuti per risospendere le cellule.
- Mantenere un massimo di 15 pesci trapiantati in una vasca da 4 L in condizioni di acqua statica per tutta la durata del trattamento. In alternativa, alloggiare i pesci trapiantati singolarmente in vasche statiche da 1 L. Dotare il serbatoio di una pompa di ossigeno ed eseguire cambi d'acqua giornalieri per ridurre al minimo il rischio di infezione.
- Monitorare e valutare l'espressione di GFP mediante citometria a flusso nei pesci circa 14 giorni dopo il trapianto per valutare il tasso di attecchimento. Registra la mortalità giornaliera dei pesci per calcolare con precisione i tassi di sopravvivenza. Eseguire l'ANOVA unidirezionale per l'analisi dell'attecchimento e il test Log-rank per l'analisi della sopravvivenza.
Risultati
Per valutare l'efficacia e la precisione dei diversi metodi di iniezione nei pesci Casper adulti, è stata condotta un'analisi comparativa utilizzando tecniche intracardiache, RO e IV (Figura 2A). Sono state iniettate quantità variabili di cellule WKM da pesci Tg(mpo: EGFP), ciascuna miscelata con colorante FITC-destrano a concentrazioni di 1 × 105 e 3 × 105 cellule. Il successo di ciascun metodo è stato determinato attraverso una valutazione microscopica immediata della presenza del segnale GFP dopo l'iniezione. I risultati hanno rivelato variazioni significative nel successo della consegna tra i metodi. Il metodo di iniezione endovenosa ha dimostrato la massima efficacia, con segnali GFP rilevati in 41 pesci su 43. Al contrario, il metodo RO ha mostrato un successo limitato, con iniezioni di successo osservate solo in 3 pesci su 37. Il metodo intracardiaco ha ottenuto un rilascio efficace in 11 pesci su 40 (Figura 2A). È stata inoltre monitorata la sopravvivenza dei pesci trapiantati. I pesci iniettati tramite i metodi RO e intracardiaci avevano tassi di sopravvivenza significativamente più bassi rispetto a quelli iniettati per via endovenosa (Figura 2B). In particolare, il numero di cellule iniettate ha influenzato i tassi di sopravvivenza tra i pesci iniettati per via endovenosa, con i riceventi che hanno ricevuto 3 × 105 cellule che hanno mostrato una migliore sopravvivenza. Questi risultati evidenziano l'efficacia e l'affidabilità superiori del metodo di iniezione endovenosa nel veicolare cellule e sostanze nel pesce zebra adulto.
L'efficienza di attecchimento delle cellule WKM nel pesce Casper ricevente è stata accuratamente valutata monitorando il segnale GFP dalle cellule trapiantate. Nei pesci che hanno ricevuto iniezioni endovenose, i segnali GFP erano rilevabili già dal terzo giorno dopo il trapianto (Figura 2C), indicando un processo di attecchimento rapido ed efficace. Al contrario, i pesci sottoposti a iniezioni RO e intracardiache hanno mostrato un'emergenza ritardata del segnale GFP, indicando un tasso di attecchimento più lento. Al 17° giorno dopo il trapianto, le cellule trapiantate avevano prevalentemente ripopolato il midollo renale, con i segnali GFP più pronunciati osservati nei pesci iniettati per via endovenosa (Figura 2C). L'analisi citofluorimetrica della KM dai riceventi ha ulteriormente sottolineato l'efficacia del metodo di iniezione endovenosa. Nei riceventi inizialmente iniettati con 3 × 105 cellule per via endovenosa, circa il 18% delle cellule nel KM era GFP-positivo, una proporzione simile a quella trovata nel midollo renale del pesce donatore Tg (mpo: EGFP) che non aveva subito alcun trapianto (Figura 2D, E). Al contrario, l'iniezione intracardiaca ha prodotto circa il 5% di cellule GFP-positive, mentre il metodo RO ha prodotto solo circa il 2% di cellule GFP-positive nel midollo renale dei riceventi. Inoltre, il tasso di attecchimento era correlato positivamente con il numero di cellule iniettate, dimostrando che dosi cellulari più elevate portavano a un maggiore attecchimento. Questi risultati confermano la robustezza della tecnica di iniezione endovenosa nel facilitare l'attecchimento cellulare e il successivo ripopolamento del midollo renale.
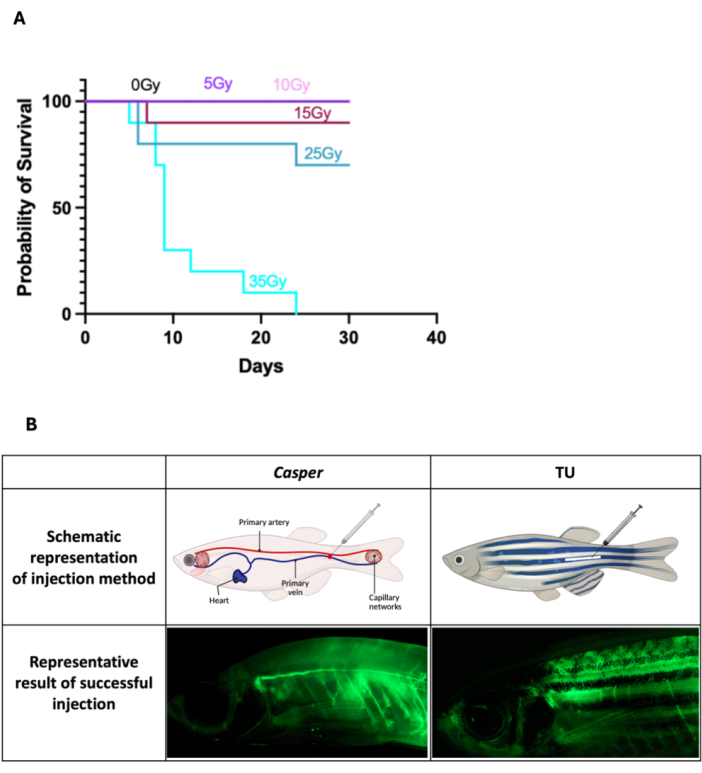
Figura 1: Risultati di sopravvivenza dopo l'irradiazione e l'iniezione endovenosa in zebrafish adulto. (A) I pesci Casper sono stati esposti a irradiazioni fino a 35 Gy e hanno monitorato la sopravvivenza per 30 giorni, confermando 25 Gy come dosaggio subletale (n = 10 per tutti i gruppi). (B) Diagrammi schematici che illustrano i siti di iniezione sia per il pesce zebra Casper che per il pesce TU, insieme ad esempi di pesci iniettati con successo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Confronto tra iniezioni retro-orbitali, intracardiache ed endovenose in zebrafish adulto. (A) Rappresentazioni schematiche ed esiti rappresentativi di metodi di iniezione RO, intracardiaci e IV in zebrafish adulto. I numeri nell'angolo in basso a destra indicano il conteggio dei pesci iniettati con successo o in modo errato rispetto al numero totale tentato per ciascun metodo, il segnale GFP è stato verificato al microscopio a fluorescenza immediatamente dopo l'iniezione. (B) Sopravvivenza globale dei riceventi dopo trapianto con un numero diverso di cellule del midollo renale del donatore con diversi metodi di iniezione (IV-100K: n = 24; Intracardiac-100K: n = 10; RO-100K: n = 12; IV-300K: n = 20; Intracardiac-300K: n = 6; RO-300K: n = 8). (C) Osservazione dell'efficienza dell'attecchimento nei riceventi dopo il trapianto tramite metodi di iniezione RO, intracardiaci e IV (D) Grafico rappresentativo della citometria a flusso per le cellule GFP-positive in KM dei riceventi a 17 giorni dopo il trapianto. (E) La percentuale di cellule GFP+ nella KM dei riceventi 17 giorni dopo il trapianto, così come nella KM dei pesci Tg(mpo:EGFP) donatori senza irradiazione (IV-100K: n = 30; Intracardiac-100K: n = 28; RO-100K: n = 22; IV-300K: n = 22; Intracardiac-300K: n = 26; RO-300K: n = 18). I dati sono medi ± s.e.m. L'ANOVA unidirezionale è stata eseguita per D. Il test Log-Rank è stato eseguito per B. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001. Barre della scala = 1 mm (A, C). Abbreviazioni: RO = retro-orbitale; IV = endovenosa; GFP = proteina fluorescente verde; KM = midollo renale; SSC-A = area laterale del picco di dispersione; FITC-A = isotiocianato di fluoresceina-area di picco. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, abbiamo sviluppato un protocollo di iniezione endovenosa su misura per il pesce zebra adulto per migliorare la precisione e la coerenza della somministrazione di cellule o farmaci. Un elemento critico di questo metodo è la capacità di localizzare e visualizzare la vena primaria, che è fondamentale per la somministrazione accurata delle sostanze. Mentre il ceppo traslucido di pesce zebra Casper è raccomandato per una visibilità ottimale dell'imbarcazione, il nostro protocollo è adattabile per l'uso con vari ceppi di pesce zebra adulto, a condizione che vengano apportate regolazioni adeguate per la visibilità e la precisione. La selezione di un calibro dell'ago appropriato è stata essenziale per ridurre al minimo il danno vascolare e garantire un trasporto efficace della sostanza. Inoltre, è stata data priorità a un'assistenza post-iniezione completa, compreso il mantenimento di acqua pulita e ben ossigenata. Queste pratiche non solo hanno semplificato il processo di iniezione, ma hanno anche migliorato significativamente la salute e la sopravvivenza del pesce zebra, portando così a risultati sperimentali più affidabili e riproducibili.
Inoltre, abbiamo condotto un'analisi comparativa delle tecniche di iniezione intracardiaca, RO e IV in zebrafish adulto, dimostrando i vantaggi distinti del metodo IV nel migliorare i tassi di sopravvivenza e promuovere l'attecchimento cellulare. Nonostante il loro uso tradizionale, le iniezioni intracardiache sono collegate ad alti tassi di mortalità13 e la precisione richiesta per iniezioni efficaci di RO è difficile da raggiungere costantemente14. La natura minimamente invasiva della tecnica endovenosa mitiga significativamente lo stress e il trauma fisico del pesce, portando a un sostanziale miglioramento della sopravvivenza e dei risultati dell'attecchimento dopo l'iniezione. Inoltre, la rapida rilevabilità dei segnali GFP entro il 3° giorno dopo il trapianto nei pesci iniettati per via endovenosa sottolinea ulteriormente l'efficienza del metodo nel facilitare un efficace attecchimento cellulare. Al contrario, l'emergere più lento dei segnali GFP nei pesci iniettati per via intracardiaca e la quasi assenza di segnali nei pesci iniettati con RO sottolineano i limiti di questi metodi alternativi, suggerendo l'approccio IV come un approccio più efficace.
Sebbene il metodo di iniezione endovenosa offra vantaggi significativi, presenta potenziali limitazioni, come la necessità di attrezzature specializzate e formazione per ottenere un'elevata precisione. Inoltre, mentre la traslucenza del ceppo Casper facilita la visualizzazione delle vene, l'adattamento di questo metodo a ceppi meno traslucidi può richiedere ulteriore visibilità e miglioramenti tecnologici. Inoltre, sono necessarie ulteriori indagini per valutare gli effetti a lungo termine delle iniezioni endovenose e per valutare la stabilità delle cellule trapiantate per periodi prolungati nel pesce zebra, il che sarà fondamentale per convalidare il successo e la sicurezza di questa tecnica.
L'efficacia della tecnica di iniezione endovenosa nel rilasciare sostanze nel flusso sanguigno e nel raggiungere alti livelli di attecchimento nel pesce zebra adulto ha diverse implicazioni per la ricerca futura. Questo metodo consente un uso più efficace del pesce zebra adulto negli studi a lungo termine, affrontando alcune limitazioni associate ai modelli larvali. L'affidabilità del metodo IV migliora l'accuratezza dei modelli per lo studio di malattie complesse e l'esecuzione di screening farmacologici, portando potenzialmente a progressi significativi nelle strategie terapeutiche. Inoltre, il successo delle iniezioni endovenose nel raggiungere un robusto attecchimento pone una solida base per ulteriori esplorazioni nella manipolazione genetica e nel trapianto, che è essenziale per studiare le malattie genetiche e le risposte immunitarie. I progressi in questo protocollo di iniezione endovenosa sono pronti a dare un contributo sostanziale alla ricerca sul pesce zebra, perfezionando gli strumenti per la ricerca biomedica e accelerando i progressi nella comprensione e nel trattamento delle malattie umane.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Ringraziamo la Zebrafish Facility del Centre for Comparative Medicine Research (CCMR) dell'Università di Hong Kong. Ringraziamo la signora Jo Yiu Ling Wong per l'assistenza agli animali. I lavori sono stati sostenuti dal programma di ricerca tematica (T12-702/20-N), dai progetti del Fondo per la salute e la ricerca medica n. 08192066 e n. 08193106, dal programma di ricerca congiunto 2021/22/2 N_HKU745 1 della National Natural Science Foundation of China (NSFC)/Research Grants Council (RGC) 2021/22/21, dal programma nazionale di ricerca e sviluppo chiave della Cina (2023YFA1800100) e dal Centro per l'oncologia e l'immunologia nell'ambito dell'iniziativa Health@InnoHK finanziata dalla Commissione per l'innovazione e la tecnologia, il governo di Hong Kong SAR, Cina (A.Y.H.L.).
Materiali
| Name | Company | Catalog Number | Comments |
| Autoclaves Steam Sterilizer | HIRAYAMA | HRG-140 | |
| Centrifuge 5424 | Eppendorf | ||
| Countess 3 Automated Cell Counter | Thermofisher | ||
| Countess II FL | Invitrogen | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-aldrich | MKCL9483 | |
| Falcon 40 µm Cell Strainer | CORNING | Blue, Sterile, Individually Packaged, 50/Case | |
| FBS, Qualified | Gibco | 26140079 | |
| FITC-Dextran (MW 10000) | MedChemExpress | 60842-46-8 | |
| Injection needle | Hamilton | HAMI207434 | 34 G, 10 mm length |
| Micro syringe | Hamilton | 7635-01 | 10 µL capacity, Model 701 RN |
| Nikon SMZ18 | |||
| PBS pH 7.4 (1x) | Gibco | 10010023 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco™ | 15070063 | 100x |
| Pipette Tips | Eppendorf | epTIPS | |
| Single Channel Pipette | Eppendorf | 05-403-151 | |
| UltraPure Distilled Water | Invitrogen | 10977015 |
Riferimenti
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K., Kim, C. H. Zebrafish as an animal model for biomedical research. Exp Mol Med. 53 (3), 310-317 (2021).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8 (5), 353-367 (2007).
- Wu, J. Q., et al. Patient-derived xenograft in zebrafish embryos: a new platform for translational research in gastric cancer. J Exp Clin Cancer Res. 36 (1), 160 (2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Dis Model Mech. 9 (9), 1063-1065 (2016).
- Stoletov, K., Montel, V., Lester, R. D., Gonias, S. L., Klemke, R. High-resolution imaging of the dynamic tumor cell vascular interface in transparent zebrafish. Proc Natl Acad Sci U S A. 104 (44), 17406-17411 (2007).
- Etchin, J. P. K. J., Look, A. T. Zebrafish as a model for the study of human cancer. Methods Cell Biol. 105, 309-337 (2011).
- Khan, N., Mahajan, N. K., Sinha, P., Jayandharan, G. R. An efficient method to generate xenograft tumor models of acute myeloid leukemia and hepatocellular carcinoma in adult zebrafish. Blood Cells Mol Dis. 75, 48-55 (2019).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- He, B. L., et al. Functions of flt3 in zebrafish hematopoiesis and its relevance to human acute myeloid leukemia. Blood. 123 (16), 2518-2529 (2014).
- Wang, D., et al. Transgenic IDH2(R172K) and IDH2(R140Q) zebrafish models recapitulated features of human acute myeloid leukemia. Oncogene. 42 (16), 1331 (2023).
- Fan, R. Y., et al. Zebrafish xenograft model for studying mechanism and treatment of non-small cell lung cancer brain metastasis. J Exp Clin Cancer Res. 40 (1), 371 (2021).
- LeBlanc, J., Bowman, T. V., Zon, L. Transplantation of whole kidney marrow in adult zebrafish. J Vis Exp. (2), e159 (2007).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645 (2009).
- Benjamin, D. C., Hynes, R. O. Intravital imaging of metastasis in adult zebrafish. BMC Cancer. 17 (1), 660 (2017).
- Hilligan, K. L., et al. Intravenous administration of BCG protects mice against lethal SARS-CoV-2 challenge. J Exp Med. 219 (2), e20211862 (2022).
- Moreo, E., et al. Intravenous administration of BCG in mice promotes natural killer and T cell-mediated antitumor immunity in the lung. Nat Commun. 14 (1), 6090 (2023).
- Wang, Z., et al. Intravenous administration of IL-12 encoding self-replicating RNA-lipid nanoparticle complex leads to safe and effective antitumor responses. Sci Rep. 14 (1), 7366 (2024).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), e59295 (2019).
- Rojas, A. M., Shiau, C. E. Brain-localized and Intravenous Microinjections in the Larval Zebrafish to Assess Innate Immune Response. Bio Protoc. 11 (7), e3978 (2021).
- van Soest, J. J., et al. Comparison of static immersion and intravenous injection systems for exposure of zebrafish embryos to the natural pathogen Edwardsiella tarda. BMC Immunol. 12, 58 (2011).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous microinjections of zebrafish larvae to study acute kidney injury. J Vis Exp. (42), e2079 (2010).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. (54), e2839 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon