Method Article
成年斑马鱼的优化静脉注射
摘要
在这里,我们提出了一种优化且有效的方案,用于将细胞或药理学试剂静脉注射到成年斑马鱼中,从而增强细胞植入并提高治疗斑马鱼的存活率。
摘要
静脉内 (IV) 注射被广泛认为是哺乳动物研究模型中实现物质全身递送的最有效和最常用的方法。然而,由于体型小和血管复杂带来的挑战,它在成年斑马鱼中用于药物输送、干细胞移植以及再生和癌症研究的应用受到限制。为了克服这些限制,过去已经探索了替代注射技术,例如心内和眼眶后 (RO) 注射,用于成年斑马鱼的干细胞移植。然而,这些技术有其缺点,包括需要细致的注射技术或增加死亡风险。
在这项研究中,我们开发了一种专门为成年斑马鱼量身定制的精细和优化的静脉注射程序,解决了与它们独特解剖结构相关的挑战。为了证明该技术的有效性,我们成功地将 Tg(mpo: EGFP) 鱼的全肾骨髓细胞和 FITC-葡聚糖染料静脉注射到成年 Casper 鱼中。随后使用荧光显微镜对注射的细胞和染料进行可视化,证实它们在斑马鱼内成功递送和植入。此外,我们证明,与心内和 RO 注射相比,IV 注射提高了治疗斑马鱼的存活率和植入效率。这种方法能够精确递送和定位物质,并且在使用成年斑马鱼进行大规模药物和化学筛查方面具有巨大潜力。此外,可视化追踪注射细胞和染料的能力为它们的植入、迁移以及与宿主组织的相互作用提供了宝贵的见解,从而能够更全面地评估斑马鱼模型中的治疗效果和生物过程。
引言
斑马鱼 (Danio rerio) 已成为生物医学研究中一种有价值的模式生物,主要是因为它与人类的基因相似性,超过 70% 的人类基因具有斑马鱼对应物 1,2。这种基因相似性,再加上斑马鱼紧凑的体型、快速的发育周期和广泛的基因作能力,使其成为科学探索的有力工具。这些属性对于涉及细胞移植、药物递送和细胞示踪的实验特别有利。此外,透明幼虫和特定色素沉着突变体(如 Casper 斑马鱼)的光学透明度允许对移植的细胞或物质进行精确可视化,为传统动物模型提供了一种更高效、更具成本效益的替代方案。
斑马鱼广泛用于开发癌症移植模型,并对神经胶质瘤、黑色素瘤、胰腺瘤和白血病等严重疾病进行药物筛选 3,4,5,6,7,8,9,10。通常,这些模型在幼虫阶段启动,以利用幼虫不成熟的免疫系统和固有的透明度,从而简化注射过程并增强短期研究的可行性。然而,使用幼虫限制了评估植入和治疗干预的持续时间 7,11。将这些实验方案过渡到成年斑马鱼会带来挑战,例如更复杂的注射程序、降低的植入效率、更高的死亡率以及个体反应的可变性增加。这些挑战凸显了对改进注射和物质输送技术的迫切需求,特别是对于涉及需要延长观察期的成年斑马鱼的研究。
从历史上看,心内12 和眼眶后 (RO) 注射13 一直是成年斑马鱼药物输送和细胞移植的主要方法。心内注射涉及将物质直接注射到心脏中,可确保药物的即时体循环,但与重大风险相关,包括潜在的心脏损伤和高死亡率。另一方面,将材料输送到眼睛后面的静脉窦的 RO 注射也促进了快速的全身分布,但可能会给鱼带来压力,并且需要高精度执行14。静脉注射对于小鼠和大鼠的全身性物质递送已得到广泛认可,对于这些模型中的药代动力学研究、药物疗效评估和治疗干预至关重要 15,16,17,18。最近,静脉注射在斑马鱼研究中越来越突出,特别是在斑马鱼幼鱼的先天免疫反应19,20 和急性肾损伤21 的研究中。然而,它们在成年斑马鱼中的应用仍然有限。
在这项研究中,我们开发并优化了一种专为成年斑马鱼量身定制的静脉注射程序,可显着提高存活率、精度和给药效率。我们直观地演示了这种方法,并使用这种精细的技术提供了详细的协议。我们成功地将来自 Tg(mpo: EGFP) 鱼的全肾骨髓 (WKM) 细胞和 FITC-葡聚糖染料静脉注射到成年 Casper 鱼中,并通过荧光显微镜评估分娩和植入确认。我们的研究结果表明,与传统的心内和 RO 方法相比,精细的 IV 注射技术更加高效和一致。随着斑马鱼在科学研究中的使用不断扩大,采用这种改进的静脉注射技术可能会增强我们对疾病发病机制的理解,并加速新治疗方法的开发。
研究方案
所有动物程序均已获得香港大学 (HKU) 实验及研究动物使用委员会 (CULATR) 的批准。
1. 注射材料的准备
- 制备细胞悬浮培养基:0.9x PBS + 5% 胎牛血清 (FBS) + 1% 青霉素/链霉素 (Pen/Strep)。
- 在 270-280 nm 波长的紫外光下对 Hamilton 注射器和连接的针头(34 G,10 mm 长度,10 μL 容量,参见 材料表)进行消毒,并将物品暴露 2 小时。
- 准备消毒过的棉签、泡沫垫和薄纸。
- 通过用消毒的鱼水稀释三卡因至终浓度为 0.2 mg/mL 来制备麻醉混合物。
- 对于 Casper 鱼中WKM细胞的移植,在移植前2天,施用25Gy的亚致死照射剂量,分为两个疗程,每个疗程12.5Gy,在同一天给药,剂量之间间隔7-8小时。对于照射过程,将 5-10 条成年鱼放入含有鱼水的 100 毫米培养皿中,并将它们暴露在伽马辐照器中。
注意:在将 Casper 鱼暴露于高达 35 Gy 的各种照射水平后,监测超过 30 天,根据生存分析确定剂量为亚致死剂量(图 1A)。应根据辐照器的设置校准确切的曝光持续时间。仅涉及药物输送的手术不需要照射。 - 使用实验室高压灭菌器蒸汽灭菌器对用于容纳处理过的鱼的鱼水进行消毒(参见 材料表),以防止感染并确保注射后鱼的安全恢复环境。
注意:灭菌过程是根据所使用的特定高压灭菌装置量身定制的,我们遵守制造商关于高压灭菌液体溶液以制备鱼水的指南。 - 准备针头洗涤缓冲液:在 1.5 mL 微量离心管中加入几管 75% 乙醇和超纯水。
- 通过将 FITC-葡聚糖(分子量:10,000)溶解在先前制备的细胞悬浮培养基(0.9x PBS,含 5% FBS 和 1% Pen/Strep)中来制备移植缓冲液。将浓度调整至 100 μg/mL。
注意:该缓冲液将用于注射,每条鱼的计划体积为 2 μL。
2. 移植用全肾骨髓的准备
- 通过将必要数量的 Tg(mpo: EGFP) 鱼浸入 0.4 mg/mL 三卡因溶液中对它们实施安乐死,确保它们在鳃盖运动停止后在溶液中保留至少 10 分钟。
- 如前所述,解剖 Tg(mpo:EGFP) 鱼以分离肾骨髓 (KM) 并将其转移到 1.5 mL 微量离心管内的细胞悬浮培养基中22。
- 通过移液并通过 40 μm 尼龙细胞过滤器过滤悬浮液来解聚 KM 细胞。
- 将悬浮液以 500 × g 离心 8 分钟。
- 弃去上清液,将沉淀重悬于 500 μL 细胞悬液中。
- 使用自动计数器和 10 μL 等分试样的细胞悬液对细胞进行计数。
- 再次以 500 × g 离心 8 分钟。
- 使用移植缓冲液将细胞浓度调节至 150,000 个细胞/μL。
3. 注射程序
- 注射前,用 75% 乙醇彻底清洗 Hamilton 注射器 3-4 次。用超纯水冲洗注射器 3-4 次,以去除任何乙醇残留物。
- 通过将斑马鱼浸入麻醉混合物中直到它们被完全麻醉来对斑马鱼进行麻醉,运动减少和反射反应丧失证明了这一点。鱼被镇静后,将它们的背侧朝上,头部朝左(图 1B)。小心地将鱼放在干净、潮湿的薄纸上,这将有助于稳定它们以进行注射。确保组织足够湿润以防止鱼变干,但又不要太湿以至于导致滑倒。
- 牢牢抓住 Hamilton 注射器,将针头与初级血管(尾静脉)成 ~45° 的角度,以有效地瞄准它,同时最大限度地减少对周围组织的损伤。对于 Capser 斑马鱼,瞄准通过其半透明身体可见的容器部分,以便准确放置针头(图 1B)。对于皮肤色素沉着的野生型斑马鱼 (Tubingen, TU),瞄准沿体轴和肛门后方初级血管区域的主要血管(图 1B)。轻轻平稳地将针头插入指定的容器中,缓慢注射 (2 μL) 以尽量减少压力,确保物质的最佳摄取,并用棉签轻轻按压该部位 10 秒以控制注射后的任何出血。
- 在显微镜下观察以确认 GFP 信号的存在,确保注射的有效性。确认细胞或染料在容器内显示为绿色信号(图 2A)。
- 注射后让鱼在新鲜消毒的鱼水中恢复 10 分钟,直到转移到静态水箱中。
- 如前所述,在注射不同试剂之间清洁针头。
- 为防止细胞聚集,每 10 分钟轻弹一次细胞悬液以重悬细胞。
- 在处理期间,在静态水条件下,在 4 L 水箱中最多保持 15 条移植鱼。或者,将移植的鱼单独存放在 1 L 静态水箱中。为水箱配备氧气泵并每天换水,以最大限度地降低感染风险。
- 移植后约 14 天通过流式细胞术监测和评估鱼中的 GFP 表达,以评估植入率。记录鱼的每日死亡率以准确计算存活率。对植入分析执行单因素方差分析,对生存分析执行对数秩检验。
结果
为了评估不同注射方法在成年 Casper 鱼中的有效性和精度,使用心内、RO 和 IV 技术进行了比较分析(图 2A)。注射不同数量的 Tg(mpo: EGFP) 鱼 WKM 细胞,每个细胞与 1 × 105 和 3 × 105 细胞的 FITC-葡聚糖染料混合。通过对注射后 GFP 信号的存在进行即时显微镜评估来确定每种方法的成功。结果显示,不同方法的投放成功率存在显著差异。IV 注射方法显示出最高的有效性,在 43 条鱼中的 41 条中检测到 GFP 信号。相比之下,RO 方法的成功率有限,37 条鱼中只有 3 条成功注射。心内方法在 40 条鱼中有 11 条成功分娩(图 2A)。还监测了移植鱼的存活率。与静脉注射的鱼相比,通过 RO 和心内方法注射的鱼的存活率显着降低(图 2B)。值得注意的是,注射的细胞数量影响了 IV 注射鱼的存活率,接受 3 × 105 个细胞的接受者表现出更好的存活率。这些发现强调了 IV 注射方法在将细胞和物质输送到成年斑马鱼方面的卓越疗效和可靠性。
通过监测移植细胞的 GFP 信号,全面评估受体 Casper 鱼中 WKM 细胞的植入效率。在接受 IV 注射的鱼中,早在移植后第 3 天即可检测到 GFP 信号(图 2C),表明植入过程快速有效。相比之下,接受 RO 和心内注射的鱼显示出延迟的 GFP 信号出现,表明植入速度较慢。到移植后第 17 天,移植的细胞主要重新填充到肾骨髓中,在 IV 注射的鱼中观察到最明显的 GFP 信号(图 2C)。来自受者的 KM 的流式细胞术分析进一步强调了 IV 注射方法的有效性。在最初静脉注射 3 × 105 个细胞的受体中,KM 中大约 18% 的细胞是 GFP 阳性,这一比例类似于在未接受任何移植的供体 Tg(mpo:EGFP)鱼的肾中发现的比例(图 2D,E)。相比之下,心内注射导致约 5% 的 GFP 阳性细胞,而 RO 方法在受者的肾骨髓中仅产生约 2% 的 GFP 阳性细胞。此外,植入率与注射的细胞数量呈正相关,表明较高的细胞剂量导致更大的植入。这些结果证实了 IV 注射技术在促进细胞植入和随后的肾骨髓再填充方面的稳健性。
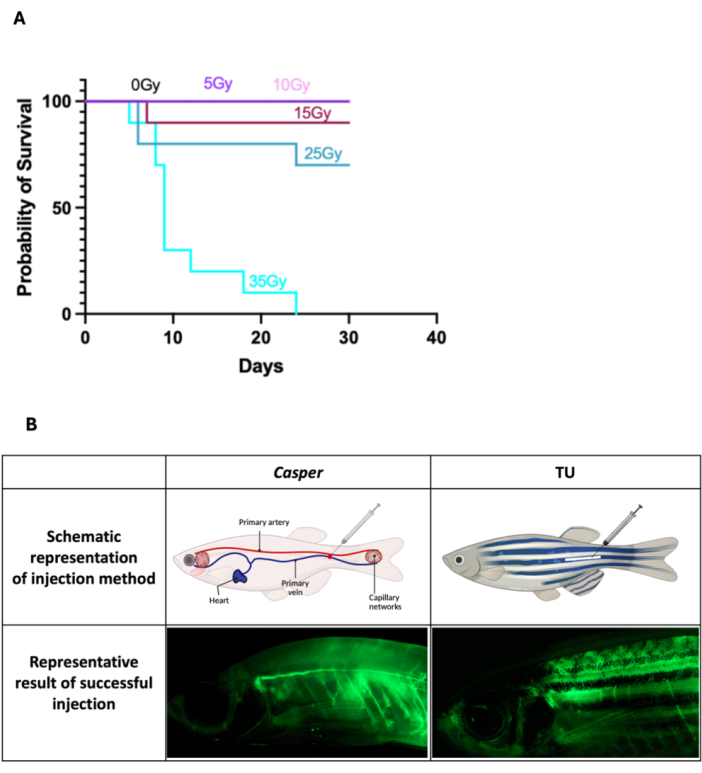
图 1:成年斑马鱼照射和静脉注射后的生存结果。 (A) Casper 鱼暴露于高达 35 Gy 的照射下,并监测了 30 天的存活率,证实 25 Gy 为亚致死剂量(所有组 n = 10)。(B) 说明 Casper 和 TU 斑马鱼注射部位的示意图,以及成功注射鱼的示例。 请单击此处查看此图的较大版本。

图 2:成年斑马鱼眼眶后、心内和静脉注射的比较。(A) 成年斑马鱼 RO、心内和 IV 注射方法的示意图和代表性结果。右下角的数字表示成功注射或错误注射的鱼的数量相对于每种方法尝试的总数,注射后立即在荧光显微镜下验证 GFP 信号。(B) 通过不同注射方法移植不同数量的供体肾细胞后受者的总生存期 (IV-100K: n = 24;心内 100K:n = 10;RO-100K:n = 12;IV-300K:n = 20;心内 300K:n = 6;RO-300K:n = 8)。(C) 通过 RO、心内和 IV 注射方法观察移植后受者的植入效率 (D) 移植后 17 天受者 KM 中 GFP 阳性细胞的代表性流式细胞术图。(E) 移植后 17 天受者 KM 中 GFP + 细胞的百分比,以及未经辐照的供体 Tg(mpo:EGFP)鱼的 KM 中 GFP + 细胞的百分比 (IV-100K: n = 30;心内 100K:n = 28;RO-100K:n = 22;IV-300K:n = 22;心内 300K:n = 26;RO-300K:n = 18)。数据均为 ± s.e.m. 的平均值。对 D 进行单因素方差分析。对 B 进行 Log-Rank 检验。*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001.比例尺 = 1 毫米 (A, C)。缩写: RO = 眶后;IV = 静脉注射;GFP = 绿色荧光蛋白;KM = 肾骨髓;SSC-A = 侧向散射峰面积;FITC-A = 异硫氰酸荧光素-峰面积。请单击此处查看此图的较大版本。
讨论
在这项研究中,我们开发了一种为成年斑马鱼量身定制的静脉注射方案,以提高递送细胞或药物的精度和一致性。这种方法的一个关键要素是定位和可视化初级静脉的能力,这对于准确给药物质至关重要。虽然建议使用半透明的 Casper 斑马鱼品系以实现最佳的血管能见度,但我们的方案适用于各种成年斑马鱼品系,前提是对可见性和准确性进行适当的调整。选择合适的针规对于最大限度地减少血管损伤和确保有效的物质运输至关重要。此外,全面的注射后护理被优先考虑,包括保持清洁和含氧良好的水。这些做法不仅简化了注射过程,还显着改善了斑马鱼的健康和存活率,从而获得了更可靠和可重复的实验结果。
此外,我们对成年斑马鱼的心内、 RO 和 IV 注射技术进行了比较分析,证明了 IV 方法在提高存活率和促进细胞植入方面的独特优势。尽管它们有传统用途,但心内注射与高死亡率有关13,并且有效 RO 注射所需的精度很难始终达到14。IV 技术的微创性质显着减轻了鱼的压力和身体创伤,从而大大提高了注射后的存活率和植入结果。此外,在 IV 注射的鱼中移植后第 3 天快速检测 GFP 信号进一步强调了该方法在促进有效细胞植入方面的效率。相比之下,心内注射的鱼中 GFP 信号出现较慢,而 RO 注射的鱼中几乎没有信号,这强调了这些替代方法的局限性,表明 IV 方法是一种更有效的方法。
虽然 IV 注射方法具有显着优势,但它也有潜在的局限性,例如需要专门的设备和培训才能达到高精度。此外,虽然 Casper 菌株的半透明性有助于静脉可视化,但将这种方法应用于半透明的菌株可能需要额外的可见性和技术增强。此外,需要进一步研究以评估 IV 注射的长期影响并评估斑马鱼中移植细胞长时间的稳定性,这对于验证该技术的持续成功和安全性至关重要。
静脉注射技术在将物质输送到血液中并在成年斑马鱼中实现高植入水平方面的有效性对未来的研究具有几个意义。这种方法可以在长期研究中更有效地使用成年斑马鱼,解决了与幼鱼模型相关的一些限制。IV 方法的可靠性提高了研究复杂疾病和进行药物筛选的模型的准确性,有可能在治疗策略方面取得重大进展。此外,静脉注射在实现稳健植入方面的成功为进一步探索基因作和移植奠定了坚实的基础,这对于研究遗传疾病和免疫反应至关重要。这种 IV 注射方案的进步有望为斑马鱼研究做出重大贡献,改进生物医学研究的工具,并加速理解和治疗人类疾病的进展。
披露声明
作者没有需要声明的利益冲突。
致谢
我们感谢香港大学比较医学研究中心 (CCMR) 的 Zebrafish Facility。我们感谢 Jo Yiu Ling Wong 女士对动物的帮助。这些工作得到了主题研究计划(T12-702/20-N)、健康与医学研究基金项目编号08192066和08193106、中国自然科学基金(NSFC)/研究资助局(RGC)2021/22 N_HKU745/21联合研究计划、中国国家重点研发计划(2023YFA1800100)以及由创新和技术委员会资助的Health@InnoHK计划下的肿瘤和免疫学中心的支持。 中国香港特别行政区政府 (A.Y.H.L.)。
材料
| Name | Company | Catalog Number | Comments |
| Autoclaves Steam Sterilizer | HIRAYAMA | HRG-140 | |
| Centrifuge 5424 | Eppendorf | ||
| Countess 3 Automated Cell Counter | Thermofisher | ||
| Countess II FL | Invitrogen | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-aldrich | MKCL9483 | |
| Falcon 40 µm Cell Strainer | CORNING | Blue, Sterile, Individually Packaged, 50/Case | |
| FBS, Qualified | Gibco | 26140079 | |
| FITC-Dextran (MW 10000) | MedChemExpress | 60842-46-8 | |
| Injection needle | Hamilton | HAMI207434 | 34 G, 10 mm length |
| Micro syringe | Hamilton | 7635-01 | 10 µL capacity, Model 701 RN |
| Nikon SMZ18 | |||
| PBS pH 7.4 (1x) | Gibco | 10010023 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco™ | 15070063 | 100x |
| Pipette Tips | Eppendorf | epTIPS | |
| Single Channel Pipette | Eppendorf | 05-403-151 | |
| UltraPure Distilled Water | Invitrogen | 10977015 |
参考文献
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K., Kim, C. H. Zebrafish as an animal model for biomedical research. Exp Mol Med. 53 (3), 310-317 (2021).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8 (5), 353-367 (2007).
- Wu, J. Q., et al. Patient-derived xenograft in zebrafish embryos: a new platform for translational research in gastric cancer. J Exp Clin Cancer Res. 36 (1), 160(2017).
- Welker, A. M., et al. Correction: Standardized orthotopic xenografts in zebrafish reveal glioma cell-line-specific characteristics and tumor cell heterogeneity. Dis Model Mech. 9 (9), 1063-1065 (2016).
- Stoletov, K., Montel, V., Lester, R. D., Gonias, S. L., Klemke, R. High-resolution imaging of the dynamic tumor cell vascular interface in transparent zebrafish. Proc Natl Acad Sci U S A. 104 (44), 17406-17411 (2007).
- Etchin, J. P. K. J., Look, A. T. Zebrafish as a model for the study of human cancer. Methods Cell Biol. 105, 309-337 (2011).
- Khan, N., Mahajan, N. K., Sinha, P., Jayandharan, G. R. An efficient method to generate xenograft tumor models of acute myeloid leukemia and hepatocellular carcinoma in adult zebrafish. Blood Cells Mol Dis. 75, 48-55 (2019).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- He, B. L., et al. Functions of flt3 in zebrafish hematopoiesis and its relevance to human acute myeloid leukemia. Blood. 123 (16), 2518-2529 (2014).
- Wang, D., et al. Transgenic IDH2(R172K) and IDH2(R140Q) zebrafish models recapitulated features of human acute myeloid leukemia. Oncogene. 42 (16), 1331(2023).
- Fan, R. Y., et al. Zebrafish xenograft model for studying mechanism and treatment of non-small cell lung cancer brain metastasis. J Exp Clin Cancer Res. 40 (1), 371(2021).
- LeBlanc, J., Bowman, T. V., Zon, L. Transplantation of whole kidney marrow in adult zebrafish. J Vis Exp. (2), e159(2007).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645(2009).
- Benjamin, D. C., Hynes, R. O. Intravital imaging of metastasis in adult zebrafish. BMC Cancer. 17 (1), 660(2017).
- Hilligan, K. L., et al. Intravenous administration of BCG protects mice against lethal SARS-CoV-2 challenge. J Exp Med. 219 (2), e20211862(2022).
- Moreo, E., et al. Intravenous administration of BCG in mice promotes natural killer and T cell-mediated antitumor immunity in the lung. Nat Commun. 14 (1), 6090(2023).
- Wang, Z., et al. Intravenous administration of IL-12 encoding self-replicating RNA-lipid nanoparticle complex leads to safe and effective antitumor responses. Sci Rep. 14 (1), 7366(2024).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), e59295(2019).
- Rojas, A. M., Shiau, C. E. Brain-localized and Intravenous Microinjections in the Larval Zebrafish to Assess Innate Immune Response. Bio Protoc. 11 (7), e3978(2021).
- van Soest, J. J., et al. Comparison of static immersion and intravenous injection systems for exposure of zebrafish embryos to the natural pathogen Edwardsiella tarda. BMC Immunol. 12, 58(2011).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous microinjections of zebrafish larvae to study acute kidney injury. J Vis Exp. (42), e2079(2010).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. (54), e2839(2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。