Method Article
Регистрация внутренних выпрямляющих токов K+ в свежевыделенных гладкомышечных клетках базилярной артерии методом Patch Clamp
В этой статье
Резюме
Этот протокол описывает быстрый и эффективный метод выделения гладкомышечных клеток из базилярной артерии крысы и регистрации направленных внутрь токов калиевых каналов в этих клетках с использованием техники патч-зажима для целых клеток. Он предлагает новый подход для исследователей, изучающих базилярную артерию и ионные каналы.
Аннотация
Цереброваскулярные заболевания являются распространенным заболеванием среди пожилых людей, и их частота неуклонно растет. Базилярная артерия является важнейшим мозговым сосудом, который снабжает мост, мозжечок, задние отделы мозга и внутреннее ухо. Активность канала калия (К+) играет важную роль в определении тонуса сосудов путем регуляции потенциала клеточной мембраны. Активация направленных внутрь выпрямляющих K+ (Kir) каналов, как и других K+ каналов, приводит к гиперполяризации клеточных мембран и вазодилатации. В этом исследовании свежевыделенные гладкомышечные клетки базилярной артерии были использованы для регистрации токов Kir с помощью метода зажима целых клеток. Исследовано влияние 100 мкмоль/л BaCl2, ингибитора Kir-канала, и 10 мкмоль/л нитропруссида натрия (SNP), нитровазодилататора, на токи Kir-канала. Результаты показали, что BaCl2 ингибирует токи Kir-канала в гладкомышечных клетках базилярной артерии, в то время как SNP усиливает эти токи. Этот протокол представляет собой исчерпывающее руководство по подготовке свежевыделенных артериальных гладкомышечных клеток и регистрации токов канала Kir с использованием техники патч-зажима, предлагая ценный ресурс для исследователей, стремящихся овладеть этим методом.
Введение
Цереброваскулярные заболевания являются распространенным заболеванием у пожилых людей. С повышением уровня жизни, увеличением продолжительности жизни и старением населения заболеваемость цереброваскулярными заболеваниями неуклоннорастет1. Базилярная артерия, непарный сосуд, образованный слиянием двусторонних позвоночных артерий, проходит под мостом внутри черепа и разделяется на две задние мозговые артерии. Он снабжает мост, мозжечок, задние отделы мозга и внутреннее ухо. Недостаточное кровоснабжение базилярной артерии может привести к эпизодическому головокружению, часто сопровождающемуся тошнотой и рвотой. Пациенты также могут испытывать такие симптомы, как шум в ушах, потеря слуха и другие связанные с этим проблемы. Эти симптомы часто связаны с такими состояниями, как шейный спондилез, церебральный атеросклероз и аномальное кровяное давление. Цереброваскулярные заболевания, особенно распространенные среди людей среднего и пожилого возраста, часто связаны с этими основными заболеваниями 2,3,4.
Артерии сопротивления играют жизненно важную роль в сердечно-сосудистой функции и поддержании гомеостаза организма. Являясь основным местом сосудистого сопротивления, они регулируют кровяное давление и сердечный выброс, обеспечивая достаточный кровоток для удовлетворения метаболических и физиологических потребностей тканей и органов5. Базилярная артерия, классифицируемая как резистентная артерия, в первую очередь регулирует приток крови к стволу мозга6. Гладкомышечные клетки, которые формируют стенки артерий сопротивления, являются ключевыми медиаторами сосудистого сопротивления за счет регуляции стационарного сокращения или сосудистого напряжения. Эти клетки содержат многочисленные ионные каналы, в том числе K+-каналы,Ca-2+ каналы и Cl-каналы, которые имеют решающее значение для модуляции сосудистого тонуса 5,7.
К+ каналы имеют решающее значение в установлении мембранного потенциала и регуляции сократительного тонуса артериальных гладкомышечных клеток8. Существует четыре типа K+ каналов в гладкой мускулатуре артерий: потенциал-зависимый K+ (Kᴠ), Ca2+-зависимый K+ (KCa), АТФ-зависимый K+ (KATP) и внутренний выпрямитель K+ (Kir) каналы 9,10,11. Kir-каналы подразделяются на семь подтипов, где Kir2.x — это классические kir-каналы. Среди них наиболее актуальными в сосудистой системе являются подсемейства Kir2.x. Токи Kir демонстрируют внутреннее выпрямление при отрицательных напряжениях, что указывает на суммарный приток K+ в ячейку, в то время как при положительных напряжениях суммарныйток K+ минимальен или отсутствует вовсе5. В сердечно-сосудистой системе каналы Kir необходимы для стабилизации мембранного потенциала. Их активация индуцирует гиперполяризацию клеточных мембран и вазодилатацию 12,13,14.
Эксперименты с наложением пластыря на свежевыделенных гладкомышечных клетках были проведены в различных артериях, включая коронарные, церебральные, почечные и брыжеечные артерии15,16. В то время как некоторые методы используют один и тот же тип коллагеназы для выделения клеток, точные процедуры различаются. В немногих исследованиях были всесторонне обобщены методы выделения гладкомышечных клеток сосудов. Таким образом, данное исследование сосредоточено на свежей изоляции первичных сосудистых гладкомышечных клеток из базилярной артерии крысы и регистрации токов канала Kir в этих клетках с использованием техники цельноклеточного зажима, что обеспечивает подробный и полный протокол для исследователей в смежных областях.
протокол
Протокол для животных был одобрен Комитетом по этике благополучия лабораторных животных Университета традиционной китайской медицины в Чэнду (запись No 2024035). В данном исследовании использовались самцы крыс породы Спрэг-Доули (SD) массой тела 260-300 г и возрастом 8-10 недель. Животных кормили водой и пищей (SPF экспериментального корма для животных) в неограниченном количестве. Подробная информация о реагентах и оборудовании, использованных в данном исследовании, приведена в Таблице материалов.
1. Диссекция базилярной артерии крысы
- Приготовление раствора
- Приготовьте растворы, как описано в таблице 1.
- Обезболить крысу путем ингаляции 2% изофлурана. Подтвердите глубокую анестезию с помощью щипки пальца ноги. При необходимости введите дополнительные анестетики. Немедленно приступайте к вскрытию черепа и обнажите мозг на портативном операционном столе.
- Быстро перенесите мозг в чашку Петри, содержащую ПСС, насыщенный 95%О2 и 5%СО2 при 4 °С. Убедитесь, что pH раствора составляет 7,40.
- Расположите мозг вентрально вверх в чашке Петри и закрепите ее иглами. Под световым микроскопом найдите базилярную артерию и осторожно удалите окружающие ткани с помощью автоклавного пинцета и ножниц (см. рисунок 1A).
- Вставьте проволоку длиной 2 см и диаметром 25 мкм в изолированную базилярную артерию. Аккуратно потрите внутреннюю стенку проволокой, чтобы эффективно удалить эндотелий сосудов.
ПРИМЕЧАНИЕ: Базилярная артерия у крыс расположена в базальной борозде ствола мозга у основания мозга и образована слиянием левой и правой позвоночных артерий. Во время процесса изоляции обращайтесь с артерией осторожно, чтобы избежать чрезмерного растяжения или сжатия, которые могут привести к повреждению.
2. Выделение гладкомышечных клеток
- Предварительно нагрейте 1 мл раствора для разделения клеток, 1 мл ферментативного гидролизата I и 1 мл ферментативного гидролизата II до 37 °C в пробирках 1, 2 и 3 соответственно (см. рисунок 1B).
- Перенесите изолированную базилярную артерию в пробирку 2. Непрерывно вводите в пробирку смесь 95%O2 и 5%CO2 и поддерживайте ферментативную обработку в течение 30 минут (см. рисунок 1C).
- Перенесите базилярную артерию из пробирки 2 в пробирку 3. Продолжайте вводить в трубку 95%O2 и 5%CO2 и поддерживайте ферментативную обработку в течение 5 минут (см. рисунок 1D).
- Добавьте 1 мл раствора для разделения клеток при температуре 37 °C из пробирки 1 в пробирку 3. Продолжайте вводить 95%O2 и 5%CO2 , сохраняя ферментативную обработку в течение 3 минут. Растирайте препарат базилярной артерии для высвобождения клеток (см. рисунок 1E).
- Добавьте разделительный раствор 4 °C в пробирку 3, чтобы завершить ферментативный процесс (см. рисунок 1F). Центрифугируйте смесь при 59 × г в течение 6 мин. Выбросьте надосадочную жидкость с помощью пипетки, снова добавьте раствор для разделения при температуре 4 °C (см. рисунок 1G) и дважды повторите центрифугирование для удаления остаточных ферментов.
- Удалите надосадочную жидкость с помощью пипетки и храните 1 мл клеточной суспензии при температуре 4 °C до 6-8 ч.
- Возьмите 100 мкл клеточной суспензии и поместите ее в ванну (см. рисунок 1H). Добавьте в ванну 1 мл внеклеточной жидкости и дайте клеткам отстояться в течение 40 минут, чтобы прикрепиться ко дну (см. рисунок 2).
ПРИМЕЧАНИЕ: Для клеток в группе обработки (например, BaCl2 или нитропруссид натрия) предварительно инкубируйте с соответствующими веществами при комнатной температуре (22-26°C) в течение 40 минут в течение периода прикрепления.
3. Регистрация тока Kir с помощью цельноклеточного патч-клеммы
- Изготовление микропипеток
- Включите съемник микропипетки (см. Таблицу материалов).
- Поместите стеклянную трубку (внешний диаметр: 1,5 мм, внутренний диаметр: 1,10 мм, длина: 10 см) в съемник. Выберите Программу 1, нажмите Enter и откройте Программу 1. Проведите испытание на рампу, нажав кнопку «Рампа» на панели управления, чтобы измерить теплоту стеклянной трубки.
ПРИМЕЧАНИЕ: Отредактируйте программу 1 со следующими параметрами: Нагрев: Нарастание, Натяжение: 0, Скорость: 25, Задержка: 1, Давление: 500, Режим: Задержка, Безопасный нагрев включен. Испытание на рампу необходимо проводить при смене филаментов или типов стеклянных пипеток. Микропипетки должны иметь диаметр наконечника ~1-2 мкм и длину конуса примерно 5 мм. Меньший диаметр наконечников и более длинные конусы приводят к более высокому сопротивлению пипетки. - Вставьте новую стеклянную трубку и выберите Программа 1. Нажмите Enter , чтобы изготовить микропипетку.
- Запись Kir Current
- Последовательно включайте аппаратные устройства: цифро-аналоговый преобразователь, усилитель сигнала, микроманипулятор, микроскоп, камеру и компьютер.
- Запустите программное обеспечение в следующем порядке: камера, усилитель сигнала и программное обеспечение для сбора данных.
ПРИМЕЧАНИЕ: Если микроскоп не оснащен камерой, то необходимо активировать только программное обеспечение прибора. Убедитесь, что программное обеспечение открыто после инициализации оборудования, чтобы обеспечить надлежащую функциональность. - В программном обеспечении для сбора данных выберите «Файл» > «Задать имена файлов данных », чтобы установить путь к хранению данных.
- Отредактируйте протокол записи токов Kir следующим образом:
- Интерфейс осциллограммы: Эпоха A и D: Тип = шаг; Первый уровень = −60 мВ; Уровень дельты = 0 мВ; Первая продолжительность = 100 мс; Длительность дельты = 0 мс. Эпоха B: Тип = шаг; Первый уровень = −160 мВ; Уровень дельты = 0 мВ; Первая длительность = 1 мс; Длительность дельты = 0 мс. Эпоха C: Тип = рампа; Первый уровень = 40 мВ; Дельта напряжения = 20 мВ; Первая длительность = 500 мс; Длительность дельты = 0 мс.
- Интерфейс Mode/Rate: Пробная задержка = 0 с; Пробежки = 1; Развертки = 1; Продолжительность развертки = 0,8 с.
- Интерфейс выходов: Канал #0; Уровень удержания = −60 мВ. Сохраните и назовите протокол как "Kir protocol".
ПРИМЕЧАНИЕ: Настройка протокола адаптирована для конкретных текущих записей и может быть повторно использована после сохранения. Убедитесь, что выходной интерфейс совпадает с проводкой прибора (например, канал #0).
- Включите функцию Membrane Test в меню Tools программного обеспечения для сбора данных.
- Расположите ячейку для измерения в центре обзора камеры микроскопа.
- Погрузите наконечник контрольного провода в раствор для ванны. Заполните 20% микропипетки (изготовленной на шаге 3.1) внутриклеточным раствором и закрепите его на держателе записывающего электрода.
- Приложите положительное давление с помощью шприца, переместите наконечник пипетки в раствор для ванны и отрегулируйте смещение пипетки в программном обеспечении усилителя сигнала, чтобы установить базовую линию тока на 0 пА (см. рис. 3A).
ПРИМЕЧАНИЕ: Используйте опорные провода Ag/AgCl. Сопротивление пипетки должно составлять 4-6 МОм.
- Приложите положительное давление с помощью шприца, переместите наконечник пипетки в раствор для ванны и отрегулируйте смещение пипетки в программном обеспечении усилителя сигнала, чтобы установить базовую линию тока на 0 пА (см. рис. 3A).
- Аккуратно прижмите пипетку к клеточной мембране. Наблюдайте увеличение сопротивления уплотнения (Rt) по меньшей мере до 1 МОм (рис. 3B). Снимите положительное давление и приложите отрицательное давление для создания высокого сопротивления с Rt ≥ 1 ГОм (Рисунок 3C).
- Установите удерживающее напряжение на −60 мВ и компенсируйте емкость электродов с помощью Cp Fast и Cp Slow (Рисунок 3D).
ПРИМЕЧАНИЕ: Если Rt остается выше 1 ГОм, перейдите к следующему шагу; В противном случае замените элемент или пипетку и повторите шаги 3.2.6-3.2.8.
- Установите удерживающее напряжение на −60 мВ и компенсируйте емкость электродов с помощью Cp Fast и Cp Slow (Рисунок 3D).
- Приложите кратковременное отрицательное давление, чтобы разорвать клеточную мембрану, образуя цельную клеточную конфигурацию (Рисунок 3E). Выберите Whole Cell в программном обеспечении усилителя сигнала, нажмите Auto для компенсации емкости мембраны (рис. 3F), загрузите протокол Kir и начните запись данных. Повторите шаги 3.2.6-3.2.9 для обработанных клеток.
ПРИМЕЧАНИЕ: Если последовательное сопротивление (Ra) составляет >30 МОм, выберите новую ячейку. Если 30 МОм > Ra > 10 МОм, примените компенсацию последовательного сопротивления перед записью. Для этого протокола требуется Ra < 10 МОм.
- Анализ данных
- Откройте программу для анализа данных и загрузите записанные данные. Используйте курсоры для анализа текущих кривых и экспорта данных для построения кривых ВАХ.
- Создайте сигнал формы сигнала стимула, выбрав «Правка» > «Создать сигнал формы сигнала стимула », и подтвердите.
- Экспортируйте трассировку протокола Kir, выбрав Edit > Transfer Traces, указав полную область трассировки и сигнал (A0 #0) и скопировав данные для дальнейшего анализа.
- Экспортируйте репрезентативные текущие трассы Kir, выбрав Edit > Transfer Traces, указав полную область трассировки и сигнал (IN 0) и скопировав данные для создания текущих графиков трассировки.
ПРИМЕЧАНИЕ: Нормализация данных тока с использованием плотности тока (пА/пФ) для точного сравнения между ячейками различных размеров. Убедитесь, что емкость мембраны (Cm) регистрируется во время эксперимента17.
Результаты
Выделение артериальных гладкомышечных клеток
В первом разделе процедуры подробно описан процесс выделения гладкомышечных клеток из базилярной артерии головного мозга крысы. Этот процесс проиллюстрирован на рисунке 1. Процедура включает в себя этапы ферментативного пищеварения и разделения клеток для высвобождения гладкомышечных клеток из артерии.
Репрезентативные изображения изолированных гладкомышечных клеток
Во втором разделе представлена репрезентативная диаграмма выделенных гладкомышечных клеток. На рисунке 2 представлены светлопольные изображения гладкомышечных клеток веретенообразной формы, подтверждающие их принадлежность к гладкомышечным клеткам на основе их характерной формы.
Техника зажима целых клеток
В третьем разделе представлена блок-схема метода патч-зажима для цельных клеток, используемого для регистрации токов Kir в только что выделенных гладкомышечных клетках. На рисунке 3 представлена подробная иллюстрация установки патч-зажима и процедур для создания конфигурации целой ячейки.
Запись тока Kir
В четвертой части представлен репрезентативный ток Kir, зарегистрированный из свежевыделенных гладкомышечных клеток с использованием метода патч-зажима для целых клеток. На рисунке 4 показаны зарегистрированные токи и влияние различных вмешательств на активность канала Kir. На рисунке 4А показан типичный ток Kir, демонстрирующий внутреннюю выпрямляемость при отрицательных напряжениях, что указывает на суммарный приток K+ в ячейку. При положительном напряжении суммарный ток K+ минимален или отсутствует. На рисунке 4B показано ингибирование токов Kir специфическим ингибитором BaCl2. Результаты показывают, что Ba2+ в концентрациях 100-300 мкмоль/л эффективно блокирует Kir-каналы, подтверждая ток как Kir. На рисунке 4C показано влияние нитропруссида натрия (SNP), нитровазодилататора, на токи Kir. Данные показывают, что SNP увеличивает ток Kir, что предполагает участие Kir-каналов в SNP-индуцированной вазодилатации. На рисунке 4F представлены значения емкости (Cm) в группах control, BaCl2 и SNP. Результаты не указывают на статистическую значимость значений Cm в этих группах.
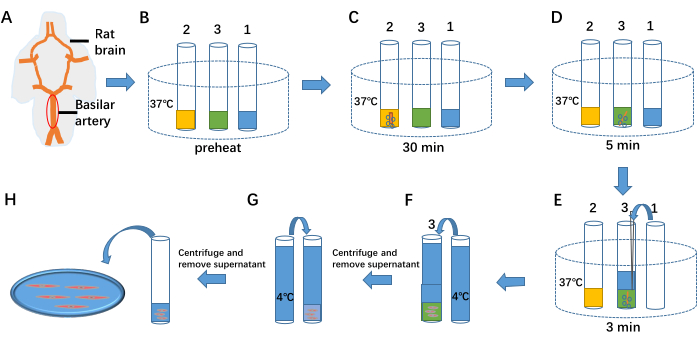
Рисунок 1: Выделение артериальных гладкомышечных клеток. (A) Вентральная сторона мозга крысы и базилярная артерия. (B) Предварительный нагрев 1 мл раствора для разделения клеток, 1 мл ферментативного гидролизата I клетки и 1 мл ферментативного гидролизата II клетки до 37 °C в пробирках 1, 2 и 3 соответственно. (К-Е) Три этапа отделения клеток от сосудистой ткани с помощью ферментативного лечения. (Ф,Г) Окончание ферментативной обработки путем добавления разделительного раствора 4 °C. (H) Клеточная жидкость, содержащая артериальные гладкомышечные клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Артериальные гладкомышечные клетки. (A) Светлопольный вид свежевыделенных гладкомышечных клеток сосудов, демонстрирующих веретенообразную морфологию. Масштабная линейка: 10 мкм. (B) Здоровые клетки, пригодные для экспериментов с патч-зажимом. Масштабная линейка: 30 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
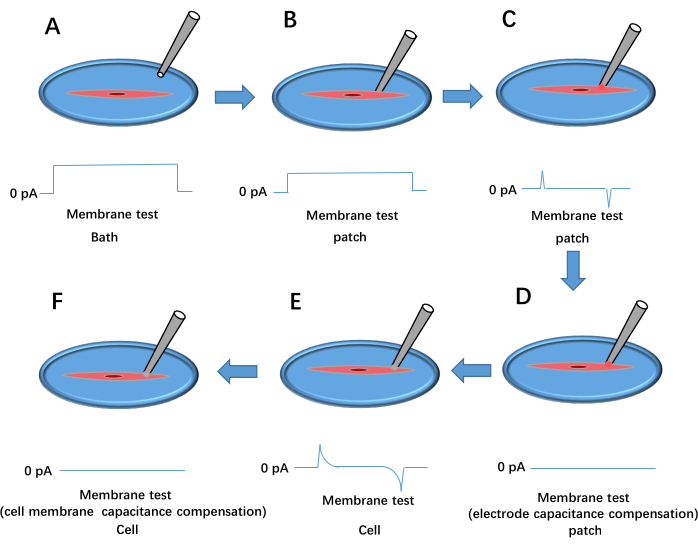
Рисунок 3: Процесс формирования патч-зажима для всей клетки. Это показывает результат испытания мембраны импульсным напряжением. (A) Пипетку опускают в ванну. (B) Записывающий электрод перемещается так, чтобы он соприкасался с ячейкой, и прижимается к мембране. (В) Образование высокопрочного уплотнения между пипеткой и клеткой. (D) Компенсация емкости электрода. (E) Разрыв клеточной мембраны. (F) Компенсация емкости клеточной мембраны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
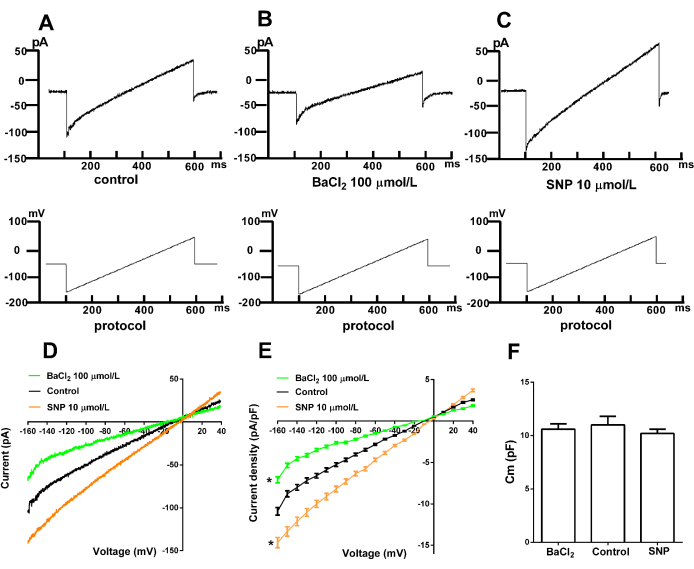
Рисунок 4. Репрезентативный ток Kir в гладкомышечных клетках артерий. (A) Нормальный ток Kir. (B) Ингибирование специфическим ингибитором BaCl2. (C) Влияние нитропруссида натрия (SNP) на ток Kir. (D) Вольт-амперная кривая кировых токов. (E) Статистические результаты. p < 0,05, BaCl2 (n = 6) и SNP (n = 6) по сравнению с контрольной группой (n = 6); различия анализировали с помощью двухстороннего двустороннего ANOVA. (F) Cm (pF), p > 0,05, BaCl2 (n = 6) и SNP (n = 6) по сравнению с контрольной группой (n = 6); Различия были проанализированы с помощью Т-критерия. Протокол стимуляции: Удержание при -60 мВ с линейной стимуляцией от -160 мВ до +40 мВ в течение 500 мс. Контроль, BaCl2 и SNP проводили отдельно в разных группах клеток. Соединения добавлялись за 40 минут до записи и могли оставаться в ванне до 20 минут во время записи. SNP: нитропруссид натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Тип решения | Состав раствора | Ключевые моменты | ||
| Физиологический раствор соли (ПСС, ммоль/л) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-глюкоза, 5 HEPES | Пропитайте раствор и наполните его смесью газа, состоящей на 95%О2 и 5%СО2 перед использованием. Затем отрегулируйте pH раствора до 7,4 с помощью NaOH. Температура для изготовления и хранения при комнатной температуре и 4°C соответственно | ||
| Раствор для разделения клеток (ммоль/л) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-глюкоза, 5 HEPES | То же, что и физиологический раствор соли | ||
| Клеточный ферментативный гидролизат I | В раствор для разделения клеток добавляли сывороточный альбумин крупного рогатого скота (БСА): 1 мг/мл, дитиотреитол (ДТТ): 1 мг/мл и папаин: 0,5 мг/мл | Приготовьте раствор сразу для использования. Температура для его изготовления при комнатной температуре | ||
| Ферментативный гидролизат клеток II | В раствор для разделения клеток добавляли БСА: 1 мг/мл, коллагеназу H: 0,3 мг/мл и коллагеназу F: 0,7 мг/мл | То же, что и ферментативный гидролизат I клетки | ||
| Раствор для ванны Kir тока (ммоль/л) | 12 NaCl, 130 KCl, 0,4 KH2PO4 , 0,32PO4, 2 NaHCO3 , 1 MgCl2 , 1,8 CaCl2 , 10 HEPES, 5,5 глюкозы | Скорректировано до pH 7,4 с использованием NaOH и осмолярности 310 мОсм. Температура для изготовления и хранения при комнатной температуре и 4°C соответственно | ||
| Раствор для наполнения пипетками Kir тока (ммоль/л) | 100 калий-D-глюконат, 30 KCl, 1 MgCl2, 1 EGTA, 15 HEPES, 1 Na2-АТФ | Отрегулирован до pH 7,2 с помощью KOH и осмолярности 300 мОсм. Температура для изготовления и хранения при комнатной температуре и -20°C соответственно | ||
Таблица 1: Состав и меры предосторожности при приготовлении различных растворов.
Обсуждение
Запись целых клеток с использованием свежевыделенных клеток восходит к началу 1980-хгодов18, а запись токов каналов от базилярных гладкомышечных клеток грызунов стала широко практиковаться в 1990-хгодах19. С развитием технологий исследователи все больше сосредотачиваются на результатах, достигнутых с помощью этих технологий. Однако внимание, уделяемое обновлению и обобщению технических методов, постепенно уменьшается. В данной статье представлен подробный метод свежего разделения гладкомышечных клеток сосудов и последующего использования этих клеток для регистрации токов Kir, с целью помочь исследователям в понимании стандартного методологического процесса.
Гладкие мышцы сосудов играют решающую роль в регулировании артериального давления. Сообщалось о многочисленных методах разделения сосудистых гладкомышечных клеток 20,21,22,23,24,25, большинство из которых включают ферментативный гидролиз. Тем не менее, типы и этапы ферментов варьируются в разных исследованиях, и различные условия эксперимента могут влиять на ферментативную эффективность. В данной статье представлен метод ферментативного гидролиза с небольшими изменениями в типах ферментов и процедурах по сравнению с предыдущими исследованиями. Он предоставляет подробный протокол для острого разделения первичных сосудистых гладкомышечных клеток.
Ключевыми этапами данного протокола являются шаги с 2.2 по 2.4, так как успешное выполнение этих этапов напрямую влияет на качество выделенных клеток. Выделенные гладкие мышечные клетки сосудов подходят для различных применений, включая эксперименты с патч-клэмпингом для изучения ионных каналов, экстракцию РНК и белков для молекулярных исследований и иммунофлуоресценцию для изучения экспрессии белков на клетках. Следовательно, этот метод предлагает универсальный подход для соответствующих исследователей, предоставляя больше экспериментальных возможностей.
Проводимость калия (K+) на мембране гладкомышечных клеток артерий играет решающую роль в регуляции мембранного потенциала, сосудистого напряжения и, в конечном счете, местного кровотока26,27. Канал Kir, тип канала K+, обнаруженный в гладких мышечных клетках артерий, помогает стабилизировать мембранный потенциал и действует как электрический усилитель для других каналов K+. При активации канал Kir индуцирует гиперполяризацию мембраны и способствует расширению сосудов28. Технология патч-хомутов долгое время считалась золотым стандартом для исследования ионных каналов29,30, при этом патч-хомут для целых ячеек является наиболее часто используемым методом31. Хотя этот метод требует высокого уровня квалификации оператора, мастерство в конечном итоге зависит от следования стандартизированным протоколам.
В этом исследовании представлена детальная, стандартизированная процедура регистрации токов Kir из свежевыделенных сосудистых гладкомышечных клеток с использованием целоклеточного зажима, что является ценным ориентиром для исследователей. Критическими шагами в протоколе являются шаги с 3.2.7 по 3.2.9, так как успешное выполнение этих шагов определяет, будут ли успешными последующие записи тока Kir. Кроме того, выбор внутриклеточных жидкостей и жидкостей для ванн существенно влияет на регистрируемый ток. Например, использование внеклеточного калия с высоким содержанием калия в этом исследовании было направлено на полную активацию внутреннего выпрямителя калиевого канала. Поэтому успех эксперимента зависит от тщательного внимания к каждой детали операции.
В то время как свежевыделенные клетки имеют большую физиологическую значимость, чем клеточные линии, существуют внутренние ограничения. К ним относятся влияние температуры окружающей среды на ферментативное разделение, различное время переваривания кровеносных сосудов разного диаметра и нестабильность нативной среды клеток. В результате время ферментативного сбраживания часто приходится корректировать. Технология патч-зажимов также создает технические проблемы, особенно на этапах герметизации и разрыва мембраны, которые требуют высокой квалификации оператора. Состояние клетки напрямую влияет на успешность всей процедуры патч-зажима. Следовательно, тщательное внимание к этим ограничениям имеет важное значение для обеспечения успеха эксперимента.
Ba2+ широко используется в качестве специфического блокатора для изучения роли Kir-каналов в клетках и тканях. При концентрациях ниже 100 моль/л Ba2+ избирательно блокирует каналы Kir, в то время как концентрации до 300 моль/л могут полностью блокировать их32. В этом исследовании BaCl2 использовался для проверки тока в канале Kir.
Кир-каналы регулируются как сосудосуживающими, так и сосудорасширяющими средствами. SNP (нитропруссид натрия), нитровазодилататор, был использован в этом исследовании для изучения этого. SNP метаболизируется в гладких мышцах сосудов с образованием оксида азота, который снижает системное сосудистое сопротивление, воздействуя как на венозные, так и на артериальные гладкие мышцы, потенциально увеличивая сердечный выброс. Благодаря быстрому началу и короткому периоду полувыведения, SNP обычно используется в качестве агента первой линии для профилактики и лечения гипертензии33. В исследовании было отмечено, что SNP усиливает ток Kir в гладкомышечных клетках базилярной артерии, что предполагает активацию каналов Kir во время вазодилатации, вызванной SNP.
Ограничением настоящих записей является то, что они были получены из разных групп клеток, а сравнения проводились путем анализа текущих плотностей между группами. Более совершенный подход включает в себя регистрацию реакций одних и тех же клеток до и после применения соединений, что сведет к минимуму влияние вариабельности от клетки к клетке на интерпретацию данных.
В заключение данной статьи приводится подробный протокол острой изоляции гладкомышечных клеток базилярной артерии крысы и использования цельноклеточного зажима для изучения токов Kir. Этот протокол универсален и может быть применен к гладкомышечным клеткам из других артерий, таких как коронарные, брыжеечные и почечные артерии. Тем не менее, время ферментативного разделения может потребоваться скорректировать в зависимости от типа артерии. Кроме того, изолированные артериальные гладкомышечные клетки могут быть использованы во множестве других экспериментальных методов.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана Специальной программой талантов Университета традиционной китайской медицины Чэнду в рамках «Плана содействия исследованиям ученых и талантов в области дисциплины Синлинь» (33002324) и Ключевым проектом исследований и разработок для представления научных и технологических талантов высокого уровня в городе Лулян (2022RC28).
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
Ссылки
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены