Method Article
Registrazione delle correnti K+ rettificanti verso l'interno nelle cellule muscolari lisce dell'arteria basilare appena isolate mediante tecnica di patch clamp
In questo articolo
Riepilogo
Questo protocollo descrive un metodo rapido ed efficiente per isolare le cellule muscolari lisce dall'arteria basilare di ratto e registrare le correnti del canale del potassio che rettificano verso l'interno in queste cellule utilizzando la tecnica del patch clamp a cellula intera. Offre un nuovo approccio per i ricercatori che studiano l'arteria basilare e i canali ionici.
Abstract
La malattia cerebrovascolare è una condizione prevalente tra gli anziani, con la sua incidenza in costante aumento. L'arteria basilare è un vaso cerebrale critico che irrora il ponte, il cervelletto, le regioni cerebrali posteriori e l'orecchio interno. L'attività del canale del potassio (K+) svolge un ruolo significativo nel determinare il tono vascolare regolando il potenziale di membrana cellulare. L'attivazione dei canali K+ (Kir) che rettificano verso l'interno, come altri canali K+ , porta all'iperpolarizzazione e alla vasodilatazione della membrana cellulare. In questo studio, le cellule muscolari lisce appena isolate dall'arteria basilare sono state utilizzate per registrare le correnti Kir tramite la tecnica del patch clamp a cellula intera. Sono stati studiati gli effetti di 100 μmol/L di BaCl2, un inibitore del canale Kir, e di 10 μmol/L di nitroprusside di sodio (SNP), un nitrovasodilatatore, sulle correnti del canale Kir. I risultati hanno dimostrato che BaCl2 ha inibito le correnti del canale Kir nelle cellule muscolari lisce dell'arteria basilare, mentre lo SNP ha potenziato queste correnti. Questo protocollo fornisce una guida completa per la preparazione di cellule muscolari lisce arteriose appena isolate e per la registrazione delle correnti del canale Kir utilizzando la tecnica del patch clamp, offrendo una risorsa preziosa per i ricercatori che cercano di padroneggiare questo metodo.
Introduzione
La malattia cerebrovascolare è una condizione prevalente nella popolazione anziana. Con il miglioramento del tenore di vita, l'aumento dell'aspettativa di vita e l'invecchiamento della popolazione, l'incidenza delle malattie cerebrovascolari è in costante aumento1. L'arteria basilare, un vaso spaiato formato dalla fusione delle arterie vertebrali bilaterali, corre sotto il ponte all'interno del cranio e si divide in due arterie cerebrali posteriori. Fornisce il ponte, il cervelletto, le regioni posteriori del cervello e l'orecchio interno. Un insufficiente afflusso di sangue all'arteria basilare può portare a vertigini episodiche, spesso accompagnate da nausea e vomito. I pazienti possono anche manifestare sintomi come acufene, perdita dell'udito e altri problemi correlati. Questi sintomi sono spesso associati a condizioni come la spondilosi cervicale, l'aterosclerosi cerebrale e la pressione sanguigna anormale. La malattia cerebrovascolare, particolarmente diffusa tra gli individui di mezza età e gli anziani, è spesso collegata a queste condizioni di base 2,3,4.
Le arterie di resistenza svolgono un ruolo vitale nella funzione cardiovascolare e nel mantenimento dell'omeostasi corporea. Come sito primario di resistenza vascolare, regolano la pressione sanguigna e la gittata cardiaca, garantendo un flusso sanguigno sufficiente a soddisfare le richieste metaboliche e fisiologiche di tessuti e organi5. L'arteria basilare, classificata come arteria di resistenza, regola principalmente il flusso sanguigno al tronco encefalico6. Le cellule muscolari lisce, che formano le pareti delle arterie di resistenza, sono mediatori chiave della resistenza vascolare attraverso la regolazione della contrazione allo stato stazionario o della tensione vascolare. Queste cellule ospitano numerosi canali ionici, tra cui i canali K+, i canali Ca2+ e i canali Cl-, che sono fondamentali per la modulazione del tono vascolare 5,7.
I canali K+ sono fondamentali per stabilire il potenziale di membrana e regolare il tono contrattile delle cellule muscolari lisce arteriose8. Esistono quattro tipi di canali K+ nella muscolatura liscia arteriosa: K+ voltaggio-dipendente (Kᴠ), K+ dipendente dal Ca2+ (KCa), K+ ATP-dipendente (KATP) e i canali K+ (Kir) del raddrizzatore verso l'interno 9,10,11. I canali Kir sono classificati in sette sottotipi, con Kir2.x che sono canali Kir classici. Tra queste, le sottofamiglie Kir2.x sono le più rilevanti nel sistema vascolare. Le correnti Kir mostrano una rettifica verso l'interno a tensioni negative, indicando un afflusso netto di K+ nella cella, mentre a tensioni positive,il flusso di corrente K+ netto 5 è minimo o nullo. Nel sistema cardiovascolare, i canali Kir sono essenziali per stabilizzare il potenziale di membrana. La loro attivazione induce iperpolarizzazione e vasodilatazione della membrana cellulare 12,13,14.
Esperimenti di patch-clamp su cellule muscolari lisce appena isolate sono stati condotti in varie arterie, tra cui arterie coronarie, cerebrali, renali e mesenteriche15,16. Sebbene alcuni metodi utilizzino lo stesso tipo di collagenasi per l'isolamento cellulare, le procedure precise variano. Pochi studi hanno riassunto in modo completo i metodi per isolare le cellule muscolari lisce vascolari. Pertanto, questo studio si concentra sul nuovo isolamento delle cellule muscolari lisce vascolari primarie dall'arteria basilare di ratto e sulla registrazione delle correnti del canale Kir in queste cellule utilizzando la tecnica del patch clamp a cellula intera, fornendo un protocollo dettagliato e completo per i ricercatori in campi correlati.
Protocollo
Il protocollo sugli animali è stato approvato dal Comitato Etico per il Benessere degli Animali del Laboratorio di Medicina Tradizionale Cinese dell'Università di Chengdu (Record No. 2024035). In questo studio sono stati utilizzati ratti maschi di Sprague-Dawley (SD), del peso di 260-300 g e di età compresa tra 8 e 10 settimane. Agli animali è stata fornita acqua e cibo (mangime sperimentale SPF) ad libitum. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Dissezione dell'arteria basilare di ratto
- Preparazione della soluzione
- Preparare le soluzioni come descritto nella Tabella 1.
- Anestetizzare il ratto mediante inalazione di isoflurano al 2%. Confermare l'anestesia profonda con un pizzico per le dita dei piedi. Se necessario, somministrare ulteriori anestetici. Procedere immediatamente all'apertura del cranio e all'esposizione del cervello sul tavolo operatorio portatile.
- Trasferire rapidamente il cervello in una capsula di Petri contenente PSS satura con il 95% di O2 e il 5% di CO2 a 4 °C. Assicurarsi che la soluzione abbia un pH di 7,40.
- Posiziona il cervello ventralmente verso l'alto in una capsula di Petri e fissalo con degli aghi. Al microscopio ottico, individuare l'arteria basilare e rimuovere con cura il tessuto circostante utilizzando pinzette e forbici autoclavate (vedi Figura 1A).
- Inserire un filo lungo 2 cm con un diametro di 25 μm nell'arteria basilare isolata. Strofinare delicatamente la parete interna con il filo per rimuovere efficacemente l'endotelio vascolare.
NOTA: L'arteria basilare nei ratti è situata all'interno dei solchi basali del tronco encefalico alla base del cervello ed è formata dalla confluenza delle arterie vertebrali sinistra e destra2. Durante il processo di isolamento, maneggiare l'arteria con cura per evitare un eccessivo stiramento o compressione che potrebbe causare danni.
2. Isolamento delle cellule muscolari lisce
- Preriscaldare 1 mL di soluzione di separazione cellulare, 1 mL di idrolizzato enzimatico I e 1 mL di idrolizzato enzimatico II a 37 °C rispettivamente nelle provette 1, 2 e 3 (vedere la Figura 1B).
- Trasferire l'arteria basilare isolata nella provetta 2. Iniettare continuamente una miscela di 95% di O2 e 5% di CO2 nella provetta e mantenere il trattamento enzimatico per 30 minuti (vedere Figura 1C).
- Trasferire l'arteria basilare dalla provetta 2 alla provetta 3. Continuare a iniettare il 95% di O2 e il 5% di CO2 nel tubo e mantenere il trattamento enzimatico per 5 minuti (vedere Figura 1D).
- Aggiungere 1 mL di soluzione di separazione cellulare a 37 °C dalla provetta 1 alla provetta 3. Continuare a iniettare il 95% di O2 e il 5% di CO2 mantenendo il trattamento enzimatico per 3 minuti. Triturare la preparazione dell'arteria basilare per rilasciare le cellule (vedi Figura 1E).
- Aggiungere una soluzione di separazione a 4 °C alla provetta 3 per terminare il processo enzimatico (vedere Figura 1F). Centrifugare il composto a 59 × g per 6 min. Eliminare il surnatante utilizzando una pipetta, aggiungere nuovamente la soluzione di separazione a 4 °C (vedere Figura 1G) e ripetere la centrifugazione due volte per rimuovere gli enzimi residui.
- Rimuovere il surnatante utilizzando una pipetta e conservare 1 mL di sospensione cellulare a 4 °C per un massimo di 6-8 ore.
- Prelevare 100 μl della sospensione cellulare e metterla nella vasca da bagno (cfr. figura 1H). Aggiungere 1 mL di liquido extracellulare al bagno e lasciare che le cellule si stabilizzino per 40 minuti per attaccarsi al fondo (vedere la Figura 2).
NOTA: Per le cellule del gruppo di trattamento (ad es. BaCl2 o nitroprussiato di sodio), preincubare con le rispettive sostanze a temperatura ambiente (22-26°C) per 40 minuti durante il periodo di fissaggio.
3. Registrazione della corrente Kir utilizzando il patch clamp a cella intera
- Fabbricazione di micropipette
- Accendere l'estrattore per micropipette (fare riferimento alla Tabella dei materiali).
- Inserire un tubo di vetro (diametro esterno: 1,5 mm, diametro interno: 1,10 mm, lunghezza: 10 cm) nell'estrattore. Seleziona Programma 1, fai clic su Invio e accedi al Programma 1. Eseguire un test di rampa facendo clic su Rampa sul pannello di controllo per misurare il valore termico del tubo di vetro.
NOTA: Modificare il programma 1 con i seguenti parametri: Calore: Rampa, Trazione: 0, Velocità: 25, Ritardo: 1, Pressione: 500, Modalità: Ritardo, Calore sicuro abilitato. Il test di rampa deve essere eseguito quando si cambiano i tipi di filamenti o pipette in vetro. Le micropipette devono avere un diametro del puntale di ~1-2 μm e una lunghezza del cono di circa 5 mm. I diametri dei puntali più piccoli e i coni più lunghi si traducono in una maggiore resistenza delle pipette. - Inserire un nuovo tubo di vetro e selezionare Programma 1. Fare clic su Invio per fabbricare la micropipetta.
- Registrazione della corrente Kir
- Accendi i dispositivi hardware in sequenza: convertitore digitale-analogico, amplificatore di segnale, micromanipolatore, microscopio, fotocamera e computer.
- Avviare il software nel seguente ordine: fotocamera, amplificatore di segnale e software di acquisizione dati.
NOTA: Se un microscopio non è dotato di una fotocamera, è necessario attivare solo il software dello strumento. Assicurarsi che il software sia aperto dopo l'inizializzazione dell'hardware per abilitare il corretto funzionamento. - Nel software di acquisizione dati, selezionare File > Imposta nomi file di dati per stabilire un percorso di archiviazione dei dati.
- Modificare il protocollo per la registrazione delle correnti Kir come segue:
- Interfaccia forma d'onda: Epoca A & D: Tipo = passo; Primo livello = −60 mV; Livello delta = 0 mV; Prima durata = 100 ms; Durata delta = 0 ms. Epoca B: Tipo = passo; Primo livello = −160 mV; Livello delta = 0 mV; Prima durata = 1 ms; Durata delta = 0 ms. Epoca C: Tipo = rampa; Primo livello = 40 mV; Livello delta = 20 mV; Prima durata = 500 ms; Durata delta = 0 ms.
- Interfaccia modalità/velocità: ritardo di prova = 0 s; Corse = 1; Spazzate = 1; Durata dello sweep = 0,8 s.
- Interfaccia uscite: Canale #0; Livello di mantenimento = −60 mV. Salvare e denominare il protocollo come "Protocollo Kir".
NOTA: L'impostazione del protocollo è personalizzata per registrazioni correnti specifiche e può essere riutilizzata dopo il salvataggio. Assicurarsi che l'interfaccia di uscita corrisponda al cablaggio dello strumento (ad esempio, il canale #0).
- Abilitare la funzione Membrane Test nel menu Strumenti del software di acquisizione dati.
- Posizionare la cella per la misurazione al centro della vista della fotocamera del microscopio.
- Immergere la punta del filo di riferimento nella soluzione del bagno. Riempire il 20% della micropipetta (realizzata al punto 3.1) con la soluzione intracellulare e fissarla sul supporto dell'elettrodo di registrazione.
- Applicare una pressione positiva utilizzando una siringa, spostare la punta della pipetta nella soluzione del bagno e regolare l'offset della pipetta sul software dell'amplificatore di segnale per impostare la linea di base corrente su 0 pA (vedere la Figura 3A).
NOTA: Utilizzare cavi di riferimento Ag/AgCl. La resistenza della pipetta deve essere di 4-6 MΩ.
- Applicare una pressione positiva utilizzando una siringa, spostare la punta della pipetta nella soluzione del bagno e regolare l'offset della pipetta sul software dell'amplificatore di segnale per impostare la linea di base corrente su 0 pA (vedere la Figura 3A).
- Premere delicatamente la pipetta contro la membrana cellulare. Osservare un aumento della resistenza della tenuta (Rt) ad almeno 1 MΩ (Figura 3B). Rimuovere la pressione positiva e applicare una pressione negativa per stabilire un'elevata resistenza con Rt ≥ 1 GΩ (Figura 3C).
- Impostare la tensione di mantenimento su -60 mV e compensare la capacità dell'elettrodo utilizzando Cp Fast e Cp Slow (Figura 3D).
NOTA: Se Rt rimane superiore a 1 GΩ, procedere al passaggio successivo; In caso contrario, sostituire la cella o la pipetta e ripetere i passaggi 3.2.6-3.2.8.
- Impostare la tensione di mantenimento su -60 mV e compensare la capacità dell'elettrodo utilizzando Cp Fast e Cp Slow (Figura 3D).
- Applicare una breve pressione negativa per rompere la membrana cellulare, formando una configurazione dell'intera cellula (Figura 3E). Selezionare Whole Cell nel software dell'amplificatore di segnale, fare clic su Auto per la compensazione della capacità della membrana (Figura 3F), caricare il protocollo Kir e iniziare la registrazione dei dati. Ripetere i passaggi 3.2.6-3.2.9 per le cellule trattate.
NOTA: Se la resistenza in serie (Ra) è >30 MΩ, selezionare una nuova cella. Se 30 MΩ > Ra > 10 MΩ, applicare la compensazione della resistenza in serie prima della registrazione. Questo protocollo richiede Ra < 10 MΩ.
- Analisi dei dati
- Aprire il software di analisi dei dati e caricare i dati registrati. Utilizzare i cursori per analizzare le tracce correnti ed esportare i dati per la rappresentazione grafica delle curve I-V.
- Creare un segnale della forma d'onda dello stimolo selezionando Modifica > Crea segnale della forma d'onda dello stimolo e confermare.
- Esportare la traccia del protocollo Kir selezionando Modifica > Trasferisci tracce, specificando la regione di traccia completa e il segnale (A0 #0) e copiando i dati per ulteriori analisi.
- Esporta le tracce correnti Kir rappresentative selezionando Modifica > Trasferisci tracce, specificando la regione di traccia completa e il segnale (IN 0) e copiando i dati per generare grafici di traccia correnti.
NOTA: Normalizza i dati correnti utilizzando la densità di corrente (pA/pF) per un confronto accurato tra celle di varie dimensioni. Assicurarsi che la capacità della membrana (Cm) sia registrata durante l'esperimento17.
Risultati
Isolamento delle cellule muscolari lisce arteriose
La prima sezione della procedura descrive in dettaglio il processo di isolamento delle cellule muscolari lisce dall'arteria basilare cerebrale del ratto. Questo processo è illustrato nella Figura 1. La procedura prevede la digestione enzimatica e le fasi di separazione cellulare per rilasciare le cellule muscolari lisce dall'arteria.
Immagini rappresentative di cellule muscolari lisce isolate
La seconda sezione presenta un diagramma rappresentativo delle cellule muscolari lisce isolate. La Figura 2 include immagini in campo chiaro di cellule muscolari lisce a forma di fuso, confermando la loro identità come cellule muscolari lisce in base alla loro forma caratteristica.
Tecnica di patch clamp a cellule intere
La terza sezione delinea il diagramma di flusso della tecnica di patch-clamp a cellula intera utilizzata per registrare le correnti Kir nelle cellule muscolari lisce appena isolate. La Figura 3 fornisce un'illustrazione dettagliata della configurazione del patch clamp e delle procedure per stabilire una configurazione a cella intera.
Registrazione della corrente Kir
La quarta parte presenta la corrente Kir rappresentativa registrata da cellule muscolari lisce appena isolate utilizzando la tecnica del patch-clamp a cellula intera. La Figura 4 mostra le correnti registrate e gli effetti dei diversi interventi sull'attività del canale Kir. La Figura 4A mostra la corrente tipica di Kir, dimostrando la rettifica verso l'interno a tensioni negative, indicando l'afflusso netto di K+ nella cella. A tensioni positive, il flusso di corrente K+ netto è minimo o nullo. La Figura 4B illustra l'inibizione delle correnti Kir da parte dell'inibitore specifico BaCl2. I risultati mostrano che Ba2+ a concentrazioni di 100-300 μmol/L blocca efficacemente i canali Kir, confermando la corrente come Kir. La Figura 4C mostra l'effetto del nitroprussiato di sodio (SNP), un nitrovasodilatatore, sulle correnti Kir. I dati mostrano che l'SNP aumenta la corrente Kir, suggerendo il coinvolgimento dei canali Kir nella vasodilatazione indotta dallo SNP. La Figura 4F presenta i valori di capacità (Cm) nei gruppi di controllo, BaCl2 e SNP. I risultati non indicano alcuna significatività statistica nei valori di Cm in questi gruppi.
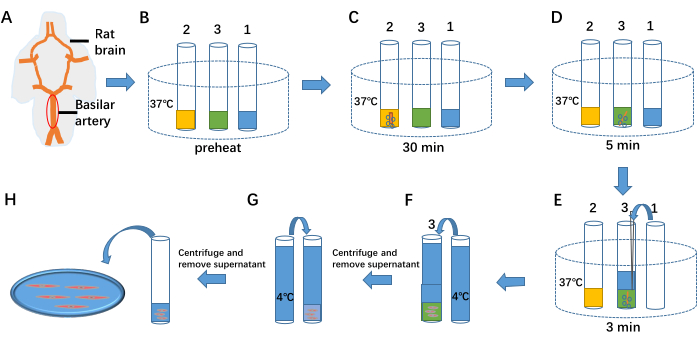
Figura 1: Isolamento delle cellule muscolari lisce arteriose. (A) Il lato ventrale del cervello di ratto e l'arteria basilare. (B) Preriscaldamento di 1 mL di soluzione di separazione cellulare, 1 mL di idrolizzato enzimatico cellulare I e 1 mL di idrolizzato enzimatico cellulare II a 37 °C rispettivamente nelle provette 1, 2 e 3. (C-E) Le tre fasi della separazione delle cellule dal tessuto vascolare mediante trattamento enzimatico. (F,G) Terminazione del trattamento enzimatico con l'aggiunta di una soluzione di separazione a 4 °C. (H) Fluido cellulare contenente cellule muscolari lisce arteriose. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Cellule muscolari lisce arteriose. (A) Vista in campo chiaro di cellule muscolari lisce vascolari appena isolate, che presentano morfologia a fuso. Barra di scala: 10 μm. (B) Cellule sane adatte per esperimenti di patch-clamp. Barra di scala: 30 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
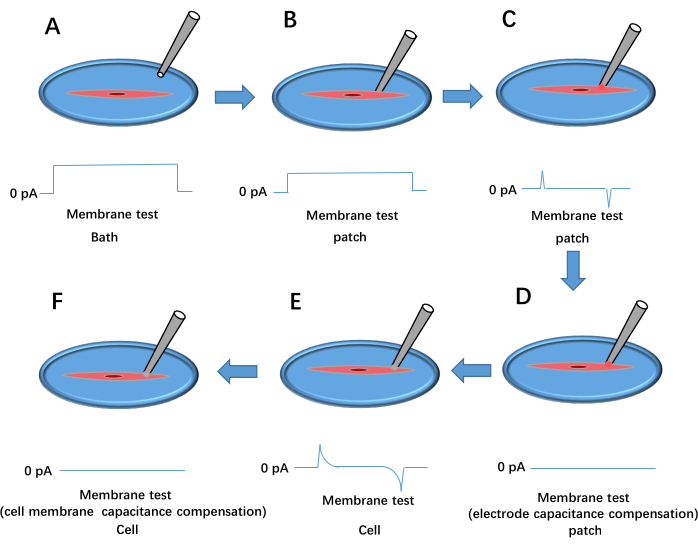
Figura 3: Processo di formazione del patch-clamp dell'intera cellula. Questo mostra l'esito del test della membrana a impulsi di tensione. (A) La pipetta viene lasciata cadere nella vasca da bagno. (B) L'elettrodo di registrazione viene spostato per entrare in contatto con la cella e premuto contro la membrana. (C) Formazione di una guarnizione ad alta resistenza tra la pipetta e la cellula. (D) Compensazione della capacità dell'elettrodo. (E) Rottura della membrana cellulare. (F) Compensazione della capacità della membrana cellulare. Clicca qui per visualizzare una versione più grande di questa figura.
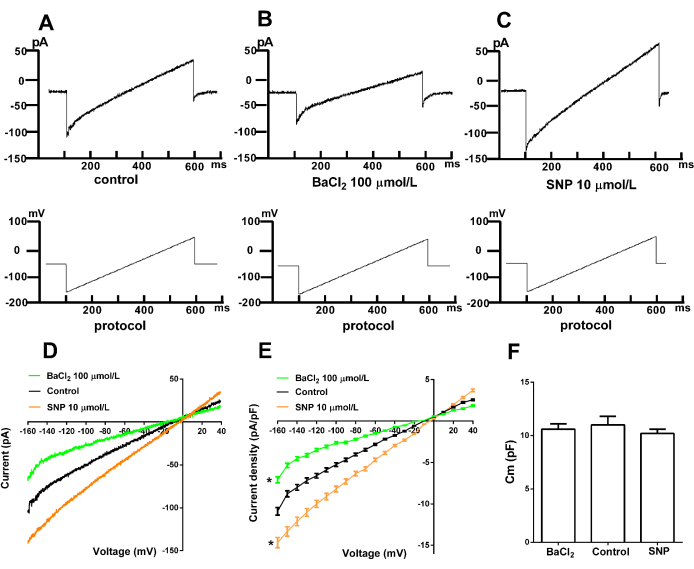
Figura 4. Corrente Kir rappresentativa nelle cellule muscolari lisce arteriose. (A) Corrente Kir normale. (B) Inibizione da parte dell'inibitore specifico BaCl2. (C) Effetto del nitroprussiato di sodio (SNP) sulla corrente Kir. (D) Curva I-V delle correnti Kir. (E) Risultati statistici. p < 0,05, BaCl2 (n = 6) e SNP (n = 6) rispetto al gruppo di controllo (n = 6); le differenze sono state analizzate mediante ANOVA a due code e a due vie. (F) Cm (pF), p > 0,05, BaCl2 (n = 6) e SNP (n = 6) rispetto al gruppo di controllo (n = 6); Le differenze sono state analizzate mediante T-test. Protocollo di stimolazione: mantenimento a -60 mV con stimolazione a rampa da -160 mV a +40 mV per 500 ms. Il controllo, BaCl2 e SNP sono stati condotti separatamente in diversi gruppi di cellule. I composti sono stati aggiunti 40 minuti prima delle registrazioni e potevano rimanere nella vasca per un massimo di 20 minuti durante la registrazione. SNP: nitroprussiato di sodio. Clicca qui per visualizzare una versione più grande di questa figura.
| Tipo di soluzione | Composizione della soluzione | Punti chiave | ||
| Soluzione salina fisiologica (PSS, mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-glucosio, 5 HEPES | Saturare la soluzione e farla bollire con un gas miscelato composto dal 95% di O2 e dal 5% di CO2 prima dell'uso. Quindi, regolare il pH della soluzione a 7,4 usando NaOH. Temperatura per la preparazione e la conservazione a temperatura ambiente e 4°C, rispettivamente | ||
| Soluzione di separazione cellulare (mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-glucosio, 5 HEPES | Come la soluzione salina fisiologica | ||
| Idrolizzato enzimatico cellulare I | L'albumina sierica bovina (BSA): 1 mg/mL, il ditiotreitolo (DTT): 1 mg/mL e la papaina: 0,5 mg/mL sono stati aggiunti alla soluzione di separazione cellulare | Preparare immediatamente la soluzione per l'uso. Temperatura per prepararlo a temperatura ambiente | ||
| Idrolizzato enzimatico cellulare II | BSA: 1 mg/mL, collagenasi H: 0,3 mg/mL e collagenasi F: 0,7 mg/mL sono stati aggiunti alla soluzione di separazione cellulare | Come l'idrolizzato enzimatico cellulare I | ||
| Soluzione per bagno con corrente Kir (mmol/L) | 12 NaCl, 130 KCl, 0,4 KH2PO4 , 0,3 NaH2PO4, 2 NaHCO3 , 1 MgCl2 , 1,8 CaCl2 , 10 HEPES, 5,5 glucosio | Regolato a un pH di 7,4 utilizzando NaOH e un'osmolarità di 310 mOsm. Temperatura per la preparazione e la conservazione a temperatura ambiente e 4°C, rispettivamente | ||
| Soluzione di riempimento per pipette con corrente Kir (mmol/L) | 100 potassio-D-gluconato, 30 KCl, 1 MgCl2 , 1 EGTA, 15 HEPES, 1 Na2-ATP | Regolato a un pH di 7,2 utilizzando KOH e un'osmolarità di 300 mOsm. Temperatura per la preparazione e la conservazione a temperatura ambiente e -20°C, rispettivamente | ||
Tabella 1: Precauzioni per la composizione e la preparazione di varie soluzioni.
Discussione
La registrazione di intere cellule utilizzando cellule appena isolate risale ai primi anni '8018 e la registrazione delle correnti di canale dalle cellule muscolari lisce basilari dei roditori è diventata ampiamente praticata negli anni '9019. Con i progressi tecnologici, i ricercatori si concentrano sempre più sui risultati ottenuti attraverso queste tecnologie. Tuttavia, l'attenzione prestata all'aggiornamento e alla sintesi dei metodi tecnici è progressivamente diminuita. Questo articolo introduce un metodo dettagliato per la nuova separazione delle cellule muscolari lisce vascolari e il successivo utilizzo di queste cellule per registrare le correnti Kir, con l'obiettivo di aiutare i ricercatori a comprendere il processo metodologico standard.
La muscolatura liscia vascolare svolge un ruolo cruciale nella regolazione della tensione arteriosa. Sono stati riportati numerosi metodi per separare le cellule muscolari lisce vascolari 20,21,22,23,24,25, la maggior parte dei quali coinvolge l'idrolisi enzimatica. Tuttavia, i tipi e le fasi degli enzimi variano da studio a studio e diverse condizioni sperimentali possono influenzare l'efficienza enzimatica. Questo articolo presenta un metodo di idrolisi enzimatica, con lievi modifiche ai tipi di enzimi e alle procedure rispetto agli studi precedenti. Fornisce un protocollo dettagliato per la separazione acuta delle cellule muscolari lisce vascolari primarie.
Le fasi chiave di questo protocollo sono le fasi da 2.2 a 2.4, poiché il completamento con successo di queste fasi influisce direttamente sulla qualità delle cellule isolate. Le cellule muscolari lisce vascolari isolate sono adatte per varie applicazioni, tra cui esperimenti di patch-clamp per studiare i canali ionici, l'estrazione di RNA e proteine per studi molecolari e l'immunofluorescenza per studiare l'espressione proteica sulle cellule. Di conseguenza, questo metodo offre un approccio versatile per i ricercatori pertinenti, fornendo più opzioni sperimentali.
La conduttanza del potassio (K+) sulla membrana delle cellule muscolari lisce arteriose svolge un ruolo cruciale nella regolazione del potenziale di membrana, della tensione vascolare e, in ultima analisi, del flusso sanguigno locale26,27. Il canale Kir, un tipo di canale K+ che si trova nelle cellule muscolari lisce arteriose, aiuta a stabilizzare il potenziale di membrana e funge da amplificatore elettrico per altri canali K+. Quando attivato, il canale Kir induce l'iperpolarizzazione della membrana e promuove la dilatazione vascolare28. La tecnologia del patch clamp è stata a lungo considerata il gold standard per la ricerca sui canali ionici29,30, con il patch clamp a cellula intera che è il metodo più comunemente usato31. Sebbene questa tecnica richieda un alto livello di abilità dell'operatore, la competenza dipende in ultima analisi dal seguire protocolli standardizzati.
Questo studio presenta una procedura dettagliata e standardizzata per la registrazione delle correnti Kir da cellule muscolari lisce vascolari appena isolate utilizzando un patch clamp a cellula intera, fornendo un prezioso riferimento per i ricercatori. I passaggi critici del protocollo sono i passaggi da 3.2.7 a 3.2.9, in quanto il completamento di questi passaggi determina se le successive registrazioni della corrente Kir avranno esito positivo. Inoltre, la selezione dei fluidi intracellulari e del bagno influisce in modo significativo sulla corrente registrata. Ad esempio, l'uso di potassio elevato extracellulare in questo studio aveva lo scopo di attivare completamente il canale del potassio raddrizzatore verso l'interno. Pertanto, il successo dell'esperimento dipende da un'attenta attenzione ad ogni dettaglio operativo.
Sebbene le cellule appena isolate offrano una maggiore rilevanza fisiologica rispetto alle linee cellulari, ci sono limitazioni intrinseche. Questi includono l'influenza della temperatura ambientale sulla separazione enzimatica, la variazione dei tempi di digestione per vasi sanguigni di diverso diametro e l'instabilità dell'ambiente nativo delle cellule. Di conseguenza, i tempi di digestione enzimatica devono spesso essere regolati. La tecnologia del patch clamp pone anche sfide tecniche, in particolare nelle fasi di sigillatura e rottura della membrana, che richiedono un'elevata abilità dell'operatore. Lo stato della cella influisce direttamente sul successo dell'intera procedura di patch-clamp. Di conseguenza, un'attenta attenzione a questi limiti è essenziale per garantire il successo dell'esperimento.
Ba2+ è stato ampiamente utilizzato come bloccante specifico per studiare il ruolo dei canali Kir nelle cellule e nei tessuti. A concentrazioni inferiori a 100 μmol/L, Ba2+ blocca selettivamente i canali Kir, mentre concentrazioni fino a 300 μmol/L possono bloccarli completamente32. In questo studio, BaCl2 è stato utilizzato per verificare la corrente del canale Kir.
I canali Kir sono regolati sia da vasocostrittori che da vasodilatatori. Lo SNP (nitroprussiato di sodio), un nitrovasodilatatore, è stato utilizzato in questo studio per esplorare questo aspetto. Lo SNP viene metabolizzato nella muscolatura liscia vascolare per produrre ossido nitrico, che riduce la resistenza vascolare sistemica agendo sia sulla muscolatura liscia venosa che su quella arteriosa, aumentando potenzialmente la gittata cardiaca. A causa della sua rapida insorgenza e della breve emivita, lo SNP è comunemente usato come agente di prima linea per la prevenzione e il trattamento dell'ipertensione33. Lo studio ha osservato che lo SNP aumenta la corrente Kir nelle cellule muscolari lisce dell'arteria basilare, suggerendo l'attivazione dei canali Kir durante la vasodilatazione indotta da SNP.
Una limitazione delle registrazioni presenti è che sono state ottenute da diversi gruppi di cellule, e i confronti sono stati fatti analizzando le densità di corrente tra i gruppi. Un approccio più raffinato comporterebbe la registrazione delle risposte delle stesse cellule prima e dopo l'applicazione dei composti, il che ridurrebbe al minimo l'impatto della variabilità da cellula a cellula sull'interpretazione dei dati.
In conclusione, questo articolo fornisce un protocollo dettagliato per l'isolamento acuto delle cellule muscolari lisce dell'arteria basilare di ratto e l'uso di patch clamp a cellula intera per studiare le correnti Kir. Questo protocollo è versatile e può essere applicato alle cellule muscolari lisce di altre arterie, come le arterie coronarie, mesenteriche e renali. Tuttavia, potrebbe essere necessario regolare il tempo di separazione enzimatica a seconda del tipo di arteria. Inoltre, le cellule muscolari lisce arteriose isolate possono essere impiegate in una varietà di altre tecniche sperimentali.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dallo Special Talent Program dell'Università di Medicina Tradizionale Cinese di Chengdu per "Xinglin Scholars and Discipline Talents Research Promotion Plan" (33002324) e dal Key Research and Development Project for Introducing High-Level Scientific and Technological Talents, in Luliang City (2022RC28).
Materiali
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
Riferimenti
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon