Method Article
Registro de correntes retificadoras internas de K+ em células musculares lisas da artéria basilar recém-isoladas pela técnica de patch clamp
Neste Artigo
Resumo
Este protocolo descreve um método rápido e eficiente para isolar células musculares lisas da artéria basilar de rato e registrar as correntes retificadoras internas dos canais de potássio nessas células usando a técnica de patch clamp de células inteiras. Ele oferece uma nova abordagem para pesquisadores que estudam a artéria basilar e os canais iônicos.
Resumo
A doença cerebrovascular é uma condição prevalente entre os idosos, com sua incidência aumentando constantemente. A artéria basilar é um vaso cerebral crítico que supre a ponte, o cerebelo, as regiões posteriores do cérebro e o ouvido interno. A atividade do canal de potássio (K+) desempenha um papel significativo na determinação do tônus vascular, regulando o potencial da membrana celular. A ativação dos canais retificadores internos de K+ (Kir), como outros canais de K+ , leva à hiperpolarização e vasodilatação da membrana celular. Neste estudo, células musculares lisas recém-isoladas da artéria basilar foram usadas para registrar as correntes de Kir por meio da técnica de patch clamp de células inteiras. Foram investigados os efeitos de 100 μmol/L de BaCl2, um inibidor do canal de Kir, e 10 μmol/L de nitroprussiato de sódio (SNP), um nitrovasodilatador, sobre as correntes do canal de Kir. Os resultados demonstraram que o BaCl2 inibiu as correntes do canal Kir nas células musculares lisas da artéria basilar, enquanto o SNP aumentou essas correntes. Este protocolo fornece um guia abrangente para preparar células musculares lisas arteriais recém-isoladas e registrar as correntes do canal Kir usando a técnica de patch clamp, oferecendo um recurso valioso para pesquisadores que buscam dominar esse método.
Introdução
A doença cerebrovascular é uma condição prevalente na população idosa. Com melhorias nos padrões de vida, aumento da expectativa de vida e envelhecimento da população, a incidência de doenças cerebrovasculares está aumentando constantemente1. A artéria basilar, um vaso não pareado formado pela fusão das artérias vertebrais bilaterais, corre abaixo da ponte dentro do crânio e se divide em duas artérias cerebrais posteriores. Ele supre a ponte, o cerebelo, as regiões posteriores do cérebro e o ouvido interno. O suprimento insuficiente de sangue para a artéria basilar pode levar a vertigem episódica, muitas vezes acompanhada de náuseas e vômitos. Os pacientes também podem apresentar sintomas como zumbido, perda auditiva e outros problemas relacionados. Esses sintomas são frequentemente associados a condições como espondilose cervical, aterosclerose cerebral e pressão arterial anormal. A doença cerebrovascular, particularmente prevalente entre indivíduos de meia-idade e idosos, está frequentemente ligada a essas condições subjacentes 2,3,4.
As artérias de resistência desempenham um papel vital na função cardiovascular e na manutenção da homeostase corporal. Como local primário de resistência vascular, regulam a pressão arterial e o débito cardíaco, garantindo fluxo sanguíneo suficiente para atender às demandas metabólicas e fisiológicas dos tecidos e órgãos5. A artéria basilar, classificada como uma artéria de resistência, regula principalmente o fluxo sanguíneo para o tronco encefálico6. As células musculares lisas, que formam as paredes das artérias de resistência, são mediadores chave da resistência vascular por meio da regulação da contração em estado estacionário ou tensão vascular. Essas células abrigam numerosos canais iônicos, incluindo canais de K+, canais de Ca2+ e canais de Cl-, que são críticos para a modulação do tônus vascular 5,7.
Os canais de K+ são críticos para estabelecer o potencial de membrana e regular o tônus contrátil das células musculares lisas arteriais8. Existem quatro tipos de canais de K+ no músculo liso arterial: K+ dependente de voltagem (Kᴠ), K+ dependente de Ca2+ (KCa), K+ dependente de ATP (KATP) e canais retificadores internos de K+ (Kir) 9,10,11. Os canais Kir são categorizados em sete subtipos, sendo Kir2.x canais Kir clássicos. Dentre estas, as subfamílias Kir2.x são as mais relevantes na vasculatura. As correntes Kir exibem retificação interna em tensões negativas, indicando um influxo líquido de K + na célula, enquanto em tensões positivas, há fluxo de corrente líquido de K + mínimo ou nenhum 5. No sistema cardiovascular, os canais de Kir são essenciais para estabilizar o potencial de membrana. Sua ativação induz hiperpolarização e vasodilatação da membrana celular 12,13,14.
Experimentos de patch-clamp em células musculares lisas recém-isoladas foram conduzidos em várias artérias, incluindo artérias coronárias, cerebrais, renais e mesentéricas15,16. Embora alguns métodos utilizem o mesmo tipo de colagenase para isolamento celular, os procedimentos precisos variam. Poucos estudos resumiram de forma abrangente os métodos de isolamento das células musculares lisas vasculares. Portanto, este estudo se concentra no isolamento fresco de células musculares lisas vasculares primárias da artéria basilar de ratos e no registro das correntes do canal Kir nessas células usando a técnica de patch clamp de células inteiras, fornecendo um protocolo detalhado e completo para pesquisadores em áreas afins.
Protocolo
O protocolo animal foi aprovado pelo Comitê de Ética de Bem-Estar Animal do Laboratório de Medicina Tradicional Chinesa da Universidade de Chengdu (Registro nº 2024035). Ratos machos da raça Sprague-Dawley (SD), pesando 260-300 g e com idade entre 8 e 10 semanas, foram utilizados neste estudo. Os animais receberam água e ração (ração experimental SPF) ad libitum. Os detalhes dos reagentes e equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Dissecção da artéria basilar do rato
- Preparação da solução
- Prepare as soluções conforme descrito na Tabela 1.
- Anestesiar o rato por inalação de isoflurano a 2%. Confirme a anestesia profunda usando uma pinça no dedo do pé. Se necessário, administre anestésicos adicionais. Prossiga imediatamente para abrir o crânio e expor o cérebro na mesa de operação portátil.
- Transfira rapidamente o cérebro para uma placa de Petri contendo PSS saturada com 95% de O2 e 5% de CO2 a 4 ° C. Certifique-se de que a solução tenha um pH de 7,40.
- Posicione o cérebro ventralmente para cima em uma placa de Petri e prenda-o com agulhas. Sob um microscópio óptico, localize a artéria basilar e remova cuidadosamente o tecido circundante usando uma pinça e tesoura autoclavadas (ver Figura 1A).
- Insira um fio de 2 cm de comprimento com um diâmetro de 25 μm na artéria basilar isolada. Esfregue suavemente a parede interna com o fio para remover efetivamente o endotélio vascular.
NOTA: A artéria basilar em ratos está situada dentro dos sulcos basais do tronco encefálico na base do cérebro e é formada pela confluência das artérias vertebrais esquerda e direita2. Durante o processo de isolamento, manuseie a artéria com cuidado para evitar alongamento ou compressão excessiva que pode resultar em danos.
2. Isolamento de células musculares lisas
- Pré-aqueça 1 mL de solução de separação celular, 1 mL de hidrolisado enzimático I e 1 mL de hidrolisado enzimático II a 37 ° C nos tubos de ensaio 1, 2 e 3, respectivamente (ver Figura 1B).
- Transfira a artéria basilar isolada para o tubo de ensaio 2. Injete continuamente uma mistura de 95% de O2 e 5% de CO2 no tubo e mantenha o tratamento enzimático por 30 min (ver Figura 1C).
- Transfira a artéria basilar do tubo de ensaio 2 para o tubo de ensaio 3. Continue injetando 95% de O2 e 5% de CO2 no tubo e mantenha o tratamento enzimático por 5 min (ver Figura 1D).
- Adicione 1 mL de solução de separação de células a 37 °C do tubo de ensaio 1 no tubo de ensaio 3. Continue injetando 95% de O2 e 5% de CO2 , mantendo o tratamento enzimático por 3 min. Triturar a preparação da artéria basilar para liberar células (ver Figura 1E).
- Adicionar a solução de separação a 4 °C ao tubo de ensaio 3 para terminar o processo enzimático (ver figura 1F). Centrifugue a mistura a 59 × g por 6 min. Rejeitar o sobrenadante com uma pipeta, adicionar novamente a solução de separação a 4 °C (ver figura 1G) e repetir a centrifugação duas vezes para remover as enzimas residuais.
- Remova o sobrenadante usando uma pipeta e armazene 1 mL da suspensão celular a 4 ° C por até 6-8 h.
- Pegue 100 μL da suspensão celular e coloque-a no banho (ver Figura 1H). Adicione 1 mL de fluido extracelular ao banho e deixe as células assentarem por 40 minutos para se ligarem ao fundo (ver Figura 2).
NOTA: Para células do grupo de tratamento (por exemplo, BaCl2 ou nitroprussiato de sódio), pré-incube com as respectivas substâncias à temperatura ambiente (22-26 ° C) por 40 min durante o período de fixação.
3. Gravação de corrente Kir usando grampo de patch de célula inteira
- Fabricação de micropipetas
- Ligue o extrator de micropipeta (consulte a Tabela de Materiais).
- Coloque um tubo de vidro (diâmetro externo: 1.5 mm, diâmetro interno: 1.10 mm, comprimento: 10 cm) no extrator. Selecione o Programa 1, clique em Enter e acesse o Programa 1. Execute um teste de rampa clicando em Rampa no painel de controle para medir o valor calorífico do tubo de vidro.
NOTA: Edite o Programa 1 com os seguintes parâmetros: Calor: Rampa, Tração: 0, Velocidade: 25, Atraso: 1, Pressão: 500, Modo: Atraso, Aquecimento seguro ativado. O ensaio em rampa deve ser efectuado aquando da mudança de filamentos ou de tipos de pipetas de vidro. As micropipetas devem ter um diâmetro de ponta de ~1-2 μm e um comprimento de cone de aproximadamente 5 mm. Diâmetros de ponteira menores e cones mais longos resultam em maior resistência à pipeta. - Insira um novo tubo de vidro e selecione Programa 1. Clique em Enter para fabricar a micropipeta.
- Gravando Kir Current
- Ligue os dispositivos de hardware sequencialmente: conversor digital-analógico, amplificador de sinal, micromanipulador, microscópio, câmera e computador.
- Inicie o software na seguinte ordem: câmera, amplificador de sinal e software de aquisição de dados.
NOTA: Se um microscópio não estiver equipado com uma câmera, apenas o software do instrumento precisará ser ativado. Certifique-se de que o software seja aberto após a inicialização do hardware para habilitar a funcionalidade adequada. - No software de aquisição de dados, selecione Arquivo > Definir nomes de arquivo de dados para estabelecer um caminho de armazenamento de dados.
- Edite o protocolo para registrar as correntes Kir da seguinte maneira:
- Interface de forma de onda: Época A & D: Tipo = passo; Primeiro nível = −60 mV; Nível delta = 0 mV; Primeira duração = 100 ms; Duração do delta = 0 ms. Época B: Tipo = etapa; Primeiro nível = −160 mV; Nível delta = 0 mV; Primeira duração = 1 ms; Duração do delta = 0 ms. Época C: Tipo = rampa; Primeiro nível = 40 mV; Nível delta = 20 mV; Primeira duração = 500 ms; Duração do delta = 0 ms.
- Interface de modo/taxa: Atraso de teste = 0 s; Corridas = 1; Varreduras = 1; Duração da varredura = 0,8 s.
- Interface de saída: Canal #0; Nível de retenção = −60 mV. Salve e nomeie o protocolo como "Protocolo Kir".
NOTA: A configuração do protocolo é adaptada para gravações atuais específicas e pode ser reutilizada após salvar. Certifique-se de que a interface de saída corresponda à fiação do instrumento (por exemplo, Canal #0).
- Ative a função Teste de membrana no menu Ferramentas do software de aquisição de dados.
- Posicione a célula para medição no centro da câmera do microscópio view.
- Mergulhe a ponta do fio de referência na solução de banho. Encha 20% da micropipeta (fabricada na etapa 3.1) com a solução intracelular e prenda-a no suporte do eletrodo de registro.
- Aplique pressão positiva usando uma seringa, mova a ponta da pipeta para a solução de banho e ajuste o deslocamento da pipeta no sinal amplifier software para definir a linha de base atual para 0 pA (consulte a Figura 3A).
NOTA: Use fios de referência Ag/AgCl. A resistência da pipeta deve ser de 4-6 MΩ.
- Aplique pressão positiva usando uma seringa, mova a ponta da pipeta para a solução de banho e ajuste o deslocamento da pipeta no sinal amplifier software para definir a linha de base atual para 0 pA (consulte a Figura 3A).
- Pressione suavemente a pipeta contra a membrana celular. Observe um aumento na resistência da vedação (Rt) para pelo menos 1 MΩ (Figura 3B). Remova a pressão positiva e aplique pressão negativa para estabelecer uma alta resistência com Rt ≥ 1 GΩ (Figura 3C).
- Defina a tensão de retenção para −60 mV e compense a capacitância do eletrodo usando Cp Fast e Cp Slow (Figura 3D).
NOTA: Se Rt permanecer acima de 1 GΩ, prossiga para a próxima etapa; caso contrário, substitua a célula ou pipeta e repita as etapas 3.2.6-3.2.8.
- Defina a tensão de retenção para −60 mV e compense a capacitância do eletrodo usando Cp Fast e Cp Slow (Figura 3D).
- Aplique uma breve pressão negativa para romper a membrana celular, formando uma configuração de célula inteira ( Figura 3E ). Selecione Whole Cell no sinal amplifier software, clique em Auto para compensação de capacitância de membrana (Figura 3F), carregue o protocolo Kir e inicie a gravação de dados. Repita as etapas 3.2.6-3.2.9 para células tratadas.
NOTA: Se a resistência em série (Ra) for >30 MΩ, selecione uma nova célula. Se 30 MΩ > Ra > 10 MΩ, aplique a compensação de resistência em série antes de gravar. Este protocolo requer Ra < 10 MΩ.
- Analisando dados
- Abra o software de análise de dados e carregue os dados gravados. Use cursores para analisar traços atuais e exportar dados para plotagem de curva I-V.
- Crie um sinal de forma de onda de estímulo selecionando Editar > Criar sinal de forma de onda de estímulo e confirme.
- Exporte o rastreamento do protocolo Kir selecionando Editar > Transferir rastreamentos, especificando a região de rastreamento completa e o sinal (A0 #0) e copiando os dados para análise posterior.
- Exporte rastreamentos atuais Kir representativos selecionando Editar > Transferir Rastreamentos, especificando a região de rastreamento completa e o sinal (IN 0) e copiando dados para gerar gráficos de rastreamento atuais.
NOTA: Normalize os dados atuais usando a densidade de corrente (pA/pF) para uma comparação precisa entre células de tamanhos variados. Certifique-se de que a capacitância da membrana (Cm) seja registrada durante o experimento17.
Resultados
Isolamento das células do músculo liso arterial
A primeira seção do procedimento detalha o processo de isolamento das células musculares lisas da artéria basilar cerebral do rato. Esse processo é ilustrado na Figura 1. O procedimento envolve digestão enzimática e etapas de separação celular para liberar células musculares lisas da artéria.
Imagens representativas de células musculares lisas isoladas
A segunda seção apresenta um diagrama representativo das células musculares lisas isoladas. A Figura 2 inclui imagens de campo claro de células musculares lisas em forma de fuso, confirmando sua identidade como células musculares lisas com base em sua forma característica.
Técnica de patch clamp de célula inteira
A terceira seção descreve o fluxograma da técnica de patch-clamp de célula inteira usada para registrar as correntes de Kir em células musculares lisas recém-isoladas. A Figura 3 fornece uma ilustração detalhada da configuração do patch clamp e dos procedimentos para estabelecer uma configuração de célula inteira.
Gravando a corrente Kir
A quarta parte apresenta a corrente Kir representativa registrada de células musculares lisas recém-isoladas usando a técnica de patch-clamp de células inteiras. A Figura 4 mostra as correntes registradas e os efeitos de diferentes intervenções na atividade do canal Kir. A Figura 4A exibe a corrente Kir típica, demonstrando a retificação interna em tensões negativas, indicando o influxo líquido de K + na célula. Em tensões positivas, há fluxo de corrente líquida de K+ mínimo ou inexistente. A Figura 4B ilustra a inibição das correntes Kir pelo inibidor específico BaCl2. Os resultados mostram que o Ba2+ em concentrações de 100-300 μmol/L bloqueia efetivamente os canais de Kir, confirmando a corrente como Kir. A Figura 4C demonstra o efeito do nitroprussiato de sódio (SNP), um nitrovasodilatador, nas correntes Kir. Os dados mostram que o SNP aumenta a corrente Kir, sugerindo o envolvimento dos canais Kir na vasodilatação induzida pelo SNP. A Figura 4F apresenta os valores de capacitância (Cm) nos grupos controle, BaCl2 e SNP. Os resultados indicam que não há significância estatística nos valores de Cm entre esses grupos.
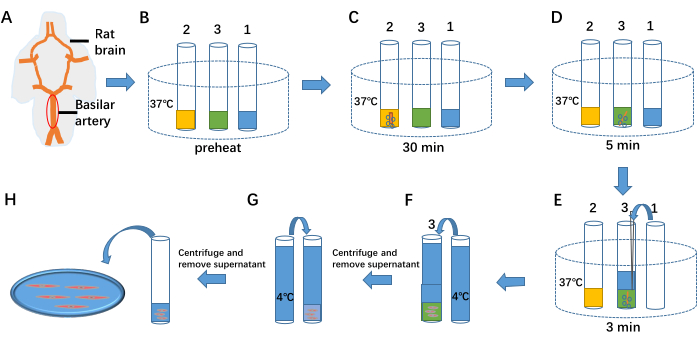
Figura 1: Isolamento das células musculares lisas arteriais. (A) O lado ventral do cérebro do rato e da artéria basilar. (B) Pré-aquecimento de 1 mL de solução de separação celular, 1 mL de hidrolisado enzimático celular I e 1 mL de hidrolisado enzimático celular II a 37 ° C nos tubos de ensaio 1, 2 e 3, respectivamente. (CE) As três etapas de separação das células do tecido vascular por tratamento enzimático. (F, G) Término do tratamento enzimático adicionando solução de separação a 4 °C. (H) Fluido celular contendo células musculares lisas arteriais. Clique aqui para ver uma versão maior desta figura.

Figura 2: Células musculares lisas arteriais. (A) Visão de campo claro de células musculares lisas vasculares recém-isoladas, exibindo morfologia fusiforme. Barra de escala: 10 μm. (B) Células saudáveis adequadas para experimentos de patch-clamp. Barra de escala: 30 μm. Clique aqui para ver uma versão maior desta figura.
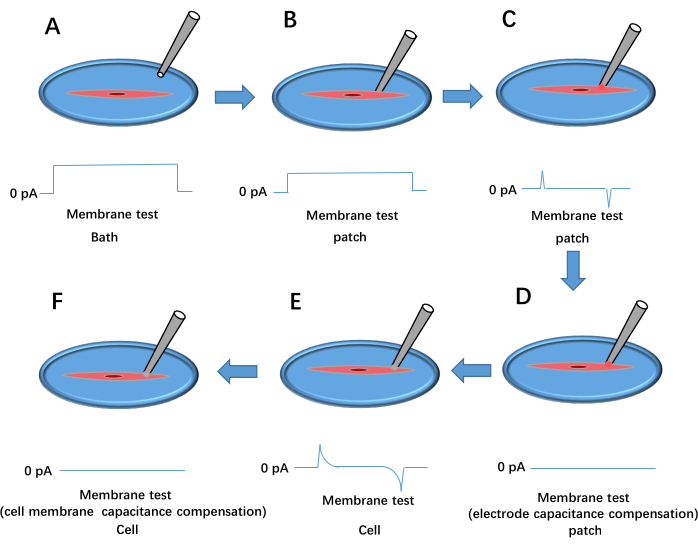
Figura 3: Processo de formação de patch-clamp de célula inteira. Isso mostra o resultado do teste de membrana de pulso de tensão. (A) A pipeta é jogada no banho. (B) O eletrodo de registro é movido para entrar em contato com a célula e pressionado contra a membrana. (C) Formação de uma vedação de alta resistência entre a pipeta e a célula. (D) Compensação da capacitância do eletrodo. (E) Ruptura da membrana celular. (F) Compensação da capacitância da membrana celular. Clique aqui para ver uma versão maior desta figura.
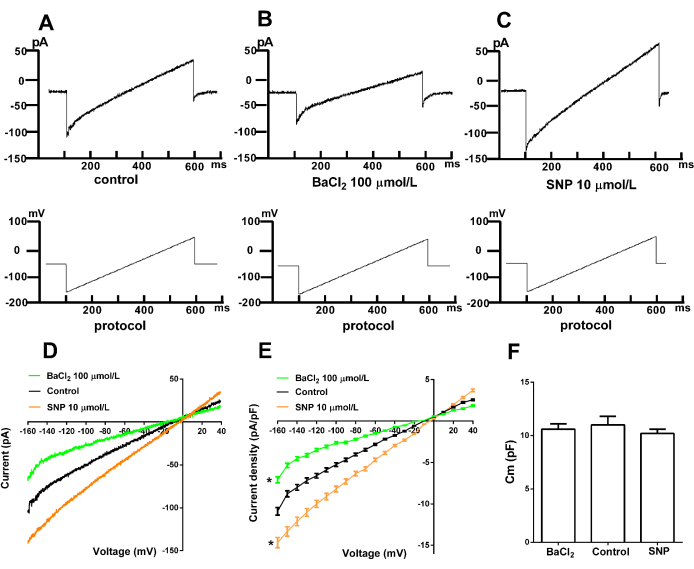
Figura 4. Corrente Kir representativa nas células do músculo liso arterial. (A) Corrente Kir normal. (B) Inibição pelo inibidor específico BaCl2. (C) Efeito do nitroprussiato de sódio (SNP) na corrente Kir. (D) Curva IV das correntes Kir. (E) Resultados estatísticos. p < 0,05, BaCl2 (n = 6) e SNP (n = 6) versus o grupo controle (n = 6); as diferenças foram analisadas por ANOVA bicaudal de duas vias. (F) Cm (pF), p > 0,05, BaCl2 (n = 6) e SNP (n = 6) versus o grupo controle (n = 6); As diferenças foram analisadas pelo teste t. Protocolo de estimulação: Mantendo a -60 mV com estimulação de rampa de -160 mV a +40 mV por 500 ms. Controle, BaCl2 e SNP foram conduzidos separadamente em diferentes grupos de células. Os compostos foram adicionados 40 minutos antes das gravações e podem permanecer no banho por até 20 minutos durante a gravação. SNP: nitroprussiato de sódio. Clique aqui para ver uma versão maior desta figura.
| Tipo de solução | Composição da solução | Pontos-chave | ||
| Solução salina fisiológica (PSS, mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-glicose, 5 HEPES | Saturar a solução e borbulhar com uma mistura de gases constituída por 95% de O2 e 5% de CO2 antes da utilização. Em seguida, ajuste o pH da solução para 7,4 usando NaOH. Temperatura para fabricação e armazenamento em temperatura ambiente e 4°C, respectivamente | ||
| Solução de separação celular (mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-glicose, 5 HEPES | O mesmo que a solução salina fisiológica | ||
| Hidrolisado enzimático celular I | Albumina sérica bovina (BSA): 1 mg/mL, ditiotreitol (DTT): 1 mg/mL e papaína: 0,5 mg/mL foram adicionados à solução de separação celular | Prepare a solução imediatamente para uso. Temperatura para fazê-lo em temperatura ambiente | ||
| Hidrolisado enzimático celular II | BSA: 1 mg/mL, colagenase H: 0,3 mg/mL e colagenase F: 0,7 mg/mL foram adicionadas à solução de separação celular | O mesmo que o hidrolisado enzimático celular I | ||
| Solução de banho de corrente Kir (mmol / L) | 12 NaCl, 130 KCl, 0,4 KH2PO4 , 0,3 NaH2PO4, 2 NaHCO3 , 1 MgCl2 , 1,8 CaCl2 , 10 HEPES, 5,5 glicose | Ajustado para um pH de 7,4 usando NaOH e uma osmolaridade de 310 mOsm. Temperatura para fabricação e armazenamento em temperatura ambiente e 4°C, respectivamente | ||
| Solução de enchimento de pipeta de corrente Kir (mmol / L) | 100 D-gluconato de potássio, 30 KCl, 1 MgCl2, 1 EGTA, 15 HEPES, 1 Na2-ATP | Ajustado para um pH de 7,2 usando KOH e uma osmolaridade de 300 mOsm. Temperatura para fabricá-lo e armazená-lo em temperatura ambiente e -20°C, respectivamente | ||
Tabela 1: Composição e precauções de preparação para várias soluções.
Discussão
O registro de células inteiras usando células recém-isoladas remonta ao início dos anos 198018, e o registro de correntes de canal de células musculares lisas basilares de roedores tornou-se amplamente praticado na década de 199019. Com os avanços tecnológicos, os pesquisadores estão cada vez mais focados nos resultados alcançados por meio dessas tecnologias. No entanto, a atenção dada à atualização e ao resumo dos métodos técnicos tem diminuído gradualmente. Este artigo apresenta um método detalhado para a separação fresca de células musculares lisas vasculares e o uso subsequente dessas células para registrar correntes Kir, com o objetivo de auxiliar os pesquisadores na compreensão do processo metodológico padrão.
O músculo liso vascular desempenha um papel crucial na regulação da tensão arterial. Numerosos métodos para separar células musculares lisas vasculares foram relatados20 , 21 , 22 , 23 , 24 , 25 , a maioria dos quais envolve hidrólise enzimática. No entanto, os tipos e etapas das enzimas variam entre os estudos, e diferentes condições experimentais podem influenciar a eficiência enzimática. Este artigo apresenta um método de hidrólise enzimática, com pequenas modificações nos tipos e procedimentos enzimáticos em comparação com estudos anteriores. Ele fornece um protocolo detalhado para a separação aguda das células musculares lisas vasculares primárias.
As principais etapas deste protocolo são as etapas 2.2 a 2.4, pois a conclusão bem-sucedida dessas etapas afeta diretamente a qualidade das células isoladas. As células isoladas do músculo liso vascular são adequadas para várias aplicações, incluindo experimentos de patch-clamp para estudar canais iônicos, extração de RNA e proteínas para estudos moleculares e imunofluorescência para investigar a expressão de proteínas nas células. Consequentemente, este método oferece uma abordagem versátil para pesquisadores relevantes, fornecendo mais opções experimentais.
A condutância de potássio (K+) na membrana das células musculares lisas arteriais desempenha um papel crucial na regulação do potencial de membrana, da tensão vascular e, em última análise, do fluxo sanguíneo local26,27. O canal Kir, um tipo de canal K + encontrado nas células musculares lisas arteriais, ajuda a estabilizar o potencial de membrana e atua como um amplificador elétrico para outros canais K +. Quando ativado, o canal de Kir induz hiperpolarização da membrana e promove dilatação vascular28. A tecnologia de patch clamp tem sido considerada o padrão-ouro para a pesquisa de canais iônicos29,30, sendo o patch clamp de célula inteira o método mais comumente usado31. Embora essa técnica exija um alto nível de habilidade do operador, a proficiência depende, em última análise, do cumprimento de protocolos padronizados.
Este estudo apresenta um procedimento detalhado e padronizado para registrar correntes Kir de células musculares lisas vasculares recém-isoladas usando um patch clamp de célula inteira, fornecendo uma referência valiosa para os pesquisadores. As etapas críticas no protocolo são as etapas 3.2.7 a 3.2.9, pois a conclusão bem-sucedida dessas etapas determina se as gravações atuais subsequentes do Kir serão bem-sucedidas. Além disso, a seleção de fluidos intracelulares e de banho afeta significativamente a corrente registrada. Por exemplo, o uso de potássio extracelular alto neste estudo teve como objetivo ativar totalmente o canal de potássio retificador interno. Portanto, o sucesso do experimento depende de uma atenção cuidadosa a cada detalhe operacional.
Embora as células recém-isoladas ofereçam mais relevância fisiológica do que as linhagens celulares, existem limitações inerentes. Isso inclui a influência da temperatura ambiente na separação enzimática, tempos de digestão variáveis para vasos sanguíneos de diferentes diâmetros e a instabilidade do ambiente nativo das células. Como resultado, os tempos de digestão enzimática geralmente precisam ser ajustados. A tecnologia de patch clamp também apresenta desafios técnicos, particularmente nas etapas de vedação e ruptura da membrana, que exigem alta habilidade do operador. O estado da célula afeta diretamente o sucesso de todo o procedimento de patch-clamp. Consequentemente, a atenção cuidadosa a essas limitações é essencial para garantir o sucesso do experimento.
O Ba2+ tem sido amplamente utilizado como bloqueador específico para estudar o papel dos canais de Kir em células e tecidos. Em concentrações abaixo de 100 μmol/L, o Ba2+ bloqueia seletivamente os canais de Kir, enquanto concentrações tão altas quanto 300 μmol/L podem bloqueá-los completamente32. Neste estudo, o BaCl2 foi utilizado para verificar a corrente do canal Kir.
Os canais Kir são regulados por vasoconstritores e vasodilatadores. SNP (nitroprussiato de sódio), um nitrovasodilatador, foi usado neste estudo para explorar isso. O SNP é metabolizado no músculo liso vascular para produzir óxido nítrico, que reduz a resistência vascular sistêmica ao atuar no músculo liso venoso e arterial, aumentando potencialmente o débito cardíaco. Devido ao seu rápido início e meia-vida curta, o SNP é comumente usado como agente de primeira linha para prevenir e tratar a hipertensão33. O estudo observou que o SNP aumentou a corrente Kir nas células musculares lisas da artéria basilar, sugerindo a ativação dos canais Kir durante a vasodilatação induzida pelo SNP.
Uma limitação dos registros atuais é que eles foram obtidos de diferentes grupos de células, e as comparações foram feitas analisando as densidades de corrente entre os grupos. Uma abordagem mais refinada envolveria o registro das respostas das mesmas células antes e depois da aplicação dos compostos, o que minimizaria o impacto da variabilidade célula a célula na interpretação dos dados.
Em conclusão, este artigo fornece um protocolo detalhado para o isolamento agudo de células musculares lisas da artéria basilar de ratos e o uso de patch clamp de células inteiras para estudar as correntes Kir. Este protocolo é versátil e pode ser aplicado a células musculares lisas de outras artérias, como as artérias coronárias, mesentéricas e renais. No entanto, o tempo de separação enzimática pode precisar ser ajustado dependendo do tipo de artéria. Além disso, células musculares lisas arteriais isoladas podem ser empregadas em uma variedade de outras técnicas experimentais.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Programa Especial de Talentos da Universidade de Medicina Tradicional Chinesa de Chengdu para o "Plano de Promoção da Pesquisa de Talentos Acadêmicos e Disciplinares de Xinglin" (33002324) e pelo Projeto Chave de Pesquisa e Desenvolvimento para a Introdução de Talentos Científicos e Tecnológicos de Alto Nível na Cidade de Luliang (2022RC28).
Materiais
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
Referências
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados