Method Article
Прижизненная продольная визуализация сосудистой динамики в кальвариальном костном мозге
В этой статье
Резюме
Прижизненная микроскопия позволяет изучать динамические биологические процессы, такие как регенерация тканей и развитие опухолей. Черепной костный мозг, высокодинамичная ткань, дает представление о кроветворении и функции сосудов. Использование биосовместимого 3D-печатного имплантата для фиксации головы позволяет проводить повторяющуюся продольную визуализацию, улучшая наше понимание динамики тканей и микроокружения опухоли.
Аннотация
Прижизненная продольная флуоресцентная микроскопия стала важнейшим методом изучения динамических биологических процессов, особенно в контексте регенерации тканей, развития опухоли и терапевтических реакций. В частности, костный мозг черепа является высокодинамичной тканью, в которой кроветворная судьба взаимосвязана с окружающей микросредой, а специализированные сосуды реагируют на нормальное и патологическое кроветворение. Традиционная визуализация неподвижных тканей дает статическую информацию, что часто ограничивает всестороннее понимание этих процессов.
Интеграция трансгенных животных, экспрессирующих клеточно-специфические маркеры, индикаторы живых клеток, достижения в области оборудования для визуализации и использование специализированных камер превратили прижизненную микроскопию в ключевой инструмент для получения информации о динамических биологических явлениях. Одним из применений прижизненной визуализации является исследование поведения опухолевых сосудов и терапевтических эффектов. Недавно разработанный титановый имплантат для фиксации головы, напечатанный на 3D-принтере, может быть надежно прикреплен к черепу мыши и подходит для продольной визуализации во время нескольких сеансов.
Предложенный протокол позволяет проводить пространственное и временное исследование сосудистой динамики в костном мозге черепного мозга, включая визуализацию и количественную оценку неоднородности сосудов, взаимодействия со стромальными и кроветворными клетками, а также измерение функциональных параметров сосудов. Кроме того, этот метод позволяет визуализировать установленное сосудистое русло и контролировать терапевтические эффекты, мобилизацию стволовых клеток и локализацию химиотерапевтических соединений с течением времени с помощью двухфотонной микроскопии. В целом, этот прижизненный протокол продольной визуализации обеспечивает комплексную платформу для исследования как поведения опухолевых сосудов, так и динамики гемопоэтических клеток, предлагая ценную информацию о сложных процессах, управляющих этими биологическими явлениями.
Введение
Прижизненная микроскопия кальвариального костного мозга (КМ) служит мощным и незаменимым методом для исследования динамических процессов кроветворения, регуляции микроокружения тканей и сосудистой динамики в нише КМ. Основная цель данного методологического подхода заключается в том, чтобы обеспечить визуализацию и анализ клеточного поведения, взаимодействий и пространственной организации в микросреде БМ in vivo в режиме реального времени. Наблюдая непосредственно за кальварией КМ с использованием передовых методов визуализации в сочетании с флуоресцентным мечением, исследователи могут пролить свет на сложное взаимодействие между гемопоэтическими стволовыми клетками (ГСК), стромальными клетками и окружающими сосудами, тем самым обеспечивая решающее понимание регуляции кроветворения и иммунных реакций.
Разработка и использование прижизненных микроскопических стволовых клеток с учетом ограничений традиционных гистологических методов и визуализации ex vivo, которые часто не в состоянии отразить динамическую природу клеточного поведения и взаимодействий в ткани. В отличие от методов статической визуализации, прижизненная микроскопия позволяет исследователям наблюдать за клеточной динамикой в режиме реального времени, позволяя изучать продольные процессы, такие как миграция клеток, пролиферация и дифференцировка в их родной нише, не жертвуя при этом экспериментальными животными. Кроме того, прижизненная микроскопия обеспечивает уникальное преимущество изучения функциональных свойств in vivo, таких как функциональность сосудов (например, перфузия, проницаемость, гипоксия), тем самым сохраняя физиологическую значимость и избегая артефактов, связанных с фиксацией и обработкой тканей. Новаторские исследования в этой области продемонстрировали огромные преимущества этого подхода 1,2, а их результаты были подтверждены и расширены более поздними усовершенствованными подходами 3,4,5, которые использовали прижизненную микроскопию для отслеживания локализации, миграции и взаимодействия эндогенных ГСК с сосудистой сетью в нише КМ. Кроме того, прижизненная микроскопия сыграла важную роль в выяснении механизмов, лежащих в основе кроветворных нарушений, таких как лейкемия и синдромы недостаточности костного мозга, что позволило по-новому взглянуть на подвижность лейкозных клеток 6,7, сосудистыепоследствия, связанные с заболеванием8,и реакцию на лекарственные препараты9.
Существует несколько преимуществ прижизненной микроскопии черепного покрытия КМ с альтернативными участками кости. Во-первых, КМ, содержащаяся в кости черепа, обеспечивает легкий доступ для прижизненной визуализации по сравнению с более глубокими костями, такими как бедренная или большеберцовая кость. Такая доступность облегчает непосредственное наблюдение за тканевым микроокружением, включая саму кость, с помощью визуализации генерации второй гармоники (ГВГ)10 без необходимости проведения инвазивных хирургических процедур. Во-вторых, череп относительно тонкий и полупрозрачный, что позволяет лучше визуализировать клеточную динамику в нише БМ. Эта прозрачность позволяет получать изображения с высоким разрешением с помощью двухфотонной микроскопии, конфокальной микроскопии и светолистовой микроскопии без необходимости использования методов истончения или очистки кости. Кость пяточной кости представляет собой стабильную, плоскую и жесткую платформу для экспериментов с прижизненной визуализацией, сводя к минимуму артефакты движения тканей и обеспечивая стабильные условия визуализации в течение длительных периодов наблюдения. Эта стабильность особенно полезна для лонгитюдных исследований, отслеживающих поведение и реакцию клеток с течением времени. Воспроизводимость является еще одним большим преимуществом, учитывая относительно небольшую и пространственно определенную структуру черепной кости у экспериментальных животных. Такое единообразие облегчает сравнение между различными экспериментальными группами и обеспечивает надежный статистический анализ данных визуализации.
В данной статье мы опишем метод визуализации кальвариальной КМ мыши с помощью прижизненной двухфотонной микроскопии с использованием недавно разработанного имплантата для фиксации головки11, напечатанного на 3D-принтере с использованием биосовместимого титанового сплава Grade 23 (Ti6Al4V), который имеет специальную и легко размещаемую жесткую крышку из того же титанового сплава, позволяющую безопасно закрывать рану во избежание инфекций или повреждения места операции. Имплантат прочно и стабильно фиксирует головку мыши на предметном столике микроскопа с помощью держателя имплантата, сводя к минимуму артефакты дыхания и позволяя получать продольные изображения одних и тех же областей с течением времени. Приведены примеры многоцветных изображений, изображающих клетки и структуры из микроокружения КМ (поверхность кости ГСП+; мезенхимальные клетки nestin-GFP+; эндотелиальные клетки cdh5-DSRED+, cdh5-GFP+ или pdgfb-GFP+) и злокачественный гемопоэтический компартмент (клетки ОМЛ tdTOMATO+), а также флуоресцентные контрастные вещества, изображающие просвет сосудов (декстран-TRITC). Сосудистые параметры, измеряемые в течение нескольких часов или дней, включая длину, прямолинейность и диаметр сосуда, а также проницаемость в различных сосудистых областях, могут предоставить важную информацию о поведении и здоровье тканей.
протокол
Все эксперименты на животных проводились в соответствии с этическим соглашением APAFIS#27215-2020041513522374 v6, утвержденным французским "Ministère de l'enseignement supérieur, de la recherche et de l'innovation."
1. Дизайн биосовместимого титанового имплантата для фиксации головы для 3D-печати
ПРИМЕЧАНИЕ: Мы разработали биосовместимый имплантат для фиксации головки с использованием программного обеспечения для параметрического моделирования систем автоматизированного проектирования (CAD) со встроенными возможностями анализа методом конечных элементов (FEA) (см. Таблицу материалов). Основными исходными данными для процесса проектирования являются анатомическая модель черепа мыши с высоким разрешением, модель объектива микроскопа и модель системы фиксации, которые в совокупности определяют размеры и конфигурацию имплантата. Конечным результатом является независимый от платформы файл сетки, обычно в формате STL или STEP, совместимый с большинством программного обеспечения для 3D-печати. Этот формат файла обеспечивает бесшовную передачу на 3D-принтер для точного изготовления имплантатов.
- Подготовка 3D модели мыши
- Поместите череп мыши, подготовленный или in vivo, в микрокомпьютерный томограф.
- Задайте параметры сканирования для оптимального разрешения мелких анатомических деталей: откройте панель управления и в разделе «Условия сканирования » выберите поле зрения (FOV). Используйте LiveView для определения объема сканирования.
ПРИМЕЧАНИЕ: С помощью разрешения детектора поле зрения будет определять размер воксела на основе разрешения детектора. В новых аппаратах микрокомпьютерной томографии поле зрения 5 мм обычно соответствует размеру вокселя 5 мкм, полю зрения 10 мм — размеру вокселя 10 мкм, полю зрения 25 мм — размеру вокселя 21 мкм. Ограниченное поле зрения при таком разрешении может потребовать нескольких сканирований для охвата всего черепа. При многократном сканировании необходимо перекрывать друг друга. - Объедините несколько сканов с высоким разрешением в программном обеспечении для визуализации, чтобы создать единую комплексную модель черепа.
- Импортируйте файлы micro-CT DICOM в программное обеспечение для сегментации (например, 3D Slicer, Amira, Avizo или Mimics) для изоляции черепа.
- Выполняйте сегментацию на основе пороговых значений, чтобы отделить костную ткань от окружающих структур, и выполняйте ручную регулировку для уточнения сложных или зашумленных областей.
- В 3D Slicer сначала импортируйте файлы DICOM, загрузите набор данных и наблюдайте за срезами КТ в виде аксиального, сагиттального и коронального среза.
- Откройте Сегмент Editor, нажмите Добавить, чтобы создать новую сегментацию | Добавьте, чтобы создать новый сегмент, который должен быть пороговым.
- На панели «Редактор сегментов » нажмите на эффект «Порог ». Настройте ползунки «Нижний и Верхний порог» (или введите числовые значения) так, чтобы сегментируемый регион выделялся красным цветом в представлениях срезов. Пороговый 3D-сегмент готов.
- Чтобы экспортировать сегментированный череп в виде файла STL, перейдите к модулю «Сегментация». Убедитесь, что выбран сегмент с пороговым значением. В разделе Экспорт/импорт моделей и надписей установите для параметра Тип экспорта значение Модели. и формат файла: STL. Нажмите кнопку «Экспорт ».
ПРИМЕЧАНИЕ: В файлах STL используется треугольный формат сетки, представляющий поверхность черепа тысячами треугольников, фиксирующих анатомическую форму в мельчайших деталях.- При необходимости выполните сшивание в MeshLab следующим образом:
- Импортируйте сетки, нажав на Файл | Импортируйте сетку и выберите одну из них в качестве эталонного скана.
- Выровняйте другие сканы с помощью инструмента «Выровнять » (Фильтры | Регистрация | Align), отметив соответствующие точки и используя Process.
- Объедините выровненные сканы, нажав на Фильтры | Сетчатый слой | Сведите видимые слои в плоскость с помощью опции «Объединить только видимые слои ».
- При необходимости выполните сшивание в MeshLab следующим образом:
- Очистите и восстановите сетку, удалив дубликаты вершин и треугольников следующим образом, чтобы обеспечить удаление треугольников, вызванных шумом, и заполнение любых непреднамеренных отверстий для получения гладкой и непрерывной поверхности:
- Нажмите на Фильтры | Чистка и ремонт | Удалите дубликаты вершин.
- Нажмите на Фильтры | Чистка и ремонт | Удалите дубликаты граней.
- Нажмите на Фильтры | Чистка и ремонт | Удалите изолированные части (по номеру лица). Укажите пороговое значение для минимального числа сохраняемых граней (например, установите этот порог низким, чтобы удалить небольшие кластеры или шум).
- Нажмите на Фильтры | Перестройка, упрощение и реконструкция | Заделайте отверстия.
- Выполните упрощение сетки до ~10 000-30 000 треугольников, так как исходные STL-файлы из micro-CT содержат очень большое количество треугольников, несовместимых с программным обеспечением CAD. В зонах с высокой детализацией сохраните небольшие треугольники на верхней части черепа, чтобы обеспечить точную посадку имплантата. В более грубых областях упростите менее важные области с помощью более крупных треугольников, чтобы уменьшить размер файла и оптимизировать эффективность обработки.
ПРИМЕЧАНИЕ: Упрощение сетки осуществляется по областям и подробно описано в пунктах 1.1.8.1-1.1.8.3.- Используйте инструмент "Выбрать подключенные компоненты " в окне "Регион " для выбора областей для упрощения.
- Используйте Уменьшение квадратичного смятия ребер для выбранных областей с параметрами. Нажмите на Фильтры | Перестановка сетки, упрощение и реконструкция | Упрощение: Децимация сворачивания квадрического края. Установите Порог качества на 0.8, Сохранить границу сетки на ДА, Сохранить топологию на ДА, Целевое количество граней: установите целевое число, соответствующее необходимому разрешению .
- Повторяйте по мере необходимости, пока общее количество треугольников не уменьшится до нужного уровня. Затем сохраните упрощенную модель в файл STL.
- Подготовка модели черепа в CAD-модели
- Импортируйте упрощенную модель черепа в формате STL в программное обеспечение САПР в качестве новой детали или модели. Убедитесь, что импортированный файл правильно преобразован в твердое или поверхностное тело, если это необходимо, в зависимости от возможностей программного обеспечения. Сохраните модель в исходном формате файла САПР, чтобы обеспечить возможность дальнейших изменений и обеспечить совместимость с последующими этапами проектирования.
- Разместите опорные точки на Брегме и Лямбде и создайте ось Брегма-Лямбда в этой модели.
- Создайте медианную плоскость, включая ось Брегма-Лямбда.
- в Срединной плоскости создайте ось, касательную к кальварии, затем сохраните подготовленный череп (Дополнительный рисунок S1).
- Создайте новую сборку и вставьте подготовленный череп таким образом, чтобы брегма совпадала с началом координат, срединная плоскость — с правой плоскостью, а ось кальвары была горизонтальной.
- Имплантат для фиксации головы будет спроектирован непосредственно внутри сборки, чтобы обеспечить идеальное прилегание к подготовленной модели черепа. Для этого создайте имплантат в качестве новой детали в сборке. Начните с перехода к Вставить | Компонент | Новая деталь в программном обеспечении CAD. При появлении запроса выберите поверхность кальварии или верхнюю плоскость сборки в качестве привязки к положению и закрепите новую деталь.
- Создайте набор одинаково удаленных плоскостей (расстояние 2 мм) поперек черепа. На каждой плоскости создайте эскиз, а на каждом эскизе нарисуйте проекционную кривую со смещением 0,2 мм в виде симметричного сплайна с девятью точками, следуя сечению верхней поверхности черепа на 0,2 мм выше черепа (дополнительный рисунок S2).
- Создайте вывертку поверхности с помощью этих шлицев - Skull Limit Surface, гарантируя, что эта поверхность гладкая без каких-либо дефектов, которая будет использоваться для создания элементов имплантата.
- Определение наблюдаемой поверхности на черепе
ПРИМЕЧАНИЕ: На основе 3D-модели определяется самая плоская область кальвариальной кости, идеальная для 3D-наблюдения. Эта область тщательно подобрана, чтобы обеспечить оптимальный доступ для объектива двухфотонного микроскопа с учетом биологической и структурной целостности черепа. В определении могут использоваться стереотаксические координаты, где точка Брегмы служит началом координатной системы.- Создайте эскиз в кальварной плоскости и создайте грушевидный сплайн от AP +6,5 до -2,6 мм шириной при AP 0,0. Это будет наблюдаемый контур поверхности (дополнительный рисунок S3).
ПРИМЕЧАНИЕ: Объектив микроскопа виртуально расположен относительно ранее определенной наблюдаемой поверхности на черепе. Этот этап включает в себя определение пространственных ограничений, налагаемых размером и формой объектива, чтобы гарантировать, что конструкция имплантата соответствует требованиям микроскопа. - Вертикально вставьте модель объектива микроскопа в сборку. Ограничьте его точку фокусировки в плоскости, параллельной плоскости черепной кости и определите ограничивающий объем объектива микроскопа.
- Создайте объем, сместив объект в соответствии с контуром наблюдаемой поверхности.
- Создание окна наблюдения вокруг определенной наблюдаемой поверхности, обеспечивающее беспрепятственный доступ объектива микроскопа.
ПРИМЕЧАНИЕ: Смотровое окно представляет собой кольцеобразную структуру, имеющую второстепенные функции, такие как удержание жидкости погружением и твердая структура для правильного закрытия защитного кожуха. - Создайте эскиз в плоскости голвары и скопируйте наблюдаемый контур поверхности.
- Создайте параллельный контур толщиной 0,5 мм. Выдавите этот двойной контур вверх на 0,9 мм и вниз к поверхности Skull Limit Surface с углом уклона 4°.
- Создайте эскиз в кальварной плоскости и создайте грушевидный сплайн от AP +6,5 до -2,6 мм шириной при AP 0,0. Это будет наблюдаемый контур поверхности (дополнительный рисунок S3).
- Определение цементирующих, хвостовых и ласточкиных конструкций.
- Создайте эскиз в плоскости черепа и нарисуйте С-образную форму толщиной 0,5 мм, соединив ее со смотровым окном, и выдавите ее на 2 мм в высоту и вниз к поверхности Skull Limit Surface с углом уклона 4° (дополнительный рисунок S4).
- Создайте эскиз в плоскости голвары и заполните это пространство прямоугольниками толщиной 0,4 мм, расположенными радиально с расстоянием 1 мм между ними.
- Выдавливайте аналогично окну наблюдения.
- Создайте хвост имплантата, опираясь на череп для фиксации, соблюдая имеющийся объем.
- Создайте поперечную плоскость по касательной к цементирующей структуре и еще на 12,5 мм назад.
- Нарисуйте прямоугольники на этих плоскостях. Проведите между ними пирамидальное тело, установив углы примерно 20° и 37° от горизонтали.
- Добавьте резьбовое отверстие M1.6 в хвостовую часть рядом с цементирующей конструкцией.
- Создайте эскиз на конце хвоста и нарисуйте профиль типа «ласточкин хвост».
- Выдавите этот профиль на 8 мм.
- Проверка невмешательства в объектив.
- Осмотрите всю конструкцию имплантата, включая смотровое окно и ласточкин хвост, чтобы убедиться в отсутствии механического вмешательства в объектив микроскопа. Проверьте наличие помех в объеме, созданном на шаге 1.3.3.
ПРИМЕЧАНИЕ: Этот этап проверки имеет решающее значение для обеспечения беспрепятственного позиционирования и перемещения объекта в соответствии с требованиями.
- Осмотрите всю конструкцию имплантата, включая смотровое окно и ласточкин хвост, чтобы убедиться в отсутствии механического вмешательства в объектив микроскопа. Проверьте наличие помех в объеме, созданном на шаге 1.3.3.
- Удалите ненужный материал из хвоста имплантата, чтобы минимизировать вес и уменьшить потенциальный дискомфорт для животного.
- Создайте эскиз в срединной плоскости и нарисуйте на нем треугольные вырезы, чтобы сформировать ферменную конструкцию при извлечении методом выдавливания из тела хвостового оперения.
- Повторите в перпендикулярной плоскости.
- Проверка максимального смещения с помощью метода конечных элементов (МКЭ) для анализа механических свойств имплантата в различных условиях.
ПРИМЕЧАНИЕ: Это моделирование помогает прогнозировать максимальное смещение и напряжения внутри имплантата во время использования, обеспечивая его надежность.- Включите надстройку для моделирования программного обеспечения САПР.
- На панели инструментов Simulation (Моделирование) создайте новое статическое исследование. Перейдите на вкладку Simulation (если она отображается) или перейдите в раздел Simulation | Учеба. В диалоговом окне Исследование выберите тип исследования Статический. Нажмите OK, чтобы создать новое исследование (дополнительный рисунок S5).
ПРИМЕЧАНИЕ: Этот тип исследования подходит для анализа деформации и напряжения при статических нагрузках, как ожидается при использовании имплантата. - Выберите материал для имплантата, который соответствует фактическому составу имплантата (Ti6Al4V).
- Определите фиксированные ограничения для моделирования точек крепления имплантата в местах, где он будет соприкасаться с фиксацией ласточкин хвост. Определите верхнюю поверхность ласточкиного хвоста как фиксированную.
- Определите вертикальную нагрузку на нижнюю поверхность имплантата. Установите вертикальное усилие 1 Н.
- Сгенерируйте сетку. Уточнение сетки в областях, где ожидается высокое напряжение или деформация (дополнительный рисунок S6). Для этого щелкните правой кнопкой мыши элемент mesh в дереве изучения и выберите Create Mesh... В диалоговом окне «Сетка » отрегулируйте плотность сетки с помощью ползунка или с помощью окна «Управление сеткой », чтобы установить максимальный и минимальный размеры элементов независимо друг от друга. Нажмите OK , чтобы создать сетку.
ПРИМЕЧАНИЕ: Программное обеспечение автоматически генерирует исходную сетку для исследования, но для получения более точных результатов сетка может быть уточнена для выбора более тонкой сетки, особенно в областях, которые имеют решающее значение для стабильности имплантата (например, окно наблюдения). Более тонкое построение сетки в этих областях повышает точность моделирования за счет захвата локальных концентраций напряжений. - Запустите статический анализ, чтобы рассчитать смещение, напряжение и распределение деформаций по всему имплантату.
- Проанализируйте результаты. Изучите график смещения, чтобы определить области максимальной деформации. Этот график показывает, насколько имплантат будет деформироваться под воздействием приложенных нагрузок, выделяя любые участки, подверженные риску чрезмерного движения. Следите за тем, чтобы деформация внутри смотрового окна не превышала 3 мкм.
- Наконец, спроектируйте защитную крышку для защиты смотрового окна, когда оно не используется. Эта крышка защищает открытую кость от загрязнений окружающей среды и физических повреждений.
2. Лечение у мышей, анестезия и хирургическая имплантация головного имплантата
ПРИМЕЧАНИЕ: Здесь могут быть использованы как самцы, так и самки, мыши C57BL/6 в возрасте от 7 до 12 недель или трансгенные мыши, как показано на рисунке. Чтобы индуцировать колонизацию КМ лейкемией, лейкозные клетки, как описано в Horton et al.12, вводят внутривенно за 2-3 недели до визуализации. Чтобы гарантировать здоровье раны, необходимо использовать стерильные методы.
- Под капотом соберите стерильные хирургические инструменты (тупые ножницы и пинцет), триммер и расходные материалы, включая гель для глаз, физиологический раствор, дезинфицирующее средство, стоматологический цемент, абсорбирующие тампоны и чистящие салфетки. Включите стерилизатор шариков.
- Заполните камеру индукции анестетика 4% изофлураном и кислородом воздуха и поместите мышь в камеру. Когда животное будет полностью обезболено (проверьте потерю корректирующего рефлекса и более глубокое и медленное дыхание), переключите поток изофлурана на носовой конус анестезирующей маски и снизьте концентрацию изофлурана до 2%.
- Поместите мышь на грелку с температурой 37 °C и визуально контролируйте частоту дыхания. Дополнительно: Для мышей с патологическим фенотипом добавьте одеяло для выживания, чтобы сохранить правильную температуру на протяжении всей анестезии.
- Введите обезболивающее лекарство подкожно (Buprecare, 0,01 мг/кг) за 30 минут до операции.
- Побрейте головку мыши электрической бритвой.
- Добавьте каплю офтальмологического геля на глаза мыши, чтобы предотвратить сухость во время нахождения под анестезией, следя за тем, чтобы гель не капал на кожу головы.
- Очистите мышь, чтобы удалить остатки волос в области операции. Промокните верхнюю часть кожи головы дезинфицирующим средством на ватную салфетку. Обязательно удалите все волосы, чтобы избежать артефактов изображения, а также риска инфицирования раны.
- С помощью стерильных щипцов и ножниц (через 30 с в стерилизаторе) сделайте небольшой разрез в центральной части волосистой части головы, чтобы обнажить центральный костный рубец. Следуйте ему, чтобы определить правильную длину и ширину области изображения. Аккуратно снимите кусочек кожи головы, приподнимите кожу между ушами с помощью щипцов и сделайте небольшой разрез на затылке. Удерживая кожу вверх, проведите ножницами под кожу и аккуратно разрежьте за пределами области визуализации.
- Удалите соединительную ткань между черепом и кожей головы. Протрите оголенную кость стерильным ПБС на ватном тампоне. Быстро приступайте к прикреплению головного имплантата к черепу мыши, чтобы избежать длительного обнажения кости черепа (<10 мин).
- Сделайте пасту с достаточным количеством стоматологического цемента в чашке Петри, следуя инструкциям производителя, и быстро нанесите ее на нижнюю часть имплантата фиксации головки.
- Не вводя стоматологический цемент в область визуализации, поместите держатель для головы на открытый череп мыши и подождите, пока он схватится.
- После застывания (обычно в течение 3-5 минут) добавьте несколько капель 37 °C PBS в камеру визуализации, чтобы сохранить гидратацию черепа.
3. Визуализация с помощью двухфотонного микроскопа
- Перед началом операции включите лазер и дайте ему нагреться для стабилизации. Включите микроскоп и запустите программное обеспечение для сбора данных. Выберите подходящую цель (погружение в воду 25x/0.95 для этого эксперимента).
- Используйте вертикальную подставку для микроскопа с фиксированным столиком, в которой достаточно места для размещения ветеринарной макетной платы с грелкой, которая должна быть перемещена как единое целое с предметным столиком xy. Используйте прочную алюминиевую оптическую макетную плату в качестве платформы для крепления головного имплантата и стереотаксической маски. Соедините гибкие шланги и их соединители, связанные с инъекцией и экстракцией изофлурана, с маской в клетке микроскопа.
- Настройте параметры сбора данных для быстрого сканирования: формат 512 x 512 пикселей; скорость 600 Гц; и коэффициент масштабирования 1.
- Настройте лазерную линию на 880 нм, чтобы иметь возможность обнаруживать SHG, GFP и tdTOMATO с одинаковой длиной волны возбуждения.
- Выключите свет в комнате и закройте коробку вокруг подставки для микроскопа должным образом, прежде чем активировать детекторы NDD и определить спектральные детектирующие вентили: PMT1, для детектирования SHG [388 - 431 нм]; HyD2, для GFP [485 - 548 нм] и HyD3 для tdTOMATO [551 - 645 нм]. Оставьте смещение равным 0.
- Создайте новый набор данных проекта и переименуйте его в соответствии с конкретным экспериментом.
- После того, как имплантат фиксации головы прикреплен к черепу мыши (подтверждено цементным затвердеванием), включите изофлуран в направлении стереотаксической маски микроскопа.
- Быстро поднесите мышь к микроскопу. Осторожно вставьте зубы мыши в маску, чтобы обеспечить проникновение изофлурана через нос мыши, приподняв ее нос одной рукой.
- Держа мышь одной рукой, другой рукой аккуратно вставьте ласточкин хвост имплантата фиксатора головки в держатель фиксации и закрепите его половинчатым поворотом винтовой ручки.
- Введите ректальный зонд с предварительно встроенным гелем на водной основе для контроля температуры и добавьте офтальмологические капли в глаза мыши.
- Заполните камеру визуализации головы большим количеством геля на водной основе или PBS и опустите объектив погружения в воду, чтобы полностью погрузить его для получения оптимального возбуждения и обнаружения сигналов, генерируемых двухфотонным возбуждением.
- Переместите x-y ступень и z-образный привод, чтобы сфокусироваться на центральной кости, в рубец на каркасе.
ПРИМЕЧАНИЕ: В качестве источника света удобно использовать окуляры микроскопа и металлогалогенную лампу, фильтруемую трехполосным фильтром возбуждения. Отсутствие оптической секции делает невозможным получение четкого изображения; Но с практикой центральная область черепа легко узнаваема. - После идентификации ткани, отмеченной костной поверхностью и центральной веной, выключите металлогалогенную лампу и закройте окна клетки микроскопа, чтобы защитить HyD-детекторы и пропустить инфракрасный (ИК) лазер.
- Установите коэффициент усиления ФЭУ/ГВГ на 850 В (его линейный рабочий диапазон) и установите коэффициент усиления HyD на 100%. Увеличивайте мощность ИК-лазера до тех пор, пока на самом нижнем из трех каналов не будет получено изображение с динамическим диапазоном 200 уровней серого (с 8-битными динамическими детекторами). Уменьшите усиление других детекторов, если различия в излучении слишком важны или если есть насыщение, используя режим «ниже нижнего» таблицы поиска (LUT).
ПРИМЕЧАНИЕ: В нашем случае мощности лазера в 30% было достаточно для получения контраста во всех каналах. - В программном обеспечении для сбора данных выполните поиск области, состоящей из карманов КМ (GFP+, tdTOMATO+), заключенных в костные поверхности (ГВГ).
- Чтобы найти различные ROI, активируйте LAS NAVIGATOR и создайте обзор всего региона с помощью спирального режима. Остановите съемку, когда полученная поверхность станет достаточно большой. Сохраните обзор, объедините его и переименуйте: это будет эталонное изображение в случае продольного изображения.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не создать слишком большую спираль, так как это может привести к контакту держателя устройства с объективом. - Запишите некоторые позиции ROI, щелкнув по значку одного изображения , и переименуйте каждую позицию в списке задач. Сделайте снимок экрана, чтобы взаимное расположение различных ROI было наложено на ранее сохраненный обзор.
ПРИМЕЧАНИЕ: Этот снимок экрана будет иметь важное значение для замены ROI при продольной визуализации, поскольку программное обеспечение для сбора данных не позволяет вызвать эту группу позиций в версии, использованной для данного эксперимента. - Чтобы получить объем z-стека, выберите режим z-стека, определите размер шага на 3 мкм и снимите флажок «Одинаковый размер стека для всех регионов ». Выберите первую позицию, определите верхнюю и нижнюю позиции, проверьте размер z-шага и нажмите « Переопределить стек». Рядом с названием позиции в списке позиций появляется значок куба. Повторите этот шаг для всех позиций различных ROI.
- Нажмите «Получить» и сохраните изображения (три канала, z-стеки с ~50 планами) в соответствующую папку. На этом шаге отмечается Tctrl эксперимента; Проверьте правильность параметров сбора данных (получите правильный динамический диапазон в трех каналах, избегайте насыщения сигнала, насколько это возможно, и проверьте время сбора данных для полного цикла).
- Чтобы измерить динамическую особенность (в данном случае проницаемость сосудов), приобретите таймлапс.
- В этой конфигурации три детектора позволяют одновременно визуализировать три канала; если для эксперимента требуется четвертый канал (в данном случае мониторинг декстрана), активируйте последовательный режим и добавьте вторую последовательность захвата. Настройте линию ИК-лазера на 820 нм, чтобы иметь возможность возбуждать флуорофор Dextan Cy5. Измените дальность обнаружения Hyd2 на [650 - 744 нм] и отключите остальные детекторы. Выберите один из режимов сбора стеков .
ПРИМЕЧАНИЕ: По умолчанию вторая последовательность сбора данных имеет те же параметры, что и последовательность 1. - Перед началом таймлапса запустите захват всех позиций, чтобы время записи не превышало 3 мин (с учетом добавления последовательного режима), минимальное время, необходимое для обнаружения утечки декстрана.
- Перед инъекцией декстрана измените режим сбора данных на xyzt. В модуле t установите временной интервал на 3 минуты и продолжительность на 1 час.
- В этой конфигурации три детектора позволяют одновременно визуализировать три канала; если для эксперимента требуется четвертый канал (в данном случае мониторинг декстрана), активируйте последовательный режим и добавьте вторую последовательность захвата. Настройте линию ИК-лазера на 820 нм, чтобы иметь возможность возбуждать флуорофор Dextan Cy5. Измените дальность обнаружения Hyd2 на [650 - 744 нм] и отключите остальные детекторы. Выберите один из режимов сбора стеков .
- Введите 100 мкл Декстрана 70 KDa-TRITC (или 500 KDa-Cy5) в дозе 3 мг/мышь внутривенно и начните забор.
- После получения сохраните набор данных в соответствующей папке.
ПРИМЕЧАНИЕ: Во время этих многочисленных шагов часто контролируйте частоту дыхания и температуру мыши и при необходимости регулируйте поток изофлурана. В идеале температура, ЭКГ и частота дыхания могут быть записаны и включены в качестве метаданных эксперимента.
4. Восстановление мыши
- После завершения сеанса визуализации отключите детектор HyDs в программном обеспечении для сбора данных и включите нагревательную коробку мыши (37 °C). Откройте клетку микроскопа, поднимите объектив и снимите ректальный зонд с мыши. Затем аккуратно выдвиньте ласточкин хвост имплантата фиксации головки из держателя фиксации и переместите мышь из стереотаксической маски микроскопа в операционную маску на грелке.
- Выключите инъекцию изофлурана под микроскопом и выключите грелку.
- Аккуратно удалите гель на водной основе или PBS с черепа мыши с помощью стерильного тампона.
- Добавляйте гель для поддержания влажности черепа между сеансами визуализации, как описано ранее13.
- Закройте область визуализации головного имплантата специальной крышкой и аккуратно закрепите ее винтом.
- Поместите мышь в нагревательную коробку при температуре 37 °C и подождите, пока она проснется. Принесите мышь в помещение для животных и поместите ее в чистую клетку с гидрогелем и обогащением. Наблюдайте за животными каждый день, чтобы заметить любые признаки боли или инфекции, в этом случае проводите Buprecare ежедневно. Чтобы сохранить влажность кальция, меняйте внутрипочвенный гель 2 раза в неделю.
ПРИМЕЧАНИЕ: Выберите высокую клетку с картонными укрытиями и материалом для гнезд и обязательно разместите мышей в отдельных клетках.
5. Продольные приобретения
ПРИМЕЧАНИЕ: Мышь может быть снова изображена в течение следующих дней. Тем не менее, не повторяйте более трех сеансов визуализации в неделю, чтобы избежать нежелательных эффектов повторной анестезии, таких как сухость глаз или чрезмерная усталость, а также респираторный дистресс и переохлаждение.
- Чтобы повторно создать образ мыши с уже установленным держателем для головы, выполните шаг 2.2 и нанесите небольшую каплю офтальмологического геля на глаза мыши, чтобы предотвратить сухость во время процедуры.
- Следуйте инструкциям в разделе 3 до шага 3.16, чтобы получить обзорное изображение.
ПРИМЕЧАНИЕ: Использование титанового имплантата с головкой без необходимости изменения высоты или угла положения держателя позволяет очень легко найти общую область интереса. - При необходимости повторно выровняйте предыдущее и новое изображения с помощью модуля «Открыть изображение и выровнять».
- Откройте изображение для захвата экрана из шага 3.17, чтобы отметить позиции на их исходном месте.
ПРИМЕЧАНИЕ: Использование контраста ГВГ очень полезно, особенно при ожидании ремоделирования кровеносных сосудов и ассоциированных клеток, экспрессирующих GFP. - Приобретайте z-стеки и таймлапсы таким же образом, как описано в шагах 3.18-3.22.
6. Количественное определение сосудистых параметров
- Сосудистые показатели
- Чтобы открыть изображения, сгенерированные программным обеспечением (файлы .lif) в IMARIS, сначала преобразуйте их в формат ".ims" с помощью Конвертера файлов. Откройте файл ".ims" с помощью IMARIS, проверьте метаданные (масштабы X, Y, Z) и выберите модуль Filament . Выберите пропустить автоматическое создание, редактируйте вручную.
- Для лучшей визуализации во время создания нити накала перейдите в раздел «Настройки » (символ листа), выберите «Линия в стиле» и оставьте количество пикселей на значении по умолчанию (1). Отметьте галочками флажки Показать дендриты, включая начальную точку, точки ветви и конечные точки. Снимите галочку с опции Показать позвоночник.
- В разделе "Рисование " (символ кисти) выберите "Метод автопути"; диаметр 5 мкм, а также источник канала, связанный с судном (в данном случае TRITC-Dextran). Наконец, отметьте галочками автоматический центр и автоматический диаметрr.
- Начните рисовать нити, используя Shift + щелчок правой кнопкой мыши , чтобы указать начальную точку ветви, и Shift + левый клик , чтобы указать конечную точку ветви.
ПРИМЕЧАНИЕ: Начальная точка обозначена светло-голубым цветом, точки ветвления - красным или темно-синим, а конечные точки - зеленым. - Чтобы задать нужный диаметр нити накала во время рисования, используйте кнопку прокрутки мыши.
- Чтобы соединить две нити с различными концевыми точками, создайте новую начальную точку между ними и соедините ее в каждой конечной точке.
ПРИМЕЧАНИЕ: Таким образом, в точках разветвления появляются зеленые конечные точки. - После создания сосудистого дерева вернитесь к настройкам и убедитесь, что количество начальных, ветвящихся и конечных точек указано правильно. Выберите конус , чтобы визуализировать диаметры и проверить их внешний вид.
- Если диаметр нити накала (или соединение) кажется неправильным, перейдите в раздел Редактировать (символ карандаша), выберите нить, которую нужно удалить, щелкнув правой кнопкой мыши, и нажмите кнопку Удалить. Перерисуйте нить, отрегулировав диаметр нити с помощью кнопки прокрутки мыши.
- Чтобы извлечь все сгенерированные статистические данные и сохранить их, нажмите на иконку Статистика | экспортировать всю статистику в файл-(иконка с несколькими дискетами внизу экрана).
ПРИМЕЧАНИЕ: Во избежание каких-либо потенциально аберрантных нитей, не соответствующих сосудам, в статистический анализ были включены только нити длиной более 20 мкм.
- Количественная оценка утечки
ПРИМЕЧАНИЕ: Чтобы открыть изображения, сгенерированные с помощью программного обеспечения (файл .lif) в IMARIS, сначала преобразуйте их в формат ".ims" с помощью Конвертера файлов.- Чтобы объединить изображения, сделанные до и после инъекции декстрана, в один и тот же временной ряд, перейдите в режим «Превзойти», нажмите как на первое изображение (Tctrl , перед введением декстрана), так и на таймлапс-изображение (время 1, 60 мин), чтобы открыть их, и объедините их, нажав «Редактировать и добавить точки времени».
ПРИМЕЧАНИЕ: Чтобы исправить возможный 3D-дрейф, выполните шаги 6.2.2-6.2.7, используя функцию моста между Фиджи и IMARIS. Установите на Фиджи следующие плагины: "IMARIS_Bridge96.jar" и "IMARISBridgeUtils.jar". Регистрация 3D дрифта выполняется с помощью "StackReg Pluging" (уже доступно на Фиджи). Если в этом нет необходимости, перейдите к шагу 6.2.8 - Чтобы выполнить коррекцию 3D дрифта, откройте Fiji to bridge images из IMARIS, нажав на Плагины | ИМАРИС | Изображение предоставлено IMARIS.
- На Фиджи выберите Плагины | Регистрация | Правильный 3D дрифт.
- В появившихся новых окнах выберите подходящий канал для регистрации.
ПРИМЕЧАНИЕ: В данном случае это был Nestin-GFP, но это мог быть любой канал, выделяющий неподвижные объекты и высокое соотношение сигнал/фон. - Чтобы улучшить обнаружение небольших смещений, выберите « Вычисление в нескольких временных масштабах», «Коррекция субпиксельного дрейфа » и «Улучшить изображения по краям», а остальные настройки оставьте по умолчанию.
- Чтобы связать исправленное изображение с IMARIS, выберите его и нажмите на Плагины | ИМАРИС | Изображение для IMARIS.
- Сохраните его в соответствующей папке, нажав Файл | Сохранить как.
- Чтобы визуализировать все полученные каналы, нажмите на Редактировать | Показать настройку дисплея. Выберите канал декстрана и время 1 (кадр 2 в нижней части экрана).
- Создайте новую поверхность, определяющую просвет сосуда в момент времени 1 , установив флажок « Добавить новую поверхность » (синий объект)
- На поверхности 1 перейдите в раздел Свойства и снимите флажки со всех параметров в разделе Параметры алгоритма. Нажмите на следующий шаг (синяя стрелка)
- Выберите сосудистый канал (в данном случае декстран) в поле исходный канал и поставьте галочку Плавное и фоновое вычитание. Оставьте все остальные параметры на значениях по умолчанию. Нажмите на следующий шаг (синяя стрелка).
- Отрегулируйте значение Порога в соответствии с внешним видом поверхности с точки зрения толщины и покрытия всех положительных областей. Нажмите на следующий шаг (синяя стрелка).
- Исключите неспецифические поверхности (в основном мелкие точки) с помощью фильтра по умолчанию Количество вокселей. Нажмите на последний шаг (зеленая стрелка).
- При необходимости продолжайте корректировку поверхности вручную, нажав на кнопку «Редактировать » (значок карандаша) в разделе «Настройка параметров». Чтобы выбрать объект для удаления, щелкните по нему левой кнопкой мыши и удалите, выбрав «Удалить». Если удаляемый объект сопоставлен с другим, отсоедините две разделенные части поверхности, нажав клавиши Shift + щелчок влево между ними и выбрав команду "Разрезать поверхность". Повторите этот шаг столько раз, сколько необходимо.
- Наконец, объедините все сегменты в режиме выделения (значок цели справа) и нажмите Control + scroll для восстановления всех объектов. Когда все выбраны, щелкните левой кнопкой мыши и нажмите «Объединить».
- Чтобы создать опорную поверхность, скопируйте эту поверхность в другие временные точки. Выделите глобальную поверхность и скопируйте ее, нажав кнопку «Дублировать », и переименуйте ее в «Внутрисосудистая».
- Выделите поверхность Intravascular и нажмите Duplicate to all Timepoints.
- Расщепляйте сигнал декстрана, чтобы различать внутренние (IN) и внесосудистые (OUT) области. Чтобы создать IN channeI для всех временных точек, нажмите на поверхность Внутрисосудистый | Правка (кнопка карандаша) | Маскируйте все.
- В окне «Выбор канала» выберите подходящий канал и установите флажок « Дубликат канала» перед применением маски. В настройках маски отметьте галочкой только Константа внутри/снаружи с установленными вокселями снаружи поверхности равным 0. Наконец, отметьте галочкой также Применить ко всем временным точкам.
- В настройке дисплея по умолчанию создается новый канал с замаскированным именем. Переименуйте его IN.
- Чтобы создать канал OUT для всех временных точек, повторите шаги 6.2.18-6.2.20, но выберите для параметра Установить вокселы внутри поверхности равным 0. Переименуйте этот новый канал в OUT.
- Чтобы извлечь статистические данные, нажмите на иконку Статистика | Экспорт всей статистики в файл (иконка с несколькими дискетами в нижней части экрана)
- Чтобы проанализировать утечку, разделите канал суммы интенсивности снаружи на канал суммы интенсивности внутри для каждой временной точки.
- Чтобы объединить изображения, сделанные до и после инъекции декстрана, в один и тот же временной ряд, перейдите в режим «Превзойти», нажмите как на первое изображение (Tctrl , перед введением декстрана), так и на таймлапс-изображение (время 1, 60 мин), чтобы открыть их, и объедините их, нажав «Редактировать и добавить точки времени».
Результаты
На рисунках 1 и 2 показана модель САПР титанового имплантата для фиксации головки, расположенного на отсканированном черепе мыши, который разработан таким образом, чтобы повторять анатомическую структуру черепа и представлять собой легкое и биосовместимое устройство, способное прочно удерживаться на предметном столике микроскопа, обеспечивая стабильность на клеточном уровне. Следуя этому пошаговому протоколу, имплантат надежно прикрепляется к черепу мыши и может быть надежно закреплен на держателе микроскопа с помощью ласточкиного хвоста, что обеспечивает плоскую область визуализации для удержания жидкости и прижизненного наблюдения с течением времени. Он может быть закрыт крышкой, чтобы свести к минимуму любое повреждение или инфекцию раны, что позволяет повторно визуализировать один и тот же участок ткани в течение нескольких недель. Проснувшись, мышь с имплантом головы может свободно ходить, питаться и заниматься обычными делами.
На рисунке 3 показано изображение кальвариальной сосудистой сети КМ, состоящей из гетерогенных капилляров, включая артериолы, переходные капилляры и синусоиды. Сосуды встраиваются в сложное тканевое микроокружение в тесном контакте с поверхностью кости и периваскулярными мезенхимальными клетками. Во время развития лейкоза одиночные изолированные лейкозные клетки могут обнаруживаться в микроокружении КМ в непосредственной близости от сосудов, и их приживление со временем увеличивается, заполняя кальварию на поздних стадиях заболевания.
На рисунке 4 показано, как изображения, полученные с помощью этого протокола, могут предоставить количественные данные, которые могут быть проанализированы с помощью статистических методов. Мы покажем, как сегментировать сосуды с помощью филаментного инструмента IMARIS и измерить длину и диаметр сосудистых фрагментов, а также их прямолинейность. Корреляция этих параметров также может быть оценена.
На рисунке 5 показана продольная визуализационная съемка двух различных положений кальвариальной КМ во время прогрессирования ОМЛ на 4, 7 и 10 день, причем 10-й день был связан с ~50% приживлением КМ лейкозными клетками, что было измерено с помощью проточной цитометрии (не показано). Мы можем наблюдать важное ремоделирование размеров ранее существовавших сосудов, а также формирование новых сосудов в определенных областях, связанных с локальной потерей костной массы.
Наконец, на рисунке 6 мы показываем, как проницаемость сосудов может быть измерена в качестве динамического параметра с помощью покадровой визуализации, показывающей способность различных сосудистых барьеров удерживать флуоресцентный краситель с течением времени.
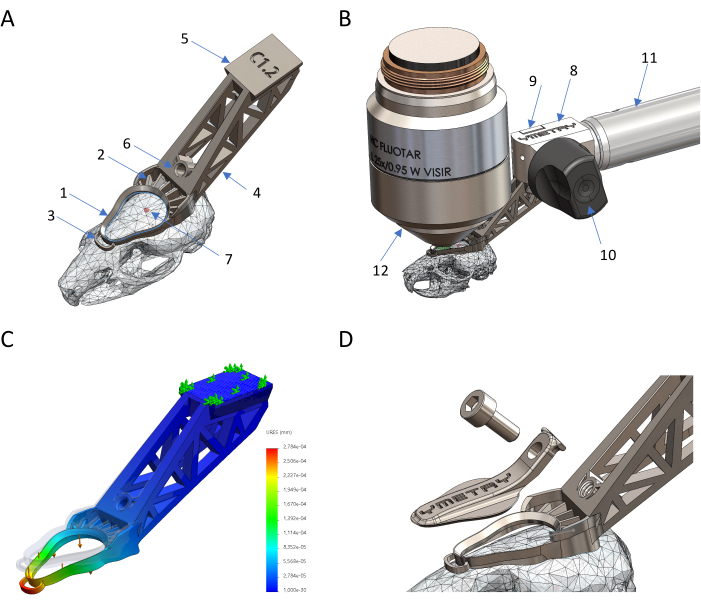
Рисунок 1: Разработка и производство биосовместимого держателя головки на основе титана. (A) Части имплантата на месте: 1 смотровое кольцо, 2 цементирующее устройство, 3 стабилизирующий анкер, 4 хвост, 5 ласточкин хвост, 6 резьбовое отверстие, 7 брегма. (Б) Подключение головного имплантата к держателю: 8 фиксирующий корпус, 9 зажим, 10 эксцентриковый рычаг, 11 структура, 12 объектив микроскопа. (C) Деформация имплантата под действием нагрузки с помощью моделирования методом конечных элементов при максимальном смещении 0,23 мкм при силе 0,04 Н. (D) Защитная крышка и ее винт. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Подготовка мыши к прижизненной визуализации. (A) Вид на головной имплантат и область визуализации, обработанную хирургическим путем перед визуализацией. (B) Имплантат головы прочно прикреплен к черепу мыши. (C) Мышь проснулась в клетке для восстановления с закрытой крышкой на головном имплантате. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
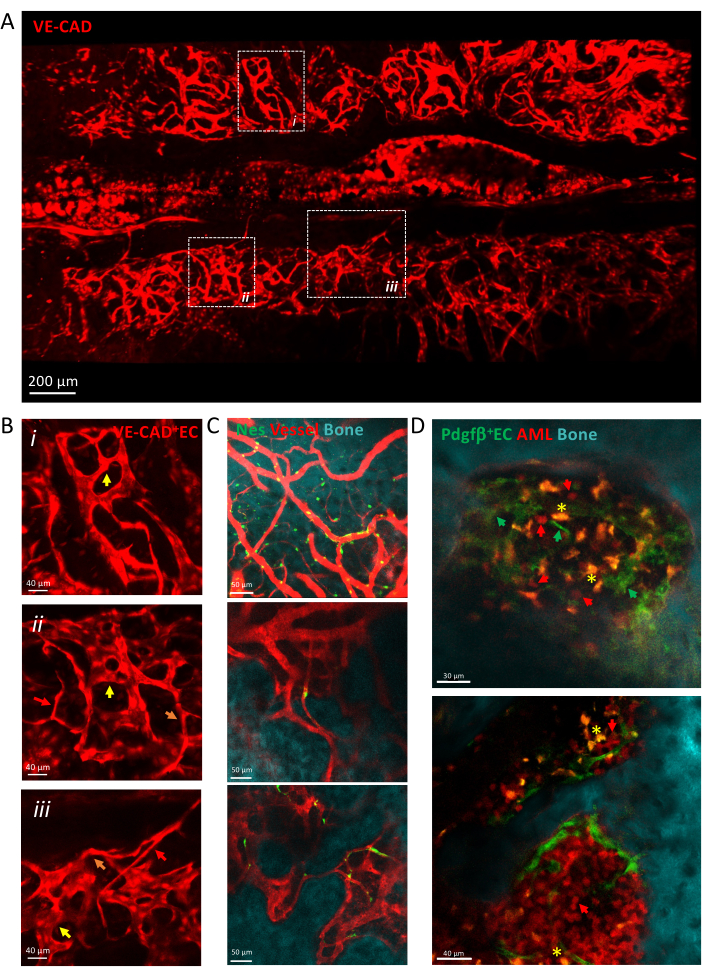
Рисунок 3: Прижизненная визуализация сосудистой сети кальварии. (A) z-проекция сканирования сосудистой сети кальварии, меченной cdh5-DSRED. (B) Увеличьте изображенные области, чтобы описать различные типы сосудов, изображенные стрелками, артериолы — красными стрелками, переходные капилляры — оранжевыми стрелками, синусоиды — желтыми стрелками. (i) и (ii) z-проекции X μm ткани; (iii) один ломтик. (C) Одиночные срезы нескольких полей зрения сосудов КМ, показывающие поверхность кости (ГСП), периваскулярные клетки (nes-GFP+) и просвет сосудов (dextran-TRITC). (D) Сосудистая ниша, связанная с прогрессированием ОМЛ. Репрезентативные срезы ранних (вверху) и поздних (внизу) временных точек развития AML. Лейкоз MLL-AF9 помечен tdTOMATO (красные стрелки), в то время как сосуды помечены pdgfb-GFP (зеленые стрелки), поверхность кости — ГВГ, а макрофаги — желтым (аутофлуоресценция, желтая звездочка). Масштабные линейки = 200 μм (A), 40 μm (B,D-нижняя панель), 50 μm (C). Сокращения: BM = костный мозг; GFP = зеленый флуоресцентный белок; ОМЛ = острый миелоидный лейкоз; EC= Эндотелиальные клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Количественная оценка сосудистых параметров. (A) Измерение сосудистых параметров с помощью филаментного инструмента IMARIS в репрезентативной z-проекции сосудов костного мозга, меченных TRITC-декстраном. Отображаются линейные и конусные представления. (В) Количественная оценка параметров судна на изображении, показанном в А. (C) Корреляция между сосудистыми параметрами, показывающая противоположную корреляцию между прямолинейностью сосуда и длиной (отрицательная, Спирмен r = -3523; p < 0,0001; R2 = 0,2102) от диаметра (положительный; Копейщик r = 0,4110; р < 0,0001; R2 = 0,1299). Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
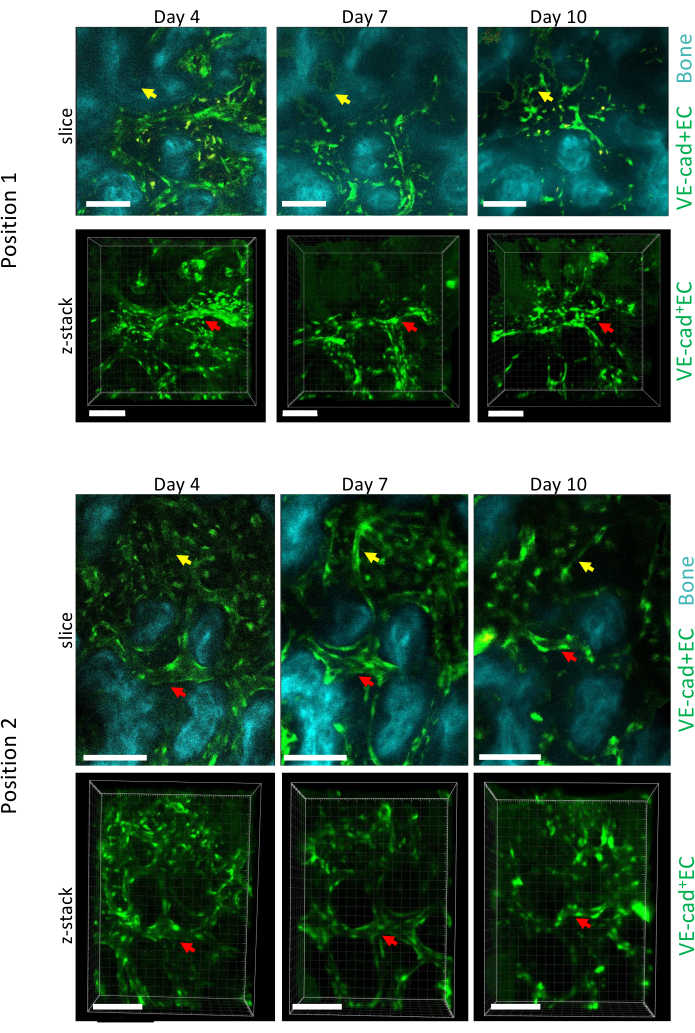
Рисунок 5: Продольная визуализация двух различных положений БМ кальварии над развитием ОМЛ. Эндотелиальные клетки, выстилающие сосуды, помечены cdh5-GFP, костная поверхность — ГВГ, а макрофаги — желтым цветом (аутофлуоресценция). Показано ремоделирование ранее существовавших сосудов (красные стрелки) и формирование новых сосудов (желтые стрелки). Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Проницаемость сосудов. (A) Схемы измерения проницаемости сосудов с помощью инструмента IMARIS Surface. (B) Z-проекция той же области, визуализированная в продольном направлении в течение 1 часа. (C) Количественная оценка проницаемости сосудов в областях, как показано на рисунке A. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок S1: Подготовленный череп. В срединной плоскости создайте ось, касательную к кальварии, затем сохраните подготовленный череп. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Планы с интервалом 2 мм. Как создать набор одинаково удаленных плоскостей (расстояние 2 мм) поперек черепа. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Наблюдаемый контур поверхности. Создайте эскиз в кальварной плоскости и создайте грушевидный сплайн от AP +6,5 до -2,6 мм шириной при AP 0,0. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S4: Наблюдение vindow. Создайте эскиз в плоскости голвары и нарисуйте С-образную форму толщиной 0,5 мм, примыкающую к окну наблюдения . Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S5: Нажмите на новое исследование. Перейдите на вкладку Simulation (если она отображается) или перейдите в раздел Simulation | Учеба. В диалоговом окне Исследование выберите тип исследования Статический. Нажмите OK, чтобы создать новое исследование. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S6: Щелкните правой кнопкой мыши для создания сетки. Уточнение сетки в областях, где ожидается высокое напряжение или деформация. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Основным преимуществом прижизненной микроскопии является ее способность фиксировать динамические клеточные процессы в режиме реального времени в их естественной среде, преодолевая ограничения традиционных гистологических методов и визуализации ex vivo. Наблюдая непосредственно за кальвариальной КМ с использованием передовых методов визуализации в сочетании с флуоресцентным мечением, как описано в этом протоколе, исследователи могут изучать не только функциональные параметры сосудов 8,14, но и продольные процессы, такие как приживление и миграция лейкозных клеток 6,15, пролиферация и метаболическая активность16,17 сохранение физиологической значимости и избежание артефактов, связанных с фиксацией и обработкой тканей.
Преимущества прижизненной визуализации BM calvaria по сравнению с альтернативными костными участками включают в себя легкую доступность, прозрачность кости черепа, позволяющую лучше визуализировать без повреждения кости, стабильность кости calvarium, сводящую к минимуму артефакты движения тканей, и воспроизводимость на экспериментальных животных, облегчающую сравнение между различными экспериментальными группами. Возможность восстановления животных и выполнения продольной визуализации также позволяет сократить количество животных, используемых в исследовании. Стоит отметить, что, поскольку были замечены специфичные для штамма различия в моделях роста сосудов черепа и последующий остеогенез18, важно учитывать это при проектировании конкретного имплантата визуализации для желаемой линии мыши, чтобы обеспечить идеальную анатомическую совместимость и доступ к желаемому месту визуализации.
Еще одним важным моментом, о котором следует упомянуть, является потенциальная разница в сосудистых и кроветворных свойствах в кальвариальной КМ по сравнению с другими костями, что является малоизученным вопросом до недавнего времени. Новые исследования предполагают локализованные функции различных костей, при этом черепная КМ отличается от других костей с точки зрения кроветворения, структуры и функции костей и сосудов 19,20,21,22,23, а также ответа на неврологические патологии 24. Эти различия необходимо дополнительно изучить и учесть, прежде чем обобщать конкретные результаты кальварии.
Проектирование и изготовление имплантата для визуализации является ключевым этапом для этой экспериментальной установки, начиная с выбора материала. Биосовместимые имплантаты играют ключевую роль в биомедицинских исследованиях, облегчая широкий спектр применений, начиная от тканевой инженерии и регенеративной медицины и заканчивая системами доставки лекарств и устройствами мониторинга in vivo . Выбор материала для головного имплантата, адаптированного для прижизненной визуализации, имеет решающее значение. В идеале материал должен обладать отличной биосовместимостью, механическими свойствами, подходящими для обеспечения минимальной гибкости и общей стабильности, и, наконец, способностью интегрироваться внутрь черепа, не вызывая воспаления. Титан идеально подходит благодаря своей хорошей переносимости в организме животного, без индукции побочных реакций при контакте с биологическими тканями, а также своей устойчивости к коррозии, обеспечивая долговременную стабильность даже при воздействии биологических жидкостей или экспериментальных растворов. Кроме того, его механическая прочность делает его устойчивым к деформации и разрушению. Несмотря на свою прочность, титан имеет относительно низкую плотность, в результате чего получаются легкие прижизненные устройства визуализации, которые минимизируют нагрузку на подопытных животных и исследователей. Наконец, его универсальность в производстве позволяет настраивать прижизненные устройства визуализации в соответствии с конкретными экспериментальными требованиями, такими как размер, форма и функциональность.
В этой статье мы разработали биосовместимый имплантат для фиксации головки с помощью программного обеспечения САПР для параметрического моделирования со встроенными возможностями анализа методом конечных элементов (FEA), в частности SolidWorks. Такой подход позволяет точно и итеративно корректировать структурные и пространственные требования имплантата, обеспечивая как анатомическую совместимость, так и механическую прочность. Бесплатные альтернативы, такие как FreeCAD, предлагают аналогичные функции моделирования и симуляции. Основными исходными данными для процесса проектирования являются анатомическая модель черепа мыши с высоким разрешением, модель объектива микроскопа и модель системы фиксации, которые в совокупности определяют размеры и конфигурацию имплантата. Конечным результатом является независимый от платформы файл сетки, обычно в формате STL или STEP, совместимый с большинством программного обеспечения для 3D-печати.
Первый шаг включает в себя захват подробных анатомических особенностей головы мыши с помощью методов визуализации с высоким разрешением, таких как микрокомпьютерная томография in vivo . Такой подход обеспечивает высочайшую анатомическую детализацию и точность, захватывая микроструктуры черепа. 3D-сканирование подготовленного обнаженного черепа также может быть вариантом. Этот метод, использующий лазерные или структурированные световые сканеры, обычно применяется на подготовленном черепе и обеспечивает точные контуры поверхности, хотя и с меньшими внутренними деталями по сравнению с микрокомпьютерной томографией. В противном случае анатомические модели могут быть загружены из публикаций с открытым исходным кодом и баз данных25 или DigiMorph{https://www.digimorph.org/specimens/Mus_musculus/}. Несмотря на удобство, эти модели могут не иметь деталей, специфичных для конкретного образца, поэтому часто требуются корректировки для конкретного животного в исследовании, такие как масштабирование до фактического расстояния по шкале Брегма-Лямбда. Полученные данные затем используются для создания точной 3D-модели черепа мыши, которая служит основой для проектирования имплантата.
Чтобы закрепить имплантат на черепе, цементирующая конструкция предназначена для покрытия оставшейся поверхности черепа, не занятой смотровым окном. Эта структура должна обеспечивать прочные точки крепления, избегая при этом критических анатомических особенностей. Цементирующая структура имеет несколько отверстий для обеспечения оптимальной полимеризации цемента под имплантатом за счет диффузии. Кроме того, стенки цементирующей конструкции имеют небольшой угол уклона, что позволяет цементу надежно закрепиться на этих наклонных стенах. Спроектирован хвост имплантата, который простирается от основного тела к системе фиксации. Этот компонент имеет решающее значение для выравнивания и стабилизации имплантата во время наблюдения, и его конструкция должна учитывать доступное пространство и анатомические ограничения головы мыши. Наконец, в конструкцию имплантата интегрирован механизм «ласточкин хвост» для легкого крепления и отделения имплантата от системы фиксации. Эта особенность повышает практичность и удобство использования имплантата при повторных наблюдениях. Механизм «ласточкин хвост» обеспечивает воспроизводимую фиксацию для легкого извлечения наблюдаемых тканей для повторных сеансов визуализации.
Читатели, рассматривающие возможность внедрения прижизненной микроскопии черепного мозга КМ, должны тщательно оценить цели своих исследований и экспериментальные требования, чтобы определить, подходит ли этот метод для их исследований. В то время как прижизненная микроскопия предлагает беспрецедентное понимание кроветворения, регуляции микроокружения тканей и сосудистой динамики in vivo, она также сопряжена с определенными техническими проблемами и ограничениями. Исследователи должны быть готовы к решению этих проблем с помощью тщательного планирования экспериментов, оптимизации параметров визуализации и использования соответствующих средств контроля. Кроме того, исследователям следует учитывать наличие специализированного оборудования для визуализации, опыта в методах флуоресцентного мечения и вычислительных ресурсов для анализа изображений. В целом, прижизненная микроскопия кальвариальной КМ обладает огромным потенциалом для углубления нашего понимания кроветворения и сосудистой биологии, предлагая уникальное окно в динамические процессы, происходящие в микроокружении КМ.
Раскрытие информации
Йожсуа Фодор является основателем компании YMETRY (регистрационный номер 888312352). У остальных авторов конфликта интересов нет.
Благодарности
Авторы хотели бы поблагодарить всех сотрудников IMAG'IC и животных в Институте Кочина за их поддержку в проведении экспериментов с микроскопией и содержании мышей. Мыши Tg(Nes-EGFP)33Enik и Tg(Pdgfb-icre/ERT2)1Frut были любезным подарком доктора Боннета (Институт Фрэнсиса Крика, Лондон). Tg(Cdh5-cre/ERT2)1Rha и B6. Мыши Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J были любезным подарком доктора Рафии (Weill Cornell Medicine, Нью-Йорк). Описанная работа была поддержана CNRS, INSERM и Université de Paris Cite, а также грантами ATIP-AVENIR, Fondation ARC pour la recherche sur le le cancer (R19084KS - RSE20008KSA), Ville de Paris "Emergence" (R20192KK - RPH20192KKA), Laurette Fugain (R23197KK), Cancéropôle IDF (RPH23177KKA), INCA PLBIO (RPH21162KKA), Fondation de France (RAF23152KKA), Ligue contre le cancer (282273/807251), Institut du cancer Paris Carpem, Европейская гематологическая ассоциация (RAK23130KKA) и Европейский исследовательский совет ERC-STG (EEA24092KKA). Основная база IMAG'IC поддерживается Национальной инфраструктурой Франции по биовизуализации (грант ANR-10-INBS-04). Лаборатория Пассаро входит в состав "Institut Hors Murs des Sciences Cardiovasculaires" и "Leukemia Institute Paris Saint-Louis".
Материалы
| Name | Company | Catalog Number | Comments |
| Amira | Thermo ScientificTM | ||
| Anesthesia | Isoflurane 2% to 3% | ||
| Anesthesic mask (animal detection) | Minerve | ||
| Anesthesic unit | Minerve | ||
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze | Jackson laboratories | MGI:3809523 | |
| CalvariaVue | Ymetry | https://ymetry.com/site/head-fixation-implants/44-mouse-head-fixation-implant-for-calvaria.html | |
| Dental cement | Kemdent | SUN527 | |
| Dextran 500 kDa-Cy5 | Tebu-bio | DX500-S5-1 | 3 mg/mouse |
| Dextran 70 kDa-TRITC | Sigma | T1162 | 3 mg/mouse |
| Disinfectant | MP-Labo | Dermidine-60ml | |
| Electric razor | Aescular | Isis | |
| Eye gel | Ocry-gel | 10g | |
| Fiji | https://imagej.net/software/fiji/downloads | v 17 May 30 | |
| Fiji plugings to bridge with Imaris | https://imagej.net/software/fiji/downloads | Imaris_Bridge96.jar ; ImarisBridgeUtils.jar | |
| Heating box | Datesand | Thermacage | |
| Heating pad for surgery | Minerve | ||
| Imaging heating pad & rectal probe | F. Haer | ||
| Imaris v9.6.0 | Oxford instruments | ||
| Intrasite gel | Chinoxia | 2390766 | |
| LAS AF Software | Leica | LAS X 3.5.7.23225 | |
| Medication | Buprecare, 0.01 mg/kg | ||
| Objective HCX IRAPO L 25x/0.95 WATER | Leica | 506374 | |
| Saline buffer (PBS 1x) | Sigma | P4417 | Sterilize by autoclave |
| SP8 DIVE FALCON Multiphoton Microscope | Leica | ||
| Stereotoxic mask | Minerve | 1201261 | |
| Sterilizator beads | Sigma | Z742555 | |
| Surgery tools | Moria | 4877A; 2183 | |
| Survival blanket | SECURIMED | 11006 | |
| Swabs / Tissues | Sterilize by autoclave | ||
| Syringe 1 mL 26 G | BD Plastipak | 305501 | |
| Temperature controller | F. Haer | 40-90-5D-02 | |
| Tg(Nes-EGFP)33Enik mice | Jackson laboratories | MGI:5523870 | |
| Tg(Pdgfb-icre/ERT2)1Frut mice | Jackson laboratories | MGI:3793852 | |
| Tg(Cdh5-cre/ERT2)1Rha mice | Jackson laboratories | MGI:3848982 | |
| Ultrasound gel | Parker laboratories | Aquasonic 100 |
Ссылки
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Christodoulou, C., et al. Live-animal imaging of native haematopoietic stem and progenitor cells. Nature. 578 (7794), 278-283 (2020).
- Upadhaya, S., et al. Intravital imaging reveals motility of adult hematopoietic stem cells in the bone marrow niche. Cell Stem Cell. 27 (2), 336-345.e4 (2020).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Duarte, D., et al. Defining the in vivo characteristics of acute myeloid leukemia cells behavior by intravital imaging. Immunol Cell Biol. 97 (2), 229-235 (2019).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to disease progression and drug response in acute myeloid leukemia. Cancer Cell. 32 (3), 324-341.e6 (2017).
- Jia, Y., et al. FLT3 inhibitors upregulate CXCR4 and E-selectin ligands via ERK suppression in AML cells and CXCR4/E-selectin inhibition enhances anti-leukemia efficacy of FLT3-targeted therapy in AML. Leukemia. 37 (6), 1379-1383 (2023).
- Pendleton, E. G., Tehrani, K. F., Barrow, R. P., Mortensen, L. J. Second harmonic generation characterization of collagen in whole bone. Biomed Opt Express. 11 (8), 4379-4396 (2020).
- Ventalon, C., Bourdieu, L., Leger, J. F., Fodor, J. Dispositif de liaison d'un animal de laboratoire à au moins un système d'expérimentation, et procédé de fixation d'un tel dispositif. France patent. , (2021).
- Horton, S. J., et al. Acute myeloid leukemia induced by MLL-ENL is cured by oncogene ablation despite acquisition of complex genetic abnormalities. Blood. 113 (20), 4922-4929 (2009).
- Scott, M. K., Akinduro, O., Lo Celso, C. In vivo 4-dimensional tracking of hematopoietic stem and progenitor cells in adult mouse calvarial bone marrow. J Vis Exp. (91), e51683 (2014).
- Jung, Y., et al. Intravital imaging of mouse bone marrow: Hemodynamics and vascular permeability. Methods Mol Biol. 1763, 11-22 (2018).
- Le, V. H., et al. In vivo longitudinal visualization of bone marrow engraftment process in mouse calvaria using two-photon microscopy. Sci Rep. 7, 44097 (2017).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Yang, M., Mahanty, A., Jin, C., Wong, A. N. N., Yoo, J. S. Label-free metabolic imaging for sensitive and robust monitoring of anti-CD47 immunotherapy response in triple-negative breast cancer. J Immunother Cancer. 10 (9), e005199 (2022).
- Li, W., et al. Tracking strain-specific morphogenesis and angiogenesis of murine calvaria with large-scale optoacoustic and Ultrasound Microscopy. J Bone Miner Res. 37 (5), 1032-1043 (2022).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Rindone, A. N., et al. Quantitative 3D imaging of the cranial microvascular environment at single-cell resolution. Nat Commun. 12 (1), 6219 (2021).
- Mills, W. A., Coburn, M. A., Eyo, U. B. The emergence of the calvarial hematopoietic niche in health and disease. Immunol Rev. 311 (1), 26-38 (2022).
- Bixel, M. G., et al. Angiogenesis is uncoupled from osteogenesis during calvarial bone regeneration. Nat Commun. 15 (1), 4575 (2024).
- Koh, B. I., et al. Adult skull bone marrow is an expanding and resilient haematopoietic reservoir. Nature. 636 (8041), 172-181 (2024).
- Kolabas, Z. I., et al. Distinct molecular profiles of skull bone marrow in health and neurological disorders. Cell. 186 (17), 3706-3725.e9 (2023).
- Rosenhain, S., et al. A preclinical micro-computed tomography database including 3D whole body organ segmentations. Sci Data. 5, 180294 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены