Method Article
Гибридизация Цепная реакция РНК Флуоресценция in situ Гибридизация хемосенсорных генов в обонятельных придатках комаров
В этой статье
Резюме
В статье описаны методы и реагенты, необходимые для проведения гибридизации цепной реакции РНК флуоресценции in situ (HCR RNA WM-FISH) для получения информации о пространственном и клеточном разрешении генов хемосенсорных рецепторов в антенне комара и верхнечелюстных пальпах.
Аннотация
Комары являются эффективными переносчиками смертельных болезней и могут ориентироваться в химической среде с помощью хемосенсорных рецепторов, экспрессируемых в их обонятельных придатках. Понимание того, как хемосенсорные рецепторы пространственно организованы в периферических обонятельных придатках, может дать представление о том, как запах кодируется в обонятельной системе комаров, и проинформировать о новых способах борьбы с распространением заболеваний, переносимых комарами. Появление гибридизации цепной реакции РНК с флуоресценцией in situ (HCR RNA WM-FISH) позволяет осуществлять пространственное картирование и одновременное профилирование экспрессии нескольких хемосенсорных генов. В данной статье мы опишем поэтапный подход к выполнению HCR РНК WM-FISH на антенне комаров Anopheles и верхнечелюстных пальпах. Мы исследовали чувствительность этой методики, изучив профиль экспрессии ионотропных обонятельных рецепторов. Мы спросили, подходит ли описанная техника HCR WM-FISH для мультиплексных исследований путем привязки РНК-зондов к трем спектрально различным флуорофорам. Полученные результаты свидетельствуют о том, что HCR РНК WM-FISH обладает высокой чувствительностью к одновременному обнаружению нескольких хемосенсорных генов в антенне и верхнечелюстных пальпированных обонятельных придатках. Дальнейшие исследования подтверждают пригодность HCR WM-FISH для профилирования коэкспрессии мишеней с двойной и тройной РНК. Этот метод, применяемый с модификациями, может быть адаптирован для локализации интересующих генов в обонятельных тканях других видов насекомых или в других придатках.
Введение
Комары-переносчики, такие как Anopheles gambiae, полагаются на богатый репертуар хемосенсорных генов, экспрессируемых в их периферических обонятельных придатках, чтобы процветать в сложном химическом мире и идентифицировать поведенчески значимые запахи, исходящие от людей-хозяев, обнаруживать источники нектара и находитьместа яйцекладки. Антенна комара и верхнечелюстные щупики обогащены хемосенсорными генами, которые управляют обнаружением запаха в этих обонятельных придатках. Три основных класса лиганд-зависимых ионных каналов управляют обнаружением запаха в обонятельных придатках комаров: рецепторы одоранта (OR), которые функционируют с облигатным корецептором рецептора одоранта (Orco); ионотропные рецепторы (ИК), которые взаимодействуют с одним или несколькими ИК-корецепторами (IR8a, IR25a и IR76b); хемосенсорные вкусовые рецепторы (ГР), которые функционируют как комплекс из трех белков для обнаружения углекислого газа (CO2)1,2.
Флуоресцентная гибридизация РНК in situ является мощным инструментом для обнаружения экспрессии эндогенной мРНК3. Как правило, в этом методе используется меченый флуорофором одноцепочечный зонд нуклеиновой кислоты с последовательностью, комплементарной мРНК-мишени. Связывание флуоресцентного РНК-зонда с РНК-мишеней позволяет идентифицировать клетки, экспрессирующие интересующий нас транскрипт. Последние достижения в настоящее время позволяют обнаруживать транскрипты в целых тканях комаров 4,5. В первом поколении технологии гибридизационной цепной реакции (HCR) использовался HCR-амплификатор на основе РНК; Это было улучшено в методе второго поколения, в котором вместо этого использовалась сконструированная ДНК для HCR-амплификатора 6,7. Эта модернизация привела к 10-кратному увеличению сигнала, резкому снижению себестоимости производства и значительному улучшению стойкости реагентов 6,7.
В протоколе описывается использование метода флуоресценции РНК in situ третьего поколения HCR (HCR RNA WM-FISH), предназначенного для определения пространственной локализации и экспрессии любого гена 8,9. В этом двухэтапном методе сначала используются зонды нуклеиновых кислот, специфичные для интересующей мРНК, но которые также содержат последовательность узнавания инициаторов; на втором этапе используются меченые флуорофором шпильки, которые связываются с последовательностью инициатора для усиления флуоресцентного сигнала (рис. 1). Этот метод также позволяет мультиплексировать два или более РНК-зондов и усиливать сигналы зондов для облегчения обнаружения и количественного определения РНК8. Визуализация обилия транскриптов и паттернов локализации РНК хемосенсорных генов, экспрессируемых в обонятельных придатках, дает первое представление о функциях хемосенсорных генов и кодировании запахов.
протокол
1. Рассмотрение и подготовка материалов
- Решите, будет ли уместна целая монтировка или криосрез ткани. Этот протокол оптимизирован для визуализации РНК in situ в антенне комаров Anopheles и верхнечелюстных пальпах без криосекции. Если толщина образцов превышает 5 мм, рекомендуется криосекционирование для проникновения зонда.
- Определите интересующие гены и скопируйте последовательности, включая интроны и экзоны, из подходящей базы данных. Транскрибируйте последовательность гена в РНК для синтеза.
- Определите, следует ли приобретать зонды у коммерческих поставщиков или зонды будут синтезироваться в лаборатории.
ПРИМЕЧАНИЕ: В данном исследовании зонды in situ были приобретены у коммерческого поставщика (см. Таблицу материалов). В качестве альтернативы он может быть синтезирован, как сообщалось ранее10. Реактивы, использованные в исследовании, описаны в таблице 1. Материалы, необходимые для приготовления реагентов, перечислены в таблице материалов.
2. Префиксация тканей
- Обезболить 10-15 взрослых самок или самцов комаров Anopheles coluzzii (штамм N'Gousso) в возрасте 5-10 дней после появления всходов, собрав их с помощью ротового аспиратора в бумажный стаканчик или пластиковую трубку и поместив в ведро со льдом. Успешная холодовая анестезия может быть подтверждена, когда комары неподвижны.
- Обезглавьте их, удалив головы из области шеи с помощью щипцов. Используя недоминантную руку, захватите грудную клетку щипцами и отделите шею от тела щипцами, удерживаемыми доминирующей рукой. Поместите головки в пробирку объемом 1,5 мл, содержащую 500 мкл хитиназно-химотрипсин-диметилсульфоксидного буфера (ПЗС-буфер) на льду.
ПРИМЕЧАНИЕ: Замерзание животных может привести к деформации усиков; Рекомендуется быстрый нокдаун на льду. Возраст комара во время тестирования может варьироваться в зависимости от проекта. Важно подтвердить и скоординировать их физиологический статус, например, находятся ли они на кровном вскармливании, голодают или спариваются. В этом исследовании обонятельные придатки были взяты у комаров, которых кормили кровью и спаривали. - Предварительно нагрейте комариные головы в ПЗС-буфере при 37 ° C на тепловом блоке в течение 5 мин, а затем переместите пробирку с комариными головками в гибридизационную печь и вращайте при 37 ° C. Время инкубации в ПЗС-буфере зависит от типа ткани. Для самок усиков Anopheles используйте 20 минут, для самцов усиков требуется 15 минут, в то время как для верхнечелюстных щупалец требуется более длительное время инкубации (1 ч).
- Перелейте все содержимое тюбика в препарирующее часовое стекло. Осторожно вылейте пробу в углубление часового (вскрытие) стекла. Если головки комаров застряли внутри пробирки, с помощью пипетки добавьте в пробирку ПЗС-буфер и промойте головку.
- Используйте щипцы, чтобы осторожно перенести головки или любые усики/щупальца, отделившиеся во время инкубации, и зафиксировать в 1 мл префиксатора.
ПРИМЕЧАНИЕ: Оставшийся буфер CCD может быть сохранен при -20 ° C. Буфер может быть повторно использован до 3 раз. Если префиксатор приобретает слегка коричневатый оттенок из-за переноса ПЗС-буфера тканями, замените его еще 1 мл фиксатора. - Поверните головки в предварительном фиксаторе на 24 ч при 4°С с помощью нутатора.
ПРИМЕЧАНИЕ: Скорость качания нутатора, использованного в этом исследовании, не регулировалась; Использовалась скорость по умолчанию (12 об/мин), установленная производителем.
3. Рассечение тканей
- Промывайте головы 4 раза (5 минут на стирку) 1 мл 0,1% PBS-Tween на льду. Чтобы избежать потери образца, используйте пипетку, прикрепленную к загрузочному наконечнику для геля, для удаления жидкости.
ПРИМЕЧАНИЕ: Две быстрые стирки, за которыми следует 10-минутная стирка, и последняя быстрая стирка может быть выполнена вместо шага 3.1. - Переложите головки из тюбика в препарирующее часовое стекло. Аккуратно налейте пробу в углубление часового стекла. Промойте комариные головы, застрявшие внутри тюбика, 0,1% PBS-Tween.
- Под препарирующим микроскопом острыми щипцами удаляют интересующие ткани (усики/пальпы) с головы. Захватите щипцами заднюю часть головы и захватите антенну другими щипцами от основания. Очистите щипцы бумагой, смоченной растворителем, не содержащим РНКазы. Удалите пальпы с помощью того же процесса.
- Переложите усики и щупальца щипцами в пустые пробирки, свободные от ДНК/РНКазы, помещенные на лед. Разделите различные части ткани на предварительно помеченные разные пробирки.
- Обезвоживают ткани в 400 мкл растворителя, содержащего смесь метанола (MeOH 80%) и диметилсульфоксида (DMSO 20%) в течение 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Нет необходимости класть ткань на нутатор; Оставьте его на штативе для пробирок комнатной температуры на лабораторном столе. Рекомендуется использовать свежую растворительную смесь. Для получения исходного раствора объемом 500 мкл смешайте 400 мкл MeOH со 100 мкл ДМСО. - Замените дегидратирующий реагент 400 мкл абсолютного (100%) метанола и обезвоживайте ткани на ночь при -20 °C. Дайте тканям осесть под действием силы тяжести и используйте пипетку, чтобы удалить жидкость.
ПРИМЕЧАНИЕ: Образцы пригодны для длительного периода обезвоживания, до 4 ночей были протестированы без потери сигнала.
4. Постфиксация тканей
- Регидратируйте ткани в четырехступенчатой серии из 400 мкл MeOH/PBS-Tween в течение 10 минут на льду. Начните с 75% MeOH/25% PBS-Tween, затем 50% MeOH/ 50% PBS-Tween, затем 25% MeOH/ 75% PBS-Tween и, наконец, 100% PBS-Tween.
ПРИМЕЧАНИЕ: Наконечник для загрузки геля с крошечным отверстием можно использовать для удаления буфера из пробирки, чтобы избежать потери тканей. Удаление буфера может быть выполнено под препарирующим микроскопом. - Промыть 400 мкл фосфатно-солевого буфера, содержащего 0,1% Tween-20 (PBS-T), в течение 10 минут при комнатной температуре. Промыть, поместив пробу на нутатор.
- Приготовьте 20 мкг/мл раствора Протеиназы-К и инкубируйте в 400 мкл раствора Протеиназы-К в течение 30 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Разбавьте 20 мг/мл бутона Proteinase-K (1000x исходный раствор), т.е. 2 мкл в 2 мл 0,1% PBS-Tween. Остатки можно хранить в морозильной камере при температуре -20°C. - Остановить ферментативное расщепление тканей путем промывания 2 раза в течение 10 мин 400 мкл 0,1% PBS-твина.
- Добавьте 400 мкл постфиксатора и инкубируйте 20 мин при комнатной температуре. Стирка 3 раза, 15 мин на стирку, 400 мкл 0,1% PBS-Tween.
5. Зондовая гибридизация
- Инкубируют ткань в 400 мкл зондового гибридизационного буфера в течение 5 мин. Убедитесь, что ткань полностью погружена в буфер, осторожно пипетируя.
- Подготовьте к следующему этапу, нагревая аликвоту буфера зондовой гибридизации до 37 °С в течение 30 мин.
- Удалить буфер и предварительно гибридизировать с помощью 400 мкл предварительно нагретого зондового буфера для гибридизации в течение 30 мин при 37 ° C.
- Приготовьте зондовый раствор для целевых хемосенсорных рецепторов (IR8a, IR76b, IR25a, IR41t.1, IR75d, IR7t, IR64a или Orco), добавив 8 пМ зонда. Добавьте 8 мкл 1 мкМ пробного материала в 500 мкл предварительно нагретого зондового гибридизационного буфера.
- Снимите предварительно нагретый буфер для гибридизации зондов и замените его 400 мкл нагретого зондового раствора.
- Инкубируют ткань при температуре 37°С в течение двух ночей на нутаторе, помещенном внутрь инкубатора и накрытом под ящиком.
6. Зондовое усиление
- Нагрейте буфер для промывки зонда до 37 ° C. Удалите излишки раствора зонда, промыв ткань 5 раз, 10 мин на промывку, 400 мкл буфера для промывки зонда при 37 ° C, нутировав в инкубаторе.
ПРИМЕЧАНИЕ: Можно начинать подготовку к шагу 6.4. Смотрите примечание в шаге 6.4. - Промывают образцы 2 раза по 5 мин при комнатной температуре 400 мкл 5-кратного солевого цитрата натрия, содержащего 10% Tween-20 (SSCT). Разморозьте буфер усиления до комнатной температуры на столешнице.
- Подготовьте ткань к амплификации путем инкубации с 400 мкл амплификационного буфера в течение 10 мин при комнатной температуре. Из-за вязкости амплификационного буфера ткани могут быть погружены не полностью. Перемешайте, осторожно пипетируя буфер для амплификации под тканью и выталкивая буфер поверх ткани, пока они не будут погружены в воду.
- Отдельно приготовьте 18 пМ шпильки h1 и 18 пМ шпильки h2, нагревая 6 мкл заготовки 3 мкМ при 95 °C в течение 90 с и охладите до комнатной температуры в темном ящике в течение 30 мин. Убедитесь, что пробирки для ПЦР плотно закрыты, чтобы предотвратить испарение шпилек во время нагрева в амплификаторе.
ПРИМЕЧАНИЕ: Для экономии времени шаг 6.4 можно запустить на4-м шаге стирки на шаге 6.1. Шпильки следует отдельно нагревать, чтобы предотвратить перекрестную реакцию. На этом этапе шпильки не следует разбавлять каким-либо буфером. Шпильки можно приобрести у производителя зондов вместе с зондами. - Замените буфер усиления, добавленный на этапе 6.3, смесью, содержащей нагретые шпильки (из шага 6.4) вместе со 100 мкл буфера для усиления. Типичная реакция содержит 6 мкл h1, 6 мкл h2 и 100 мкл амплификационного буфера.
ПРИМЕЧАНИЕ: Шпильки h1 и h2 можно объединить после охлаждения до комнатной температуры, а затем добавить в 100 мкл буфера для усиления. Чтобы избежать переноса образцов тканей из одной пробирки в другую, амплификационный буфер на стадии 6.3 можно удалить и заменить смесью шпилек, разбавленной в амплификационном буфере. - Инкубируйте ткань в течение ночи и нутируйте в темноте при комнатной температуре, используя скорость нутатора по умолчанию.
7. Монтаж образца ткани
- Разбавляют амплификационный буфер в инкубируемой ткани 300 мкл 5x SSCT (хлорид натрия и цитрат натрия, разведенный в Tween-20).
ПРИМЕЧАНИЕ: Разбавление полезно для снижения вязкости и облегчает удаление амплификационного буфера из ткани. Мы использовали Triton-X 100 для префиксатора и Tween-20 для постфиксационного этапа из-за различий в их действии в качестве агентов для пермеабилизации клеточной мембраны. - Вымойте салфетку 5 раз 400 мкл 5x SSCT при комнатной температуре.
ПРИМЕЧАНИЕ: При необходимости храните салфетку временно при температуре 4 °C, пока она не будет готова к монтажу. Мы не превышаем 2 суток до визуализации. - Нанесите 5 капель монтажного раствора на предметное стекло. Отрежьте кончик наконечника пипетки объемом 200 мкл, чтобы сделать его шире, и перенесите ткань на новое предметное стекло.
- Возьмите образцы тканей за основание щипцами и осторожно погрузите и промойте в ряде капель раствора. Будьте осторожны, чтобы не повредить ткани на этом этапе.
- Закрепите монтажным раствором, поместите покровный лист и запечатайте лаком для ногтей. Изображение образцов тканей in situ с помощью конфокального микроскопа.
Результаты
Надежное обнаружение хемосенсорных генов в антенне Anopheles
Исследована чувствительность метода HCR FISH (рис. 1) для выявления экспрессии хемосенсорных рецепторов в обонятельных тканях комаров. Руководствуясь данными транскрипции РНК, о которых сообщалось ранее на антенне самки комара Anopheles, мы создали зонды для нацеливания на различные ИК-рецепторы. Средние значения транскрипции из четырех независимых исследований антеннального транскриптома показали, что Ir41t.1 (11 RPKM), Ir75d (12 RPKM) и Ir7t (13 RPKM) были менее распространены в антенне по сравнению с корецепторами Ir25a (197 RPKM) и Ir76b (193 RPKM)5,11,12,13,14. Мы сгенерировали зонды для Ir41t.1, Ir75d и Ir7t. IR64a (31 RPKM) также был выбран в качестве мишени, учитывая, что его уровень транскрипта примерно в 3 раза выше, чем самое низкое значение транскрипта среди интересующих генов-кандидатов. Здесь следует отметить, что значения RPKM из транскриптомных исследований представляют собой массовое измерение транскриптов со всей антенны. Таким образом, может случиться так, что только несколько нейронов высоко экспрессируют транскрипт гена IR, или может случиться так, что ген IR будет слабо экспрессирован во многих клетках. Таким образом, значения RPKM не обязательно могут соответствовать уровню обилия IR в нейроне. Кроме того, усиление сигнала, обеспечиваемое методом HCR, также может затруднить использование этого метода для точной оценки уровней нейронального транскрипта на основе флуоресцентных сигналов. В нашей недавней публикации эти понятия обсуждались более подробно5. Данные свидетельствуют о том, что HCR WM-FISH обладает высокой чувствительностью к обнаружению транскриптов мРНК из тканей антенн, как показано на рисунке 2.
Мультиплексное ко-мечение различных мишеней РНК в хемосенсорных придатках
Для изучения колокализации РНК-мишеней мы генерировали зонды, конъюгированные с разными флуорофорами. Двойная гибридизация in situ , нацеленная на транскрипты корецепторного гена рецептора Odorant (Orco) и наиболее широко экспрессируемого гена корецептора ионотропного рецептора (Ir25a), выявила колокализацию этих различных семейств хемосенсорных рецепторов в подмножестве клеточных популяций в антенне (рис. 3A) и верхнечелюстных пальпах (рис. 3B). Мы также исследовали колокализацию транскриптов трех генов ИК-корецептора (Ir8a, Ir25a и Ir76b). Паттерны колокализации позволяют предположить, что Ir76b-положительные клетки экспрессируют Ir25a, тогда как Ir8a-позитивные клетки частично локализуются с Ir76b и Ir25a (рис. 4). Анализ коэкспрессии ИК-корецепторов демонстрирует надежность использования HCR WM-FISH для мультиплексных исследований.
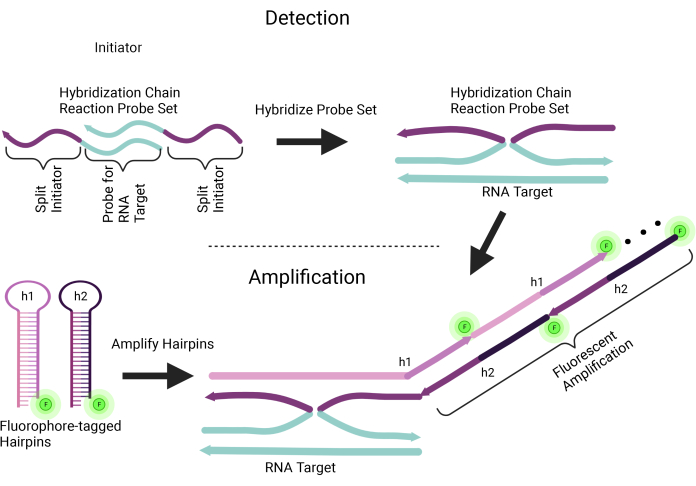
Рисунок 1: Схема цепной реакции гибридизации in situ . Этот метод работает в два этапа: детектирование и усиление. Набор зондов для цепной реакции гибридизации in situ состоит из расщепленного инициатора и последовательности нуклеиновой кислоты, специфичной для РНК-мишени. Для гибридизации нескольких участков в РНК-мишени может быть спроектировано несколько пар наборов зондов; Это определяет шаг обнаружения. Стадия амплификации требует, чтобы меченные флуорофором шпильки (h1 и h2) специфически связывались с инициатором, конъюгированным с набором зондов. После связывания сигнал РНК, меченный флуорофором, усиливается повторным связыванием меченых флуорофором шпилек. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Локализация РНК хемосенсорных генов ИК. HCR WM-FISH самок Anopheles coluzzii антенны для нацеливания ИК. РНК-зонды включают (A) IR41t.1, (B) IR75d, (C) IR7t и (D) IR64a. Вставки в белых пунктирных прямоугольниках представляют собой увеличенные изображения ткани. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Двойная in situ колокализация хемосенсорных генов в антенне и верхнечелюстных пальпах. Конфокальные изображения Z-стека клеток, экспрессирующих Ir25a (зеленый) и Orco (пурпурный) в антенне (A) и (B) верхнечелюстной щупальцах самок комаров Anopheles coluzzii . Вставки в белых пунктирных прямоугольниках представляют собой увеличенные изображения ткани. Шкала составляет 10 мкм. Рисунок 3B был изменен с15. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Картирование пространственной колокализации нескольких РНК-мишеней. Изображения in situ , показывающие картины колокализации трех ИК-корецепторов: IR25a (пурпурный), IR8a (зеленый) и IR76b (синий) в антенне комара. Белые стрелки указывают на клетки, экспрессирующие три ИК-корецептора (IR25a, IR8a и IR76b). Шкала 20 мкм. Эта цифра была изменена с5. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Реагенты для цепной реакции гибридизации in situ . Реагенты, необходимые для проведения гибридизационной цепной реакции, цельномонтированной флуоресцентной гибридизации in situ . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Третье поколение гибридизационной цепной реакции (ГЦР) отличается чувствительностью и надежностью для визуализации нескольких мишеней РНК8. HCR WM-FISH был успешно применен на эмбрионах дрозофилы, курицы, мыши и рыбки данио, а также на личинках нематод и рыбок данио-рерио 10,16,17. Усики комаров и верхнечелюстные щупики, как правило, склонны к высокой аутофлуоресценции и слабому проникновению зонда, что особенно сложно при проведении традиционных методов полного монтажа in situ. Эти недостатки были уменьшены за счет шага усиления сигнала, интегрированного в протокол HCR, который улучшает соотношение сигнал/фон и позволяет обнаруживать транскрипты мРНК обонятельного хеморецептора (рис. 2). Конструкция протокола HCR гарантирует, что инициирующие зонды привязаны к амплифицирующим полимерам, что позволяет визуализировать мишени РНК с низким сигналом. В мультиплексной установке различные ортогональные усилители HCR были привязаны к спектрально уникальным флуорофорам. Такой подход был критически важен для предотвращения спектрального просачивания из соседнего канала визуализации.
Чтобы оптимизировать метод HCR для использования с придатками комаров, мы провели несколько наблюдений. Усилители HCR светочувствительны и всегда должны храниться в коробке в морозильной камере с температурой -20 °C. По нашему опыту, экстенсивная инкубация тканей в ПЗС-буфере, протеиназе К или короткое время фиксации в параформальдегиде могут привести к поломке усиков или щупиков на этапах промывки. Усики и верхнечелюстные щупики также всегда следует захватывать за основание, чтобы избежать поломки. На раннем этапе адаптации этого протокола мы последовательно теряли ткани во время серии буферных обменов (шаги 5 и 6). Для минимизации таких потерь в начале эксперимента количество тканей увеличивали в два раза, проводили этапы промывки и буферные замены под микроскопом, а для удаления буферов из тканей использовали наконечники для загрузки геля шириной не более 0,5 мм.
HCR WM-FISH успешно работает с периферическими обонятельными придатками комаров-переносчиков Anopheles gambiae 5,15 и Aedes aegypti 4,18, и протокол может быть дополнительно оптимизирован и адаптирован к другим частям тканей насекомых или другим животным. Оригинальный протокол, разработанный производителем, не включает инкубацию в ПЗС-буфере. Этот этап был интегрирован в протокол для переваривания и пермеабилизации хитиновой кутикулы. Мы продлили время инкубации в наборах зондов на две ночи, чтобы дать больше времени для проникновения зонда, что является модификацией протокола производителя, который рекомендует 16-часовое время инкубации, что хорошо подходит для образцов-дженериков на предметном стекле. Оптимизация этого протокола для других частей тканей насекомых потребовала бы изменения времени инкубации в ПЗС-буфере; Периферические тканевые участки с толстой кутикулой, скорее всего, потребуют длительного инкубационного периода. Концентрация протеиназы К также должна быть экспериментально скорректирована при адаптации этого протокола к различным тканям или стадиям развития животных. При работе с тканями толщиной более 5 мм проникновение зонда становится сложной задачей. В такой ситуации необходимы дополнительные усилия для проведения криосекции тканей или дальнейшего изменения протокола, описанного в этом исследовании.
HCR WM-FISH ограничен одновременной визуализацией только нескольких генов-мишеней за раз, по сравнению с пространственной транскриптомикой, которая потенциально может позволить одновременную визуализацию тысяч генов19. Коммерческий синтез РНК-зондов обходится дорого; В качестве альтернативы можно было бы изготовить зонды и усилители в лаборатории, но это может быть сложной задачей для большинства групп, а также трудоемким и отнимающим много времени. Этот протокол также ограничен трудностями, возникающими при проникновении РНК-зонда через цельные толстые образцы, что может потребовать внесения изменений в протокол (например, подготовка ткани на этапе 2) или секционирования неповрежденной ткани. Если описанный здесь метод HCR WM-FISH не может обнаружить транскрипт РНК в обонятельном придатке, ген может экспрессироваться только в нескольких клетках и требовать обширного обследования ткани, возможно, не транскрибируется или может быть транскрибирован на уровне ниже предела обнаружения этого метода. Для подтверждения таких результатов может быть проведена количественная ОТ-ПЦР или секвенирование РНК.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Марго Херре (Margo Herre) и лабораторию Лесли Восшалла (Leslie Voshall) за то, что они поделились своим протоколом гибридизации in situ для обонятельных придатков Aedes aegypti . Эта работа была поддержана грантами Национальных институтов здравоохранения для C.J.P. (NIAID R01Al137078), стипендией HHMI Ханны Грей для J.I.R., премией Джонса Хопкинса для постдокторантуры J.I.R. и постдокторской стипендией Института исследования малярии Джонса Хопкинса для J.I.R. Мы благодарим Научно-исследовательский институт малярии Университета Джонса Хопкинса и Благотворительный фонд Блумберга за поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Amplification buffer | Molecular Instruments | Molecular Instruments, Inc. | In Situ Hybridization + Immunofluorescence | 50 mL |
| Calcium Chloride (CaCl2) 1M | Sigma-Aldrich | 21115-100ML | |
| Chitinase | Sigma-Aldrich | C6137-50UN | |
| Chymotrypsin | Sigma-Aldrich | CHY5S-10VL | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Eppendorf tube | VWR | 20901-551 | 1.5 mL |
| Forceps | Dumont | 11251 | Number 5 |
| Gel loading tip | Costar | 4853 | 1-200 µL tip |
| Hairpins | Molecular Instruments | Molecular Instruments, Inc. | In Situ Hybridization + Immunofluorescence | h1 and h2 initiator splits |
| HEPES (1M) | Sigma-Aldrich | H0887 | |
| IR25a probe | Molecular Instruments | Probe Set ID: PRK149 | AGAP010272 |
| IR41t.1 probe | Molecular Instruments | Probe Set ID: PRK978 | AGAP004432 |
| IR64a probe | Molecular Instruments | Probe Set ID: PRK700 | AGAP004923 |
| IR75d probe | Molecular Instruments | Probe Set ID: PRK976 | AGAP004969 |
| IR76b probe | Molecular Instruments | Probe Set ID: PRI998 | AGAP011968 |
| IR7t probe | Molecular Instruments | Probe Set ID: PRL355 | AGAP002763 |
| IR8a probe | Molecular Instruments | Probe Set ID: PRK150 | AGAP010411 |
| LoBind Tubes | VWR | 80077-236 | 0.5 mL DNA/RNA LoBind Tubes |
| Magnessium Chloride (MgCl2) 1M | Thermo Fisher | AM9530G | |
| Methanol | Fisher | A412-500 | |
| Nuclease-free water | Thermo Fisher | 43-879-36 | |
| Nutator | Denville Scientific | Model 135 | 3-D Mini rocker |
| Orco probe | Molecular Instruments | Probe set ID PRD954 | AGAP002560 |
| Paraformaldehyde (20% ) | Electron Microscopy Services | 15713-S | |
| Phosphate Buffered Saline (10X PBS) | Thermo Fisher | AM9625 | |
| Probe hybridization buffer | Molecular Instruments | https://www.molecularinstruments.com/ | 50 mL |
| Probe wash buffer | Molecular Instruments | Molecular Instruments, Inc. | In Situ Hybridization + Immunofluorescence | 100 mL |
| Proteinase-K | Thermo Fisher | AM2548 | |
| Saline-Sodium Citrate (SSC) 20x | Thermo Fisher | 15-557-044 | |
| SlowFade Diamond | Thermo Fisher | S36972 | mounting solution |
| Sodium Chloride (NaCl) 5M | Invitrogen | AM9760G | |
| Triton X-100 (10%) | Sigma-Aldrich | 93443 | |
| Tween-20 (10% ) | Teknova | T0027 | |
| Watch glass | Carolina | 742300 | 1 5/8" square; transparent |
Ссылки
- Konopka, J. K., et al. Olfaction in Anopheles mosquitoes. Chem Senses. 46, (2021).
- Raji, J. I., Potter, C. J. Chemosensory ionotropic receptors in human host-seeking mosquitoes. Curr Opin Insect Sci. 54, 100967 (2022).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806 (2020).
- Herre, M., et al. Non-canonical odor coding in the mosquito. Cell. 185 (17), 3104-3123.e28 (2022).
- Raji, J. I., Konopka, J. K., Potter, C. J. A spatial map of antennal-expressed ionotropic receptors in the malaria mosquito. Cell Rep. 42 (2), 112101 (2023).
- Choi, H. M. T., et al. Programmable in situ amplification for multiplexed imaging of mRNA expression. Nat Biotechnol. 28 (11), 1208-1212 (2010).
- Choi, H. M. T., Beck, V. A., Pierce, N. A. Next-generation in situ hybridization chain reaction: higher gain, lower cost, greater durability. ACS Nano. 8 (5), 4284-4294 (2014).
- Choi, H. M. T., et al. Third-generation in situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), dev165753 (2018).
- Schwarzkopf, M., et al. Hybridization chain reaction enables a unified approach to multiplexed, quantitative, high-resolution immunohistochemistry and in situ hybridization. Development. 148 (22), dev199847 (2021).
- Choi, H. M. T., et al. Mapping a multiplexed zoo of mRNA expression. Development. 143 (19), 3632-3637 (2016).
- Pitts, R. J., Derryberry, S. L., Zhang, Z., Zwiebel, L. J. Variant ionotropic receptors in the malaria vector mosquito Anopheles gambiae tuned to amines and carboxylic acids. Sci Rep. 7, 40297 (2017).
- Rinker, D. C., Zhou, X., Pitts, R. J., Rokas, A., Zwiebel, L. J. Antennal transcriptome profiles of anopheline mosquitoes reveal human host olfactory specialization in Anopheles gambiae. BMC Genomics. 14, 749 (2013).
- Maguire, S. E., Afify, A., Goff, L. A., Potter, C. J. Odorant-receptor-mediated regulation of chemosensory gene expression in the malaria mosquito Anopheles gambiae. Cell Rep. 38 (10), 110494 (2022).
- Athrey, G., et al. Chemosensory gene expression in olfactory organs of the anthropophilic Anopheles coluzzii and zoophilic Anopheles quadriannulatus. BMC Genomics. 18 (1), 751 (2017).
- Task, D., et al. Chemoreceptor co-expression in Drosophila melanogaster olfactory neurons. eLife. 11, e72599 (2022).
- Shah, S., et al. Single-molecule RNA detection at depth by hybridization chain reaction and tissue hydrogel embedding and clearing. Development. 143 (15), 2862-2867 (2016).
- Trivedi, V., Choi, H. M. T., Fraser, S. E., Pierce, N. A. Multidimensional quantitative analysis of mRNA expression within intact vertebrate embryos. Development. 145 (1), dev156869 (2018).
- Herre, M., Greppi, C. RNA in situ hybridization and immunohistochemistry to visualize gene expression in peripheral chemosensory tissues of mosquitoes. Cold Spring Harb Protoc. 2023 (1), 48-54 (2023).
- Marx, V. Method of the Year: spatially resolved transcriptomics. Nat Methods. 18 (1), 9-14 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены