Method Article
תגובת שרשרת הכלאה RNA פלואורסצנטיות מלאה באתרה הכלאה של גנים כימו-סנסוריים בתוספות ריח יתושים
In This Article
Summary
המאמר מתאר את השיטות והריאגנטים הדרושים לביצוע הכלאה של תגובת שרשרת RNA, הכלאה פלואורסצנטית באתרה (HCR RNA, WM-FISH) כדי לחשוף תובנות לגבי הרזולוציה המרחבית והתאית של גנים קולטנים כימו-סנסוריים באנטנת היתושים ובמישוש המקסילרי.
Abstract
יתושים הם וקטורים יעילים של מחלות קטלניות ויכולים לנווט בסביבתם הכימית באמצעות קולטנים כימו-סנסוריים המתבטאים בתוספות הריח שלהם. הבנת האופן שבו קולטנים כימו-סנסוריים מאורגנים מרחבית בתוספות הריח ההיקפיות יכולה להציע תובנות לגבי האופן שבו ריח מקודד במערכת חוש הריח של יתושים ולספק דרכים חדשות להילחם בהתפשטות מחלות המועברות על ידי יתושים. הופעתה של תגובת שרשרת הכלאה מהדור השלישי RNA פלואורסצנטי באתרו (HCR RNA, WM-FISH) מאפשרת מיפוי מרחבי ופרופיל ביטוי סימולטני של גנים כימו-סנסוריים מרובים. כאן, אנו מתארים גישה מדורגת לביצוע HCR RNA WM-FISH על אנטנת יתוש אנופלס ומישוש מקסילרי. חקרנו את הרגישות של טכניקה זו על ידי בחינת פרופיל הביטוי של קולטני ריח יונוטרופיים. שאלנו אם טכניקת HCR WM-FISH שתוארה מתאימה למחקרים מרובים על ידי קשירת גשושיות RNA לשלושה פלואורופורים מובחנים ספקטרלית. התוצאות סיפקו ראיות לכך ש- HCR RNA WM-FISH רגיש מאוד לזיהוי בו זמנית של גנים כימו-סנסוריים מרובים באנטנה ובתוספות הריח של מישוש הריח המקסילרי. חקירות נוספות מעידות על התאמתו של HCR WM-FISH לפרופיל ביטוי משותף של מטרות RNA כפולות ומשולשות. טכניקה זו, כאשר מיושמת עם שינויים, יכולה להיות ניתנת להתאמה כדי למקם גנים בעלי עניין ברקמות הריח של מיני חרקים אחרים או בנספחים אחרים.
Introduction
וקטורים של יתושים כגון אנופלס גמביה מסתמכים על רפרטואר עשיר של גנים כימו-סנסוריים המתבטאים בתוספות הריח ההיקפיות שלהם כדי לשגשג בעולם כימי מורכב ולזהות ריחות רלוונטיים התנהגותית הנובעים מפונדקאים אנושיים, לאתר מקורות צוף ולאתר אתרי אוביפוזיציה1. אנטנת היתוש והמישוש המקסילרי מועשרים בגנים כימו-סנסוריים המניעים זיהוי ריחות בתוספות חוש הריח הללו. שלוש קבוצות עיקריות של תעלות יונים מגודרות ליגנד מניעות זיהוי ריחות בתוספות הריח של יתושים: קולטני הריח (ORs), הפועלים עם קולטן אובלנטי אובלנטי (Orco); קולטנים יונוטרופיים (IRs), אשר אינטראקציה עם קולטן IR אחד או יותר (IR8a, IR25a ו- IR76b); קולטני המשב הכימו-סנסורי (GRs), המתפקדים כקומפלקס של שלושה חלבונים לזיהוי פחמן דו-חמצני (CO2)1,2.
RNA fluorescence in situ hybridization הוא כלי רב עוצמה לזיהוי ביטוי של mRNA אנדוגני3. באופן כללי, שיטה זו משתמשת בבדיקת חומצת גרעין חד-גדילית עם תיוג פלואורופור עם רצף משלים ל-mRNA מטרה. קשירה של גשושית הרנ"א הפלואורסצנטי לרנ"א המטרה מאפשרת זיהוי תאים המביעים תעתיק עניין. ההתקדמות האחרונה מאפשרת כעת זיהוי תמלילים ברקמות יתוש שלמות 4,5. הדור הראשון של טכנולוגיית תגובת שרשרת הכלאה (HCR) השתמש במגבר HCR מבוסס RNA; זה השתפר בשיטת הדור השני שבמקום זאת השתמשה בדנ"א מהונדס עבור מגבר HCR 6,7. שדרוג זה הביא לעלייה של פי 10 בסיגנל, ירידה דרמטית בעלות הייצור ושיפור משמעותי בעמידות של ריאגנטים 6,7.
בפרוטוקול אנו מתארים את השימוש בשיטת הדור השלישי של HCR להכלאה מלאה של RNA באתרו (HCR RNA WM-FISH) המיועדת לאיתור לוקליזציה מרחבית וביטוי של כל גן 8,9. שיטה דו-שלבית זו משתמשת תחילה בבדיקות חומצות גרעין ספציפיות ל-mRNA המעניין, אך מכילות גם רצף זיהוי יוזם; השלב השני משתמש בסיכות ראש עם תיוג פלואורופור שנקשרות לרצף היוזם כדי להגביר את האות הפלואורסצנטי (איור 1). שיטה זו מאפשרת גם ריבוב של שתי בדיקות RNA או יותר והגברת אותות בדיקה כדי להקל על זיהוי וכימות RNA8. הדמיה של שפע התעתיק ודפוסי לוקליזציה של RNA של גנים כימו-סנסוריים המתבטאים בתוספות הריח מציעה את הקו הראשון של תובנה לגבי תפקודי גנים כימו-סנסוריים וקידוד ריח.
Protocol
1. שיקולים והכנת חומרים
- החלט אם הרכבה שלמה או הקפאה של רקמה תהיה מתאימה. פרוטוקול זה ממוטב להדמיית RNA באתרו בהרכבה מלאה באנטנת יתוש אנופלס ומישוש מקסילרי ללא חתך קריו. אם הדגימות עבות יותר מ-5 מ"מ, מומלץ לבצע חתך קריו-חתך כדי לאפשר חדירה לבדיקה.
- לזהות את הגנים המעניינים ולהעתיק את הרצפים כולל אינטרונים ואקסונים ממסד נתונים מתאים. תעתוק רצף הגן לרנ"א לסינתזה.
- קבע אם לרכוש בדיקות מספקים מסחריים או אם בדיקות יסונתזו במעבדה.
הערה: במחקר זה, הגשושיות באתרן נרכשו מספק מסחרי (ראה טבלת חומרים). לחלופין, ניתן לסנתז אותו כפי שדווח בעבר10. ריאגנטים ששימשו במחקר מתוארים בטבלה 1. החומרים הדרושים להכנת הריאגנטים מפורטים בטבלת החומרים.
2. קיבוע מראש רקמות
- מרדימים 10-15 יתושי אנופלס קולוצי בוגרים (זן N'Gousso), בגילאי 5-10 ימים לאחר הופעתם, על ידי איסופם עם שואב פה לתוך נייר או צינור פלסטיק והנחתם בדלי המכיל קרח. ניתן לאשר הרדמה מוצלחת הנגרמת על ידי הצטננות כאשר היתושים אינם ניידים.
- ערפו את ראשיהם על ידי הסרת הראשים מאזור הצוואר בעזרת זוג מלקחיים. בעזרת היד הלא דומיננטית תופסים את בית החזה במלקחיים ומפרידים את הצוואר מהגוף בעזרת מלקחיים המוחזקים על ידי היד הדומיננטית. הניחו את הראשים בצינור של 1.5 מ"ל המכיל 500 מיקרוליטר של חיץ צ'יטינאז-כימוטריפסין דימתיל סולפוקסיד (חיץ CCD) על קרח.
הערה: הקפאת בעלי חיים יכולה לעוות את האנטנות; מומלץ להפיל במהירות על הקרח. גילו של היתוש במהלך הבדיקה עשוי להשתנות בהתאם לפרויקט. חשוב לאשר ולתאם את מצבם הפיזיולוגי, כגון האם הם ניזונים מדם, מורעבים או מזדווגים. במחקר זה נדגמו נספחי ריח מיתושים שניזונו מדם והזדווגו. - לפני חימום ראשי יתושים בחיץ CCD ב 37 ° C על בלוק חום במשך 5 דקות ולאחר מכן להעביר את הצינור המכיל את ראשי היתושים לתנור הכלאה ולסובב ב 37 ° C. זמן הדגירה במאגר CCD תלוי בסוג הרקמה. עבור אנטנות אנופלס נקביות, השתמש 20 דקות, אנטנות זכריות דורשות 15 דקות, בעוד זמן דגירה ארוך יותר (1 שעות) נדרש עבור palps מקסילרי.
- העבירו את כל תכולת הצינור לזכוכית שעון מנתח. מזגו בעדינות דגימה לתוך שקע זכוכית השעון (דיסקציה). אם ראשי יתושים תקועים בתוך הצינור, השתמשו בפיפטה כדי להוסיף חיץ CCD לתוך הצינור ולשטוף את הראש.
- השתמש במלקחיים כדי להעביר בזהירות את הראשים או כל אנטנה / palps מנותק במהלך הדגירה ולתקן 1 מ"ל של pre-fixative.
הערה: ניתן לשמר מאגר CCD שאריות ב -20 ° C. ניתן לעשות שימוש חוזר במאגר עד פי 3. אם pre-fixative הופך מעט חום בגלל חיץ CCD לשאת על ידי הרקמות, להחליף אותו עם עוד 1 מ"ל של קיבוע. - סובבו את הראשים בקיבוע מראש במשך 24 שעות ב-4°C באמצעות נוטטור.
הערה: מהירות הנדנוד של הנוטטור ששימש במחקר זה לא הייתה ניתנת לכוונון; נעשה שימוש במהירות ברירת המחדל שנקבעה (12 סל"ד) על-ידי היצרן.
3. דיסקציה של רקמות
- יש לשטוף את הראשים 4 פעמים (5 דקות בכל שטיפה) עם 1 מ"ל של 0.1% PBS-Tween על קרח. כדי למנוע אובדן דגימה, השתמש פיפטה מחובר קצה העמסת ג'ל כדי להסיר את הנוזל.
הערה: ניתן לבצע שתי שטיפות מהירות ולאחריהן שטיפה באורך 10 דקות, ושטיפה מהירה סופית במקום שלב 3.1. - מעבירים את הראשים שבצינור לזכוכית שעון מנתח. מזגו בעדינות דגימה לתוך שקע של שעון. שטפו ראשי יתושים שתקועים בתוך הצינור עם 0.1% PBS-Tween.
- תחת מיקרוסקופ מנתח, הסר רקמות מעניינות (אנטנות/פאלפס) מהראש בעזרת מלקחיים חדים. החזק את החלק האחורי של הראש עם מלקחיים ותפוס אנטנה עם מלקחיים נוספת מהבסיס. נקו מלקחיים עם נייר טבול בממס נטול RNAse. הסר את palps באמצעות אותו תהליך.
- העבירו את האנטנות ואת המשטחים בעזרת מלקחיים לצינורות ריקים נטולי DNA/RNase המונחים על קרח. הפרידו את חלקי הרקמה השונים לצינורות שונים שסומנו מראש.
- יש לייבש רקמה ב-400 מיקרוליטר של ממס המכיל תערובת של מתנול (MeOH 80%) ודימתיל סולפוקסיד (DMSO 20%) למשך שעה אחת בטמפרטורת החדר.
הערה: אין צורך להניח רקמה על nutator; הניחו לו לשבת על מדף צינורות בטמפרטורת החדר על ספסל המעבדה. מומלץ להשתמש בתערובת ממס טרי. לקבלת תמיסת מלאי של 500 μL, ערבבו 400 μL של MeOH עם 100 μL של DMSO. - החלף את מגיב התייבשות עם 400 μL של מתנול מוחלט (100%) ולייבש רקמות לילה ב -20 ° C. לאפשר לרקמות להתיישב על ידי כוח הכבידה ולהשתמש פיפטה כדי להסיר את הנוזל.
הערה: דגימות הן קיימא לתקופה ממושכת של התייבשות, עד 4 לילות נבדקו ללא אובדן אות.
4. רקמה לאחר קיבוע
- החזירו לחות לרקמות בסדרה בת ארבעה שלבים של MeOH/PBS-Tween מדורג של 400 μL למשך 10 דקות על קרח. התחל עם 75% MeOH/25% PBS-Tween ואחריו 50% MeOH / 50% PBS-Tween, לאחר מכן 25% MeOH / 75% PBS-Tween ולבסוף 100% PBS-Tween.
הערה: ניתן להשתמש בקצה העמסת ג'ל עם פתח זעיר כדי להסיר את החיץ מהצינור כדי למנוע אובדן הרקמות. הסרת חיץ יכולה להיעשות תחת מיקרוסקופ ניתוח. - יש לשטוף עם 400 μL של מלח חוצץ פוספט המכיל 0.1% Tween-20 (PBS-T) במשך 10 דקות בטמפרטורת החדר. לשטוף על ידי הנחת המדגם על nutator.
- הכינו תמיסת פרוטאינאז-K של 20 מיקרוגרם/מ"ל ודגרו על תמיסת פרוטאינאז-K של 400 מיקרוליטר למשך 30 דקות בטמפרטורת החדר.
הערה: לדלל 20 מ"ג / מ"ל מלאי Proteinase-K (1000x תמיסת מלאי) כלומר, 2 μL ב 2 מ"ל של 0.1% PBS-Tween. את השאריות ניתן לאחסן במקפיא -20 מעלות צלזיוס. - עצור עיכול אנזימטי של רקמות על ידי שטיפה 2x במשך 10 דקות עם 400 μL של 0.1% PBS-tween.
- מוסיפים 400 μL של הפוסט-קיבוע ודגרים במשך 20 דקות בטמפרטורת החדר. יש לכבס 3 פעמים, 15 דקות בכל כביסה, עם 400 מיקרוליטר של 0.1% PBS-Tween.
5. הכלאה של בדיקה
- לדגור על רקמה ב 400 μL של חיץ הכלאת בדיקה במשך 5 דקות. ודא שהרקמה שקועה לחלוטין במאגר על ידי פיפטוף עדין.
- היכונו לשלב הבא על ידי חימום aliquot של חיץ הכלאה בדיקה ל 37 ° C במשך 30 דקות.
- הסר את החיץ וקדם הכלאה עם 400 μL של חיץ הכלאה בדיקה מחומם מראש למשך 30 דקות ב 37 ° C.
- צור פתרון בדיקה עבור קולטני המטרה הכימו-סנסוריים (IR8a, IR76b, IR25a, IR41t.1, IR75d, IR7t, IR64a או Orco) על ידי הוספת 8 pM של בדיקה. הוסף 8 μL של מלאי בדיקה 1 μM למאגר הכלאה של בדיקה מחומם מראש של 500 μL.
- הסר את חיץ הכלאת הגשושית שחומם מראש והחלף אותו בתמיסת בדיקה מחוממת של 400 מיקרוליטר.
- רקמת הדגירה ב 37 מעלות צלזיוס במשך שני לילות על nutator ממוקם בתוך אינקובטור מכוסה תחת קופסה.
6. הגברה של בדיקה
- חממו את מאגר שטיפת הבדיקה ל -37 מעלות צלזיוס. הסר תמיסת בדיקה עודפת על ידי שטיפת הרקמה 5x, 10 דקות לכל כביסה, עם 400 μL של חיץ שטיפת בדיקה ב 37 מעלות צלזיוס, אגוז באינקובטור.
הערה: ההכנה לשלב 6.4 עשויה להתחיל. ראה את ההערה בשלב 6.4. - יש לשטוף דוגמיות 2x, 5 דקות בכל כביסה, עם 400 μL של 5x מלוחים-נתרן ציטראט המכילים 10% Tween-20 (SSCT) בטמפרטורת החדר. הפשירו את חיץ ההגברה לטמפרטורת החדר על גבי ספסל.
- מכינים את הרקמה להגברה על ידי דגירה עם 400 מיקרוליטר של חיץ הגברה למשך 10 דקות בטמפרטורת החדר. בשל צמיגות חיץ ההגברה, רקמות לא יכול להיות שקוע לחלוטין. מערבבים על ידי פיטום עדין של חיץ ההגברה מתחת לרקמה והוצאת החיץ על גבי הרקמה עד שהם שקועים.
- הכינו בנפרד 18 pM של סיכת ראש h1 ו-18pM של סיכת ראש h2 על ידי חימום 6 μL של 3 μM ב-95°C למשך 90 שניות וצננו לטמפרטורת החדר במגירה חשוכה למשך 30 דקות. ודא שצינורות ה-PCR מכוסים היטב כדי למנוע אידוי של סיכות השיער בזמן חימום במחזור תרמי.
הערה: כדי לחסוך זמן, ניתן להתחיל את שלב 6.4 בשלבהכביסה הרביעי בשלב 6.1. יש לחמם את סיכות השיער בנפרד כדי למנוע תגובה צולבת. אין לדלל סיכות שיער עם כל חיץ בשלב זה. את סיכות הראש ניתן לרכוש מיצרן הגשושית יחד עם הגשושיות. - החלף את מאגר ההגברה שנוסף בשלב 6.3 בתערובת המכילה את סיכות השיער המחוממות (משלב 6.4) יחד עם 100 μL של חיץ הגברה. תגובה טיפוסית תכיל 6 μL של h1, 6 μL של h2, ו-100 μL של חיץ הגברה.
הערה: ניתן לשלב את סיכות השיער h1 ו-h2 לאחר קירור לטמפרטורת החדר ולאחר מכן להוסיף אותן ל-100 μL של חיץ הגברה. כדי להימנע מהעברת דגימות הרקמה מצינור אחד למשנהו, ניתן להסיר את חיץ ההגברה בשלב 6.3 ולהחליפו בתערובת סיכות השיער המדוללות במאגר הגברה. - יש לדגור על רקמה למשך הלילה ולאגוז בחושך בטמפרטורת החדר באמצעות מהירות ברירת המחדל של המזין.
7. דגימת רקמה הרכבה
- חיץ הגברה מדולל ברקמה המודגרת עם 300 μL של 5x SSCT (נתרן כלורי-נתרן ציטראט מדולל ב- Tween-20).
הערה: הדילול עוזר להפחית את הצמיגות ומקל על הסרת חיץ ההגברה מהרקמה. השתמשנו ב-Triton-X 100 עבור השלב שלפני הקיבוע וב-Tween-20 עבור השלב שלאחר הקיבוע בגלל ההבדלים בפעולות שלהם כסוכנים לחדירת קרום התא. - יש לשטוף רקמות 5x עם 400 μL של 5x SSCT בטמפרטורת החדר.
הערה: יש לאחסן את הרקמה באופן זמני בטמפרטורה של 4°C עד להרכבה מוכנה להרכבה, במידת הצורך. לא חרגנו מיומיים לפני ההדמיה. - הכינו 5 טיפות של תמיסת הרכבה על מגלשת זכוכית. חתכו את קצה קצה פיפטה בנפח 200 מיקרוליטר כדי להרחיב אותו והעבירו את הרקמה למגלשת זכוכית חדשה.
- תפוס את דגימות הרקמה בבסיסן במלקחיים וטבול ושטוף בעדינות בסדרה של טיפות תמיסת הרכבה. היזהר לא לשבור את הרקמות בשלב זה.
- הרכבה עם תמיסת הרכבה, יש להניח את הכיסוי ולאטום עם לק. תמונה באתרו דגימות רקמה באמצעות מיקרוסקופ קונפוקלי.
תוצאות
זיהוי חזק של גנים כימו-סנסוריים באנטנת אנופלס
חקרנו את הרגישות של שיטת HCR FISH (איור 1) כדי לזהות את הביטוי של קולטנים כימו-חושיים ברקמות ריח של יתושים. בהנחיית נתוני תעתיק RNA שדווחו מוקדם יותר על אנטנת יתוש אנופלס הנקבית, יצרנו גשושיות כדי להתמקד במגוון של IRs. ערכי התעתיק הממוצעים מארבעה מחקרי תעתיק אנטנה עצמאיים גילו כי Ir41t.1 (11 RPKM), Ir75d (12 RPKM) ו- Ir7t (13 RPKM) היו פחות נפוצים באנטנה בהשוואה לקולטני המשנה Ir25a (197 RPKM) ו- Ir76b (193 RPKM)5,11,12,13,14. יצרנו גשושיות כדי להתמקד ב-Ir41t.1, Ir75d ו-Ir7t. IR64a (31 RPKM) הותקף גם הוא, בהתחשב בכך שרמת התעתיק שלו שופעת בערך פי 3 מערך התעתיק הנמוך ביותר מבין הגנים המועמדים המעניינים. יש לציין כאן כי ערכי RPKM ממחקרי תמלול מייצגים מדידה בתפזורת של תמלילים מהאנטנה כולה. לכן, ייתכן שרק תאי עצב מעטים מבטאים תעתיק של גן IR, או שגן IR מתבטא באופן נמוך בתאים רבים. לכן, ערכי RPKM עשויים שלא בהכרח להתאים לרמת השפע של IR בתוך תא עצב. בנוסף, הגברת האות הניתנת על ידי שיטת HCR עשויה גם להקשות על שימוש בשיטה זו כדי לאמוד במדויק את רמות התעתיק העצבי בהתבסס על אותות פלואורסצנטיים. הפרסום האחרון שלנו דן במושגים אלה בפירוט רב יותר5. הנתונים מצביעים על כך ש-HCR WM-FISH רגיש מאוד לזיהוי תעתיקי mRNA מרקמות אנטנה, כפי שמוצג באיור 2.
תיוג משותף מרובה של מטרות RNA שונות בתוספות כימו-סנסוריות
כדי לבחון את הקו-לוקליזציה של מטרות רנ"א, יצרנו גשושיות מצומדות לפלואורופורים שונים. הכלאה כפולה באתרה המכוונת לתעתיקים של הגן קו-קולטן לקולטן אודורנט (Orco) וגן הקולטן המשותף לקולטן היונוטרופי בעל הביטוי הרחב ביותר (Ir25a) חשפה קו-לוקליזציה של משפחות קולטנים כימו-סנסוריים מובחנות אלה בתת-קבוצה של אוכלוסיות תאים באנטנה (איור 3A) ובמישוש מקסילרי (איור 3B). חקרנו גם את הקולוקליזציה של תעתיקים של שלושה גנים קולטני IR (Ir8a, Ir25a ו-Ir76b). דפוסי לוקליזציה מצביעים על כך שתאים חיוביים ל-Ir76b מבטאים Ir25a, בעוד שתאים חיוביים ל-Ir8a מבטאים לוקליזציה חלקית עם Ir76b ו-Ir25a (איור 4). ניתוח הביטוי המשותף של קולטני IR מדגים את החוסן של השימוש ב- HCR WM-FISH למחקרים מרובים.
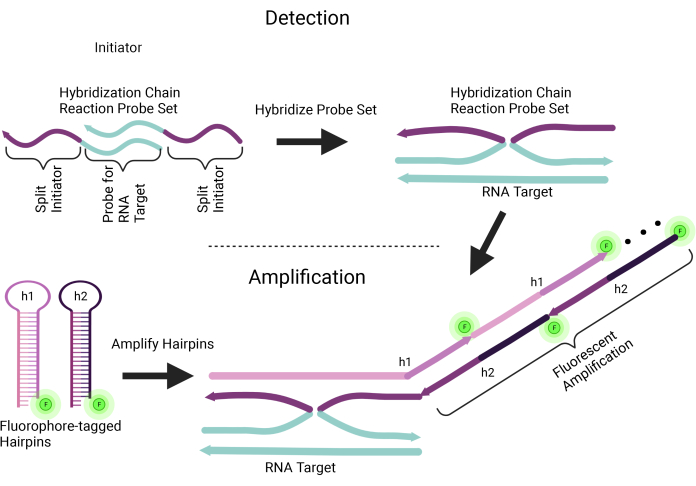
איור 1: סכמטי של תגובת שרשרת הכלאה באתר . שיטה זו פועלת בשני שלבים: זיהוי והגברה. בדיקה שנקבעה לתגובת שרשרת הכלאה באתרה כוללת יוזם מפוצל ורצף חומצות גרעין ספציפי למטרת הרנ"א. ניתן לתכנן זוגות מרובים של קבוצות גשושיות כדי ליצור הכלאה של מספר אזורים ביעד הרנ"א; פעולה זו מגדירה את שלב הזיהוי. שלב ההגברה דורש סיכות ראש עם תיוג פלואורופור (h1 ו-h2) כדי להיקשר במיוחד ליוזם המצומד לסט בדיקה. בעת הקשירה, אות הרנ"א המסומן על ידי הפלואורופור מוגבר על ידי קשירה חוזרת ונשנית של סיכות שיער עם תיוג פלואורופור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: לוקליזציה של RNA של גנים כימו-סנסוריים IR. HCR WM-FISH של אנטנות Anopheles coluzzii נקבות כדי לתקוף IRs. בדיקות RNA כוללות (A) IR41t.1, (B) IR75d, (C) IR7t ו-(D) IR64a. הכניסות בתיבות מקווקו לבנות הן תמונות מוגדלות מהרקמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: לוקליזציה כפולה באתרה של גנים כימו-סנסוריים באנטנה ובמישוש המקסילרי. תמונות קונפוקליות של ערימת Z של תאים המבטאים Ir25a (ירוק) ואורקו (מגנטה) באנטנה (A) ו-(B) מישוש מקסילרי של נקבות יתושי Anopheles coluzzii . הכניסות בתיבות מקווקו לבנות הן תמונות מוגדלות מהרקמה. קנה המידה הוא 10 מיקרומטר. איור 3B שונהמ-15. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: מיפוי הקולוקליזציה המרחבית של מטרות רנ"א מרובות. תמונות באתרן המציגות דפוסי לוקליזציה של שלושה קולטני IR, IR25a (מגנטה), IR8a (ירוק) ו-IR76b (כחול) באנטנת היתושים. חיצים לבנים מצביעים על תאים המבטאים את שלושת קולטני ה-IR (IR25a, IR8a ו-IR76b). קנה המידה הוא 20 מיקרומטר. נתון זה שונהמ-5. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: ריאגנטים לתגובת שרשרת הכלאה באתר. ריאגנטים נדרשו לביצוע תגובת שרשרת הכלאה של כל ההרכבה פלואורסצנטית באתרה . אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
הדור השלישי של תגובת שרשרת הכלאה (HCR) יוצא דופן ברגישותו ובחוסנו כדי לדמיין מספר מטרות RNA8. HCR WM-FISH שימש בהצלחה על עוברים של דרוזופילה, תרנגולות, עכברים ודגי זברה, כמו גם על זחלים של נמטודות ודגי זברה 10,16,17. אנטנות יתושים ומישושים מקסילריים נוטים בדרך כלל לחדירה אוטופלואורסצנטית גבוהה וחדירה חלשה של גשושיות, שהן מאתגרות במיוחד בעת ביצוע שיטות מסורתיות של הרכבה שלמה באתרן. החסרונות האלה הצטמצמו על-ידי שלב הגברת האות המשולב בפרוטוקול HCR, אשר משפר את יחס האות לרקע ומאפשר זיהוי של תעתיקי mRNA של קולטני ריח (איור 2). תכנון פרוטוקול HCR מבטיח שהגשושיות היוצרות קשורות לפולימרי ההגברה, מה שמאפשר הדמיה של מטרות RNA עם אות נמוך. במערך המרובב, מגברי HCR אורתוגונליים שונים נקשרו לפלואורופורים ייחודיים ספקטרלית. גישה זו הייתה קריטית כדי למנוע דימום ספקטרלי מערוץ הדמיה שכן.
כדי לייעל את שיטת HCR לשימוש עם נספחי יתושים, ערכנו מספר תצפיות. מגברי HCR רגישים לאור ויש לאחסן אותם תמיד בקופסה במקפיא -20 מעלות צלזיוס. מניסיוננו, דגירה נרחבת של רקמות במאגר CCD, פרוטאינאז K, או זמן קיבוע קצר בפרפורמלדהיד עלולה לגרום לשבירה של אנטנות או פאלפים במהלך שלבי השטיפה. אנטנות ו palps מקסילרי צריך גם תמיד להיות תפס על ידי הבסיס כדי למנוע שבירה. בשלב המוקדם של התאמת פרוטוקול זה, איבדנו רקמות באופן עקבי במהלך סדרת חילופי החיץ (שלבים 5 ו-6). כדי למזער הפסדים כאלה, הוכפל מספר הרקמות בתחילת הניסוי, שלבי שטיפה וחילופי חיץ בוצעו מתחת למיקרוסקופ, וקצות העמסת ג'ל לא יותר מ -0.5 מ"מ שימשו להסרת המאגרים מהרקמות.
HCR WM-FISH הצליח בתוספות ריח היקפיות של וקטורי יתושים Anopheles gambiae 5,15 ו-Aedes aegypti 4,18, והפרוטוקול יכול להיות מותאם עוד יותר לחלקי רקמת חרקים אחרים או לבעלי חיים שונים. הפרוטוקול המקורי שתוכנן על ידי היצרן אינו משלב דגירה במאגר CCD. שלב זה שולב בפרוטוקול כדי לעכל ולחדור את הקוטיקולה chitinous. הארכנו את זמן הדגירה בערכות הבדיקה לשני לילות כדי לתת יותר זמן לחדירת הגשושית, שינוי של פרוטוקול היצרן שממליץ על זמן דגירה של 16 שעות שעובד טוב עבור דגימות גנריות בשקופית. אופטימיזציה של פרוטוקול זה עבור חלקי רקמת חרקים אחרים תדרוש שינוי זמן הדגירה במאגר CCD; חלקי רקמה היקפיים עם ציפורניים עבות ידרשו ככל הנראה זמן דגירה ממושך. ריכוז הפרוטאינאז K חייב גם להיות מותאם באופן ניסיוני תוך התאמת פרוטוקול זה לרקמות שונות או לשלבי התפתחות שונים של בעלי חיים. כאשר עובדים עם רקמות בעובי של יותר מ -5 מ"מ, חדירת הגשושית הופכת לאתגר. במצב כזה, נדרשים מאמצים נוספים כדי לבצע הקפאה של רקמות או לשנות עוד יותר את הפרוטוקול המתואר במחקר זה.
HCR WM-FISH מוגבל להדמיה בו זמנית של מטרות גנים מעטות בלבד בכל פעם, בהשוואה לשעתוק מרחבי, אשר עשוי לאפשר הדמיה סימולטנית של אלפי גנים19. סינתזה מסחרית של בדיקות RNA היא יקרה; האלטרנטיבה תהיה לייצר את הגשושיות והמגברים במעבדה, אבל זה יכול להיות מאתגר עבור רוב הקבוצות והוא דורש עבודה רבה וגוזל זמן. פרוטוקול זה מוגבל גם על ידי קשיים בהם נתקלת חדירת בדיקת RNA באמצעות דגימות עבות שלמות, אשר עשויות לדרוש החלפות לפרוטוקול (למשל, שלב 2 הכנת רקמות) או חתך של הרקמה השלמה. אם שיטת HCR WM-FISH המתוארת כאן אינה מצליחה לזהות תעתיק RNA בתוספתן חוש הריח, הגן עשוי להתבטא רק בתאים ספורים ולדרוש סקר מקיף של הרקמה, ייתכן שאינו משועתק, או עשוי להיות משועתק ברמה מתחת לגבול הזיהוי של שיטה זו. ניתן לבצע RT-PCR כמותי או RNA seq כדי לאמת ממצאים כאלה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים למרגו הררה ולמעבדת לסלי וושל על שיתוף פרוטוקול ההכלאה באתרם עבור נספחי ריח Aedes aegypti . עבודה זו נתמכה על ידי מענקים מהמכונים הלאומיים לבריאות ל- C.J.P. (NIAID R01Al137078), מלגת HHMI חנה גריי ל- J.I.R, פרס מאיץ פוסט-דוקטורט של ג'ונס הופקינס ל- J.I.R, ומלגת פוסט-דוקטורט של מכון ג'ונס הופקינס לחקר המלריה ל- J.I.R. אנו מודים למכון לחקר המלריה בג'ונס הופקינס ולקרן בלומברג על תמיכתם.
Materials
| Name | Company | Catalog Number | Comments |
| Amplification buffer | Molecular Instruments | Molecular Instruments, Inc. | In Situ Hybridization + Immunofluorescence | 50 mL |
| Calcium Chloride (CaCl2) 1M | Sigma-Aldrich | 21115-100ML | |
| Chitinase | Sigma-Aldrich | C6137-50UN | |
| Chymotrypsin | Sigma-Aldrich | CHY5S-10VL | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Eppendorf tube | VWR | 20901-551 | 1.5 mL |
| Forceps | Dumont | 11251 | Number 5 |
| Gel loading tip | Costar | 4853 | 1-200 µL tip |
| Hairpins | Molecular Instruments | Molecular Instruments, Inc. | In Situ Hybridization + Immunofluorescence | h1 and h2 initiator splits |
| HEPES (1M) | Sigma-Aldrich | H0887 | |
| IR25a probe | Molecular Instruments | Probe Set ID: PRK149 | AGAP010272 |
| IR41t.1 probe | Molecular Instruments | Probe Set ID: PRK978 | AGAP004432 |
| IR64a probe | Molecular Instruments | Probe Set ID: PRK700 | AGAP004923 |
| IR75d probe | Molecular Instruments | Probe Set ID: PRK976 | AGAP004969 |
| IR76b probe | Molecular Instruments | Probe Set ID: PRI998 | AGAP011968 |
| IR7t probe | Molecular Instruments | Probe Set ID: PRL355 | AGAP002763 |
| IR8a probe | Molecular Instruments | Probe Set ID: PRK150 | AGAP010411 |
| LoBind Tubes | VWR | 80077-236 | 0.5 mL DNA/RNA LoBind Tubes |
| Magnessium Chloride (MgCl2) 1M | Thermo Fisher | AM9530G | |
| Methanol | Fisher | A412-500 | |
| Nuclease-free water | Thermo Fisher | 43-879-36 | |
| Nutator | Denville Scientific | Model 135 | 3-D Mini rocker |
| Orco probe | Molecular Instruments | Probe set ID PRD954 | AGAP002560 |
| Paraformaldehyde (20% ) | Electron Microscopy Services | 15713-S | |
| Phosphate Buffered Saline (10X PBS) | Thermo Fisher | AM9625 | |
| Probe hybridization buffer | Molecular Instruments | https://www.molecularinstruments.com/ | 50 mL |
| Probe wash buffer | Molecular Instruments | Molecular Instruments, Inc. | In Situ Hybridization + Immunofluorescence | 100 mL |
| Proteinase-K | Thermo Fisher | AM2548 | |
| Saline-Sodium Citrate (SSC) 20x | Thermo Fisher | 15-557-044 | |
| SlowFade Diamond | Thermo Fisher | S36972 | mounting solution |
| Sodium Chloride (NaCl) 5M | Invitrogen | AM9760G | |
| Triton X-100 (10%) | Sigma-Aldrich | 93443 | |
| Tween-20 (10% ) | Teknova | T0027 | |
| Watch glass | Carolina | 742300 | 1 5/8" square; transparent |
References
- Konopka, J. K., et al. Olfaction in Anopheles mosquitoes. Chem Senses. 46, (2021).
- Raji, J. I., Potter, C. J. Chemosensory ionotropic receptors in human host-seeking mosquitoes. Curr Opin Insect Sci. 54, 100967 (2022).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806 (2020).
- Herre, M., et al. Non-canonical odor coding in the mosquito. Cell. 185 (17), 3104-3123.e28 (2022).
- Raji, J. I., Konopka, J. K., Potter, C. J. A spatial map of antennal-expressed ionotropic receptors in the malaria mosquito. Cell Rep. 42 (2), 112101 (2023).
- Choi, H. M. T., et al. Programmable in situ amplification for multiplexed imaging of mRNA expression. Nat Biotechnol. 28 (11), 1208-1212 (2010).
- Choi, H. M. T., Beck, V. A., Pierce, N. A. Next-generation in situ hybridization chain reaction: higher gain, lower cost, greater durability. ACS Nano. 8 (5), 4284-4294 (2014).
- Choi, H. M. T., et al. Third-generation in situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), dev165753 (2018).
- Schwarzkopf, M., et al. Hybridization chain reaction enables a unified approach to multiplexed, quantitative, high-resolution immunohistochemistry and in situ hybridization. Development. 148 (22), dev199847 (2021).
- Choi, H. M. T., et al. Mapping a multiplexed zoo of mRNA expression. Development. 143 (19), 3632-3637 (2016).
- Pitts, R. J., Derryberry, S. L., Zhang, Z., Zwiebel, L. J. Variant ionotropic receptors in the malaria vector mosquito Anopheles gambiae tuned to amines and carboxylic acids. Sci Rep. 7, 40297 (2017).
- Rinker, D. C., Zhou, X., Pitts, R. J., Rokas, A., Zwiebel, L. J. Antennal transcriptome profiles of anopheline mosquitoes reveal human host olfactory specialization in Anopheles gambiae. BMC Genomics. 14, 749 (2013).
- Maguire, S. E., Afify, A., Goff, L. A., Potter, C. J. Odorant-receptor-mediated regulation of chemosensory gene expression in the malaria mosquito Anopheles gambiae. Cell Rep. 38 (10), 110494 (2022).
- Athrey, G., et al. Chemosensory gene expression in olfactory organs of the anthropophilic Anopheles coluzzii and zoophilic Anopheles quadriannulatus. BMC Genomics. 18 (1), 751 (2017).
- Task, D., et al. Chemoreceptor co-expression in Drosophila melanogaster olfactory neurons. eLife. 11, e72599 (2022).
- Shah, S., et al. Single-molecule RNA detection at depth by hybridization chain reaction and tissue hydrogel embedding and clearing. Development. 143 (15), 2862-2867 (2016).
- Trivedi, V., Choi, H. M. T., Fraser, S. E., Pierce, N. A. Multidimensional quantitative analysis of mRNA expression within intact vertebrate embryos. Development. 145 (1), dev156869 (2018).
- Herre, M., Greppi, C. RNA in situ hybridization and immunohistochemistry to visualize gene expression in peripheral chemosensory tissues of mosquitoes. Cold Spring Harb Protoc. 2023 (1), 48-54 (2023).
- Marx, V. Method of the Year: spatially resolved transcriptomics. Nat Methods. 18 (1), 9-14 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved