Method Article
Куркуминоид-опосредованная антимикробная фотодинамическая терапия на мышиной модели кандидоза полости рта
В этой статье
Резюме
Этот протокол описывает применение антимикробной фотодинамической терапии (ФДТ) на мышиной модели кандидоза полости рта. ФДТ проводили с использованием водорастворимой смеси куркуминоидов и синего светодиодного света.
Аннотация
Антимикробная фотодинамическая терапия (ФДТ) была широко исследована in vitro, а доклинические модели инфекций на животных подходят для оценки альтернативных методов лечения до клинических испытаний. В этом исследовании описывается эффективность аФДТ на мышиной модели кандидоза полости рта. Сорок мышей были иммуносупрессивно введены с помощью подкожных инъекций преднизолона, а их языки были инокулированы с помощью мазка из ротовой полости, предварительно смоченного в клеточной суспензии C. albicans . В ходе эксперимента тетрациклин вводили с питьевой водой. Через пять дней после инокуляции грибка мыши были случайным образом распределены на восемь групп; Девятая группа необработанных неинфицированных мышей была включена в качестве отрицательного контроля (n = 5). Три концентрации (20 мкМ, 40 мкМ и 80 мкМ) смеси куркуминоидов были протестированы с синим светодиодным светом (89,2 мВт/см2; ~455 нм) и без света (группы C+L+ и C+L- соответственно). В качестве контрольной группы оценивали только свет (C-L+), отсутствие лечения (C-L-) и животных без инфекции. Данные анализировали с помощью тестов Уэлча ANOVA и Геймса-Хауэлла (α = 0,05). Кандидоз полости рта был установлен у всех инфицированных животных и визуализировался макроскопически по наличию характерных белых пятен или псевдомембран на тыльной стороне языка. Гистопатологические срезы подтвердили большое присутствие дрожжей и филаментов, ограниченных ороговевшим слоем эпителия в группе C-L-, а присутствие грибковых клеток было визуально снижено на изображениях, полученных от мышей, подвергшихся ФДТ куркуминоидами 40 мкМ или 80 мкМ. ФДТ, опосредованная 80 мкМ куркуминоидами, способствовала снижению количества колоний на 2,47 log10 по сравнению с таковыми в группе C-L- (p = 0,008). Во всех остальных группах не было выявлено статистически значимого снижения количества колоний, включая группы фотосенсибилизаторов (C+L-) или только света (C-L+). Куркуминоид-опосредованная аФДТ снижала грибковую нагрузку от языков мышей.
Введение
Кандидоз полости рта (ОК) – основная грибковая инфекция ротовой полости; это вызвано чрезмерным ростом Candida spp. Предрасполагающие факторы к ОК включают эндокринную дисфункцию, применение антибиотиков широкого спектра действия, радио- и химиотерапию, дефицит питательных веществ, ксеростомию (низкий поток слюны), ношение зубных протезов, плохую гигиену и, особенно, иммуносупрессию1. Среди видов Candida Candida albicans является наиболее распространенным и вирулентным; Он обнаруживается в организме человека как комменсальный вид и как условно-патогенный микроорганизм. C. albicans обладает способностью изменять свою морфологию от комменсальных дрожжей (бластопоров) до патогенных филаментов (гиф и псевдогиф)2. Нитевидные формы, особенно гифы, могут проникать в эпителий хозяина путем эндоцитоза или активного проникновения, вызывая инфекцию3. Другие факторы вирулентности C. albicans включают адгезию, образование биопленки и секрецию липолитических и гидролитических ферментов и токсинов, таких как липазы, фосфолипазы, протеиназы и кандидализин4.
Лечение ОК включает использование противогрибковых средств, особенно топических полиенов и азолов (нистатин и миконазол)5. Тем не менее, они показывают только краткосрочную эффективность, и часто рецидивируют. Кроме того, чрезмерное использование противогрибковых препаратов породило проблему развития и распространения устойчивости к противогрибковымпрепаратам6. Поэтому необходимы альтернативные методы лечения, такие как антимикробная фотодинамическая терапия (ФДТ), которая сочетает в себе фотосенсибилизатор (ФС) и свет с соответствующей длиной волны (такой же, как и у поглощения ФС) в присутствии кислорода. ФС связываются с клетками или поглощаются ими и при активации светом продуцируют активные формы кислорода (АФК), которые токсичны для сенсибилизированных клеток7.
В ФДТ одним из фотосенсибилизаторов (ФС) является куркумин (CUR), природное соединение, извлеченное из корневищ растения куркумы (Curcuma longa L.). Куркумин обладает многочисленными терапевтическими свойствами, включая противовоспалительные, антиоксидантные, противораковые и противомикробные свойства 8,9. Предыдущее исследование показало, что ФДТ с использованием CUR эффективно уменьшает C. albicans в мышиной модели кандидоза полости рта, не причиняя никакого вреда тканям хозяина10. CUR является основным куркуминоидом, извлекаемым из куркумы, но в этом растении также содержатся другие полифенолы, такие как деметоксикуркумин и бис-деметоксикуркумин. Куркуминоид-опосредованная аФДТ продемонстрировала антибактериальную активность в отношении биопленок золотистого стафилококка, выращенных в катетерах11. Однако, насколько нам известно, его противогрибковая активность в отношении C. albicans остается неясной. Таким образом, в этом исследовании мы оценили аФДТ, опосредованную куркуминоидной солью, против C. albicans в мышиной модели ОК.
протокол
Протокол исследования по использованию мышей был одобрен Комитетом по этике использования животных (номера дел 05/2008 и 09/2020) в Школе стоматологии, Араракура, UNESP. В качестве референтного штамма использовали C. albicans (ATCC 90028). Для настоящего исследования были использованы шестинедельные самки швейцарских мышей (n = 45) с массой тела 20-30 г. Животные были предоставлены Государственным университетом Сан-Паулу, UNESP, Ботукату.
1. Подготовка ПС и выбор источника света для ФДТ
- Подготовьте ПС в соответствии с техническими характеристиками тестируемого вещества.
ПРИМЕЧАНИЕ: В этом исследовании в качестве ФС использовалась водорастворимая смесь куркуминоидов (водорастворимая солевая смесь12 на основе CUR) (см. таблицу материалов и рисунок 1). Разведения на 20 мкМ, 40 мкМ и 80 мкМ (15,6, 29,2 и 58,4 мг/л соответственно) готовили в сверхчистой воде непосредственно перед использованием и выдерживали при температуре 5 °C. - Выберите световое оборудование с соответствующей длиной волны (такой же, как у поглощения ФС), способное равномерно и одновременно освещать всю фотосенсибилизируемую мишень без нагрева ткани.
ПРИМЕЧАНИЕ: В данном исследовании использовался наконечник, содержащий светодиод (светодиод, см. таблицу материалов), который был разработан в Институте физики Сан-Карлоса (Университет Сан-Паулу, Сан-Карлос, Испания, Бразилия). Выходная мощность света составляла 89,2 мВт/см2 при длине волны синего цвета около 455 нм.
2. Приготовление инокулята C. albicans
- Референсный штамм C. albicans (ATCC 90028) хранить в дрожжах-пептон-глюкозе (YEPD, см. таблицу материалов) с 50% глицерином при -80 °C до использования.
- Замороженный штамм разморозить при комнатной температуре, распределить 100 мкл аликвоты на чашке Петри с декстрозным агаром Сабуро (SDA) с хлорамфениколом (см. таблицу материалов) и инкубировать при 37 °C в течение 48 ч.
- Перенесите пять колоний в 10 мл дрожжевого азотного бульона со средой 2% глюкозы (YNBg) и выращивайте аэробно при 37 °C в течение 16 ч.
- Разбавляют дрожжевую культуру в свежем YNBg (1:10) и проводят аэробную инкубацию при 37 °C до тех пор, пока оптическая плотность не достигнет средней логарифмической фазы роста.
ПРИМЕЧАНИЕ: Предварительно стандартизируйте кривую роста микроорганизмов для каждой лаборатории. В текущем исследовании культурам давали инкубироваться в течение примерно 8 ч, пока они не достигали средней логарифмической фазы роста, на что указывает оптическая плотность на длине волны 540 нм (OD540), со средним значением 0,536 ± 0,062 условных единиц (среднее ± стандартное отклонение [SD]). - Центрифугируют культуру при 5 000 х г при комнатной температуре в течение 5 мин, выбрасывают надосадочную жидкость и дважды промывают гранулы тем же объемом стерильного фосфатно-солевого буфера (PBS; 0,136 М NaCl, 2 мМ KCl, 1 мМ KH2PO4, 10 мМ Na2HPO4, рН 7,4).
- Используйте аликвоты объемом 100 мкл для выполнения четырех последовательных 10-кратных разведений в PBS, распределите разведения по планшетам SDA и инкубируйте при 37 °C в течение 48 ч для подсчета колоний. Как правило, грибковые суспензии используются в концентрациях примерно 4,5 × 107 колониеобразующих единиц на миллилитр (КОЕ/мл).
3. Индукция ОК у мышей
ПРИМЕЧАНИЕ: Следующая методика была ранее описана Takakura et al.13 и воспроизведена нашей группой10,14 с некоторыми изменениями.
- Случайным образом распределите мышей по девяти группам (n = 5), что соответствует одинаковому количеству обработок (Дополнительный файл 1).
ПРИМЕЧАНИЕ: Ротовая полость мышей должна быть отрицательной на рост Candida . Это необходимо проверить, взяв мазок из ротовой полости и нанеся образец на SDA. - Содержать животных в пропиленовых ящиках по10 штук (макс. 5 мышей в коробке), с древесной стружкой для напольного покрытия, в виварии с регулируемой температурой при температуре 23 ± 2 °C при цикле 12/12 ч свет/темнота. Никакого специального обогащения не требуется.
- Содержать мышей на экструдированной мышиной диете и фильтрованной воде ad libitum.
- Подкожно вводят иммуносупрессивный препарат преднизолон (100 мг/кг массы тела, см. таблицу материалов) в первый раз в первый день всем членам групп C+L+ 20, C+L+ 40, C+L+ 80, C+L- 20 мкМ, C+L- 40, C+L- 80, C-L+ и C-L- (Дополнительный файл 1).
ПРИМЕЧАНИЕ: Держите мышей из одной группы в одной коробке и ежедневно наблюдайте за ними на предмет любых признаков стресса и потери веса. Обратитесь к ветеринарному врачу за обезболивающим или измененным кормом/водой, если вы заметили стресс или потерю веса. - Начиная с первого дня и до конца эксперимента, добавляйте тетрациклина гидрохлорид в питьевую воду в концентрации 0,83 мг/мл13.
- Инокулировать языки мышей на второй день, включая группы C+L+ 20, C+L+ 40, C+L+ 80, C+L- 20, C+L- 40, C+L- 80, C-L+ и C-L- (Дополнительный файл 1), инокулюмом C. albicans . Не прививайте мышей из отрицательной контрольной группы (NCtrl).
- Усыпляйте животных внутримышечным введением 10 мг/кг хлорпромазина хлорида (см. таблицу материалов) на каждую мышцу бедра перед проведением посева.
- Проводят внутриротовую инокуляцию мышей путем замачивания стерильного тампона (по одному на животное) в свежеприготовленную (т.е. приготовленную непосредственно перед инокуляцией) стандартизированную суспензию C. albicans.
- Поместите мышей под седативные препараты в положение лежа на спине. Осторожно вытащите язык изо рта с помощью стерильных щипцов. Протирайте язык каждой мышки смоченным тампоном в течение 30 с. Наблюдайте за мышами до тех пор, пока они не оправятся от седации.
- На пятый день вводят дополнительную подкожную инъекцию преднизолона (100 мг/кг массы тела) для поддержания иммуносупрессии.
ПРИМЕЧАНИЕ: Этот протокол достаточен для сохранения инфекции в течение 7 дней после внутриротовой инокуляции. Временная шкала протокола показана на рисунке 2.
4. Антимикробная фотодинамическая терапия и восстановление C. albicans из поражений полости рта
- На седьмой день, перед началом лечения, обезболивают животных с помощью внутрибрюшинной инъекции кетамина гидрохлорида (100 мг/кг массы тела) в сочетании с ксилазином (10 мг/кг массы тела) (см. таблицу материалов).
- Поместите каждое животное в положение лежа на спине на подушечку 14,15, оснащенную проволокой из нержавеющей стали, которую можно обмотать вокруг резцов, чтобы рот оставался открытым.
ПРИМЕЧАНИЕ: Изотермические прокладки рекомендуются для согревания мышей во время их седативных препаратов, предотвращения гипотермии при комнатной температуре и предотвращения смертности, связанной с анестезией15. Каждое животное, находящееся под наркозом, должно находиться под наблюдением по отсутствию рефлекса отмены при защемлении пальцев ног для подтверждения глубины анестезии. При необходимости можно ввести одну поддерживающую дозу кетамина в размере 1/3 первоначальной дозы (без ксилазина). - Отведя нижнюю челюсть и щеки, осторожно поместите язык за пределы рта.
- Для мышей из группы С+L+ пипетку 70 мкл ФС на спинку языка (в одной из тестируемых концентраций). Держите мышей в темном помещении в течение 20 минут в качестве периода предварительного облучения. Следите за тем, чтобы в течение этого времени язык каждого животного оставался в ротовой полости, чтобы предотвратить проглатывание фотосенсибилизатора (ФС).
- После периода фотосенсибилизации вытащите язык изо рта для освещения. Поместите светодиодное устройство на спинку язычка и зажгите при 37,5 Дж/см2 (7 мин с данным устройством) (Рисунок 3).
- Животным из группы С+L- пипетку 70 мкл ПС в одной из испытуемых концентраций на спинку языка и держать этих мышей в темноте в течение 27 мин.
- Для животных из группы C-L+ (обработанных светом без предварительной фотосенсибилизации) пипетку 70 мкл стерильного физиологического раствора на спинку языка. Держите мышей в темноте в течение 20 минут, а затем освещайте их языки при давлении 37,5 Дж/см2 (7 минут с данным устройством).
- Для мышей из группы С-L (не обработанных ФС и светом) пипетку 70 мкл стерильного физиологического раствора на спинку языка и держать в темноте в течение 27 мин.
- Извлечение C. albicans из языков всех мышей сразу после лечения. Промокните спинку языка в течение 1 мин стерильным ватным тампоном.
- Поместите каждый образец тампона в пробирку, содержащую 1 мл стерильного физиологического раствора, и встряхните его на 1 минуту, чтобы ресуспендировать микробные клетки.
- Немедленно выполняйте 10-кратное последовательное разведение в PBS и 25 мкл аликвот на планшетах SDA в двух экземплярах. Инкубируйте планшеты аэробно при 37 °C в течение 48 ч.
- Через 48 ч используйте цифровой счетчик колоний (см. Таблицу материалов) для определения количества дрожжевых колоний. Рассчитайте нагрузку C. albicans (КОЕ/мл) для каждого животного.
- Преобразуйте значения КОЕ/мл в log10 и выполните надлежащий анализ в соответствии с планом эксперимента и предположениями о данных.
ПРИМЕЧАНИЕ: В настоящем исследовании использовались односторонний ANOVA Уэлча и post-hoc критерий Геймса-Хауэлла (α = 0,05)16 .
5. Гистопатологические анализы
- На восьмой день обезболивают мышей кетамином в дозе 100 мг/кг в сочетании с ксилазином в дозе 10 мг/кг путем внутрибрюшинной инъекции и усыпляют их при передозировке кетамина (200 мг/кг, вводимого внутрибрюшниально). Подтвердите смерть, проверив отсутствие дыхательных движений (апноэ) и сердцебиения (асистолия).
- Осторожно зажмите язык и вытащите его изо рта животного. С помощью ручного скальпеля сделайте разрез перед циркумваллярными сосочками, чтобы хирургическим путем удалить весь язык, не причиняя никаких травм передней и центральной областям.
- Зафиксируйте язык в 10% буферном формалине (рН 7,2-7,4) на 24 ч и промойте в проточной воде в течение 2 ч.
- Приступают к включению в процесс парафина: обезвоживанию, осветлению и пропитке10,14.
- Вырежьте серийные срезы (толщиной 5 мкм) с помощью микротома, затем прикрепите их к предметным стеклам. Приступают к окрашиванию этих срезов с помощью периодической кислоты-Шиффа и гематоксилина (PAS-H) для гистопатологического исследования и выявления грибов путем наблюдения под световым микроскопом.
- Попросите патологоанатома, желательно слепого к изучаемым группам, изучить реакцию тканей на инфекцию C. albicans .
- Описывают гистологические характеристики ткани (эпителия и соединительной ткани), особенности местных воспалительных реакций различной интенсивности.
Результаты
Мышиная модель ОК показала типичные белые пятна и псевдомембраны на языке всех инфицированных мышей (рис. 4А). У C. albicans, полученных от C-L- животных, подтверждена колонизация тканей этим микроорганизмом (значения варьировали от 1,62 x 104 до 4,80 x 10,5 КОЕ/мл). Как и ожидалось, у животных из группы NCtr не было выявлено каких-либо изменений в тканях или роста колоний после отбора проб (рис. 4B).
ФДТ снижала жизнеспособность C. albicans при использовании куркуминоидов при дозе 80 мкМ для фотосенсибилизации (рис. 5). Среднее логарифмическоеснижение 10 , достигнутое при использовании 80 мкМ PS-опосредованной ФДТ, составило 2,47 по сравнению с таковым в группе C-L- (p = 0,008).
Количество колоний C. albicans , извлеченных из языков мышей, существенно не отличалось у мышей, получавших куркуминоиды без освещения (группы C+L), мышей, получавших свет, но ранее не подвергавшихся фотосенсибилизации (группы C-L+), и мышей, не получавших лечения (группа C-L-), и мышей, не получавших лечения (группа C-L) (p ≥ 0,210).
Гистологические особенности языков неинфицированных животных (NCtr) показали нормальные/здоровые ткани, включая интактную собственную пластинку, базальную мембрану и нитевидные сосочки (рис. 6А). Напротив, при изучении гистопатологических изображений языков мышей из группы C-L- было очевидно, что дрожжи и нити присутствовали в ороговевшем слое эпителия, хотя инфильтрация грибов отсутствовала. В нижележащей соединительной ткани наблюдалась легкая воспалительная реакция, в основном опосредованная мононуклеарными клетками, при этом нитевидные сосочки заметно отсутствовали (рис. 6Б). Гистологический анализ языков мышей в группах C+L- и C-L+ показал сходные характеристики. Напротив, на срезах языка мышей, получавших 80 мкМ куркуминоид-опосредованную ФДТ, было выявлено сниженное количество грибковых клеток, в основном ограниченных ороговевшим слоем эпителия (рис. 6C).
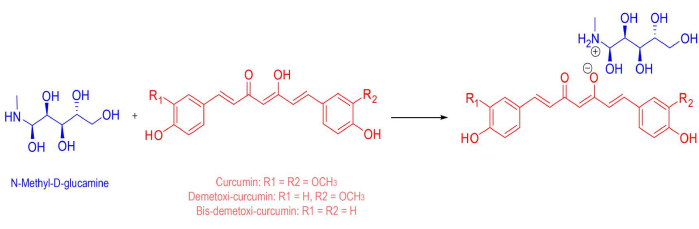
Рисунок 1: Химическая структура фотосенсибилизатора. Химический состав водорастворимой солевой смеси, используемой в качестве фотосенсибилизатора, содержит 53,4% природного куркумина и 46,6% других куркуминоидов (деметоксикуркумин и бис-деметоксикуркумин). Окончательная средняя молекулярная масса составляет 730,32 г/моль. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
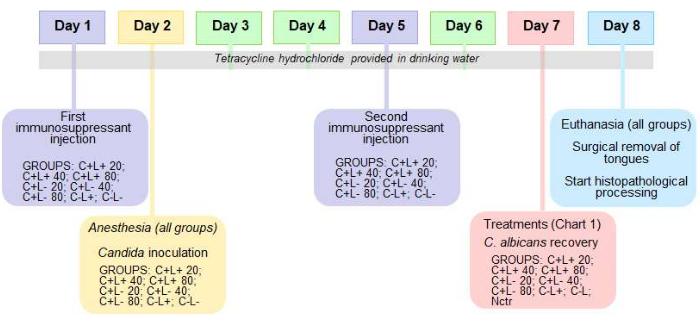
Рисунок 2: Хронология протокола для мышиной модели орального кандидоза и ФДТ. График с описанием протокола для мышиной модели перорального кандидоза и антимикробной фотодинамической терапии (ФДТ). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
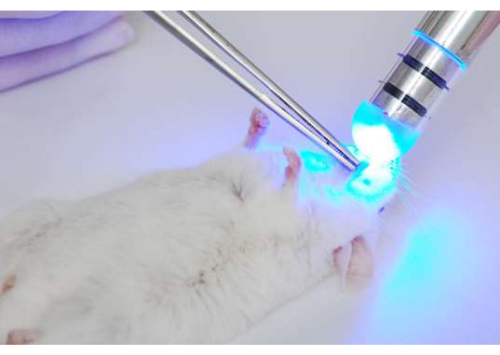
Рисунок 3: Освещение языков мышей после фотосенсибилизации. После фотосенсибилизации (инкубации инфицированной ткани с фотосенсибилизатором) языки освещали при 37,5 Дж/см2 с помощью синего (~455 нм) светодиодного света. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Белые поражения в мышиной модели кандидоза полости рта. (A) Репрезентативные изображения, изображающие белые поражения, наблюдаемые в мышиной модели кандидоза полости рта. (Б) Отрицательный (неинфицированный) контроль. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
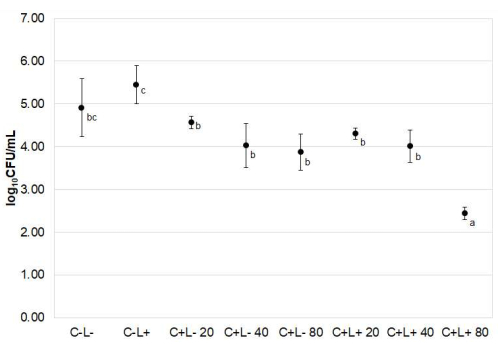
Рисунок 5: Candida albicans , извлеченный из языков мышей. Данные представляют собой средние значения ± стандартное отклонение log10 (КОЕ/мл) от групп лечения. Однофакторный ANOVA Уэлча показал, что эффекты лечения статистически значимо различались между группами (p < 0,001). Различные строчные буквы (a, b, c) рядом со средними значениями указывают на статистически значимые различия по критерию Геймса-Хауэлла (p≤ 0,030). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
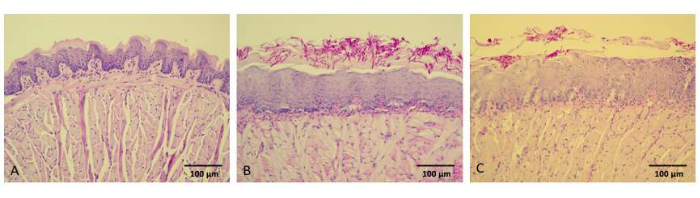
Рисунок 6: Репрезентативные изображения гистологических срезов мышиных языков. Гистологические срезы мышиных языков были окрашены PAS-H, и изображения были получены в 200-кратном размере. (A) Мыши с отрицательным контролем без индуцированного кандидоза полости рта, фотосенсибилизации и освещения (группа NCtr). (B) Мыши с индуцированным кандидозом полости рта, не фотосенсибилизированные и не подвергшиеся воздействию светодиодного освещения (C-L-группа). (C) Животные с индуцированным кандидозом полости рта, подвергшиеся воздействию куркуминоидов 80 мкМ и светодиодному освещению 37,5 Дж/см2 (группа C+L+80). Масштабные линейки = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Экспериментальные группы. Список экспериментальных групп, использованных в настоящем исследовании. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
C. albicans ассоциировался с инфекциями полости рта и пищевода у лиц с ослабленным иммунитетом, сахарным диабетом, длительным приемом антибиотиков и плохой гигиеной полости рта 1,3. Изучение инфекционных заболеваний человека требует исследований как in vitro, так и in vivo, прежде чем можно будет безопасно и точно спланировать клинические испытания. В настоящем исследовании описан метод создания мышиной модели ОК, который может быть использован для оценки патогенеза инфекций полости рта C. albicans и эффективности противогрибковых подходов 15,16,17,18,19.
Мышиная модель ОК, использованная здесь, была успешно установлена, о чем свидетельствует значительное восстановление грибковой нагрузки после поражений, а также характерные особенности инфекции, наблюдаемые при макроскопическом и гистопатологическом анализах языков инфицированных мышей. Во многих исследованиях использовались аналогичные мышиные модели ОК. В таких моделях самки мышей иммуносупрессивно прививаются C. albicans, что приводит к поражениям на языке 10,13,14,15,20,21. Иммуносупрессия преднизолоном, глюкокортикоидом, ингибирует активность нейтрофилов в отношении C. albicans22. В этом исследовании самкам мышей была проведена иммуносупрессия с помощью двух подкожных инъекций преднизолона, за один день до и через три дня после заражения C. albicans13. Кроме того, введение тетрациклина в питьевую воду в ходе эксперимента вызывало дисбактериоз полости рта, нарушая бактерии полости рта и помогая C. albicans процветать23,24. Кроме того, седативный эффект, вызванный внутримышечной инъекцией хлорпромазина хлорида, не позволял животным пить воду и есть сразу после инокуляции. Таким образом, грибковые клетки дольше оставались в контакте с тыльной стороной языка, что способствовало развитию зародышевых трубок и переходу от дрожжей к филаментам (гифам и псевдогифам), которые являются патогенной морфологией C. albicans, способной проникать в эпителий человека. Teichert et al.25 использовали протокол иммунодефицита для индуцирования ОК у мышей и выделили только 2 x 102 КОЕ/мл C. albicans.
Несмотря на то, что Totti et al.26 использовали мышей, подвергшихся сиалоаденэктомии, и провели четыре отдельные инокуляции суспензией C. albicans, примечательно, что в их случае инфекция не была устойчивой у большинства животных в ходе эксперимента. В отличие от этого, в настоящем исследовании инокуляция грибковыми клетками проводилась только один раз, и в результате из полости рта было извлечено10,4 КОЕ/мл C. albicans. В этом исследовании использовалась мышиная модель кандидоза, описанная Takakura et al.13, которые проводили пероральную инокуляцию клиническим штаммом, выделенным от пациента с кожным кандидозом (10,6 КОЕ/мл). Через три-семь дней после инокуляции из ротовой полости мышей было извлечено 105-10 6 КОЕ/мл C. albicans 13. Различия между методом Takakura et al.13 и этим исследованием заключаются в использовании различных концентраций грибов в посевном материале (в этом исследовании использовалось 10,7 КОЕ/мл C. albicans) и различных штаммов C. albicans для перорального инокуляции (здесь использовался референтный штамм ATCC 90028). Carmello et al.20 использовали аналогичный протокол, который включал использование животных с ослабленным иммунитетом. Тем не менее, они ввели животным две дополнительные подкожные инъекции преднизолона на 1, 5, 9 и 13 дни эксперимента. Их исследование выявило положительную корреляцию между баллами, присвоенными поражениям ротовой полости инфицированных животных, и количеством КОЕ/мл в течение периода от 5 до 16 дней после заражения. В предыдущих исследованиях было установлено, что крайне важно внимательно следить за животными под наркозом, чтобы предотвратить гипотермию. Дополнительные поддерживающие дозы кетамина следует назначать с осторожностью, только в случае необходимости27.
Что касается эффективности применения ФДТ, результаты показали, что облучение языков, ранее обработанных смесью куркуминоидной соли 80 мкМ, вызывало значительное снижение (2,47 log10) жизнеспособности C. albicans. Гистологический анализ показал, что срезы языков, обработанные 80 мкМ куркуминоид-опосредованной АФДТ, показали снижение количества грибковых клеток, которые были ограничены ороговевшим слоем, и низкую воспалительную реакцию. Стоит подчеркнуть, что воспалительная реакция была выявлена у всех мышей, которые были инфицированы C. albicans. Это наблюдение подразумевает, что воспаление, наблюдаемое во всех группах аФДТ, может быть связано с инфекцией Candida, а не с аФДТ, что согласуется с нашими предыдущими исследованиями 10,13,14,15.
В предыдущих исследованиях в качестве ФС использовали CUR, метиленовый синий и фотодитазин (PDZ) и получили многообещающие результаты 10,20,24,25,27. В аналогичном исследовании10 комбинированное воздействие CUR и светодиодного света вызывало значительное снижение жизнеспособности C. albicans; однако использование 80 мкМ CUR и света снижало жизнеспособность грибов на 4,0 log10. Dovigo et al.10 использовали только CUR в качестве PS, в то время как мы использовали соль, содержащую три основных куркуминоида из C. longa. Когда CUR (260 мкМ) и светодиодный свет использовались в течение пяти дней подряд при лечении кандидоза полости рта у мышей, авторы наблюдали снижение жизнеспособности грибка на 1,11 log10 21. При использовании метиленового синего в качестве ФС в дозах 450 мкг/мл и 500 мкг/мл аФДТ полностью уничтожала C. albicans из ротовой полости мышей25. Более того, при опосредовании ФДТ (100 мг/л) наблюдалось снижение 3,0 log10 и полная ремиссия поражений полости рта20. Кроме того, ФДТ увеличивала экспрессию ФНО-α по сравнению с таковой в20-й группе без лечения. В исследовании, в котором использовался штамм, резистентный к флуконазолу, аФДТ, опосредованная PDZ (200 мг/л), способствовала снижению, эквивалентному 1,3 log1027. Кроме того, комбинация аФДТ с нистатином приводила к существенному снижению жизнеспособности грибков, что составляло снижение на 2,6 log10, наряду с заметным улучшением поражений полости рта и уменьшением воспалительной реакции27. В совокупности эти исследования предоставляют убедительные доказательства эффективности аФДТ в снижении грибковой нагрузки в мышиной модели кандидоза полости рта, подчеркивая ее потенциал в качестве клинического варианта лечения из-за ее антимикробной эффективности, не причиняющей вреда тканям хозяина.
В заключение, мышиная модель ОК, использованная в этом исследовании, подходит для имитации инфекции и оценки эффективности АФДТ. В качестве ограничения используемая здесь модель ОК использовала только один референтный штамм C. albicans (другие штаммы, клинические изоляты и виды Candida, не относящиеся к albicans, не оценивались). Кроме того, вызванная кортикостероидами иммуносупрессия, используемая у мышей для развития инфекции полости рта, может не имитировать другие состояния иммунодефицита, например, вызванные ВИЧ-инфекцией. Кроме того, могут быть различия в условиях развития ОК в организме хозяина, например, в микробиоте полости рта мышей и человека. Этот протокол должен быть расширен для оценки смешанных биопленок, образованных более чем одним видом или разными штаммами одного и того же вида. Кроме того, поддержание мышей в адекватном состоянии седативных препаратов и предотвращение гипотермии, избегая при этом смертности, связанной с анестезией, являются наиболее сложными этапами протокола.
Благодарности
Авторы благодарят за финансовую поддержку FAPESP (Исследовательский фонд Сан-Паулу, номер процесса FAPESP #2013/07276-1 (CePID CePOF) и 2008/00601-6. Мы также благодарим доктора Ану Паулу Сильва за предоставленную информацию о водорастворимой соли на основе CUR.
Материалы
| Name | Company | Catalog Number | Comments |
| C. albicans | ATCC (Rockville, Md, USA) | 90028 | Used to prepare the Candida inoculum |
| Centrifuge | Eppendorf Centrifuge 5804/5804R,B. Braun, Melsungen, Hesse, Germany | 022628146 (NA) | Used to prepare the Candida inoculum |
| Chlorpromazine chloride 2 mg/mL | Compounding pharmacy, Araraquara, SP, Brazil | - | Used to sedate animals during candida inoculation |
| Curcumin-based water-soluble salt | PDTPharma, Cravinhos, Brazil | - | Consisting of 53.4% of natural curcumin, and 46.6% of other curcuminoids (demethoxycurcumin and bis-demethoxycurcumin). Prepared in water and N-MethylD-Glucamine (final average molecular weight of 730.32 g.mol−1) |
| Digital colony counter | CP 600 Plus, Phoenix Ind Com Equipamentos Científicos Ltda, Araraquara, SP, Brazil | - | Used to count colonies on agar plates |
| Extruded mouse chow | Benelab food, Industry Qualy Animal Nutrition and Commerce Ltda., Lindóia, São Paulo State, Brazil. | - | Used for the feeding of the mice |
| Ketamine Hydrochloride 10% | Ketamina Agener, União Química Farmacêutica Nacional S/A, Embu-Guaçu, SP, Brazil | - | Used to anesthetize animals before treatments and for euthanasia |
| Light-emitting diode handpiece (prototype) | Instituto de Física de São Carlos, University of São Paulo, São Carlos, SP, Brazil | - | Fabricated with LXHL-PR09, Luxeon III Emitter, Lumileds Lighting, San Jose, California, USA |
| Methylprednisolone acetate 40 mg | DEPO-MEDROL, Pfizer, New York | - | Used as an immunosuppressant |
| Microtome | Leica Microsystems, Bannockburn, IL, USA | SM2500 | Used to cut the serial sections of the tongues |
| Propylene boxes (cages housing) H13 x L20 x D30 cm | Bonther Equipaments, Ribeirão Preto, SP, Brazil | - | Used to keep the animals throughout the experimental period |
| Sabouraud Dextrose Agar with Chloramphenicol | HiMedia, Mumbai, India | MM1067-500G | Culture medium for yeast growth (agar) |
| Spectrophotometer | Spectrophotometer Kasvi K37-VIS , São José dos Pinhais, PR, Brazil | K37-VIS | Used to standardize the inoculum concentration |
| Tetracycline hydrochloride | Compounding pharmacy, Araraquara, SP, Brazil | - | Antibiotic given to induce oral dysbiosis |
| Wood shavings | J.R. Wood Shavings, Comerce of Sawdust Ltda., Conchal, São Paulo State, Brazil | - | Used for floor covering inside the housing boxes |
| Xylazine 2% | Calmiun, União Química Farmacêutica Nacional S/A, Embu-Guaçu, SP, Brazil | - | Used in combination with ketamine for anesthesia |
| Yeast Nitrogen Broth | Difco, InterLab, Detroit, MI, USA | DF0919-07-3 | Culture medium for yeast growth (broth) |
| Yeast Peptone Dextrose Broth | NutriSelect Basic, Sigma Aldrich | Y1375 | Culture medium for maintaining the strains at -80°C and grow |
Ссылки
- Vila, T., Sultan, A. S., Montelongo-Jauregui, D., Jabra-Rizk, M. A. Oral candidiasis: a disease of opportunity. Journal of fungi (Basel, Switzerland). 6 (1), 15(2020).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Moyes, D. L., Richardson, J. P., Naglik, J. R. Candida albicans-epithelial interactions and pathogenicity mechanisms: scratching the surface. Virulence. 6 (4), 338-346 (2015).
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Quindós, G., et al. Therapeutic tools for oral candidiasis: Current and new antifungal drugs. Medicina oral, patologia oral y cirugia buccal. 24 (2), e172-e180 (2019).
- Nishimoto, A. T., Sharma, C., Rogers, P. D. Molecular and genetic basis of azole antifungal resistance in the opportunistic pathogenic fungus Candida albicans. Journal of Antimicrobial Chemotherapy. 75 (2), 257-270 (2020).
- Gholami, L., Shahabi, S., Jazaeri, M., Hadilou, M., Fekrazad, R. Clinical applications of antimicrobial photodynamic therapy in dentistry. Frontiers in Microbiology. 13, 1020995(2013).
- Trigo-Gutierrez, J. K., Vega-Chacón, Y., Soares, A. B., Mima, E. G. O. Antimicrobial activity of curcumin in nanoformulations: a comprehensive review. International Journal of Molecular Sciences. 22 (13), 7130(2021).
- Santezi, C., Reina, B. D., Dovigo, L. N. Curcumin-mediated Photodynamic Therapy for the treatment of oral infections-A review. Photodiagnosis and Photodynamic Therapy. 21, 409-415 (2018).
- Dovigo, L. N., et al. Curcumin-mediated photodynamic inactivation of Candida albicans in a murine model of oral candidiasis. Medical Mycology. 51 (3), 243-251 (2013).
- Zangirolami, A. C., Carbinatto, F., Filho, J. D. V., Bagnato, V. S., Blanco, K. C. Impact of light-activated curcumin and curcuminoids films for catheters decontamination. Colloids and SurfacesB: Biointerfaces. 213, 112386(2022).
- Santezi, C., Tanomaru, J. M., Bagnato, V. S., Júnior, O. B., Dovigo, L. N. Potential of curcumin-mediated photodynamic inactivation to reduce oral colonization. Photodiagnosis Photodynamic Therapy. 15, 46-52 (2016).
- Takakura, N., et al. A novel murine model of oral candidiasis with local symptoms characteristic of oral thrush. Microbiology and immunology. 47 (5), 321-326 (2003).
- Mima, E. G., et al. Susceptibility of Candida albicans to photodynamic therapy in a murine model of oral candidosis. OralSurgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology. 109, 392-401 (2010).
- Solis, N. V., Filler, S. G. Mouse model of oropharyngeal candidiasis. Nature Protocol. 7 (4), 637-642 (2012).
- Marôco, J. Análise Estatística com o SPSS Statistics 25. , ReportNumber 7th ed, Lisboa, Portugal. (2018).
- Naglik, J. R., Fidel, P. L. Jr, Odds, F. C. Animal models of mucosal Candida infection. FEMS Microbiology Letters. 283 (2), 129-139 (2008).
- Samaranayake, Y. H., Samaranayake, L. P. Experimental oral candidiasis in animal models. Clinical Microbiology Reviews. 14, 398-429 (2001).
- Chamilos, G., Lionakis, M. S., Lewis, R. E., Kontoyiannis, D. P. Role of mini-host models in the study of medically important fungi. The Lancet Infectious Diseases. 7, 42-55 (2007).
- Carmello, J. C., et al. Treatment of oral candidiasis using Photodithazine- mediated photodynamic therapy in vivo. PLoS One. 11 (6), e0156947(2016).
- Sakima, V. T., et al. Antimicrobial photodynamic therapy mediated by curcumin-loaded polymeric nanoparticles in a murine model of oral candidiasis. Molecules. 23 (8), 2075(2018).
- Abe, S., et al. A glucocorticoid antagonist, mifepristone affects anti-Candida activity of murine neutrophils in the presence of prednisolone in vitro and experimental candidiasis of prednisolone-treated mice in vivo. FEMS Immunology and Medical Microbiology. 13 (4), 311-316 (1996).
- Jones, J. H., Russell, C., Young, C., Owen, D. Tetracycline and the colonization and infection of the mouths of germ-free and conventionalized rats with Candida albicans. Journal Antimicrobial Chemotherapy. 2 (3), 247-253 (1976).
- Russell, C., Jones, J. H. Effects of oral inoculation of Candida albicans in tetracycline-treated rats. Journal of Medical Microbiology. 6 (3), 275-279 (1973).
- Teichert, M. C., Jones, J. W., Usacheva, M. N., Biel, M. A. Treatment of oral candidiasis with methylene blue- mediated photodynamic therapy in an immunodeficient murine model. OralSurgery, Medicine, Pathology, Radiology and Endodontology. 93, 155-160 (2002).
- Totti, M. G. A., Santos, E. B., Almeida, O. P., Koga-Ito, C. Y., Jorge, A. O. C. Oral candidosis by Candida albicans in normal and xerostomic mice. Brazilian Oral Research. 18, 202-207 (2004).
- Hidalgo, K. J. R., et al. Antimicrobial photodynamic therapy in combination with nystatin in the treatment of experimental oral candidiasis induced by Candida albicans resistant to fluconazole. Pharmaceuticals (Basel). 12 (3), E140(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены