Method Article
العلاج الضوئي الديناميكي المضاد للميكروبات بوساطة الكركمينويد على نموذج الفئران لداء المبيضات الفموي
In This Article
Summary
يصف هذا البروتوكول تطبيق العلاج الضوئي الديناميكي المضاد للميكروبات (aPDT) في نموذج الفئران لداء المبيضات الفموي. تم إجراء aPDT باستخدام خليط قابل للذوبان في الماء من الكركمينويدات وضوء LED الأزرق.
Abstract
تم التحقيق على نطاق واسع في العلاج الضوئي الديناميكي المضاد للميكروبات (aPDT) في المختبر ، والنماذج الحيوانية قبل السريرية للعدوى مناسبة لتقييم العلاجات البديلة قبل التجارب السريرية. تصف هذه الدراسة فعالية aPDT في نموذج الفئران لداء المبيضات الفموي. تم تثبيط أربعين فأرا بحقن بريدنيزولون تحت الجلد ، وتم تلقيح ألسنتهم باستخدام مسحة فموية غارقة مسبقا في تعليق خلية C. albicans . تم إعطاء التتراسيكلين عن طريق مياه الشرب أثناء التجربة. بعد خمسة أيام من التلقيح الفطري ، تم توزيع الفئران بشكل عشوائي إلى ثماني مجموعات. تم تضمين مجموعة تاسعة من الفئران غير المصابة غير المعالجة كعنصر تحكم سلبي (ن = 5). تم اختبار ثلاثة تركيزات (20 ميكرومتر و 40 ميكرومتر و 80 ميكرومتر) من خليط من الكركمينويدات باستخدام ضوء LED أزرق (89.2 ميغاواط / سم2 ؛ ~ 455 نانومتر) وبدون ضوء (مجموعات C + L + و C + L- ، على التوالي). تم تقييم الضوء وحده (C-L +) ، وعدم العلاج (C-L-) ، غير المصابة بالعدوى كعناصر تحكم. تم تحليل البيانات باستخدام اختبارات ويلش ANOVA و Games-Howell (α = 0.05). تم تأسيس داء المبيضات الفموي في جميع المصابة وتصوره مجهريا من خلال وجود بقع بيضاء مميزة أو أغشية كاذبة على ظهر الألسنة. أكدت المقاطع النسيجية المرضية وجود كبير للخميرة والخيوط المقتصرة على الطبقة الكيراتينية للظهارة في مجموعة C-L ، وانخفض وجود الخلايا الفطرية بصريا في الصور التي تم الحصول عليها من الفئران المعرضة ل aPDT إما مع 40 ميكرومتر أو 80 ميكرومتر curcuminoids. aPDT بوساطة 80 ميكرومتر كوركومينويدس عززت انخفاض 2.47 سجل10 في عدد المستعمرات مقارنة بتلك الموجودة في مجموعة C-L- (p = 0.008). لم تظهر جميع المجموعات الأخرى أي انخفاض ذي دلالة إحصائية في عدد المستعمرات ، بما في ذلك مجموعات التحسس الضوئي (C + L-) أو الضوء وحده (C-L +). قلل aPDT بوساطة الكركمينو من الحمل الفطري من ألسنة الفئران.
Introduction
داء المبيضات الفموي (OC) هو العدوى الفطرية الرئيسية في تجويف الفم. وهو ناتج عن فرط نمو المبيضات النيابة. تشمل العوامل المؤهبة ل OC ضعف الغدد الصماء ، واستخدام المضادات الحيوية واسعة الطيف ، والعلاج الإشعاعي والعلاج الكيميائي ، ونقص التغذية ، وجفاف الفم (انخفاض تدفق اللعاب) ، واستخدام أطقم الأسنان ، وسوء النظافة ، وخاصة كبت المناعة1. من بين أنواع المبيضات ، المبيضات البيض هي الأكثر انتشارا وضراوة. تم العثور عليها كنوع متعايش في جسم الإنسان وكعامل ممرض انتهازي. C. albicans لديه القدرة على تغيير مورفولوجيته من الخمائر المتعايشة (الأريمية) إلى خيوط مسببة للأمراض (خيوط وخيوط كاذبة)2. يمكن للأشكال الخيطية ، وخاصة الخيوط ، أن تغزو ظهارة المضيف عن طريق الاختراق الخلوي أو الاختراق النشط ، مما يسبب العدوى3. تشمل عوامل الفوعة الأخرى ل C. albicans الالتصاق ، وتكوين الأغشية الحيوية ، وإفراز الإنزيمات والسموم المحللة للدهون والمائية ، مثل الليباز ، والفوسفوليباز ، والبروتينات ، والمبيضات4.
تتضمن علاجات OC استخدام العوامل المضادة للفطريات ، وخاصة البولينات الموضعية والأزول (النيستاتين والميكونازول)5. ومع ذلك ، فإنها تظهر فقط فعالية قصيرة الأجل ، والتكرار متكرر. بالإضافة إلى ذلك ، أدى الإفراط في استخدام مضادات الفطريات إلى ظهور مشكلة تطور المقاومة المضادة للفطريات وانتشارها6. لذلك ، هناك حاجة إلى علاجات بديلة ، مثل العلاج الضوئي الديناميكي المضاد للميكروبات (aPDT) ، والذي يجمع بين محسس ضوئي (PS) وضوء بطول موجي مناسب (مثل امتصاص PS) في وجود الأكسجين. ترتبط PSS بالخلايا أو تمتصها ، وعندما يتم تنشيطها بواسطة الضوء ، تنتج أنواع الأكسجين التفاعلية (ROS) السامة للخلايا الحساسة7.
في aPDT ، أحد المحسسات الضوئية (PSs) المستخدمة هو الكركمين (CUR) ، وهو مركب طبيعي مستخرج من جذور نبات الكركم (Curcuma longa L.) يمتلك الكركمين العديد من السمات العلاجية ، بما في ذلك القدرات المضادة للالتهابات ومضادات الأكسدة والمضادة للسرطانومضادات الميكروبات 8,9. وجد تحقيق سابق أن aPDT باستخدام CUR قلل بشكل فعال من C. albicans في نموذج الفئران من داء المبيضات الفموي دون التسبب في أي ضرر لأنسجة المضيف10. CUR هو الكركمين الرئيسي المستخرج من الكركم ، ولكن توجد أيضا بوليفينول أخرى ، مثل ديميثوكسيكوركومين وثنائي ديميثوكسي كوركومين ، في هذا النبات. أظهر aPDT بوساطة الكركمينو نشاطا مضادا للبكتيريا ضد الأغشية الحيوية للمكورات العنقودية الذهبية المزروعة في القسطرة11. ومع ذلك ، على حد علمنا ، لا يزال نشاطه المضاد للفطريات ضد C. albicans غير واضح. لذلك ، في هذه الدراسة ، قمنا بتقييم aPDT بوساطة ملح الكركمينويد ضد C. albicans في نموذج الفئران من OC.
Protocol
تمت الموافقة على بروتوكول البحث لاستخدام الفئران من قبل لجنة أخلاقيات استخدام (رقم الحالة 05/2008 و 09/2020) في كلية طب الأسنان ، أراراكورا ، UNESP. تم استخدام C. albicans (ATCC 90028) كسلالة مرجعية. تم استخدام إناث الفئران السويسرية البالغة من العمر ستة أسابيع (ن = 45) ، مع نطاق كتلة الجسم من 20-30 جم ، في هذه الدراسة. تم توفير من قبل جامعة ولاية ساو باولو ، UNESP ، بوتوكاتو.
1. إعداد PS واختيار مصدر الضوء ل aPDT
- قم بإعداد PS وفقا لمواصفات المادة المراد اختبارها.
ملاحظة: في هذه الدراسة ، تم استخدام خليط قابل للذوبان في الماء من الكركمينويدات (خليط الملح القابل للذوبان في الماء12 القائم على CUR) باعتباره PS (انظر جدول المواد والشكل 1). تم تحضير التخفيفات عند 20 ميكرومتر و 40 ميكرومتر و 80 ميكرومتر (15.6 و 29.2 و 58.4 مجم / لتر على التوالي) في ماء فائق النقاء مباشرة قبل الاستخدام وحفظت عند 5 درجات مئوية. - حدد جهازا ضوئيا بطول موجي مناسب (مثل طول امتصاص PS) قادر على إضاءة الهدف الحساس للضوء بالكامل بشكل موحد وفي وقت واحد دون تسخين الأنسجة.
ملاحظة: في هذه الدراسة ، تم استخدام قبضة تحتوي على صمام ثنائي باعث للضوء (LED ، انظر جدول المواد) ، تم تصميمه في معهد Física de São Carlos (جامعة ساو باولو ، ساو كارلوس ، SP ، البرازيل). كانت طاقة الخرج الناتجة عن الضوء 89.2 ميغاواط / سم2 بطول موجي أزرق يبلغ حوالي 455 نانومتر.
2. إعداد لقاح C. albicans
- احتفظ بالسلالة المرجعية C. albicans (ATCC 90028) في الخميرة والببتون والجلوكوز (YEPD ، انظر جدول المواد) مع 50٪ من الجلسرين عند -80 درجة مئوية حتى الاستخدام.
- قم بإذابة السلالة المجمدة في درجة حرارة الغرفة ، وانشر حصة 100 ميكرولتر على طبق بتري مع أجار سكر العنب Sabouraud (SDA) مع الكلورامفينيكول (انظر جدول المواد) ، واحتضانها عند 37 درجة مئوية لمدة 48 ساعة.
- انقل خمس مستعمرات إلى 10 مل من مرق نيتروجين الخميرة مع وسط جلوكوز 2٪ (YNBg) وتنمو هوائيا عند 37 درجة مئوية لمدة 16 ساعة.
- تمييع ثقافة الخميرة في YNBg الطازجة (1:10) واحتضانها هوائيا عند 37 درجة مئوية حتى تصل الكثافة البصرية إلى مرحلة منتصف النمو اللوغاريتمي.
ملاحظة: توحيد منحنى النمو الميكروبي لكل مختبر سابقا. في البحث الحالي ، سمح للمزارع بالتحضين لمدة 8 ساعات تقريبا ، حتى وصلت إلى مرحلة منتصف اللوغاريتم للنمو كما هو موضح في الكثافة الضوئية عند 540 نانومتر (OD540) ، بقيمة متوسطة تبلغ 0.536 ± 0.062 وحدة تعسفية (متوسط ± الانحراف المعياري [SD]). - قم بطرد مركزي للمزرعة عند 5000 × جم في درجة حرارة الغرفة لمدة 5 دقائق ، وتخلص من المادة الطافية واغسل الحبيبات مرتين بنفس الحجم من المحلول الملحي المعقم المخزن بالفوسفات (PBS ؛ 0.136 M NaCl ، 2 mM KCl ، 1 mM KH2PO4 ، 10 mM Na2HPO4 ، pH 7.4).
- استخدم حصص 100 ميكرولتر لأداء أربعة تخفيفات متسلسلة 10 أضعاف في PBS ، ونشر التخفيفات على لوحات SDA ، واحتضانها عند 37 درجة مئوية لمدة 48 ساعة لعدد المستعمرات. كمعيار ، يتم استخدام المعلقات الفطرية بتركيزات حوالي 4.5 × 107 وحدات تشكيل مستعمرة لكل مليلتر (CFU / mL)].
3. تحريض OC في الفئران
ملاحظة: تم وصف المنهجية التالية سابقا بواسطة Takakura et al.13 وتم استنساخها من قبل مجموعتنا10،14 ، مع بعض التعديلات.
- توزيع الفئران عشوائيا في تسع مجموعات (ن = 5) ، المقابلة لنفس العدد من العلاجات (الملف التكميلي 1).
ملاحظة: يجب أن يكون تجويف الفم للفئران سلبيا لنمو المبيضات . يجب التحقق من ذلك عن طريق مسح تجويف الفم وطلاء العينة على SDA. - احتفظ بالحيوانات في صناديق البروبيلين10 (5 فئران لكل صندوق كحد أقصى) ، مع نشارة الخشب لتغطية الأرضيات ، في حظيرة يتم التحكم في درجة حرارتها عند 23 ± 2 درجة مئوية تحت دورة ضوء / مظلمة 12/12 ساعة. ولا يلزم توفير تخصيب محدد.
- الحفاظ على الفئران على النظام الغذائي للفأر المبثوق والمياه المفلترة ad libitum.
- حقن تحت الجلد الدواء المثبط للمناعة ، بريدنيزولون (100 ملغم / كغم من وزن الجسم ، انظر جدول المواد) ، لأول مرة في اليوم الأول لجميع أعضاء المجموعات C + L + 20 ، C + L + 40 ، C + L + 80 ، C + L- 20 μM ، C + L- 40 ، C + L- 80 ، C-L + ، و C-L- (الملف التكميلي 1).
ملاحظة: احتفظ بالفئران من نفس المجموعة في نفس الصندوق وراقبها يوميا بحثا عن أي علامة على الإجهاد وفقدان الوزن. اطلب المشورة البيطرية للحصول على طعام / ماء مسكن أو معدل إذا لوحظ الإجهاد أو فقدان الوزن. - بدءا من اليوم الأول وحتى نهاية التجربة ، قم بتوفير هيدروكلوريد التتراسيكلين في مياه الشرب عند 0.83 مجم / مل13.
- تلقيح ألسنة الفئران في اليوم الثاني ، بما في ذلك المجموعات C + L + 20 و C + L + 40 و C + L + 80 و C + L- 20 و C + L- 40 و C + L- 80 و C-L + و C-L- (الملف التكميلي 1) ، مع لقاح C. albicans . لا تقم بتلقيح تلك الفئران من مجموعة التحكم السلبية (NCtrl).
- تخدير عن طريق الحقن العضلي ل 10 مغ/كغ كلوريد كلوربرومازين (انظر جدول المواد) على كل عضلة من عضلات الفخذ قبل إجراء التلقيح.
- إجراء التلقيح داخل الفم للفئران عن طريق نقع مسحة معقمة (واحدة لكل) في تعليق موحد طازج (أي معد مباشرة قبل التلقيح) من C. albicans.
- ضع الفئران المخدرة في وضع ضعيف. اسحب ألسنتهم برفق من أفواههم باستخدام ملقط معقم. فرك لسان كل فأر بمسحة مبللة لمدة 30 ثانية. راقب الفئران حتى تتعافى من التخدير.
- في اليوم الخامس، يتم تطبيق حقنة تكميلية تحت الجلد من بريدنيزولون (100 ملغ/كغ من وزن الجسم) للحفاظ على كبت المناعة.
ملاحظة: هذا البروتوكول كاف للحفاظ على العدوى لمدة 7 أيام بعد التلقيح داخل الفم. يظهر الجدول الزمني للبروتوكول في الشكل 2.
4. العلاج الضوئي الديناميكي المضاد للميكروبات واستعادة C. albicans من آفات الفم
- في اليوم السابع، وقبل العلاج، يتم تخدير باستخدام حقن هيدروكلوريد الكيتامين داخل الصفاق (100 ملغم/كغ من وزن الجسم) مع الزيلازين (10 ملغم/كغ من وزن الجسم) (انظر جدول المواد).
- ضع كل في وضع ضعيف على جهازوسادة 14,15 مزود بأسلاك من الفولاذ المقاوم للصدأ يمكن لفها حول القواطع لإبقاء الفم مفتوحا.
ملاحظة: يوصى باستخدام منصات متساوية الحرارة لتدفئة الفئران أثناء تخديرها ، ومنع انخفاض حرارة الجسم في درجة حرارة الغرفة وتجنب الوفيات المرتبطة بالتخدير15. يجب مراقبة كل مخدر من خلال عدم وجود منعكس انسحاب عند قرص أصابع القدم لتأكيد عمق التخدير. يمكن إعطاء جرعة صيانة واحدة من الكيتامين عند 1/3 الجرعة الأصلية (بدون زيلازين) إذا لزم الأمر. - مع تراجع الفك السفلي والخدين ، ضع اللسان برفق خارج الفم.
- بالنسبة للفئران من مجموعات C + L + ، ماصة 70 ميكرولتر من PS على ظهر اللسان (في أحد التركيزات المختبرة). الحفاظ على الفئران في بيئة مظلمة لمدة 20 دقيقة كفترة ما قبل التشعيع. تأكد من أنه خلال هذا الوقت ، يظل لسان كل في مكانه داخل تجويف الفم لمنع تناول المحسس الضوئي (PS).
- بعد فترة التحسس الضوئي ، اسحب اللسان من الفم للإضاءة. ضع جهاز LED على ظهر اللسان وأضيء بسرعة 37.5 جول / سم2 (7 دقائق مع الجهاز الحالي) (الشكل 3).
- بالنسبة للحيوانات من مجموعات C + L- ، ماصة 70 ميكرولتر من PS في أحد التركيزات المختبرة على ظهر اللسان ، والحفاظ على هذه الفئران في الظلام لمدة 27 دقيقة.
- بالنسبة للحيوانات من مجموعة C-L + (المعالجة بالضوء دون أي حساسية ضوئية سابقة) ، ماصة 70 ميكرولتر من محلول ملحي معقم على ظهر اللسان. أبق الفئران في الظلام لمدة 20 دقيقة ثم أضيء ألسنتها بسرعة 37.5 جول / سم2 (7 دقائق بالجهاز الحالي).
- بالنسبة للفئران من مجموعة C-L (غير المعالجة ب PS ولا بالضوء) ، ماصة 70 ميكرولتر من محلول ملحي معقم على ظهر اللسان والاحتفاظ بها في الظلام لمدة 27 دقيقة.
- استعادة C. albicans من ألسنة جميع الفئران مباشرة بعد العلاج. مسحة الظهر من اللسان لمدة 1 دقيقة مع مسحة القطن معقمة.
- ضع كل عينة مسحة في أنبوب يحتوي على 1 مل من محلول ملحي معقم ودوامة لمدة دقيقة واحدة لإعادة تعليق الخلايا الميكروبية.
- قم على الفور بإجراء تخفيفات تسلسلية 10 أضعاف في PBS ولوحة 25 ميكرولتر على لوحات SDA في نسختين. احتضان الألواح هوائيا عند 37 درجة مئوية لمدة 48 ساعة.
- بعد 48 ساعة ، استخدم عداد مستعمرة رقمي (انظر جدول المواد) لتحديد عدد مستعمرات الخميرة. احسب حمل C. albicans (CFU / mL) لكل.
- تحويل قيم CFU / mL إلى log10 وتحليلها بشكل صحيح وفقا لتصميم التجربة وافتراضات البيانات.
ملاحظة: في التحقيق الحالي ، تم استخدام اختبار ويلش أحادي الاتجاه ANOVA و Games-Howell اللاحق (α = 0.05) 16 .
5. التحليلات النسيجية المرضية
- في اليوم الثامن ، تخدير الفئران بالكيتامين عند 100 مغ / كغ مع زيلازين عند 10 ملغم / كغم عن طريق الحقن داخل الصفاق والقتل الرحيم بجرعة زائدة من الكيتامين (200 ملغم / كغم تدار عن طريق داخل السماق). تأكيد الوفاة عن طريق التحقق من عدم وجود حركة تنفسية (انقطاع النفس) ، وغياب ضربات القلب (الانقباض).
- قرصة اللسان بعناية وسحبه من فم. باستخدام مشرط يدوي ، قم بعمل شق قبل الحليمات المحيطة لإزالة اللسان بالكامل جراحيا دون التسبب في أي إصابات للمناطق الأمامية والوسطى.
- ثبت اللسان في 10٪ من الفورمالين المخزن (درجة الحموضة 7.2-7.4) لمدة 24 ساعة واغسله بالماء الجاري لمدة ساعتين.
- المضي قدما في إدراج في عملية البارافين: الجفاف ، والتوضيح ، والتشريب10،14.
- قم بقص المقاطع التسلسلية (بسمك 5 ميكرومتر) باستخدام ميكروتوم ، ثم ضع المقاطع على شرائح زجاجية. المضي قدما في تلطيخ هذه الأقسام باستخدام حمض شيف الدوري والهيماتوكسيلين (PAS-H) للفحص النسيجي المرضي وتحديد الفطريات من خلال الملاحظة تحت المجهر الضوئي.
- اطلب من أخصائي علم الأمراض ، ويفضل أن يكون أعمى عن المجموعات التي تمت دراستها ، فحص تفاعل الأنسجة بسبب عدوى C. albicans .
- وصف الخصائص النسيجية للنسيج (الظهارة والنسيج الضام) ، وخاصة الاستجابات الالتهابية المحلية ذات الشدة المتفاوتة.
النتائج
أظهر نموذج الفئران من OC بقع بيضاء نموذجية وأغشية كاذبة على لسان جميع الفئران المصابة (الشكل 4A). أكدت C. albicans المستعادة من C-L- استعمار الأنسجة بواسطة هذه الكائنات الحية الدقيقة (تراوحت القيم من 1.62 × 104 إلى 4.80 × 105 CFU / mL). كما هو متوقع ، لم تظهر من مجموعة NCtr أي تغيرات في الأنسجة أو نمو مستعمرة بعد أخذ العينات (الشكل 4B).
قلل aPDT من صلاحية C. albicans عندما تم استخدام curcuminoids عند 80 ميكرومتر للتحسس الضوئي (الشكل 5). كان متوسط التخفيض اللوغاريتمي10 الذي تم تحقيقه باستخدام aPDT بوساطة 80 ميكرومتر PS 2.47 ، مقارنة بالمجموعة C-L (p = 0.008).
لم يكن عدد مستعمرات C. albicans التي تم استردادها من ألسنة الفئران مختلفا بشكل كبير بين الفئران التي عولجت بالكوركومينويدات بدون إضاءة (مجموعات C + L) ، والفئران المعالجة بالضوء ولكن لم يتم تحسسها ضوئيا من قبل (مجموعات C-L +) ، والفئران غير المعالجة (مجموعة C-L) (p ≥ 0.210).
أظهرت السمات النسيجية لألسنة غير المصابة (NCtr) أنسجة طبيعية / صحية ، بما في ذلك الصفيحة المخصوصة السليمة ، والغشاء القاعدي ، والحليمات الخيطية (الشكل 6 أ). في المقابل ، عند فحص الصور النسيجية المرضية لألسنة الفئران من مجموعة C-L- ، كان من الواضح أن الخميرة والخيوط كانت موجودة داخل الطبقة الكيراتينية للظهارة ، على الرغم من عدم وجود تسلل للفطريات. في النسيج الضام الأساسي ، لوحظت استجابة التهابية خفيفة ، بوساطة الخلايا أحادية النواة في المقام الأول ، وكانت الحليمات الخيطية غائبة بشكل ملحوظ (الشكل 6 ب). أظهر التحليل النسيجي لألسنة الفئران في كل من مجموعات C + L و C-L + خصائص مماثلة. في المقابل ، كشفت أقسام اللسان من الفئران المعالجة ب 80 ميكرومتر aPDT بوساطة كوركومينويد عن انخفاض عدد الخلايا الفطرية ، والتي تقتصر بشكل أساسي على الطبقة الكيراتينية للظهارة (الشكل 6C).
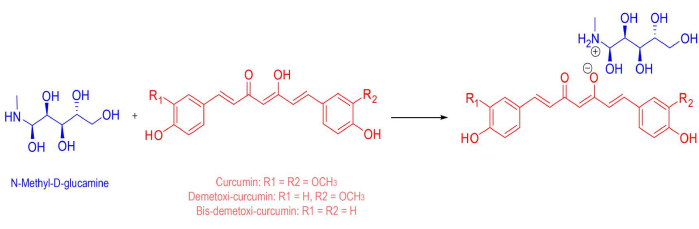
الشكل 1: التركيب الكيميائي للمحسس الضوئي. التركيب الكيميائي لخليط الملح القابل للذوبان في الماء المستخدم كمحسس ضوئي ، ويضم 53.4٪ كركمين طبيعي و 46.6٪ كوركومينويدات أخرى (ديميثوكسيكوركومين وثنائي ديميثوكسي كوركومين). متوسط الوزن الجزيئي النهائي هو 730.32 جم / مول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
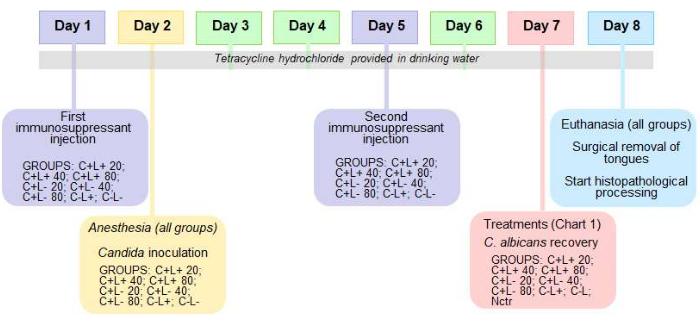
الشكل 2: الجدول الزمني للبروتوكول لنموذج الفئران لداء المبيضات الفموي و aPDT. جدول زمني يحدد بروتوكول نموذج الفئران لداء المبيضات الفموي والعلاج الضوئي الديناميكي المضاد للميكروبات (aPDT). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: إضاءة ألسنة الفئران بعد التحسس الضوئي. بعد التحسس الضوئي ، (حضانة الأنسجة المصابة بالمحسس الضوئي) ، أضاءت الألسنة عند 37.5 جول / سم2 باستخدام ضوء LED أزرق (~ 455 نانومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الآفات البيضاء في نموذج داء المبيضات الفموي الفئران. (أ) صور تمثيلية تصور الآفات البيضاء التي لوحظت في نموذج الفئران لداء المبيضات الفموي. ب: السيطرة السلبية (غير المصابة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
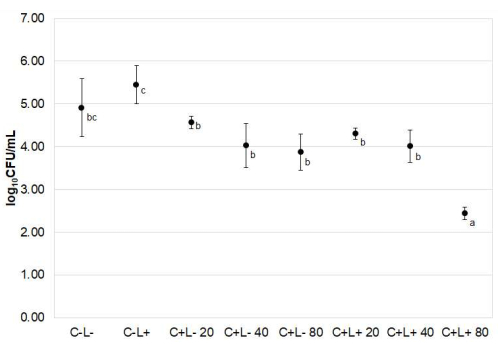
الشكل 5: تعافت المبيضات البيضاء من ألسنة الفئران. تمثل البيانات القيم المتوسطة ± الانحراف المعياري للسجل10 (CFU / mL) من مجموعات العلاج. أشار WELCH أحادي الاتجاه إلى أن تأثيرات العلاجات كانت مختلفة إحصائيا بين المجموعات (p < 0.001). تشير الأحرف الصغيرة المختلفة (أ ، ب ، ج) بجوار الوسائل إلى اختلافات ذات دلالة إحصائية وفقا لاختبار Games-Howell (p≤ 0.030). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
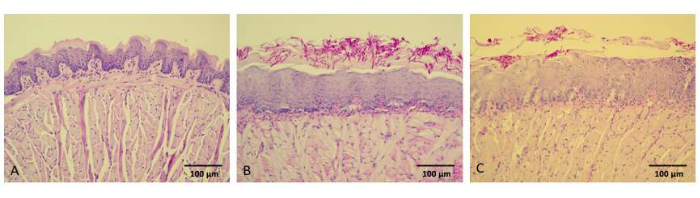
الشكل 6: صور تمثيلية للمقاطع النسيجية لألسنة الفئران. تم تلطيخ المقاطع النسيجية لألسنة الفئران باستخدام PAS-H ، وتم التقاط الصور بمعدل 200x. (أ) فئران التحكم السلبي دون داء المبيضات الفموي المستحث ، والحساسية الضوئية ، والإضاءة (مجموعة NCtr). (ب) الفئران المصابة بداء المبيضات الفموي المستحث ، غير حساسة للضوء ولا تتعرض لإضاءة LED (مجموعة C-L). (ج) المصابة بداء المبيضات الفموي المستحث ، المعرضة ل 80 ميكرومتر كوركومينويدس و 37.5 جول / سم2 إضاءة LED (مجموعة C + L + 80). قضبان المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: المجموعات التجريبية. قائمة بالمجموعات التجريبية المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
ارتبطت C. albicans بالتهابات الفم والمريء لدى الأفراد الذين يعانون من نقص المناعة ، ومرض السكري ، والاستخدام المطول للمضادات الحيوية ، وسوء نظافة الفم1،3. تتطلب دراسة الأمراض المعدية البشرية تحقيقات في المختبر وفي الجسم الحي قبل أن يتم تصميم التجارب السريرية بأمان ودقة. تصف الدراسة الحالية طريقة لإنشاء نموذج الفئران من OC ، والذي يمكن استخدامه لتقييم التسبب في التهابات الفم بواسطة C. albicans وفعالية الأساليب المضادة للفطريات15،16،17،18،19.
تم إنشاء نموذج الفئران من OC المستخدم هنا بنجاح ، كما يتضح من استعادة الحمل الفطري الكبير من الآفات وكذلك من خلال سمات العدوى المميزة التي لوحظت في التحليلات العيانية والنسيجية المرضية لألسنة الفئران المصابة. استخدمت العديد من الدراسات نماذج الفئران المماثلة ل OC. في مثل هذه النماذج ، يتم تثبيط مناعة الفئران الإناث وتلقيحها ب C. albicans ، مما يؤدي إلى آفات على اللسان10،13،14،15،20،21. كبت المناعة مع بريدنيزولون ، وهو جلايكورتيكود ، يمنع نشاط العدلات ضد C. albicans22. في هذه الدراسة ، تم تثبيط مناعة إناث الفئران بحقنتين تحت الجلد من بريدنيزولون ، قبل يوم واحد وثلاثة أيام بعد الإصابة ب C. albicans13. بالإضافة إلى ذلك ، تسبب إعطاء التتراسيكلين في مياه الشرب أثناء التجربة في dysbiosis عن طريق الفم عن طريق إزعاج بكتيريا الفم ومساعدة C. albicans على الازدهار23,24. علاوة على ذلك ، فإن التخدير الناجم عن الحقن العضلي لكلوريد الكلوربرومازين منع من شرب الماء وتناول الطعام مباشرة بعد التلقيح. وهكذا ، بقيت الخلايا الفطرية على اتصال مع ظهر اللسان لفترة أطول ، مما مكن من تطوير الأنابيب الجرثومية والانتقال من الخمائر إلى الخيوط (خيوط وخيوط كاذبة) ، وهي الأشكال المسببة للأمراض من C. albicans التي يمكن أن تغزو ظهارة الإنسان. استخدم Teichert et al.25 بروتوكول نقص المناعة للحث على OC في الفئران واستعاد فقط 2 × 102 CFU / mL من C. albicans.
بينما استخدم Totti et al.26 الفئران التي تم استئصال سيالودينكت وأجرى أربعة تلقيحات منفصلة مع تعليق C. albicans ، من الجدير بالذكر أنه في حالتهم ، لم تستمر العدوى في معظم على مدار التجربة. في المقابل ، في هذه الدراسة ، تم إجراء التلقيح بالخلايا الفطرية مرة واحدة فقط ، وأدى إلى استعادة 104 CFU / mL من C. albicans من تجويف الفم. استخدمت هذه الدراسة نموذج الفئران لداء المبيضات الذي وصفه تاكاكورا وآخرون .13 ، الذين أجروا التلقيح عن طريق الفم بسلالة سريرية معزولة من مريض مصاب بداء المبيضات الجلدي (106 CFU / mL). بعد ثلاثة إلى سبعة أيام من التلقيح ، تم استرداد 105-10 6 CFU / mL من C. albicans من تجويف الفم للفئران13. تشمل الاختلافات بين طريقة Takakura et al.13 وهذه الدراسة استخدام تركيزات فطرية مختلفة في اللقاح (استخدمت هذه الدراسة 107 CFU / mL من C. albicans) وسلالات مختلفة من C. albicans للتلقيح الفموي (تم استخدام السلالة المرجعية ATCC 90028 هنا). استخدم Carmello et al.20 بروتوكولا مشابها ، والذي تضمن استخدام المثبطة للمناعة. ومع ذلك ، قاموا بإعطاء حقنتين إضافيتين تحت الجلد من بريدنيزولون للحيوانات في الأيام 1 و 5 و 9 و 13 من التجربة. كشفت دراستهم عن وجود علاقة إيجابية بين الدرجات المخصصة للآفات الفموية للحيوانات المصابة وعدد CFU / mL على مدى فترة تتراوح من 5 إلى 16 يوما بعد الإصابة. لقد ثبت في الأبحاث السابقة أنه من الضروري مراقبة عن كثب تحت التخدير لمنع انخفاض حرارة الجسم. يجب إعطاء جرعات صيانة إضافية من الكيتامين بحذر ، فقط عند الضرورة27.
فيما يتعلق بفعالية تطبيق aPDT ، أظهرت النتائج أن تشعيع الألسنة التي سبق معالجتها بخليط ملح الكركمينويد 80 ميكرومتر تسبب في انخفاض كبير (2.47 log10) في صلاحية C. albicans. كشفت التحليلات النسيجية أن مقاطع من الألسنة المعالجة ب 80 ميكرومتر بوساطة aPDT بوساطة الكركمينو أظهرت انخفاضا في عدد الخلايا الفطرية ، والتي اقتصرت على الطبقة الكيراتينية ، واستجابة التهابية منخفضة. تجدر الإشارة إلى أنه تم اكتشاف استجابة التهابية في جميع الفئران المصابة ب C. albicans. تشير هذه الملاحظة إلى أن الالتهاب الذي لوحظ في جميع مجموعات aPDT قد يكون مرتبطا بعدوى المبيضات بدلا من أن يعزى إلى aPDT ، وهي نتيجة متسقة تتماشى مع تحقيقاتنا السابقة10،13،14،15.
استخدمت التحقيقات السابقة CUR وأزرق الميثيلين و photodithazine (PDZ) ك PSs وحصلت على نتائج واعدة10،20،24،25،27. في دراسة مماثلة10 ، تسبب التعرض المشترك لضوء CUR و LED في انخفاض كبير في صلاحية C. albicans. ومع ذلك ، فإن استخدام 80 ميكرومتر CUR والضوء قلل من صلاحية الفطريات بمقدار 4.0 سجل10. استخدم Dovigo et al.10 فقط CUR ك PS ، بينما استخدمنا ملحا يحتوي على ثلاثة كوركومينويدسات رئيسية من C. longa. عندما تم استخدام CUR (260 ميكرومتر) وضوء LED لمدة خمسة أيام متتالية في علاج داء المبيضات الفموي في الفئران ، لاحظ المؤلفون انخفاضا قدره 1.11 سجل10 في صلاحية الفطريات21. عندما تم استخدام أزرق الميثيلين ك PS عند 450 ميكروغرام / مل و 500 ميكروغرام / مل ، قضى aPDT تماما على C. albicans من تجويف الفمللفئران 25. علاوة على ذلك ، عندما تم التوسط في aPDT بواسطة PDZ (100 مجم / لتر) ، لوحظ انخفاض 3.0 log10 ومغفرة كاملة للآفات الفموية20. بالإضافة إلى ذلك ، زاد aPDT من تعبير TNF-α مقارنة بالتعبير في المجموعةغير المعالجة 20. في دراسة حيث تم استخدام سلالة مقاومة للفلوكونازول ، عزز aPDT بوساطة PDZ (200 مجم / لتر) انخفاضا يعادل 1.3 log1027. علاوة على ذلك ، أدى الجمع بين aPDT مع النيستاتين إلى انخفاض كبير في صلاحية الفطريات ، مما أدى إلى انخفاض قدره 2.6 log10 ، إلى جانب تحسينات ملحوظة في آفات الفم وانخفاض في الاستجابة الالتهابية27. بشكل جماعي ، تقدم هذه الدراسات أدلة دامغة على فعالية aPDT في تقليل العبء الفطري داخل نموذج الفئران لداء المبيضات الفموي ، مما يؤكد إمكاناته كخيار علاجي سريري بسبب فعاليته المضادة للميكروبات دون التسبب في ضرر للأنسجة المضيفة.
في الختام ، فإن نموذج الفئران من OC المستخدم في هذه الدراسة مناسب لمحاكاة العدوى وتقييم فعالية aPDT. كقيد ، استخدم نموذج OC المستخدم هنا سلالة مرجعية واحدة فقط من C. albicans (لم يتم تقييم سلالات أخرى ، وعزلات سريرية ، وأنواع المبيضات غير البيضاء). بالإضافة إلى ذلك ، قد لا يحاكي كبت المناعة الناجم عن الكورتيكوستيرويد المستخدم في الفئران لتطوير العدوى الفموية حالات نقص المناعة الأخرى ، مثل تلك الناتجة عن الإصابة بفيروس نقص المناعة البشرية. قد تكون هناك أيضا اختلافات في الظروف المضيفة لتطوير OC ، مثل الجراثيم الفموية للفئران والبشر. وينبغي توسيع نطاق هذا البروتوكول لتقييم الأغشية الحيوية المختلطة التي يشكلها أكثر من نوع واحد أو سلالات مختلفة من نفس النوع. علاوة على ذلك ، فإن إبقاء الفئران مخدرة بشكل كاف ومنع انخفاض حرارة الجسم مع تجنب الوفيات المرتبطة بالتخدير هي أصعب خطوات البروتوكول.
Acknowledgements
يشكر المؤلفون الدعم المالي من FAPESP (مؤسسة أبحاث ساو باولو ، رقم العملية FAPESP # 2013 / 07276-1 (CePID CePOF) و 2008 / 00601-6. كما نشكر الدكتورة آنا باولا سيلفا على تقديم المعلومات حول الملح القابل للذوبان في الماء القائم على CUR.
Materials
| Name | Company | Catalog Number | Comments |
| C. albicans | ATCC (Rockville, Md, USA) | 90028 | Used to prepare the Candida inoculum |
| Centrifuge | Eppendorf Centrifuge 5804/5804R,B. Braun, Melsungen, Hesse, Germany | 022628146 (NA) | Used to prepare the Candida inoculum |
| Chlorpromazine chloride 2 mg/mL | Compounding pharmacy, Araraquara, SP, Brazil | - | Used to sedate animals during candida inoculation |
| Curcumin-based water-soluble salt | PDTPharma, Cravinhos, Brazil | - | Consisting of 53.4% of natural curcumin, and 46.6% of other curcuminoids (demethoxycurcumin and bis-demethoxycurcumin). Prepared in water and N-MethylD-Glucamine (final average molecular weight of 730.32 g.mol−1) |
| Digital colony counter | CP 600 Plus, Phoenix Ind Com Equipamentos Científicos Ltda, Araraquara, SP, Brazil | - | Used to count colonies on agar plates |
| Extruded mouse chow | Benelab food, Industry Qualy Animal Nutrition and Commerce Ltda., Lindóia, São Paulo State, Brazil. | - | Used for the feeding of the mice |
| Ketamine Hydrochloride 10% | Ketamina Agener, União Química Farmacêutica Nacional S/A, Embu-Guaçu, SP, Brazil | - | Used to anesthetize animals before treatments and for euthanasia |
| Light-emitting diode handpiece (prototype) | Instituto de Física de São Carlos, University of São Paulo, São Carlos, SP, Brazil | - | Fabricated with LXHL-PR09, Luxeon III Emitter, Lumileds Lighting, San Jose, California, USA |
| Methylprednisolone acetate 40 mg | DEPO-MEDROL, Pfizer, New York | - | Used as an immunosuppressant |
| Microtome | Leica Microsystems, Bannockburn, IL, USA | SM2500 | Used to cut the serial sections of the tongues |
| Propylene boxes (cages housing) H13 x L20 x D30 cm | Bonther Equipaments, Ribeirão Preto, SP, Brazil | - | Used to keep the animals throughout the experimental period |
| Sabouraud Dextrose Agar with Chloramphenicol | HiMedia, Mumbai, India | MM1067-500G | Culture medium for yeast growth (agar) |
| Spectrophotometer | Spectrophotometer Kasvi K37-VIS , São José dos Pinhais, PR, Brazil | K37-VIS | Used to standardize the inoculum concentration |
| Tetracycline hydrochloride | Compounding pharmacy, Araraquara, SP, Brazil | - | Antibiotic given to induce oral dysbiosis |
| Wood shavings | J.R. Wood Shavings, Comerce of Sawdust Ltda., Conchal, São Paulo State, Brazil | - | Used for floor covering inside the housing boxes |
| Xylazine 2% | Calmiun, União Química Farmacêutica Nacional S/A, Embu-Guaçu, SP, Brazil | - | Used in combination with ketamine for anesthesia |
| Yeast Nitrogen Broth | Difco, InterLab, Detroit, MI, USA | DF0919-07-3 | Culture medium for yeast growth (broth) |
| Yeast Peptone Dextrose Broth | NutriSelect Basic, Sigma Aldrich | Y1375 | Culture medium for maintaining the strains at -80°C and grow |
References
- Vila, T., Sultan, A. S., Montelongo-Jauregui, D., Jabra-Rizk, M. A. Oral candidiasis: a disease of opportunity. Journal of fungi (Basel, Switzerland). 6 (1), 15(2020).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Moyes, D. L., Richardson, J. P., Naglik, J. R. Candida albicans-epithelial interactions and pathogenicity mechanisms: scratching the surface. Virulence. 6 (4), 338-346 (2015).
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Quindós, G., et al. Therapeutic tools for oral candidiasis: Current and new antifungal drugs. Medicina oral, patologia oral y cirugia buccal. 24 (2), e172-e180 (2019).
- Nishimoto, A. T., Sharma, C., Rogers, P. D. Molecular and genetic basis of azole antifungal resistance in the opportunistic pathogenic fungus Candida albicans. Journal of Antimicrobial Chemotherapy. 75 (2), 257-270 (2020).
- Gholami, L., Shahabi, S., Jazaeri, M., Hadilou, M., Fekrazad, R. Clinical applications of antimicrobial photodynamic therapy in dentistry. Frontiers in Microbiology. 13, 1020995(2013).
- Trigo-Gutierrez, J. K., Vega-Chacón, Y., Soares, A. B., Mima, E. G. O. Antimicrobial activity of curcumin in nanoformulations: a comprehensive review. International Journal of Molecular Sciences. 22 (13), 7130(2021).
- Santezi, C., Reina, B. D., Dovigo, L. N. Curcumin-mediated Photodynamic Therapy for the treatment of oral infections-A review. Photodiagnosis and Photodynamic Therapy. 21, 409-415 (2018).
- Dovigo, L. N., et al. Curcumin-mediated photodynamic inactivation of Candida albicans in a murine model of oral candidiasis. Medical Mycology. 51 (3), 243-251 (2013).
- Zangirolami, A. C., Carbinatto, F., Filho, J. D. V., Bagnato, V. S., Blanco, K. C. Impact of light-activated curcumin and curcuminoids films for catheters decontamination. Colloids and SurfacesB: Biointerfaces. 213, 112386(2022).
- Santezi, C., Tanomaru, J. M., Bagnato, V. S., Júnior, O. B., Dovigo, L. N. Potential of curcumin-mediated photodynamic inactivation to reduce oral colonization. Photodiagnosis Photodynamic Therapy. 15, 46-52 (2016).
- Takakura, N., et al. A novel murine model of oral candidiasis with local symptoms characteristic of oral thrush. Microbiology and immunology. 47 (5), 321-326 (2003).
- Mima, E. G., et al. Susceptibility of Candida albicans to photodynamic therapy in a murine model of oral candidosis. OralSurgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology. 109, 392-401 (2010).
- Solis, N. V., Filler, S. G. Mouse model of oropharyngeal candidiasis. Nature Protocol. 7 (4), 637-642 (2012).
- Marôco, J. Análise Estatística com o SPSS Statistics 25. , ReportNumber 7th ed, Lisboa, Portugal. (2018).
- Naglik, J. R., Fidel, P. L. Jr, Odds, F. C. Animal models of mucosal Candida infection. FEMS Microbiology Letters. 283 (2), 129-139 (2008).
- Samaranayake, Y. H., Samaranayake, L. P. Experimental oral candidiasis in animal models. Clinical Microbiology Reviews. 14, 398-429 (2001).
- Chamilos, G., Lionakis, M. S., Lewis, R. E., Kontoyiannis, D. P. Role of mini-host models in the study of medically important fungi. The Lancet Infectious Diseases. 7, 42-55 (2007).
- Carmello, J. C., et al. Treatment of oral candidiasis using Photodithazine- mediated photodynamic therapy in vivo. PLoS One. 11 (6), e0156947(2016).
- Sakima, V. T., et al. Antimicrobial photodynamic therapy mediated by curcumin-loaded polymeric nanoparticles in a murine model of oral candidiasis. Molecules. 23 (8), 2075(2018).
- Abe, S., et al. A glucocorticoid antagonist, mifepristone affects anti-Candida activity of murine neutrophils in the presence of prednisolone in vitro and experimental candidiasis of prednisolone-treated mice in vivo. FEMS Immunology and Medical Microbiology. 13 (4), 311-316 (1996).
- Jones, J. H., Russell, C., Young, C., Owen, D. Tetracycline and the colonization and infection of the mouths of germ-free and conventionalized rats with Candida albicans. Journal Antimicrobial Chemotherapy. 2 (3), 247-253 (1976).
- Russell, C., Jones, J. H. Effects of oral inoculation of Candida albicans in tetracycline-treated rats. Journal of Medical Microbiology. 6 (3), 275-279 (1973).
- Teichert, M. C., Jones, J. W., Usacheva, M. N., Biel, M. A. Treatment of oral candidiasis with methylene blue- mediated photodynamic therapy in an immunodeficient murine model. OralSurgery, Medicine, Pathology, Radiology and Endodontology. 93, 155-160 (2002).
- Totti, M. G. A., Santos, E. B., Almeida, O. P., Koga-Ito, C. Y., Jorge, A. O. C. Oral candidosis by Candida albicans in normal and xerostomic mice. Brazilian Oral Research. 18, 202-207 (2004).
- Hidalgo, K. J. R., et al. Antimicrobial photodynamic therapy in combination with nystatin in the treatment of experimental oral candidiasis induced by Candida albicans resistant to fluconazole. Pharmaceuticals (Basel). 12 (3), E140(2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved