Method Article
Terapia fotodinâmica antimicrobiana mediada por curcuminóides em um modelo murino de candidíase oral
Neste Artigo
Resumo
Este protocolo descreve a aplicação da Terapia Fotodinâmica Antimicrobiana (TFDa) em um modelo murino de candidíase oral. A aPDT foi realizada usando uma mistura solúvel em água de curcuminóides e luz LED azul.
Resumo
A Terapia Fotodinâmica Antimicrobiana (TFDa) tem sido extensivamente investigada in vitro, e modelos animais pré-clínicos de infecções são adequados para avaliar tratamentos alternativos antes de ensaios clínicos. Este estudo descreve a eficácia da aPDT em um modelo murino de candidíase oral. Quarenta camundongos foram imunossuprimidos com injeções subcutâneas de prednisolona, e suas línguas foram inoculadas com swab oral previamente embebido em suspensão celular de C. albicans . A tetraciclina foi administrada via água potável durante o curso do experimento. Cinco dias após a inoculação fúngica, os camundongos foram distribuídos aleatoriamente em oito grupos; Um nono grupo de camundongos não infectados não tratados foi incluído como controle negativo (n = 5). Três concentrações (20 μM, 40 μM e 80 μM) de uma mistura de curcuminóides foram testadas com luz LED azul (89,2 mW/cm2; ~455 nm) e sem luz (grupos C+L+ e C+L-, respectivamente). Animais leves (C-L+), sem tratamento (C-L-) e sem infecção foram avaliados como controles. Os dados foram analisados por ANOVA de Welch e Games-Howell (α = 0,05). A candidíase oral foi estabelecida em todos os animais infectados e visualizada macroscopicamente através da presença de manchas brancas características ou pseudomembranas no dorso da língua. Cortes histopatológicos confirmaram grande presença de leveduras e filamentos limitados à camada queratinizada do epitélio no grupo C-L-, e a presença de células fúngicas foi visualmente diminuída nas imagens obtidas de camundongos submetidos à aPDT com curcuminóides de 40 μM ou 80 μM. A aPDT mediada por 80 μM de curcuminóides promoveu uma redução de 2,47 log10 na contagem de colônias em comparação com aquelas no grupo C-L- (p = 0,008). Todos os outros grupos não apresentaram redução estatisticamente significativa no número de colônias, incluindo os grupos fotossensibilizador (C+L-) ou somente luz (C-L+). A aPDT mediada por curcuminóides reduziu a carga fúngica das línguas de camundongos.
Introdução
A candidíase oral (CO) é a principal infecção fúngica da cavidade oral; é causada pelo crescimento excessivo de Candida spp. Os fatores predisponentes para FO incluem disfunção endócrina, uso de antibióticos de amplo espectro, radioterapia e quimioterapia, deficiências nutricionais, xerostomia (baixo fluxo salivar), uso de próteses dentárias, falta de higiene e, principalmente, imunossupressão1. Entre as espécies de Candida , Candida albicans é a mais prevalente e virulenta; É encontrada como uma espécie comensal no corpo humano e como um patógeno oportunista. C. albicans tem a capacidade de alterar sua morfologia de leveduras comensais (blastóporos) para filamentos patogênicos (hifas e pseudo-hifas)2. As formas filamentosas, especialmente as hifas, podem invadir o epitélio do hospedeiro por endocitose ou penetração ativa, causandoinfecção3. Outros fatores de virulência de C. albicans incluem adesão, formação de biofilme e secreção de enzimas e toxinas lipolíticas e hidrolíticas, como lipases, fosfolipases, proteinases e candidalisina4.
O tratamento da CO envolve o uso de antifúngicos, especialmente polienos e azólicos tópicos (nistatina e miconazol)5. No entanto, apresentam eficácia em curto prazo, sendo frequente a recorrência. Além disso, o uso excessivo de antifúngicos tem gerado o problema do desenvolvimento e disseminação de resistência antifúngica6. Portanto, terapias alternativas são necessárias, como a Terapia Fotodinâmica Antimicrobiana (TFDa), que combina um fotossensibilizador (PS) e luz em um comprimento de onda apropriado (o mesmo da absorção do PS) na presença de oxigênio. As PSs são ligadas ou absorvidas pelas células e, quando ativadas pela luz, produzem espécies reativas de oxigênio (EROs) tóxicas para as células sensibilizadas7.
Na aPDT, um dos fotossensibilizadores (PSs) empregados é a curcumina (CUR), um composto natural extraído dos rizomas da planta cúrcuma (Curcuma longa L.). A curcumina possui inúmeros atributos terapêuticos, incluindo capacidades anti-inflamatórias, antioxidantes, anticancerígenas e antimicrobianas 8,9. Uma investigação anterior constatou que a TFD utilizando CUR efetivamente diminuiu C. albicans em um modelo murino de candidíase oral sem causar qualquer dano aos tecidos do hospedeiro10. CUR é o principal curcuminóide extraído da cúrcuma, Mas outros polifenóis, como demetoxicurcumina e bis-demetoxicurcumina, também são encontrados nesta planta. A aPDT mediada por curcuminóides demonstrou atividade antibacteriana contra biofilmes de Staphylococcus aureus cultivados em cateteres11. No entanto, até onde sabemos, sua atividade antifúngica contra C. albicans permanece obscura. Portanto, neste estudo, avaliamos a aPDT mediada por um sal curcuminóide contra C. albicans em um modelo murino de CO.
Protocolo
O protocolo de pesquisa para o uso de camundongos foi aprovado pelo Comitê de Ética no Uso de Animais (processos números 05/2008 e 09/2020) da Faculdade de Odontologia de Araraquara, UNESP. C. albicans (ATCC 90028) foi utilizada como cepa de referência. Camundongos Swiss fêmeas com seis semanas de idade (n = 45), com uma faixa de massa corporal de 20-30 g, foram utilizados para o presente estudo. Os animais foram fornecidos pela Universidade Estadual Paulista, UNESP, Botucatu.
1. Preparação do PS e seleção da fonte de luz para aPDT
- Preparar o PS de acordo com as especificações da substância a ensaiar.
NOTA: Neste estudo, uma mistura solúvel em água de curcuminóides (mistura de sal solúvel em água à base de CUR12) foi usada como PS (ver Tabela de Materiais e Figura 1). Diluições de 20 μM, 40 μM e 80 μM (15,6, 29,2 e 58,4 mg/L, respectivamente) foram preparadas em água ultrapura imediatamente antes do uso e mantidas a 5 °C. - Selecionar um equipamento de luz com comprimento de onda apropriado (o mesmo da absorção PS) capaz de iluminar todo o alvo fotossensibilizado uniformemente e simultaneamente sem aquecer o tecido.
OBS: Neste estudo, foi utilizada uma peça de mão contendo diodo emissor de luz (LED, ver Tabela de Materiais), projetada no Instituto de Física de São Carlos (Universidade de São Paulo, São Carlos, SP, Brasil). A potência de saída fornecida pela luz foi de 89,2 mW/cm2 a um comprimento de onda azul de aproximadamente 455 nm.
2. Preparação do inóculo de C. albicans
- Manter a estirpe de referência C. albicans (ATCC 90028) em levedura-peptona-glicose (YEPD, ver Tabela de Materiais) com 50% de glicerol a -80 °C até à utilização.
- Descongelar a estirpe congelada à temperatura ambiente, espalhar uma alíquota de 100 μL numa placa de Petri com ágar Sabouraud dextrose (SDA) com cloranfenicol (ver Tabela de Materiais) e incubar a 37 °C durante 48 horas.
- Transferir cinco colônias para 10 mL de caldo nitrogenado de levedura com meio de glicose a 2% (YNBg) e crescer aerobicamente a 37 °C por 16 h.
- Diluir a cultura de levedura em YNBg fresco (1:10) e incubar aerobicamente a 37 °C até que a densidade óptica atinja a fase logarítmica média de crescimento.
OBS: Padronizar previamente a curva de crescimento microbiano para cada laboratório. Na presente pesquisa, as culturas foram incubadas por cerca de 8 h, até atingirem a fase logarítmica média de crescimento, como indicado pela densidade óptica a 540 nm (OD540), com valor médio de 0,536 ± 0,062 unidades arbitrárias (média ± desvio padrão [DP]). - Centrifugar a cultura a 5.000 x g à temperatura ambiente por 5 min, descartar o sobrenadante e lavar o pellet duas vezes com o mesmo volume de solução salina tamponada com fosfato estéril (PBS; 0,136 M NaCl, 2 mM KCl, 1 mM KH2PO4, 10 mM Na2HPO4, pH 7,4).
- Use alíquotas de 100 μL para realizar quatro diluições seriadas de 10 vezes em PBS, espalhe diluições em placas de SDA e incube a 37 °C por 48 h para contagem de colônias. Como padrão, suspensões fúngicas são usadas em concentrações de aproximadamente 4,5 × 107 unidades formadoras de colônias por mililitro (UFC/mL)].
3. Indução de CO em camundongos
OBS: A seguinte metodologia foi previamente descrita por Takakura et al.13 e reproduzida por nossogrupo10,14, com algumas modificações.
- Camundongos distribuídos aleatoriamente em nove grupos (n = 5), correspondendo ao mesmo número de tratamentos (Arquivo Suplementar 1).
NOTA: A cavidade oral de camundongos deve ser negativa para o crescimento de Candida . Isso precisa ser verificado por swab da cavidade oral e plaqueamento da amostra em SDA. - Manter os animais em caixas de propileno10 (5 ratos por caixa, máx.), com aparas de madeira para revestimento do piso, num biotério com temperatura controlada a 23 ± 2 °C sob um ciclo claro/escuro de 12/12 h. Não é necessário fornecer nenhum enriquecimento específico.
- Manter camundongos em dieta extrusada de camundongos e água filtrada ad libitum.
- Injetar subcutaneamente a droga imunossupressora, prednisolona (100 mg/kg de peso corporal, ver Tabela de Materiais), pela primeira vez no primeiro dia a todos os membros dos grupos C+L+ 20, C+L+ 40, C+L+ 80, C+L- 20 μM, C+L- 40, C+L- 80, C-L+ e C-L- (Arquivo Suplementar 1).
NOTA: Mantenha ratos do mesmo grupo na mesma caixa e monitore-os diariamente para qualquer sinal de estresse e perda de peso. Procure aconselhamento veterinário para analgésicos ou alimentos / água alterados se o estresse ou perda de peso são observados.. - A partir do primeiro dia e até o final do experimento, fornecer cloridrato de tetraciclina em água de beber a 0,83 mg/mL13.
- Inocular línguas de camundongos no segundo dia, incluindo os grupos C+L+ 20, C+L+ 40, C+L+ 80, C+L- 20, C+L- 40, C+L- 80, C-L+ e C-L- (Arquivo Suplementar 1), com o inóculo de C. albicans . Não inocular os ratinhos do grupo de controlo negativo (NCtrl).
- Sedar os animais por injeção intramuscular de 10 mg/kg de cloreto de clorpromazina (ver Tabela de Materiais) em cada músculo da coxa antes de realizar a inoculação.
- Realizar a inoculação intraoral dos camundongos mergulhando um swab estéril (um por animal) em uma suspensão padronizada de C. albicans recém-preparada (ou seja, preparada imediatamente antes da inoculação).
- Coloque camundongos sedados em decúbito dorsal. Puxe suavemente a língua para fora da boca usando uma pinça estéril. Esfregue a língua de cada rato com um cotonete embebido por 30 s. Monitore camundongos até que eles se recuperem da sedação.
- No quinto dia, administrar uma injeção subcutânea complementar de prednisolona (100 mg/kg de peso corporal) para manter a imunossupressão.
NOTA: Este protocolo é adequado para manter a infecção por 7 dias após a inoculação intraoral. A linha do tempo do protocolo é mostrada na Figura 2.
4. Terapia fotodinâmica antimicrobiana e recuperação de C. albicans de lesões bucais
- No sétimo dia, antes do tratamento, anestesiar os animais com uma injeção intraperitoneal de cloridrato de cetamina (100 mg/kg de peso corporal) combinado com xilazina (10 mg/kg de peso corporal) (ver Tabela de Materiais).
- Colocar cada animal em decúbito dorsal sobre um dispositivode almofada 14,15 equipado com fios de aço inoxidável que podem ser enrolados ao redor dos incisivos para manter a boca aberta.
OBS: As almofadas isotérmicas são recomendadas para aquecer os camundongos enquanto estão sedados, prevenindo a hipotermia à temperatura ambiente e evitando mortalidade relacionada à anestesia15. Cada animal anestesiado deve ser monitorado pela ausência de um reflexo de retirada quando os dedos são pinçados para confirmar a profundidade da anestesia. Uma dose de manutenção de cetamina a 1/3 da dose original (sem xilazina) pode ser administrada se necessário. - Com a mandíbula e as bochechas retraídas, coloque suavemente a língua fora da boca.
- Para camundongos do grupo C+L+, pipetar 70 μL do PS no dorso da língua (em uma das concentrações testadas). Manter os ratos em um ambiente escuro por uma duração de 20 minutos como um período de pré-irradiação. Certifique-se de que, durante esse tempo, a língua de cada animal permaneça posicionada dentro da cavidade oral para evitar que o fotossensibilizador (PS) seja ingerido.
- Após o período de fotossensibilização, puxe a língua para fora da boca para iluminação. Coloque o dispositivo de LED no dorso da língua e acenda a 37,5 J/cm2 (7 min com o presente dispositivo) (Figura 3).
- Para os animais dos grupos C+L-, pipetar 70 μL do PS em uma das concentrações testadas no dorso da língua e mantê-los no escuro por 27 min.
- Para os animais do grupo C-L+ (tratados com luz sem fotossensibilização prévia), pipetar 70 μL de solução salina estéril no dorso da língua. Mantenha os ratos no escuro por 20 min e, em seguida, ilumine suas línguas a 37,5 J/cm2 (7 min com o presente dispositivo).
- Para camundongos do grupo C-L- (não tratados com PS nem com luz), pipetar 70 μL de solução salina estéril no dorso da língua e mantê-los no escuro por 27 min.
- Recuperar C. albicans das línguas de todos os ratos imediatamente após o tratamento. Esfregue o dorso da língua por 1 min com um cotonete estéril.
- Coloque cada swab de amostra em um tubo contendo 1 mL de solução salina estéril e vórtice por 1 min para ressuspender as células microbianas.
- Realizar imediatamente diluições seriadas de 10 vezes em PBS e alíquotas de placa de 25 μL sobre placas SDA em duplicata. Incubar as placas por via aeróbia a 37 °C durante 48 horas.
- Após 48 h, use um contador de colônias digital (consulte Tabela de Materiais) para determinar as contagens de colônias de leveduras. Calcular a carga de C. albicans (UFC/mL) para cada animal.
- Transformar os valores de UFC/mL em log10 e analisar adequadamente de acordo com o planejamento do experimento e as premissas dos dados.
LEGENDA: No presente estudo, foi utilizada a ANOVA one-way de Welch e o teste post-hoc de Games-Howell (α = 0,05)16 .
5. Análise histopatológica
- No oitavo dia, anestesiar camundongos com cetamina a 100 mg/kg combinada com xilazina a 10 mg/kg por injeção intraperitonial e eutanasiá-los com uma overdose de cetamina (200 mg/kg administrada por via intraperiotonial). Confirme a morte verificando a ausência de movimento respiratório (apneia) e ausência de batimentos cardíacos (assistolia).
- Aperte cuidadosamente a língua e retire-a da boca do animal. Com o uso de bisturi manual, faça uma incisão antes das papilas circunvaladas para remover cirurgicamente toda a língua sem causar lesões nas regiões anterior e central.
- Fixar a língua em formalina tamponada a 10% (pH 7,2-7,4) por 24 h e lavá-la em água corrente por 2 h.
- Proceder com a inclusão no processo de parafina: desidratação, clarificação e impregnação10,14.
- Corte seções seriais (5 μm de espessura) usando um micrótomo e, em seguida, afixe as seções em lâminas de vidro. Proceder à coloração destes cortes utilizando ácido periódico de Schiff e hematoxilina (PAS-H) para exame histopatológico e identificação de fungos através de observação ao microscópio de luz.
- Peça a um patologista, de preferência cego para os grupos estudados, para examinar a reação tecidual devido à infecção por C. albicans .
- Descrever as características histológicas do tecido (epitélio e tecido conjuntivo), especialmente as respostas inflamatórias locais de intensidades variáveis.
Resultados
O modelo murino de CO mostrou manchas brancas típicas e pseudomembranas na língua de todos os camundongos infectados (Figura 4A). C. albicans recuperados de animais C-L- confirmaram a colonização tecidual por este microrganismo (valores variaram de 1,62 x 104 a 4,80 x 105 UFC/mL). Como esperado, os animais do grupo NCtr não apresentaram alterações teciduais ou crescimento de colônias após a amostragem (Figura 4B).
A aPDT diminuiu a viabilidade de C. albicans quando curcuminóides foram usados a 80 μM para fotossensibilização (Figura 5). A redução média do log10 obtida com 80 μM de aPDT mediada por PS foi de 2,47, comparada ao grupo C-L- (p = 0,008).
O número de colônias de C. albicans recuperadas de línguas de camundongos não foi significativamente diferente entre camundongos tratados com curcuminóides sem iluminação (grupos C+L-), camundongos tratados com luz, mas não previamente fotossensibilizados (grupos C-L+) e camundongos não tratados (grupo C-L-) (p ≥ 0,210).
As características histológicas das línguas dos animais não infectados (NCtr) mostraram tecidos normais/sadios, incluindo lâmina própria íntegra, membrana basal e papilas filiformes (Figura 6A). Em contraste, ao examinar as imagens histopatológicas das línguas dos camundongos do grupo C-L-, ficou evidente a presença de leveduras e filamentos na camada queratinizada do epitélio, embora não houvesse infiltração de fungos. No tecido conjuntivo subjacente, observou-se discreta resposta inflamatória, mediada primariamente por células mononucleares, e as papilas filiformes estavam notavelmente ausentes (Figura 6B). A análise histológica das línguas de camundongos nos grupos C+L- e C-L+ apresentou características semelhantes. Em contraste, os cortes da língua de camundongos tratados com 80 μM de aPDT mediada por curcuminóides revelaram um número reduzido de células fúngicas, principalmente limitadas à camada queratinizada do epitélio (Figura 6C).
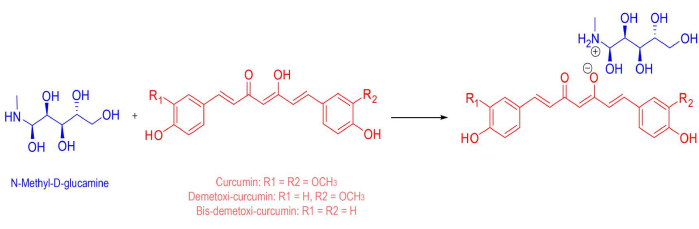
Figura 1: Estrutura química do fotossensibilizador. A estrutura química da mistura de sal solúvel em água usada como fotossensibilizador, compreendendo 53,4% curcumina natural e 46,6% outros curcuminóides (demetoxicurcumina e bis-demetoxicurcumina). O peso molecular médio final é de 730,32 g/mol. Clique aqui para ver uma versão maior desta figura.
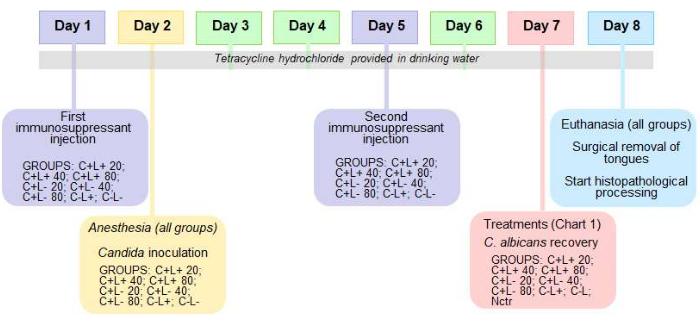
Figura 2: Linha do tempo do protocolo para o modelo murino de candidíase oral e aPDT. Uma linha do tempo delineando o protocolo para o modelo murino de candidíase oral e terapia fotodinâmica antimicrobiana (aPDT). Clique aqui para ver uma versão maior desta figura.
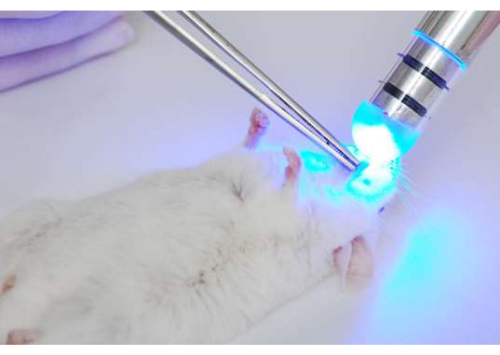
Figura 3: Iluminação da língua de camundongos após fotossensibilização. Após a fotossensibilização (incubação do tecido infectado com o fotossensibilizador), as línguas foram iluminadas a 37,5 J/cm2 usando uma luz LED azul (~455 nm). Clique aqui para ver uma versão maior desta figura.

Figura 4: Lesões brancas no modelo murino de candidíase oral. (A) Imagens representativas das lesões brancas observadas no modelo murino de candidíase oral. (B) Controle negativo (não infectado). Clique aqui para ver uma versão maior desta figura.
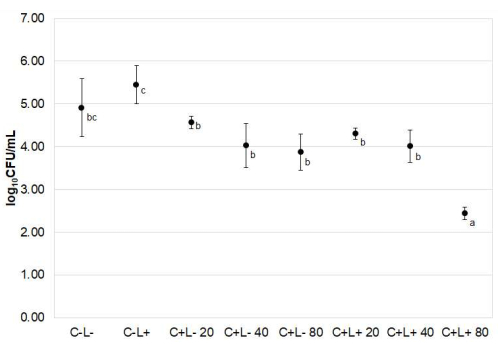
Figura 5: Candida albicans recuperada da língua de camundongos. Os dados representam valores médios ± desvio padrão do log10 (UFC/mL) dos grupos de tratamento. A ANOVA one-way de Welch indicou que os efeitos dos tratamentos foram estatisticamente diferentes entre os grupos (p < 0,001). Letras minúsculas diferentes (a, b, c) próximas às médias indicam diferenças estatisticamente significativas de acordo com o teste de Games-Howell (p≤ 0,030). Clique aqui para ver uma versão maior desta figura.
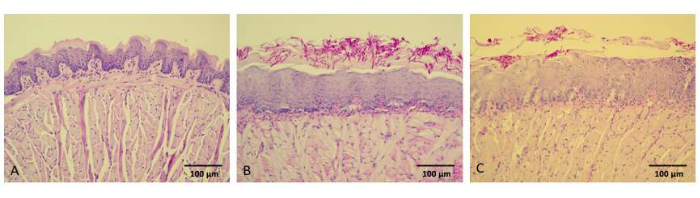
Figura 6: Imagens representativas de cortes histológicos de línguas de camundongos. Cortes histológicos de línguas de camundongos foram corados com PAS-H, e as imagens foram capturadas em 200x. (A) Camundongos controle negativo sem candidíase oral induzida, fotossensibilização e iluminação (grupo NCtr). (B) Camundongos com candidíase oral induzida, não fotossensibilizados nem expostos à iluminação LED (grupo C-L-). (C) Animais com candidíase oral induzida, expostos a 80 μM de curcuminóides e iluminação LED de 37,5 J/cm2 (grupo C+L+ 80). Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Grupos experimentais. Lista dos grupos experimentais utilizados no presente estudo. Clique aqui para baixar este arquivo.
Discussão
C. albicans tem sido associada a infecções orais e esofágicas em indivíduos com estado de imunocomprometimento, diabetes mellitus, uso prolongado de antibióticos e higiene oral deficiente 1,3. O estudo de doenças infecciosas humanas requer investigações in vitro e in vivo antes que os ensaios clínicos possam ser projetados com segurança e precisão. O presente estudo descreve um método para estabelecer um modelo murino de CO, que pode ser usado para avaliar a patogênese de infecções orais por C. albicans e a eficácia de abordagens antifúngicas 15,16,17,18,19.
O modelo murino de CO aqui empregado foi estabelecido com sucesso, como evidenciado pela substancial recuperação da carga fúngica das lesões, bem como pelas características características de infecção observadas nas análises macroscópicas e histopatológicas das línguas de camundongos infectados. Muitos estudos têm utilizado modelos murinos semelhantes de CO. Nesses modelos, camundongos fêmeas são imunossuprimidos e inoculados com C. albicans, resultando em lesões na língua10,13,14,15,20,21. A imunossupressão com prednisolona, um glicocorticoide, inibe a atividade dos neutrófilos contra C. albicans22. Neste estudo, camundongos fêmeas foram imunossuprimidos com duas injeções subcutâneas de prednisolona, um dia antes e três dias após a infecção por C. albicans13. Além disso, a administração de tetraciclina em água potável durante o curso do experimento causou disbiose oral por perturbar as bactérias orais e ajudar C. albicans a prosperar23,24. Além disso, a sedação causada pela injeção intramuscular de cloreto de clorpromazina impediu que os animais bebessem água e se alimentassem imediatamente após a inoculação. Assim, as células fúngicas permaneceram em contato com o dorso da língua por mais tempo, possibilitando o desenvolvimento de tubos germinativos e a transição de leveduras para filamentos (hifas e pseudo-hifas), que são as morfologias patogênicas de C. albicans que podem invadir o epitélio humano. Teichert et al.25 utilizaram um protocolo de imunodeficiência para induzir CO em camundongos e recuperaram apenas 2 x 102 UFC/mL de C. albicans.
Enquanto Totti et al.26 utilizaram camundongos sialoadenectomizados e realizaram quatro inoculações separadas com uma suspensão de C. albicans , vale ressaltar que, no caso deles, a infecção não se manteve na maioria dos animais ao longo do experimento. Por outro lado, no presente estudo, a inoculação com células fúngicas foi realizada uma única vez, resultando na recuperação de 10a 4 UFC/mL de C. albicans da cavidade oral. Este estudo empregou o modelo murino de candidíase descrito por Takakura et al.13, que realizaram inoculação oral com uma cepa clínica isolada de um paciente com candidíase cutânea (106 UFC/mL). Três a sete dias após a inoculação, 105-10 6 UFC/mL de C. albicans foram recuperados da cavidade oral de camundongos13. As diferenças entre o método de Takakura et al.13 e este estudo incluem o uso de diferentes concentrações fúngicas no inóculo (este estudo utilizou 107 UFC/mL de C. albicans) e diferentes cepas de C. albicans para inoculação oral (a cepa de referência ATCC 90028 foi usada aqui). Carmello et al.20 empregaram protocolo semelhante, que envolveu o uso de animais imunossuprimidos. No entanto, eles administraram duas injeções subcutâneas adicionais de prednisolona aos animais nos dias 1, 5, 9 e 13 do experimento. Seu estudo revelou uma correlação positiva entre os escores atribuídos às lesões orais dos animais infectados e o número de UFC/mL em um período que variou de 5 a 16 dias pós-infecção. Está bem estabelecido em pesquisas anteriores que é crucial monitorar de perto os animais sob anestesia para prevenir a hipotermia. Doses adicionais de manutenção de cetamina devem ser administradas com critério, somente quando necessário27.
Em relação à eficácia da aplicação de aPDT, os resultados mostraram que a irradiação de línguas previamente tratadas com uma mistura de sal curcuminóide de 80 μM causou uma redução significativa (2,47 log10) na viabilidade de C. albicans. As análises histológicas revelaram que cortes de línguas tratadas com 80 μM de aPDT mediada por curcuminóides mostraram um número reduzido de células fúngicas, que estavam limitadas à camada queratinizada, e uma baixa resposta inflamatória. Vale ressaltar que uma resposta inflamatória foi detectada em todos os camundongos infectados por C. albicans. Essa observação implica que a inflamação observada em todos os grupos de TFDa pode estar ligada à infecção por Candida e não ser atribuída à aPDT, um achado consistente em concordância com nossas investigações anteriores 10,13,14,15.
Investigações anteriores utilizaram CUR, azul de metileno e fotoditazina (PDZ) como PSs e obtiveram resultados promissores 10,20,24,25,27. Em um estudo semelhante10, uma exposição combinada à luz CUR e LED causou uma redução significativa na viabilidade de C. albicans; entretanto, o uso de 80 μM de CUR e luz reduziu a viabilidade fúngica em 4,0 log10. Dovigo et al.10 utilizaram apenas CUR como SP, enquanto que usamos um sal contendo os três principais curcuminóides de C. longa. Quando CUR (260 μM) e LED light foram utilizados por cinco dias consecutivos no tratamento da candidíase oral em camundongos, os autores observaram uma redução de 1,11 log10 na viabilidade fúngica21. Quando o azul de metileno foi utilizado como PS a 450 μg/mL e 500 μg/mL, a aPDT erradicou totalmente C. albicans da cavidade oral de camundongos25. Além disso, quando a aPDT foi mediada por PDZ (100 mg/L), observou-se redução de 3,0 log10 e remissão completa das lesões bucais20. Além disso, a aPDT aumentou a expressão do TNF-α em comparação com o grupo não tratado20. Em um estudo em que foi utilizada uma cepa resistente ao fluconazol, a aPDT mediada por PDZ (200 mg/L) promoveu uma redução equivalente a 1,3 log1027. Além disso, a combinação de aPDT com nistatina resultou em substancial redução da viabilidade fúngica, com redução de 2,6 log10, melhora notável das lesões orais e redução da resposta inflamatória27. Coletivamente, esses estudos fornecem evidências convincentes da eficácia da aPDT na redução da carga fúngica dentro do modelo murino de candidíase oral, ressaltando seu potencial como opção de tratamento clínico devido à sua eficácia antimicrobiana sem causar danos aos tecidos do hospedeiro.
Em conclusão, o modelo murino de CO utilizado neste estudo é apropriado para mimetizar infecção e avaliar a eficácia da aPDT. Como limitação, o modelo de CO utilizado aqui empregou apenas uma cepa referência de C. albicans (outras cepas, isolados clínicos e espécies de Candida não-albicans não foram avaliadas). Além disso, a imunossupressão induzida por corticosteroides usada em camundongos para desenvolver infecção oral pode não mimetizar outros estados de imunodeficiência, como o devido à infecção pelo HIV. Também pode haver diferenças nas condições do hospedeiro para o desenvolvimento de CO, como a microbiota oral de camundongos e humanos. Este protocolo deve ser expandido para avaliar biofilmes mistos formados por mais de uma espécie ou por diferentes linhagens da mesma espécie. Além disso, manter camundongos adequadamente sedados e prevenir a hipotermia, evitando mortalidade relacionada à anestesia, são as etapas mais difíceis do protocolo.
Agradecimentos
Os autores agradecem o apoio financeiro da FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo, processo número FAPESP #2013/07276-1 (CePID CePOF) e 2008/00601-6. Agradecemos também à Dra. Ana Paula Silva por fornecer as informações sobre o sal solúvel em água à base de CUR.
Materiais
| Name | Company | Catalog Number | Comments |
| C. albicans | ATCC (Rockville, Md, USA) | 90028 | Used to prepare the Candida inoculum |
| Centrifuge | Eppendorf Centrifuge 5804/5804R,B. Braun, Melsungen, Hesse, Germany | 022628146 (NA) | Used to prepare the Candida inoculum |
| Chlorpromazine chloride 2 mg/mL | Compounding pharmacy, Araraquara, SP, Brazil | - | Used to sedate animals during candida inoculation |
| Curcumin-based water-soluble salt | PDTPharma, Cravinhos, Brazil | - | Consisting of 53.4% of natural curcumin, and 46.6% of other curcuminoids (demethoxycurcumin and bis-demethoxycurcumin). Prepared in water and N-MethylD-Glucamine (final average molecular weight of 730.32 g.mol−1) |
| Digital colony counter | CP 600 Plus, Phoenix Ind Com Equipamentos Científicos Ltda, Araraquara, SP, Brazil | - | Used to count colonies on agar plates |
| Extruded mouse chow | Benelab food, Industry Qualy Animal Nutrition and Commerce Ltda., Lindóia, São Paulo State, Brazil. | - | Used for the feeding of the mice |
| Ketamine Hydrochloride 10% | Ketamina Agener, União Química Farmacêutica Nacional S/A, Embu-Guaçu, SP, Brazil | - | Used to anesthetize animals before treatments and for euthanasia |
| Light-emitting diode handpiece (prototype) | Instituto de Física de São Carlos, University of São Paulo, São Carlos, SP, Brazil | - | Fabricated with LXHL-PR09, Luxeon III Emitter, Lumileds Lighting, San Jose, California, USA |
| Methylprednisolone acetate 40 mg | DEPO-MEDROL, Pfizer, New York | - | Used as an immunosuppressant |
| Microtome | Leica Microsystems, Bannockburn, IL, USA | SM2500 | Used to cut the serial sections of the tongues |
| Propylene boxes (cages housing) H13 x L20 x D30 cm | Bonther Equipaments, Ribeirão Preto, SP, Brazil | - | Used to keep the animals throughout the experimental period |
| Sabouraud Dextrose Agar with Chloramphenicol | HiMedia, Mumbai, India | MM1067-500G | Culture medium for yeast growth (agar) |
| Spectrophotometer | Spectrophotometer Kasvi K37-VIS , São José dos Pinhais, PR, Brazil | K37-VIS | Used to standardize the inoculum concentration |
| Tetracycline hydrochloride | Compounding pharmacy, Araraquara, SP, Brazil | - | Antibiotic given to induce oral dysbiosis |
| Wood shavings | J.R. Wood Shavings, Comerce of Sawdust Ltda., Conchal, São Paulo State, Brazil | - | Used for floor covering inside the housing boxes |
| Xylazine 2% | Calmiun, União Química Farmacêutica Nacional S/A, Embu-Guaçu, SP, Brazil | - | Used in combination with ketamine for anesthesia |
| Yeast Nitrogen Broth | Difco, InterLab, Detroit, MI, USA | DF0919-07-3 | Culture medium for yeast growth (broth) |
| Yeast Peptone Dextrose Broth | NutriSelect Basic, Sigma Aldrich | Y1375 | Culture medium for maintaining the strains at -80°C and grow |
Referências
- Vila, T., Sultan, A. S., Montelongo-Jauregui, D., Jabra-Rizk, M. A. Oral candidiasis: a disease of opportunity. Journal of fungi (Basel, Switzerland). 6 (1), 15(2020).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Moyes, D. L., Richardson, J. P., Naglik, J. R. Candida albicans-epithelial interactions and pathogenicity mechanisms: scratching the surface. Virulence. 6 (4), 338-346 (2015).
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Quindós, G., et al. Therapeutic tools for oral candidiasis: Current and new antifungal drugs. Medicina oral, patologia oral y cirugia buccal. 24 (2), e172-e180 (2019).
- Nishimoto, A. T., Sharma, C., Rogers, P. D. Molecular and genetic basis of azole antifungal resistance in the opportunistic pathogenic fungus Candida albicans. Journal of Antimicrobial Chemotherapy. 75 (2), 257-270 (2020).
- Gholami, L., Shahabi, S., Jazaeri, M., Hadilou, M., Fekrazad, R. Clinical applications of antimicrobial photodynamic therapy in dentistry. Frontiers in Microbiology. 13, 1020995(2013).
- Trigo-Gutierrez, J. K., Vega-Chacón, Y., Soares, A. B., Mima, E. G. O. Antimicrobial activity of curcumin in nanoformulations: a comprehensive review. International Journal of Molecular Sciences. 22 (13), 7130(2021).
- Santezi, C., Reina, B. D., Dovigo, L. N. Curcumin-mediated Photodynamic Therapy for the treatment of oral infections-A review. Photodiagnosis and Photodynamic Therapy. 21, 409-415 (2018).
- Dovigo, L. N., et al. Curcumin-mediated photodynamic inactivation of Candida albicans in a murine model of oral candidiasis. Medical Mycology. 51 (3), 243-251 (2013).
- Zangirolami, A. C., Carbinatto, F., Filho, J. D. V., Bagnato, V. S., Blanco, K. C. Impact of light-activated curcumin and curcuminoids films for catheters decontamination. Colloids and SurfacesB: Biointerfaces. 213, 112386(2022).
- Santezi, C., Tanomaru, J. M., Bagnato, V. S., Júnior, O. B., Dovigo, L. N. Potential of curcumin-mediated photodynamic inactivation to reduce oral colonization. Photodiagnosis Photodynamic Therapy. 15, 46-52 (2016).
- Takakura, N., et al. A novel murine model of oral candidiasis with local symptoms characteristic of oral thrush. Microbiology and immunology. 47 (5), 321-326 (2003).
- Mima, E. G., et al. Susceptibility of Candida albicans to photodynamic therapy in a murine model of oral candidosis. OralSurgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology. 109, 392-401 (2010).
- Solis, N. V., Filler, S. G. Mouse model of oropharyngeal candidiasis. Nature Protocol. 7 (4), 637-642 (2012).
- Marôco, J. Análise Estatística com o SPSS Statistics 25. , ReportNumber 7th ed, Lisboa, Portugal. (2018).
- Naglik, J. R., Fidel, P. L. Jr, Odds, F. C. Animal models of mucosal Candida infection. FEMS Microbiology Letters. 283 (2), 129-139 (2008).
- Samaranayake, Y. H., Samaranayake, L. P. Experimental oral candidiasis in animal models. Clinical Microbiology Reviews. 14, 398-429 (2001).
- Chamilos, G., Lionakis, M. S., Lewis, R. E., Kontoyiannis, D. P. Role of mini-host models in the study of medically important fungi. The Lancet Infectious Diseases. 7, 42-55 (2007).
- Carmello, J. C., et al. Treatment of oral candidiasis using Photodithazine- mediated photodynamic therapy in vivo. PLoS One. 11 (6), e0156947(2016).
- Sakima, V. T., et al. Antimicrobial photodynamic therapy mediated by curcumin-loaded polymeric nanoparticles in a murine model of oral candidiasis. Molecules. 23 (8), 2075(2018).
- Abe, S., et al. A glucocorticoid antagonist, mifepristone affects anti-Candida activity of murine neutrophils in the presence of prednisolone in vitro and experimental candidiasis of prednisolone-treated mice in vivo. FEMS Immunology and Medical Microbiology. 13 (4), 311-316 (1996).
- Jones, J. H., Russell, C., Young, C., Owen, D. Tetracycline and the colonization and infection of the mouths of germ-free and conventionalized rats with Candida albicans. Journal Antimicrobial Chemotherapy. 2 (3), 247-253 (1976).
- Russell, C., Jones, J. H. Effects of oral inoculation of Candida albicans in tetracycline-treated rats. Journal of Medical Microbiology. 6 (3), 275-279 (1973).
- Teichert, M. C., Jones, J. W., Usacheva, M. N., Biel, M. A. Treatment of oral candidiasis with methylene blue- mediated photodynamic therapy in an immunodeficient murine model. OralSurgery, Medicine, Pathology, Radiology and Endodontology. 93, 155-160 (2002).
- Totti, M. G. A., Santos, E. B., Almeida, O. P., Koga-Ito, C. Y., Jorge, A. O. C. Oral candidosis by Candida albicans in normal and xerostomic mice. Brazilian Oral Research. 18, 202-207 (2004).
- Hidalgo, K. J. R., et al. Antimicrobial photodynamic therapy in combination with nystatin in the treatment of experimental oral candidiasis induced by Candida albicans resistant to fluconazole. Pharmaceuticals (Basel). 12 (3), E140(2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados