Method Article
Заготовка и первичная культура лептоменингеальных лимфатических эндотелиальных клеток
В этой статье
Резюме
Лептоменингеальные лимфатические эндотелиальные клетки (LLECs), недавно идентифицированный тип внутричерепных клеток, имеют плохо изученные функции. В этом исследовании представлен воспроизводимый протокол получения LLEC у мышей и создания первичных культур in vitro . Этот протокол предназначен для того, чтобы позволить исследователям углубиться в клеточные функции и потенциальные клинические последствия LLEC.
Аннотация
Лептоменингеальные лимфатические эндотелиальные клетки (ЛЛЕК) представляют собой недавно обнаруженную внутричерепную клеточную популяцию с уникальным распределением, четко отличающимся от периферических лимфатических эндотелиальных клеток. Их клеточная функция и клинические последствия остаются в значительной степени неизвестными. Следовательно, наличие запаса LLEC имеет важное значение для проведения функциональных исследований in vitro. Тем не менее, в настоящее время не существует протокола для сбора и культивирования LLEC in vitro.
В этом исследовании был успешно собран LLEC с использованием многоступенчатого протокола, который включал покрытие колбы фибронектином, рассечение лептоменингов с помощью микроскопа, ферментативное расщепление лептоменингов для получения одноклеточной суспензии, индуцирование экспансии LLEC с фактором роста эндотелия сосудов-С (VEGF-C) и отбор положительных клеток гиалуронового рецептора-1 лимфатических сосудов (LYVE-1) с помощью магнитно-активированной сортировки клеток (MACS). Этот процесс в конечном итоге привел к формированию первичной культуры. Чистота ЛЛЭК подтверждена методом иммунофлуоресцентного окрашивания и проточного цитометрического анализа, при этом уровень чистоты превысил 95%. Этот многоступенчатый протокол продемонстрировал воспроизводимость и осуществимость, что значительно облегчит изучение клеточной функции и клинических последствий LLEC.
Введение
Недавно обнаруженные лептоменингеальные лимфатические эндотелиальные клетки (ЛЛЕК) образуют сетку из отдельных клеток в лептоменингах, демонстрируя отчетливую картину распределения по сравнению с периферическими лимфатическими эндотелиальными клетками 1,2. Клеточные функции и клинические последствия, связанные с LLEC, остаются в значительной степени неизведанной территорией. Для того, чтобы проложить путь для функциональных исследований LLEC, необходимо создать модель in vitro для их изучения. Таким образом, в этом исследовании был разработан комплексный протокол для изоляции и первичной культуры LLEC.
Мыши являются предпочтительной животной моделью из-за их пригодности для генетических манипуляций при исследовании заболеваний. В предыдущих исследованиях были успешно выделены лимфатические эндотелиальные клетки из различных тканей мышей, включая лимфатические узлы3, брыжеечную ткань4, дермальную ткань5, собирающие лимфатические элементы6 и легочную ткань7. Эти процедуры выделения в основном основывались на таких методах, как магнитно-активированная сортировка клеток (MACS) и сортировка методом проточной цитометрии 8,9,10. Кроме того, исследовательские усилия привели к созданию линий арахноидальных клеток крыс и лимфатических капиллярных клеточных линийкрыс 11,12. Несмотря на существование методов культивирования эксплантов для лептоменингов13, существует острая необходимость в стандартизированном протоколе для выделения и культивирования ЛЛЭК. Следовательно, в этом исследовании был успешно собран и культивирован LLEC путем тщательной диссоциации лептоменингов под контролем микроскопа и стимулирования экспансии LLEC с помощью фактора роста эндотелия сосудов (VEGF-C). Отличительным маркером лимфатических эндотелиальных клеток является гиалуроновый рецептор-1 лимфатического сосуда (LYVE-1)14. Этот многоступенчатый протокол селективно изолирует LYVE-1-положительные LLEC с помощью MACS и впоследствии проверяет их чистоту с помощью проточного цитометрического анализа и иммунофлуоресцентного окрашивания.
Основные этапы этого многоэтапного протокола можно резюмировать следующим образом: покрытие колбы, диссоциация лептоменингов, ферментативное расщепление лептоменингов, клеточная экспансия, магнитный отбор клеток и последующее культивирование LLEC. Наконец, чистота выделенных ЛЛЕК подтверждается с помощью проточного цитометрического анализа и иммунофлуоресцентного окрашивания. Основная цель данного исследования состоит в том, чтобы представить воспроизводимый многоступенчатый протокол выделения LLEC из мышиных лептоменингов и их последующего культивирования in vitro . Этот протокол призван значительно облегчить исследования клеточных функций и клинических последствий LLECs.
протокол
Это исследование получило одобрение Комитета по этике экспериментов на животных Куньминского медицинского университета (kmmu20220945). Все эксперименты проводились в соответствии с установленными рекомендациями по уходу за животными. Лептоменингеальные лимфатические эндотелиальные клетки (LLEC) были получены от самцов мышей C57Bl/6J в возрасте 6-8 недель и весом от 20 до 25 г. Эти мыши были закуплены в Куньминском медицинском университете в Куньмине, Китай. Весь эксперимент проводился в строгих стерильных условиях. Все этапы центрифугирования выполняются при комнатной температуре, если не указано иное.
1. Подготовка реактивов и инструментов
ПРИМЕЧАНИЕ: Все шаги, связанные с растворами, должны выполняться в шкафу биологической опасности класса II.
- Приготовьте буфер для промывки, смешав фосфатно-солевой буфер (PBS) с кальцием и магнием, 10% фетальной бычьей сывороткой (FBS) и 1% пенициллин-стрептомицин (P/S) (см. таблицу материалов). Храните этот буфер в холоде при температуре 4 °C. Важно приготовить его свежим в день использования и дегазировать буфер.
- Приготовьте пищеварительные ферменты, соединив 10 мл PBS (без кальция и магния) с 2 мл 0,25% трипсина, 1 мл 20 мг/мл папаина и 200 мкл 1 мг/мл коллагеназы I (см. таблицу материалов).
ПРИМЕЧАНИЕ: Обеспечьте использование аликвот соответствующих объемов, чтобы предотвратить повторные циклы замораживания-оттаивания. Храните эти аликвоты при температуре -20 °C. - Подготовьте питательную среду, используя коммерчески доступный набор среды для выращивания эндотелиальных клеток, который включает VEGF-C (100 нг/мл) и 1% P/S (см. таблицу материалов).
- Приготовьте стоп-буфер, добавив модифицированную среду Eagle's Medium (DMEM) Dulbecco с 10% FBS, чтобы остановить процесс пищеварения.
- Подготовьте стерильные хирургические инструменты: эти инструменты должны включать ножницы, пинцет с зазубренным концом и пинцет с тонким концом.
2. Покрытие колбы
- Покройте колбу T25 раствором фибронектина в концентрации 100 мкг/мл (см. таблицу материалов) и инкубируйте в течение ночи при 37 °C. Перед использованием удалите раствор покрытия с помощью пипетки.
- Трижды промойте колбу PBS, затем аспирируйте PBS и дайте колбе T25 высохнуть на воздухе.
3. Диссоциация лептоменингов
ПРИМЕЧАНИЕ: Всегда используйте предварительно охлажденные буферы и растворы при температуре 4 °C.
- Обезболивайте мышей избыточной ингаляцией 4% изофлурана, а затем приносите их в жертву путем быстрого обезглавливания ножницами, которые были предварительно очищены 70% этанолом.
- Осторожно надрежьте кожу по средней линии, начиная от отверстия в задней части черепа и распространяясь к лобной области.
- Осторожно извлеките череп, осторожно приподняв его ножницами, чтобы не повредить лептоменинги, обеспечив получение всего мозга, включая лептоменинги.
- Погрузите весь мозг в буфер для промывки и осторожно промойте его, чтобы удалить поверхностную кровь.
- Перенесите мозг в стерильную чашку Петри, не измельчая, и извлеките лептоменинги с поверхности мозга с помощью тонкого пинцета под микроскопом.
- Разрежьте лептоменинговую ткань на фрагменты с помощью стерильных микроножниц.
4. Ферментативное пищеварение лептоменингов
- Добавьте к фрагментам 10 мл ферментной смеси (шаг 1,2) и инкубируйте при 37 °C в течение 15 минут. Осторожно перемешайте, чтобы убедиться, что фрагменты отделились от дна трубки. После этого добавьте 10 мл буфера (шаг 1.4), чтобы остановить пищеварение.
- Центрифугу при 300 x g в течение 5 мин при 4 °C и осторожно удалите надосадочную жидкость с помощью пипетки.
- Добавьте 10 мл холодного PBS и пропустите смесь через ситечко 70 мкм в стерильную пробирку объемом 50 мл, чтобы отфильтровать любые комки.
5. Расширение клеток
- Планшет 1 x 10 5 клеток насм2 в покрытую фибронектином колбу T25 (шаг 2) с5 мл питательной среды.
- Инкубируют клетки при 37 °C с 5%СО2 в течение 24 ч. После этого удалите среду, чтобы удалить неприкрепленные клетки.
- Поддерживайте культуру, заменяя 50% среды каждые два дня. Повторите этот процесс два-три раза.
6. Выбор магнитных ячеек
ПРИМЕЧАНИЕ: Работайте быстро, поддерживайте холод в клетках и используйте предварительно охлажденные растворы для предотвращения неспецифического мечения клеток.
- Подготовка инструментов и реагентов: прикрепить магнитный сепаратор к стойке магнитного сепаратора (см. Таблицу материалов). Подсоедините селекционную колонку к магнитному сепаратору и поместите сетчатый фильтр 70 мкм поверх селекционной колонки. Поместите пробирку объемом 50 мл под колонку отбора для сбора потока.
- Ферментативное пищеварение: как только клетки достигнут 80% слияния, аспирируют среду и промывают клетки PBS. Добавьте 0,25% трипсина, чтобы отделить адгезивные клетки, и инкубируйте при 37 °C в течение 5 мин. Остановите пищеварение, добавив буфер остановки. Центрифугируют клетки при 300 x g в течение 5 мин при комнатной температуре и удаляют надосадочную жидкость.
- Инкубация антител: ресуспендировать 1 x 107 клеток в 100 мкл PBS и добавить 10 мкл антитела LYVE-1 (см. таблицу материалов). Тщательно перемешать и выдержать 30 мин в темноте при температуре 4 °С.
- Вращайте клетки при 300 x g в течение 5 мин и выбросьте надосадочную жидкость. Промыть клетки, введя 1 мл PBS и центрифугируя при 300 x g в течение 5 мин. Полностью удалить надосадочную жидкость.
- Маркировка микрогранулами: ресуспендировать клетки в 100 мкл PBS и добавить 20 мкл микрогранул (см. таблицу материалов). Хорошо перемешать и выдержать 30 мин в темноте при температуре 4 °C.
- Отжим клетки при 300 x g в течение 5 мин и сцедите надосадочную жидкость. Затем очистите клетки 1 мл PBS путем центрифугирования при 300 x g в течение 5 мин. Наконец, полностью удалите надосадочную жидкость.
- Магнитно-отрицательное исключение: ресуспендировать клетки в 4 мл PBS. Пропустите клетки через ситечко для клеток 70 мкм, чтобы удалить скопления. Подготовьте селекционную колонку (см. Таблицу материалов), промыв ее 3 мл PBS, затем нанесите клеточную суспензию в селекционную колонку.
- Выполните этапы промывки 3 мл PBS и соберите LYVE-1-отрицательные клетки в пробирку объемом 50 мл, расположенную под колонкой отбора, чтобы они могли пройти.
- Магнитный положительный отбор: пипетка 6 мл PBS в колонку отбора. Мгновенно промывают магнитно-меченые ячейки, с усилием вдавливая поршень в селекционную колонку, чтобы получить LYVE-1-положительные LLEC.
ПРИМЕЧАНИЕ: Всегда ждите, пока резервуар столбца выбора не опустеет, прежде чем переходить к следующему шагу.
7. Культура LLEC
- Центрифугируют LYVE-1-положительные LLEC при 300 x g в течение 5 мин, а затем осторожно удаляют надосадочную жидкость.
- Планшет 1 x 10 5 клеток насм2 в покрытую фибронектином колбу T25 с5 мл питательной среды.
- Поддерживайте культуру, заменяя 50% среды через день. Когда клетки достигнут 80% слияния, отделите клетки 0,25% трипсином и выполните клеточный пассаж. Используйте клетки для последующих экспериментов после 2-3 проходов.
8. Анализ проточной цитометрии
ПРИМЕЧАНИЕ: Проточный цитометрический анализ проводили по ранее описанной процедуре15.
- Добавьте 0,25% трипсина, чтобы отделить адгезивные клетки, и инкубируйте при 37 °C в течение 5 мин. Затем добавьте буфер остановки, чтобы остановить пищеварение.
- Центрифугируют клетки при 300 х г в течение 5 мин и полностью аспирируют надосадочную жидкость. Ресуспендировать 1 x 106 ячеек в 100 мкл PBS.
- Добавьте 1 мкл антитела LYVE-1. Тщательно перемешать и выдержать 10 мин в темноте при комнатной температуре.
- Ресуспендируйте клетки в соответствующем количестве PBS-буфера для анализа с помощью проточной цитометрии и программного обеспечения FlowJo (см. таблицу материалов).
9. Иммунофлуоресцентное окрашивание
ПРИМЕЧАНИЕ: Иммунофлуоресцентное окрашивание проводили в соответствии с процедурой, описанной ранее16.
- Промойте клетки ПБС три раза. Зафиксируйте клетки 4% параформальдегидом (PFA) в течение 10 мин при комнатной температуре. Выбросьте PFA и промойте клетки PBS три раза.
- Нанесите блочный буфер на 1 ч при комнатной температуре. Извлеките буфер блоков из покровных листов.
- Добавьте антитело LYVE-1 в буфер для окрашивания к клеткам и инкубируйте в темноте. Трижды промойте клетки ПБС.
- Добавьте соответствующее вторичное антитело (см. Таблицу материалов) в буфер для окрашивания к клеткам и инкубируйте в темноте. Трижды промойте клетки ПБС.
- Контрокраска 4',6-диамидино-2-фенилиндолом (DAPI). Теперь клетки готовы к иммунофлуоресцентной микроскопии.
Результаты
В этом исследовании представлен воспроизводимый многоступенчатый протокол забора лимфатических эндотелиальных клеток (LLEC) у мышей и последующего создания их первичной культуры in vitro. Основные этапы включают подготовку колбы и покрытие фибронектином, диссоциацию лептоменингов, получение одноклеточной суспензии путем ферментативного расщепления и индуцирование расширения LLEC с помощью VEGF-C. Затем LYVE-1-положительные LLEC селективно выделяют с помощью магнитно-активируемой сортировки клеток (MACS). Наконец, для оценки чистоты ЛЛЭК проводят иммунофлуоресцентное окрашивание и проточный цитометрический анализ, при этом результаты МТТ-анализа демонстрируют устойчивые темпы роста ЛЛЭК (дополнительный рисунок 1). Основные этапы этого многопроцедурного протокола проиллюстрированы на блок-схеме, при этом весь процесс занимает примерно 2-3 недели (рис. 1).
Для получения ЛЛЭК необходимо диссоциировать лептоменинги и способствовать их экспансии, сохраняя при этом жизнеспособность клеток с помощью эффективных хирургических методов и поддержания холодной среды (рис. 2A-E). После получения всего мозга вместе с лептоменингами в стерильных условиях выполняется этап щадящей промывки для удаления эритроцитов крови (рис. 2F). Затем лептоменинги осторожно извлекаются с поверхности мозга под микроскопом (рис. 2G). Эти лептоменинги в основном состоят из коллагеновых волокон, поэтому они фрагментированы для ускорения ферментативного пищеварения (рис. 2H). Затем проводится ферментативное расщепление этих фрагментов, а любые оставшиеся комки фильтруются через ситечко 70 мкм для удаления более крупных кластеров коллагеновых волокон (рис. 2I). Наконец, клетки помещают в покрытую фибронектином колбу T25 и добавляют VEGF-C для индуцирования расширения (рис. 2J). Через 24 ч питательную среду удаляют для удаления неприкрепленных клеток. Эти этапы облегчают извлечение клеток из лептоменингов и способствуют экспансии, что имеет решающее значение для получения достаточного количества LYVE-1-положительных LLEC на более поздних этапах процесса.
В то время как VEGF-C индуцирует экспансию LLEC, гетерогенные клеточные популяции все еще могут расти вместе. Для выделения чистых LYVE-1-положительных LLEC используется MACS, поскольку LYVE-1 является признанным маркером лимфатических эндотелиальных клеток. Чистоту ЛЛЭК оценивают с помощью проточной цитометрии, при этом результаты показывают, что процент LYVE-1-положительных клеток в пассаже 2 существенно не отличается от пассажа 3 после MACS, демонстрируя чистоту более 95% (рис. 3A). Для дальнейшей валидации специфичности LYVE-1-положительных LLEC для идентификации17,18,19 использовали три дополнительных маркера эндотелиальных клеток лимфатической системы – подопланин (PDPN), рецептор фактора роста эндотелия сосудов-3 (VEGFR-3) и гомеобокс, связанный с Prospero1 (PROX1). Иммунофлуоресцентное окрашивание подтвердило, что LYVE-1 окрашивается совместно с этими тремя маркерами (рис. 3B). Кроме того, идентичность LLEC была установлена в срезах мозга в физиологических условиях, что свидетельствует о совместном окрашивании LYVE-1 с PROX1, VEGFR-3 и PDPN (дополнительный рисунок 2A). LYVE-1-положительные клетки не экспрессировали F4/80 и тромбоцитарный фактор роста бета (PDGFR-β), эффективно отличая LLEC от макрофагов и фибробластов (дополнительный рисунок 2B). Таким образом, этот протокол позволяет собирать высокочистые LLEC, способные к культивированию in vitro.
Лептоменингеальные клетки до MACS демонстрируют гетерогенность, отличающуюся от колоний лимфатических эндотелиальных клеток. Их морфология варьируется от одиночных круглых сфер до плавленых волокон (рис. 4A-D). Тем не менее, после MACS LLEC демонстрируют типичные эндотелиальные черты в форме веретена и булыжника (рис. 4E-H). Основываясь на этих результатах, LLEC эффективно собираются с помощью этого многопроцедурного протокола и поддерживаются в здоровом состоянии роста.

Рисунок 1: Схематическое изображение многопроцедурного протокола. Эта блок-схема иллюстрирует многопроцедурный протокол сбора и культивирования LLEC. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Забор клеток лептоменинга. (А) Подготовка стерильных хирургических инструментов. (B) Мышей обезболивали путем вдыхания 4% изофлурана, а затем очищали 70% этанолом после эвтаназии. (C) Обезглавливание мышей и осторожный разрез кожи по средней линии, начиная от задней части черепа к лобной области. (D) Деликатное удаление черепа для сохранения целостности лептоменингов. (E) Извлечение всего мозга, содержащего лептоменинги. (F) Промывание всего мозга буферным раствором с осторожной промывкой для удаления поверхностной крови. (G) Вскрытие лептоменингов с поверхности головного мозга с помощью пинцета с тонким концом. (H) Разрезание лептоменингов на фрагменты стерильными микроножницами с последующим добавлением 10 мл ферментной смеси и инкубацией при 37 °C в течение 15 мин. (I) Ресуспендирование гранулы в 10 мл PBS и фильтрация комков через ситечко 70 мкм. (J) Гальваническое покрытие ячеек в покрытую колбу Т25. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Оценка чистоты LLEC после MACS. (A) Репрезентативные гистограммы проточного цитометрического анализа, демонстрирующие экспрессию LYVE-1-положительных клеток в пассажах 2 и 3 после MACS. Процент LYVE-1-положительных клеток превышает 95% после MACS. Данные репрезентативны для трех независимых экспериментов (Mean ± SEM). Полосы погрешности указывают на SEM. (B) Репрезентативное иммунофлуоресцентное изображение, показывающее совместное окрашивание LYVE-1 с PDPN, VEGFR-3 и PROX1. Масштабные линейки = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
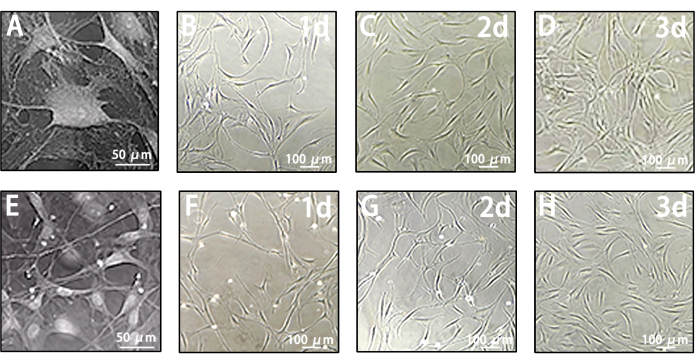
Рисунок 4: Характеристики роста лептоменингеальных клеток и ЛЛЕК. (A) Морфология лептоменингеальных клеток, запечатленных на репрезентативных изображениях. Масштабная линейка = 50 мкм. (B-D) Репрезентативные изображения, показывающие морфологию лептоменингеальных клеток на 1-й, 2-й и 3-й день до MACS. Масштабные линейки = 100 мкм. (E) Морфология LLEC, запечатленных на репрезентативных изображениях. Масштабная линейка = 50 мкм. (F-H) Репрезентативные изображения, иллюстрирующие морфологию LLEC на 1-й, 2-й и 3-й день после MACS. Масштабные линейки = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Темпы роста LLEC и SVEC4-10. Результаты МТТ-анализа показывают достоверное снижение скорости роста ЛЛЕК в пассаже 1 по сравнению с группой SVEC4-10. Существенных различий между группами LLEC 2 и 3 по сравнению с группой SVEC4-10 не выявлено. Данные представляют собой результаты шести независимых экспериментов (среднее ± SEM). Полосы ошибок указывают на SEM. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Характеристика и различение LLEC в срезах мозга. (A) Репрезентативное иммунофлуоресцентное изображение, иллюстрирующее совместное окрашивание LYVE-1 с PROX1, VEGFR-3 и PDPN в срезах мозга в физиологических условиях. Масштабные линейки = 2 мкм. (B) Репрезентативное иммунофлуоресцентное изображение, демонстрирующее, что LYVE-1 не окрашивается вместе с F4/80 и PDGFR-β в срезах мозга в физиологических условиях. Масштабные линейки = 20 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Рост LLEC при стимуляции VEGF-C. (A) Репрезентативные изображения ЛЛЭК при стимуляции VEGF-C в концентрации 1 нг/мл. (B) Репрезентативные изображения НЛЭК при стимуляции VEGF-C в дозе 100 нг/мл. (C) Репрезентативные изображения ЛЛЕК при стимуляции VEGF-C в концентрации 500 нг/мл. Масштабные линейки = 50 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4: Экспрессия CD31, PDPN и VEGFR-3 после сбора. (A) Репрезентативные гистограммы проточного цитометрического анализа показывают, что CD31-положительные клетки составляют менее 5%. (B) Репрезентативные гистограммы проточного цитометрического анализа показывают, что PDPN-положительные клетки превышают 95%. (C) Репрезентативные гистограммы проточного цитометрического анализа показывают, что VEGFR-3-положительные клетки превышают 95%. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок 5: Морфология LLEC и отличие от CD31. (A) Репрезентативные изображения морфологии ЛЛЕК, выявленные с помощью окрашивания гематоксилин-эозином. Масштабная линейка = 20 мкм. (B) Репрезентативные иммунофлуоресцентные изображения показывают, что LYVE-1 и PDPN не окрашиваются совместно с CD31. Масштабные линейки = 50 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 6: Скорость распространения LLEC. Репрезентативные результаты анализа CCK-8 показывают значительное снижение скорости пролиферации LLEC в пассаже 1 и пассаже 6 по сравнению с пассажем 2 и 5 соответственно. Данные представляют собой результаты шести независимых экспериментов (среднее ± SEM). Полосы ошибок указывают на SEM. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
О существующем протоколе сбора и культивирования LLEC in vitro ранее не сообщалось. В этом исследовании представлен воспроизводимый, многопроцедурный протокол сбора и культивирования LLEC из лептоменингов мышей.
Несмотря на то, что этот многопроцедурный протокол воспроизводим, существует несколько ключевых соображений. Например, колбы Т25, покрытые фибронектином, способствуют адгезии LLEC и функционируют, устраняя неадгезивные клетки, тем самым обеспечивая более однородную клеточную популяцию. Кроме того, время и температура во время хирургических процедур для диссоциации лептоменингов являются критическими факторами, влияющими на жизнеспособность клеток. Поэтому очень важно поддерживать продолжительность в пределах 1 часа и поддерживать буфер в достаточном холодном состоянии. Еще один важный момент связан с присутствием эритроцитов в лептоменингах, от которых высвобождение гемоглобина может нанести вред LLECs. Чтобы смягчить это, необходимо осторожно промывать и промывать, чтобы удалить красные кровяные тельца, предотвращая их цитотоксическое действие. Наконец, LLEC требуют стимуляции VEGF-C20, особенно в концентрации 100 нг/мл. При такой стимуляции LLEC демонстрируют характерную эндотелиальную морфологию, а не образуют трубки (дополнительный рисунок 3A-C). Следовательно, в этом исследовании использовалась питательная среда, содержащая 100 нг/мл VEGF-C, чтобы индуцировать экспансию и поддерживать однородность в клеточных популяциях.
Описанный здесь многопроцедурный протокол включает в себя шаги по устранению неполадок и некоторые ограничения. Во-первых, этот протокол занимает 2-3 недели, что делает его непрактичным для частого повторения. Во-вторых, хирургические и ферментативные процедуры могут привести к присутствию мертвых клеток, которые не удаляются перед нанесением покрытия, что потенциально влияет на клеточную культуру. Эта возможность будет изучена в будущих реализациях протокола. В-третьих, в то время как чистота собранных LLEC (VEGFR-3 и PDPN-положительных клеток) превышает 95%, некоторые гетерогенные клеточные популяции сохраняются, включая CD31-положительные клетки, которые составляют менее 5% (дополнительный рисунок 4A-C). Это распространенная проблема при культивировании первичных клеток. Изображения высокого разрешения, полученные при окрашивании гематоксилин-эозином, показывают, что LLEC имеют характерные эндотелиальные формы, но не экспрессируют CD31 (дополнительный рисунок 5A, B). Наконец, результаты анализа CCK-8 указывают на значительное снижение скорости пролиферации в LLEC в пассаже 1 и 6 по сравнению с пассажем 2 и 5 соответственно (дополнительный рисунок 6). Пассаж 1 может привести к повреждению LLEC из-за лечения антителами и физического стресса во время сортировки, в то время как пассаж 6 показывает снижение пролиферации по мере увеличения количества пассажей. Поэтому последующие клетки после прохождения 6 непригодны для соответствующих экспериментов. Учитывая распределение фибробластов в мозговых оболочках21, примерно 5% контаминированных клеток могут содержать фибробласты. Чтобы решить эту проблему, добавление генетикина и иммуномагнитной сортировки клеток может быть использовано для удаления загрязненных фибробластов22,23. Мониторинг скорости контаминации фибробластов в каждом прохождении ЛЛЭК поможет устранить влияние фибробластов на рост ЛЛЭК24. Учитывая гетерогенность между мышами и людьми, сбор и культивирование первичных человеческих LLEC должны быть продолжены для потенциального клинического применения в будущих исследованиях.
Таким образом, в настоящее время не существует установленного протокола для сбора и культивирования LLEC in vitro. В этом исследовании представлен воспроизводимый, многопроцедурный протокол для сбора LLEC у мышей leptomeninges и последующего установления их первичной культуры in vitro. Эта работа будет способствовать дальнейшему изучению клеточных функций и потенциальному клиническому применению LLEC.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов, который они должны раскрывать.
Благодарности
Исследование было поддержано грантами Национального фонда естественных наук Китая (81960226, 81760223), Фонда естественных наук провинции Юньнань (202001AS070045, 202301AY070001-011) и Научно-исследовательского фонда Департамента образования провинции Юньнань (2023Y0784).
Материалы
| Name | Company | Catalog Number | Comments |
| Block buffer | Beyotime | P0102 | Store aliquots at –4 °C |
| Collagenase I | Solarbio | C8140 | Store aliquots at –20 °C |
| DAPI | Beyotime | P0131 | Store aliquots at –20 °C |
| DMEM | Solarbio | 11995 | Store aliquots at –4 °C |
| D-PBS | Solarbio | D1041 | Store aliquots at –4 °C |
| EGM-2 MV Bullet Kit | Lonza | C-3202 | Store aliquots at –4 °C |
| FBS | Solarbio | S9010 | Store aliquots at –20 °C |
| Fibronectin | Solarbio | F8180 | Store aliquots at –20 °C |
| FlowJo Software | BD Biosciences | V10.8.1 | |
| LYVE-1 antibody | eBioscience | 12-0443-82 | Store aliquots at –4 °C |
| Magnetic separator | Miltenyi | 130-042-302 | Sterile before use |
| Magnetic separator stand | Miltenyi | 130-042-303 | Sterile before use |
| Microbeads | Miltenyi | 130-048-801 | Store aliquots at –4 °C |
| P/S | Solarbio | P1400 | Store aliquots at –20 °C |
| Papain | Solarbio | G8430-25g | Store aliquots at –20 °C |
| PBS | Solarbio | D1040 | Store aliquots at –4 °C |
| PDPN antibody | Santa | sc-53533 | Store aliquots at –4 °C |
| PFA | Solarbio | P1110 | Store aliquots at –4 °C |
| PROX1 antibody | Santa | sc-81983 | Store aliquots at –4 °C |
| Selection column | Miltenyi | 130-042-401 | Sterile before use |
| Trypsin | Gibco | 25200072 | Store aliquots at –20 °C |
| VEGF-C | Abcam | ab51947 | Store aliquots at –20 °C |
| VEGFR-3 antibody | Santa | sc-514825 | Store aliquots at –4 °C |
Ссылки
- Shibata-Germanos, S., et al. Structural and functional conservation of non-lumenized lymphatic endothelial cells in the mammalian leptomeninges. Acta Neuropathologica. 139 (2), 383-401 (2020).
- Suárez, I., Schulte-Merker, S. Cells with many talents: lymphatic endothelial cells in the brain meninges. Cells. 10 (4), 799 (2021).
- Jordan-Williams, K. L., Ruddell, A. Culturing purifies murine lymph node lymphatic endothelium. Lymphatic Research and Biology. 12 (3), 144-149 (2014).
- Jones, B. E., Yong, L. C. Culture and characterization of bovine mesenteric lymphatic endothelium. In vitro Cellular & Developmental Biology. 23 (10), 698-706 (1987).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Jablon, K. L., et al. Isolation and short-term culturing of primary lymphatic endothelial cells from collecting lymphatics: A techniques study. Microcirculation. 30 (2-3), e12778 (2023).
- Lapinski, P. E., King, P. D. Isolation and culture of mouse lymphatic endothelial cells from lung tissue. Methods in Molecular Biology. 2319, 69-75 (2021).
- Lokmic, Z. Isolation, Identification, and culture of human lymphatic endothelial cells. Methods in Molecular Biology. 1430, 77-90 (2016).
- Thiele, W., Rothley, M., Schmaus, A., Plaumann, D., Sleeman, J. Flow cytometry-based isolation of dermal lymphatic endothelial cells from newborn rats. Lymphology. 47 (4), 177-186 (2014).
- Lokmic, Z., et al. Isolation of human lymphatic endothelial cells by multi-parameter fluorescence-activated cell sorting. Journal of Visualized Experiments. 99, e52691 (2015).
- Janson, C., Romanova, L., Hansen, E., Hubel, A., Lam, C. Immortalization and functional characterization of rat arachnoid cell lines. Neuroscience. 177, 23-34 (2011).
- Romanova, L. G., Hansen, E. A., Lam, C. H. Generation and preliminary characterization of immortalized cell line derived from rat lymphatic capillaries. Microcirculation. 21 (6), 551-561 (2014).
- Park, T. I., et al. Routine culture and study of adult human brain cells from neurosurgical specimens. Nature Protocols. 17 (2), 190-221 (2022).
- Okuda, K. S., et al. lyve1 expression reveals novel lymphatic vessels and new mechanisms for lymphatic vessel development in zebrafish. Development. 139 (13), 2381-2391 (2012).
- Bokobza, C., et al. Magnetic Isolation of microglial cells from neonate mouse for primary cell cultures. Journal of Visualized Experiments. 185, e62964 (2022).
- Wang, J. M., Chen, A. F., Zhang, K. Isolation and primary culture of mouse aortic endothelial cells. Journal of Visualized Experiments. 118, e52965 (2016).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. The American Journal of Pathology. 154 (2), 385-394 (1999).
- Petrova, T. V., Koh, G. Y. Organ-specific lymphatic vasculature: From development to pathophysiology. The Journal of Experimental Medicine. 215 (1), 35-49 (2018).
- Wilting, J., et al. The transcription factor Prox1 is a marker for lymphatic endothelial cells in normal and diseased human tissues. The FASEB Journal. 16 (10), 1271-1273 (2002).
- Yin, X., et al. Lymphatic endothelial heparan sulfate deficiency results in altered growth responses to vascular endothelial growth factor-C (VEGF-C). The Journal of Biological Chemistry. 286 (17), 14952-14962 (2011).
- DeSisto, J., et al. Single-cell transcriptomic analyses of the developing meninges reveal meningeal fibroblast diversity and function. Developmental Cell. 54 (1), 43-59 (2020).
- Chen, Z., et al. A method for eliminating fibroblast contamination in mouse and human primary corneal epithelial cell cultures. Current Eye Research. , 1-11 (2023).
- Starzonek, C., et al. Enrichment of human dermal stem cells from primary cell cultures through the elimination of fibroblasts. Cells. 12 (6), 949 (2023).
- Lam, C. H., Romanova, L., Hubel, A., Janson, C., Hansen, E. A. The influence of fibroblast on the arachnoid leptomeningeal cells in vitro. Brain Research. 1657, 109-119 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены