Method Article
軟髄膜リンパ管内皮細胞の採取と初代培養
要約
最近同定された頭蓋内細胞タイプである軟髄膜リンパ内皮細胞(LREC)は、機能が十分に理解されていません。この研究は、マウスからLLECを採取し、 in vitro 初代培養を確立するための再現性のあるプロトコルを提示します。このプロトコルは、研究者がLLECの細胞機能と潜在的な臨床的意味を掘り下げることができるように設計されています。
要約
軟髄膜リンパ内皮細胞(LREC)は、末梢リンパ内皮細胞とは明らかに異なる独特の分布を持つ、最近発見された頭蓋内細胞集団です。それらの細胞機能と臨床的意味は、ほとんど不明のままです。したがって、LLECの供給は、in vitroで機能研究を行うために不可欠です。しかし、現在、in vitroでLLECを収穫および培養するための既存のプロトコルはありません。
この研究では、フラスコをフィブロネクチンでコーティングし、顕微鏡の助けを借りて軟髄膜を解剖し、軟髄膜を酵素的に消化して単一細胞懸濁液を調製し、血管内皮増殖因子-C(VEGF-C)でLLECの増殖を誘導し、磁気活性化細胞選別(MACS)によるリンパ管ヒアルロン酸受容体-1(LYVE-1)陽性細胞を選択するなど、多段階のプロトコルを使用してLLECを採取することに成功しました。このプロセスは、最終的に一次文化の確立につながりました。LLECの純度は、免疫蛍光染色およびフローサイトメトリー解析によって確認され、純度レベルは95%を超えました。この多段階プロトコルは、再現性と実現可能性を実証しており、LLECの細胞機能と臨床的意味の探求を大幅に促進します。
概要
新たに発見された軟髄膜リンパ管内皮細胞(LLEC)は、軟髄膜内の個々の細胞の網目構造を形成し、末梢リンパ管内皮細胞と比較して明確な分布パターンを示します1,2。LLECに関連する細胞機能と臨床的意味合いは、ほとんど未知の領域のままです。LLECの機能研究への道を開くためには、その研究のためのin vitroモデルを確立することが不可欠です。したがって、この研究では、LLECの単離と初代培養のための包括的なプロトコルを考案しました。
マウスは、疾患研究における遺伝子操作に適しているため、好ましい動物モデルです。これまでの研究では、リンパ節3、腸間膜組織4、真皮組織5、採取リンパ管6、肺組織7など、さまざまなマウス組織からリンパ内皮細胞を単離することに成功しています。これらの単離手順は、主に磁気活性化細胞選別(MACS)やフローサイトメトリーソーティングなどの技術に依存してきました8,9,10。さらに、研究努力により、ラットくも膜細胞株およびラットリンパ毛細血管細胞株が確立されました11,12。軟髄膜13の外植片培養技術が存在するにもかかわらず、LLECの単離と培養のための標準化されたプロトコルが緊急に必要とされています。その結果、本研究では、顕微鏡のガイド下で細髄膜を細心の注意を払って解離させ、血管内皮増殖因子-C(VEGF-C)を用いてLLECの増殖を促進することで、LLECの採取と培養に成功しました。リンパ管内皮細胞の特徴的なマーカーは、リンパ管ヒアルロン酸受容体-1(LYVE-1)14である。このマルチステッププロトコルでは、MACSを用いてLYVE-1陽性LLECを選択的に単離し、その後、フローサイトメトリー解析と免疫蛍光染色によってその純度を検証します。
この多段階のプロトコルの主なステップは次の通り要約することができる:フラスコのコーティング、leptomeningesの解離、leptomeningesの酵素の消化力、細胞拡張、磁気細胞の選択およびそれに続くLLECsの培養。最後に、単離されたLLECの純度は、フローサイトメトリー分析および免疫蛍光染色によって確認されます。この研究の包括的な目的は、マウス軟髄膜およびその後の in vitro 培養からLLECを単離するための再現性のある多段階プロトコルを提示することです。このプロトコルはLLECsの細胞機能そして臨床含意に調査を非常に促進するために態勢を整える。
プロトコル
本研究成果は、昆明医科大学動物実験倫理委員会(kmmu20220945)の承認を得ました。すべての実験は、確立された動物管理ガイドラインに従っていました。軟髄膜リンパ管内皮細胞(LREC)は、6〜8週齢、体重20〜25gの雄のC57Bl/6Jマウスから採取した。これらのマウスは、中国の昆明にある昆明医科大学から調達しました。実験手順全体は、厳格な無菌条件下で実施されました。遠心分離工程は、特に指定のない限り、室温で行います。
1. 試薬・器具の調製
注意: ソリューションに関連するすべてのステップは、クラスIIバイオハザードキャビネット内で実施する必要があります。
- リン酸緩衝生理食塩水(PBS)をカルシウムおよびマグネシウム、10%ウシ胎児血清(FBS)、および1%ペニシリン-ストレプトマイシン(P/S)と混合して、洗浄バッファーを調製します( 材料表を参照)。このバッファーを4°Cで冷たく保ちます。 使用当日に新鮮な状態で調製し、緩衝液を脱気することが不可欠です。
- 10 mLのPBS(カルシウムとマグネシウムを含まない)と2 mLの0.25%トリプシン、1 mLの20 mg/mLパパイン、および200 μLの1 mg/mLコラゲナーゼIを組み合わせて消化酵素を調製します( 材料表を参照)。
注意: 凍結融解サイクルが繰り返されないように、適切な容量のアリコートを使用してください。これらのアリコートは-20°Cで保管してください。 - VEGF-C(100 ng/mL)および1% P/Sを含む市販の内皮細胞増殖培地キットを利用して培地を調製します( 材料表を参照)。
- ダルベッコ修飾イーグル培地(DMEM)に10%FBSを添加して停止バッファーを調製し、消化プロセスを停止させます。
- 滅菌手術器具を準備する:これらの器具には、はさみ、鋸歯状の先端ピンセット、および細かいピンセットを含める必要があります。
2.フラスココーティング
- T25フラスコに100 μg/mLのフィブロネクチン溶液( 材料表を参照)をコーティングし、37°Cで一晩インキュベートします。 使用前にピペットで塗布液を除去してください。
- フラスコをPBSで3回洗浄し、続いてPBSを吸引し、T25フラスコを風乾させます。
3.軟髄膜の解離
注:常に4°Cで予冷したバッファーと溶液を使用してください。
- 4%イソフルランを過剰に吸入してマウスに麻酔をかけ、70%エタノールで洗浄したハサミを使用して迅速に斬首してマウスを犠牲にします。
- 頭蓋骨の後ろの開口部から始めて、前頭部に向かって伸びる正中線に沿って皮膚を慎重に切開します。
- 頭蓋骨を繊細に取り外し、はさみでそっと持ち上げて軟髄膜を損傷しないようにし、軟髄膜を含む脳全体を確実に取得します。
- 脳全体を洗浄バッファーに浸し、静かに洗い流して表面の血液を取り除きます。
- 脳を刻まずに滅菌シャーレに移し、顕微鏡下で細かいピンセットを使用して脳の表面から軟髄膜を抽出します。
- 滅菌マイクロハサミを使用して、軟髄膜組織を断片に切断します。
4.軟髄膜酵素消化
- 酵素ミックス(ステップ1.2)10 mLをフラグメントに加え、37°Cで15分間インキュベートします。静かに攪拌して、破片がチューブの底から剥がれるようにします。その後、10 mLの停止バッファー(ステップ1.4)を添加して消化を停止します。
- 4°Cで5分間、300 x g で遠心分離し、ピペットを使用して上清を慎重に除去します。
- 10 mLの冷たいPBSを加え、混合物を70 μmのストレーナーに通して滅菌済みの50 mLチューブに通し、凝集塊をろ過します。
5.セルの拡張
- 1 x 105 cells per cm 2をフィブロネクチンでコーティングしたT25フラスコ(ステップ2 )に5 mLの培地とともにプレーティングします。
- 細胞を37°Cで5%CO2 で24時間インキュベートします。その後、培地を除去して、付着していない細胞を取り除きます。
- 培地の50%を2日ごとに交換することで、培養を維持します。このプロセスを2〜3回繰り返します。
6. 磁性セルの選択
注:迅速に作業し、細胞の冷たさを維持し、予冷溶液を利用して非特異的な細胞標識を防ぎます。
- 器具と試薬の調製:磁気セパレーターを磁気セパレータースタンドに取り付けます( 材料表を参照)。選択カラムを磁気分離器に接続し、選択カラムの上に70 μmのセルストレーナーを配置します。選択カラムの下に 50 mL チューブを置き、フローを収集します。
- 酵素消化:細胞が80%コンフルエントに達したら、培地を吸引し、細胞をPBSで洗い流します。0.25%トリプシンを添加して接着細胞を剥離し、37°Cで5分間インキュベートします。停止バッファーを添加して消化を停止します。細胞を室温で300 x g で5分間遠心分離し、上清を除去します。
- 抗体インキュベーション:100 μLのPBSに1 x 10 7個の細胞を再懸濁し、10 μLのLYVE-1抗体を添加します( 材料表を参照)。十分に混合し、4°Cの暗所で30分間インキュベートします。
- 細胞を300 x g で5分間回転させ、上清を廃棄します。1 mLのPBSを導入し、300 x g で5分間遠心分離して細胞をすすぎます。上澄みを完全に取り除きます。
- マイクロビーズ標識:細胞を100 μLのPBSに再懸濁し、20 μLのマイクロビーズを加えます( 材料表を参照)。よく混合し、4°Cの暗所で30分間インキュベートします。
- 細胞を300 x g で5分間回転させ、上清をデカントします。続いて、1 mLのPBSで300 x g で5分間遠心分離し、細胞を洗浄します。最後に、上澄みを完全に取り除きます。
- 磁気陰性排除:細胞を4 mLのPBSに再懸濁します。細胞を70μmのセルストレーナーに通し、凝集塊を除去します。3 mLのPBSで洗い流して選択カラム( 材料表を参照)を調製し、細胞懸濁液を選択カラムに塗布します。
- 3 mL の PBS で洗浄ステップを行い、LYVE-1 陰性細胞を選択カラムの下に配置した 50 mL チューブに集めて通過させます。
- 磁気ポジティブセレクション:6 mLのPBSを選択カラムにピペットで移します。プランジャーを選択カラムにしっかりと押し込むことで、磁気標識された細胞を即座に洗い流し、LYVE-1陽性LLECを取得します。
注:次の手順に進む前に、必ず選択列リザーバーが空になるまで待ってください。
7. LLECの文化
- LYVE-1陽性LLECを300 x g で5分間遠心分離し、上清を慎重に除去します。
- 1 x 105 cells/cm2 をフィブロネクチンでコーティングしたT25フラスコに5mLの培地とともにプレーティングします。
- 培地の50%を1日おきに交換して培養を維持します。細胞が80%のコンフルエントに達したら、0.25%トリプシンで細胞を剥離し、細胞継代を行います。2〜3継代後のその後の実験に細胞を利用します。
8. フローサイトメトリー解析
注:フローサイトメトリー解析は、前述の手順15に従って実施した。
- 0.25%トリプシンを添加して接着細胞を剥離し、37°Cで5分間インキュベートします。次に、停止バッファーを添加して消化を停止します。
- 細胞を300 x g で5分間遠心分離し、上清を完全に吸引します。1 x 106 細胞を100 μLのPBSに再懸濁します。
- LYVE-1抗体1 μLを添加します。完全に混合し、室温で暗所で10分間インキュベートします。
- 細胞を適切な量のPBSバッファーに再懸濁し、フローサイトメトリーおよびFlowJoソフトウェアを使用して分析します( 材料表を参照)。
9. 免疫蛍光染色
注:免疫蛍光染色は、前述の手順に従って行いました16。
- 細胞をPBSで3回洗浄します。セルを4%パラホルムアルデヒド(PFA)で室温で10分間固定します。PFAを廃棄し、細胞をPBSで3回洗浄します。
- ブロックバッファーを室温で1時間アプライします。カバーガラスからブロックバッファーを取り外します。
- 染色バッファー中のLYVE-1抗体を細胞に添加し、暗所でインキュベートします。細胞をPBSで3回洗浄します。
- 染色バッファー中の適切な二次抗体( 材料表を参照)を細胞に添加し、暗所でインキュベートします。細胞をPBSで3回洗浄します。
- 4',6-ジアミジノ-2-フェニルインドール(DAPI)による対比染色。これで、細胞は免疫蛍光顕微鏡検査の準備が整いました。
結果
この研究は、マウスからリンパ管内皮細胞(LLECs)を採取し、その後in vitroで初代培養を確立するための再現性のある多段階プロトコルを提示します。重要なステップには、フラスコの調製とフィブロネクチンコーティング、軟髄膜の解離、酵素消化による単一細胞懸濁液の取得、およびVEGF-CによるLLECの増殖の誘導が含まれます。次に、LYVE-1陽性LLECは、磁気活性化セルソーティング(MACS)を使用して選択的に単離されます。最後に、免疫蛍光染色とフローサイトメトリー解析を実施してLLECの純度を評価し、MTTアッセイの結果、LLECの堅牢な増殖速度が実証されました(補足図1)。このマルチプロシージャルプロトコルの主なステップはフローチャートに示されており、プロセス全体には約2〜3週間かかります(図1)。
LLECを採取するには、効率的な手術技術によって細胞の生存率を維持し、低温環境を維持しながら、軟髄膜を解離し、LLECの増殖を促進することが不可欠です(図2A-E)。無菌状態で軟髄膜とともに脳全体を採取した後、穏やかな洗浄ステップを実行して血中赤血球を除去します(図2F)。次に、顕微鏡下で脳の表面から軟髄膜を慎重に抽出します(図2G)。これらの軟髄膜は主にコラーゲン線維で構成されているため、酵素消化を促進するために断片化されています(図2H)。続いて、これらの断片の酵素消化を行い、残った凝集塊を70 μmのストレーナーでろ過して、コラーゲン繊維の大きな塊を除去します(図2I)。最後に、細胞をフィブロネクチンでコーティングしたT25フラスコに播種し、VEGF-Cを添加して増殖を誘導します(図2J)。24時間後、培地を除去して、付着していない細胞を除去します。これらのステップは、軟髄膜からの細胞の採取を促進し、プロセスの後半で十分なLYVE-1陽性LLECを得るために重要な増殖を促進します。
VEGF-CはLLECの増殖を誘導しますが、不均一な細胞集団は依然として一緒に増殖する可能性があります。純粋なLYVE-1陽性LLECを単離するために、LYVE-1はリンパ系内皮細胞のマーカーとして認識されているため、MACSが採用されています。LLECの純度はフローサイトメトリーで評価され、その結果、継代2のLYVE-1陽性細胞の割合はMACS後の継代3と有意差がなく、95%を超える純度が示されました(図3A)。LYVE-1陽性LLECの特異性をさらに検証するために、3つの追加のリンパ内皮細胞マーカー-ポドプラニン(PDPN)、血管内皮増殖因子受容体-3(VEGFR-3)、およびプロスペロ関連ホメオボックス1(PROX1)を同定に使用しました17,18,19。免疫蛍光染色により、LYVE-1 がこれら 3 つのマーカーと共染色されることが確認されました(図 3B)。さらに、LLECの同一性は、生理学的条件下での脳切片で確立され、LYVE-1とPROX1、VEGFR-3、およびPDPNとの共染色が示されました(補足図2A)。LYVE-1陽性細胞は、F4/80および血小板由来成長因子ベータ(PDGFR-β)を発現しておらず、LLECをマクロファージおよび線維芽細胞と効果的に区別しました(補足図2B)。要約すると、このプロトコルは、in vitro培養が可能な高純度のLLECの収穫を可能にします。
MACS以前の軟髄膜細胞は、リンパ管内皮細胞のコロニーとは異なる不均一性を示します。その形態は、単一の丸い球体から融合繊維の形状まで多岐にわたります(図4A-D)。しかし、MACS後のLLECは、典型的な紡錘体と丸石状の内皮のような特徴を示します(図4E-H)。これらの結果に基づいて、LLECは、このマルチプロシージャルプロトコルを通じて効果的に収穫され、健全な成長状態に維持されます。

図1:マルチプロシージャプロトコルの概略図。このフローチャートは、LLECの収穫と培養のためのマルチプロシージャルプロトコルを示しています。この図の拡大版をご覧になるには、ここをクリックしてください。

図2:軟髄膜細胞の採取 。 (A)滅菌手術器具の調製。(B)マウスに4%イソフルランを吸入 して 麻酔をかけ、その後、安楽死後に70%エタノールで洗浄した。(C)マウスの斬首と、頭蓋骨の後ろから前頭部に向かって皮膚を慎重に正中切開する。(D)軟髄膜の完全性を維持するための頭蓋骨の繊細な除去。(E)軟髄膜を含む脳全体の回収。(F)表面の血液を除去するために、穏やかに洗い流す緩衝液で脳全体を洗浄する。(G)細かいピンセットを使用した脳表面からの軟髄膜の解剖。(H)滅菌マイクロハサミで軟髄膜を断片に切断し、続いて10 mLの酵素混合物を添加し、37°Cで15分間インキュベートします。 (I)ペレットを10 mLのPBSに再懸濁し、70 μmのストレーナーで凝集塊をろ過します。(J)コーティングされたT25フラスコへの細胞のプレーティング。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:MACS後のLLEC純度の評価 。 (A)MACS後の継代2および3におけるLYVE-1陽性細胞の発現を示すフローサイトメトリー解析からの代表的なヒストグラム。LYVE-1陽性細胞の割合は、MACS後に95%を超えます。データは、3つの独立した実験(平均±SEM)を代表するものです。エラーバーはSEMを示します。 (B)LYVE-1とPDPN、VEGFR-3、およびPROX1との共染色を示す代表的な免疫蛍光画像。スケールバー = 50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
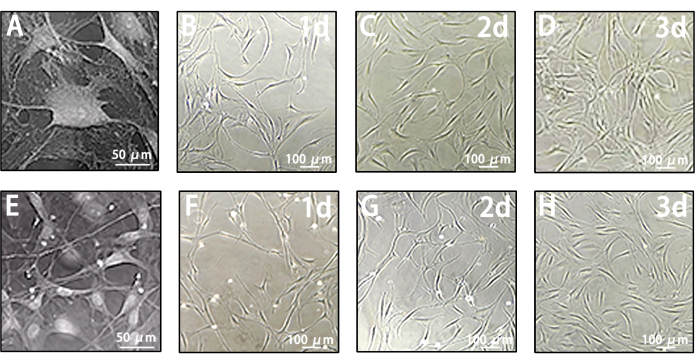
図4:軟髄膜細胞とLLECの増殖特性 (A)代表画像で捉えた軟髄膜細胞の形態。スケールバー = 50 μm。 (B-D) MACS の前の 1 日目、2 日目、および 3 日目の軟髄膜細胞の形態を示す代表的な画像。スケールバー = 100 μm。 (E)代表的な画像で撮影されたLLECの形態。スケールバー = 50 μm。 (F-H) MACS後の1日目、2日目、3日目のLLECの形態を示す代表的な画像。スケールバー = 100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足図1:LLECとSVEC4-10の成長率。 MTTアッセイの結果は、SVEC4-10群と比較して、継代1のLLECの増殖速度の有意な低下を示しています。継代2と継代3のLLEC群とSVEC4-10群の間に有意差は認められなかった。データは、6つの独立した実験(平均±SEM)の結果を表しています。エラーバーはSEMを示します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:脳スライスにおけるLLECの特性評価と識別。 (A)生理学的条件下での脳切片におけるLYVE-1とPROX1、VEGFR-3、およびPDPNとの共染色を示す代表的な免疫蛍光画像。スケールバー = 2 μm。 (B)生理学的条件下では、LYVE-1が脳切片のF4/80およびPDGFR-βと共染色されないことを示す代表的な免疫蛍光画像。スケールバー = 20 μm。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:VEGF-C刺激下でのLLECの成長。 (A)1 ng/mL VEGF-C 刺激下での LLEC の代表的な画像。(B)100 ng/mL VEGF-C 刺激下での LLEC の代表的な画像。(C)500 ng/mL VEGF-C 刺激下での LLEC の代表的な画像。スケールバー = 50 μm。 このファイルをダウンロードするには、ここをクリックしてください。
補足図4:採取後のCD31、PDPN、およびVEGFR-3の発現。 (A)フローサイトメトリー解析の代表的なヒストグラムは、CD31陽性細胞が5%未満であることを示しています。(B)フローサイトメトリー解析の代表的なヒストグラムは、PDPN陽性細胞が95%を超えていることを示しています。(C)フローサイトメトリー解析からの代表的なヒストグラムは、VEGFR-3陽性細胞が95%を超えることを示しています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図5:LLECの形態とCD31との区別。 (A)ヘマトキシリン-エオシン染色により明らかになったLLECの形態の代表的な画像。スケールバー = 20 μm。 (B)代表的な免疫蛍光画像は、LYVE-1およびPDPNがCD31と共染色しないことを示しています。スケールバー = 50 μm。 このファイルをダウンロードするには、ここをクリックしてください。
補足図6:LLECの増殖率 CCK-8アッセイの代表的な結果は、継代2および継代5と比較して、継代1および継代6におけるLLECの増殖率の有意な低下を示す。データは、6つの独立した実験(平均±SEM)の結果を表しています。エラーバーはSEMを示します。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
in vitroでLLECを採取および培養するための既存のプロトコルは、以前に報告されていません。この研究では、マウス軟髄膜からLLECを採取および培養するための再現性のあるマルチプロシージャルプロトコルを紹介します。
このマルチプロシージャルプロトコルは再現可能ですが、いくつかの重要な考慮事項があります。例えば、フィブロネクチンでコーティングされたT25フラスコは、非接着細胞を排除することでLLECの接着と機能を促進し、それによってより均質な細胞集団を確保します。さらに、軟髄膜を解離するための外科的処置中の時間と温度は、細胞の生存率に影響を与える重要な要素です。したがって、1時間以内の持続時間を維持し、バッファーを十分に冷たく保つことが重要です。もう一つの重要な点は、ヘモグロビンの放出がLLECに害を及ぼす可能性がある軟髄膜における赤血球の存在に関するものである。これを軽減するには、赤血球をやさしく洗い流して洗浄し、赤血球を除去し、細胞毒性効果を防ぐことが不可欠です。最後に、LLEC は、特に 100 ng/mL の濃度で VEGF-C20 による刺激を必要とします。この刺激下では、LLECは管を形成するのではなく、特徴的な内皮様形態を示します(補足図3A-C)。そこで、本研究では、100 ng/mLのVEGF-Cを含む培地を用いて、細胞集団の増殖を誘導し、均一性を維持しました。
ここで説明するマルチプロシージャプロトコルには、トラブルシューティングの手順といくつかの制限があります。まず、このプロトコルは完了するまでに2〜3週間かかるため、頻繁に繰り返すことは現実的ではありません。第二に、外科的および酵素的処置により、プレーティング前に除去されない死細胞が存在する可能性があり、細胞培養に影響を与える可能性があります。この可能性は、将来のプロトコル実装で検討されます。第三に、採取されたLLEC(VEGFR-3およびPDPN陽性細胞)の純度は95%を超えているが、CD31陽性細胞を含む一部の不均一な細胞集団は5%未満である(補足図4A-C)。これは、初代細胞の培養における共通の課題です。ヘマトキシリン-エオシン染色による高解像度画像は、LLECが特徴的な内皮様形状を示すが、CD31を発現しないことを示している(補足図5A、B)。最後に、CCK-8アッセイの結果は、継代2および5と比較して、継代1および6におけるLLECの増殖率の有意な低下を示しています(補足図6)。継代1は抗体処理によるLLECの損傷や選別時の物理的ストレスにつながる可能性がありますが、継代6は継代数が増えるにつれて増殖が減少します。したがって、継代6の後続の細胞は、関連する実験には適していません。髄膜21における線維芽細胞の分布を考えると、汚染された細胞の約5%が線維芽細胞を含む可能性がある。これに対処するために、ジェネチシンと免疫磁気細胞の選別に加えて、汚染された線維芽細胞を除去することができます22,23。LLECの各継代における線維芽細胞の汚染率を監視することは、LLECの成長に対する線維芽細胞の影響を排除するのに役立ちます24。マウスとヒトの不均一性を考慮すると、ヒト初代LLECの採取と培養は、将来の研究における潜在的な臨床応用のために追求されるべきです。
要約すると、現在、in vitroでLLECを収穫および培養するための確立されたプロトコルはありません。この研究では、マウスの軟髄膜からLLECを採取し、その後in vitroで初代培養を確立するための再現性のあるマルチプロシージャルプロトコルを紹介します。この研究は、LLECの細胞機能と潜在的な臨床応用のさらなる探求を促進します。
開示事項
著者らは、開示すべき利益相反がないことを宣言します。
謝辞
この研究は、中国国家自然科学基金会(81960226、81760223年)、雲南省自然科学基金会(202001AS070045、202301AY070001-011)、雲南省教育局科学研究基金会(2023Y0784)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Block buffer | Beyotime | P0102 | Store aliquots at –4 °C |
| Collagenase I | Solarbio | C8140 | Store aliquots at –20 °C |
| DAPI | Beyotime | P0131 | Store aliquots at –20 °C |
| DMEM | Solarbio | 11995 | Store aliquots at –4 °C |
| D-PBS | Solarbio | D1041 | Store aliquots at –4 °C |
| EGM-2 MV Bullet Kit | Lonza | C-3202 | Store aliquots at –4 °C |
| FBS | Solarbio | S9010 | Store aliquots at –20 °C |
| Fibronectin | Solarbio | F8180 | Store aliquots at –20 °C |
| FlowJo Software | BD Biosciences | V10.8.1 | |
| LYVE-1 antibody | eBioscience | 12-0443-82 | Store aliquots at –4 °C |
| Magnetic separator | Miltenyi | 130-042-302 | Sterile before use |
| Magnetic separator stand | Miltenyi | 130-042-303 | Sterile before use |
| Microbeads | Miltenyi | 130-048-801 | Store aliquots at –4 °C |
| P/S | Solarbio | P1400 | Store aliquots at –20 °C |
| Papain | Solarbio | G8430-25g | Store aliquots at –20 °C |
| PBS | Solarbio | D1040 | Store aliquots at –4 °C |
| PDPN antibody | Santa | sc-53533 | Store aliquots at –4 °C |
| PFA | Solarbio | P1110 | Store aliquots at –4 °C |
| PROX1 antibody | Santa | sc-81983 | Store aliquots at –4 °C |
| Selection column | Miltenyi | 130-042-401 | Sterile before use |
| Trypsin | Gibco | 25200072 | Store aliquots at –20 °C |
| VEGF-C | Abcam | ab51947 | Store aliquots at –20 °C |
| VEGFR-3 antibody | Santa | sc-514825 | Store aliquots at –4 °C |
参考文献
- Shibata-Germanos, S., et al. Structural and functional conservation of non-lumenized lymphatic endothelial cells in the mammalian leptomeninges. Acta Neuropathologica. 139 (2), 383-401 (2020).
- Suárez, I., Schulte-Merker, S. Cells with many talents: lymphatic endothelial cells in the brain meninges. Cells. 10 (4), 799 (2021).
- Jordan-Williams, K. L., Ruddell, A. Culturing purifies murine lymph node lymphatic endothelium. Lymphatic Research and Biology. 12 (3), 144-149 (2014).
- Jones, B. E., Yong, L. C. Culture and characterization of bovine mesenteric lymphatic endothelium. In vitro Cellular & Developmental Biology. 23 (10), 698-706 (1987).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Jablon, K. L., et al. Isolation and short-term culturing of primary lymphatic endothelial cells from collecting lymphatics: A techniques study. Microcirculation. 30 (2-3), e12778 (2023).
- Lapinski, P. E., King, P. D. Isolation and culture of mouse lymphatic endothelial cells from lung tissue. Methods in Molecular Biology. 2319, 69-75 (2021).
- Lokmic, Z. Isolation, Identification, and culture of human lymphatic endothelial cells. Methods in Molecular Biology. 1430, 77-90 (2016).
- Thiele, W., Rothley, M., Schmaus, A., Plaumann, D., Sleeman, J. Flow cytometry-based isolation of dermal lymphatic endothelial cells from newborn rats. Lymphology. 47 (4), 177-186 (2014).
- Lokmic, Z., et al. Isolation of human lymphatic endothelial cells by multi-parameter fluorescence-activated cell sorting. Journal of Visualized Experiments. 99, e52691 (2015).
- Janson, C., Romanova, L., Hansen, E., Hubel, A., Lam, C. Immortalization and functional characterization of rat arachnoid cell lines. Neuroscience. 177, 23-34 (2011).
- Romanova, L. G., Hansen, E. A., Lam, C. H. Generation and preliminary characterization of immortalized cell line derived from rat lymphatic capillaries. Microcirculation. 21 (6), 551-561 (2014).
- Park, T. I., et al. Routine culture and study of adult human brain cells from neurosurgical specimens. Nature Protocols. 17 (2), 190-221 (2022).
- Okuda, K. S., et al. lyve1 expression reveals novel lymphatic vessels and new mechanisms for lymphatic vessel development in zebrafish. Development. 139 (13), 2381-2391 (2012).
- Bokobza, C., et al. Magnetic Isolation of microglial cells from neonate mouse for primary cell cultures. Journal of Visualized Experiments. 185, e62964 (2022).
- Wang, J. M., Chen, A. F., Zhang, K. Isolation and primary culture of mouse aortic endothelial cells. Journal of Visualized Experiments. 118, e52965 (2016).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. The American Journal of Pathology. 154 (2), 385-394 (1999).
- Petrova, T. V., Koh, G. Y. Organ-specific lymphatic vasculature: From development to pathophysiology. The Journal of Experimental Medicine. 215 (1), 35-49 (2018).
- Wilting, J., et al. The transcription factor Prox1 is a marker for lymphatic endothelial cells in normal and diseased human tissues. The FASEB Journal. 16 (10), 1271-1273 (2002).
- Yin, X., et al. Lymphatic endothelial heparan sulfate deficiency results in altered growth responses to vascular endothelial growth factor-C (VEGF-C). The Journal of Biological Chemistry. 286 (17), 14952-14962 (2011).
- DeSisto, J., et al. Single-cell transcriptomic analyses of the developing meninges reveal meningeal fibroblast diversity and function. Developmental Cell. 54 (1), 43-59 (2020).
- Chen, Z., et al. A method for eliminating fibroblast contamination in mouse and human primary corneal epithelial cell cultures. Current Eye Research. , 1-11 (2023).
- Starzonek, C., et al. Enrichment of human dermal stem cells from primary cell cultures through the elimination of fibroblasts. Cells. 12 (6), 949 (2023).
- Lam, C. H., Romanova, L., Hubel, A., Janson, C., Hansen, E. A. The influence of fibroblast on the arachnoid leptomeningeal cells in vitro. Brain Research. 1657, 109-119 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved