Method Article
연수막 림프 내피 세포의 수확 및 1차 배양
요약
최근에 확인된 두개내 세포 유형인 연수막 림프 내피 세포(LEC)는 기능이 잘 이해되지 않습니다. 이 연구는 마우스에서 LLEC를 수확하고 시험관 내 1차 배양을 확립하기 위한 재현 가능한 프로토콜을 제시합니다. 이 프로토콜은 연구자들이 LLEC의 세포 기능과 잠재적인 임상적 영향을 탐구할 수 있도록 설계되었습니다.
초록
연수막 림프 내피 세포(LEC)는 최근에 발견된 두개내 세포 집단으로, 말초 림프 내피 세포와 명확하게 구별되는 독특한 분포를 가지고 있습니다. 그들의 세포 기능과 임상적 의미는 거의 알려지지 않았습니다. 결과적으로, LLEC의 공급은 체외에서 기능적 연구를 수행하는 데 필수적입니다. 그러나 현재 시험관 내에서 LLEC를 수확하고 배양하기 위한 기존 프로토콜은 없습니다.
이 연구는 플라스크를 피브로넥틴으로 코팅하고, 현미경을 사용하여 렙토메닝을 해부하고, 렙토메닝을 효소로 소화하여 단세포 현탁액을 준비하고, 혈관 내피 성장 인자-C(VEGF-C)로 LLEC의 확장을 유도하고, 자기 활성화 세포 분류(MACS)를 통해 림프관 히알루론산 수용체-1(LYVE-1) 양성 세포를 선택하는 등 다단계 프로토콜을 사용하여 LLEC를 성공적으로 수확했습니다. 이 과정은 궁극적으로 1차 문화의 확립으로 이어졌다. LLEC의 순도는 면역형광 염색 및 유세포 분석을 통해 확인되었으며, 순도는 95%를 초과했습니다. 이 다단계 프로토콜은 재현성과 타당성을 입증했으며, 이는 LLEC의 세포 기능 및 임상적 의미에 대한 탐구를 크게 촉진할 것입니다.
서문
새로 발견된 렙토메닝 림프 내피 세포(LEC)는 렙토메닝 내에서 개별 세포의 그물망을 형성하여 말초 림프 내피 세포와 비교할 때 뚜렷한 분포 패턴을 나타냅니다 1,2. LLEC와 관련된 세포 기능 및 임상적 의미는 여전히 미지의 영역으로 남아 있습니다. LLEC에 대한 기능적 연구의 길을 닦기 위해서는 연구를 위한 체외 모델을 확립하는 것이 필수적입니다. 따라서 본 연구는 LLEC의 격리 및 1차 배양에 대한 포괄적인 프로토콜을 고안했습니다.
마우스는 질병 연구에서 유전자 조작에 적합하기 때문에 선호되는 동물 모델입니다. 이전 연구에서는 림프절3, 장간막 조직4, 피부 조직5, 수집 림프관6 및 폐 조직7을 포함한 다양한 마우스 조직에서 림프 내피 세포를 성공적으로 분리했습니다. 이러한 분리 절차는 주로 자기 활성화 세포 분류(MACS) 및 유세포 분석분류 8,9,10과 같은 기술에 의존해 왔습니다. 또한, 연구 노력은 쥐 거미막 세포주와 쥐 림프 모세관 세포주11,12의 확립으로 이어졌습니다. 렙토메닝(leptomeninges)에 대한 외식물 배양 기법이 존재함에도 불구하고(13), LLEC의 분리 및 배양을 위한 표준화된 프로토콜이 시급히 필요하다. 결과적으로 이 연구는 현미경의 유도 하에 렙토메닝을 꼼꼼하게 해리하고 혈관 내피 성장 인자-C(VEGF-C)를 사용하여 LLEC의 확장을 촉진하여 LLEC를 성공적으로 수확 및 배양했습니다. 림프 내피 세포의 독특한 표지자는 림프관 히알루론산 수용체-1(lyve-1)입니다14. 이 다단계 프로토콜은 MACS를 사용하여 LYVE-1 양성 LLEC를 선택적으로 분리한 후 유세포 분석 및 면역형광 염색을 통해 순도를 검증합니다.
이 다단계 프로토콜의 주요 단계는 플라스크 코팅, 렙토메닝의 해리, 렙토메닝의 효소 분해, 세포 확장, 자기 세포 선택 및 LLEC의 후속 배양으로 요약할 수 있습니다. 마지막으로, 분리된 LLEC의 순도는 유세포 분석 및 면역형광 염색을 통해 확인됩니다. 이 연구의 가장 중요한 목표는 마우스 렙토메닝에서 LLEC를 분리하고 후속 시험관 내 배양을 위한 재현 가능한 다단계 프로토콜을 제시하는 것입니다. 이 프로토콜은 LLEC의 세포 기능 및 임상적 영향에 대한 조사를 크게 촉진할 준비가 되어 있습니다.
프로토콜
본 연구는 쿤밍의과대학 동물실험윤리위원회(kmmu20220945)의 승인을 받았다. 모든 실험은 확립된 동물 관리 지침을 준수했습니다. 연수막 림프 내피 세포(LEC)는 6-8주 되고 체중이 20-25g인 수컷 C57Bl/6J 마우스로부터 수확했습니다. 이 쥐들은 중국 쿤밍에 있는 쿤밍 의과대학에서 조달했다. 전체 실험 절차는 엄격한 멸균 조건에서 수행되었습니다. 모든 원심분리 단계는 달리 명시되지 않는 한 실온에서 수행됩니다.
1. 시약 및 기구 준비
알림: 용액과 관련된 모든 단계는 클래스 II 생물학적 위험 캐비닛 내에서 수행해야 합니다.
- 인산염 완충 식염수(PBS)를 칼슘 및 마그네슘, 10% 소 태아 혈청(FBS) 및 1% 페니실린-스트렙토마이신(P/S)과 혼합하여 세척 완충액을 준비합니다( 재료 표 참조). 이 버퍼를 4°C에서 차갑게 유지하십시오. 사용 당일에 신선하게 준비하고 완충액의 가스를 제거하는 것이 중요합니다.
- 10mL의 PBS(칼슘 및 마그네슘 제외)를 0.25% 트립신 2mL, 20mg/mL 파파인 1mL, 1mg/mL 콜라겐분해효소 I 200μL와 결합하여 소화 효소를 준비합니다( 재료 표 참조).
알림: 반복적인 동결-해동 주기를 방지하기 위해 적절한 부피의 부분 표본을 사용하십시오. 이 부분 표본은 -20 °C에서 보관하십시오. - VEGF-C(100ng/mL) 및 1% P/S를 포함하는 시판되는 내피 세포 성장 배지 키트를 활용하여 배양 배지를 준비합니다( 재료 표 참조).
- 분해 과정을 중지하기 위해 10% FBS로 Dulbecco's modified Eagle's medium(DMEM)을 보충하여 중지 완충액을 준비합니다.
- 멸균 수술 기구 준비: 이러한 기구에는 가위, 톱니 모양의 팁 핀셋 및 미세한 핀셋이 포함되어야 합니다.
2. 플라스크 코팅
- T25 플라스크에 100μg/mL 피브로넥틴 용액( 재료 표 참조)을 코팅하고 37°C에서 밤새 배양합니다. 사용하기 전에 피펫을 사용하여 코팅 용액을 제거하십시오.
- PBS로 플라스크를 세 번 세척한 다음 PBS를 흡입하고 T25 플라스크를 자연 건조시킵니다.
3. 렙토메닝 해리
알림: 항상 4°C에서 미리 냉각된 완충액과 용액을 사용하십시오.
- 4% 이소플루란을 과도하게 흡입하여 쥐를 마취한 다음 이전에 70% 에탄올로 세척한 가위를 사용하여 신속하게 목을 베어 희생합니다.
- 두개골 뒤쪽의 구멍에서 시작하여 전두엽 부위로 뻗어 정중선을 따라 피부를 조심스럽게 절개합니다.
- 두개골을 조심스럽게 제거하고 가위로 부드럽게 들어 올려 연수막을 손상시키지 않도록 하여 연수막을 포함한 뇌 전체를 얻습니다.
- 뇌 전체를 세척 완충액에 담그고 부드럽게 씻어내어 표면 혈액을 제거합니다.
- 뇌를 자르지 않고 멸균된 페트리 접시에 옮기고 현미경으로 미세한 핀셋을 사용하여 뇌 표면에서 렙토메닝을 추출합니다.
- 멸균 마이크로 가위를 사용하여 렙토메닝 조직을 조각으로 자릅니다.
4. 렙토메닝 효소 소화
- 효소 혼합물 10mL(단계 1.2)를 단편에 첨가하고 37°C에서 15분 동안 배양합니다. 조각이 튜브 바닥에서 분리되도록 부드럽게 저어줍니다. 그 후, 10mL의 정지 완충액(1.4단계)을 추가하여 분해를 중단시킵니다.
- 4°C에서 5분 동안 300 x g 으로 원심분리하고 피펫을 사용하여 상층액을 조심스럽게 제거합니다.
- 콜드 PBS 10mL를 넣고 혼합물을 70μm 스트레이너를 통해 멸균 50mL 튜브에 통과시켜 덩어리를 걸러냅니다.
5. 세포 확장
- 1 x 10 cm당 5개 세포를 5mL의 배양 배지로 피브로넥틴 코팅된 T25 플라스크(2단계)에 플레이트 2개로 만듭니다.
- 37°C에서 5%CO2 로 24시간 동안 세포를 배양합니다. 그런 다음 배지를 제거하여 부착되지 않은 세포를 제거합니다.
- 이틀에 한 번씩 배지의 50%를 교체하여 배양을 유지합니다. 이 과정을 두세 번 반복한다.
6. 마그네틱 셀 선택
알림: 신속하게 작업하고, 셀 냉각을 유지하고, 사전 냉각된 용액을 활용하여 비특이적 셀 라벨링을 방지합니다.
- 기기 및 시약 준비: 자기 분리기를 자기 분리기 스탠드에 부착합니다( 재료 표 참조). 선택 컬럼을 자기 분리기에 연결하고 70μm 셀 스트레이너를 선택 컬럼 위에 배치합니다. 선택 컬럼 아래에 50mL 튜브를 놓아 흐름을 수집합니다.
- 효소 분해: 세포가 80% 합류에 도달하면 배지를 흡인하고 PBS로 세포를 헹굽니다. 0.25% 트립신을 첨가하여 부착 세포를 분리하고 37°C에서 5분 동안 배양합니다. 중지 버퍼를 추가하여 분해를 중지합니다. 실온에서 300 x g 에서 5분 동안 세포를 원심분리하고 상층액을 제거합니다.
- 항체 배양: 100μL의 PBS에 1 x 107 개의 총 세포를 재현탁시키고 10μL의 LYVE-1 항체를 추가합니다( 재료 표 참조). 잘 섞고 4°C의 어두운 곳에서 30분 동안 배양합니다.
- 세포를 300 x g 에서 5분 동안 회전시키고 상층액을 버립니다. PBS 1mL를 주입하고 300 x g 에서 5분 동안 원심분리하여 세포를 헹굽니다. 상층액을 완전히 제거하십시오.
- 마이크로비즈 라벨링: 100μL의 PBS에 세포를 재현탁시키고 20μL의 마이크로비즈를 추가합니다( 재료 표 참조). 잘 섞고 4°C의 어두운 곳에서 30분 동안 배양합니다.
- 세포를 300 x g 에서 5분 동안 회전시키고 상층액을 디캔팅합니다. 그 후, 300 x g 에서 5분 동안 원심분리를 통해 PBS 1mL로 세포를 세척합니다. 마지막으로 상층액을 완전히 제거합니다.
- 자기 음성 배제: 4mL의 PBS에 세포를 재현탁시킵니다. 70μm 셀 스트레이너에 세포를 통과시켜 덩어리를 제거합니다. 선택 컬럼( 재료 표 참조)을 3mL의 PBS로 헹구어 준비한 다음 셀 현탁액을 선택 컬럼에 적용합니다.
- 3mL의 PBS로 세척 단계를 수행하고 LYVE-1-음성 세포를 선택 컬럼 아래에 위치한 50mL 튜브에 수집하여 통과시킬 수 있도록 합니다.
- 자기 양성 선택: PBS 6mL를 선택 컬럼에 피펫팅합니다. 플런저를 선택 컬럼에 단단히 밀어 넣어 자기적으로 표지된 세포를 즉시 플러시하여 LYVE-1 양성 LLEC를 얻습니다.
알림: 다음 단계로 진행하기 전에 항상 선택 열 저장소가 비워질 때까지 기다리십시오.
7. LLEC의 문화
- LYVE-1 양성 LLEC를 300 x g 에서 5분 동안 원심분리한 다음 상층액을 조심스럽게 제거합니다.
- 1 x 10cm당 5개 세포를 5mL의 배양 배지가 있는 피브로넥틴 코팅된 T25 플라스크에 2개 플레이트로 만듭니다.
- 이틀에 한 번씩 배지의 50%를 교체하여 배양을 유지합니다. 세포가 80% 합류에 도달하면 0.25% 트립신으로 세포를 분리하고 세포 통과를 수행합니다. 2-3 통과 후 후속 실험을 위해 세포를 활용하십시오.
8. 유세포 분석
참고: 유세포 분석은 앞서 설명한 절차15에 따라 수행되었습니다.
- 0.25% 트립신을 첨가하여 부착 세포를 분리하고 37°C에서 5분 동안 배양합니다. 그런 다음 중지 버퍼를 추가하여 소화를 중지합니다.
- 세포를 300 x g 에서 5분 동안 원심분리하고 상층액을 완전히 흡인합니다. 1 x 106 세포를 100 μL의 PBS에 재현탁시킵니다.
- LYVE-1 항체 1μL를 추가합니다. 잘 섞고 실온의 어두운 곳에서 10분 동안 배양합니다.
- 유세포 분석 및 FlowJo 소프트웨어를 사용하여 분석을 위해 적절한 양의 PBS 완충액에 세포를 재현탁시킵니다( 재료 표 참조).
9. 면역형광 염색
참고: 면역형광 염색은 앞서 설명한 절차에 따라수행되었습니다 16.
- PBS로 세포를 세 번 씻습니다. 실온에서 4% 파라포름알데히드(PFA)로 세포를 10분 동안 고정합니다. PFA를 버리고 PBS로 세포를 세 번 씻습니다.
- 실온에서 1시간 동안 블록 버퍼를 적용합니다. 커버슬립에서 블록 버퍼를 제거합니다.
- 염색 완충액의 LYVE-1 항체를 세포에 추가하고 어두운 곳에서 배양합니다. PBS로 세포를 세 번 세척합니다.
- 염색 완충액에 적절한 2차 항체( 재료 표 참조)를 세포에 추가하고 어두운 곳에서 배양합니다. PBS로 세포를 세 번 세척합니다.
- 4',6-diamidino-2-phenylindole(DAPI)로 대조염색. 이제 세포는 면역형광 현미경 검사를 받을 준비가 되었습니다.
결과
이 연구는 생쥐에서 림프 내피 세포(LEC)를 채취한 후 시험관 내에서 1차 배양을 확립하기 위한 재현 가능한 다단계 프로토콜을 제시합니다. 주요 단계에는 플라스크 준비 및 피브로넥틴 코팅, 렙토메닝의 해리, 효소 분해를 통한 단세포 현탁액 획득, VEGF-C로 LLEC 확장 유도가 포함됩니다. 그런 다음 LYVE-1 양성 LLEC를 자기 활성화 세포 분류(MACS)를 사용하여 선택적으로 분리합니다. 마지막으로, 면역형광 염색 및 유세포 분석을 수행하여 LLEC의 순도를 평가하며, MTT 분석 결과는 강력한 LLECs 성장률을 보여줍니다(보충 그림 1). 이 다중 절차 프로토콜의 기본 단계는 순서도에 나와 있으며 전체 프로세스는 약 2-3주가 소요됩니다(그림 1).
LLEC를 수확하기 위해서는 렙토메닝을 해리하고 LLEC의 확장을 촉진하는 동시에 효율적인 수술 기법을 통해 세포 생존력을 보존하고 추운 환경을 유지하는 것이 필수적입니다(그림 2A-E). 멸균 상태에서 렙토메닝과 함께 뇌 전체를 채취한 후, 혈액 적색 세포를 제거하기 위해 부드러운 세척 단계를 수행합니다(그림 2F). 다음으로, 렙토메닝은 현미경으로 뇌 표면에서 조심스럽게 추출됩니다(그림 2G). 이러한 렙토메닝은 주로 콜라겐 섬유로 구성되어 있으므로 효소 소화를 촉진하기 위해 단편화되어 있습니다(그림 2H). 그 후, 이러한 단편의 효소 분해가 수행되고 남아 있는 덩어리는 70μm 스트레이너를 통해 여과되어 더 큰 콜라겐 섬유 클러스터를 제거합니다(그림 2I). 마지막으로, 세포를 피브로넥틴으로 코팅된 T25 플라스크에 도금하고, VEGF-C를 첨가하여 증식을 유도한다(그림 2J). 24시간 후, 배양 배지를 제거하여 부착되지 않은 세포를 제거합니다. 이러한 단계는 렙토메닝에서 세포의 수확을 촉진하고 확장을 촉진하며, 이는 공정 후반부에 충분한 LYVE-1 양성 LLEC를 얻는 데 중요합니다.
VEGF-C가 LLEC 확장을 유도하는 동안, 이질적인 세포 집단은 여전히 함께 성장할 수 있습니다. 순수한 LYVE-1 양성 LLEC를 분리하기 위해 MACS를 사용하는데, 이는 LYVE-1이 림프 내피 세포에 대해 인정된 마커이기 때문입니다. LLEC의 순도는 유세포 분석을 통해 평가되며, 그 결과 통로 2의 LYVE-1 양성 세포의 비율이 MACS 후 통로 3과 크게 다르지 않아 95% 이상의 순도를 보여줍니다(그림 3A). LYVE-1 양성 LLEC의 특이성을 추가로 검증하기 위해 3개의 추가 림프 내피 세포 마커인 포도플라닌(PDPN), 혈관 내피 성장 인자 수용체-3(VEGFR-3) 및 프로스페로 관련 호메오박스1(PROX1)을 식별에 사용했습니다17,18,19. 면역형광 염색을 통해 LYVE-1이 이 세 가지 마커와 함께 염색되는 것을 확인했습니다(그림 3B). 또한, LLEC의 정체는 생리학적 조건 하에서 뇌 절편에서 확립되었으며, LYVE-1과 PROX1, VEGFR-3 및 PDPN의 동시 염색을 보여주었습니다(보충 그림 2A). LYVE-1 양성 세포는 F4/80 및 혈소판 유래 성장 인자 베타(PDGFR-β)를 발현하지 않아 LLEC를 대식세포 및 섬유아세포와 효과적으로 구별할 수 있었습니다(보충 그림 2B). 요약하면, 이 프로토콜은 체외 배양이 가능한 고순도 LLEC를 수확할 수 있습니다.
MACS 이전의 렙토메닝 세포는 림프 내피 세포의 콜로니와 다른 이질성을 나타냅니다. 그들의 형태는 단일 원형 구에서 융합 섬유 모양에 이르기까지 다양합니다(그림 4A-D). 그러나 MACS 이후 LLEC는 전형적인 방추체 및 조약돌 모양의 내피와 유사한 특징을 나타냅니다(그림 4E-H). 이러한 결과를 바탕으로 LLEC는 이 다중 절차 프로토콜을 통해 효과적으로 수확되고 건강한 성장 상태로 유지됩니다.

그림 1: 다중 절차 프로토콜의 개략도 . 이 순서도는 LLEC의 수확 및 배양을 위한 다중 절차 프로토콜을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 렙토메닝 세포 수확 . (A) 멸균 수술 기구 준비. (B) 마우스는 4% 이소플루란의 흡입을 통해 마취시킨 후 안락사 후 70% 에탄올로 세척하였다. (C) 쥐의 목을 베고 두개골 뒤쪽에서 시작하여 전두엽 부위를 향해 피부의 정중선을 조심스럽게 절개합니다. (D) 연수막의 무결성을 보존하기 위해 두개골을 섬세하게 제거합니다. (E) 렙토메닝을 포함하는 전체 뇌의 검색. (F) 완충 용액으로 뇌 전체를 세척하여 표면 혈액을 제거합니다. (G) 미세한 핀셋을 사용하여 뇌 표면에서 연수막을 해부합니다. (H) 멸균 마이크로 가위로 렙토메닝을 단편으로 절단한 후 효소 혼합물 10mL를 첨가하고 37°C에서 15분 동안 배양합니다. (I) PBS 10mL에 펠릿을 재현탁시키고 70μm 스트레이너를 통해 덩어리를 여과합니다. (J) 코팅된 T25 플라스크에 세포 도금. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: MACS 후 LLEC 순도 평가. (A) MACS 다음 통로 2 및 3에서 LYVE-1 양성 세포의 발현을 보여주는 유세포 분석의 대표 히스토그램. MACS 후 LYVE-1 양성 세포의 비율이 95%를 초과합니다. 데이터는 세 가지 독립적인 실험(평균 ± SEM)을 대표합니다. 오차 막대는 SEM을 나타냅니다. (B) LYVE-1과 PDPN, VEGFR-3 및 PROX1의 동시 염색을 보여주는 대표적인 면역형광 이미지. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
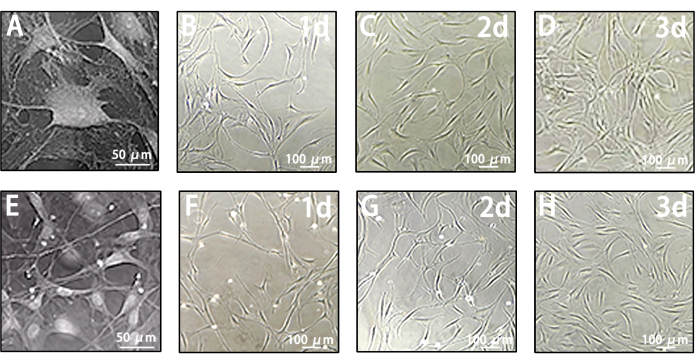
그림 4: 연수막 세포와 LLEC의 성장 특성. (A) 대표 이미지에서 캡처된 연수막 세포의 형태. 척도 막대 = 50 μm. (B-D) MACS 전 1일, 2일, 3일에 연수막 세포의 형태를 묘사한 대표 이미지. 스케일 바 = 100 μm. (E) 대표 이미지에서 캡처된 LLEC의 형태. 척도 막대 = 50 μm. (FH) MACS 후 1일차, 2일차, 3일차의 LLEC의 형태를 보여주는 대표 이미지. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: LLEC 및 SVEC4-10의 성장률. MTT 분석 결과는 SVEC4-10 그룹에 비해 통로 1에서 LLEC의 성장률이 크게 감소했음을 보여줍니다. SVEC4-10 그룹과 비교하여 통과 2와 통과 3 LLEC 그룹 간에 유의한 차이는 없었습니다. 데이터는 6개의 독립적인 실험(평균 ± SEM)의 결과를 나타냅니다. 오차 막대는 SEM을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 뇌 절편에서 LLEC의 특성화 및 구별. (A) 생리학적 조건에서 뇌 절편에서 LYVE-1과 PROX1, VEGFR-3 및 PDPN의 동시 염색을 보여주는 대표적인 면역형광 이미지. 스케일 바 = 2 μm. (B) 생리학적 조건에서 뇌 절편에서 LYVE-1이 F4/80 및 PDGFR-β와 동시 염색되지 않음을 보여주는 대표적인 면역형광 이미지. 스케일 바 = 20 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: VEGF-C 자극 하에서 LLEC의 성장. (A) 1ng/mL VEGF-C 자극 하에서 LLEC의 대표 이미지. (B) 100ng/mL VEGF-C 자극 하에서 LLEC의 대표 이미지. (C) VEGF-C 자극이 500ng/mL 미만인 LLEC의 대표 이미지. 스케일 바 = 50 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4: 수확 후 CD31, PDPN 및 VEGFR-3의 발현. (A) 유세포 분석의 대표 히스토그램은 CD31 양성 세포가 5% 미만임을 보여줍니다. (B) 유세포 분석의 대표 히스토그램은 PDPN 양성 세포가 95%를 초과한다는 것을 나타냅니다. (C) 유세포 분석의 대표 히스토그램은 VEGFR-3 양성 세포가 95%를 초과한다는 것을 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 5: LLEC의 형태 및 CD31과의 차이점. (A) 헤마톡실린-에오신 염색에 의해 밝혀진 LLECs 형태의 대표 이미지. 스케일 바 = 20 μm. (B) 대표적인 면역형광 이미지는 LYVE-1 및 PDPN이 CD31과 동시 염색되지 않음을 보여줍니다. 스케일 바 = 50 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 6: LLEC의 확산 속도. CCK-8 분석의 대표적인 결과는 각각 2번 및 5번 항에 비해 1번 항과 6번 항에서 LLEC의 증식률이 현저히 감소했음을 보여줍니다. 데이터는 6개의 독립적인 실험(평균 ± SEM)의 결과를 나타냅니다. 오차 막대는 SEM을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
시험관 내에서 LLEC를 수확하고 배양하기 위한 기존 프로토콜은 이전에 보고된 적이 없습니다. 이 연구는 마우스 렙토메닝에서 LLEC를 수확하고 배양하기 위한 재현 가능한 다중 절차 프로토콜을 소개합니다.
이 다중 절차 프로토콜은 재현 가능하지만 몇 가지 주요 고려 사항이 있습니다. 예를 들어, 피브로넥틴 코팅된 T25 플라스크는 비부착 세포를 제거함으로써 LLEC의 접착과 기능을 촉진하여 보다 균질한 세포 집단을 보장합니다. 또한 렙토메닝을 해리하기 위한 수술 절차 중 시간과 온도는 세포 생존력에 영향을 미치는 중요한 요소입니다. 따라서 지속 시간을 1시간 이내로 유지하고 버퍼를 충분히 차갑게 유지하는 것이 중요합니다. 또 다른 중요한 점은 렙토메닝에 적혈구가 존재한다는 것인데, 이로부터 헤모글로빈의 방출이 LLEC에 해를 끼칠 수 있습니다. 이를 완화하려면 적혈구를 부드럽게 씻어내고 씻어 적혈구를 제거하여 세포 독성 효과를 예방하는 것이 중요합니다. 마지막으로, LLEC는 특히 100ng/mL 농도에서 VEGF-C20을 사용한 자극이 필요합니다. 이러한 자극 하에서, LLEC는 튜브를 형성하기보다는 특징적인 내피와 유사한 형태를 나타낸다(보충 그림 3A-C). 결과적으로, 이 연구는 세포 집단에서 확장을 유도하고 균질성을 유지하기 위해 100ng/mL VEGF-C를 함유한 배양 배지를 사용했습니다.
여기에 설명된 다중 절차 프로토콜에는 문제 해결 단계 및 몇 가지 제한 사항이 있습니다. 첫째, 이 프로토콜은 완료하는 데 2-3주가 걸리므로 자주 반복하는 것은 실용적이지 않습니다. 둘째, 수술 및 효소 시술로 인해 도금 전에 제거되지 않은 죽은 세포가 존재하여 잠재적으로 세포 배양에 영향을 미칠 수 있습니다. 이 가능성은 향후 프로토콜 구현에서 탐구될 것입니다. 셋째, 수확된 LEC(VEGFR-3 및 PDPN 양성 세포)의 순도는 95%를 초과하지만, 5% 미만을 구성하는 CD31 양성 세포를 포함한 일부 이종 세포 집단은 지속됩니다(보충 그림 4A-C). 이는 일차 세포 배양에서 흔히 발생하는 문제입니다. 헤마톡실린-에오신 염색의 고해상도 이미지는 LLEC가 특징적인 내피와 유사한 모양을 나타내지만 CD31을 발현하지 않는다는 것을 보여줍니다(보충 그림 5A,B). 마지막으로, CCK-8 분석 결과는 각각 2 및 5 통과에 비해 1 및 6 통과에서 LLEC의 증식 속도가 유의하게 감소했음을 나타냅니다(보충 그림 6). 1번 통로는 항체 처리로 인한 LLECs 손상과 분류 중 물리적 스트레스로 이어질 수 있는 반면, 6번 통로는 통로 수가 증가함에 따라 증식이 감소하는 것을 보여줍니다. 그러므로, 통로 6 이후의 후속 세포는 관련 실험에 적합하지 않다. 수막(21)에서의 섬유아세포의 분포를 감안할 때, 오염된 세포의 대략 5%는 섬유아세포를 포함할 수 있다. 이를 해결하기 위해, 유전적 및 면역자성 세포 분류의 첨가를 사용하여 오염된 섬유아세포를 제거할 수 있다22,23. LLEC의 각 통로에서 섬유아세포의 오염률을 모니터링하면 섬유아세포가 LLEC의 성장에 미치는 영향을 제거하는 데 도움이 된다24. 마우스와 인간 사이의 이질성을 고려할 때, 1차 인간 LLEC의 수확 및 배양은 향후 연구에서 잠재적인 임상 적용을 위해 추구되어야 합니다.
요약하자면, 현재 시험관 내에서 LLEC를 수확하고 배양하기 위한 확립된 프로토콜은 없습니다. 이 연구는 생쥐 렙토메닝에서 LLEC를 수확한 후 시험관에서 1차 배양을 확립하기 위한 재현 가능한 다중 절차 프로토콜을 소개합니다. 이 연구는 세포 기능과 LLEC의 잠재적인 임상 적용에 대한 추가 탐구를 촉진할 것입니다.
공개
저자는 공개할 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 중국 국립자연과학재단(81960226, 81760223), 윈난성 자연과학재단(202001AS070045, 202301AY070001-011), 윈난성 교육부 과학연구재단(2023Y0784)의 보조금으로 지원됐다.
자료
| Name | Company | Catalog Number | Comments |
| Block buffer | Beyotime | P0102 | Store aliquots at –4 °C |
| Collagenase I | Solarbio | C8140 | Store aliquots at –20 °C |
| DAPI | Beyotime | P0131 | Store aliquots at –20 °C |
| DMEM | Solarbio | 11995 | Store aliquots at –4 °C |
| D-PBS | Solarbio | D1041 | Store aliquots at –4 °C |
| EGM-2 MV Bullet Kit | Lonza | C-3202 | Store aliquots at –4 °C |
| FBS | Solarbio | S9010 | Store aliquots at –20 °C |
| Fibronectin | Solarbio | F8180 | Store aliquots at –20 °C |
| FlowJo Software | BD Biosciences | V10.8.1 | |
| LYVE-1 antibody | eBioscience | 12-0443-82 | Store aliquots at –4 °C |
| Magnetic separator | Miltenyi | 130-042-302 | Sterile before use |
| Magnetic separator stand | Miltenyi | 130-042-303 | Sterile before use |
| Microbeads | Miltenyi | 130-048-801 | Store aliquots at –4 °C |
| P/S | Solarbio | P1400 | Store aliquots at –20 °C |
| Papain | Solarbio | G8430-25g | Store aliquots at –20 °C |
| PBS | Solarbio | D1040 | Store aliquots at –4 °C |
| PDPN antibody | Santa | sc-53533 | Store aliquots at –4 °C |
| PFA | Solarbio | P1110 | Store aliquots at –4 °C |
| PROX1 antibody | Santa | sc-81983 | Store aliquots at –4 °C |
| Selection column | Miltenyi | 130-042-401 | Sterile before use |
| Trypsin | Gibco | 25200072 | Store aliquots at –20 °C |
| VEGF-C | Abcam | ab51947 | Store aliquots at –20 °C |
| VEGFR-3 antibody | Santa | sc-514825 | Store aliquots at –4 °C |
참고문헌
- Shibata-Germanos, S., et al. Structural and functional conservation of non-lumenized lymphatic endothelial cells in the mammalian leptomeninges. Acta Neuropathologica. 139 (2), 383-401 (2020).
- Suárez, I., Schulte-Merker, S. Cells with many talents: lymphatic endothelial cells in the brain meninges. Cells. 10 (4), 799 (2021).
- Jordan-Williams, K. L., Ruddell, A. Culturing purifies murine lymph node lymphatic endothelium. Lymphatic Research and Biology. 12 (3), 144-149 (2014).
- Jones, B. E., Yong, L. C. Culture and characterization of bovine mesenteric lymphatic endothelium. In vitro Cellular & Developmental Biology. 23 (10), 698-706 (1987).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Jablon, K. L., et al. Isolation and short-term culturing of primary lymphatic endothelial cells from collecting lymphatics: A techniques study. Microcirculation. 30 (2-3), e12778 (2023).
- Lapinski, P. E., King, P. D. Isolation and culture of mouse lymphatic endothelial cells from lung tissue. Methods in Molecular Biology. 2319, 69-75 (2021).
- Lokmic, Z. Isolation, Identification, and culture of human lymphatic endothelial cells. Methods in Molecular Biology. 1430, 77-90 (2016).
- Thiele, W., Rothley, M., Schmaus, A., Plaumann, D., Sleeman, J. Flow cytometry-based isolation of dermal lymphatic endothelial cells from newborn rats. Lymphology. 47 (4), 177-186 (2014).
- Lokmic, Z., et al. Isolation of human lymphatic endothelial cells by multi-parameter fluorescence-activated cell sorting. Journal of Visualized Experiments. 99, e52691 (2015).
- Janson, C., Romanova, L., Hansen, E., Hubel, A., Lam, C. Immortalization and functional characterization of rat arachnoid cell lines. Neuroscience. 177, 23-34 (2011).
- Romanova, L. G., Hansen, E. A., Lam, C. H. Generation and preliminary characterization of immortalized cell line derived from rat lymphatic capillaries. Microcirculation. 21 (6), 551-561 (2014).
- Park, T. I., et al. Routine culture and study of adult human brain cells from neurosurgical specimens. Nature Protocols. 17 (2), 190-221 (2022).
- Okuda, K. S., et al. lyve1 expression reveals novel lymphatic vessels and new mechanisms for lymphatic vessel development in zebrafish. Development. 139 (13), 2381-2391 (2012).
- Bokobza, C., et al. Magnetic Isolation of microglial cells from neonate mouse for primary cell cultures. Journal of Visualized Experiments. 185, e62964 (2022).
- Wang, J. M., Chen, A. F., Zhang, K. Isolation and primary culture of mouse aortic endothelial cells. Journal of Visualized Experiments. 118, e52965 (2016).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. The American Journal of Pathology. 154 (2), 385-394 (1999).
- Petrova, T. V., Koh, G. Y. Organ-specific lymphatic vasculature: From development to pathophysiology. The Journal of Experimental Medicine. 215 (1), 35-49 (2018).
- Wilting, J., et al. The transcription factor Prox1 is a marker for lymphatic endothelial cells in normal and diseased human tissues. The FASEB Journal. 16 (10), 1271-1273 (2002).
- Yin, X., et al. Lymphatic endothelial heparan sulfate deficiency results in altered growth responses to vascular endothelial growth factor-C (VEGF-C). The Journal of Biological Chemistry. 286 (17), 14952-14962 (2011).
- DeSisto, J., et al. Single-cell transcriptomic analyses of the developing meninges reveal meningeal fibroblast diversity and function. Developmental Cell. 54 (1), 43-59 (2020).
- Chen, Z., et al. A method for eliminating fibroblast contamination in mouse and human primary corneal epithelial cell cultures. Current Eye Research. , 1-11 (2023).
- Starzonek, C., et al. Enrichment of human dermal stem cells from primary cell cultures through the elimination of fibroblasts. Cells. 12 (6), 949 (2023).
- Lam, C. H., Romanova, L., Hubel, A., Janson, C., Hansen, E. A. The influence of fibroblast on the arachnoid leptomeningeal cells in vitro. Brain Research. 1657, 109-119 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유