Method Article
Визуализация митофагии флуоресцентными красителями для митохондрий и лизосом
В этой статье
Резюме
Митофагия является основным механизмом контроля качества митохондрий. Однако оценке митофагии in vivo препятствует отсутствие надежных количественных анализов. Здесь представлен протокол наблюдения митофагии в живых клетках с использованием клеточного проникающего зелено-флуоресцентного красителя митохондрий и красителя красных флуоресцентных лизосом.
Аннотация
Митохондрии, будучи электростанциями клетки, играют важную роль в биоэнергетике, генерации свободных радикалов, гомеостазе кальция и апоптозе. Митофагия является основным механизмом контроля качества митохондрий и обычно изучается с использованием микроскопических наблюдений, однако анализы митофагии in vivo трудно выполнить. Оценка митофагии путем визуализации живых органелл является альтернативным и необходимым методом митохондриальных исследований. Этот протокол описывает процедуры использования клеточного проникающего зелено-флуоресцентного красителя митохондрий MitoTracker Green и красного флуоресцентного лизосомного красителя LysoTracker Red в живых клетках, включая загрузку красителей, визуализацию митохондрий и лизосом, а также ожидаемые результаты. Также приведены подробные шаги по оценке митофагии в живых клетках, а также технические примечания о настройках программного обеспечения микроскопа. Этот метод может помочь исследователям наблюдать митофагию с помощью флуоресцентной микроскопии живых клеток. Кроме того, он может быть использован для количественной оценки митохондрий и лизосом и оценки морфологии митохондрий.
Введение
Митохондрии являются электростанциями почти всех эукариотических клеток 1,2. В дополнение к производству АТФ путем окислительного фосфорилирования, митохондрии играют жизненно важную роль в других процессах, таких как биоэнергетика, гомеостаз кальция, генерация свободных радикалов, апоптоз и клеточный гомеостаз 3,4,5. Поскольку митохондрии генерируют активные формы кислорода (АФК) из нескольких комплексов в цепи переноса электронов, они постоянно стимулируются потенциальным окислительным стрессом, который в конечном итоге может привести к структурным повреждениям и дисфункции, когда система антиоксидантной защиты разрушается 6,7. Было обнаружено, что митохондриальная дисфункция способствует развитию многих заболеваний, включая метаболические нарушения, нейродегенерацию и сердечно-сосудистые заболевания8. Поэтому крайне важно поддерживать здоровые митохондриальные популяции и их правильную функцию. Митохондрии являются высокопластичными и динамичными органеллами; их морфология и функция контролируются механизмами контроля качества митохондрий, включая посттрансляционные модификации (ПТМ) митохондриальных белков, митохондриальный биогенез, слияние, деление и митофагию 9,10. Митохондриальное деление, опосредованное связанным с динамином белком 1 (DRP1), ГТФазой надсемейства динаминов белков, приводит к малым и круглым митохондриям и изолирует дисфункциональные митохондрии, которые могут быть очищены и деградированы митофагией11,12.
Митофагия — это клеточный процесс, который избирательно разрушает митохондрии путем аутофагии, обычно происходящей в поврежденных митохондриях после травмы, старения или стресса. Впоследствии эти митохондрии доставляются в лизосомы для деградации10. Таким образом, митофагия является катаболическим процессом, который помогает поддерживать количество и качество митохондрий в здоровом состоянии в широком диапазоне типов клеток. Он играет решающую роль в восстановлении клеточного гомеостаза в нормальных физиологических и стрессовых условиях13,14. Клетки характеризуются сложным механизмом митофагии, который индуцируется различными сигналами клеточного стресса и изменений в развитии. Регуляторные пути митофагии классифицируются как убиквитин-зависимые илирецептор-зависимые 15,16; убиквитин-зависимая аутофагия опосредована киназой PINK1 и рекрутированием убиквитин-лигазы Parkin E3 в митохондрии17,18, в то время как рецептор-зависимая аутофагия включает связывание рецепторов аутофагии с микротрубочкой-ассоциированной белковой легкой цепью LC3, которая опосредует митофагию в ответ на повреждение митохондрий19.
Просвечивающая электронная микроскопия (ТЭМ) является наиболее часто используемым методом и до сих пор одним из лучших методов для наблюдения и обнаружения митофагии20. Морфологическими особенностями митофагии являются аутофагосомы или аутолизосомы, образованные слиянием аутофагосом с лизосомами, что можно наблюдать по изображениям электронной микроскопии21. Слабость электронной микроскопии (ЭМ), однако, заключается в неспособности контролировать динамические процессы митофагии, такие как деполяризация митохондрий, деление митохондрий и слияние аутофагосом и лизосом, в живой клетке20. Таким образом, оценка митофагии с помощью визуализации живых органелл является привлекательным альтернативным методом митохондриальных исследований. Метод визуализации живых клеток, описанный здесь, использует два флуоресцентных красителя для окрашивания митохондрий и лизосом. Когда происходит митофагия, поврежденные или лишние митохондрии, поглощенные аутофагосомами, окрашиваются в зеленый цвет митохондриальным красителем, в то время как красный краситель окрашивает лизосомы. Слияние этих аутофагосом и лизосом, называемых аутолизосомами, приводит к тому, что зеленая и красная флуоресценция перекрываются и проявляются в виде желтых точек, что указывает на возникновение митофагии22. Клеточно-проницаемый краситель митохондрий (MitoTracker Green) содержит умеренно тиол-реактивный хлорметиловый фрагмент для маркировки митохондрий23. Чтобы метить митохондрии, клетки просто инкубируются с красителем, который пассивно диффундирует через плазматическую мембрану и накапливается в активных митохондриях. Этот краситель митохондрий может легко окрашивать живые клетки и менее эффективен при окрашивании альдегидно-фиксированных или мертвых клеток. Лизосомный краситель (LysoTracker Red) представляет собой флуоресцентный ацидотропный зонд, используемый для маркировки и отслеживания кислых органелл в живых клетках. Этот краситель проявляет высокую селективность для кислых органелл и может эффективно маркировать живые клетки при наномолярных концентрациях24.
Здесь представлены процедуры использования этих флуоресцентных красителей в живых клетках, включая загрузку красителей и визуализацию митохондрий и лизосом. Этот метод может помочь исследователям наблюдать митофагию с помощью флуоресцентной микроскопии живых клеток. Он также может быть использован для количественной оценки митохондрий и лизосом и оценки морфологии митохондрий.
протокол
1. Клеточная культура и пассаж
ПРИМЕЧАНИЕ: Протокол описан с использованием обычно культивируемых мышиных эмбриональных фибробластов (MEF) в качестве примера.
- Культивируйте клетки MEF в чашках для культивирования клеток 10 см с 10 мл модифицированной орлиной среды Dulbecco (DMEM). Инкубируйте при 37 °C и 5% CO2 и контролируйте клетки под микроскопом при 100-кратном увеличении.
- Выполняйте рутинную передачу ячеек.
- Когда клетки достигнут 80%-90% конфлюзии (каждые 3 дня), промывайте клетки 2 мл фосфатного буферного физиологического раствора Dulbecco (DPBS). Затем добавляют 2 мл 0,05% трипсина-ЭДТА в течение 1 мин для диссоциации клеток, а затем 2 мл ДМЭМ, чтобы остановить действие трипсина-ЭДТА. Центрифугируют клеточную суспензию при 100 х г в течение 3 мин и повторно суспендируют ячейку гранулы в 1 мл ДМЭМ.
- Подсчитайте ячейки с помощью автоматизированного счетчика клеток и слайдов камеры подсчета клеток (см. Таблицу материалов), а затем привите 1,5 х 106 клеток в новую чашку для клеточной культуры размером 10 см, содержащую 10 мл DMEM.
- Для анализа митофагии подготовьте клеточную суспензию, как показано на этапе 1.2.1. Разбавить клеточную суспензию до 1 х 105 клеток/мл в свежем ДМЭМ.
- Добавьте 2 мл разбавленной клеточной суспензии в 20-миллиметровую конфокальную посуду (см. Таблицу материалов) и встряхните чашку для культивирования в «крестике». Инкубируют чашку для культивирования клеток в инкубаторе 37 °C, 5% CO2 в течение 24 ч.
2. Окрашивание митохондрий
- Удалите из морозильной камеры раствора аликвоты зеленого флуоресцентного митохондриального красителя и красителя красных флуоресцентных лизосом (см. Таблицу материалов).
- Готовят рабочие растворы красителей, разбавляя исходные растворы 1:1000 в ДМЭМ и хорошо перемешивают. Например, добавьте 2 мкл каждого из 1 мМ митохондриального красителя и лизосомного красителя к 2 мл DMEM, чтобы получить рабочую концентрацию 1 мкМ для обоих красителей.
- Извлеките среду из чашки конфокальной культуры (шаг 1.4). Добавляют 1 мл окрашивающего раствора (приготовленного на стадии 2.2) для покрытия клеток. Поместите чашку для культивирования клеток в инкубатор при 37 °C, 5% CO2 в течение 20-30 мин.
3. Конфокальная визуализация
- Готовят 1 л буфера Кребса-Хенселеита (KH) (138,2 мМ NaCl, 3,7 мМ KCl, 0,25 мМ CaCl2, 1,2 мМ KH2PO4, 1,2 мМ MgSO 4,7H2O, 15 мМ глюкозы и 21,85 мМ HEPES; конечный рН 7,4) и хранить при 4 °C (до 1 месяца).
- В день конфокальной визуализации заранее извлеките буфер KH из холодильника и предварительно разогрейте его до комнатной температуры (от 20 до 25 °C).
- Установите параметры программного обеспечения для визуализации конфокальной микроскопии (см. Таблицу материалов): Для изображений двойного возбуждения используйте последовательное возбуждение при 488 нм и 543 нм и собирайте излучение при 505-545 нм и >560 нм соответственно.
ПРИМЕЧАНИЕ: Установите параметры образа следующим образом. Режим сканирования: кадр; Скорость: 9; Среднее: количество, 1; Коэффициент усиления: от 450 до 600; Пинхол: от 30 до 200; лазер: <10%. Лучше всего сначала запустить программное обеспечение для обработки изображений, а затем полностью включить лазер 488 нм. Лазер 543 нм необходимо включить и стабилизировать в течение 3-5 мин перед использованием (рисунок 1А). - Извлеките питательную среду, содержащую краситель, из инкубатора (этап 2.3) и добавьте в чашку 1 мл буфера KH.
- Чтобы индуцировать митофагию, обрабатывают клетки карбонильным цианидом-4-(трифторметокси)фенилгидразоном (FCCP) при 1 мкМ (конечной концентрации) в буфере KH в течение 10 мин при комнатной температуре и немедленно приступают к изображению клеток с помощью конфокального микроскопа.
- Нанесите соответствующее количество масла на верхнюю часть 63-кратной масляной линзы (см. Таблицу материалов). Поместите образец клетки на стадию образца конфокального микроскопа и переместите его непосредственно над объективом.
- Используйте программное обеспечение для создания образов, чтобы найти образец, щелкнув вкладку Locate в левом верхнем углу интерфейса программного обеспечения (рисунок 1B). Выберите зеленый фильтр для эксперимента.
- Используйте грубую ручку регулировки для быстрой фокусировки, перемещая объектив вверх и вниз. После того, как образец ячейки будет хорошо виден через окуляр, выполните поиск и сфокусируйте область отдельных ячеек и переместите ее в центр поля зрения.
- Нажмите на вкладку «Приобретение » в левом верхнем углу интерфейса программного обеспечения, чтобы получить изображения. Для предварительного просмотра выберите только канал 488 нм и разрешение кадра 1024 x 1024.
- Нажмите на вкладку Live в левом верхнем углу, чтобы начать сканирование в реальном времени. Отрегулируйте поле зрения до максимально резкого и отрегулируйте мощность лазера, переместив ползунок влево или вправо (рисунок 1A). Держите коэффициент усиления ниже 600, чтобы избежать передержки.
- Отрегулируйте значение точечного отверстия на 156, значение усиления на 545 и значение цифрового смещения на 0.
- Выберите лучшее поле зрения, проверьте два канала (488 нм и 543 нм) и выберите разрешение кадра 1024 x 1024. Нажмите кнопку Привязать , чтобы получить 2D-изображения. Сохраните полученные изображения.
ПРИМЕЧАНИЕ: Зеленый краситель митохондрий имеет пик возбуждения при 490 нм и пик излучения при 516 нм; его можно возбуждать с помощью лазера 488 нм. Красный краситель лизосом имеет пик возбуждения при 576 нм и пик излучения при 590 нм; его можно возбуждать с помощью лазера 543 нм.
4. Анализ изображений
- Откройте сохраненное изображение с помощью ImageJ и импортируйте в него объединенное изображение.
- Вручную подсчитайте количество желтых точек в каждой клетке, которые указывают на то, что лизосома поглощает митохондрии.
Результаты
MitoTracker Green представляет собой зелено-флуоресцентное митохондриальное пятно, которое способно точно локализоваться в митохондриях. Краситель может легко окрашивать живые клетки и менее эффективен при окрашивании альдегидно-фиксированных или мертвых клеток (рисунок 2). Красный флуоресцентный лизосомный краситель LysoTracker Red способен маркировать и отслеживать кислые лизосомальные органеллы и может окрашивать только живые клетки (рисунок 2). Конфокальная микроскопическая визуализация позволяет визуализировать митохондрии и лизосомы, окрашенные соответствующими красителями (рисунок 1 и рисунок 2).
Митофагия представляет собой катаболический клеточный процесс, который избирательно разлагает митохондрии путем аутофагии, что обычно происходит в поврежденных митохондриях после травмы, старения или стресса20. Впоследствии эти митохондрии доставляются в лизосомы для деградации. Митофагия помогает поддерживать количество и качество митохондрий в здоровом состоянии в широком диапазоне типов клеток. В здоровых клетках млекопитающих митофагия встречается нечасто, и поэтому для индуцирования этого процесса25 требуются другие раздражители. Карбонилцианид-4 (трифторметокси) фенилгидразон (FCCP), митохондриальный разъединитель, представляет собой неспецифический ионофор, который вызывает серьезную потерю потенциала митохондриальной мембраны в течение нескольких минут, изменение внутриклеточного рН и последующую митофагию26,27. В этом исследовании FCCP использовался для запуска митофагии в клетках MEF для конфокальной визуализации. Когда поврежденные зеленые митохондрии поглощаются красными лизосомами, зеленая и красная флуоресценция перекрываются, чтобы выявить желтые ко-локализованные митохондрии-лизосомы (рисунок 3). Желтые точки на рисунках 3D и 4B соответствуют этим колокализованным митохондриально-лизосомам, представляющим собой продолжающуюся митофагию, и, таким образом, могут быть подсчитаны для оценки степени митофагии (рисунок 4).
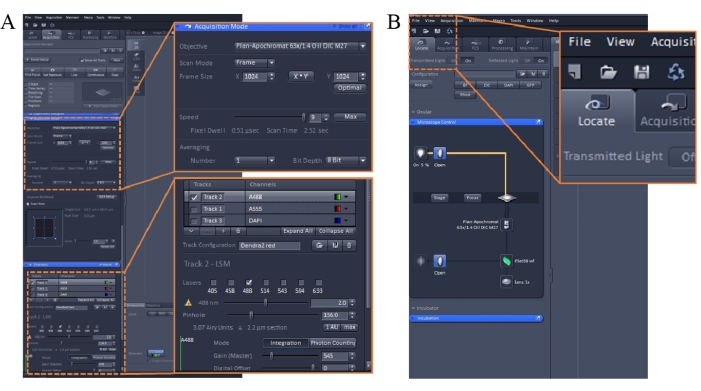
Рисунок 1: Параметры визуализации программного обеспечения для визуализации конфокальной микроскопии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
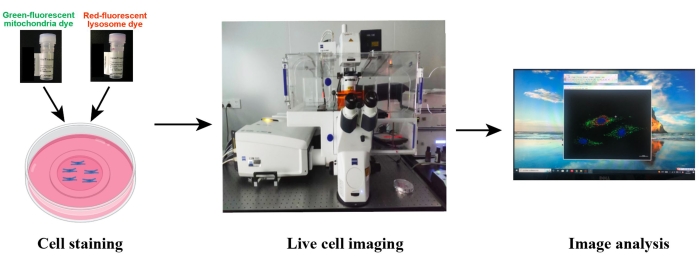
Рисунок 2: Схематическая иллюстрация конфокальной визуализации живых клеток. Живые клетки окрашивают совместно с зелено-флуоресцентным митохондриальным красителем и краснофлуоресцентным лизосомальным красителем, а затем живые клетки визуализируются с помощью конфокальной микроскопии. Обработка изображений и анализ данных выполнялись с использованием программного обеспечения для визуализации, связанного с микроскопом, или Image J. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
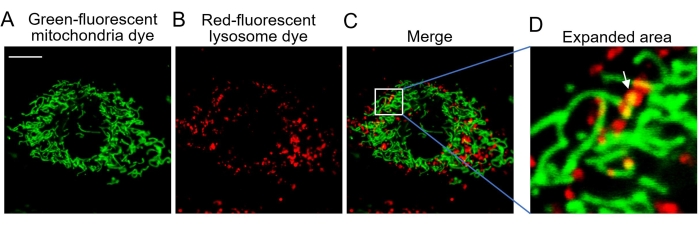
Рисунок 3: Конфокальная визуализация живых клеток. (А) Репрезентативные изображения клеток, окрашенных зелено-флуоресцентным красителем митохондрий, показывают митохондрии. (B) Репрезентативные изображения клеток, окрашенных краснофлуоресцентным красителем лизосомы, показывающие лизосому. (C) Объединенное изображение обоих флуоресцентных красителей. (D) Расширенная область с митофагией. Белая стрелка указывает на зеленые митохондрии, поглощенные красными лизосомами. Аббревиатура: Ex = длина волны возбуждения. Зелено-флуоресцентный краситель митохондрий возбуждается при 488 нм с излучением, собранным при 505-545 нм. Красный флуоресцентный краситель лизосом возбуждается при 543 нм с излучением, собранным при >560 нм. Шкала = 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
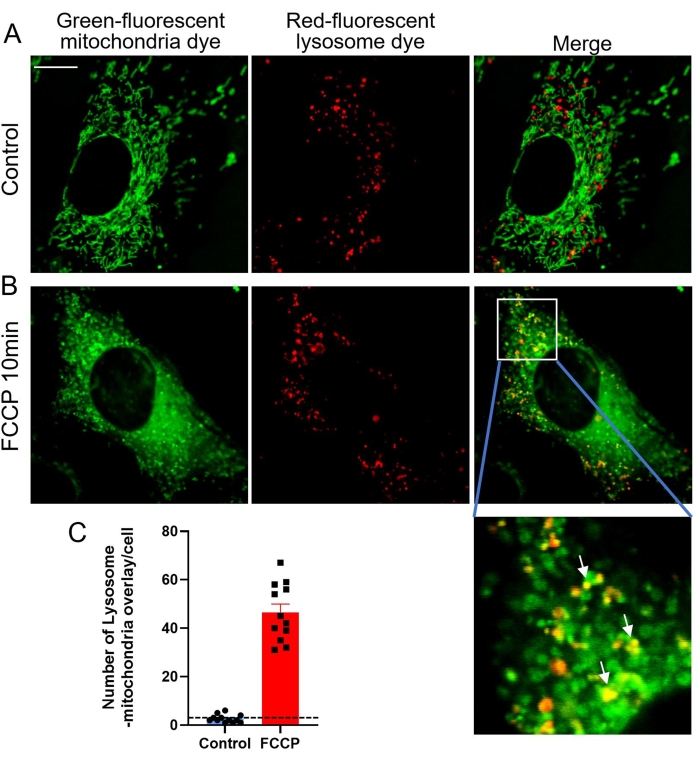
Рисунок 4: Митофагия, вызванная стимуляцией FCCP. (A) Репрезентативные изображения клеток, окрашенных совместно с зелено-флуоресцентным красителем митохондрий и красным флуоресцентным красителем лизосом. (B) Репрезентативные изображения клеток, обработанных 1 мкМ FCCP в течение 10 мин. Белая стрелка указывает на зеленые митохондрии, поглощенные красными лизосомами. (C) Количественные данные митофагии, обозначенные лизосомально-митохондриальным наложением. Данные являются средними ± SEM, n = 8 ячеек. *p < 0,05 по сравнению с контролем. Шкала = 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Протокол, описанный здесь, предоставляет метод оценки и мониторинга динамического процесса митофагии в живых клетках, включая аутофагосомы, лизосомы и деление митохондрий, путем совместного окрашивания с клеточными проницаемыми митохондриями и лизосомными красителями. Метод также может быть использован для идентификации митохондрий и оценки морфологии митохондрий. Оба красителя, используемые в этом исследовании, должны быть защищены от света, следует избегать многократных циклов замораживания-оттаивания, а красители должны храниться в одноразовых аликвотах, насколько это возможно. Рекомендуется готовить рабочие растворы красителей, чтобы избежать добавления их непосредственно в среду культивирования клеток, что может привести к высоким местным концентрациям и недостаточному перемешиванию красителей. Чтобы избежать окрашивания других клеточных структур, клетки MEF должны быть окрашены в течение 30 минут перед визуализацией с помощью конфокального микроскопа. Процедуру окрашивания рекомендуется выполнять непосредственно перед визуализацией. В клетках MEF как митохондрии, так и лизосомные красители при 1 мкМ хорошо локализованы в митохондриях и лизосомах соответственно с более высокими концентрациями красителей, приводящими к цитотоксичности, а также неспецифическому окрашиванию других клеточных структур. Эта концентрация также оптимальна для окрашивания митохондрий и лизосом в клетках H9C2. Для других клеточных линий концентрация красителя и время окрашивания, которые позволяют красителю хорошо локализоваться в органеллах, должны быть оптимизированы. Для получения четких изображений митохондрий и лизосом параметры коллекции изображений (см. примечание на шаге 3.3) должны быть добросовестно скорректированы. Слияние клеток на 50%-60% имеет решающее значение для получения отдельных изображений живых клеток, и поэтому клетки должны быть подсчитаны перед посевом. Если в лаборатории нет конфокальной посуды, в качестве альтернативы можно использовать круглые крышки. В некоторых исследованиях на животных, особенно при клинических обследованиях, трудно обнаружить митофагию в образцах живой ткани животных из-за отсутствия надежных и удобных количественных экспериментов по изучению митофагии. Тем не менее, митофагия в клетках, выделенных из тканей животных, может быть оценена с использованием протокола, описанного здесь. Ограничением этого метода является то, что, хотя оба красителя могут легко окрашивать живые клетки, они менее эффективны при окрашивании мертвых или альдегидно-фиксированных клеток.
В дополнение к красителям, используемым в этом исследовании, другие индикаторы митохондрий и лизосом, такие как MitoMM1/2 и LysoKK, соответственно, в настоящее время доступны исследователям для оценки митофагии28,29. В то время как MitoMM1/2 может окрашивать митохондрии в параформальдегид-фиксированные клетки или ткани, он не может непосредственно оценить митофагию и требует двойного окрашивания специфическим антителом, таким как анти-LC3B, для обнаружения митофагии. Поскольку LysoKK может окрашивать только живые клетки, комбинация этих красителей также может обнаруживать только митохондриальную аутофагию в живых клетках28,29. Тем не менее, MitoMM1/2 прост в использовании и позволяет использовать фильтр TRITC (так как он не проявляет возбуждения при использовании синего лазера и не производит зеленого излучения). LysoKK может окрашивать органеллы в течение 5 мин, способствуя быстрому мониторингу и оценке многочисленных раздражителей28,29.
Митофагия происходит в клетках через сложный механизм, который индуцируется различными сигналами клеточного стресса и изменениями развития. FCCP, мощный разъединитель митохондриального окислительного фосфорилирования, представляет собой неспецифический ионофор26, который использовался для индуцирования митофагии в этом исследовании. FCCP (1 мкМ) вмешивается в протонный градиент, транспортируя протоны через внутреннюю митохондриальную мембрану, процесс, который вызывает изменение внутриклеточного рН. Таким образом, FCCP может вызвать серьезную потерю потенциала митохондриальной мембраны в течение нескольких минут, а затем индуцировать митохондриальную аутофагию путем набора паркина и микротрубочек-ассоциированной белковой световой цепи 3 (LC3) в митохондрии 26,27,30. Регуляторные пути митофагии классифицируются как убиквитин-зависимые (PINK1-паркин-опосредованные) или рецептор-зависимые (опосредованные LC3 и другими рецепторами)15,16. Митофагия была изучена с использованием специфических антител, которые связываются с ключевыми молекулами в рецептор-зависимом аутофагическом пути, таком как LC3B, с последующим совместным окрашиванием с красным флуоресцентным красителем лизосом31,32. Хотя трудно дифференцировать эти два пути с использованием красителей, используемых в этом протоколе, они предлагают простой метод оценки степени митофагии в живых клетках и оценки морфологии митохондрий.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была частично профинансирована Национальной ключевой программой исследований и разработок Китая (2017YFA0105601, 2018YFA0107102), Национальным фондом естественных наук Китая (81970333,31901044, и Программой для профессора специального назначения в Шанхайских высших учебных заведениях (GZ2020008).
Материалы
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Countstar | IC1000 | |
| Cell counting chamber slides | Countstar | 12-0005-50 | |
| Dulbecco's modified Eagle medium (DMEM) | Corning | 10-013-CV | |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CVC | |
| Glass bottom cell culture dish (confocal dish) | NEST | 801002 | |
| Image J (Rasband, NIH) | NIH | https://imagej.nih.gov/ij/download.html | |
| Krebs–Henseleit(KHB) buffer | Self-prepared | ||
| LysoTracker Red | Invitrogen | 1818430 | 100 µmol/L, red-fluorescent lysosome dye |
| MitoTracker Green | Invitrogen | 1842298 | 200 µmol/L stock, green-fluorescent mitochondria dye |
| Mouse Embryonic Fibroblasts | Self-prepared | ||
| Objective (63x oil lens) | ZEISS | ZEISS LSM 880 | |
| Trypsin-EDTA 0.25% | Gibico | Cat# 25200056 | |
| ZEISS LSM 880 Confocal Laser Scanning Microscope | ZEISS | ZEISS LSM 880 | |
| ZEN Microscopy Software 2.1 (confocal microscope imaging software) | ZEISS | ZEN 2.1 |
Ссылки
- Tao, M., et al. Animal mitochondria: evolution, function, and disease. Current Molecular Medicine. 14 (1), 115-124 (2014).
- Henze, K., Martin, W. Evolutionary biology: essence of mitochondria. Nature. 426 (6963), 127-128 (2003).
- Kiriyama, Y., Nochi, H. Intra- and intercellular quality control mechanisms of mitochondria. Cells. 7 (1), (2017).
- Rossmann, M. P., Dubois, S. M., Agarwal, S., Zon, L. I. Mitochondrial function in development and disease. Disease Models & Mechanisms. 14 (6), 048912(2021).
- Suliman, H. B., Piantadosi, C. A. Mitochondrial quality control as a therapeutic target. Pharmacological Reviews. 68 (1), 20-48 (2016).
- Wong, H. S., Dighe, P. A., Mezera, V., Monternier, P. A., Brand, M. D. Production of superoxide and hydrogen peroxide from specific mitochondrial sites under different bioenergetic conditions. Journal of Biological Chemistry. 292 (41), 16804-16809 (2017).
- Zhao, R. Z., Jiang, S., Zhang, L., Yu, Z. B. Mitochondrial electron transport chain, ROS generation and uncoupling (Review). International Journal of Molecular Medicine. 44 (1), 3-15 (2019).
- Murphy, M. P., Hartley, R. C. Mitochondria as a therapeutic target for common pathologies. Nature Reviews: Drug Discovery. 17 (12), 865-886 (2018).
- Fan, H., et al. Mitochondrial quality control in cardiomyocytes: a critical role in the progression of cardiovascular diseases. Frontiers in Physiology. 11, 252(2020).
- Ma, K., et al. Mitophagy, mitochondrial homeostasis, and cell fate. Frontiers in Cell and Developmental Biology. 8, 467(2020).
- Kraus, F., Roy, K., Pucadyil, T. J., Ryan, M. T. Function and regulation of the divisome for mitochondrial fission. Nature. 590 (7844), 57-66 (2021).
- Ren, L., et al. Mitochondrial dynamics: fission and fusion in fate determination of mesenchymal stem cells. Frontiers in Cell and Developmental Biology. 8, 580070(2020).
- Onishi, M., Yamano, K., Sato, M., Matsuda, N., Okamoto, K. Molecular mechanisms and physiological functions of mitophagy. The EMBO Journal. 40 (3), 104705(2021).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Khaminets, A., Behl, C., Dikic, I. Ubiquitin-dependent and independent signals in selective autophagy. Trends in Cell Biology. 26 (1), 6-16 (2016).
- Fritsch, L. E., Moore, M. E., Sarraf, S. A., Pickrell, A. M. Ubiquitin and receptor-dependent mitophagy pathways and their implication in neurodegeneration. Journal of Molecular Biology. 432 (8), 2510-2524 (2020).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. Journal of Cell Biology. 183 (5), 795-803 (2008).
- Lazarou, M., Jin, S. M., Kane, L. A., Youle, R. J. Role of PINK1 binding to the TOM complex and alternate intracellular membranes in recruitment and activation of the E3 ligase Parkin. Developmental Cell. 22 (2), 320-333 (2012).
- Chen, M., et al. Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy. Autophagy. 12 (4), 689-702 (2016).
- Ding, W. X., Yin, X. M. Mitophagy: mechanisms, pathophysiological roles, and analysis. Biological Chemistry. 393 (7), 547-564 (2012).
- Parzych, K. R., Klionsky, D. J. An overview of autophagy: morphology, mechanism, and regulation. Antioxidants and Redox Signaling. 20 (3), 460-473 (2014).
- Hasegawa, J., et al. Autophagosome-lysosome fusion in neurons requires INPP5E, a protein associated with Joubert syndrome. The EMBO Journal. 35 (17), 1853-1867 (2016).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. Journal of Chromatography B. Analytical Technologies in the Biomedical and Life Sciences. 793 (1), 141-150 (2003).
- Chazotte, B. Labeling lysosomes in live cells with LysoTracker. Cold Spring Harbor Protocols. 2011 (2), 5571(2011).
- Pickles, S., Vigie, P., Youle, R. J. Mitophagy and quality control mechanisms in mitochondrial maintenance. Current Biology. 28 (4), 170-185 (2018).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20 (1), 31-42 (2013).
- Berezhnov, A. V., et al. Intracellular pH modulates autophagy and mitophagy. Journal of Biological Chemistry. 291 (16), 8701-8708 (2016).
- Takemori, H., et al. Visualization of mitophagy using LysoKK, a 7-nitro-2,1,3-benzoxadiazole-(arylpropyl)benzylamine derivative. Mitochondrion. 62, 176-180 (2022).
- Maeda, M., et al. The new live imagers MitoMM1/2 for mitochondrial visualization. Biochemical and Biophysical Research Communications. 562, 50-54 (2021).
- Feng, X. R., Yin, W., Wang, J. L., Feng, L., Kang, Y. J. Mitophagy promotes the stemness of bone marrow-derived mesenchymal stem cells. Experimental Biology and Medicine. 246 (1), 97-105 (2021).
- Chu, C. T., et al. Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nature Cell Biology. 15 (10), 1197-1205 (2013).
- Sentelle, R. D., et al. Ceramide targets autophagosomes to mitochondria and induces lethal mitophagy. Nature Chemical Biology. 8 (10), 831-838 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены