Method Article
ミトコンドリアとリソソームの蛍光色素によるマイトファジーの可視化
要約
マイトファジーは、ミトコンドリアの品質管理の主要なメカニズムです。しかしながら、 in vivoでの マイトファジーの評価は、信頼できる定量アッセイの欠如によって妨げられている。ここでは、細胞透過性の緑色蛍光ミトコンドリア色素と赤色蛍光リソソーム色素を使用して、生細胞内のマイトファジーを観察するためのプロトコルを紹介します。
要約
細胞の原動力であるミトコンドリアは、生体エネルギー学、フリーラジカル生成、カルシウム恒常性、およびアポトーシスにおいて重要な役割を果たしています。マイトファジーはミトコンドリアの品質管理の主要なメカニズムであり、一般的に顕微鏡観察を使用して研究されていますが、 in vivo マイトファジーアッセイは実行が困難です。生きた細胞小器官をイメージングしてマイトファジーを評価することは、ミトコンドリア研究のための代替的かつ必要な方法です。このプロトコルでは、細胞透過性緑色蛍光ミトコンドリア色素MitoTracker Greenおよび赤色蛍光リソソーム色素LysoTracker Redを生細胞で使用するための手順を、色素の負荷、ミトコンドリアおよびリソソームの可視化、および期待される結果を含めて説明します。生細胞中のマイトファジーを評価するための詳細な手順、および顕微鏡ソフトウェアの設定に関するテクニカルノートも提供されています。この方法は、研究者が生細胞蛍光顕微鏡を使用してマイトファジーを観察するのに役立ちます。さらに、ミトコンドリアとリソソームの定量化やミトコンドリアの形態の評価にも使用できます。
概要
ミトコンドリアは、ほぼすべての真核細胞の原動力です1,2。酸化的リン酸化によるATP産生に加えて、ミトコンドリアは、生体エネルギー、カルシウム恒常性、フリーラジカル生成、アポトーシス、細胞恒常性などの他のプロセスにおいて重要な役割を果たします3,4,5。ミトコンドリアは電子伝達系内の複数の複合体から活性酸素種(ROS)を生成するため、潜在的な酸化ストレスによって絶えず刺激され、抗酸化防御システムが崩壊すると、最終的には構造的損傷や機能不全につながる可能性があります6,7。ミトコンドリア機能障害は、代謝障害、神経変性、心血管疾患など、多くの疾患に寄与することがわかっています8。したがって、健康なミトコンドリア集団とその適切な機能を維持することが重要です。ミトコンドリアは非常に可塑的で動的な細胞小器官です。それらの形態と機能は、ミトコンドリアタンパク質の翻訳後修飾(PTM)、ミトコンドリア生合成、融合、分裂、およびマイトファジーを含むミトコンドリア品質管理メカニズムによって制御されています9,10。ダイナミンスーパーファミリーのタンパク質のGTPアーゼであるダイナミン関連タンパク質1(DRP1)によって媒介されるミトコンドリア分裂は、小さくて丸いミトコンドリアをもたらし、機能不全のミトコンドリアを分離し、マイトファジーによって除去および分解することができます11,12。
マイトファジーは、オートファジーによってミトコンドリアを選択的に分解する細胞プロセスであり、通常、損傷、老化、またはストレスの後に損傷したミトコンドリアで発生します。続いて、これらのミトコンドリアは、分解のためにリソソームに送達される10。したがって、マイトファジーは、広範囲の細胞型においてミトコンドリアの量と質を健康な状態に維持するのに役立つ異化プロセスです。これは、通常の生理学的およびストレス条件下での細胞の恒常性の回復に重要な役割を果たします13,14。細胞は、細胞ストレスおよび発生変化の異なるシグナルによって誘発される複雑なマイトファジー機構によって特徴付けられる。マイトファジー調節経路は、ユビキチン依存性または受容体依存性に分類されます15,16;ユビキチン依存性オートファジーは、キナーゼPINK1とユビキチンリガーゼParkin E3のミトコンドリアへの動員によって媒介されますが17,18、受容体依存性オートファジーは、ミトコンドリア損傷に応答してマイトファジーを媒介する微小管関連タンパク質軽鎖LC3へのオートファジー受容体の結合を含みます19。
透過型電子顕微鏡(TEM)は、マイトファジーを観察および検出するために最も一般的に使用される方法であり、依然として最良の方法の1つです20。マイトファジーの形態学的特徴は、オートファゴソームまたはオートファゴソームとリソソームの融合によって形成されるオートリソソームであり、これは電子顕微鏡画像から観察することができる21。しかし、電子顕微鏡(EM)の弱点は、生細胞20におけるミトコンドリア脱分極、ミトコンドリア分裂、オートファゴソームとリソソームの融合などのマイトファジーの動的プロセスを監視できないことです。したがって、生体オルガネラのイメージングを通じてマイトファジーを評価することは、ミトコンドリア研究の魅力的な代替方法です。ここで説明するライブセルイメージング技術は、2つの蛍光色素を使用してミトコンドリアとリソソームを染色します。マイトファジーが発生すると、オートファゴソームに取り込まれた損傷または余分なミトコンドリアはミトコンドリア色素によって緑色に染色され、赤色染料はリソソームを染色します。オートリソソームと呼ばれるこれらのオートファゴソームとリソソームの融合により、緑と赤の蛍光が重なり合って黄色の点として現れ、マイトファジーの発生を示します22。細胞透過性ミトコンドリア色素(MitoTracker Green)には、ミトコンドリア23を標識するための軽度のチオール反応性クロロメチル部分が含まれています。ミトコンドリアを標識するために、細胞は単に色素と共にインキュベートされ、それは原形質膜を横切って受動的に拡散しそして活性ミトコンドリアに蓄積する。このミトコンドリア色素は生細胞を容易に染色することができ、アルデヒド固定または死細胞の染色にはあまり効果的ではありません。リソソーム色素(LysoTracker Red)は、生細胞の酸性細胞小器官の標識と追跡に使用される蛍光アシドトロピックプローブです。この色素は酸性細胞小器官に対して高い選択性を示し、ナノモル濃度で生細胞を効果的に標識することができます24。
ここでは、これらの蛍光色素を生細胞に使用する手順(色素のロード、ミトコンドリアとリソソームの可視化など)について説明します。この方法は、研究者が生細胞蛍光顕微鏡を使用してマイトファジーを観察するのに役立ちます。また、ミトコンドリアとリソソームの定量化、およびミトコンドリアの形態の評価にも使用できます。
プロトコル
1. 細胞培養と継代
注:プロトコルは、例としてルーチン培養マウス胚性線維芽細胞(MEF)を使用して説明されています。
- 10 mLのダルベッコ改変イーグル培地(DMEM)を含む10 cm細胞培養皿でMEF細胞を培養します。37°Cおよび5%CO2 でインキュベートし、顕微鏡下で細胞を100倍の倍率でモニターします。
- 定期的な細胞継代を実行します。
- 細胞が80%〜90%のコンフルエントに達したら(3日ごと)、2 mLのダルベッコリン酸緩衝生理食塩水(DPBS)で細胞を洗浄します。次に、2 mLの0.05%トリプシン-EDTAを1分間添加して細胞を解離し、続いて2 mLのDMEMを加えてトリプシン-EDTAの作用を停止します。細胞懸濁液を100 x g で3分間遠心分離し、細胞ペレットを1 mLのDMEMに再懸濁します。
- 自動セルカウンターとセルカウントチャンバースライド( 材料表を参照)を使用して細胞をカウントし、10 mLのDMEMを含む新しい10 cm細胞培養皿に1.5 x 106 細胞を接種します。
- マイトファジーアッセイでは、ステップ1.2.1のように細胞懸濁液を調製します。細胞懸濁液を新鮮なDMEMで1 x 105 細胞/mLに希釈します。
- 希釈した細胞懸濁液2 mLを20 mmの共焦点ディッシュ( 材料表を参照)に加え、培養ディッシュを「クロス」で振とうします。細胞培養皿を37°C、5%CO2 インキュベーター中で24時間インキュベートする。
2.ミトコンドリア染色
- 緑色蛍光ミトコンドリア色素と赤色蛍光リソソーム色素のストック溶液アリコート( 材料の表を参照)を-20°Cの冷凍庫から取り出します。
- 原液をDMEMで1:1,000に希釈して染料の作業溶液を調製し、よく混ぜます。例えば、DMEM2 mLに1 mMのミトコンドリア色素とリソソーム色素をそれぞれ2 μL添加すると、両方の色素の使用濃度が1 μMになります。
- 共焦点培養皿から培地を取り出します(ステップ1.4)。細胞を覆う染色液(ステップ2.2で調製)を1 mL加えます。細胞培養皿を37°C、5%CO2 のインキュベーターに20〜30分間入れます。
3. 共焦点イメージング
- 1 Lのクレブス・ヘンゼライト(KH)バッファー(138.2 mM NaCl、3.7 mM KCl、0.25 mM CaCl 2、1.2 mM KH 2 PO 4、1.2 mM MgSO 4.7H2O、15 mM グルコース、および21.85mM HEPES、最終pH7.4)を調製し、4°Cで保存します(最長1ヶ月間)。
- 共焦点撮影当日は、あらかじめ冷蔵庫からKHバッファーを取り出し、室温(20〜25°C)に予温してください。
- 共焦点顕微鏡イメージングソフトウェアのパラメータを設定します( 材料の表を参照)。 デュアル励起画像の場合、488 nmと543 nmで順次励起を使用し、それぞれ505-545 nmと>560 nmで発光を収集します。
メモ: イメージング設定を次のように設定します。スキャンモード:フレーム;スピード:9;平均: 数値、1;ゲイン:450〜600;ピンホール:30から200;レーザー:<10%。最初にイメージングソフトウェアを起動してから、488nmレーザーを完全にオンにすることをお勧めします。543 nmレーザーは、使用前にオンにして3〜5分間安定させる必要があります(図1A)。 - 色素を含む培養液をインキュベーターから取り出し(ステップ2.3)、1 mLのKHバッファーをディッシュに加えます。
- マイトファジーを誘導するには、細胞をシアニドカルボニル-4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)で1 μM(最終濃度)のKHバッファー中で室温で10分間処理し、すぐに共焦点顕微鏡を使用して細胞のイメージングに進みます。
- 63xオイルレンズの上部に適量のオイルを塗布します( 材料の表を参照)。細胞サンプルを共焦点顕微鏡のサンプルステージに置き、対物レンズの真上に移動します。
- イメージングソフトウェアを使用して、ソフトウェアインターフェイスの左上隅にある [検索 ]タブをクリックしてサンプルを見つけます(図1B)。実験用の緑色のフィルター セットを選択します。
- 粗調整ノブを使用して、対物レンズを上下に動かしてすばやく焦点を合わせます。細胞サンプルが接眼レンズを通してはっきりと見えるようになったら、単一細胞の領域を検索して焦点を合わせ、視野の中心に移動します。
- ソフトウェアインターフェイスの左上隅にある [取得 ]タブをクリックして、画像を取得します。プレビュー用に 488 nm チャンネルとフレーム解像度 1024 x 1024 のみを選択します。
- 左上隅にある[ライブ]タブをクリックして、 ライブ スキャンを開始します。視野を最もシャープに調整し、スライダーを左右に動かしてレーザー出力を調整します(図1A)。露出オーバーを避けるために、ゲイン設定を600未満に保ちます。
- ピンホール値を156に、ゲイン値を545に、デジタルオフセット値を0に調整します。
- 最適な視野を選択し、2つのチャンネル(488 nmと543 nm)を確認し、フレーム解像度1024 x 1024を選択します。[ スナップ ] をクリックして 2D 画像を取得します。取得した画像を保存します。
注:緑色のミトコンドリア色素は、490 nmに励起ピークがあり、516 nmに発光ピークがあります。488nmレーザーを使用して励起できます。赤色リソソーム色素は、576nmに励起ピークを有し、590nmに発光ピークを有する。543nmレーザーを使用して励起できます。
4. 画像解析
- 保存した画像をImageJで開き、差し込み画像をインポートします。
- 各セル内の黄色の点の数を手動で数えますが、これはリソソームがミトコンドリアを飲み込んでいることを示します。
結果
MitoTracker Greenは、ミトコンドリアに正確に局在することができる緑色蛍光ミトコンドリア染色剤です。この色素は生細胞を簡単に染色できますが、アルデヒド固定細胞や死細胞の染色にはあまり効果がありません(図2)。赤色蛍光リソソーム色素LysoTracker Redは、酸性リソソーム細胞小器官の標識と追跡が可能で、生細胞のみを染色することができます(図2)。共焦点顕微鏡イメージングにより、適切な色素で染色されたミトコンドリアとリソソームを可視化できます(図1 および 図2)。
マイトファジーは、オートファジーによってミトコンドリアを選択的に分解する異化細胞プロセスであり、これは通常、損傷、老化、またはストレスの後に損傷したミトコンドリアで発生します20。続いて、これらのミトコンドリアは分解のためにリソソームに送達される。マイトファジーは、幅広い細胞タイプでミトコンドリアの量と質を健康な状態に維持するのに役立ちます。健康な哺乳動物細胞では、マイトファジーはまれにしか起こらないため、このプロセスを誘導するために他の刺激が必要です25。ミトコンドリア脱共役剤であるカルボニルシアニド-4(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)は、数分以内にミトコンドリア膜電位の深刻な喪失、細胞内pHの変化、およびその後のマイトファジーを引き起こす非特異的イオノフォアです26,27。この研究では、FCCPを使用して、共焦点イメージングのためにMEF細胞のマイトファジーをトリガーしました。損傷した緑色染色ミトコンドリアが赤色染色リソソームに飲み込まれると、緑色と赤色の蛍光が重なり合い、黄色の共局在ミトコンドリアリソソームが現れます(図3)。図3Dおよび図4Bの黄色の点は、これらの共局在ミトコンドリア-リソソームに対応し、進行中のマイトファジーを表しているため、マイトファジーの程度を評価するためにカウントできます(図4)。
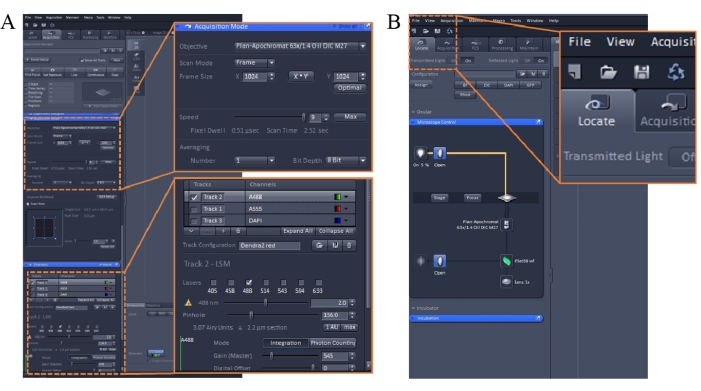
図1:共焦点顕微鏡イメージングソフトウェアのイメージングパラメータ。 この図の拡大版を表示するには、ここをクリックしてください。
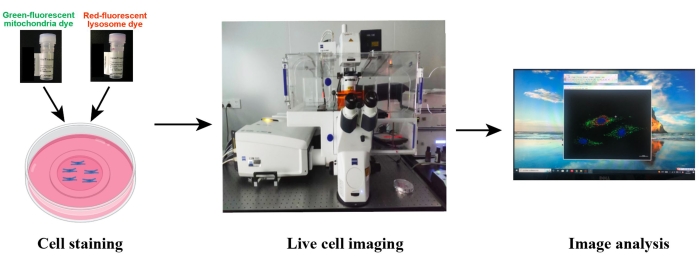
図2:生細胞の共焦点イメージングの概略図。生細胞を緑色蛍光ミトコンドリア色素と赤色蛍光リソソーム色素で共染色し、共焦点顕微鏡を用いて生細胞を画像化する。画像処理およびデータ解析は、顕微鏡関連イメージングソフトウェアまたはImage Jを使用して実行しました。 この図の拡大版を表示するには、ここをクリックしてください。
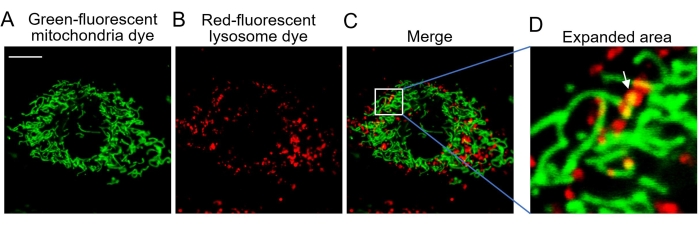
図3:生細胞の共焦点イメージング 。 (a)緑色蛍光ミトコンドリア色素で染色した細胞の代表的な画像は、ミトコンドリアを示す。(B)リソソームを示す赤色蛍光リソソーム色素で染色した細胞の代表像。(c)両蛍光色素の合成像。(D)マイトファジーを示す拡大領域。白い矢印は、赤いリソソームに飲み込まれた緑色のミトコンドリアを示しています。略語:Ex =励起波長。緑色蛍光ミトコンドリア色素は488 nmで励起され、505-545 nmで発光が収集されます。赤色蛍光リソソーム色素は543 nmで励起され、>560 nmで発光が収集されます。スケールバー = 10 μm。 この図の拡大版を表示するには、ここをクリックしてください。
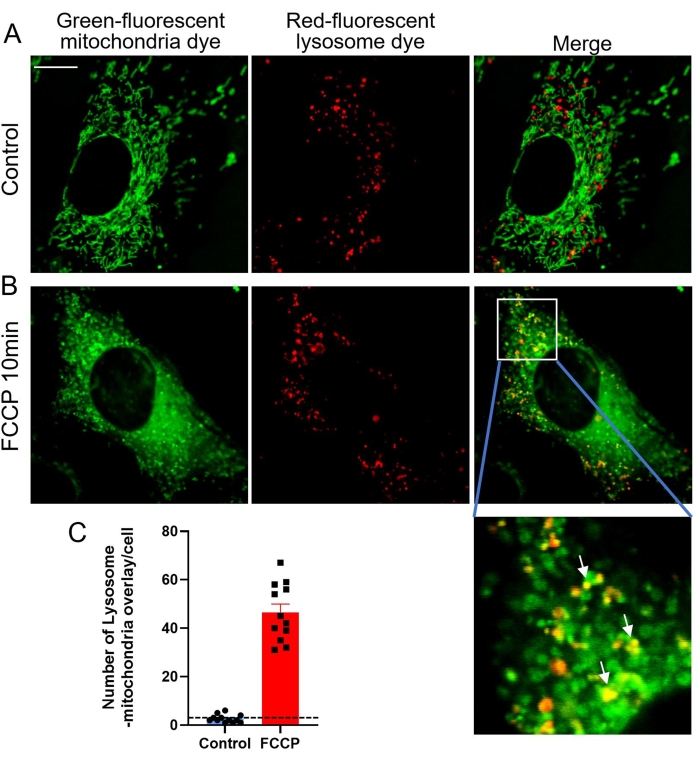
図4:FCCP刺激によって引き起こされるマイトファジー 。 (A)緑色蛍光ミトコンドリア色素と赤色蛍光リソソーム色素を共染色した細胞の代表的な画像。(B)1 μM FCCPで10分間処理した細胞の代表的な画像。白い矢印は、赤いリソソームに飲み込まれた緑色のミトコンドリアを示しています。(C)リソソーム-ミトコンドリアオーバーレイによって示されるマイトファジーの定量データ。データはSEM±平均値であり、n = 8セルである。*p < 0.05 対対照。スケールバー = 10 μm。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここで説明するプロトコルは、オートファゴソーム、リソソーム、およびミトコンドリア分裂を含む生細胞におけるマイトファジーの動的プロセスを、細胞透過性ミトコンドリアおよびリソソーム色素との共染色を通じて評価およびモニタリングする方法を提供します。この方法は、ミトコンドリアを同定し、ミトコンドリアの形態を評価するためにも使用できます。この研究で使用される両方の染料は、光から保護する必要があり、複数の凍結融解サイクルを回避し、染料は可能な限り使い捨てアリコートで保管する必要があります。色素の作業溶液を調製して、細胞培養培地に直接添加しないようにすることをお勧めします, その結果、局所濃度が高くなり、色素の混合が不十分になる可能性があります。.他の細胞構造の染色を避けるために、共焦点顕微鏡でイメージングする前にMEF細胞を30分間染色する必要があります。イメージングの直前に染色手順を実行することをお勧めします。MEF細胞では、1 μMのミトコンドリア色素とリソソーム色素の両方がそれぞれミトコンドリアとリソソームによく局在しており、色素濃度が高いほど細胞毒性や他の細胞構造の非特異的染色が生じます。この濃度は、H9C2細胞のミトコンドリアおよびリソソームの染色にも最適です。他の細胞株では、色素が細胞小器官によく局在することを可能にする色素濃度と染色時間を最適化する必要があります。ミトコンドリアとリソソームの鮮明な画像を取得するには、画像収集パラメータ(ステップ3.3の注を参照)を良心的に調整する必要があります。50%〜60%での細胞コンフルエンスは、個々の生細胞画像を得るために重要であるため、播種前に細胞をカウントする必要があります。ラボに共焦点皿がない場合は、円形のカバーガラスを代わりに使用できます。一部の動物実験、特に臨床試験では、マイトファジーを研究するための信頼性が高く便利な定量実験がないため、動物の生体組織サンプル中のマイトファジーを検出することは困難です。それにもかかわらず、動物組織から単離された細胞におけるマイトファジーは、ここで説明するプロトコルを使用して評価することができる。この方法の制限は、両方の色素が生細胞を容易に染色できるが、死細胞またはアルデヒド固定細胞の染色にはあまり効果的ではないことである。
この研究で使用された色素に加えて、MitoMM1 / 2やLysoKKなどの他のミトコンドリアとリソソームトレーサーが、現在、マイトファジーを評価するために研究者に利用可能です28,29。MitoMM1/2はパラホルムアルデヒド固定細胞や組織のミトコンドリアを染色できますが、マイトファジーを直接評価することはできず、マイトファジーを検出するには抗LC3Bなどの特異的抗体による二重染色が必要です。LysoKKは生細胞のみを染色できるため、これらの色素の組み合わせは、生細胞のミトコンドリアオートファジーのみを検出することもできます28,29。それにもかかわらず、MitoMM1/2は使いやすく、TRITCフィルターの使用を可能にします(青色レーザーを使用しても励起を示さず、緑色の発光を生成しないため)。LysoKKは5分以内に細胞小器官を染色することができ、多数の刺激の迅速な監視と評価を容易にします28,29。
マイトファジーは、さまざまな細胞ストレスシグナルと発生変化によって誘発される複雑なメカニズムを介して細胞内で発生します。ミトコンドリアの酸化的リン酸化の強力な脱共役剤であるFCCPは、この研究でマイトファジーを誘導するために使用された非特異的イオノフォア26です。FCCP(1μM)は、ミトコンドリア内膜を横切ってプロトンを輸送することにより、プロトン勾配を妨害し、細胞内のpHの変化を引き起こすプロセスです。したがって、FCCPは、数分以内にミトコンドリア膜電位の深刻な喪失を引き起こし、次いで、パーキンおよび微小管関連タンパク質軽鎖3(LC3)をミトコンドリアに動員することによってミトコンドリアオートファジーを誘導することができる26、27、30。マイトファジー調節経路は、ユビキチン依存性(PINK1-パーキン媒介性)または受容体依存性(LC3および他の受容体媒介性)に分類されます15,16。マイトファジーは、LC3Bなどの受容体依存性オートファジー経路の重要な分子に結合する特異的抗体を使用して研究されており、続いて赤色蛍光リソソーム色素31,32との共染色が行われています。このプロトコルで使用されている色素を使用してこれら2つの経路を区別することは困難ですが、生細胞におけるマイトファジーの程度を評価し、ミトコンドリアの形態を評価する簡単な方法を提供します。
開示事項
著者は開示する利益相反を持っていません。
謝辞
この研究の一部は、中国国家重点研究開発プログラム(2017YFA0105601、2018YFA0107102)、中国国家自然科学基金会(81970333,31901044)、および上海高等教育機関の特別任命教授プログラム(GZ2020008)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Countstar | IC1000 | |
| Cell counting chamber slides | Countstar | 12-0005-50 | |
| Dulbecco's modified Eagle medium (DMEM) | Corning | 10-013-CV | |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CVC | |
| Glass bottom cell culture dish (confocal dish) | NEST | 801002 | |
| Image J (Rasband, NIH) | NIH | https://imagej.nih.gov/ij/download.html | |
| Krebs–Henseleit(KHB) buffer | Self-prepared | ||
| LysoTracker Red | Invitrogen | 1818430 | 100 µmol/L, red-fluorescent lysosome dye |
| MitoTracker Green | Invitrogen | 1842298 | 200 µmol/L stock, green-fluorescent mitochondria dye |
| Mouse Embryonic Fibroblasts | Self-prepared | ||
| Objective (63x oil lens) | ZEISS | ZEISS LSM 880 | |
| Trypsin-EDTA 0.25% | Gibico | Cat# 25200056 | |
| ZEISS LSM 880 Confocal Laser Scanning Microscope | ZEISS | ZEISS LSM 880 | |
| ZEN Microscopy Software 2.1 (confocal microscope imaging software) | ZEISS | ZEN 2.1 |
参考文献
- Tao, M., et al. Animal mitochondria: evolution, function, and disease. Current Molecular Medicine. 14 (1), 115-124 (2014).
- Henze, K., Martin, W. Evolutionary biology: essence of mitochondria. Nature. 426 (6963), 127-128 (2003).
- Kiriyama, Y., Nochi, H. Intra- and intercellular quality control mechanisms of mitochondria. Cells. 7 (1), (2017).
- Rossmann, M. P., Dubois, S. M., Agarwal, S., Zon, L. I. Mitochondrial function in development and disease. Disease Models & Mechanisms. 14 (6), 048912(2021).
- Suliman, H. B., Piantadosi, C. A. Mitochondrial quality control as a therapeutic target. Pharmacological Reviews. 68 (1), 20-48 (2016).
- Wong, H. S., Dighe, P. A., Mezera, V., Monternier, P. A., Brand, M. D. Production of superoxide and hydrogen peroxide from specific mitochondrial sites under different bioenergetic conditions. Journal of Biological Chemistry. 292 (41), 16804-16809 (2017).
- Zhao, R. Z., Jiang, S., Zhang, L., Yu, Z. B. Mitochondrial electron transport chain, ROS generation and uncoupling (Review). International Journal of Molecular Medicine. 44 (1), 3-15 (2019).
- Murphy, M. P., Hartley, R. C. Mitochondria as a therapeutic target for common pathologies. Nature Reviews: Drug Discovery. 17 (12), 865-886 (2018).
- Fan, H., et al. Mitochondrial quality control in cardiomyocytes: a critical role in the progression of cardiovascular diseases. Frontiers in Physiology. 11, 252(2020).
- Ma, K., et al. Mitophagy, mitochondrial homeostasis, and cell fate. Frontiers in Cell and Developmental Biology. 8, 467(2020).
- Kraus, F., Roy, K., Pucadyil, T. J., Ryan, M. T. Function and regulation of the divisome for mitochondrial fission. Nature. 590 (7844), 57-66 (2021).
- Ren, L., et al. Mitochondrial dynamics: fission and fusion in fate determination of mesenchymal stem cells. Frontiers in Cell and Developmental Biology. 8, 580070(2020).
- Onishi, M., Yamano, K., Sato, M., Matsuda, N., Okamoto, K. Molecular mechanisms and physiological functions of mitophagy. The EMBO Journal. 40 (3), 104705(2021).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Khaminets, A., Behl, C., Dikic, I. Ubiquitin-dependent and independent signals in selective autophagy. Trends in Cell Biology. 26 (1), 6-16 (2016).
- Fritsch, L. E., Moore, M. E., Sarraf, S. A., Pickrell, A. M. Ubiquitin and receptor-dependent mitophagy pathways and their implication in neurodegeneration. Journal of Molecular Biology. 432 (8), 2510-2524 (2020).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. Journal of Cell Biology. 183 (5), 795-803 (2008).
- Lazarou, M., Jin, S. M., Kane, L. A., Youle, R. J. Role of PINK1 binding to the TOM complex and alternate intracellular membranes in recruitment and activation of the E3 ligase Parkin. Developmental Cell. 22 (2), 320-333 (2012).
- Chen, M., et al. Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy. Autophagy. 12 (4), 689-702 (2016).
- Ding, W. X., Yin, X. M. Mitophagy: mechanisms, pathophysiological roles, and analysis. Biological Chemistry. 393 (7), 547-564 (2012).
- Parzych, K. R., Klionsky, D. J. An overview of autophagy: morphology, mechanism, and regulation. Antioxidants and Redox Signaling. 20 (3), 460-473 (2014).
- Hasegawa, J., et al. Autophagosome-lysosome fusion in neurons requires INPP5E, a protein associated with Joubert syndrome. The EMBO Journal. 35 (17), 1853-1867 (2016).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. Journal of Chromatography B. Analytical Technologies in the Biomedical and Life Sciences. 793 (1), 141-150 (2003).
- Chazotte, B. Labeling lysosomes in live cells with LysoTracker. Cold Spring Harbor Protocols. 2011 (2), 5571(2011).
- Pickles, S., Vigie, P., Youle, R. J. Mitophagy and quality control mechanisms in mitochondrial maintenance. Current Biology. 28 (4), 170-185 (2018).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20 (1), 31-42 (2013).
- Berezhnov, A. V., et al. Intracellular pH modulates autophagy and mitophagy. Journal of Biological Chemistry. 291 (16), 8701-8708 (2016).
- Takemori, H., et al. Visualization of mitophagy using LysoKK, a 7-nitro-2,1,3-benzoxadiazole-(arylpropyl)benzylamine derivative. Mitochondrion. 62, 176-180 (2022).
- Maeda, M., et al. The new live imagers MitoMM1/2 for mitochondrial visualization. Biochemical and Biophysical Research Communications. 562, 50-54 (2021).
- Feng, X. R., Yin, W., Wang, J. L., Feng, L., Kang, Y. J. Mitophagy promotes the stemness of bone marrow-derived mesenchymal stem cells. Experimental Biology and Medicine. 246 (1), 97-105 (2021).
- Chu, C. T., et al. Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nature Cell Biology. 15 (10), 1197-1205 (2013).
- Sentelle, R. D., et al. Ceramide targets autophagosomes to mitochondria and induces lethal mitophagy. Nature Chemical Biology. 8 (10), 831-838 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved