Method Article
Visualisierung der Mitophagie mit Fluoreszenzfarbstoffen für Mitochondrien und Lysosomen
In diesem Artikel
Zusammenfassung
Mitophagie ist der primäre Mechanismus der mitochondrialen Qualitätskontrolle. Die Bewertung der Mitophagie in vivo wird jedoch durch das Fehlen zuverlässiger quantitativer Assays behindert. Hier wird ein Protokoll zur Beobachtung der Mitophagie in lebenden Zellen unter Verwendung eines zellpermierten grün-fluoreszierenden Mitochondrienfarbstoffs und eines rot fluoreszierenden Lysosomenfarbstoffs vorgestellt.
Zusammenfassung
Mitochondrien, die Kraftwerke der Zelle, spielen eine wichtige Rolle bei der Bioenergetik, der Erzeugung freier Radikale, der Kalziumhomöostase und der Apoptose. Mitophagie ist der primäre Mechanismus der mitochondrialen Qualitätskontrolle und wird im Allgemeinen durch mikroskopische Beobachtung untersucht, jedoch sind In-vivo-Mitophagie-Assays schwierig durchzuführen. Die Bewertung der Mitophagie durch Bildgebung lebender Organellen ist eine alternative und notwendige Methode für die mitochondriale Forschung. Dieses Protokoll beschreibt die Verfahren zur Verwendung des zellpermierten grün-fluoreszierenden Mitochondrienfarbstoffs MitoTracker Green und des rot fluoreszierenden Lysosomenfarbstoffs LysoTracker Red in lebenden Zellen, einschließlich der Beladung der Farbstoffe, der Visualisierung der Mitochondrien und des Lysosoms sowie der erwarteten Ergebnisse. Detaillierte Schritte zur Bewertung der Mitophagie in lebenden Zellen sowie technische Hinweise zu den Einstellungen der Mikroskopsoftware werden ebenfalls bereitgestellt. Diese Methode kann Forschern helfen, Mitophagie mit lebender Zellfluoreszenzmikroskopie zu beobachten. Darüber hinaus kann es verwendet werden, um Mitochondrien und Lysosomen zu quantifizieren und die mitochondriale Morphologie zu beurteilen.
Einleitung
Mitochondrien sind die Kraftwerke fast aller eukaryotischen Zellen 1,2. Neben der ATP-Produktion durch oxidative Phosphorylierung spielen Mitochondrien eine wichtige Rolle in anderen Prozessen wie Bioenergetik, Kalziumhomöostase, Erzeugung freier Radikale, Apoptose und zellulärer Homöostase 3,4,5. Da Mitochondrien reaktive Sauerstoffspezies (ROS) aus mehreren Komplexen in der Elektronentransportkette erzeugen, werden sie ständig durch potenziellen oxidativen Stress stimuliert, der schließlich zu strukturellen Schäden und Funktionsstörungen führen kann, wenn das antioxidative Abwehrsystem kollabiert 6,7. Es wurde festgestellt, dass mitochondriale Dysfunktion zu vielen Krankheiten beiträgt, einschließlich Stoffwechselstörungen, Neurodegeneration und Herz-Kreislauf-Erkrankungen8. Daher ist es wichtig, gesunde mitochondriale Populationen und ihre ordnungsgemäße Funktion zu erhalten. Mitochondrien sind hochplastische und dynamische Organellen; Ihre Morphologie und Funktion werden durch mitochondriale Qualitätskontrollmechanismen kontrolliert, einschließlich posttranslationaler Modifikationen (PTM) von mitochondrialen Proteinen, mitochondrialer Biogenese, Fusion, Spaltung und Mitophagie 9,10. Die mitochondriale Spaltung, die durch das Dynamin-verwandte Protein 1 (DRP1), eine GTPase der Dynamin-Superfamilie von Proteinen, vermittelt wird, führt zu kleinen und runden Mitochondrien und isoliert die dysfunktionalen Mitochondrien, die durch Mitophagie11,12 gereinigt und abgebaut werden können.
Mitophagie ist ein zellulärer Prozess, der Mitochondrien selektiv durch Autophagie abbaut, die normalerweise in beschädigten Mitochondrien nach Verletzungen, Alterung oder Stress auftritt. Anschließend werden diese Mitochondrien an Lysosomen zum Abbauabgegeben 10. Daher ist die Mitophagie ein kataboler Prozess, der dazu beiträgt, die Quantität und Qualität der Mitochondrien in einem gesunden Zustand in einer Vielzahl von Zelltypen zu erhalten. Es spielt eine entscheidende Rolle bei der Wiederherstellung der zellulären Homöostase unter normalen physiologischen und Stressbedingungen13,14. Zellen zeichnen sich durch einen komplexen Mitophagiemechanismus aus, der durch verschiedene Signale von zellulärem Stress und Entwicklungsveränderungen induziert wird. Mitophagie-Regulationswege werden als Ubiquitin-abhängig oder Rezeptor-abhängig klassifiziert15,16; Die Ubiquitin-abhängige Autophagie wird durch die Kinase PINK1 und die Rekrutierung der Ubiquitin-Ligase Parkin E3 an die Mitochondrienvermittelt 17,18, während die rezeptorabhängige Autophagie die Bindung von Autophagierezeptoren an die Mikrotubuli-assoziierte Protein-Leichtkette LC3 beinhaltet, die Mitophagie als Reaktion auf mitochondriale Schäden vermittelt 19.
Die Transmissionselektronenmikroskopie (TEM) ist die am häufigsten verwendete Methode und immer noch eine der besten Methoden zur Beobachtung und zum Nachweis der Mitophagie20. Die morphologischen Merkmale der Mitophagie sind Autophagosomen oder Autolysosomen, die durch die Fusion von Autophagosomen mit Lysosomen gebildet werden, was aus elektronenmikroskopischen Bildern beobachtet werden kann21. Die Schwäche der Elektronenmikroskopie (EM) ist jedoch die Unfähigkeit, die dynamischen Prozesse der Mitophagie, wie mitochondriale Depolarisation, mitochondriale Spaltung und Fusion von Autophagosomen und Lysosomen, in der lebenden Zellezu überwachen 20. Daher ist die Bewertung der Mitophagie durch Bildgebung lebender Organellen eine attraktive alternative Methode für die mitochondriale Forschung. Die hier beschriebene Lebendzellbildgebungstechnik verwendet zwei Fluoreszenzfarbstoffe, um Mitochondrien und Lysosomen zu färben. Wenn Mitophagie auftritt, werden beschädigte oder überflüssige Mitochondrien, die von Autophagosomen verschlungen werden, durch den mitochondrialen Farbstoff grün gefärbt, während der rote Farbstoff die Lysosomen färbt. Die Verschmelzung dieser Autophagosomen und Lysosomen, die als Autolysosomen bezeichnet werden, bewirkt, dass sich die grüne und rote Fluoreszenz überlappen und sich als gelbe Punkte manifestieren, was auf das Auftreten von Mitophagiehinweist 22. Der zellpermierte Mitochondrienfarbstoff (MitoTracker Green) enthält einen leicht thiolreaktiven Chlormethylanteil, um Mitochondrien23 zu markieren. Um Mitochondrien zu markieren, werden Zellen einfach mit dem Farbstoff inkubiert, der passiv über die Plasmamembran diffundiert und sich in aktiven Mitochondrien ansammelt. Dieser Mitochondrienfarbstoff kann lebende Zellen leicht färben und ist weniger wirksam bei der Färbung von aldehydfixierten oder toten Zellen. Der Lysosomenfarbstoff (LysoTracker Red) ist eine fluoreszierende acidotrope Sonde, die zur Markierung und Verfolgung saurer Organellen in lebenden Zellen verwendet wird. Dieser Farbstoff weist eine hohe Selektivität für saure Organellen auf und kann lebende Zellen bei nanomolaren Konzentrationen effektiv markieren24.
Die Verfahren zur Verwendung dieser Fluoreszenzfarbstoffe in lebenden Zellen, einschließlich der Beladung der Farbstoffe und der Visualisierung von Mitochondrien und Lysosomen, werden hier vorgestellt. Diese Methode kann Forschern helfen, Mitophagie mit lebender Zellfluoreszenzmikroskopie zu beobachten. Es kann auch verwendet werden, um Mitochondrien und Lysosomen zu quantifizieren und die mitochondriale Morphologie zu beurteilen.
Protokoll
1. Zellkultur und Passaging
HINWEIS: Das Protokoll wird am Beispiel routinemäßig kultivierter embryonaler Fibroblasten (MEFs) der Maus beschrieben.
- Kultur von MEF-Zellen in 10 cm Zellkulturschalen mit 10 ml Dulbecco's Modified Eagle Medium (DMEM). Inkubieren Sie bei 37 °C und 5% CO2 und überwachen Sie die Zellen unter dem Mikroskop bei 100-facher Vergrößerung.
- Führen Sie routinemäßiges Zell-Passaging durch.
- Wenn die Zellen 80% -90% Konfluenz erreichen (alle 3 Tage), waschen Sie die Zellen mit 2 ml Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS). Dann fügen Sie 2 ml 0,05% Trypsin-EDTA für 1 Minute hinzu, um die Zellen zu dissoziieren, gefolgt von 2 ml DMEM, um die Wirkung von Trypsin-EDTA zu stoppen. Zentrifugieren Sie die Zellsuspension bei 100 x g für 3 min und resuspendieren Sie das Zellpellet in 1 ml DMEM.
- Zählen Sie die Zellen mit einem automatisierten Zellzähler und Objektträgern für die Zellzählkammer (siehe Materialtabelle) und impfen Sie dann 1,5 x 106 Zellen in eine neue 10-cm-Zellkulturschale mit 10 ml DMEM.
- Für den Mitophagietest wird eine Zellsuspension gemäß Schritt 1.2.1 hergestellt. Die Zellsuspension wird in frischem DMEM auf 1 x 105 Zellen/ml verdünnt.
- 2 ml der verdünnten Zellsuspension in eine 20 mm große konfokale Schale geben (siehe Materialtabelle) und die Kulturschale in einem "Kreuz" schütteln. Die Zellkulturschale in einem 37 °C, 5%CO2 Inkubator für 24 h inkubieren.
2. Mitochondriale Färbung
- Die Aliquots der Stammlösung des grün fluoreszierenden mitochondrialen Farbstoffs und des rot fluoreszierenden Lysosomenfarbstoffs (siehe Materialtabelle) werden aus dem Gefrierschrank bei -20 °C entfernt.
- Bereiten Sie Arbeitslösungen der Farbstoffe vor, indem Sie die Stammlösungen 1:1.000 in DMEM verdünnen und gut mischen. Zum Beispiel fügen Sie jeweils 2 μL 1 mM mitochondrialen Farbstoff und Lysosomenfarbstoff zu 2 ml DMEM hinzu, um eine Arbeitskonzentration von 1 μM für beide Farbstoffe zu erhalten.
- Entfernen Sie das Medium aus der konfokalen Kulturschale (Schritt 1.4). Fügen Sie 1 ml der Färbelösung (hergestellt in Schritt 2.2) hinzu, um die Zellen zu bedecken. Die Zellkulturschale für 20-30 min in einen Inkubator bei 37 °C, 5%CO2 geben.
3. Konfokale Bildgebung
- 1 l Krebs-Henseleit (KH)-Puffer (138,2 mM NaCl, 3,7 mM KCl, 0,25 mM CaCl2, 1,2 mM KH2PO4, 1,2 mM MgSO 4,7H2O, 15 mM Glucose und 21,85 mM HEPES; End-pH7,4) vorbereiten und bei4 °C lagern (bis zu 1 Monat).
- Am Tag der konfokalen Bildgebung den KH-Puffer vorab aus dem Kühlschrank nehmen und auf Raumtemperatur (20 bis 25 °C) vorwärmen.
- Stellen Sie die Parameter der konfokalen Mikroskopie-Bildgebungssoftware ein (siehe Materialtabelle): Verwenden Sie für Bilder mit doppelter Anregung die sequentielle Anregung bei 488 nm und 543 nm und sammeln Sie die Emission bei 505-545 nm bzw. >560 nm.
HINWEIS: Legen Sie die Imaging-Einstellungen wie folgt fest. Scan-Modus: Rahmen; Geschwindigkeit: 9; Durchschnitt: Anzahl, 1; Gewinn: 450 bis 600; Pinhole: 30 bis 200; Laser: <10%. Am besten starten Sie zuerst die Imaging-Software und schalten dann den 488-nm-Laser vollständig ein. Der 543-nm-Laser muss vor der Verwendung eingeschaltet und 3-5 Minuten lang stabilisiert werden (Abbildung 1A). - Entfernen Sie das Kulturmedium, das den Farbstoff enthält, aus dem Inkubator (Schritt 2.3) und geben Sie 1 ml KH-Puffer in die Schale.
- Um die Mitophagie zu induzieren, behandeln Sie die Zellen mit Carbonylcyanid-4-(trifluormethoxy) phenylhydrazon (FCCP) bei 1 μM (Endkonzentration) in KH-Puffer für 10 min bei Raumtemperatur und fahren Sie sofort fort, die Zellen mit dem konfokalen Mikroskop abzubilden.
- Tragen Sie eine entsprechende Menge Öl auf die Oberseite der 63-fachen Öllinse auf (siehe Materialtabelle). Legen Sie die Zellprobe auf den Probentisch des konfokalen Mikroskops und bewegen Sie sie direkt über die Objektivlinse.
- Verwenden Sie die Imaging-Software, um das Beispiel zu finden, indem Sie auf die Registerkarte Locate (Suchen ) in der oberen linken Ecke der Softwareoberfläche klicken (Abbildung 1B). Wählen Sie einen grünen Filtersatz für das Experiment aus.
- Verwenden Sie den groben Einstellknopf, um schnell zu fokussieren, indem Sie das Objektiv nach oben und unten bewegen. Nachdem die Zellprobe durch das Okular gut sichtbar ist, suchen und fokussieren Sie den Bereich einzelner Zellen und bewegen Sie ihn in die Mitte des Sichtfeldes.
- Klicken Sie auf die Registerkarte Erfassung in der oberen linken Ecke der Softwareoberfläche, um Bilder aufzunehmen. Wählen Sie nur den 488-nm-Kanal und die Bildauflösung 1024 x 1024 für die Vorschau aus.
- Klicken Sie auf die Registerkarte Live in der oberen linken Ecke, um einen Live-Scan zu starten. Stellen Sie das Sichtfeld auf das schärfste und die Laserleistung ein, indem Sie den Schieberegler nach links oder rechts bewegen (Abbildung 1A). Halten Sie die Verstärkungseinstellung unter 600, um eine Überbelichtung zu vermeiden.
- Stellen Sie den Lochblendenwert auf 156, den Verstärkungswert auf 545 und den digitalen Offsetwert auf 0 ein.
- Wählen Sie das beste Sichtfeld, überprüfen Sie die beiden Kanäle (488 nm und 543 nm) und wählen Sie die Bildauflösung 1024 x 1024. Klicken Sie auf Ausrichten , um 2D-Bilder aufzunehmen. Speichern Sie die aufgenommenen Bilder.
HINWEIS: Der grüne Mitochondrienfarbstoff hat einen Anregungspeak bei 490 nm und einen Emissionspeak bei 516 nm; Es kann mit einem 488-nm-Laser angeregt werden. Der rote Lysosomenfarbstoff hat einen Anregungspeak bei 576 nm und einen Emissionspeak bei 590 nm; Es kann mit einem 543-nm-Laser angeregt werden.
4. Bildanalyse
- Öffnen Sie das gespeicherte Bild mit ImageJ und importieren Sie das zusammengeführte Bild hinein.
- Zählen Sie manuell die Anzahl der gelben Punkte in jeder Zelle, die anzeigen, dass das Lysosom Mitochondrien verschlingt.
Ergebnisse
MitoTracker Green ist eine grün fluoreszierende mitochondriale Färbung, die in der Lage ist, Mitochondrien genau zu lokalisieren. Der Farbstoff kann lebende Zellen leicht färben und ist weniger wirksam bei der Färbung aldehydfixierter oder toter Zellen (Abbildung 2). Der rot fluoreszierende Lysosomenfarbstoff LysoTracker Red ist in der Lage, saure lysosomale Organellen zu markieren und zu verfolgen und kann nur lebende Zellen färben (Abbildung 2). Die konfokale mikroskopische Bildgebung ermöglicht die Visualisierung von Mitochondrien und Lysosomen, die mit den entsprechenden Farbstoffen gefärbt sind (Abbildung 1 und Abbildung 2).
Mitophagie ist ein kataboler zellulärer Prozess, der Mitochondrien selektiv durch Autophagie abbaut, was normalerweise in beschädigten Mitochondrien nach Verletzung, Alterung oder Stress auftritt20. Anschließend werden diese Mitochondrien an Lysosomen zum Abbau abgegeben. Mitophagie hilft, die Quantität und Qualität der Mitochondrien in einem gesunden Zustand in einer Vielzahl von Zelltypen zu erhalten. In gesunden Säugetierzellen tritt die Mitophagie selten auf, und daher sind andere Reize erforderlich, um diesen Prozess zu induzieren25. Carbonylcyanid-4 (Trifluormethoxy) phenylhydrazon (FCCP), ein mitochondrialer Entkoppler, ist ein unspezifischer Ionophor, der innerhalb von Minuten einen schweren Verlust des mitochondrialen Membranpotentials, eine Veränderung des intrazellulären pH-Werts und eine anschließende Mitophagie verursacht26,27. In dieser Studie wurde FCCP verwendet, um Mitophagie in MEF-Zellen für die konfokale Bildgebung auszulösen. Wenn beschädigte grün gefärbte Mitochondrien von rot gefärbten Lysosomen verschlungen werden, überlappen sich die grüne und rote Fluoreszenz, um gelbe co-lokalisierte Mitochondrien-Lysosomen zu enthüllen (Abbildung 3). Die gelben Punkte in Abbildung 3D und Abbildung 4B entsprechen diesen kolokalisierten Mitochondrien-Lysosomen, die eine anhaltende Mitophagie darstellen, und können daher gezählt werden, um das Ausmaß der Mitophagie zu bewerten (Abbildung 4).
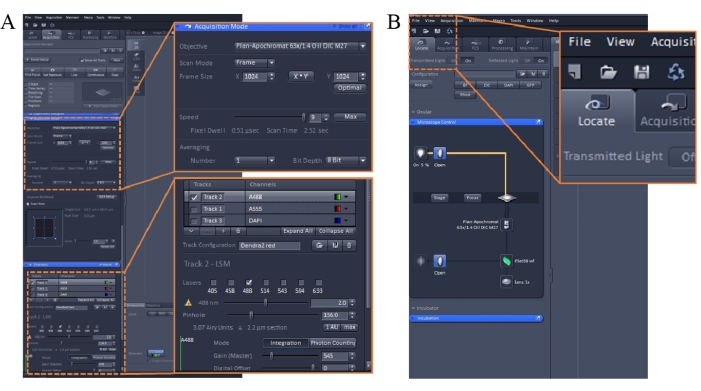
Abbildung 1: Bildgebungsparameter der konfokalmikroskopischen Bildgebungssoftware. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
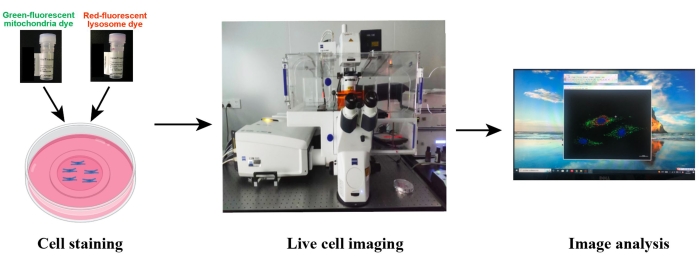
Abbildung 2: Schematische Darstellung der konfokalen Bildgebung lebender Zellen. Die lebenden Zellen werden mit dem grün fluoreszierenden mitochondrialen Farbstoff und dem rot-fluoreszierenden lysosomalen Farbstoff kofärbt, und dann werden die lebenden Zellen mit konfokaler Mikroskopie abgebildet. Die Bildverarbeitung und Datenanalyse wurde mit der mikroskopassoziierten Bildgebungssoftware oder Image J durchgeführt.
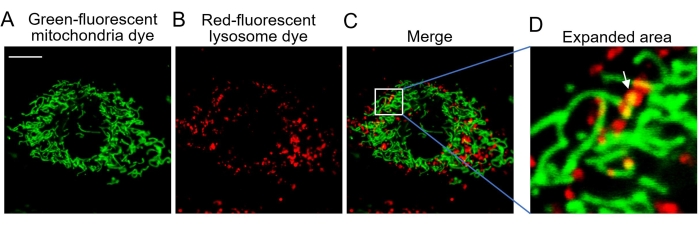
Abbildung 3: Konfokale Bildgebung lebender Zellen. (A) Repräsentative Bilder von Zellen, die mit dem grün fluoreszierenden Mitochondrienfarbstoff gefärbt sind, zeigen die Mitochondrien. (B) Repräsentative Bilder von Zellen, die mit dem rot fluoreszierenden Lysosomfarbstoff gefärbt sind und das Lysosom zeigen. (C) Zusammengeführtes Bild beider Fluoreszenzfarbstoffe. (D) Erweiterter Bereich mit Mitophagie. Der weiße Pfeil zeigt grüne Mitochondrien an, die von roten Lysosomen verschlungen werden. Abkürzung: Ex = Anregungswellenlänge. Der grün-fluoreszierende Mitochondrienfarbstoff wird bei 488 nm angeregt, wobei die Emission bei 505-545 nm gesammelt wird. Der rot fluoreszierende Lysosomenfarbstoff wird bei 543 nm angeregt, wobei die Emission bei >560 nm gesammelt wird. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
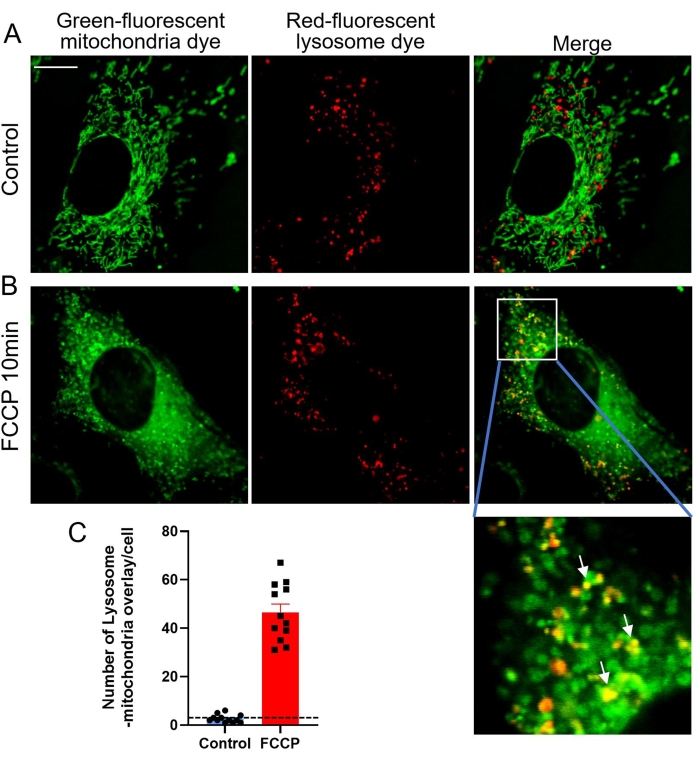
Abbildung 4: Mitophagie, ausgelöst durch FCCP-Stimulation . (A) Repräsentative Bilder von Zellen, die mit dem grün fluoreszierenden Mitochondrienfarbstoff und dem rot fluoreszierenden Lysosomenfarbstoff kogefärbt sind. (B) Repräsentative Bilder von Zellen, die 10 min lang mit 1 μM FCCP behandelt wurden. Der weiße Pfeil zeigt grüne Mitochondrien an, die von roten Lysosomen verschlungen werden. (C) Quantitative Daten der Mitophagie, die durch lysosomal-mitochondrien-Overlay angezeigt werden. Die Daten sind Mittelwert ± SEM, n = 8 Zellen. *p < 0,05 versus Kontrolle. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Das hier beschriebene Protokoll bietet eine Methode zur Bewertung und Überwachung des dynamischen Prozesses der Mitophagie in lebenden Zellen, an dem Autophagosomen, Lysosomen und mitochondriale Spaltung beteiligt sind, durch Co-Färbung mit zellpermeierten Mitochondrien und Lysosomenfarbstoffen. Die Methode kann auch verwendet werden, um Mitochondrien zu identifizieren und die mitochondriale Morphologie zu beurteilen. Beide in dieser Studie verwendeten Farbstoffe sollten vor Licht geschützt werden, mehrere Gefrier-Tau-Zyklen sollten vermieden werden und die Farbstoffe sollten so weit wie möglich in Einwegaliquoten gelagert werden. Es wird empfohlen, Arbeitslösungen der Farbstoffe herzustellen, um zu vermeiden, dass sie direkt dem Zellkulturmedium zugesetzt werden, was zu hohen lokalen Konzentrationen und unzureichender Durchmischung der Farbstoffe führen kann. Um eine Färbung anderer Zellstrukturen zu vermeiden, sollten die MEF-Zellen vor der Bildgebung mit dem konfokalen Mikroskop 30 Minuten lang gefärbt werden. Es wird empfohlen, das Färbeverfahren unmittelbar vor der Bildgebung durchzuführen. In MEF-Zellen sind sowohl Mitochondrien als auch Lysosomenfarbstoffe bei 1 μM gut in Mitochondrien bzw. Lysosomen lokalisiert, wobei höhere Farbstoffkonzentrationen zu Zytotoxizität sowie unspezifischer Färbung anderer Zellstrukturen führen. Diese Konzentration ist auch optimal für die Färbung von Mitochondrien und Lysosomen in H9C2-Zellen. Für andere Zelllinien müssen die Farbstoffkonzentration und die Färbezeit, die es dem Farbstoff ermöglichen, sich gut an den Organellen zu lokalisieren, optimiert werden. Um klare Bilder von Mitochondrien und Lysosomen zu erhalten, müssen die Bildsammlungsparameter (siehe Hinweis in Schritt 3.3) gewissenhaft angepasst werden. Die Zellkonfluenz bei 50%-60% ist entscheidend, um individuelle Lebendzellbilder zu erhalten, und daher müssen Zellen vor der Aussaat gezählt werden. Wenn das Labor keine konfokalen Schalen hat, können alternativ kreisförmige Deckgläser verwendet werden. In einigen Tierstudien, insbesondere in klinischen Untersuchungen, ist es schwierig, Mitophagie in lebenden Gewebeproben von Tieren nachzuweisen, da zuverlässige und bequeme quantitative Experimente zur Untersuchung der Mitophagie fehlen. Dennoch kann die Mitophagie in Zellen, die aus tierischen Geweben isoliert wurden, mit dem hier beschriebenen Protokoll beurteilt werden. Eine Einschränkung dieser Methode besteht darin, dass beide Farbstoffe zwar leicht lebende Zellen färben können, aber weniger wirksam bei der Färbung toter oder aldehydfixierter Zellen sind.
Zusätzlich zu den in dieser Studie verwendeten Farbstoffen stehen den Forschern derzeit andere Mitochondrien und Lysosomen-Tracer wie MitoMM1/2 bzw. LysoKK zur Bewertung der Mitophagie28,29 zur Verfügung. Während MitoMM1/2 Mitochondrien in paraformaldehydfixierten Zellen oder Geweben färben kann, kann es die Mitophagie nicht direkt beurteilen und erfordert eine doppelte Färbung mit einem spezifischen Antikörper wie Anti-LC3B, um Mitophagie nachzuweisen. Da LysoKK nur lebende Zellen färben kann, kann die Kombination dieser Farbstoffe auch nur mitochondriale Autophagie in lebenden Zellen nachweisen28,29. Dennoch ist MitoMM1/2 einfach zu bedienen und ermöglicht die Verwendung des TRITC-Filters (da es bei Verwendung eines blauen Lasers keine Anregung zeigt und keine grüne Emission erzeugt). LysoKK kann Organellen innerhalb von 5 min färben, was die schnelle Überwachung und Beurteilung zahlreicher Reize erleichtert28,29.
Mitophagie tritt in Zellen über einen komplexen Mechanismus auf, der durch verschiedene zelluläre Stresssignale und Entwicklungsveränderungen induziert wird. FCCP, ein potenter Entkoppler der mitochondrialen oxidativen Phosphorylierung, ist ein unspezifischer Ionophor26, der in dieser Studie zur Induktion der Mitophagie verwendet wurde. FCCP (1 μM) stört den Protonengradienten, indem es Protonen über die innere Mitochondrienmembran transportiert, ein Prozess, der eine Änderung des intrazellulären pH-Werts verursacht. So kann FCCP innerhalb von Minuten einen schweren Verlust des mitochondrialen Membranpotentials verursachen und dann die mitochondriale Autophagie induzieren, indem Parkin und Mikrotubuli-assoziierte Protein-Leichtkette 3 (LC3) zu den Mitochondrienrekrutiert werden 26,27,30. Mitophagie-Regulationswege werden als Ubiquitin-abhängig (PINK1-parkin-vermittelt) oder rezeptorabhängig (vermittelt durch LC3 und andere Rezeptoren) klassifiziert15,16. Die Mitophagie wurde mit spezifischen Antikörpern untersucht, die an Schlüsselmoleküle im rezeptorabhängigen autophagischen Signalweg binden, wie LC3B, gefolgt von einer Co-Färbung mit dem rot fluoreszierenden Lysosomenfarbstoff31,32. Obwohl es schwierig ist, zwischen diesen beiden Signalwegen mit den in diesem Protokoll verwendeten Farbstoffen zu unterscheiden, bieten sie eine einfache Methode, um das Ausmaß der Mitophagie in lebenden Zellen zu bewerten und die mitochondriale Morphologie zu beurteilen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde teilweise durch das National Key Research and Development Program of China (2017YFA0105601, 2018YFA0107102), die National Natural Science Foundation of China (81970333,31901044,) und das Program for Professor of Special Appointment an Shanghai Institutions of Higher Learning (GZ2020008) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Countstar | IC1000 | |
| Cell counting chamber slides | Countstar | 12-0005-50 | |
| Dulbecco's modified Eagle medium (DMEM) | Corning | 10-013-CV | |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CVC | |
| Glass bottom cell culture dish (confocal dish) | NEST | 801002 | |
| Image J (Rasband, NIH) | NIH | https://imagej.nih.gov/ij/download.html | |
| Krebs–Henseleit(KHB) buffer | Self-prepared | ||
| LysoTracker Red | Invitrogen | 1818430 | 100 µmol/L, red-fluorescent lysosome dye |
| MitoTracker Green | Invitrogen | 1842298 | 200 µmol/L stock, green-fluorescent mitochondria dye |
| Mouse Embryonic Fibroblasts | Self-prepared | ||
| Objective (63x oil lens) | ZEISS | ZEISS LSM 880 | |
| Trypsin-EDTA 0.25% | Gibico | Cat# 25200056 | |
| ZEISS LSM 880 Confocal Laser Scanning Microscope | ZEISS | ZEISS LSM 880 | |
| ZEN Microscopy Software 2.1 (confocal microscope imaging software) | ZEISS | ZEN 2.1 |
Referenzen
- Tao, M., et al. Animal mitochondria: evolution, function, and disease. Current Molecular Medicine. 14 (1), 115-124 (2014).
- Henze, K., Martin, W. Evolutionary biology: essence of mitochondria. Nature. 426 (6963), 127-128 (2003).
- Kiriyama, Y., Nochi, H. Intra- and intercellular quality control mechanisms of mitochondria. Cells. 7 (1), (2017).
- Rossmann, M. P., Dubois, S. M., Agarwal, S., Zon, L. I. Mitochondrial function in development and disease. Disease Models & Mechanisms. 14 (6), 048912(2021).
- Suliman, H. B., Piantadosi, C. A. Mitochondrial quality control as a therapeutic target. Pharmacological Reviews. 68 (1), 20-48 (2016).
- Wong, H. S., Dighe, P. A., Mezera, V., Monternier, P. A., Brand, M. D. Production of superoxide and hydrogen peroxide from specific mitochondrial sites under different bioenergetic conditions. Journal of Biological Chemistry. 292 (41), 16804-16809 (2017).
- Zhao, R. Z., Jiang, S., Zhang, L., Yu, Z. B. Mitochondrial electron transport chain, ROS generation and uncoupling (Review). International Journal of Molecular Medicine. 44 (1), 3-15 (2019).
- Murphy, M. P., Hartley, R. C. Mitochondria as a therapeutic target for common pathologies. Nature Reviews: Drug Discovery. 17 (12), 865-886 (2018).
- Fan, H., et al. Mitochondrial quality control in cardiomyocytes: a critical role in the progression of cardiovascular diseases. Frontiers in Physiology. 11, 252(2020).
- Ma, K., et al. Mitophagy, mitochondrial homeostasis, and cell fate. Frontiers in Cell and Developmental Biology. 8, 467(2020).
- Kraus, F., Roy, K., Pucadyil, T. J., Ryan, M. T. Function and regulation of the divisome for mitochondrial fission. Nature. 590 (7844), 57-66 (2021).
- Ren, L., et al. Mitochondrial dynamics: fission and fusion in fate determination of mesenchymal stem cells. Frontiers in Cell and Developmental Biology. 8, 580070(2020).
- Onishi, M., Yamano, K., Sato, M., Matsuda, N., Okamoto, K. Molecular mechanisms and physiological functions of mitophagy. The EMBO Journal. 40 (3), 104705(2021).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Khaminets, A., Behl, C., Dikic, I. Ubiquitin-dependent and independent signals in selective autophagy. Trends in Cell Biology. 26 (1), 6-16 (2016).
- Fritsch, L. E., Moore, M. E., Sarraf, S. A., Pickrell, A. M. Ubiquitin and receptor-dependent mitophagy pathways and their implication in neurodegeneration. Journal of Molecular Biology. 432 (8), 2510-2524 (2020).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. Journal of Cell Biology. 183 (5), 795-803 (2008).
- Lazarou, M., Jin, S. M., Kane, L. A., Youle, R. J. Role of PINK1 binding to the TOM complex and alternate intracellular membranes in recruitment and activation of the E3 ligase Parkin. Developmental Cell. 22 (2), 320-333 (2012).
- Chen, M., et al. Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy. Autophagy. 12 (4), 689-702 (2016).
- Ding, W. X., Yin, X. M. Mitophagy: mechanisms, pathophysiological roles, and analysis. Biological Chemistry. 393 (7), 547-564 (2012).
- Parzych, K. R., Klionsky, D. J. An overview of autophagy: morphology, mechanism, and regulation. Antioxidants and Redox Signaling. 20 (3), 460-473 (2014).
- Hasegawa, J., et al. Autophagosome-lysosome fusion in neurons requires INPP5E, a protein associated with Joubert syndrome. The EMBO Journal. 35 (17), 1853-1867 (2016).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. Journal of Chromatography B. Analytical Technologies in the Biomedical and Life Sciences. 793 (1), 141-150 (2003).
- Chazotte, B. Labeling lysosomes in live cells with LysoTracker. Cold Spring Harbor Protocols. 2011 (2), 5571(2011).
- Pickles, S., Vigie, P., Youle, R. J. Mitophagy and quality control mechanisms in mitochondrial maintenance. Current Biology. 28 (4), 170-185 (2018).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20 (1), 31-42 (2013).
- Berezhnov, A. V., et al. Intracellular pH modulates autophagy and mitophagy. Journal of Biological Chemistry. 291 (16), 8701-8708 (2016).
- Takemori, H., et al. Visualization of mitophagy using LysoKK, a 7-nitro-2,1,3-benzoxadiazole-(arylpropyl)benzylamine derivative. Mitochondrion. 62, 176-180 (2022).
- Maeda, M., et al. The new live imagers MitoMM1/2 for mitochondrial visualization. Biochemical and Biophysical Research Communications. 562, 50-54 (2021).
- Feng, X. R., Yin, W., Wang, J. L., Feng, L., Kang, Y. J. Mitophagy promotes the stemness of bone marrow-derived mesenchymal stem cells. Experimental Biology and Medicine. 246 (1), 97-105 (2021).
- Chu, C. T., et al. Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nature Cell Biology. 15 (10), 1197-1205 (2013).
- Sentelle, R. D., et al. Ceramide targets autophagosomes to mitochondria and induces lethal mitophagy. Nature Chemical Biology. 8 (10), 831-838 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten