Method Article
Анализ флуоресценции кальция с двойным добавлением для высокопроизводительного скрининга рекомбинантных рецепторов, связанных с G-белком
В этой статье
Резюме
В этой работе описан высокопроизводительный внутриклеточный флуоресцентный анализ кальция для 384-луночных пластин для скрининга библиотек малых молекул на рекомбинантных рецепторах, связанных с G-белком (GPCR). Мишень, рецептор кинина от клеща лихорадки крупного рогатого скота, Rhipicephalus microplus, экспрессируется в клетках CHO-K1. Этот анализ идентифицирует агонисты и антагонисты, используя одни и те же клетки в одном анализе «двойного добавления».
Аннотация
Рецепторы, связанные с G-белком (GPCR), представляют собой крупнейшее надсемейство рецепторов и являются мишенями многочисленных лекарств человека. Высокопроизводительный скрининг (HTS) случайных библиотек малых молекул против GPCR используется фармацевтической промышленностью для обнаружения целевых лекарств. В этом исследовании HTS был использован для идентификации новых низкомолекулярных лигандов специфических для беспозвоночных нейропептидных GPCR в качестве зондов для физиологических исследований векторов смертельных человеческих и ветеринарных патогенов.
Специфический для беспозвоночных рецептор кинина был выбран в качестве мишени, потому что он регулирует многие важные физиологические процессы у беспозвоночных, включая диурез, питание и пищеварение. Кроме того, фармакология многих беспозвоночных GPCR плохо характеризуется или не характеризуется вообще; таким образом, дифференциальная фармакология этих групп рецепторов по отношению к родственным GPCR у других метазоанов, особенно у людей, добавляет знания о структурно-активных отношениях GPCR как надсемейства. Анализ HTS был разработан для клеток в 384-луночных пластинах для открытия лигандов рецептора кинина от клеща лихорадки крупного рогатого скота или южного клеща крупного рогатого скота, Rhipicephalus microplus. Рецептор клещевого кинина стабильно экспрессировался в клетках CHO-K1.
Рецептор кинина при активации эндогенными нейропептидами кинина или другими агонистами малых молекул вызывает высвобождение Ca2+ из запасов кальция в цитоплазму. Этот анализ флуоресценции кальция в сочетании с подходом «двойного добавления» может обнаруживать функциональные агонисты и антагонисты, «поражающие» молекулы в одной и той же пластине анализа. Каждый анализ проводился с использованием лекарственных пластин, несущих массив из 320 случайных малых молекул. Был получен надежный Z'-фактор 0,7, и три молекулы агониста и два антагониста были идентифицированы, когда HTS находился в конечной концентрации 2 мкМ. Анализ флуоресценции кальция, представленный здесь, может быть адаптирован для скрининга других GPCR, которые активируют сигнальный каскад Ca2+ .
Введение
Рецепторы, связанные с G-белком (GPCR), которые присутствуют от дрожжей к человеку, представляют собой крупнейшее надсемейство рецепторов во многих организмах1. Они играют решающую роль в регулировании почти всех биологических процессов у животных. В геноме членистоногих насчитывается 50-200 GPCR, что означает, что они представляют собой самое большое надсемейство мембранных рецепторов2. Они классифицируются на шесть основных классов, A-F, на основе их сходства последовательностей и функций3. GPCR трансдуцируют различные внеклеточные сигналы, такие как гормоны, нейропептиды, биогенные амины, глутамат, протон, липогликопротеины и фотоны4. GPCR соединяются с гетеротримерными G-белками (Gα, Gβ и Gγ) для передачи последующих сигналов. GPCR в сочетании с белками Gαs или Gαi/o увеличивают или уменьшают, соответственно, внутриклеточные 3', 5'-циклические уровни аденозинмонофосфата (цАМФ) путем активации или ингибирования аденилциклазы. GPCR, связанные с Gαq/11, индуцируют высвобождение кальция из эндоплазматических ретикулумных запасов кальция путем активации пути фосфолипазы C (PLC)-инозитол-1,4,5-трифосфата (IP3). GPCR в сочетании с Gα12/13 активируют RhoGTPase нуклеотидные обменные факторы 5,6. GPCR являются мишенью более 50% лекарств для человека и акарицида, амитраза4. Поскольку GPCR передают такие разнообразные сигналы, они являются многообещающими целями для разработки новых пестицидов, которые нарушают физиологические функции, специфичные для беспозвоночных.
Целью HTS является идентификация пораженных молекул, которые могут модулировать функции рецепторов. HTS включает в себя разработку анализов, миниатюризацию и автоматизацию7. Членистоногие нейропептидные GPCR участвуют в большинстве физиологических функций, таких как развитие, линька и экдиз, экскреция, мобилизация энергии и размножение4. Большинство нейропептидных GPCR членистоногих и метазоев сигнализируют через кальциевый сигнальный каскад 2,6,8,9,10, например, в миоингибиторных пептидных и SIFамидных рецепторах черноногих клещей Ixodes scapularis; их лиганды антагонистичны в анализах моторики задней кишки, при этом SIF вызывает сокращение, а MIP ингибирует его11,12. NPY-подобный рецептор комара желтой лихорадки, Aedes aegypti, регулирует женщину-хозяина, ищущего13. По сравнению с другими альтернативными анализами мобилизации кальция, такими как анализ биолюминесценции кальция экворина14, анализ флуоресценции кальция прост в выполнении, не требует трансфекции других рекомбинантных белков, обнаруживающих кальций, и является экономически эффективным. Анализ флуоресценции кальция дает пролонгированный сигнал по сравнению с быстрым кинетическим сигналом, полученным в анализе биолюминесценции кальция экворина14,15.
В приведенном здесь примере кининовый рецептор от клеща лихорадки крупного рогатого скота, Rhipicephalus microplus, был рекомбинантно экспрессирован в клеточной линии CHO-K1 и использовался для анализа флуоресценции кальция. Существует только один ген рецептора кинина, обнаруженный в R. microplus; рецептор сигнализирует через Gq белок-зависимый сигнальный путь и запускает отток Ca2+ из запасов кальция во внутриклеточное пространство16. Этот процесс может быть обнаружен и количественно определен флуорофором, который вызывает флуоресцентный сигнал при связывании ионов кальция (рисунок 1).
Кининовый рецептор представляет собой специфический для беспозвоночных GPCR, который относится к родопсиноподобным рецепторам класса А. Кинин является древним сигнальным нейропептидом, который присутствует в моллюсках, ракообразных, насекомых и акари 4,17,18. У колеоптерянов (жуков) отсутствует кининовая сигнальная система; у комара Aedes aegypti есть только один рецептор кинина, который связывает три эдескинина, в то время как Drosophila melanogaster имеет один рецептор кинина с дросокинином в качестве уникального лиганда 19,20,21. У позвоночных нет гомологичных кининов или кининовых рецепторов. Хотя точная функция кинина у клещей неизвестна, у женщин R. microplus, заглушенных рецептором RNAi, значительно снижается репродуктивная пригодность22. Кинины являются плеотропными пептидами у насекомых. У Drosophila melanogaster они участвуют как в центральной, так и в периферической нервной регуляторной системах23, преэкдисисе24, питании25,метаболизме 26 и паттернах активности сна 26,27, а также личиночной локомоции28. Кинины регулируют сокращение задней кишки, диурез и питание у комара A. aegypti 29,30,31. Кининовые пептиды имеют законсервированный С-концевой пентапептид Phe-X1-X2-Trp-Gly-NH2, который является минимально необходимой последовательностью для биологической активности32. Специфичность членистоногих, малый размер эндогенного лиганда, который делает их поддающимися низкомолекулярной интерференции, и плейотропные функции у насекомых делают кининовый рецептор перспективной мишенью для борьбы с вредителями4.
Анализ «двойного сложения» (рисунок 2) позволяет идентифицировать агонисты или антагонисты в том же анализе HTS15. Он адаптирован из анализа «двойного добавления», который обычно используется в фармацевтической промышленности для открытия лекарств33. Короче говоря, первое добавление лекарств в клеточную пластину позволяет идентифицировать потенциальные агонисты в химической библиотеке при обнаружении более высокого флуоресцентного сигнала по сравнению с применением контроля растворителя. После 5 мин инкубации с этими небольшими молекулами на все скважины наносится известный агонист (кининовый пептид). Те скважины, которые случайным образом получили антагонист из лекарственной пластины, показывают более низкий флуоресцентный сигнал при добавлении агониста по сравнению с контрольными лунками, которые получили растворитель при первом добавлении. Этот анализ позволяет идентифицировать потенциальные агонисты и антагонисты с одними и теми же клетками. В стандартном проекте HTS эти пораженные молекулы будут дополнительно проверены с помощью анализов «доза-реакция» и дополнительных анализов биологической активности, которые здесь не показаны.

Рисунок 1: Иллюстрация механизма анализа флуоресценции кальция. Белок Gq запускает внутриклеточный сигнальный путь кальция. Рецептор кинина (рецептор, связанный с G-белком) был рекомбинантно экспрессирован в клетках CHO-K1. Когда лиганд агониста связывается с рецептором, белок Gq, связанный с рецептором кинина, активирует PLC, который катализирует превращение молекулы PIP2 в IP3 и DAG. Затем IP3 связывается с IP3R на поверхности эндоплазматического ретикулума, что приводит к высвобождению Ca2+ в цитоплазму, где ионы Ca2+ связываются с флуорофорами и вызывают флуоресцентный сигнал. Флуоресцентный сигнал может быть получен возбуждением при 490 нм и обнаружен при 514 нм. Сокращения: GPCR = рецептор, связанный с G-белком; PLC = фосфолипаза C; PIP2 = фосфатидилинозитол 4,5-бисфосфат; IP3 = инозитолтрисфосфат; DAG = диацилглицерин; IP3R = IP3 рецептор. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Рабочий процесс для высокопроизводительного скрининга малых молекул на рецепторе, связанном с G-белком, экспрессируемом в клетках CHO-K1. (A) Рекомбинантные клетки CHO-K1, стабильно экспрессирующие рецептор кинина, добавляли к 384-луночной пластине (10 000 клеток/лунка) с помощью жидкостной системы обработки (25 мкл/лунка) и инкубировали в увлажненном инкубатореCO2 в течение 12-16 ч. (B) ) Буфер анализа, содержащий флуоресцентный краситель (25 мкл/лунка), добавляли в клеточную пластину с помощью системы обработки жидкости. Пластину инкубировали в течение 30 мин при 37 °C в течение 30 мин и уравновешивали при RT еще 30 мин. (C) Фоновый флуоресцентный сигнал клеток в каждой скважине измеряли с помощью пластинчатого считывателя. (D) Растворы лекарственных средств из 384-луночной библиотечной пластины и пустого растворителя (все при 0,5 мкл/лунку) добавляли в пластину клеточного анализа с использованием системы обработки жидкости. (E) Клеточные реакции флуоресценции кальция измеряли с помощью считывателя пластин сразу после добавления растворов лекарственного средства; соединение (соединения), вызывающее сигналы флуоресценции выше среднего, были выбраны в качестве агониста удара (ударов). Удары антагониста, блокирующие GPCR (значок ниже), были выявлены после добавления агониста пептидов во время шага G. (F) В той же пробирной пластине после 5 мин инкубации клеток с экранирующими соединениями к каждой лунке добавляли эндогенный агонистический пептид Rhimi-K-1 (QFSPWGamide) клещевого кининового рецептора (1 мкМ). (G) Клеточные флуоресцентные реакции после добавления агониста пептида немедленно измерялись считывателем пластин. Соединение(я), ингибирующее флуоресцентный сигнал, было выбрано в качестве удара(ов) антагониста. Сокращения: GPCR = рецептор, связанный с G-белком; RT = комнатная температура; РФС = относительные единицы флуоресценции. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Обслуживание клеток
ПРИМЕЧАНИЕ: Клеточная линия CHO-K1, которая стабильно экспрессирует рецептор кинина из R. microplus, названная BMLK3, была разработана Holmes et al.16. Подробности развития клеточной линии представлены в другом месте14. Все следующие этапы выполняются в стерильных условиях в шкафу биобезопасности класса II.
- Выращивают рекомбинантную клеточную линию в селективных средах (среда F-12K, содержащая 10% фетальной бычьей сыворотки [FBS] и 800 мкг/мл сульфата G418) для обеспечения экспрессии рецептора-мишени. Храните клетки, стабильно экспрессирующие рецептор в 1 мл морозильной среды (90% FBS и 10% диметилсульфоксида [DMSO]) в криовиале 2 мл в морозильной камере с температурой −80 °C.
ПРИМЕЧАНИЕ: Для длительного хранения замороженных клеток храните их в жидком азоте. - Перед прогревом всех сред перед посевом клеток. В шкафу биобезопасности переложите 13 мл предварительной селективной среды (среда F-12K, содержащая 10% FBS и 800 мкг/мл сульфата G418) в колбу Т-75 и храните ее в шкафу биобезопасности. Разморозьте один флакон замороженных клеток BMLK3 (~1,5 × 106 клеток) на водяной бане 37 °C в течение 2-3 мин. Переместите размороженные ячейки в колбу Т-75. Поддерживайте ячейки в увлажненном инкубаторе при 37 °C и 5% CO2 , если не указано иное.
- Когда клетки достигают 90% сливания (1-2 дня), предварительно прогрейте все среды до 37 °C, за исключением фосфатно-буферного физиологического раствора Dulbecco (DPBS), который выдерживается при комнатной температуре. В шкафу биобезопасности извлеките отработанную среду из колбы Т-75, промыть клетки в течение 5 с 10 мл DPBS, осторожно закрутив колбу, а затем удалите DPBS серологической пипеткой.
ПРИМЕЧАНИЕ: Изображение клеток CHO-K1 при 90% слиянии показано в Lu et al.14. - Отделяют клетки от колбы Т-75 путем добавления 2 мл 0,25% трипсина-ЭДТА и инкубируют в течение 3-5 мин при 37 °C в инкубаторе. Затем добавьте 8 мл селективной среды и хорошо перемешайте, пипетируя и выпуская осторожно 2x-3x с той же серологической пипеткой.
- Перенесите 2 мл клеточной суспензии (~1 × 106 клеток) со стадии 1.4 в новую колбу Т-75, содержащую 10 мл теплой селективной среды. Выращивайте клетки в течение 1-2 дней в инкубаторе, пока они не достигнут 90% слияния.
- Используйте ячейки для анализа, следуя следующим шагам, или повторите шаги 1,4-1,5 один или два раза перед использованием ячеек в анализе.
ПРИМЕЧАНИЕ: Не превышайте трех-четырех проходов, так как сигнал анализа с определенными клеточными линиями может стать слабее с дальнейшими проходами.
2. Анализ флуоресценции кальция
- Нанесите покрытие на клеточную пластину.
- Используйте систему обработки жидкостей, размещенную внутри шкафа биобезопасности, для всех этапов дозирования в плитах с 384 скважинами. Создание пользовательских программ для пипетки в 384-луночных плитах31 (Дополнительная таблица S1). Заранее нанесите стерильные 384-луночные пластины. В шкафу биобезопасности загрузите 10 мкл/лунку водного раствора поли-D-лизина (PDL) по 0,05 мг/мл в каждую пластину и инкубируйте в течение 5 мин при комнатной температуре.
- Опорожните тарелку, быстро перевернув тарелку и аккуратно промокав ее на стерильных бумажных полотенцах. Затем промойте каждую лунку 10 мкл воды, опорожните тарелку и оставьте тарелку сушиться в шкафу биобезопасности на ночь без крышки. Закройте тарелку крышкой и храните при температуре 4 °C в холодильнике.
ПРИМЕЧАНИЕ: Пластины с покрытием можно хранить при температуре 4 °C до 6 месяцев.
- День 1
- Достаньте лекарственную пластину (100 мкМ в 90% DPBS + 10% DMSO, конечная концентрация в скважине для HTS составит 2 мкМ), хранящуюся в морозильной камере −20 °C, и поместите ее при комнатной температуре.
ПРИМЕЧАНИЕ: Расположение лекарственной пластины: Каждая 384-луночная пластина (24 колонки х 16 рядов) содержит 320 скважин с различными библиотечными соединениями и 64 скважины с заготовленным растворителем (DPBS, содержащим 10% DMSO), которые расположены в четырех столбцах, с двумя колоннами на краю каждой стороны. Схему тарелок см. в дополнительной таблице S2 . - Когда клетки достигнут ~ 70%-90% слияния в колбе Т-75, отделите клетки от колбы Т-75, как описано ниже. Предварительно прогрейте все среды до 37 °C, кроме DPBS (комнатной температуры).
- Удалите отработанную среду, промыть клетки 10 мл DPBS, а затем удалить DPBS. Отсоедините клетки от колбы Т-75 с использованием 2 мл 0,25% трипсина-ЭДТА в течение 3-5 мин при 37 °С в инкубаторе, добавьте 8 мл селективной среды и переведите клеточную суспензию в коническую трубку объемом 15 мл в центрифугу при 1000 × г в течение 3 мин.
- Откажитесь от супернатанта и повторно суспендируйте ячейку гранулы в 10 мл среды F-12K, содержащей 1% FBS и 400 мкг/мл сульфата G418. Храните суспензию в шкафу биобезопасности при определении количества клеток.
- Определение плотности ячейки суспензии для дальнейшего разбавления: Смешайте 20 мкл клеточной суспензии в 20 мкл 0,4% трипанового синего цвета, а затем загрузите 20 мкл смеси в камеру подсчета клеток для считывания счетчиком клеток для плотности клеток.
- Разбавляют клеточную суспензию в той же среде (среда F-12K, содержащая 1% FBS и 400 мкг/мл сульфата G418) до конечного объема по меньшей мере 15 мл при плотности 4 × 105 клеток/мл.
- Посейте клетки в 384-луночную пластину с PDL-покрытием. Переложить 15 мл вышеуказанной клеточной суспензии (4 × 105 клеток/мл) в резервуар автосочистого реагента объемом 150 мл. Дозируйте 25 мкл клеточной суспензии (~10 000 ячеек/лунку) в каждую скважину из 384 скважин пластины, используя систему обработки жидкости в два этапа. Загрузите наконечники с низким удержанием 384/12,5 мкл на головку обработчика жидкости, аспират 12,5 мкл из резервуара (скорость 5,2 мкл/с) и дозируйте в каждую скважину (скорость: 3,1 мкл/с).
- Повторите дозирование, как и на предыдущем этапе 2.2.5, чтобы достичь 25 мкл на скважину. Затем инкубируют пластину в течение ночи (14-16 ч) при 37 °C и 5% CO2 в увлажненном инкубаторе.
ПРИМЕЧАНИЕ: Поскольку максимальный объем дозирования составляет 12,5 мкл для этой конкретной головки, пипетка для 25 мкл выполняется в два этапа.
- Достаньте лекарственную пластину (100 мкМ в 90% DPBS + 10% DMSO, конечная концентрация в скважине для HTS составит 2 мкМ), хранящуюся в морозильной камере −20 °C, и поместите ее при комнатной температуре.
- День 2
- На следующее утро проверьте покрытую клеточную пластину под микроскопом; если не сливается, подождите, пока клетки не достигнут 90% конфлюентности.
- Приготовьте запасной раствор флуоресцентного красителя: повторно суспендируйте лиофилизированный флуоресцентный краситель в 100 мкл ДМСО и избегайте прямого света на исходном растворе. Оберните трубку алюминиевой фольгой, чтобы предотвратить фотоотбеливание.
ПРИМЕЧАНИЕ: Запас может быть аликвотирован на 15 мкл аликвот для каждого анализа пластины, чтобы избежать повторного замораживания и оттаивания; аликвоты могут храниться при −80 °C до 1 месяца. - В шкафу биобезопасности с выключенным освещением приготовьте загрузочный краситель (1x) в конической трубке объемом 15 мл, обернутой алюминиевой фольгой, сочетая 15 мкл флуоресцентного раствора красителя (из стадии 2.3.2) и остальные компоненты предварительного набора (37 °C): 13,5 мл 1x HHBS (буфер Хэнка с 20 мМ HEPES) и 1,5 мл реагента B (ингибитор выдоха красителя).
ПРИМЕЧАНИЕ: На этом этапе в комнате горит свет. - Закройте трубку и хорошо перемешайте, осторожно перевернув трубку несколько (обычно 3-5 раз) раз.
ПРИМЕЧАНИЕ: Хранить при комнатной температуре и использовать загрузочную смесь красителей в течение 30 мин. - Когда ячейки достигнут 90% сливания, удалите отработанную среду с 384-луночной пробирной пластины, быстро перевернув пластину и осторожно промокав на стерильных бумажных полотенцах; Повторите это движение 2x-3x, чтобы удалить всю жидкость с пластины. Выбросьте мокрые полотенца.
- Выключите большинство искусственных прямых источников света в комнате (оставив мягкую, тусклую настольную лампу включенной или аналогичную, чтобы обеспечить видимые условия работы) и в шкафу биобезопасности на все этапы до конца анализа (примерно в течение 1,5 ч).
- Поместите 15 мл загрузочного красителя (1x) с шага 2.3.3 в автоматический резервуар объемом 150 мл.
- Перенесите 25 мкл загрузочного красителя (1x) из резервуара в каждую скважину с помощью системы обработки жидкости с наконечниками с низким удержанием 384/12,5 мкл путем дозирования 12,5 мкл в каждую скважину пластины (скорость аспирации и дозирования: 3,8 мкл/с).
- Повторите этап дозирования, как показано в пункте 2.3.7.1, чтобы достичь конечного объема 25 мкл в каждой скважине пластины. Накройте и оберните пластину алюминиевой фольгой, чтобы защитить ее от окружающего света.
- Инкубируйте покрытую клеточную пластину при 37 °C в увлажненном инкубаторе CO2 в течение 30 минут, извлеките ее из инкубатора и уравновешивайте при комнатной температуре внутри считывателя пластин или на стенде, держа пластину закрытой и обернутой фольгой еще 30 минут. Затем ячейки готовы к высокопроизводительному скринингу (HTS).
- Химическая подготовка: Раскрутите пластину лекарственного средства со стадии 2.2.1 при 1 200 × г в пластинчатой центрифуге в течение 1 мин при комнатной температуре.
- Готовят 10-кратный пептидный раствор агониста Rhimi-K-1 (QFSPWGamide) (10 мкМ) путем повторного использования 100 нмолей лиофилизированного пептида в 10 мл 1x HHBS, содержащего 0,1% DMSO, и переносят раствор в авто-дружественный резервуар объемом 150 мл.
- Измерьте фоновый сигнал: Для всего анализа HTS в считывателе пластин в разделе «Протоколы» выберите режим флуоресценции конечной точки.
ПРИМЕЧАНИЕ: Флуоресцентный сигнал считывается с нижней части пластины на длинах волн возбуждения/излучения 495 нм/525 нм.- Вставьте ячейку пластины в устройство чтения пластин. На панели приборов выберите регулировку усиления, выберите случайный колодец на пластине, присвойте ему 5-10% от максимального измеряемого значения флуоресценции и выберите регулируемую (считывающую) высоту.
- Нажмите кнопку Начать измерение , чтобы прочитать всю пластину для фонового флуоресцентного сигнала в относительных флуоресцентных блоках (РФС).
- Анализ «двойного сложения»
- Используя систему обработки жидкости с наконечниками 384/12,5 мкл, смешивают раствор препарата в каждой лунке лекарственной пластины, пипетку 3x вверх и вниз 10 мкл раствора лекарственного средства (в DPBS, содержащем 10% DMSO) (скорость пипетки: 5,2 мкл/с) и «аспират» 1,5 мкл из каждой лунки лекарственной пластины (скорость аспирации: 1,0 мкл/с).
- "Дозировать" 0,5 мкл соединений в пластину клеточного анализа (скорость дозирования: 1 мкл/с) для достижения конечной концентрации 2 мкМ в 0,2% ДМСО.
- Поместите пробирную пластину сразу же в считыватель пластин после добавления просеивающих соединений. Считывайте одну и ту же пластину как в прямом, так и в обратном направлениях считывания. Чтобы получить эти показания, определите программу для чтения из «скважины 1-384» и сразу из «384-1».
ПРИМЕЧАНИЕ: Считывание в обоих направлениях занимает в общей сложности 2 минуты. Такая конструкция считывания предназначена для компенсации снижения силы сигнала, которое происходит во время считывания пластин в каждом направлении. См. шаг 3.1 для анализа показаний. - Утилизируйте оставшийся 1 мкл раствора лекарственного средства в наконечниках, погружая наконечники в резервуар для отходов объемом 150 мл, содержащий ~50 мл DPBS (скорость дозирования: 1,0 мкл/с).
- Инкубируйте просеивающие соединения с клетками в течение в общей сложности 5 мин (включая 2 мин считывания пластин) при комнатной температуре в шкафу биобезопасности с выключенным светом. Добавьте 3 мкл пептида агониста, Rhimi-K-1 (QFSPWGamide), из резервуара (скорость аспирации: 3,1 мкл/с) в пробирную пластину с помощью системы обработки жидкости (скорость дозирования: 3,1 мкл/с) с наконечниками 384/12,5 мкл.
- Поместите пластину в считыватель пластин сразу после добавления агониста пептида. Считывание пластины как в прямом, так и в обратном направлениях с помощью той же программы, что и на шаге 2.3.12.3
3. Анализ данных
- Используя аналитическое программное обеспечение, связанное с пластинчатым считывателем, установленным на компьютере, рассчитайте реакции клеточной флуоресценции (в РФС) для обоих показаний после первого добавления соединения (First read; РФСназад [Дополнительная таблица S2]) и после этапов добавления агонистов (Второе чтение = RFUant [Дополнительная таблица S2]). Каждое считывание получается путем усреднения двух значений, полученных (не показанных) по показаниям передней и обратной пластин из шагов 2.3.12.3 и 2.3.12.6, соответственно.
ПРИМЕЧАНИЕ: RFUназад, RFUant относятся к относительным флуоресцентным единицам потенциальных ударов агониста (читайте на шаге 2.3.12.3) и потенциальных ударов антагониста (читайте в шаге 2.3.12.6) соответственно. - Экспортируйте все три набора данных, RFUbg, RFUago и RFUant, из аналитического программного обеспечения в три отдельные электронные таблицы. Каждая электронная таблица будет иметь только два столбца: хорошо позицию и необработанный РФС (файлы здесь не показаны).
ПРИМЕЧАНИЕ: РФСбг относится к РФС из предыстории, прочитанной в шаге 2.3.11.2. - Отформатируйте данные из трех электронных таблиц и организуйте вышеуказанные данные в одном CSV-файле (см. пример в дополнительной таблице S2). Вычтите фоновый сигнал, считанный из РФСназад и РФСант соответственно (столбцы G и H в Дополнительной таблице S2).
- Импортируйте CSV-файл в коммерчески доступную «онлайн-платформу данных HTS» (см. Таблицу материалов) для последующего анализа данных (таблица 1) и хранения.
- Вручную рассчитайте Z'-фактор для контроля качества каждого пластинчатого анализа, используя уравнение (1):
уравнение (1): (1)
(1)
ПРИМЕЧАНИЕ: μc- и μc+ представляют собой средние RRU показаний одних и тех же скважин, которые служат отрицательными контрольными элементами при первом добавлении после добавления растворителя (пустой растворитель, n = 64; числа синего цвета в дополнительной таблице S2) и служат положительными контрольными элементами после добавления агониста (пустой растворитель + агонист, n = 64; числа в пурпурном цвете), соответственно. Кроме того, σc- и σc+ представляют собой соответствующие им стандартные отклонения (SD). - Вручную выберите молекулы удара из тепловых карт на «онлайн-платформе данных HTS» и рассчитайте нормализованный процент активации (NPA) и ингибирующую активность (Io) для ударов агонистов и антагонистов, используя уравнение (2) и уравнение (3):
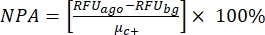 (2)
(2) (3)
(3)
Результаты
Собственная лекарственная пластина (SAC2-34-6170), состоящая из 320 случайных малых молекул, была использована для демонстрации этого анализа HTS в качестве примера. HTS имел отличное качество анализа с коэффициентом Z' 0,7 (таблица 1). Этот Z'-фактор отражает качество анализа независимо от испытуемых соединений34. Z'-фактор 0,5 или выше указывает на хороший динамический диапазон сигнала анализа между RRU положительных и отрицательных элементов управления. Анализы с Z'-коэффициентом менее 0,5 имеют неоптимальный динамический диапазон сигнала, обычно не информативны для выбора попадания и, следовательно, отбрасываются. Ответ (измеренный в относительных флуоресцентных единицах, РФС) от положительных контрольных групп (средний RFU 64 положительных ответов контрольной группы, μc+ = 130 139) был в среднем в 19 раз выше, чем у отрицательных контрольных (средний RFU 64 отрицательных ответов контрольной группы, μc- = 6 675). Отсечная флуоресценция для выбора «ударов агонистов» здесь была установлена на максимальное отношение нормализованного процента активации (NPA) >50%. Отсечная флуоресценция для выбора «ударов антагонистов» была установлена на наблюдаемую ингибирующую активность (Io) >50%. Были выбраны три молекулы агониста и два попадания антагонистов: SACC-0090237 (NPA = 153%), SACC-0036982 (NPA = 118%) и SACC-0006532 (NPA = 152%) в качестве агонистов и SACC-0103392 (Io = 53%) и SACC-0041280 (Io = 56%) в качестве антагонистов (исходные данные приведены в дополнительной таблице S2). Примеры расчетов NPA и Io для агонистов (зеленые строки) и антагонистов (оранжевые строки) соответственно приведены в дополнительной таблице S2.
| Добавление соединений | μс1 | σс | μс- | σс- | Значение Z' |
| (n = 320) | (n = 320) | (n = 64) | (n = 64) | ||
| 9,212 | 18,130 | 6,675 | 1,895 | 0.7 | |
| Добавление пептида агониста | μс | σс | μс+ | σc+ | 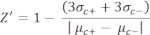 |
| 1,22,322 | 15,987 | 1,30,139 | 11,062 |
Таблица 1: Сводка нормализованных реакций клеток со всей пластины в анализе HTS. Среднее (μ) и стандартное отклонение (σ) получены из анализа хранилища CDD. Сокращения: HTS = высокопроизводительный скрининг; РФУ = относительные флуоресцентные единицы; 1с (образцы) = 320 испытанных соединений; μs = среднее значение клеточных ответов (RRU) из 320 скважин; μc- = среднее значение РФУ от отрицательных элементов управления; μc+ = среднее значение RRU из положительных элементов управления; σs = стандартное отклонение клеточных реакций (RRU) от 320 лунок; σc- = стандартное отклонение РФУ от отрицательных контрольных значений; σc+ = стандартное отклонение РФУ от положительных контрольных значений.
Дополнительная таблица S1: Пользовательские программы системы обработки жидкости для автоматических этапов дозирования. Эта таблица была изменена по сравнению с Xiong et al.31. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица S2: Необработанные данные репрезентативных результатов. Строки, выделенные зеленым цветом, представляют удары агонистов, а строки, выделенные оранжевым цветом, представляют удары антагонистов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Целью HTS является идентификация пораженных молекул путем скрининга огромного количества малых молекул. Поэтому результаты этого примера представляют собой лишь небольшую часть обычного эксперимента HTS. Кроме того, идентифицированные пораженные молекулы должны быть проверены в последующих анализах, таких как дозозависимый анализ на той же рекомбинантной клеточной линии и на клеточной линии CHO-K1, несущей только пустой вектор, который может быть выполнен одновременно для сохранения небольших молекул. Анализы цитотоксичности помогут продемонстрировать, что отсутствие реакции во втором дополнении не связано со смертностью клеток. Другие биоанализы должны быть выполнены для подтверждения активности в изолированных тканях in vitro или путем применения или подачи небольших молекул живым членистоногим. Полный конвейер идентификации низкомолекулярных лигандов рецептора клещевого кинина можно найти в предыдущей публикации31. Через этот конвейер было идентифицировано в общей сложности 36 попаданий антагонистов рецептора кинина клещей. Три из этих антагонистов были дополнительно протестированы в анализе тканевого сокращения-ингибирования и показали антимиотропную активность на задней кишке комара, где ортологичные рецепторы кинина комара экспрессируются31.
Каждая GPCR-экспрессирующая клеточная линия должна быть проверена для подходящих экспериментальных условий перед выполнением HTS. Эти условия включают плотность клеток (10 000 клеток на лунку), концентрацию экранированных соединений (2 мкМ), конечную концентрацию DMSO (0,2%) в анализе, концентрацию лиганда агониста, используемого для второго добавления (1 мкМ), скорость и глубину пипетирования и время считывания после добавления пептида агониста (5 мин). Крайне важно отрегулировать глубину и скорость системы обработки жидкости, чтобы гарантировать, что этапы дозирования не нарушают работу клеток, если ячейки являются адгезивными. Проверка этих условий перед началом HTS поможет в устранении неполадок, если качество анализа плохое. Важно иметь клетки в оптимальных условиях: клетки должны достигать 90%-100% слияния, но не быть чрезмерно конфлюированными в клеточной пластине при использовании для HTS. Если фоновые сигналы в определенных скважинах аномально низкие или высокие, после подтверждения под микроскопом очевидно низкой или высокой плотности клеток, выбросы должны быть удалены вручную при анализе данных. Прежде чем адаптировать анализ флуоресценции кальция к HTS, кинетическая кривая положительного пептида должна быть известна, так как кинетический ответ клеток на пептид агониста должен длиться в течение 1-2 минут, чтобы он был адаптирован в анализ HTS и длиться достаточно долго, чтобы прочитать всю пластину. Для достижения пролонгированного сигнала следует применять относительно высокую концентрацию пептида агониста или тестировать более высокую плотность клеток. Если кинетический ответ определенных рецепторных клеток слишком короткий (длится менее 1 мин), рекомендуется считывать с большей скоростью в считывании конечной точки или использовать только часть пластины для HTS. Конечно, качество рекомбинантной клеточной линии по отношению к уровню экспрессии рецепторов имеет решающее значение для успеха. Различные клональные клеточные линии, вероятно, будут варьироваться, так как вставка плазмиды случайна в геном, и это, безусловно, может повлиять на экспрессию рецепторов. Было бы идеально включить ранний тест на флуоресценцию кальция в трансфектированном бассейне и в процессе выбора клональных клеточных линий.
Ограничение анализа флуоресценции кальция заключается в том, что он измеряет активность вторичных мессенджеров вместо прямого связывания лиганда с рецептором. Хотя можно исключить попадание агониста вне цели путем скрининга пораженных молекул на клетках, которые не экспрессируют рецептор-мишень, невозможно полностью исключить молекулы внецелевого антагониста, используя этот анализ, потому что возможно, что некоторые молекулы могут ингибировать клеточные пути высвобождения кальция после передачи сигналов GPCR. Поэтому необходима дальнейшая валидация с использованием либо лигандсвязывающего анализа, либо биоанализа для валидации на уровне организма, например, в анализе клещевой ткани с известным агонистом, как это было сделано ранее с комарами31.
Большинство функциональных анализов, которые обнаруживают активацию GPCR, в основном измеряют внутриклеточные события в двух основных сигнальных путях: G-белково-зависимых и G-белковых независимых путях. G-белково-зависимые анализы измеряют концентрации Ca2+, инозитолтрифосфата (IP3) или цАМФ, в то время как G-белковые независимые анализы обнаруживают в основном трафик рецепторов или набор β-арестина7. Различные анализы используют различные технологии для считывания, такие как чувствительные красители Ca2 + (флуоресцентные анализы), фотопротеины, такие как акворины (Ca2 + биолюминесцентные анализы)14, помеченные флуоресцентные белки, анализы на основе флуоресцентного резонансного переноса энергии (FRET), анализы на основе биолюминесцентного резонансного переноса энергии (BRET) или клеточные анализы без меток на основе оптических биосенсоров. Эти анализы и соответствующие доступные технологии считывания были подробно рассмотрены Чжаном и Се35. Некоторые анализы применимы к любым GPCR, а некоторые специфичны для определенных GPCR (например, анализ Ca2+ для Gq-связанных рецепторов, цАМФ для Gi/o- илиG-s-связанных рецепторов). Однако, беспорядочно экспрессируя определенные G-белки с рецептором в рекомбинантных клетках, сигнальный путь может быть изменен. Например, белки Gq15/16 могут быть совместно экспрессированы с не-Gq-связанными рецепторами для обнаружения сигналов PLC-IP3-Ca 2+ 7,36. В отличие от анализов, которые измеряют одно молекулярное событие, существуют анализы с высоким содержанием, которые собирают огромное количество биологических данных для улучшения специфичности лиганда37. Этот тип анализа также более сложен и дорог для выполнения7.
В исследованиях беспозвоночных наиболее широко используемые функциональные анализы обнаруживают активацию GPCR путем анализа колебаний концентраций вторых мессенджеров, таких как Ca2+ или cAMP. Из-за различий в сигнальных путях между млекопитающими и беспозвоночными большинство других вышеупомянутых технологий считывания еще не получили широкого распространения для исследований GPCR среди беспозвоночных. Тем не менее, G-белки относительно сохраняются во всем животном мире. Недавно Lismont et al.38 продемонстрировали, что некоторые биосенсоры G-белка на основе БРЕТ человека также могут быть адаптированы для обнаружения активации GPCR насекомого при совместной экспрессии в рецепторных рекомбинантных клетках. Путем совместной экспрессии каждого из различных биосенсоров на основе G-белка (Gs, Gi/o, Gq/11 или G12/13) со специфическими GPCR можно выяснить механизм связывания G-белка. В исследовании Lismont et al.38 Schgr-CRF-DH мог дозозависимо активировать биосенсоры Gi/o и Gq/11 и не активировать биосенсоры Gs и G12/13.
В целом, анализ флуоресценции кальция, выполненный в 384-луночной пластине в сочетании с описанным здесь подходом «двойного добавления», позволяет отсеивать десятки тысяч молекул за относительно короткое время. Это относительно эффективный по времени и затратам подход к обнаружению пораженных молекул для последующей проверки и применения.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана премией USDA-NIFA-AFRI Animal Health and Well-Being Award (Номер награды 2022-67015-36336, PVP [Директор проекта]) и конкурсными фондами из Техасской программы грантов A&M AgriLife Research Insect Vector Diseases (FY'22-23) P.V.P. Группа преподавателей A.W.E.S.O.M.E. Колледжа сельского хозяйства и наук о жизни, TAMU, признана за помощь в редактировании рукописи. Дополнительная таблица S2 содержит данные из собственной, случайной, низкомолекулярной библиотеки, полученной из лаборатории доктора Джеймса Саккеттини в Техасском университете A & M и Texas A & M AgriLife Research.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10x96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
Ссылки
- Hanlon, C. D., Andrew, D. J. Outside-in signaling - A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993(2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260(2021).
- Hansen, K. B., Bräuner-Osborne, H. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. Leifert, W. , Humana Press. Totowa, NJ. (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167(2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151(2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486(2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732(2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008(2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H. Chapter 32 - Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). Kastin, A. J. , Academic Press. Cambridge, MA. 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800(2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940(2021).
- Kim, Y. -J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409(2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607(2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037(2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены