Method Article
בדיקת סידן פלואורסצנטית "דו-תוספת" לבדיקת תפוקה גבוהה של קולטנים מצומדים לחלבון G רקומביננטי
In This Article
Summary
בעבודה זו מתוארת בדיקה פלואורסצנטית של סידן תוך-תאי בעל תפוקה גבוהה עבור צלחות של 384 בארות לסינון ספריות מולקולות קטנות על קולטנים מצומדים לחלבון G רקומביננטי (GPCRs). המטרה, קולטן קינין מקרציית קדחת הבקר, Rhipicephalus microplus, מתבטאת בתאי CHO-K1. בדיקה זו מזהה אגוניסטים ואנטגוניסטים המשתמשים באותם תאים במבחן "תוספת כפולה" אחת.
Abstract
קולטנים מצומדים לחלבון G (GPCRs) מייצגים את משפחת-העל הגדולה ביותר של קולטנים והם המטרות של תרופות אנושיות רבות. סינון בתפוקה גבוהה (HTS) של ספריות מולקולות קטנות אקראיות מול GPCRs משמש את תעשיית התרופות לגילוי תרופות ספציפיות למטרה. במחקר זה, נעשה שימוש ב-HTS כדי לזהות ליגנדות חדשניות של מולקולות קטנות של GPCRs נוירופפטידים ספציפיים לחסרי חוליות כבדיקות למחקרים פיזיולוגיים של וקטורים של פתוגנים קטלניים אנושיים ווטרינריים.
קולטן קינין הספציפי לחסרי חוליות נבחר כיעד משום שהוא מווסת תהליכים פיזיולוגיים חשובים רבים אצל חסרי חוליות, כולל דיאורזה, האכלה ועיכול. יתר על כן, הפרמקולוגיה של GPCRs חסרי חוליות רבים מאופיינת בצורה גרועה או אינה מאופיינת כלל; לכן, הפרמקולוגיה הדיפרנציאלית של קבוצות קולטנים אלה ביחס ל- GPCRs הקשורים במטזואנים אחרים, במיוחד בני אדם, מוסיפה ידע ליחסי המבנה-פעילות של GPCRs כמשפחת-על. בדיקת HTS פותחה עבור תאים בלוחות של 384 בארות לגילוי ליגנדות של קולטן קינין מקרציית קדחת הבקר, או קרציית בקר דרומית, Rhipicephalus microplus. קולטן הקרצייה קינין התבטא ביציבות בתאי CHO-K1.
קולטן קינין, כאשר הוא מופעל על ידי נוירופפטידים אנדוגניים של קינין או אגוניסטים אחרים של מולקולות קטנות, גורם לשחרור Ca2+ ממאגרי סידן לתוך הציטופלסמה. בדיקת סידן פלואורסצנטית זו בשילוב עם גישת "תוספת כפולה" יכולה לזהות מולקולות "פוגעות" פונקציונליות של אגוניסט ואנטגוניסט באותה צלחת בדיקה. כל בדיקה נערכה באמצעות לוחות תרופות שנשאו מערך של 320 מולקולות קטנות אקראיות. התקבל גורם Z אמין של 0.7, וזוהו שלוש מולקולות אגוניסט ושני אנטגוניסטים כאשר ה-HTS היה בריכוז סופי של 2 מיקרומטר. ניתן להתאים את בדיקת הסידן הפלואורסצנטית המדווחת כאן לסינון GPCRs אחרים המפעילים את מפל האיתות Ca2+ .
Introduction
קולטנים מצומדים לחלבון G (GPCRs), הנמצאים משמרים ועד בני אדם, מייצגים את משפחת-העל הגדולה ביותר של קולטנים באורגניזמים רבים1. הם ממלאים תפקידים קריטיים בוויסות כמעט כל התהליכים הביולוגיים בבעלי חיים. ישנם 50-200 GPCRs בגנום של פרוקי רגליים, כלומר הם מייצגים את משפחת קולטני הממברנההגדולה ביותר 2. הם מסווגים לשש מחלקות עיקריות, A-F, בהתבסס על דמיון הרצף והפונקציות שלהם3. GPCRs מתמרים אותות חוץ-תאיים שונים, כגון אלה של הורמונים, נוירופפטידים, אמינים ביוגניים, גלוטמט, פרוטון, ליפוגליקופרוטאינים ופוטונים4. GPCRs מצמידים לחלבוני G הטרוטרימרים (Gα, Gβ ו-Gγ) כדי להעביר אותות במורד הזרם. GPCRs המצומדים לחלבוני Gαs או Gα i/o מגבירים או מקטינים, בהתאמה, את רמות האדנוזין מונופוספט (cAMP) התוך-תאיים 3', 5'-מחזורי על-ידיהפעלה או עיכוב של אדניליל ציקלאז. GPCRs המצומדים ל-Gαq/11 גורמים לשחרור סידן ממאגרי הסידן ברשתית האנדופלסמית על-ידי הפעלת מסלול הפוספוליפאז C (PLC)-אינוזיטול-1,4,5-טריפוספט (IP3). GPCRs המצומדים ל- Gα12/13 מפעילים את גורמי החלפת הנוקלאוטידים RhoGTPase 5,6. GPCRs הם המטרה של יותר מ -50% של תרופות אנושיות ו acaricide, amitraz4. כאשר GPCRs מתמרים אותות כה מגוונים, הם מהווים יעדים מבטיחים לפיתוח חומרי הדברה חדשניים המשבשים תפקודים פיזיולוגיים ספציפיים לחסרי חוליות.
המטרה של HTS היא לזהות מולקולות פגיעות שיכולות לווסת את תפקודי הקולטן. HTS כולל פיתוח בדיקות, מזעור ואוטומציה7. GPCRs נוירופפטידים של פרוקי רגליים מעורבים ברוב הפונקציות הפיזיולוגיות, כגון התפתחות, נפילה ואקדיזיס, הפרשה, גיוס אנרגיה ורבייה4. רוב הנוירופפטידים GPCRs של פרוקי רגליים ומטזואנים מאותתים דרך מפל איתות הסידן 2,6,8,9,10, כגון בקולטני הפפטיד המיואינהימבורי וה-SIFamide של הקרצייה השחורה Ixodes scapularis; הליגנדות שלהם הן אנטגוניסטיות במבחני תנועתיות אחוריים, כאשר SIF מעורר התכווצות ו- MIP מעכב אותו11,12. קולטן דמוי NPY של יתוש הקדחת הצהובה, Aedes aegypti, מווסת את נקבת הפונדקאית המחפשת13. בהשוואה למבחנים חלופיים אחרים לגיוס סידן, כגון בדיקת הסידן הביולומינסנציהaequorin 14, בדיקת הסידן הפלואורסצנטי קלה לביצוע, אינה דורשת העברה של חלבונים אחרים המזהים סידן רקומביננטי, והיא חסכונית. בדיקת הסידן הפלואורסצנטי מייצרת אות ממושך בהשוואה לאות הקינטי המהיר המתקבל בבדיקת הסידן הביולומינסנציה של אקוורין14,15.
בדוגמה כאן, קולטן קינין מקרציית קדחת הבקר, Rhipicephalus microplus, התבטא באופן רקומביננטי בקו התאים CHO-K1 ושימש לבדיקת סידן פלואורסצנטי. יש רק גן אחד של קולטן קינין שנמצא במיקרופלוס R. ; הקולטן מאותת דרך מסלול איתות תלוי חלבון Gq ומפעיל את השטף של Ca2+ ממאגרי סידן לתוך החלל התוך-תאי16. ניתן לזהות ולכמת את התהליך הזה על-ידי פלואורופור, שמעורר אות פלואורסצנטי בעת קשירת יוני סידן (איור 1).
קולטן קינין הוא GPCR ספציפי לחסרי חוליות, השייך לקולטנים דמויי רודופסין מסוג A. קינין הוא נוירופפטיד איתות עתיק שנמצא במולוסקה, סרטנאים, חרקים ואקרי 4,17,18. קולופטרנים (חיפושיות) חסרים את מערכת האיתות של קינין; אצל היתוש Aedes aegypti, יש רק קולטן קינין אחד שקושר שלושה אדסקינינים, בעוד שלדרוזופילה מלנוגסטר יש קולטן קינין אחד עם דרוסוקינין כליגנדייחודי 19,20,21. אין קינינים הומולוגיים או קולטני קינין אצל בעלי חוליות. למרות שהתפקוד המדויק של קינין אינו ידוע בקרציות, הנקבות המושתקות ב-RNAi של קולטן קינין של R. microplus מראות ירידה משמעותית בכושר הרבייה22. קינינים הם פפטידים פלוטרופיים בחרקים. ב Drosophila melanogaster, הם מעורבים הן במערכת ויסות העצבים המרכזית והן ההיקפית 23, טרום אקדיזה24, האכלה 25, מטבוליזם 26, ודפוסי פעילות שינה26,27, כמו גם תנועה זחל 28. קינינים מווסתים את ההתכווצות האחורית, דיאורזיס והזנה ביתוש A. aegypti 29,30,31. לפפטידים של קינין יש פנטפפטיד C-terminal Phe-X1-X2-Trp-Gly-NH2 שמור, שהוא הרצף המינימלי הנדרש לפעילות ביולוגית32. הספציפיות של פרוקי הרגליים, הגודל הקטן של הליגנד האנדוגני, מה שהופך אותם לנוחים להפרעות של מולקולות קטנות, והתפקודים הפליאוטרופיים בחרקים הופכים את קולטן קינין למטרה מבטיחה להדברה4.
מבחן "התוספת הכפולה" (איור 2) מאפשר זיהוי של אגוניסטים או אנטגוניסטים באותה בדיקת HTS15. הוא מותאם מבדיקת "תוספת כפולה" המשמשת בדרך כלל בתעשיית התרופות לגילוי תרופות33. בקצרה, התוספת הראשונה של תרופות לצלחת התא מאפשרת זיהוי של אגוניסטים פוטנציאליים בספרייה הכימית כאשר אות פלואורסצנטי גבוה יותר מזוהה בהשוואה ליישום של בקרת הממס. לאחר 5 דקות של דגירה עם מולקולות קטנות אלה, אגוניסט ידוע (פפטיד קינין) מוחל על כל הבארות. אותן בארות שקיבלו באופן אקראי אנטגוניסט מצלחת התרופה מציגות אות פלואורסצנטי נמוך יותר על תוספת אגוניסטית בהשוואה לבארות הבקרה שקיבלו את הממס בתוספת הראשונה. בדיקה זו מאפשרת זיהוי של אגוניסטים ואנטגוניסטים פוטנציאליים עם אותם תאים. בפרויקט HTS סטנדרטי, מולקולות פגיעות אלה יאומתו עוד יותר באמצעות מבחני מינון-תגובה ועל ידי מבחני פעילות ביולוגית נוספים, שאינם מוצגים כאן.

איור 1: המחשה של מנגנון בדיקת הסידן הפלואורסצנטי. חלבון ה-Gq מפעיל את מסלול איתות הסידן התוך-תאי. קולטן קינין (קולטן מצומד לחלבון G) בא לידי ביטוי רקומביננטי בתאי CHO-K1. כאשר הליגנד האגוניסט נקשר לקולטן, חלבון ה-Gq הקשור לקולטן קינין מפעיל את PLC, מה שמזרז את ההמרה של מולקולת PIP2 ל-IP3 ו-DAG. לאחר מכן, IP 3 נקשר ל-IP3R על פני השטח של הרשתית האנדופלסמית, מה שמוביל לשחרור Ca 2+ לתוך הציטופלסמה, שם יוני Ca2+ נקשרים לפלואורופורים ומעוררים אות פלואורסצנטי. ניתן לקבל את אות הפלואורסצנציה על ידי עירור ב 490 ננומטר ולזהות ב 514 ננומטר. קיצורים: GPCR = קולטן מצומד חלבון G; PLC = פוספוליפאז C; PIP2 = פוספטידילינוזיטול 4,5-ביספוספט; IP3 = אינוזיטול טריספוספט; DAG = דיאצילגליצרול; IP3 R = קולטן IP3. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: תהליך העבודה של הקרנה בתפוקה גבוהה של מולקולות קטנות על קולטן מצומד לחלבון G המתבטא בתאי CHO-K1. (A) תאי CHO-K1 רקומביננטיים המבטאים ביציבות את קולטן הקינין נוספו לצלחת 384 באר (10,000 תאים/באר) באמצעות מערכת טיפול בנוזל (25 μL/well) ודוגרו באינקובטור CO2 לח במשך 12-16 שעות. (ב ) חיץ הבדיקה המכיל את הצבע הפלואורסצנטי (25 μL/well) נוסף ללוחית התא באמצעות מערכת טיפול בנוזל. הצלחת דוגרה במשך 30 דקות בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות ושיוותה ב-RT למשך 30 דקות נוספות. (D) תמיסות סמים מצלחת ספרייה של 384 בארות וממס ריק (כולם ב-0.5 μL/well) נוספו ללוחית הבדיקה התאית באמצעות מערכת טיפול בנוזלים. (E) תגובות פלואורסצנטיות של סידן תאי נמדדו עם קורא הצלחות מיד לאחר הוספת תמיסות התרופה; תרכובות המעוררות אותות פלואורסצנטיים גבוהים מהממוצע נבחרו כפגיעות אגוניסטיות. להיטים אנטגוניסטיים שחוסמים את ה-GPCR (אייקון למטה) נחשפו לאחר הוספת האגוניסט הפפטידי במהלך שלב G. (F) באותה צלחת בדיקה, לאחר 5 דקות של דגירה של התאים עם תרכובות הקרנה, פפטיד אגוניסט אנדוגני Rhimi-K-1 (QFSPWGamide) של קולטן קינין קרציות נוסף לכל באר (1 μM). (G) תגובות פלואורסצנטיות תאיות לאחר תוספת הפפטיד האגוניסטית נמדדו על ידי קורא הלוחות באופן מיידי. תרכובות המעכבות את האות הפלואורסצנטי נבחרו כפגיעות אנטגוניסטיות. קיצורים: GPCR = קולטן מצומד חלבון G; RT = טמפרטורת החדר; RFU = יחידות פלואורסצנטיות יחסיות. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
1. תחזוקת תאים
הערה: קו תאי CHO-K1 המבטא ביציבות את קולטן קינין מ - R. microplus, בשם BMLK3, פותח על ידי Holmes et al.16. פרטי התפתחות קו התא מוצגים במקום אחר14. כל השלבים הבאים מבוצעים בתנאים סטריליים בארון בטיחות ביולוגית מדרגה II.
- הגדל את קו התא הרקומביננטי במדיה סלקטיבית (מדיום F-12K המכיל 10% סרום בקר עוברי [FBS] ו-800 מיקרוגרם/מ"ל G418 סולפט) כדי להבטיח את הביטוי של קולטן המטרה. אחסן את התאים המבטאים ביציבות את הקולטן ב-1 מ"ל של מדיום מקפיא (90% FBS ו-10% דימתיל סולפוקסיד [DMSO]) בקריביאלי של 2 מ"ל במקפיא של −80 מעלות צלזיוס.
הערה: לאחסון ארוך טווח של התאים הקפואים, אחסן אותם בחנקן נוזלי. - מחממים מראש את כל המדיה לפני תרבית תאים. בארון בטיחות ביולוגית, העבירו 13 מ"ל של מדיום סלקטיבי שחומם מראש (מדיום F-12K המכיל 10% FBS ו-800 מיקרוגרם/מ"ל G418 סולפט) לתוך בקבוקון T-75, ושמרו אותו בארון הבטיחות הביולוגית. הפשרת בקבוקון אחד של BMLK3 תאים קפואים (~ 1.5 × 106 תאים) באמבט מים 37 מעלות צלזיוס למשך 2-3 דקות. מעבירים את התאים המופשרים לתוך בקבוק T-75. שמור על התאים באינקובטור לח ב 37 מעלות צלזיוס ו 5% CO2 אלא אם כן צוין אחרת.
- כאשר התאים מגיעים למפגש של 90% (1-2 ימים), יש לחמם מראש את כל המדיה ל-37 מעלות צלזיוס, למעט תמיסת המלח החצובה בפוספט (DPBS) של דולבקו, שנשמרת בטמפרטורת החדר. בארון biosafety, להסיר את המדיום בילה מן בקבוק T-75, לשטוף את התאים במשך 5 s עם 10 מ"ל של DPBS על ידי מערבולת את הבקבוק בעדינות, ולאחר מכן להסיר את DPBS עם פיפטה סרולוגית.
הערה: תמונה של תאי CHO-K1 במפגש של 90% מוצגת ב- Lu et al.14. - נתק את התאים מבקבוק T-75 על ידי הוספת 2 מ"ל של 0.25% טריפסין-EDTA, ודגירה במשך 3-5 דקות ב 37 מעלות צלזיוס בחממה. לאחר מכן, מוסיפים 8 מ"ל של מדיום סלקטיבי, ומערבבים היטב על ידי פיפטינג ושחרור בעדינות 2x-3x עם אותה פיפטה סרולוגית.
- העבר 2 מ"ל של תרחיף התא (~ 1 × 106 תאים) משלב 1.4 לתוך בקבוק T-75 חדש המכיל 10 מ"ל של מדיום סלקטיבי חם. לגדל את התאים במשך 1-2 ימים באינקובטור עד שהם מגיעים למפגש של 90%.
- השתמש בתאים עבור הבדיקה שלאחר השלבים הבאים, או חזור על שלבים 1.4-1.5 פעם או פעמיים לפני השימוש בתאים בבדיקה.
הערה: אין לחרוג משלושה עד ארבעה מעברים, מכיוון שאות הבדיקה עם קווי תאים מסוימים עלול להיחלש עם מעברים נוספים.
2. בדיקת סידן פלואורסצנטי
- מצפים את צלחת התא.
- השתמש במערכת לטיפול בנוזלים הממוקמת בתוך ארון בטיחות ביולוגית עבור כל שלבי הצנרת בלוחות 384 הבארות. צור תוכניות מותאמות אישית לצינורות לתוך לוחות384 באר 31 (טבלה משלימה S1). מצפים מראש את הצלחות הסטריליות של 384 בארות. בארון בטיחות ביולוגית, יש לטעון 10 μL/well של תמיסה מימית של פולי-D-ליזין (PDL) ב-0.05 מ"ג/מ"ל לכל צלחת, ולדגור במשך 5 דקות בטמפרטורת החדר.
- רוקנו את הצלחת על ידי היפוך מהיר של הצלחת והכתמתה בעדינות על מגבות נייר סטריליות. לאחר מכן, יש לשטוף כל באר ב-10 מיקרו-ליטר מים, לרוקן את הצלחת ולהשאיר את הצלחת לייבוש בארון הבטיחות למשך הלילה ללא המכסה. סוגרים את הצלחת עם המכסה, ומאחסנים בטמפרטורה של 4 מעלות צלזיוס במקרר.
הערה: ניתן לאחסן את הלוחות המצופים בטמפרטורה של 4 מעלות צלזיוס למשך עד 6 חודשים.
- יום 1
- הוציאו את צלחת התרופות (100 מיקרומטר ב-90% DPBS + 10% DMSO, הריכוז הסופי בבאר עבור HTS יהיה 2 מיקרומטר) המאוחסן במקפיא −20 מעלות צלזיוס, והניחו אותה בטמפרטורת החדר.
הערה: פריסת צלחת התרופות: כל צלחת 384 בארות (24 עמודות x 16 שורות) מכילה 320 בארות עם תרכובות ספרייה שונות ו -64 בארות עם ממס ריק (DPBS המכיל 10% DMSO), המסודרות בארבע עמודות, עם שתי עמודות בקצה כל צד. ראו טבלה משלימה S2 לפריסת הצלחות. - כאשר תאים מגיעים למפגש של ~70%-90% בבקבוקון T-75, נתק את התאים מבקבוק T-75 כמתואר להלן. מחממים את כל המדיה ל-37 מעלות צלזיוס למעט ה-DPBS (טמפרטורת החדר).
- הסר את המדיום בילה, לשטוף את התאים עם 10 מ"ל של DPBS, ולאחר מכן להסיר את DPBS. נתק את התאים מבקבוק T-75 באמצעות 2 מ"ל של 0.25% טריפסין-EDTA למשך 3-5 דקות ב-37 מעלות צלזיוס באינקובטור, הוסף 8 מ"ל של מדיום סלקטיבי והעבר את מתלה התא לצינור חרוטי של 15 מ"ל לצנטריפוגה ב-1,000 × גרם למשך 3 דקות.
- יש להשליך את הסופר-נטנט ולתלות מחדש את גלולת התא ב-10 מ"ל של מדיום F-12K המכיל 1% FBS ו-400 מיקרוגרם/מ"ל G418 סולפט. שמור את המתלים בארון הבטיחות הביולוגית בעת קביעת ספירת התאים.
- קבע את צפיפות התאים של התרחיף לצורך דילול נוסף: ערבב 20 μL של תרחיף התא לתוך 20 μL של 0.4% טריפאן כחול, ולאחר מכן טען 20 μL של התערובת לתוך תא ספירת תאים כדי להיקרא על ידי מונה תאים עבור צפיפות התא.
- לדלל את תרחיף התא באותו מדיום (מדיום F-12K המכיל 1% FBS ו-400 מיקרוגרם/מ"ל G418 סולפט) לנפח סופי של לפחות 15 מ"ל בצפיפות של 4 × 105 תאים/מ"ל.
- זרעו את התאים בצלחת 384 המצופה ב-PDL. העבר 15 מ"ל מתלי התא הנ"ל (4 × 105 תאים למ"ל) למאגר ריאגנטים ידידותי לרכב של 150 מ"ל. יש לחלק 25 μL של תרחיף התא (~ 10,000 תאים / באר) לתוך כל באר של 384 בארות של הצלחת באמצעות מערכת טיפול בנוזל בשני שלבים. טען 384/12.5 μL קצוות שמירה נמוכים על ראש המטפל בנוזל, שאף 12.5 μL מהמאגר (מהירות 5.2 μL/s), והשלך לתוך כל באר (מהירות: 3.1 μL / s).
- חזור על הפיפטינג כמו בשלב הקודם 2.2.5 כדי להגיע ל-25 μL לכל באר. לאחר מכן, לדגור את הצלחת לילה (14-16 שעות) ב 37 מעלות צלזיוס ו 5% CO2 באינקובטור לחות.
הערה: מכיוון שנפח הפיפטינג המרבי הוא 12.5 μL עבור ראש ספציפי זה, פיפטינג עבור 25 μL מבוצע בשני שלבים.
- הוציאו את צלחת התרופות (100 מיקרומטר ב-90% DPBS + 10% DMSO, הריכוז הסופי בבאר עבור HTS יהיה 2 מיקרומטר) המאוחסן במקפיא −20 מעלות צלזיוס, והניחו אותה בטמפרטורת החדר.
- יום 2
- למחרת בבוקר, בדוק את צלחת התא המכוסה תחת מיקרוסקופ; אם לא מפגש, המתן עד שהתאים יגיעו למפגש של 90%.
- הכן תמיסת מלאי של צבע פלואורסצנטי: השהה צבע פלואורסצנטי ליופילי ב- 100 μL של DMSO, והימנע מאור ישיר בתמיסת המלאי. יש לעטוף את השפופרת ברדיד אלומיניום כדי למנוע הלבנת פוטו.
הערה: ניתן להעלות את המניה ל-15 μL aliquots עבור כל בדיקת צלחת כדי למנוע הקפאה והפשרה חוזרות ונשנות; ניתן לאחסן את האליקוטים ב- −80 מעלות צלזיוס למשך עד חודש אחד. - בארון הבטיחות הביולוגית עם האורות כבויים, הכינו צבע העמסה (1x) בצינור חרוטי של 15 מ"ל עטוף ברדיד אלומיניום, המשלב 15 μL מתמיסת הצבע הפלואורסצנטי (משלב 2.3.2) ושאר רכיבי הערכה שחוממו מראש (37 מעלות צלזיוס): 13.5 מ"ל של 1x HHBS (המאגר של האנק עם 20 mM HEPES) ו-1.5 מ"ל של מגיב B (מעכב efflux צבע).
הערה: תאורת החדר דולקת במהלך שלב זה. - סגרו את הצינור וערבבו היטב על ידי היפוך עדין של הצינור מספר פעמים (בדרך כלל 3-5x).
הערה: יש לשמור בטמפרטורת החדר ולהשתמש בתערובת הצבעים לטעינה תוך 30 דקות. - כאשר התאים מגיעים למפגש של 90%, הסר את המדיום המושקע מצלחת הבדיקה של 384 בארות על ידי היפוך מהיר של הצלחת והכתמה עדינה על מגבות נייר סטריליות; חזור על תנועה זו 2x-3x כדי להסיר את כל הנוזל מהצלחת. השליכו את המגבות הרטובות.
- כבו את רוב האורות הישירים המלאכותיים בחדר (משאירים מנורת שולחן רכה ועמומה דולקת או דומה כדי לאפשר תנאי עבודה נראים לעין) ובארון הבטיחות הביולוגית לכל השלבים עד סוף הבדיקה (בערך למשך שעה וחצי).
- מקם 15 מ"ל של צבע הטעינה (1x) משלב 2.3.3 למאגר ידידותי לרכב של 150 מ"ל.
- העבר 25 μL של צבע ההעמסה (1x) מהמאגר לתוך כל באר באמצעות מערכת טיפול בנוזלים עם 384/12.5 μL טיפים לשמירה נמוכה על ידי חלוקת 12.5 μL לתוך כל באר של הצלחת (שאיפה ומהירות חלוקה: 3.8 μL / s).
- חזור על שלב הפיפטינג כמו ב- 2.3.7.1 כדי להגיע לנפח סופי של 25 μL בכל באר של הצלחת. מכסים ועוטפים את הצלחת בנייר אלומיניום כדי להגן עליה מפני אור הסביבה.
- דגירה של צלחת התא המכוסה בטמפרטורה של 37 מעלות צלזיוס באינקובטור האדים CO2 למשך 30 דקות, הסר אותה מהאינקובטור ושיווי משקל בטמפרטורת החדר בתוך קורא הצלחות או על הספסל, תוך שמירה על הצלחת מכוסה ועטופה בנייר כסף למשך 30 דקות נוספות. לאחר מכן התאים מוכנים להקרנה בתפוקה גבוהה (HTS).
- הכנה כימית: סובבו את צלחת התרופה משלב 2.2.1 ב-1,200 × גרם בצנטריפוגת צלחת למשך דקה אחת בטמפרטורת החדר.
- הכינו תמיסת פפטידים אגוניסטית 10x של Rhimi-K-1 (QFSPWGamide) (10 μM) על ידי החייאת 100 nmoles של פפטיד lyophilized ב 10 מ"ל של 1x HHBS המכיל 0.1% DMSO, ולהעביר את התמיסה למאגר 150 מ"ל ידידותי אוטומטית.
- מדוד את אות הרקע: עבור כל בדיקת HTS בקורא הלוחות, תחת פרוטוקולים, בחר מצב פלואורסצנציה של נקודת קצה.
הערה: האות הפלואורסצנטי נקרא מתחתית הלוח באורכי גל עירור/פליטה של 495 ננומטר/525 ננומטר.- הכנס את לוחית התא לקורא הלוחות. בלוח המחוונים, בחר כוונן רווח, בחר באר אקראית על הלוח, הקצה אותה כ- 5%-10% מערך הפלואורסצנציה המרבי הניתן למדידה, ובחר התאם (קריאה) גובה.
- לחץ על התחל מדידה כדי לקרוא את כל הלוח עבור אות הפלואורסצנציה ברקע ביחידות פלואורסצנטיות יחסית (RFU).
- בדיקת "תוספת כפולה"
- שימוש במערכת הטיפול בנוזלים עם טיפים של 384/12.5 μL, כדי לערבב את תמיסת התרופה בכל באר של צלחת התרופה, פיפטה פי 3 למעלה ולמטה 10 μL של תמיסת התרופה (ב-DPBS המכילה 10% DMSO) (מהירות פיפטינג: 5.2 μL/s), ו"לשאוף" 1.5 μL מכל באר של צלחת התרופה (מהירות שאיפה: 1.0 μL/s).
- "מחלקים" 0.5 μL של התרכובות לתוך צלחת הבדיקה של התא (מהירות פיפטינג: 1 μL/s) כדי להגיע לריכוז סופי של 2 μM ב 0.2% DMSO.
- הנח את צלחת הבדיקה מיד לתוך קורא הלוחות לאחר הוספת תרכובות ההקרנה. קרא את אותה צלחת בכיוון הקריאה קדימה ואחורה. כדי להשיג קריאות אלה, הגדר תוכנית לקריאה מתוך "באר 1-384" ומיד מ "384-1".
הערה: הקריאה בשני הכיוונים אורכת 2 דקות בסך הכל. עיצוב קריאה זה נועד לפצות על הירידה בעוצמת האות המתרחשת במהלך קריאת הלוח בכל כיוון. עיין בשלב 3.1 לניתוחי הקריאה. - השליכו את 1 μL הנותרים של תמיסת התרופה בקצוות על ידי טבילת הקצוות לתוך מאגר פסולת של 150 מ"ל המכיל ~ 50 מ"ל של DPBS (מהירות חלוקה: 1.0 μL / s).
- דגרו את תרכובות הסינון עם התאים למשך 5 דקות בסך הכל (כולל 2 דקות של קריאת צלחת) בטמפרטורת החדר בארון הבטיחות הביולוגית כשהאורות כבויים. הוסף 3 μL של הפפטיד האגוניסטי, Rhimi-K-1 (QFSPWGamide), מהמאגר (מהירות שאיפה: 3.1 μL/s) לתוך צלחת הבדיקה באמצעות מערכת הטיפול בנוזל (מהירות חלוקה: 3.1 μL / s) עם 384/12.5 μL טיפים.
- מניחים את הצלחת בקורא הצלחות מיד לאחר הוספת הפפטיד האגוניסטי. קרא את הלוח הן בכיוון קדימה והן בכיוון ההפוך באמצעות אותה תוכנית כמו בשלב 2.3.12.3
3. ניתוח נתונים
- באמצעות תוכנת הניתוח המשויכת לקורא הצלחות המותקן במחשב, חשב את תגובות הפלואורסצנציה התאית (ב- RFU) עבור שתי הקריאות לאחר התוספת התרכובת הראשונה (קריאה ראשונה; לפני RFU [טבלה משלימה S2]) ולאחר שלבי התוספת האגוניסטית (קריאה שנייה = נמלת RFU [טבלה משלימה S2]). כל קריאה מתקבלת על ידי ממוצע של שני הערכים המתקבלים (לא מוצגים) על ידי קריאות הלוח קדימה ואחורה משלב 2.3.12.3 ושלב 2.3.12.6, בהתאמה.
הערה: לפני RFU, נמלת RFU מתייחסת ליחידות הפלואורסצנטיות היחסיות של להיטי האגוניסט הפוטנציאליים (נקראים בשלב 2.3.12.3) וללהיטי האנטגוניסטים הפוטנציאליים (נקראים בשלב 2.3.12.6), בהתאמה. - ייצא את כל שלוש קבוצות הנתונים, RFU bg, RFU לפני ונמלת RFU, מתוכנת הניתוח לשלושה גיליונות אלקטרוניים נפרדים. כל גיליון אלקטרוני יכלול שתי עמודות בלבד: מיקום טוב ו- RFU גולמי (קבצים שאינם מוצגים כאן).
הערה: RFU bg מתייחס ל- RFU של הרקע שנקרא בשלב 2.3.11.2. - עצב את הנתונים משלושת הגיליונות האלקטרוניים וארגן את הנתונים לעיל בקובץ csv אחד (ראה את הדוגמה בטבלה המשלימה S2). הפחת את אות הרקע שנקרא מלפני RFU ומנמלת RFU, בהתאמה (עמודות G ו- H בטבלה המשלימה S2).
- יבא את קובץ ה- csv לתוך "פלטפורמת נתונים מקוונת של HTS" הזמינה באופן מסחרי (ראה טבלת חומרים) לניתוח נתונים במורד הזרם (טבלה 1) ואחסון.
- חשב באופן ידני את גורם Z עבור בקרת האיכות של כל בדיקת צלחת באמצעות משוואה (1):
משוואה (1): (1)
(1)
הערה: μ c ו- μc+ מייצגים את ה- RFUs הממוצעים של קריאות של אותן בארות, המשמשות כבקרות שליליות בתוספת הראשונה לאחר הוספת הממס (ממס ריק, n = 64; מספרים בכחול בטבלה משלימה S2) ומשמשות כבקרות חיוביות לאחר הוספת האגוניסט (ממס ריק + אגוניסט, n = 64; מספרים במגנטה), בהתאמה. בנוסף, σ c ו- σc+ מייצגים את סטיות התקן (SDs) המתאימות שלהם. - בחר ידנית את מולקולות הפגיעה ממפות החום ב"פלטפורמת הנתונים המקוונת של HTS", וחשב את הפעלת האחוזים המנורמלת (NPA) והפעילות המעכבת (Io) עבור להיטי האגוניסט ולהיטי האנטגוניסטים באמצעות משוואה (2) ומשוואה (3):
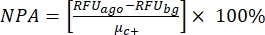 (2)
(2) (3)
(3)
תוצאות
צלחת תרופות פנימית (SAC2-34-6170) המורכבת מ-320 מולקולות קטנות אקראיות שימשה להדגמת מבחן HTS זה כדוגמה. ל-HTS הייתה איכות בדיקה מצוינת עם מקדם Z' של 0.7 (טבלה 1). גורם Z' זה משקף את איכות הבדיקה ללא תלות בתרכובות שנבדקו34. גורם Z′ של 0.5 ומעלה מציין טווח דינמי של אות בדיקה טוב בין ה- RFUs של הפקדים החיוביים לבין הבקרות השליליות. למבחנים עם גורם Z קטן מ-0.5 יש טווח דינמי של אות לא אופטימלי, הם בדרך כלל לא אינפורמטיביים לבחירת להיטים, ולכן הם מושלכים. התגובה (שנמדדה ביחידות פלואורסצנטיות יחסיות, RFU) מבוקרים חיוביים (RFU ממוצע של 64 תגובות בקרה חיוביות, μc+ = 130,139) הייתה בממוצע גבוהה פי 19 מזו של הבקרות השליליות (RFU ממוצע של 64 תגובות בקרה שליליות, μc- = 6,675). פלואורסצנטיות החיתוך לבחירת "להיטי אגוניסט" כאן הוגדרה ליחס מקסימלי של אחוז הפעלה מנורמל (NPA) של >50%. פלואורסצנטיות החיתוך לבחירת "פגיעות אנטגוניסטיות" הוגדרה לפעילות מעכבת נצפית (Io) של >50%. נבחרו שלוש מולקולות פגיעה אגוניסטיות ושני פגיעות אנטגוניסטיות: SACC-0090237 (NPA = 153%), SACC-0036982 (NPA = 118%), ו- SACC-0006532 (NPA = 152%) כאגוניסטים, ו- SACC-0103392 (I o = 53%) ו- SACC-0041280 (I o = 56%) כאנטגוניסטים (הנתונים הגולמיים מוצגים בטבלה המשלימה S2). דוגמאות לחישובים של NPA ו- Io עבור אגוניסטים (שורות ירוקות) ואנטגוניסטים (שורות כתומות), בהתאמה, מוצגות בטבלה המשלימה S2.
| תוספת תרכובת | μs1 | σשניות | μג- | σג- | ערך Z' |
| (n = 320) | (n = 320) | (n = 64) | (n = 64) | ||
| 9,212 | 18,130 | 6,675 | 1,895 | 0.7 | |
| תוספת פפטיד אגוניסטית | μ שניות | σשניות | μc+ | σc+ | 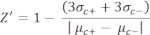 |
| 1,22,322 | 15,987 | 1,30,139 | 11,062 |
טבלה 1: סיכום תגובות התאים המנורמלים מכל הצלחת במבחן HTS. הממוצע (μ) וסטיית התקן (σ) מתקבלים מניתוח כספת CDD. קיצורים: HTS = סינון תפוקה גבוהה; RFUs = יחידות פלואורסצנטיות יחסיות; 1שניות (דגימות) = 320 תרכובות שנבדקו; μs = הערך הממוצע של תגובות סלולריות (RFUs) מ-320 בארות; μc- = הערך הממוצע של RFUs מבקרות שליליות; μc+ = הערך הממוצע של RFUs מבוקרים חיוביים; σs = סטיית תקן של תגובות סלולריות (RFUs) מ-320 בארות; σc- = סטיית תקן של RFUs מבקרות שליליות; σc+ = סטיית תקן של RFUs מבקרות חיוביות.
טבלה משלימה S1: תוכניות מותאמות אישית של מערכת הטיפול בנוזלים לשלבי הצנרת האוטומטיים. טבלה זו שונתה מ- Xiong et al.31. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה S2: הנתונים הגולמיים של התוצאות המייצגות. השורות המודגשות בירוק מייצגות את הלהיטים האגוניסטיים, והשורות המודגשות בכתום מייצגות את להיטי היריבים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
המטרה של HTS היא לזהות מולקולות פגיעות באמצעות סינון מספר עצום של מולקולות קטנות. לכן, התוצאות מדוגמה זו מייצגות רק חלק קטן מניסוי HTS קונבנציונלי. יתר על כן, מולקולות הפגיעה שזוהו צריכות להיות מאומתות במבחנים במורד הזרם, כגון בדיקה תלוית מינון על אותו קו תאים רקומביננטי ועל קו תאים CHO-K1 הנושא רק את הווקטור הריק, אשר ניתן לבצע בו זמנית כדי להציל מולקולות קטנות. מבחני ציטוטוקסיות יסייעו להוכיח כי חוסר תגובה בתוספת השנייה אינו נובע מתמותת תאים. יש לבצע בדיקות ביולוגיות אחרות כדי לאמת את הפעילות ברקמות המבודדות במבחנה, או על ידי יישום או הזנה של המולקולות הקטנות לפרוקי רגליים חיים. את הצינור המלא של זיהוי ליגנד במולקולות קטנות של קולטן הקרצייה קינין ניתן למצוא בפרסום קודם31. באמצעות צינור זה זוהו בסך הכל 36 פגיעות אנטגוניסטיות של קולטן קינין הקרציות. שלושה מהאנטגוניסטים הללו נבדקו עוד יותר בבדיקת התכווצות רקמות והראו פעילות אנטי-מיוטרופית על היתוש האחורי, שם קולטני קינין יתושים אורתולוגיים באים לידי ביטוי31.
כל קו תאים המבטא GPCR צריך להיות מאומת לתנאי ניסוי מתאימים לפני ביצוע HTS. תנאים אלה כוללים את צפיפות התאים (10,000 תאים לבאר), ריכוז התרכובות הנבדקות (2 μM), ריכוז ה- DMSO הסופי (0.2%) בבדיקה, ריכוז הליגנד האגוניסטי המשמש לתוספת השנייה (1 μM), מהירות ועומק הפיפטינג, וזמן הקריאה לאחר הוספת הפפטיד האגוניסט (5 דקות). זה קריטי להתאים את העומק והמהירות של מערכת הטיפול בנוזלים כדי להבטיח ששלבי החלוקה לא יפריעו לתאים אם התאים דבקים. האימות של תנאים אלה לפני היציאה ל- HTS יסייע בפתרון בעיות אם איכות הבדיקה ירודה. חשוב שהתאים יהיו בתנאים אופטימליים: התאים צריכים להגיע למפגש של 90%-100% אך לא להיות בעלי צפיפות יתר בצלחת התא כאשר משתמשים בהם עבור HTS. אם אותות הרקע בבארות מסוימות נמוכים או גבוהים באופן חריג, לאחר אישור תחת המיקרוסקופ לצפיפות תאים נמוכה או גבוהה בעליל, יש להסיר את החריגים באופן ידני בעת ניתוח הנתונים. לפני התאמת בדיקת הסידן הפלואורסצנטי ל- HTS, העקומה הקינטית של הפפטיד החיובי חייבת להיות ידועה, שכן התגובה הקינטית של התאים לפפטיד האגוניסט צריכה להימשך 1-2 דקות כדי שהיא תותאם למבחן HTS ותימשך מספיק זמן כדי לקרוא את הצלחת כולה. כדי להשיג את האות הממושך, יש ליישם ריכוז גבוה יחסית של הפפטיד האגוניסטי, או לבדוק צפיפות תאים גבוהה יותר. אם התגובה הקינטית של תאי הקולטן המסוימים קצרה מדי (נמשכת פחות מדקה אחת), מומלץ לקרוא במהירות גבוהה יותר בקריאת נקודת הקצה או להשתמש רק בחלק מהצלחת עבור HTS. אין ספק שאיכות קו התאים הרקומביננטיים ביחס לרמת ביטוי הקולטן חיונית להצלחה. סביר להניח שקווי תאי שבלולית שונים ישתנו, שכן החדרת הפלסמיד היא אקראית בגנום, וזה בהחלט יכול להשפיע על ביטוי הקולטן. זה יהיה אידיאלי לשלב בדיקת סידן פלואורסצנטית מוקדמת של המאגר הטרנספקטיבי ובמהלך תהליך בחירת קווי התאים הקלוניים.
המגבלה של בדיקת הסידן הפלואורסצנטי היא שהיא מודדת את פעילותם של השליחים המשניים במקום את הקשירה הישירה של הליגנד לקולטן. למרות שניתן לשלול את פגיעות האגוניסט מחוץ למטרה על ידי סינון מולקולות הפגיעה על התאים שאינם מבטאים את קולטן המטרה, לא ניתן לשלול לחלוטין את מולקולות הפגיעה של האנטגוניסט מחוץ למטרה באמצעות בדיקה זו מכיוון שייתכן שמולקולות מסוימות עשויות לעכב את מסלולי שחרור הסידן התאיים במורד הזרם של איתות ה- GPCR. לכן, יש צורך באימות נוסף באמצעות בדיקת קשירת ליגנד או בדיקה ביולוגית לאימות ברמת האורגניזם, כגון בבדיקת רקמת קרציות עם אגוניסט ידוע, כפי שנעשה בעבר עם יתושים31.
רוב המבחנים הפונקציונליים שמזהים הפעלת GPCR מודדים בעיקר אירועים תוך-תאיים בשני מסלולי איתות עיקריים: מסלולים תלויי חלבון G ומסלולים שאינם תלויים בחלבון G. מבחנים תלויי חלבון G מודדים Ca2+, אינוזיטול טריפוספט (IP3), או ריכוזי cAMP, בעוד שבדיקות שאינן תלויות בחלבון G מזהות בעיקר סחר בקולטנים או גיוס β-arrestin7. מבחנים שונים משתמשים בטכנולוגיות שונות לקריאה, כגון צבעים רגישים ל-Ca 2+ (מבחני פלואורסצנציה), פוטופרוטאינים כגון aequorins (מבחני Ca2+ bioluminescence)14, חלבונים פלואורסצנטיים מתויגים, מבחנים מבוססי העברת אנרגיה בתהודה פלואורסצנטית (FRET), מבחנים מבוססי העברת אנרגיה בתהודה ביולוגית (BRET), או מבחנים תאיים מבוססי ביוסנסור אופטי ללא תווית. מבחנים אלה וטכנולוגיות הקריאה הזמינות המתאימות נבדקו בפירוט על ידי ג'אנג ושיה35. חלק מהמבחנים ישימים לכל GPCRs, וחלקם ספציפיים ל-GPCRs מסוימים (לדוגמה, בדיקת Ca2+ עבור קולטנים מצומדים G q, cAMP עבור קולטנים מצומדיםG i / o אוG s). עם זאת, על ידי ביטוי משותף מופקר של חלבוני G מסוימים עם הקולטן בתאים הרקומביננטיים, ניתן לשנות את מסלול האיתות. לדוגמה, חלבוני Gq15/16 יכולים לבוא לידי ביטוי משותף עם קולטנים שאינם מצומדים ל-Gq עבור זיהוי איתות PLC-IP3-Ca 2+ 7,36. בניגוד למבחנים המודדים אירוע מולקולרי יחיד, ישנם מבחני ניתוח בעלי תוכן גבוה, אשר אוספים כמות עצומה של נתונים ביולוגיים כדי לשפר את הספציפיות של הליגנד37. סוג זה של בדיקה הוא גם מורכב יותר ויקר יותר לביצוע7.
במחקר חסרי חוליות, המבחנים הפונקציונליים הנפוצים ביותר מזהים הפעלת GPCR על ידי ניתוח התנודות בריכוזים של שליחים שניים, כגון Ca2+ או cAMP. בשל ההבדלים במסלולי האיתות בין יונקים לחסרי חוליות, רוב טכנולוגיות הקריאה האחרות שהוזכרו לעיל עדיין לא אומצו באופן נרחב עבור מחקרי GPCR של חסרי חוליות. עם זאת, חלבוני G נשמרים יחסית ברחבי ממלכת החי. לאחרונה, Lismont et al.38 הראו כי ניתן להתאים כמה ביוסנסורים של חלבון G המבוססים על BRET אנושיים גם כדי לזהות את ההפעלה של GPCR חרק כאשר הם באים לידי ביטוי משותף בתאים הרקומביננטיים של הקולטן. על ידי ביטוי משותף של כל אחד מהביוסנסורים השונים המבוססים על חלבון G (Gs, Gi/o, G q/11 או G12/13) עם GPCRs ספציפיים, ניתן להבהיר את מנגנון צימוד החלבון G. במחקר שנערך על ידי Lismont et al.38, ה-Schgr-CRF-DH יכול היה להפעיל באופן תלוי מינון את הביוסנסורים Gi/o ו-G q/11 ולא הפעיל את הביוסנסורים Gs ו-G12/13.
בסך הכל, בדיקת הסידן הפלואורסצנטית המבוצעת בצלחת של 384 בארות בשילוב עם גישת "התוספת הכפולה" המתוארת כאן מאפשרת סינון של עשרות אלפי מולקולות בזמן קצר יחסית. זוהי גישה חסכונית יחסית בזמן ובמחיר לגילוי מולקולות פגיעה עבור אימותים ויישומים במורד הזרם.
Disclosures
למחברים אין ניגוד עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי פרס USDA-NIFA-AFRI לבריאות ורווחת בעלי חיים (פרס מספר 2022-67015-36336, PVP [מנהל הפרויקט]) ומקרנות תחרותיות מתוכנית המענקים למחלות וקטוריות חרקים של טקסס A&M AgriLife (FY'22-23) ל- P.V.P. קבוצת הסגל A.W.E.S.O.M.E. של המכללה לחקלאות ומדעי החיים, TAMU, מוכרת על עזרה בעריכת כתב היד. טבלה משלימה S2 מכילה נתונים מספריית מולקולות קטנות פנימית, אקראית, שהתקבלו ממעבדתו של ד"ר ג'יימס סאצ'טיני באוניברסיטת A&M בטקסס A&M AgriLife Research.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10x96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
References
- Hanlon, C. D., Andrew, D. J. Outside-in signaling - A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993(2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260(2021).
- Hansen, K. B., Bräuner-Osborne, H. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. Leifert, W. , Humana Press. Totowa, NJ. (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167(2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151(2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486(2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732(2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008(2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H. Chapter 32 - Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). Kastin, A. J. , Academic Press. Cambridge, MA. 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800(2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940(2021).
- Kim, Y. -J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409(2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607(2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037(2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved