Method Article
Фосфолипидный медиатор индуцированная трансформация в трехмерных культурах
В этой статье
Резюме
Настоящий протокол описывает создание 3D-культур «сверху» нетрансформированной эпителиальной клеточной линии молочной железы MCF10A, которая была модифицирована для изучения трансформации, вызванной активирующим фактором тромбоцитов (PAF). Иммунофлуоресценция была использована для оценки трансформации и подробно обсуждается.
Аннотация
Для изучения рака было разработано несколько моделей, таких как модели грызунов и установленные клеточные линии. Ценная информация о канцерогенезе была получена в результате исследований с использованием этих моделей. Клеточные линии обеспечили понимание дерегуляции молекулярной сигнализации, связанной с опухолевым генезом молочной железы, в то время как модели грызунов широко используются для изучения клеточных и молекулярных характеристик рака молочной железы in vivo. Создание 3D-культур эпителиальных и раковых клеток молочной железы помогает преодолеть разрыв между моделями in vivo и in vitro , имитируя условия in vivo in vitro. Эта модель может быть использована для понимания дерегуляции сложных молекулярных сигнальных событий и клеточных характеристик во время канцерогенеза молочной железы. Здесь система 3D-культур модифицируется для изучения фосфолипидной медиатор-индуцированной (активирующий фактор тромбоцитов, PAF) трансформации. Иммуномодуляторы и другие секретируемые молекулы играют важную роль в инициации и прогрессировании опухоли в молочной железе. В настоящем исследовании 3D-ацинарные культуры эпителиальных клеток молочной железы подвергаются воздействию проявленных характеристик трансформации PAF, таких как потеря полярности и измененные клеточные характеристики. Эта система 3D-культур поможет пролить свет на генетические и / или эпигенетические возмущения, вызванные различными мелкомолекулярными образованиями в микроокружении опухоли. Кроме того, эта система также обеспечит платформу для идентификации новых, а также известных генов, которые могут быть вовлечены в процесс трансформации.
Введение
Для изучения прогрессирования рака доступно множество моделей, каждая из которых уникальна и представляет собой подтип этого сложного заболевания. Каждая модель предоставляет уникальную и ценную информацию о биологии рака и улучшает средства для имитации фактического состояния заболевания. Установленные клеточные линии, выращенные как монослой, предоставили ценную информацию о жизненно важных процессах in vitro, таких как пролиферация, инвазивность, миграция и апоптоз1. Хотя двумерная (2D) клеточная культура была традиционным инструментом для исследования реакции клеток млекопитающих на несколько возмущений окружающей среды, экстраполяция этих результатов для прогнозирования реакций на тканевом уровне не кажется достаточно убедительной. Основным ограничением 2D-культур является то, что создаваемая микросреда в значительной степени отличается от микросреды самой ткани молочной железы2. 2D культуре не хватает взаимодействия клеток с внеклеточным матриксом, что жизненно важно для роста любой ткани. Кроме того, силы растяжения, испытываемые клеткой в монослойных культурах, препятствуют полярности этих клеток, тем самым изменяя передачу сигналов и поведение клеток 3,4,5. Трехмерные (3D) системы культур открыли новый путь в области исследований рака с их способностью имитировать условия in vivo in vitro. Многие важные микроокружательные сигналы, которые теряются в 2D-культуре клеток, могут быть восстановлены с использованием 3D-культур богатого ламинином внеклеточного матрикса (lrECM)6.
Различные исследования выявили значение микроокружения опухоли в канцерогенезе 7,8. Факторы, связанные с воспалением, являются основной частью микросреды. Активирующий фактор тромбоцитов (PAF) является фосфолипидным медиатором, секретируемым различными иммунными клетками, который опосредует множественные иммунные реакции 9,10. Высокие уровни PAF секретируются различными клеточными линиями рака молочной железы и связаны с усиленной пролиферацией11. Исследования из нашей лаборатории показали, что длительное присутствие PAF в ацинарных культурах приводит к трансформации эпителиальных клеток молочной железы12. PAF активирует PAF-рецептор (PAFR), активируя сигнальную ось13 PI3K/Akt. Также сообщается, что PAFR связан с EMT, инвазией и метастазированием14.
Настоящий протокол демонстрирует модельную систему для изучения PAF-индуцированной трансформации с использованием 3D-культур эпителиальных клеток молочной железы, как было ранее описано Chakravarty et al.12. Эпителиальные клетки молочной железы, выращенные на внеклеточном матриксе (3D-культуры), имеют тенденцию образовывать поляризованные сфероиды, остановленные ростом. Они называются ацинами и очень напоминают ацины ткани молочной железы, наименьшую функциональную единицу молочной железы, in vivo15. Эти сфероиды (фиг.1А,В) состоят из монослоя плотно упакованных поляризованных эпителиальных клеток, окружающих полый просвет и прикрепленных к базальной мембране (фиг.1С). Этот процесс морфогенеза хорошо описан в литературе16. При посеве на lrECM клетки подвергаются делению и дифференцировке, образуя кластер клеток, которые затем поляризуются с 4-го дня. К 8-му дню ацины состоят из группы поляризованных клеток, которые находятся в прямом контакте с внеклеточным матриксом и скопления неполяризованных клеток, заключенных во внешние поляризованные клетки, без контакта с матрицей. Известно, что эти неполяризованные клетки подвергаются апоптозу на 12-й день культуры, образуя полый просвет. К 16-му дню формируется16 структур, остановленных ростом.
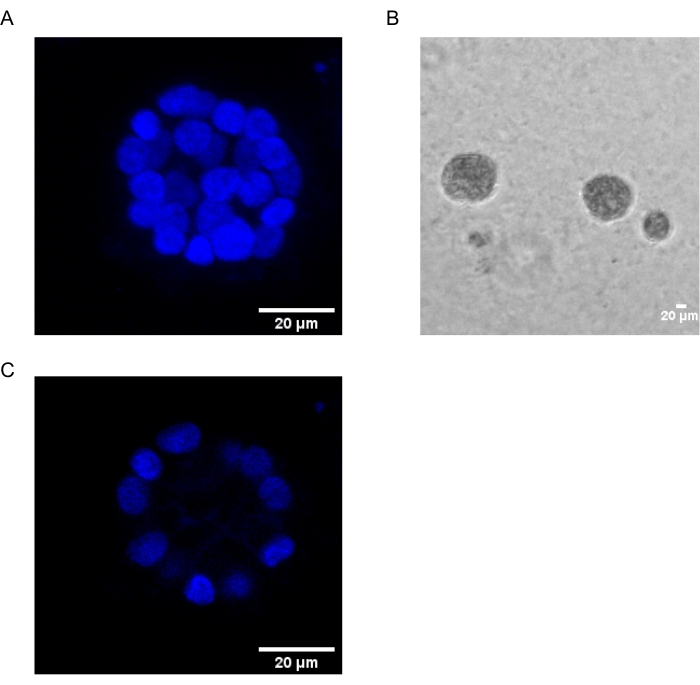
Рисунок 1: Ядра клеток в ацини, окрашенные ядерным пятном. (А) 3D конструкция ацини. (B) Фазоконтрастное изображение ацини MCF10A, выращенное на Matrigel в течение 20 дней. (C) Самая центральная секция показывает наличие полого просвета. Шкала = 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В отличие от 2D-культур, ацинарные культуры помогают различать нормальные и трансформированные клетки через очевидные изменения морфологии. Нетрансформированные эпителиальные клетки молочной железы образуют ацинус с полым просветом, имитируя нормальные ацины молочной железы человека. Эти сфероиды при трансформации показывают нарушенную морфологию, характеризующуюся значительной потерей полярности (одним из признаков рака), отсутствием просвета или нарушением полого просвета (из-за уклонения от апоптоза), что может быть вызвано дерегуляцией различных генов 17,18,19,20 . Эти превращения могут быть изучены с использованием широко используемых методов, таких как иммунофлуоресценция. Таким образом, модель 3D-культуры клеток может функционировать как простой метод исследования процесса ацинарного морфогенеза молочной железы и канцерогенеза молочной железы. Создание системы 3D-культур для понимания эффекта медиатора фосфолипидов, PAF, поможет в высокопроизводительном доклиническом скрининге лекарств.
Эта работа адаптировала протокол 3D «на вершине» культуры 16,21 для изучения трансформации, вызванной PAF22. Фенотипические изменения, вызванные воздействием ацинумов на медиатор фосфолипидов, изучали с использованием иммунофлуоресценции. В исследовании использовались различные маркеры полярности и эпителиального перехода в мезенхимальный переход (ЭМТ) 12,16. В таблице 1 упоминается их нормальная локализация и ожидаемый фенотип при трансформации.
| Антитела | Знаки | Нормальная локализация | Трансформированный фенотип |
| α6-Интегрин | Базолатераль | Базальный со слабым боковым пятном | Сильное боковое / апикальное пятно |
| β-Катенин | Клеточно-клеточный переход | Базолатераль | Аномальная / ядерная или цитоплазматическая локализация |
| Виментин | ЭМТ | Отсутствующее/слабое присутствие | Ап-регулирование |
Таблица 1: Маркеры, использованные в исследовании. Используются различные маркеры с их локализацией при наличии и отсутствии лечения ПАФ.
Этот метод может быть наилучшим образом использован для изучения / скрининга правдоподобных лекарств и генов-мишеней для различных подтипов рака молочной железы. Это может обеспечить данные о реакции на лекарства ближе к сценарию in vivo , помогая в более быстрой и надежной разработке лекарств. Также эта система может быть использована для изучения молекулярной сигнализации, связанной с лекарственной реакцией и лекарственной устойчивостью.
протокол
1. Посев клеток MCF10A в lrECM
- Поддерживать клетки MCF10A (адгезивные эпителиальные клетки молочной железы) в питательной среде. Проходите клетки каждые 4 дня.
ПРИМЕЧАНИЕ: Состав питательной среды: высокая глюкоза DMEM без пирувата натрия, содержащая конскую сыворотку (5%), инсулин (10 мкг/мл), гидрокортизон (0,5 мкг/мл), эпидермальный фактор роста, EGF (20 нг/мл), холерного токсина (100 нг/мл) и пенициллин-стрептомицин (100 ед/мл) (см. Таблицу материалов). - Оттаивание lrECM (см. Таблицу материалов) на льду за 20 мин до начала эксперимента. Днем посева клеток обычно считается День 0.
- Для трипсинизации клеток аспирируют среду и промывают 2 мл PBS. Добавьте 900 мкл 0,05% трипсина-ЭДТА и инкубируйте при 37 °C в течение ~ 15 мин или до полного трипсинизации клеток.
- Подготовьте слой lrECM в восьми колодцах камерного покровного стекла (см. Таблицу материалов).
- Когда клетки трипсинизируются, покройте каждую лунку 60 мкл lrECM и поместите ее в инкубатор CO2 с температурой 37 °C максимум на 15 минут.
- Подготовьте клеточную суспензию, выполнив следующие действия.
- После полного смещения клеток добавляют 5 мл среды повторной суспензии для подавления активности трипсина и вращают клетки при 112 х г в течение 10 мин при 25 °C.
ПРИМЕЧАНИЕ: Состав среды повторной суспензии: ДМЭМ с высоким содержанием глюкозы без пирувата натрия, дополненный конской сывороткой (20%) и пенициллин-стрептомицином (100 ЕД/мл). - Аспирировать отработанную среду и повторно суспендировать клетки в 2 мл пробирной среды. Хорошо перемешайте суспензию, чтобы обеспечить образование одноклеточной суспензии.
ПРИМЕЧАНИЕ: Состав исследуемой среды: высокий уровень глюкозы DMEM без пирувата натрия, дополненный конской сывороткой (2%), гидрокортизоном (0,5 мкг/мл), холерным токсином (100 нг/мл), инсулином (10 мкг/мл) и пенициллин-стрептомицином (100 ед/мл). - Подсчитайте клетки с помощью гемоцитометра и рассчитайте объем клеточной суспензии, необходимый для посева 6 х 103 клеток в каждую лунку.
ПРИМЕЧАНИЕ: Обычно предпочтительно включать в расчет одну дополнительную скважину для учета любых ошибок пипетирования. - В зависимости от количества необходимых лунок разбавляют клеточную суспензию в накладной среде.
ПРИМЕЧАНИЕ: Состав накладной среды для одной скважины выглядит следующим образом: 400 мкл пробирной среды, 8 мкл lrECM (2% финала) и 0,02 мкл 100 мкг/мл EGF (5 нг/мл финала).
- После полного смещения клеток добавляют 5 мл среды повторной суспензии для подавления активности трипсина и вращают клетки при 112 х г в течение 10 мин при 25 °C.
- Выполните посев клеток.
- Добавьте 400 мкл разбавленной клеточной суспензии к подготовленным слоям lrECM (этап 1.4), тщательно следя за тем, чтобы не нарушить слой lrECM. Инкубировать при 37 °C в увлажненном 5% CO2 инкубаторе.
2. Лечение PAF
- Добавляют PAF 3 ч после посева клеток. Подготовьте 100 мкМ запас PAF в PBS и добавьте необходимый объем 0,2 мкл в каждую скважину (что соответствует 200 нМ).
- Добавляйте одинаковую концентрацию PAF при каждом изменении мультимедиа.
3. Повторное кормление свежими носителями
- Пополняйте клетки свежей средой каждые 4 дня (т.е. День 4, День 8, День 12 и День 16).
4. Иммунофлуоресцентное исследование для выявления фенотипических изменений, вызванных длительным воздействием PAF
- После 20 дней культивирования тщательно вытрите среду из каждой скважины и промывайте скважины 400 мкл предварительно подогретой ПБС.
- Зафиксируйте ацинарные структуры, добавив 400 мкл 4% параформальдегида (свежеприготовленного путем разбавления 16% параформальдегида в 1x PBS) и инкубации в течение 20 мин при комнатной температуре.
- Промыть скважины один раз ледяным PBS и пермеабилизировать PBS, содержащим 0,5% Triton X-100 в течение 10 мин при 4 °C.
- Через 10 мин немедленно, но осторожно вылейте раствор Triton-X 100 и промойте 400 мкл PBS-глицина (свежеприготовленного путем добавления щепотки глицина в 1x PBS). Это повторяется трижды в течение 15 минут каждый.
- Добавьте 400 мкл первичного блокирующего раствора, содержащего 10% козью сыворотку (см. Таблицу материалов) в буфер иммунофлуоресценции (ИФ) и инкубируйте при комнатной температуре в течение 60 мин.
ПРИМЕЧАНИЕ: Состав буфера ПЧ: 0,05% азида натрия, 0,1% BSA, 0,2% Triton-X 100 и 0,05% Tween (20 в 1 PBS). - Удаляют первичный блокирующий раствор, добавляют 200 мкл 2% вторичного блокирующего антитела (F(ab')2 фрагмента антитела, выращенного у козы против мышиного антигена, см. Таблицу материалов), приготовленного в первичном блокирующем растворе, и оставляют его на 45-60 мин при комнатной температуре.
- Получают первичное антитело (см. Таблицу материалов) в 2% растворе вторичного блокирующего антитела в разведении 1:100. После удаления вторичного блокирующего раствора добавляют свежеприготовленное антитело и инкубируют в течение ночи при 4 °C.
- Предыдущая стадия может вызвать сжижение базальной мембраны. Прежде чем приступить к эксперименту, подождите, пока слайд не достигнет комнатной температуры. Осторожно пипетку раствора первичного антитела и трижды промыть его 400 мкл буфера ПЧ.
- Во время последней промывки буфером ПЧ готовят разведение флуорофорно-конъюгированного вторичного антитела (см. Таблицу материалов) в первичном блокирующем растворе в 1:200. Инкубируют слайды во вторичном растворе антител в течение 40-60 мин при комнатной температуре.
- Промойте слайды 400 мкл буфера ПЧ в течение 20 минут, затем две промывки PBS в течение 10 минут каждая.
- Противопоставлять ядра ПБС, содержащим 0,5 нг/мл ядерного пятна (см. Таблицу материалов) в течение 5-6 мин при комнатной температуре. Трижды вымойте слайды 400 мкл PBS, чтобы удалить лишние пятна.
- Аккуратно выложите всю PBS и обеспечьте удаление остаточного раствора. Добавьте одну каплю монтажного реагента (см. Таблицу материалов) в каждую лунку и дайте ей постоять при комнатной температуре в течение ночи.
- Храните слайды при комнатной температуре и изображения слайдов как можно скорее.
- Изображение под 40-кратным или 63-кратным увеличением на конфокальном микроскопе (см. Таблицу материалов), с получением оптических Z-сечений шагом 0,6 мм (NA = 1,4).
- Откройте полученные изображения с помощью программного обеспечения для обработки изображений (см. Таблицу материалов). Продемонстрируйте морфологические различия с помощью 3D-проекций.
ПРИМЕЧАНИЕ: Самое центральное оптическое Z-сечение лучше всего использовать для отображения различий в локализации маркеров полярности. Они могут быть количественно определены вручную, чтобы представить процент сфероидов, показывающих этот конкретный рисунок окрашивания. - Чтобы проиллюстрировать различия в экспрессии белков, выполните полуколичественный анализ, измеряя среднее значение серого цвета или вычисляя скорректированную общую флуоресценцию клеток (CTCF)23. Представьте данные в виде скрипичных или точечных графиков.
Результаты
Клетки MCF10A при воздействии лечения PAF образуют ацинарные структуры с очень отчетливыми фенотипами. Было обнаружено, что α6-интегрин неправильно локализован с более апикальным окрашиванием. Некоторые ацины также показали прерывистое окрашивание (рисунок 2А). Оба этих фенотипа указывают на потерю базальной полярности, о чем свидетельствует литература 24,25. Более ранние сообщения указывают на спорную роль α6-интегрина в метастазировании рака. α6-интегрин присутствует в виде димера с β1- или β4-интегрином. Было обнаружено, что субъединица α6β4 играет значительную роль в формировании гемидемосом в эпителиальных клетках26. Снижение регуляции этого интегрина было обнаружено в простате и некоторых случаях рака молочной железы, при этом потеря α6β4-интегрина была обнаружена при протоковой карциноме молочной железы (степень III). Фенотип потери наблюдается в клетках, которые метастазируют в паренхиму и плевральную полость 27,28,29. GM130 представляет собой цис-гольджи локализованный белок; Тела Гольджи апически локализованы в ацинарных культурах MCF10A16,30. Лечение PAF привело к неправильной локализации GM130, что свидетельствует о нарушении апикальной полярности (рисунок 2B). Виментин является промежуточной нитью, которая участвует в миграции клеток; он повышается, когда эпителиальные клетки подвергаются эпителиальному переходу в мезенхимальный переход (EMT)31. Обработка PAF ацинарными культурами MCF10A привела к повышению уровня виментина, что наблюдается по интенсивности окрашивания (рисунок 2C), предполагая EMT.

Рисунок 2: PAF нарушает полярность и индуцирует EMT-подобные изменения в MCF10A ацинусах молочной железы. Клетки MCF10A были выращены как 3D -топовые» культуры в lrECM. Культуры лечились PAF в день 0, 4, 8, 12 и 16. Культуры выдерживали в течение 20 дней, а затем иммуноокрашивали для α6-интегрина (зеленый) и ядерного пятна (синий) (A), (B) GM130 (зеленый), маркера апикальной полярности, и (C) виментина (красный), маркера EMT. Показан самый центральный стек соответствующих ацини. Репрезентативные данные относятся к 40-50 ацини из трех биологически независимых экспериментов. Шкала = 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Установленные модели на основе клеточных линий широко используются для изучения процесса канцерогенеза. Однослойные культуры клеток продолжают давать представление о различных молекулярных сигнальных путях, которые опосредуют характерные изменения в раковых клетках32. Исследования роли хорошо известных онкогенов, таких как Ras, Myc и мутированный p53, были впервые зарегистрированы с использованием однослойных культур в качестве модельной системы 33,34,35,36. Однако в модели 2D-культуры отсутствует множество важных структурных и функциональных параметров, присутствующих in vivo. Исследования скрининга лекарств в 2D-культурах часто показывают значительный ответ (гибель клеток или ингибирование мишени) даже при более низких концентрациях, в то же время не показывая какого-либо значительного эффекта при применении у мышей37. Основной причиной этого является различная доступность и поглощение лекарств в 2D-монослойной культуре. 3D культура38.
Концепция 3D-культур появилась как мощный инструмент для изучения прогрессирования рака в последнее десятилетие. 3D-культуры включают растущие клетки на внеклеточном матриксе, что приводит к образованию структур, напоминающих функциональные единицы, присутствующие в ткани in vivo16. 3D-культуры в значительной степени имитируют микросреду in vivo и, таким образом, преодолевают ограничения 2D-культур39. Более того, поскольку клетки, выращенные в 3D, имеют человеческое происхождение и система более поддается изучению ранних событий, она проще и элегантнее, чем модели грызунов.
С помощью этой платформы демонстрируется модель для изучения процесса трансформации после воздействия фосфолипидного медиатора, такого как PAF. Исследования, проведенные в нашей лаборатории, показали, что лечение PAF может трансформировать неопухолевую линию эпителиальных клеток молочной железы, MCF10A12. Этот метод оптимизирован для непрерывного воздействия НА клетки PAF, аналогично сценарию in vivo , где PAF присутствует в микросреде.
Клетки MCF10A, выращенные в 2D, должны проходить каждые 4 дня. Если они не поддерживаются в соответствии с протоколом, они ведут себя очень по-разному, что видно только при выращивании на ECM16. Количество проходов клеток должно быть как можно ниже. Этот метод также имеет ограничения из-за изменения концентрации белка в разных партиях lrECM. Это можно преодолеть, проверив различные партии, просто покрыв ячейки на ложе lrECM и наблюдая за распределением по размерам ациний. Если нет большой изменчивости в размерах, пакет lrECM можно считать подходящим для экспериментов.
Оценка трансформации обычно производится иммунофлуоресценцией, что демонстрируется на видео. При выполнении иммунофлуоресценции этапы, включающие инкубацию при 4 °C, имеют решающее значение; пипетка раствора, когда слой lrECM находится в жидком состоянии, делает слой неравномерным, что приводит к потере ацинарных структур. Одним из способов решения проблемы неравномерности является хранение слайдов при 4 °C на ровной платформе в течение ночи или изменение увеличения, при котором выполняется визуализация. Чтобы избежать пипетки ацинарных конструкций, осторожно извлеките камеру из хранилища при температуре 4 °C и удалите три четверти добавленного объема, а затем выньте остальное во время последующих промывок.
Еще одной серьезной проблемой, с которой мы сталкиваемся, является высокий фон из-за lrECM. Для преодоления этой проблемы можно использовать 2% вторичное блокирующее антитело вместо 1%. Однако увеличение вторичной блокировки не служит цели окрашивания апикальных маркеров и E-кадгерина. В таких случаях желательно подвергнуть стекло крышки камеры после 20-го дня PBS-EDTA в течение 15 мин при 4 °C, а затем зафиксировать ацину по тому же протоколу, как показано на видео. PBS-EDTA частично растворяет lrECM, тем самым уменьшая фон. Однако, если время инкубации превышено, эта обработка может привести к потере структур при пипетке раствора. Следовательно, при проведении этой процедуры необходимо проявлять максимальную осторожность. Также было замечено, что хранение слайдов в течение более длительных периодов времени может привести к увеличению фонового сигнала. Поэтому визуализация должна быть сделана как можно скорее. Желательно визуализировать не менее 15 ацин за эксперимент, чтобы определить изменение фенотипа.
3D-ацинарные культуры имеют определенные ограничения, такие как трудности в отслеживании отдельных клеток во время визуализации живых клеток. Некоторые исследования, такие как влияние на клеточный цикл, должны проводиться с использованием визуализации живых клеток для поддержания пространственной и временной информации. Однако из-за постоянных изменений структуры трудно отследить такие параметры в 3D ацинарных культурах с помощью обычных конфокальных микроскопов. Это требует использования передовых микроскопических методов, таких как микроскопия сверхвысокого разрешения или микроскопия Airyscan. Это также потребует смещения ацинарных структур для определенных анализов трансформации, таких как заживление ран, независимый от анкориджа рост и анализы опухолегенности in vivo . Это смещение приведет к потере важной пространственной и временной информации. Белковые лизаты, собранные из культур, часто разбавляются из-за присутствия IrECM, что создает проблемы с загрузкой достаточного количества лизатов. Однако это можно преодолеть в большей степени, вытеснив ацинальные структуры и собрав их перед лизисом.
Здесь была продемонстрирована модельная система для изучения фосфолипидного медиатора / иммуно-ассоциированной фактор-индуцированной трансформации. Эта модель может прояснить генетический и / или эпигенетический путь (пути), которые могут быть дерегулированы, что приводит к резким изменениям в морфологии. Этот метод также может быть использован для скрининга потенциальных терапевтических средств. Такие исследования скрининга лекарств обеспечат больший успех, чем скрининги, проведенные в 2D культурах38. Основным моментом этого метода является адаптивность в соответствии с требованиями исследования. Схема лечения и методы анализа могут быть изменены по мере необходимости. Кроме того, этот метод может дать представление о молекулярной сигнализации, затронутой при лечении40. Методика также поможет предсказать возможное возникновение лекарственной устойчивости. Кроме того, это также поможет прояснить механизм, участвующий в лекарственной устойчивости, и определить правдоподобные цели для ее преодоления. Исследования установили возможности совместного культивирования нескольких типов клеток в 3D, которые могут быть дополнительно модифицированы для адаптации к схеме лечения41. Такие возможности обеспечат более глубокое понимание характеристик и молекулярных изменений, которые происходят in vivo во время инициации и прогрессирования рака молочной железы.
Раскрытие информации
Авторы заявляют об отсутствии потенциальных конфликтов интересов.
Благодарности
Мы благодарим Центр микроскопии IISER в Пуне за доступ к оборудованию и инфраструктуре и поддержку экспериментов. Это исследование было поддержано грантом Департамента биотехнологии (DBT), правительства Индии (BT/PR8699/MED/30/1018/2013), Совета по научным и инженерным исследованиям (SERB), правительства Индии (EMR/2016/001974) и частично финансированием IISER, Pune Core. A.K. финансировался стипендией CSIR-SRF, L.A. финансировался через стипендию DST-INSPIRE, V.C финансировался DBT (BT/PR8699/MED/30/1018/2013).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Ссылки
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены