Method Article
وسيط الفوسفوليبيد الناجم عن التحول في الثقافات ثلاثية الأبعاد
In This Article
Summary
يصف البروتوكول الحالي إنشاء ثقافات ثلاثية الأبعاد "على القمة " لخط الخلايا الظهارية غير المتحولة للثدي ، MCF10A ، الذي تم تعديله لدراسة التحول الناجم عن عامل تنشيط الصفائح الدموية (PAF). تم استخدام التألق المناعي لتقييم التحول ويتم مناقشته بالتفصيل.
Abstract
تم تطوير العديد من النماذج لدراسة السرطان ، مثل نماذج القوارض وخطوط الخلايا الثابتة. تم توفير رؤى قيمة حول التسرطن من خلال الدراسات التي تستخدم هذه النماذج. وقد وفرت خطوط الخلايا فهما لإزالة القيود التنظيمية من الإشارات الجزيئية المرتبطة بتكوين أورام الثدي، في حين تستخدم نماذج القوارض على نطاق واسع لدراسة الخصائص الخلوية والجزيئية لسرطان الثدي في الجسم الحي. إنشاء ثقافات 3D من الخلايا الظهارية والسرطانية الثدي يساعد في سد الفجوة بين في الجسم الحي والنماذج في المختبر من خلال محاكاة الظروف في الجسم الحي في المختبر. يمكن استخدام هذا النموذج لفهم تحرير أحداث الإشارات الجزيئية المعقدة والخصائص الخلوية أثناء تسرطن الثدي. هنا ، يتم تعديل نظام ثقافة 3D لدراسة التحول الناجم عن وسيط الدهون الفوسفاتية (عامل تنشيط الصفائح الدموية ، PAF). تلعب أجهزة المناعة والجزيئات المفرزة الأخرى دورا رئيسيا في بدء الورم وتقدمه في الثدي. في هذه الدراسة ، تتعرض ثقافات 3D acinar للخلايا الظهارية للثدي لخصائص التحول PAF المعروضة مثل فقدان القطبية والخصائص الخلوية المتغيرة. سيساعد نظام زراعة 3D هذا في إلقاء الضوء على الاضطرابات الجينية و / أو اللاجينية التي تسببها مختلف كيانات الجزيئات الصغيرة في البيئة الدقيقة للورم. بالإضافة إلى ذلك ، سيوفر هذا النظام أيضا منصة لتحديد الجينات الجديدة والمعروفة التي قد تشارك في عملية التحول.
Introduction
يتوفر عدد لا يحصى من النماذج لدراسة تطور السرطان ، كل منها فريد من نوعه ويمثل نوعا فرعيا من هذا المرض المعقد. يوفر كل نموذج رؤى فريدة وقيمة في بيولوجيا السرطان وقد حسن الوسائل لمحاكاة حالة المرض الفعلية. قدمت خطوط الخلايا الراسخة التي نمت كطبقة أحادية رؤى قيمة في العمليات الحيوية في المختبر ، مثل الانتشار والغزو والهجرة وموت الخلايا المبرمج1. على الرغم من أن زراعة الخلايا ثنائية الأبعاد (2D) كانت الأداة التقليدية للتحقيق في استجابة خلايا الثدييات للعديد من الاضطرابات البيئية ، إلا أن استقراء هذه النتائج للتنبؤ بالاستجابات على مستوى الأنسجة لا يبدو مقنعا بما فيه الكفاية. القيد الرئيسي للثقافات ثنائية الأبعاد هو أن البيئة الدقيقة التي تم إنشاؤها تختلف إلى حد كبير عن تلك الموجودة في أنسجة الثدي نفسها2. تفتقر ثقافة 2D إلى تفاعل الخلايا مع المصفوفة خارج الخلية ، وهو أمر حيوي لنمو أي أنسجة. أيضا ، فإن قوى الشد التي تعاني منها الخلية في مزارع الطبقة الأحادية تعيق قطبية هذه الخلايا ، وبالتالي تغير إشارات الخلية وسلوكها3،4،5. فتحت أنظمة الاستزراع ثلاثية الأبعاد (3D) طريقا جديدا في مجال أبحاث السرطان مع قدرتها على محاكاة الظروف في الجسم الحي في المختبر. يمكن إعادة إنشاء العديد من الإشارات البيئية الدقيقة الحاسمة التي تضيع في زراعة الخلايا ثنائية الأبعاد باستخدام ثقافات ثلاثية الأبعاد من المصفوفة خارج الخلية الغنية باللامينين (lrECM)6.
حددت دراسات مختلفة أهمية البيئة الدقيقة للورم في التسرطن 7,8. العوامل المرتبطة بالالتهاب هي جزء رئيسي من البيئة الدقيقة. عامل تنشيط الصفائح الدموية (PAF) هو وسيط فوسفوليبيد تفرزه خلايا مناعية مختلفة تتوسط استجابات مناعية متعددة 9,10. يتم إفراز مستويات عالية من PAF بواسطة خطوط خلايا سرطان الثدي المختلفة وترتبط بالانتشار المعزز11. أظهرت الدراسات التي أجريت في مختبرنا أن الوجود المطول ل PAF في الثقافات الأسينارية يؤدي إلى تحول الخلايا الظهارية للثدي12. يقوم PAF بتنشيط مستقبل PAF (PAFR) ، وتنشيط محور الإشارة PI3K / Akt13. وتفيد التقارير أيضا أن PAFR مرتبط ب EMT والغزو والانبثاث14.
يوضح هذا البروتوكول نظاما نموذجيا لدراسة التحول الناجم عن PAF ، باستخدام ثقافات ثلاثية الأبعاد للخلايا الظهارية للثدي ، كما وصفها سابقا Chakravarty et al.12. تميل الخلايا الظهارية للثدي التي تنمو على المصفوفة خارج الخلية (ثقافات 3D) إلى تشكيل كرويات مستقطبة توقف النمو. وتسمى هذه الأسيني وتشبه إلى حد كبير الأسيني من أنسجة الثدي ، أصغر وحدة وظيفية في الغدة الثديية ، في الجسم الحي15. تتكون هذه الكرويات (الشكل 1A ، B) من طبقة واحدة من الخلايا الظهارية المستقطبة المعبأة بشكل وثيق حول تجويف مجوف ومتصلة بالغشاء السفلي (الشكل 1C). تم وصف عملية التشكل هذه بشكل جيد في الأدب16. عند زرعها على lrECM ، تخضع الخلايا للانقسام والتمايز لتشكيل مجموعة من الخلايا ، والتي تستقطب بعد ذلك من اليوم 4 فصاعدا. بحلول اليوم 8 ، يتكون الأسيني من مجموعة من الخلايا المستقطبة التي تكون على اتصال مباشر مع المصفوفة خارج الخلية ومجموعة من الخلايا غير المستقطبة المغلقة داخل الخلايا المستقطبة الخارجية ، مع عدم وجود اتصال بالمصفوفة . من المعروف أن هذه الخلايا غير المستقطبة تخضع لموت الخلايا المبرمج بحلول اليوم 12 من الثقافة ، مما يشكل تجويفا مجوفا. بحلول اليوم 16 ، يتم تشكيل الهياكل المتوقفة عن النمو16.
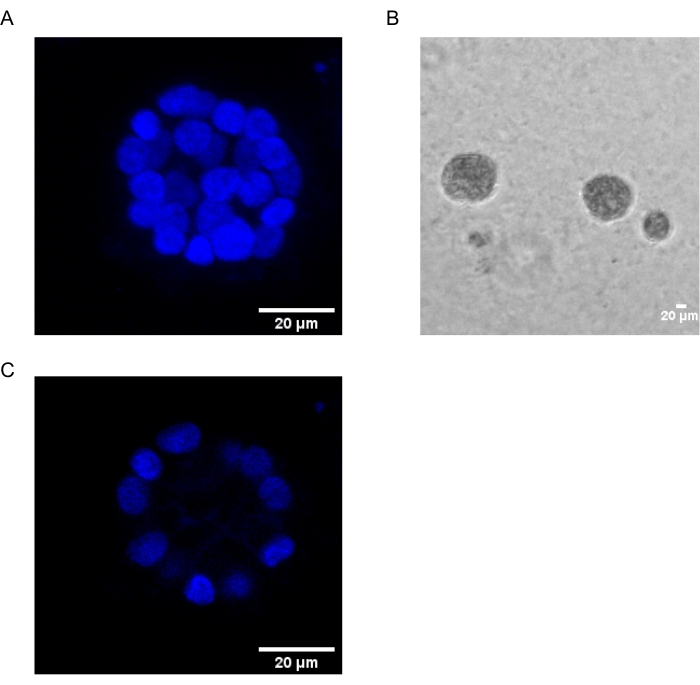
الشكل 1: نوى الخلايا في الأسيني الملطخة ببقعة نووية . (A) بناء 3D من الأسيني. (ب) صورة تباين الطور ل MCF10A acini المزروعة في Matrigel لمدة 20 يوما. (ج) يظهر القسم الأوسط وجود تجويف مجوف. شريط المقياس = 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
على عكس ثقافات 2D ، تساعد ثقافات acinar في تمييز الخلايا الطبيعية والمحولة من خلال التغيرات المورفولوجية الواضحة. تشكل الخلايا الظهارية غير المتحولة في الثدي الأسيني مع تجويف مجوف ، يحاكي أسيني الثدي البشري الطبيعي. تظهر هذه الكرويات ، عند التحول ، مورفولوجيا معطلة تتميز بفقدان كبير للقطبية (واحدة من السمات المميزة للسرطان) ، أو عدم وجود تجويف ، أو اضطراب في التجويف المجوف (بسبب التهرب من موت الخلايا المبرمج) الذي قد يحدث بسبب تحرير الجينات المختلفة17،18،19،20 . يمكن دراسة هذه التحولات باستخدام تقنيات شائعة الاستخدام مثل التألق المناعي. وبالتالي ، يمكن أن يعمل نموذج زراعة الخلايا 3D كطريقة بسيطة للتحقيق في عملية تكوين الثدي وسرطان الثدي. إن إنشاء نظام ثقافة 3D لفهم تأثير وسيط الدهون الفوسفاتية ، PAF ، سيساعد في فحص الأدوية قبل السريرية عالي الإنتاجية.
قام هذا العمل بتكييف بروتوكول الثقافة ثلاثية الأبعاد "على القمة"16,21 لدراسة التحول الناجم عن PAF 22. تمت دراسة التغيرات المظهرية الناجمة عن تعرض الأسيني لوسيط الدهون الفوسفاتية باستخدام التألق المناعي. تم استخدام العديد من علامات القطبية والظهارية إلى الانتقال الوسيط (EMT) 12,16 في الدراسة. ويذكر الجدول 1 توطينها الطبيعي ونمطها الظاهري المتوقع عند التحول.
| الاجسام المضاده | علامات | التوطين العادي | النمط الظاهري المحول |
| α6-إنتيغرين | القاعدية | القاعدية مع وصمة عار جانبية ضعيفة | وصمة عار جانبية / قمية قوية |
| β كاتينين | تقاطع الخلية والخلية | القاعدية | توطين غير طبيعي / نووي أو سيتوبلازمي |
| فيمنتين | EMT | غياب / ضعف الحضور | التنظيم المرتفع |
الجدول 1: العلامات المستخدمة في الدراسة. علامات مختلفة تستخدم مع توطينها في وجود وغياب علاج PAF.
يمكن استخدام هذه الطريقة بشكل أفضل لدراسة / فحص الأدوية المعقولة والجينات المستهدفة لمختلف الأنواع الفرعية لسرطان الثدي. وهذا يمكن أن يوفر بيانات استجابة للأدوية أقرب إلى سيناريو في الجسم الحي ، مما يساعد في تطوير الأدوية بشكل أسرع وأكثر موثوقية. أيضا ، يمكن استخدام هذا النظام لدراسة الإشارات الجزيئية المرتبطة بالاستجابة للأدوية ومقاومة الأدوية.
Protocol
1. بذر خلايا MCF10A في lrECM
- الحفاظ على خلايا MCF10A (الخلايا الظهارية الملتصقة بالثدي) في وسط النمو. مرور الخلايا كل 4 أيام.
ملاحظة: تكوين وسط النمو: DMEM عالي الجلوكوز بدون بيروفات الصوديوم التي تحتوي على مصل الحصان (5٪) ، الأنسولين (10 ميكروغرام / مل) ، الهيدروكورتيزون (0.5 ميكروغرام / مل) ، عامل نمو البشرة ، EGF (20 نانوغرام / مل) ، من توكسين الكوليرا (100 نانوغرام / مل) ، والبنسلين - الستربتومايسين (100 وحدة / مل) (انظر جدول المواد). - إذابة lrECM (انظر جدول المواد) على الجليد قبل 20 دقيقة من بدء التجربة. يعتبر يوم بذر الخلايا عموما اليوم 0.
- لتريبسين الخلايا ، استنشق الوسط ، واغسله ب 2 مل من PBS. أضف 900 ميكرولتر من 0.05٪ Trypsin-EDTA واحتضنها عند 37 درجة مئوية لمدة 15 دقيقة تقريبا أو حتى يتم تربسين الخلايا بالكامل.
- قم بإعداد سرير من lrECM في ثمانية آبار من شريحة زجاجية مغطاة بغرف (انظر جدول المواد).
- عندما تكون الخلايا مجربة ، قم بتغطية كل بئر ب 60 ميكرولتر من lrECM وضعه في حاضنة CO2 37 درجة مئوية لمدة أقصاها 15 دقيقة.
- قم بإعداد تعليق الخلية باتباع الخطوات أدناه.
- بعد الإزاحة الكاملة للخلايا، أضف 5 مل من وسط إعادة التعليق لإخماد نشاط التربسين وقم بتدوير الخلايا عند 112 × جم لمدة 10 دقائق عند 25 درجة مئوية.
ملاحظة: تكوين وسط إعادة التعليق: ارتفاع نسبة الجلوكوز DMEM بدون بيروفات الصوديوم ، مع استكمال مصل الحصان (20 ٪) والبنسلين الستربتومايسين (100 وحدة / مل). - استنشاق الوسط المستنفد وإعادة تعليق الخلايا في 2 مل من وسط الفحص. امزج التعليق جيدا لضمان تكوين تعليق خلية واحدة.
ملاحظة: تكوين متوسط المقايسة: ارتفاع الجلوكوز DMEM بدون بيروفات الصوديوم ، مع استكمال مصل الحصان (2 ٪) ، هيدروكورتيزون (0.5 ميكروغرام / مل) ، توكسين الكوليرا (100 نانوغرام / مل) ، الأنسولين (10 ميكروغرام / مل) ، والبنسلين الستربتومايسين (100 وحدة / مل). - عد الخلايا باستخدام مقياس الدم واحسب حجم تعليق الخلايا اللازم لزرع 6 × 103 خلايا في كل بئر.
ملاحظة: يفضل عموما تضمين بئر إضافي واحد في الحساب لحساب أي أخطاء في السحب. - وفقا لعدد الآبار المطلوبة ، قم بتخفيف تعليق الخلية في وسط تراكب.
ملاحظة: تكوين متوسط التراكب لبئر واحد هو كما يلي: 400 ميكرولتر من وسط المقايسة ، و 8 ميكرولتر من lrECM (2٪ نهائي) ، و 0.02 ميكرولتر من 100 ميكروغرام / مل من EGF (5 نانوغرام / مل نهائي).
- بعد الإزاحة الكاملة للخلايا، أضف 5 مل من وسط إعادة التعليق لإخماد نشاط التربسين وقم بتدوير الخلايا عند 112 × جم لمدة 10 دقائق عند 25 درجة مئوية.
- أداء البذر من الخلايا.
- أضف 400 ميكرولتر من تعليق الخلايا المخفف إلى أسرة lrECM المعدة (الخطوة 1.4) ، مع ضمان عدم إزعاج سرير lrECM بعناية. احتضان في 37 درجة مئوية في حاضنة 5٪ CO2 رطبة.
2. علاج PAF
- أضف PAF 3 h بعد بذر الخلايا. قم بإعداد مخزون 100 ميكرومتر من PAF في PBS وأضف الحجم المطلوب البالغ 0.2 ميكرولتر في كل بئر (والذي يتوافق مع 200 نانومتر).
- أضف نفس تركيز PAF أثناء كل تغيير في الوسائط.
3. إعادة التغذية بوسائط جديدة
- قم بتجديد الخلايا بوسط طازج كل 4 أيام (أي اليوم 4 واليوم 8 واليوم 12 واليوم 16).
4. دراسة التألق المناعي للكشف عن التغيرات المظهرية الناجمة عن التعرض المطول ل PAF
- بعد 20 يوما من الزراعة ، قم بإخراج الوسط بعناية من كل بئر وغسل الآبار ب 400 ميكرولتر من PBS المسخن مسبقا.
- إصلاح الهياكل acinar عن طريق إضافة 400 ميكرولتر من 4 ٪ paraformaldehyde (أعدت طازجة عن طريق تخفيف 16 ٪ paraformaldehyde في 1x PBS) والحضانة لمدة 20 دقيقة في درجة حرارة الغرفة.
- شطف الآبار مرة واحدة مع PBS الباردة الجليد وتتخلل مع PBS تحتوي على 0.5٪ Triton X-100 لمدة 10 دقائق عند 4 درجات مئوية.
- بعد 10 دقائق ، قم على الفور ولكن بعناية بإخراج محلول Triton-X 100 وشطفه ب 400 ميكرولتر من PBS-glycine (يتم إعداده طازجا عن طريق إضافة قليل من الجلايسين في 1x PBS). يتكرر هذا ثلاث مرات لمدة 15 دقيقة لكل منهما.
- أضف 400 ميكرولتر من محلول الحجب الأولي الذي يتكون من مصل الماعز بنسبة 10٪ (انظر جدول المواد) في مخزن مؤقت للتألق المناعي (IF) واحتضنه في درجة حرارة الغرفة لمدة 60 دقيقة.
ملاحظة: تكوين المخزن المؤقت IF: 0.05٪ أزيد الصوديوم ، 0.1٪ BSA ، 0.2٪ Triton-X 100 ، و 0.05٪ Tween (20 في 1 PBS). - قم بإزالة محلول الحجب الأولي ، وأضف 200 ميكرولتر من 2٪ من الجسم المضاد المانع الثانوي (F (ab')2 من الجسم المضاد المرفوع في الماعز ضد مستضد الماوس ، انظر جدول المواد) المحضر في محلول الحجب الأولي ، واتركه لمدة 45-60 دقيقة في درجة حرارة الغرفة.
- تحضير الجسم المضاد الأولي (انظر جدول المواد) في محلول الأجسام المضادة المانع الثانوي بنسبة 2٪ في تخفيف 1:100. بعد إزالة محلول الحجب الثانوي ، أضف الجسم المضاد المحضر حديثا واحتضنه طوال الليل عند 4 درجات مئوية.
- الخطوة السابقة قد تثير تسييل الغشاء السفلي. قبل متابعة التجربة ، انتظر حتى تصل الشريحة إلى درجة حرارة الغرفة. ماصة بعناية محلول الأجسام المضادة الأساسي وغسله ثلاث مرات مع 400 ميكرولتر من المخزن المؤقت IF.
- أثناء الغسيل الأخير باستخدام المخزن المؤقت IF ، قم بإعداد تخفيف بنسبة 1:200 للجسم المضاد الثانوي المترافق مع الفلوروفور (انظر جدول المواد) في محلول الحجب الأساسي. احتضان الشرائح في محلول الأجسام المضادة الثانوي لمدة 40-60 دقيقة في درجة حرارة الغرفة.
- اشطف الشرائح باستخدام 400 ميكرولتر من المخزن المؤقت IF لمدة 20 دقيقة ، متبوعا بغسالتين باستخدام PBS لمدة 10 دقائق لكل منهما.
- قم بمعالجة البقع باستخدام PBS التي تحتوي على 0.5 نانوغرام / مل من البقع النووية (انظر جدول المواد) لمدة 5-6 دقائق في درجة حرارة الغرفة. اغسل الشرائح ثلاث مرات باستخدام 400 ميكرولتر من PBS لإزالة البقع الزائدة.
- قم بإخراج PBS بالكامل بعناية وتأكد من إزالة المحلول المتبقي. أضف قطرة واحدة من كاشف التركيب (انظر جدول المواد) في كل بئر واتركه يقف في درجة حرارة الغرفة طوال الليل.
- قم بتخزين الشرائح في درجة حرارة الغرفة وصور الشرائح في أقرب وقت ممكن.
- صورة تحت التكبير 40x أو 63x على مجهر متحد البؤرة (انظر جدول المواد)، مع أخذ مقاطع Z بصرية بحجم خطوة 0.6 مم (NA = 1.4).
- افتح الصور التي تم الحصول عليها باستخدام برنامج معالجة الصور (انظر جدول المواد). إظهار الاختلافات المورفولوجية باستخدام إسقاطات 3D.
ملاحظة: يمكن استخدام المقطع Z البصري في أقصى الوسط لإظهار الاختلافات في توطين علامات القطبية. يمكن قياسها كميا يدويا لتمثيل النسبة المئوية للكرويات التي تظهر نمط التلطيخ المحدد. - لتوضيح الاختلافات في التعبير عن البروتينات، قم بإجراء تحليل شبه كمي يقيس متوسط القيمة الرمادية أو حساب التألق الكلي للخلايا المصححة (CTCF)23. تمثيل البيانات كقطع كمان أو نقاط.
النتائج
خلايا MCF10A ، عند التعرض لعلاج PAF ، تشكل هياكل أسينار ذات أنماط ظاهرية متميزة للغاية. تم العثور على α6-integrin ليكون موضعيا بشكل خاطئ مع تلطيخ أكثر قمي. كما أظهر عدد قليل من الأسيني تلطيخا متقطعا (الشكل 2 أ). يشير كل من هذين النوعين الظاهريين إلى فقدان القطبية القاعدية ، كما يتضح من الأدبيات24,25. تشير التقارير السابقة إلى الدور المثير للجدل ل α6-integrin في ورم خبيث سرطاني. α6-integrin موجود كخافت مع إما β1- أو β4-integrin. تم العثور على الوحدة الفرعية α6β4 للعب دورا هاما في تشكيل الهيمديسموسوسومات في الخلايا الظهارية26. تم العثور على انخفاض تنظيم هذا الإنتغرين في البروستاتا وبعض حالات سرطان الثدي ، حيث تم العثور على فقدان α6β4-integrin في سرطان القنوات في الثدي (الصف الثالث). وينظر إلى النمط الظاهري المفقود في الخلايا التي تنتقل إلى الحمة والتجويف الجنبي27،28،29. GM130 هو بروتين موضعي من CIS-Golgi. يتم توطين أجسام Golgi بشكل قمي في ثقافات MCF10A acinar16,30. أدى علاج PAF إلى سوء توطين GM130 ، مما يشير إلى اضطراب القطبية القمية (الشكل 2B). Vimentin هو خيوط وسيطة تشارك في هجرة الخلايا. يتم تنظيمه عندما تخضع الخلايا الظهارية للانتقال الظهاري إلى الوسيط (EMT)31. أدت معالجة PAF لمزارع الأسينار MCF10A إلى ارتفاع مستويات الفيمنتين كما لوحظ من شدة التلطيخ (الشكل 2C) ، مما يشير إلى EMT.

الشكل 2: يعطل PAF القطبية ويحفز التغيرات الشبيهة ب EMT في أسيني الثدي MCF10A. نمت خلايا MCF10A كثقافات ثلاثية الأبعاد "على القمة" في lrECM. تم التعامل مع الثقافات مع PAF في اليوم 0 و 4 و 8 و 12 و 16. تم الحفاظ على الثقافات لمدة 20 يوما ثم تم تلطيخ المناعة ل α6-integrin (الأخضر) والبقع النووية (الأزرق) (A) ، (B) GM130 (الأخضر) ، وهي علامة على القطبية القمية ، و (C) Vimentin (الأحمر) ، علامة EMT. تم عرض المكدس المركزي لل acini المعني. البيانات التمثيلية هي ل 40-50 acini من ثلاث تجارب مستقلة بيولوجيا. شريط المقياس = 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تستخدم النماذج القائمة على خط الخلايا على نطاق واسع لدراسة عملية التسرطن. تستمر مزارع الخلايا أحادية الطبقة في تقديم رؤى ثاقبة حول مسارات الإشارات الجزيئية المختلفة التي تتوسط التغيرات المميزة في الخلايا السرطانية32. تم الإبلاغ لأول مرة عن دراسات حول دور الجينات السرطانية المعروفة مثل Ras و Myc و p53 المتحورة باستخدام ثقافات أحادية الطبقة كنظام نموذجي 33,34,35,36. ومع ذلك ، يفتقر نموذج ثقافة 2D إلى الكثير من المعلمات الهيكلية والوظيفية المهمة الموجودة في الجسم الحي. غالبا ما تظهر دراسات فحص الأدوية في ثقافات 2D استجابة كبيرة (موت الخلايا أو تثبيط الهدف) ، حتى عند تركيزات أقل ، بينما تفشل في إظهار أي تأثير كبير عند الإعجاب في الفئران37. أحد الأسباب الرئيسية لذلك هو تباين توافر الأدوية وامتصاصها في ثقافة أحادية الطبقة 2D مقابل. ثقافة 3D38.
وقد برز مفهوم الثقافات 3D كأداة قوية لدراسة تطور السرطان في العقد الماضي. تتضمن الثقافات ثلاثية الأبعاد خلايا متنامية على مصفوفة خارج الخلية ، مما يؤدي إلى تكوين هياكل تشبه الوحدات الوظيفية الموجودة في الأنسجة في الجسم الحي16. الثقافات 3D تحاكي البيئة الدقيقة في الجسم الحي إلى حد كبير ، وبالتالي التغلب على قيود الثقافات 2D39. علاوة على ذلك ، نظرا لأن الخلايا المزروعة في 3D هي من أصل بشري والنظام أكثر قابلية لدراسة الأحداث المبكرة ، فهو أبسط وأكثر أناقة من نماذج القوارض.
باستخدام هذه المنصة ، يتم عرض نموذج لدراسة عملية التحول بعد التعرض لوسيط الدهون الفوسفاتية مثل PAF. حددت الدراسات من مختبرنا أن علاج PAF يمكن أن يحول خط الخلايا الظهارية للثدي غير الورمي ، MCF10A12. تم تحسين هذه الطريقة لتعريض الخلايا باستمرار ل PAF ، على غرار سيناريو في الجسم الحي ، حيث يوجد PAF في البيئة الدقيقة.
يجب تمرير خلايا MCF10A ، عندما تنمو في 2D ، كل 4 أيام. إذا لم يتم الحفاظ عليها وفقا للبروتوكول ، فإنها تتصرف بشكل مختلف تماما ، وهو أمر مرئي فقط عند زراعتها على ECM16. يجب أن يبقى رقم مرور الخلايا منخفضا قدر الإمكان. هذه الطريقة لها أيضا قيود بسبب الاختلاف في تركيز البروتين في دفعات مختلفة من lrECM. يمكن التغلب على ذلك عن طريق اختبار الدفعات المختلفة ببساطة عن طريق طلاء الخلايا على سرير lrECM ومراقبة توزيع حجم الأسيني. إذا لم يكن هناك تباين كبير في الحجم ، يمكن اعتبار دفعة lrECM مناسبة للتجارب.
يتم تقييم التحول بشكل عام عن طريق التألق المناعي ، والذي يظهر في الفيديو. أثناء أداء التألق المناعي ، فإن الخطوات التي تنطوي على الحضانة عند 4 درجات مئوية أمر بالغ الأهمية. سحب المحلول عندما تكون طبقة lrECM في حالة سائلة يجعل الطبقة غير متساوية ، مما يؤدي إلى فقدان الهياكل الأسينارية. تتمثل إحدى طرق معالجة مشكلة التفاوت في تخزين الشرائح عند 4 درجات مئوية على منصة متساوية بين عشية وضحاها أو تغيير التكبير الذي يتم فيه التصوير. لتجنب سحب هياكل acinar ، قم بإزالة الغرفة بعناية من التخزين 4 درجات مئوية وإزالة ثلاثة أرباع الحجم المضاف في البداية ، ثم أخرج الباقي أثناء عمليات الغسيل اللاحقة.
مشكلة رئيسية أخرى تواجهها هي الخلفية العالية بسبب lrECM. للتغلب على هذه المشكلة ، يمكن للمرء استخدام 2٪ من الأجسام المضادة الثانوية المانعة بدلا من 1٪. ومع ذلك ، فإن زيادة الحجب الثانوي لا تخدم الغرض من تلطيخ العلامات القمية و E-cadherin. في مثل هذه الحالات ، ينصح بإخضاع زجاج غطاء الغرفة بعد اليوم 20 إلى PBS-EDTA لمدة 15 دقيقة عند 4 درجات مئوية ، ثم إصلاح الأسيني باتباع نفس البروتوكول كما هو موضح في الفيديو. PBS-EDTA يذوب جزئيا lrECM ، وبالتالي تقليل الخلفية. ومع ذلك ، إذا تم تجاوز وقت الحضانة ، يمكن أن يؤدي هذا العلاج إلى فقدان الهياكل أثناء سحب المحلول. وبالتالي ، يجب توخي أقصى درجات الحذر أثناء تنفيذ هذا الإجراء. وقد لوحظ أيضا أن تخزين الشرائح لفترات أطول يمكن أن يؤدي إلى زيادة في إشارة الخلفية. لذلك ، يجب إجراء التصوير في أقرب وقت ممكن. من المستحسن تصوير ما لا يقل عن 15 أسيني لكل تجربة لتحديد تغيير في النمط الظاهري.
تحتوي ثقافات 3D acinar على قيود معينة ، مثل صعوبة تتبع الخلايا المفردة أثناء تصوير الخلايا الحية. يجب إجراء بعض الدراسات ، مثل التأثيرات على دورة الخلية ، باستخدام تصوير الخلايا الحية للحفاظ على المعلومات المكانية والزمانية. ومع ذلك ، بسبب التغيرات المستمرة في الهيكل ، من الصعب تتبع هذه المعلمات في ثقافات 3D acinar باستخدام المجاهر البؤرية العادية. وهذا يستدعي استخدام تقنيات مجهرية متقدمة مثل الفحص المجهري فائق الدقة أو الفحص المجهري Airyscan. كما سيتطلب إزاحة الهياكل الأسينارية لبعض مقايسات التحول مثل التئام الجروح ، والنمو المستقل عن المرساة ، وفحوصات الأورام في الجسم الحي . ومن شأن هذا الإزاحة أن يؤدي إلى فقدان معلومات مكانية وزمنية هامة. غالبا ما يتم تخفيف تحلل البروتين الذي تم جمعه من الثقافات بسبب وجود IrECM ، مما يطرح مشكلات في تحميل كمية كافية من الليزات. ومع ذلك ، يمكن التغلب على هذا إلى حد كبير عن طريق إزاحة هياكل الأسيني وجمعها قبل التحلل.
هنا ، تم إثبات نظام نموذجي لدراسة وسيط الدهون الفوسفاتية / التحول الناجم عن العوامل المرتبطة بالمناعة. يمكن لهذا النموذج توضيح المسار (المسارات) الجينية و / أو اللاجينية التي قد يتم إلغاء تنظيمها ، مما يؤدي إلى تغييرات جذرية في المورفولوجيا. يمكن أيضا استخدام هذه الطريقة لفحص العلاجات المحتملة. ستوفر دراسات فحص الأدوية هذه نجاحا أفضل من الفحوصات التي أجريت في ثقافات 2D38. ومن أبرز ما يميز هذه الطريقة هو التكيف وفقا لمتطلبات الدراسة. يمكن تعديل نظام العلاج وطرق التحليل حسب الحاجة. علاوة على ذلك ، يمكن أن توفر هذه الطريقة نظرة ثاقبة على الإشارات الجزيئية المتأثرة بالعلاج40. ستساعد هذه التقنية أيضا على التنبؤ باحتمال حدوث مقاومة الأدوية. وعلاوة على ذلك، سيساعد أيضا في توضيح الآلية التي تنطوي عليها مقاومة الأدوية وتحديد أهداف معقولة للتغلب عليها. وقد أثبتت الدراسات إمكانيات المشاركة في زراعة أنواع متعددة من الخلايا في 3D ، والتي يمكن تعديلها بشكل أكبر لاستيعاب نظام العلاج41. ستوفر هذه الفرص رؤى أكبر حول الخصائص والتغيرات الجزيئية التي تحدث في الجسم الحي أثناء بدء وتطور سرطان الثدي.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب محتمل في المصالح.
Acknowledgements
ونشكر مرفق الفحص المجهري التابع للمعهد الدولي للدراسات الاستراتيجية في بيون على إمكانية الوصول إلى المعدات والبنية التحتية ودعم التجارب. تم دعم هذه الدراسة من خلال منحة من وزارة التكنولوجيا الحيوية (DBT) ، حكومة الهند (BT / PR8699 / MED/30/1018/2013) ، مجلس أبحاث العلوم والهندسة (SERB) ، حكومة الهند (EMR / 2016 / 001974) وجزئيا من قبل IISER، تمويل Pune Core. تم تمويل A. K. من قبل زمالة CSIR-SRF ، وتم تمويل لوس أنجلوس من خلال زمالة DST-INSPIRE ، وتم تمويل V.C بواسطة DBT (BT / PR8699 / MED/30/1018/2013).
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved