Method Article
Изогенный чип почечного клубочка, разработанный из индуцированных человеком плюрипотентных стволовых клеток
В этой статье
Резюме
Здесь представлен протокол для разработки персонализированной системы «орган на чипе», которая рекапитулирует структуру и функцию клубочкового фильтрационного барьера почек путем интеграции генетически согласованных эпителиальных и сосудистых эндотелиальных клеток, дифференцированных от индуцированных человеком плюрипотентных стволовых клеток. Эта биоинженерная система может продвигать прецизионную медицину почек и связанные с ней приложения.
Аннотация
Хроническая болезнь почек (ХБП) поражает 15% взрослого населения США, но создание таргетной терапии было ограничено отсутствием функциональных моделей, которые могут точно предсказать биологические реакции человека и нефротоксичность. Достижения в области прецизионной медицины почек могут помочь преодолеть эти ограничения. Однако ранее установленные in vitro модели клубочка почек человека — первичного участка фильтрации крови и ключевой мишени многих заболеваний и токсичности лекарств — обычно используют гетерогенные клеточные популяции с ограниченными функциональными характеристиками и непревзойденным генетическим фоном. Эти характеристики значительно ограничивают их применение для моделирования конкретных заболеваний пациента и терапевтического открытия.
В этой статье представлен протокол, который интегрирует индуцированный человеком плюрипотентный стволовый (iPS) клеточный клубочковый эпителий (подоциты) и эндотелий сосудов от одного пациента для разработки изогенного и васкуляризированного микрофлюидного чипа почечного клубочка. Полученный чип клубочка состоит из эндотелиальных и эпителиальных клеточных слоев, полученных из стволовых клеток, которые экспрессируют специфические для линии маркеры, продуцируют белки базальной мембраны и образуют интерфейс ткань-ткань, напоминающий клубочковый фильтрационный барьер почки. Спроектированный чип клубочка избирательно фильтрует молекулы и рекапитулирует лекарственное повреждение почек. Способность восстанавливать структуру и функцию почечного клубочка с использованием изогенных типов клеток создает возможность моделировать заболевание почек со специфичностью пациента и продвигать полезность органов на чипах для прецизионной медицины почек и связанных с ней применений.
Введение
Устройства «орган на чипе» представляют собой динамические 3D-модели in vitro, которые используют молекулярную и механическую стимуляцию, а также васкуляризацию для формирования ткане-тканевых интерфейсов, которые моделируют структуру и функцию конкретных органов. Ранее установленные устройства «орган на чипе», целью которых было повторение клубочка почки (клубочковые чипы), состояли из клеточных линий животных1 или первичных и увековеченных клеточных линий человека гетерогенных источников 2,3. Использование генетически гетерогенных клеточных источников представляет вариации, которые значительно ограничивают исследования специфических для пациента реакций и генетики или механизмов заболевания 4,5. Решение этой проблемы зависит от наличия изогенных клеточных линий, происходящих от конкретных людей с сохраненными молекулярными и генетическими профилями, чтобы обеспечить более точную микросреду для разработки моделей in vitro 2,3,6. Изогенные клеточные линии человеческого происхождения теперь могут быть легко сгенерированы благодаря достижениям в культуре iPS-клеток человека. Поскольку человеческие iPS-клетки, как правило, неинвазивно получены, могут самообновляться бесконечно и дифференцироваться практически в любой тип клеток, они служат привлекательным источником клеток для создания моделей in vitro, таких как чип клубочка 7,8. Клубочковый фильтрационный барьер является первичным участком для фильтрации крови. Кровь сначала фильтруется через эндотелий сосудов, клубочковую базальную мембрану и, наконец, через специализированный эпителий, называемый подоцитами. Все три компонента фильтрационного барьера способствуют селективной фильтрации молекул. Здесь представлен протокол для создания устройства «орган на чипе», сопряженного с эндотелием сосудов и клубочковым эпителием из одного источника iPS-клеток человека. Хотя этот протокол особенно полезен для разработки изогенного и васкуляризированного чипа для рекапитуляции клубочкового фильтрационного барьера, он также обеспечивает план для разработки других типов персонализированных органов на чипах и мультиорганных платформ, таких как изогенная система «тело на чипе».
Протокол, описанный в настоящем описании, начинается с дивергентной дифференцировки iPS-клеток человека в две отдельные линии - боковые клетки мезодермы и мезодермы, которые впоследствии дифференцируются в эндотелий сосудов и клубочковый эпителий соответственно. Для генерации боковых клеток мезодермы человеческие iPS-клетки были посеяны на пластинах с покрытием 1-слойной базальной мембраны и культивированы в течение 3 дней (без обмена средой) в среде N2B27, дополненной активатором Wnt, CHIR 99021, и мощным индуктором мезодермы, костно-морфогенетическим 4 (BMP4). Полученные боковые клетки мезодермы ранее характеризовались экспрессией брахиуры (Т), смешанного парного гомеобокса (MIXL) и эомезодермина (EOMES)9. Впоследствии боковые клетки мезодермы культивировали в течение 4 дней в среде, дополненной VEGF165 и Forskolin, чтобы индуцировать сосудистые эндотелиальные клетки, которые были отсортированы на основе экспрессии VE-cadherin и / или PECAM-1 с использованием магнитно-активированной сортировки клеток (MACS). Полученные сосудистые эндотелиальные клетки (viEC) расширяли путем культивирования их на колбах с 3-покрытым базальной мембраной матрикс до готовности к посеву в микрофлюидном устройстве.
Для генерации клеток мезодермы человеческие iPS-клетки были посеяны на пластинах с покрытием 2-слойной базальной мембраны и культивированы в течение 2 дней в среде, содержащей активин А и CHIR99021. Полученные клетки мезодермы характеризовались экспрессией HAND1, гусеницы и брачуры (Т), как описано ранее 2,10,11. Чтобы индуцировать дифференцировку клеток промежуточной мезодермы (IM), клетки мезодермы культивировали в течение 14 дней в среде, дополненной BMP-7 и CHIR99021. Полученные IM-клетки экспрессируют опухоль Вильма 1 (WT1), парный бокс-ген 2 (PAX2) и нечетно пропущенный родственный белок 1 (OSR-1)2,10,11.
Двухканальный микрофлюидный чип на основе полидиметилсилоксана (PDMS) был разработан для рекапитуляции структуры клубочкового фильтрационного барьера in vitro. Мочевой канал составляет 1000 мкм x 1000 мкм (Ш х В), а размер капиллярного канала составляет 1000 мкм х 200 мкм (Ш х В). Циклические циклы растяжения и релаксации облегчались полыми камерами, присутствующими с каждой стороны флюидных каналов. Клетки были посеяны на гибкую мембрану PDMS (толщиной 50 мкм), которая разделяет мочевой и капиллярный каналы. Мембрана оснащена гексагональными порами (диаметр 7 мкм, 40 мкм друг от друга), чтобы способствовать межклеточной сигнализации (рисунок 1A)2,12. За два дня до завершения индукции IM микрофлюидные чипы были покрыты базальной мембранной матрицей 2. viEC были посеяны в капиллярный канал микрофлюидного чипа с использованием эндотелиальной поддерживающей среды за 1 день до завершения индукции IM, и чип был перевернут вверх ногами, чтобы обеспечить адгезию клеток на базальной стороне мембраны PDMS, покрытой ECM. В день завершения индукции IM клетки были засеяны в мочевой канал микрофлюидного чипа с использованием среды, дополненной BMP7, активином A, CHIR99021, VEGF165 и всей трансретиноевой кислотой, чтобы индуцировать дифференцировку подоцитов внутри чипа. На следующий день резервуары среды были заполнены средой индукции подоцитов и средой эндотелиального обслуживания, и на микросхемы была нанесена 10% механическая деформация при 0,4 Гц и поток жидкости (60 мкл/ч).
Клеточные микрофлюидные чипы культивировали в течение 5 дополнительных дней с использованием среды индукции подоцитов (в мочевом канале) и эндотелиальной поддерживающей среды (в сосудистом канале). Полученные чипы почечного клубочка культивировали в течение 7 дополнительных дней в поддерживающей среде как для подоцитарных, так и для эндотелиальных клеток. Дифференцированные подоциты положительно экспрессировали специфические для линии белки, включая подоцин и нефрин 13,14, в то время как viECs положительно экспрессировали белки идентификации линии PECAM-1 и VE-Cadherin, все из которых являются необходимыми молекулами для поддержания целостности клубочкового фильтрационного барьера15,16 . Было обнаружено, что подоциты и viEC секретируют наиболее распространенный белок клубочковой базальной мембраны, коллаген IV, который также важен для созревания и функции тканей.
Было обнаружено, что трехкомпонентная система фильтрационного барьера - эндотелий, базальная мембрана и эпителий - в клубочковых чипах избирательно фильтрует молекулы и реагирует на химиотерапевтическое, нефротоксическое лекарственное лечение. Результаты медикаментозного лечения показали, что чип клубочков может быть использован для исследований нефротоксичности и для моделирования заболеваний. Этот протокол обеспечивает общее руководство по разработке функционального микрофлюидного чипа почечного клубочка из иззогенных производных iPS-клеток. Последующий анализ инженерного чипа может быть выполнен по желанию исследователя. Для получения дополнительной информации об использовании чипа клубочка для моделирования клубочкового повреждения, вызванного лекарственными средствами, обратитесь к предыдущим публикациям 2,12.
протокол
1. Подготовка растворов базальной мембранной матрицы и покрытых подложек
- Оттаивание фундаментальной мембранной матрицы 1 ночью на льду при 4 °C. Аликвота в соответствии с предложением завода-изготовителя в отношении коэффициента разрежения. Используя коническую трубку объемом 50 мл и пипетку, тщательно перемешайте соответствующее количество матрицы базальной мембраны 1 в 25 мл холодного DMEM/F12 до полного размораживания и растворения.
- Чтобы растворить замороженную аликвоту, возьмите ~200 мкл из 25 мл холодного DMEM/F12 и перенесите его в замороженную аликвотную трубку. Пипетка вверх и вниз до тех пор, пока матрица не будет тщательно разморожена и растворена. Перенос полного содержания трубчатого матрикса 1 базальной мембраны в остальную часть холодного DMEM/F12.
- Пипетка 1 мл раствора матрицы базальной мембраны 1 в каждую скважину из 6-луночной пластины. Чтобы использовать покрытые пластины в тот же день, инкубируйте при 37 °C в течение 2 ч.
- Альтернативно, пластины с покрытием могут быть обернуты парапленкой и храниться при 4 °C в течение 2 недель. Когда будет готова к использованию хранящаяся пластина, инкубируют при 37 °C в течение 30 мин.
- Разбавляют основную мембранную матрицу 2 в 9 мл стерильной дистиллированной воды для достижения конечной концентрации 5 мкг/мл. Пипетка 700 мкл раствора матрицы 2 базальной мембраны в каждую скважину 12-луночной пластины. Оберните основную мембранную матрицу 2 пластинами с покрытием парапленкой и храните при 4 °C до 2 недель.
- Восстанавливают лиофилизированную матрицу базальной мембраны 3 для достижения конечной концентрации 1 мг/мл в фосфатно-буферном физиологическом растворе (PBS, Ca+2- и Mg+2-free), как это предлагается производителем. Развести одну аликвоту 250 мкл до конечной концентрации 25 мкг/мл в 9,75 мл PBS (Ca+2 и Mg+2 свободно). Используйте 6 мл этого раствора для покрытия одной колбы T75 (конечная концентрация 2 мкг/см2). Хранить колбы с матричным покрытием при температуре 4 °C до 1 недели.
2. Культура iPS-клеток человека
ПРИМЕЧАНИЕ: Линия DU11, используемая в этом протоколе, была протестирована и оказалась свободной от аномалий микоплазмы и кариотипа.
- Инкубировать основную мембранную матрицу пластин с 1-м покрытием при 37°С в течение 1-2 ч.
- Промывайте каждую лунку 6-луночной плиты 3x 1 мл теплого (37 °C) DMEM/F12. Добавьте 2 мл питательной среды iPS-клеток человека (CCM) (Дополнительная таблица S1) к каждой лунке 6-луночной пластины. Инкубируйте пластины при 37 °C, пока клетки готовятся к посеву, как описано ниже.
- Промывайте каждую лунку 6-луночной пластины, содержащей человеческие iPS-клетки, 1 мл теплого DMEM/F12.
- Аспирируйте DMEM/F12. Добавьте 1 мл теплого буфера отслоения клеток к каждой скважине 6-луночной пластины. Инкубировать при 37 °C в течение 1 мин.
- Визуально осмотрите каждую лунку под микроскопом на предмет диссоциации вокруг краев клеточной колонии. Осторожно аспирируйте буфер отслоения клеток из клеток. Аккуратно промыть каждую лунку 1 мл теплого DMEM/F12.
- Осмотрите пластины под микроскопом, чтобы убедиться, что клетки не полностью отсоединились от пластины или не были случайно аспирированы.
- Добавьте 3 мл теплого человеческого iPS CCM в каждую лунку 6-луночной пластины с клетками. Используя клеточный лифтер, аккуратно соскоблите колонии. Используя серологическую пипетку объемом 5 мл, осторожно перемешайте клеточную суспензию в каждой лунке вверх и вниз один раз.
- Извлеките из инкубатора новую основную мембранную матрицу с 1-м покрытием. Перенесите 0,5 мл клеточной суспензии в каждую скважину новой пластины матрицы базальной мембраны с 1-покрытием. Переместите пластину в восьмерку, чтобы равномерно распределить ячейки. Инкубировать при 37 °C в 5% CO2 инкубаторе.
- Аспирируйте отработанную среду и заменяйте 3 мл человеческого iPS CCM каждый день культивирования до тех пор, пока клетки не станут на 70% сливающимися (примерно через 4 дня после прохождения).
3. Дни 0-16: дифференцировка ИПСК человека в промежуточные клетки мезодермы
- Дни 0-2: индукция мезодермы
- Перемещайте пластины матрицы базальной мембраны с 2-м покрытием от 4 °C до комнатной температуры в течение 2 ч для уравновешивания после хранения.
- Аспирировать отработанную среду из каждой скважины 6-луночной пластины, содержащей примерно 70% сливающихся iPS-клеток человека. Аккуратно промыть ячейки 3x с 1 мл теплого DMEM/F12.
- Аспирируйте DMEM/F12. Добавьте 1 мл буфера отслоения клеток к каждой лунке 6-луночной пластины человеческих iPS-клеток. Инкубировать при 37 °C в течение 5-7 мин.
- Визуально осмотрите каждую лунку под микроскопом на предмет диссоциации вокруг краев клеточной колонии. Используя клеточный лифтер, аккуратно соскоблите колонии.
- Перенесите клеточные суспензии из всех колодцев 6-луночной пластины в коническую трубку объемом 15 мл и используйте P1000 для пипетки вверх и вниз несколько раз, чтобы получить одноэлементную суспензию iPS-клеток.
- Наполните клеточную суспензию в конической трубке до 14 мл DMEM/F12. Центрифуга в течение 5 мин при 200 × г при комнатной температуре.
- Аспирировать супернатанта. Повторно суспендировать ячейку гранулы в 14 мл теплого DMEM/F12. Центрифугирование повторяют в течение 5 мин при 200 × г при комнатной температуре.
- Аспирировать супернатанта. Повторное суспендирование клеток в 1 мл мезодермной индукционной среды (Дополнительная таблица S1). Подсчитайте клетки с помощью гемоцитометра. Разбавляют в индукционной среде Мезодермы для достижения конечной концентрации 1 × 105 клеток/мл.
- Аспирировать покрытие из основы мембраны матрицы 2 с покрытием пластины. Промыть каждую лунку базальной мембранной матрицей 2-слойной пластины 2x с 1 мл теплого DMEM/F12.
- Аккуратно пипеткой суспензию ячейки вверх и вниз в 2 раза. Переложить 1 мл клеточной суспензии на каждую лунку фундаментальной мембраны матрицы с 2-м покрытием пластины. Осторожно переместите пластину в восьмерке, чтобы равномерно распределить ячейки.
- Инкубируйте пластину при температуре 37 °C в течение ночи. На следующий день (день 1) аспирировать отработанную среду из каждой скважины 12-луночной плиты. Заменить 1 мл теплой индукционной среды Мезодермы. Инкубировать при 37 °C в течение ночи.
- Дни 2-16: промежуточная индукция мезодермы
- Аспирируйте отработанную мезодермную индукционную среду. Заменить 1 м л теплой промежуточной мезодермной индукционной среды (Дополнительная таблица S1). Аспирировать отработанную среду и заменять 1 мл теплой промежуточной мезодермной индукционной среды каждый день в течение 14 дней.
4. Дни 0-15: дифференцировка и расширение ИПСК человека в эндотелиальные клетки сосудов
- День 0: посев iPS-клеток человека
- Приготовьте 15 мл человеческого iPS CCM с ингибитором ROCK (Дополнительная таблица S1). Держите в тепле при 37 °C.
- Инкубируют одну основную мембранную матрицу с 1-покрытием пластины в течение 1-2 ч при 37 °C. Аспирировать матрицу базальной мембраны 1. Промыть 3x с 1 мл теплого DMEM/F12.
- Аспирируйте DMEM/F12. Добавьте 2 мл человеческого iPS CCM с ингибитором ROCK к каждой лунке 6-луночной пластины. Инкубируйте пластины при 37 °C, пока клетки готовятся к посеву, как описано ниже.
- Аспирировать отработанную среду из каждой скважины 6-луночной пластины, содержащей примерно 70% сливающихся iPS-клеток человека. Аккуратно промыть ячейки 3x с 1 мл теплого DMEM/F12.
- Аспирируйте DMEM/F12. Добавьте 1 мл буфера отслоения клеток к каждой лунке 6-луночной пластины человеческих iPS-клеток. Инкубируют при 37 °C в течение 5-7 мин, чтобы диссоциировать клетки на отдельные клетки.
ПРИМЕЧАНИЕ: Из-за присущих различий между клеточными линиями iPS пользователю необходимо будет визуально осмотреть клетки через 5 минут, чтобы определить оптимальное время инкубации. - Переведите клетки в коническую трубку объемом 15 мл. Доведите клеточную суспензию до 14 мл с теплым DMEM/F12, чтобы нейтрализовать буфер отсоединения. Центрифуга в течение 5 мин при 200× г при комнатной температуре.
- Осторожно аспирировать супернатант. Повторное суспендирование клеток в 1 мл человеческого iPS CCM с ингибитором ROCK. Подсчитайте общее количество клеток с помощью гемоцитометра.
- Засейте клетки от 37 000 до 47 000 клеток /см2 (от 355 200 до 451 200 клеток / лунка 6-луночной пластины). Инкубировать при 37 °C в течение ночи.
ПРИМЕЧАНИЕ: Из-за присущих различий между линиями ячеек iPS пользователю необходимо будет определить оптимальную плотность посева.
- Дни 1-3: латеральная индукция мезодермы
- На следующий день (день 1) аспирировать отработанную среду из каждой лунки 6-луночной пластины iPS-клеток человека. Замените каждую скважину 6-луночной плиты 5 мл латеральной мезодермной индукционной среды (Дополнительная таблица S1). При масштабировании сосуда для культивирования (например, колб), как правило, заменяют в 3 раза больший рабочий объем в сосуде для культивирования.
- Не меняйте эту среду в течение 3 дней.
ПРИМЕЧАНИЕ: Боковая индукционная среда мезодермы в скважинах обычно меняет цвет с красного на желтый, поскольку клетки используют питательные вещества. Однако мутная среда или среда с ростом бактерий не является нормальной и должна быть обеззаражена и выброшена как таковая.
- Дни 4-6: индукция эндотелиальных клеток
- Аспирируйте отработанную среду из каждой скважины 6-луночной плиты. Замените каждую лунку 6-луночной плиты 3 мл теплой эндотелиальной индукционной среды (Дополнительная таблица S1). Инкубируйте пластину при температуре 37 °C в течение ночи.
- В течение следующих 2 дней (дни 5 и 6) соберите отработанную среду из всех скважин в коническую трубку объемом 50 мл. Храните коническую трубку при температуре 4 °C. Пополняйте клетки 3 мл теплой эндотелиальной индукционной среды. Инкубировать пластину при 37 °C.
- День 7: сортировка эндотелиальных клеток (viEC)
- Вынимаем основную мембранную матрицу 3 колбы и оставляем при комнатной температуре на 1 ч.
- Подготовьте 50 мл буфера MACS (Дополнительная таблица S1).
- Поместите буфер отслоения клеток, буфер MACS, эндотелиальный CCM и PBS (Ca2+ и Mg2+ свободный) на льду в тканевом культуральном капюшоне.
- Поместите магнит на подставку MACS. Поместите две конические трубки по 50 мл и одну коническую трубку объемом 15 мл в держатель конической трубки.
- Поместите подставку MACS (с прикрепленным магнитом) и одну колонку LS в вытяжку для культивирования тканей. Установите держатель конической трубки (с коническими трубками внутри) на подставке MACS, под магнитом (дополнительный рисунок S1A).
- Соберите отработанную среду из каждой скважины 6-луночной плиты в коническую трубу объемом 50 мл со стадии 4.3.2. Промыть каждую лунку 6-луночной пластины PBS (Ca2+ и Mg2+ свободно).
- Аспирировать PBS. Добавьте 1 мл буфера отсоединения клеток. Инкубируют при 37 °C в течение 5-7 мин, чтобы полностью диссоциировать клетки.
- Переведите клетки в коническую трубку объемом 50 мл. Доведите клеточную суспензию до 15 мл с холодным эндотелиальным СКК. Центрифуга при 200 × г в течение 5 мин при комнатной температуре.
- Аспирировать супернатанта. Повторное суспендирование клеток в 1 мл холодного буфера MACS. Подсчитайте клетки с помощью гемоцитометра.
- Добавьте 10 мл буфера MACS в суспензию ячейки. Центрифуга в течение 5 мин при 200 × г при комнатной температуре.
- Аспирировать супернатанта. Повторное суспендирование клеток в 80 мкл буфера MACS на 10 миллионов клеток. Добавьте 20 мкл на 10 миллионов клеток блокирующего реагента FcR, микрошариков CD31 и микрошариков CD144. Инкубировать в течение 15 мин на льду.
- Пока клеточная суспензия инкубируется, центрифугируют среду, собранную из эндотелиальной индукции (стадия 4.3.2), при 200 × г в течение 10 мин.
- Соберите супернатант в вакуумный фильтр объемом 500 мл 0,22 мкм. Готовят эндотелиальную кондиционированную среду (дополнительная таблица S1). Отфильтруйте среду в стерильных условиях и держите среду теплой при 37 °C.
ПРИМЕЧАНИЕ: Скорость пролиферации эндотелиальных клеток начнет уменьшаться после прохождения 3. Для достижения экспоненциального роста после пассажа 3 эндотелиальная кондиционированная и поддерживающая среда может быть дополнена ингибитором TGF-Beta (SB431542) 10 мкМ, начиная с пассажа 1. - После 15-минутной инкубации на стадии 4.4.11 добавьте 10 мл буфера MACS на 10 миллионов клеток (максимум 30 мл буфера MACS) к клеточной суспензии. Центрифуга по 200 × г в течение 5 мин.
- Аспирировать супернатанта. Повторное суспендирование в 1 мл буфера MACS.
- Возьмите колонну LS и вытащите поршень из шприца. Поместите плунжер обратно в пластиковую втулку. Поместите колонку на магнит.
- Поместите первую коническую трубку объемом 50 мл под колонну. Добавьте в столбец 1 мл буфера MACS. Соберите в коническую трубку объемом 50 мл под ней.
- Дайте жидкости течь, хотя и не полностью, чтобы предотвратить высыхание колонны. Когда капли жидкости начнут медленно струиться, добавьте клеточную суспензию в колонку. Соберите проточную трубу в ту же коническую трубку объемом 50 мл.
- Когда капли жидкости начнут медленно просачиваться, поместите под колонну следующую коническую трубку объемом 50 мл. Добавьте в столбец начальное прохождение (шаг 4.4.18). Соберите в коническую трубку объемом 50 мл под ней.
- Когда капли жидкости начнут медленно просачиваться, добавьте 500 мкл буфера MACS 3x для промывки колонны.
- Снимите колонку с магнита. Поместите колонну на коническую трубку объемом 15 мл. Добавьте в столбец 1 мл холодной PBS.
- Чтобы собрать клетки, возьмите поршень из пластикового рукава и плотно протолкните его в колонну.
- Подсчитайте клетки с помощью гемоцитометра. Доведите клеточную суспензию до 5 мл с PBS. Центрифуга в течение 5 мин при 200 × г.
- Пока клетки подвергаются центрифугированию, промывайте основную мембранную матрицу с 3-покрытым колбой 3x с 5 мл PBS для подготовки к посеву клеток. Аспирировать PBS и добавить 20 мл эндотелиальной кондиционированной среды в основную мембранную матрицу с 3-покрытым колбой.
- Извлеките клетки из центрифуги и аспирируйте супернатант. Повторное суспендирование клеток в эндотелиальной кондиционированной среде для посева в 26 000 клеток /см2 (1,95 × 106 клеток / колба T75). Засейте клетки.
- Чтобы рассчитать эффективность сортировки и выход ячеек, разделите количество ячеек из шага 4.4.23 на количество ячеек из шага 4.4.9.
- Дни 8-15: расширение ВЭС
- На следующий день (8 день) аспирировать отработанную среду из колбы. Заменить 10 мл эндотелиальной кондиционированной среды. Заменяйте эндотелиальную кондиционированную среду через день до тех пор, пока колба не станет на 90% сливающейся или пока флакон с эндотелиальным кондиционированным носителем не будет полностью использован.
- Аспирировать отработанную среду и заменять 10 мл эндотелиальной поддерживающей среды (Дополнительная таблица S1) через день для продолжения расширения.
- Для прохождения виЭК подготовьте две базальные мембранные матричные 3-покрытые Т75 колбы. Оставьте колбы комнатной температуры на 1 ч. Тщательно вымойте свежеприготовленные колбы 3x с 5 мл PBS.
- Аспирировать PBS. Добавьте 10 мл теплой эндотелиальной поддерживающей среды к каждой свежеприготовленной колбе. Инкубируйте пластины при 37 °C, пока клетки готовятся к посеву, как описано ниже.
- Добавьте 5 мл буфера отсоединения клеток в 90% сливающуюся колбу T75 с виЭК. Инкубировать при 37 °C в течение 5-7 мин. Переведите клетки в коническую трубку объемом 15 мл. Добавьте 5 мл теплого DMEM/F12. Центрифуга по 200 × г в течение 5 мин.
- Аспирировать супернатанта. Повторное суспендирование в 1 мл теплой эндотелиальной поддерживающей среды. Добавьте 500 мкл клеточной суспензии в каждую из свежеприготовленных колб T75.
- На следующий день аспирируйте отработанную среду. Заменить 10 мл эндотелиальной поддерживающей среды. Аспирировать отработанную среду и заменять 10 мл эндотелиальной поддерживающей среды через день до тех пор, пока колба не станет на 90% сливающейся.
5. День 14: Подготовка микрофлюидных чиповых устройств органов для клеточной культуры
- Плазменная обработка и покрытие матрицы базальной мембраны 2
- Готовят раствор основыальной мембранной матрицы 2 (этап 1.3). Отложите его в сторону.
- В вытяжке для культивирования стерильных тканей распакуйте стерильную чашку Петри размером 100 мм х 15 мм. Поместите чашку Петри сверху вниз под дно чашки Петри (дополнительный рисунок S1B).
- С помощью пинцета выньте микрофлюидные чипсы из упаковки и поместите их внутрь чашки Петри. Закройте чашку Петри крышкой из-под чашки.
- На плазменном ашере поместите крышку чашки Петри под чашку, сверху вниз, удерживая их вместе, как единое целое. Поместите блок чашки Петри в камеру плазменного ашера. Запустите плазменный ашер с кислородом при 100 Вт, 15 SCCM, 30 с.
- Чувствительность ко времени: Как только лечение будет завершено, выньте чашку Петри из плазменной ашера. Быстро и слегка протрите крышку чашки Петри 70% этанолом, распыленным на лабораторную салфетку. Накройте чашку Петри крышкой.
- Поднесите чашку Петри к вытяжке для культивирования стерильных тканей. Осторожно добавляют 25 мкл раствора основы мембранной матрицы 2 в мочевой (верхний) канал чипа. Добавьте 20 мкл раствора матрицы 2 базальной мембраны в капиллярный (нижний) канал чипа.
- Возьмите два стерильных 15 мл конических колпачков и заполните их стерильной дистиллированной водой (~ 500 мкл). Поместите колпачок в чашку Петри, чтобы предотвратить высыхание каналов стружки и мембраны. Поставьте крышку на блюдо. Инкубировать при 37 °C в течение ночи.
6. Посев виЭК и промежуточных клеток мезодермы в микрофлюидные устройства
- День 15: ViEC
- Аспирировать среду из Т75-колб, содержащих 90% сливающихся виЭК. Добавляют 5 мл буфера отслоения клеток и инкубируют при 37 °C в течение 5-7 мин.
- Переведите клетки в коническую трубку объемом 15 мл. Добавить 5 мл DMEM/F12. Центрифуга по 200 × г в течение 5 мин.
ПРИМЕЧАНИЕ: Каждая колба T75 с приблизительно 90% сливающихся viEC даст ~ 3 миллиона клеток. - Аспирировать супернатанта. Повторно суспендируют клетки в 300 мкл эндотелиальной поддерживающей среды для получения примерно 2 миллионов клеток / 300 мкл. Подсчитайте клетки с помощью гемоцитометра. Отложите суспензию ячейки в сторону.
- Перенесите чашку Петри, содержащую микрофлюидные чипсы, на вытяжку для культивирования тканей. Прикрепите защитный наконечник P200 к наконечнику аспиратора.
- Промывайте верхний и нижний каналы микрофлюидного чипа 200 мкл DMEM/F12, одновременно аспирируя периферию розетки.
- Крепко держите стружку с помощью барьерного наконечника P200, прикрепленного к аспиратору, вдали от выходного отверстия нижнего канала. Плотно вводят 20 мкл суспензии viEC с приблизительно 134 000 клеток в капиллярный (нижний) канал чипа. Осторожно аспирировать среду с периферии выхода.
- Проверьте под микроскопом наличие пузырьков или неравномерной плотности посева viEC.
- Осторожно переверните чип, чтобы перевернуть его, чтобы viEC могли прилипать к базальной стороне гибкой мембраны PDMS. Поместите чип в картридж держателя. Добавьте 3 мл PBS в картридж держателя чипа, чтобы предотвратить высыхание мембраны. Инкубируйте чип при 37 °C в течение 3 ч.
- Проверьте нижний канал под микроскопом на наличие сливающегося слоя виЭК, прикрепленного к гибкой мембране PDMS. Опустите 200 мкл эндотелиальной поддерживающей среды на входное отверстие нижнего канала и дайте ей течь по каналу, чтобы промыть канал неприкрепленных эндотелиальных клеток, осторожно аспирируя с периферии капиллярного (нижнего) канала выходного отверстия.
- Замените чип обратно в картридж держателя. Инкубировать при 37 °C в течение ночи.
- День 16: промежуточные клетки мезодермы (IM)
- Осторожно промывайте капиллярный (нижний) канал 200 мкл эндотелиальной поддерживающей среды, тщательно аспирируя периферию выходного отверстия.
- Промывайте мочевой (верхний) канал 200 мкл DMEM/F12, тщательно аспирируя периферию выхода. Поместите ~50 мкл DMEM/F12 на входной и выходной порты.
- Аспирировать промежуточную мезодермную индукционную среду из каждой скважины 12-луночной плиты.
ПРИМЕЧАНИЕ: Каждая лунка в конце дифференцировки дает приблизительно 1,5 миллиона IM клеток. - Добавьте 1 мл трипсина-ЭДТА в каждую лунку 12-луночной плиты и инкубируйте при 37 °C в течение 5 мин.
- Аккуратно соскребите клетки с помощью подъемника клеток, а также пипетку вверх и вниз, чтобы диссоциировать клетки с помощью P1000. Добавьте 2 мл раствора для нейтрализации трипсина (дополнительная таблица S1) в каждую лунку. Переведите клетки в коническую трубку объемом 50 мл. Доведите объем клеточной суспензии до 50 мл с ПОМОЩЬЮ DMEM/F12 и центрифуги при 200 × г в течение 5 мин.
- Аспирировать супернатанта. Повторно суспендируют клетки в 500 мкл промежуточной мезодермной индукционной среды для получения примерно 3 миллионов клеток на 500 мкл. Подсчитайте клетки с помощью гемоцитометра.
- Крепко держите чип с помощью барьерного наконечника P200, прикрепленного к аспиратору, вдали от выходного отверстия мочевого (верхнего) канала. Плотно вводят 25 мкл клеточной суспензии с приблизительно 112 500 IM клетками в мочевой (верхний) канал чипа и осторожно аспирируют среду с периферии выхода.
- Проверьте под микроскопом наличие пузырьков или неравномерной плотности посева IM-клеток. Добавьте 3 мл PBS в картридж держателя чипа. Инкубировать при 37 °C в течение 3 ч.
- Промывайте оба канала 200 мкл соответствующей клеточной культуральной среды, тщательно аспирируя периферию выходов чипа, чтобы предотвратить обратный поток отработанной среды и клеточного мусора.
- Прикрепите пустые барьерные наконечники P200 в оба выхода мочевого и капиллярного каналов. Пипетка 200 мкл эндотелиальной поддерживающей среды и вводят половину ее во входное отверстие капиллярного канала. Отпустите наконечник пипетки внутрь входного отверстия таким образом, чтобы и входное, и выходное отверстие канала теперь были прикреплены к наконечникам пипетки, заполненным средой.
- Пипетка 200 мкл поддерживающей среды IM и вводят половину во входной канал мочевыводящих путей. Отпустите наконечник пипетки внутрь входного отверстия таким образом, чтобы и входное, и выходное отверстие канала теперь были прикреплены к наконечникам пипетки, заполненным средой. Инкубируйте чипы с помощью наконечников, встроенных при температуре 37 °C в течение ночи.
- Подключите чипы к биореактору Organ Chip для применения потока жидкости и механического напряжения.
- Удалите кончики P200 из мочевыводящих и капиллярных каналов. Добавьте капли соответствующих сред на вход и выход мочевого и капиллярного каналов, чтобы предотвратить высыхание.
- Добавьте 3 мл теплой среды индукции подоцитов (дополнительная таблица S1) во входной резервуар для мочевыводящих путей. Добавьте 3 мл теплой эндотелиальной поддерживающей среды в резервуар капиллярного входа.
- Добавьте 300 мкл теплой среды индукции подоцитов в выходной резервуар мочевого канала непосредственно над выходным отверстием. Добавьте 300 мкл теплой эндотелиальной поддерживающей среды в выходной резервуар капиллярного канала непосредственно над выходным отверстием.
- Поместите капсулы на лоток и в биореактор Organ Chip.
- Используйте поворотный циферблат на биореакторе органного чипа, чтобы выбрать и начать основной цикл (2 мин). Визуально осмотрите нижнюю сторону капсулы на наличие мелких капель во всех четырех жидкостных портах.
- Чтобы обеспечить контакт жидкости и жидкости между нижней стороной Pod и микрофлюидными портами чипа, осторожно вставьте держатель микросхемы в модуль. Осторожно нажмите на выступ держателя чипа внутрь и вверх. Аспирируйте избыточную среду с поверхности чипа.
- Установите скорость потока биореактора чипа органа на уровне 60 мкл/ч. Установите циклическую деформацию на 10% при 0,4 Гц. Используйте поворотный циферблат на биореакторе Organ Chip, чтобы выбрать цикл регулирования и работать в течение 2 часов.
- Визуально осмотрите выпускные резервуары на предмет повышения уровня среды.
- Используйте поворотный циферблат на биореакторе Organ Chip для выбора цикла регулирования.
7. Дни 17-21 и далее: индукция подоцитов и поддержание чипа
- Аспирируйте среду из выходных резервуаров мочевого канала по диагонали от порта, но держите некоторую среду в резервуаре каждый день культуры. Пополняйте входной резервуар мочевого канала до 3 мл среды индукции подоцитов каждые 2 дня в течение 5 дней.
- Через 5 дней аспирируйте среду из мочевого канала, но держите некоторую среду в резервуаре. Ежедневно пополняйте резервуар входного отверстия мочевого канала 3 мл поддерживающей среды подоцитов.
- Аспирируйте среду из выходных резервуаров капиллярного канала по диагонали от порта, но держите некоторую среду в резервуаре каждый день культуры. Ежедневно пополняйте резервуар на входе капиллярного канала до 3 мл эндотелиальной поддерживающей среды.
8. Функциональный анализ и иммунофлуоресцентная визуализация
ПРИМЕЧАНИЕ: См. Дополнительный файл 1 для получения подробной информации об анализе проточной цитометрии, ИФА для сточных вод чипа и выделении мРНК.
- Функциональный анализ (молекулярная фильтрация) с использованием инулина и альбумина
- Аспирируйте среду из капиллярного канала выходного резервуара по диагонали от порта, но держите некоторую среду в резервуаре. Заменить 3 мл эндотелиальной поддерживающей среды, дополненной инулином и альбумином (Дополнительная таблица S1) в течение 6 ч.
- Используя серологическую пипетку 5 мл, измерьте объем (в мл) среды из мочевого канала и переведите в коническую трубку объемом 15 мл. Оберните трубку в алюминиевую фольгу для защиты от света и минимизации фотоотбеливания флуорофорно-конъюгированного инулина и альбумина. Пополняйте резервуар 3 мл поддерживающей среды подоцитов.
- Приготовьте запасной раствор инулина в поддерживающей среде подоцитов. Начиная с 25 мкг/мл инулина, готовят восемь стандартов инулина путем 2-кратного последовательного разведения в поддерживающей среде подоцитов.
- Аналогично готовят запасной раствор альбумина в поддерживающей среде подоцитов. Начиная со 150 мкг/мл альбумина, готовят восемь стандартов альбумина путем 2-кратного последовательного разведения в поддерживающей среде подоцитов.
- Пипетка в дублировании 100 мкл каждой стандартной концентрации инулина в каждую скважину черной 96-луночной пластины (или 16 общих скважин инулина). Пипетка в дублировании 100 мкл каждой стандартной концентрации альбумина в каждую скважину той же 96-луночной пластины (всего 16 лунок альбумина). Пипетка в дублирующей 100-мкл среде поддержания подоцитов служит заготовкой (или двумя общими лунками поддерживающей среды подоцитов).
- Пипетка в дублировании 100 мкл сточных вод из мочевого канала в каждую лунку той же 96-луночной пластины. Пипетка в дубликате 100 мкл сточных вод из капиллярного канала.
- Вставьте пластину в считыватель пластин и измерьте флуоресценцию альбумина при возбуждении 550 нм и излучении 615 нм. Измерьте одну и ту же пластину для инулина при возбуждении 513 нм и излучении 577 нм.
- На основе сгенерированных данных усредните дубликаты измерений (на чип). Вычтите пустое значение, соответствующее показаниям этой пластины, из остальных данных на листе.
- Построение значений, соответствующих стандартам альбумина, для создания стандартной кривой с концентрацией [мкг/мл] на оси x и флуоресценцией на оси Y. Построение значений, соответствующих эталонам инулина, для создания стандартной кривой с концентрацией [мкг/мл] на оси x и флуоресценцией на оси Y.
- Используйте пакет программного обеспечения для статистического анализа и линейную интерполяцию для определения концентрации инулина и альбумина в моче, соответственно, в сточной среде из чипов.
- Определите мочевой клиренс инулина/альбумина из чипов с помощью уравнения (1)2:
Мочевой клиренс = ([U] × УФ) / [P] (1)
Где [U] - концентрация в моче со стадии 8.1.10, UV - объем собранных стоков мочевого канала со стадии 8.1.2, а [P] - капиллярная концентрация инулина или альбумина (10 мкг/мл инулина или 100 мкг/мл альбумина).
- Иммунофлуоресцентная визуализация
- Введите пустой наконечник P200 в выходные отверстия мочевого и капиллярного каналов. Чтобы зафиксировать клетки, пипетку 200 мкл 4% формальдегида и вводят половину его в нижний канал на входе. Отпустите наконечник пипетки внутрь входного отверстия.
- Пипетка 200 мкл 4% формальдегида и вводит половину его в мочевой канал на входе. Отпустите наконечник пипетки внутри входного отверстия таким образом, чтобы и входное, и выходное отверстие канала теперь были прикреплены к наконечникам пипетки, заполненным фиксатором.
- Инкубировать чипсы при комнатной температуре в течение 20 мин.
- Через 20 минут выбросьте все наконечники пипеток. Вводите чистые, пустые наконечники P200 в выходные отверстия мочевого и капиллярного каналов. Для проникновения в клетки пипетку 200 мкл 0,125% Тритона X-100/PBS и вводят половину ее во входное отверстие капиллярного канала. Отпустите наконечник пипетки внутрь входного отверстия.
- Пипетка 200 мкл 0,125% тритона X-100/PBS и вводит половину его во входной канал мочевыводящих путей. Отпустите наконечник пипетки внутрь входного отверстия. Инкубировать чип при комнатной температуре в течение 5 мин.
- Выбросьте все наконечники пипеток. Вводите чистые, пустые наконечники P200 в выходные отверстия мочевого и капиллярного каналов. Чтобы блокировать клетки, пипетку 200 мкл 1% бычьего сывороточного альбумина (BSA) в 0,125% Triton X-100/PBS и вводят половину его во входной капиллярный канал. Отпустите наконечник пипетки внутрь входного отверстия.
- Пипетка 200 мкл 1% BSA в 0,125% Triton X-100/PBS и вводит половину его во входной канал мочевыводящих путей. Отпустите наконечник пипетки внутрь входного отверстия. Инкубировать при комнатной температуре в течение 30 мин.
- Выбросьте все наконечники пипеток. Промывайте оба канала 3x путем пипетки 200 мкл 0,125% Triton X-100/PBS в каждый канал и инкубации при комнатной температуре в течение 5 мин.
- Готовят 100 мкл первичного антитела на канал с рекомендуемым производителем разведением в 0,125% Triton X-100/PBS. Вводите чистые, пустые наконечники P200 в выходные отверстия мочевого и капиллярного каналов. Пипетка 100 мкл первичного антитела и вводит половину в соответствующие каналы. Отпустите наконечник пипетки внутрь входного отверстия.
- Инкубировать в течение 1 ч при комнатной температуре или, для лучшего результата, на ночь при 4 °C.
ПРИМЕЧАНИЕ: Несколько первичных антител могут применяться одновременно; однако раствор первичного антитела должен быть разбавлен в соответствии с инструкциями производителя. - Промывайте каналы 3 x 10 мин, как описано в шаге 8.2.8.
- Готовят 100 мкл вторичного антитела на канал с рекомендуемым производителем коэффициентом разбавления в 0,125% Triton X-100/PBS. Вводите чистые, пустые наконечники P200 в выходные отверстия мочевого и капиллярного каналов. Пипетка 100 мкл вторичного антитела и вводит половину в соответствующие каналы. Отпустите наконечники пипетки внутри входного отверстия. Инкубировать в течение 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Каждое вторичное антитело должно применяться отдельно. Промывайте не менее 3 х 10 минут между каждым нанесением в соответствии с этапом 8.2.8. - Промывайте каналы 3 x 10 мин, как описано в шаге 8.2.8.
- Промывайте оба канала один раз 200 мкл дистиллированной воды, аспирируя остаточную жидкость с периферии выходных отверстий чипа.
- Вводите чистый, пустой P200 в выходные отверстия мочевого и капиллярного каналов. Для контрокрашения клеток пипетку 200 мкл 4',6-диамидино-2-фенилиндола (DAPI, разведение 1:1000 в дистиллированной воде) и вводят половину ее во входной капиллярный канал. Отпустите наконечник пипетки внутрь входного отверстия, а пипетку 200 мкл DAPI и введите половину ее во входное отверстие мочевого канала. Отпустите наконечник пипетки внутрь входного отверстия и инкубируйте при комнатной температуре в течение 5 минут.
- Выбросьте все наконечники пипеток. Вводите чистые, пустые наконечники P200 в выходные отверстия мочевого и капиллярного каналов. Чтобы контрокрашить клетки, пипетку 200 мкл фаллоидина (разведение 1:1000 в PBS без Ca2+ и Mg2+) и вводят половину ее во входное отверстие капиллярного канала и освобождают наконечник пипетки внутри входного отверстия. Пипетка 200 мкл фаллоидина (разведение 1:1000 в PBS без Ca2+ и Mg2+) и вводят половину его во входное отверстие мочевого канала и освобождают кончик пипетки внутри входного отверстия. Инкубировать при комнатной температуре в течение 15 мин.
- Промывайте каналы 3x 200 мкл PBS без Ca2+ и Mg2+ и аспирируйте избыточную жидкость с периферии выходных портов.
- Визуализируйте чипы.
Результаты
Здесь мы показываем, что функциональная 3D-модель клубочка in vitro может быть васкуляризирована и эпителизирована из изогенного источника человеческих iPS-клеток. В частности, этот протокол предоставляет инструкции о том, как применять технологию iPS-клеток человека, в частности, их способность дифференцироваться в специализированные типы клеток, генерировать почечный клубочковый эпителий (подоциты) и сосудистый эндотелий (viECs), которые могут быть интегрированы с микрофлюидными устройствами для моделирования структуры и функции почки человека на уровне конкретного пациента. Схематический обзор этого протокола и временной шкалы (рисунок 1A) описывает, как культивировать митотически активные iPS-клетки человека (рисунок 1B), а затем дифференцировать их (параллельно) в клеточные линии мезодермы и латеральной мезодермы (рисунок 1C, D). Было обнаружено, что полученные клетки мезодермы экспрессируют брахиурию (Т), в то время как боковые клетки мезодермы экспрессируют брахиурию (Т), MIXL и EOMES 2,9,10,11.
Последующая дифференцировка клеток мезодермы продуцировала промежуточные клетки мезодермы (IM), в то время как дифференцировка боковых клеток мезодермы продуцировала viECs (Рисунок 1D)2,10,11,17. Анализ проточной цитометрии использовался для изучения экспрессии CD144 в дифференцированных viEC (до и после сортировки MAC) по сравнению с отрицательными контрольными группами (включая окрашенные и недифференцированные iPS-клетки человека и неокрашенный эндотелий). Оптимизированная эндотелиальная дифференцировка приведет к образованию 50% или более CD31/CD144-положительных клеток до сортировки MAC, что значительно улучшится после сортировки клеток по сравнению с контрольной группой. Репрезентативные результаты показывают эффективность дифференцировки CD144 до сортировки MAC, которая увеличилась до 77% или более CD144-положительных клеток (не включая CD31-положительные клетки) после сортировки MAC (рисунок 1E).
На 14-й день этого протокола (до завершения дифференцировки IM и расширения viEC) устройства «орган-на-чипе» были подготовлены к посеву клеток путем плазматической обработки и функционализации с базальной мембранной матрицей 2. На следующий день (15-й день протокола) viEC были засеяны в капиллярный (нижний) канал микрофлюидного устройства со средой viEC. На следующий день после посева viEC (16-й день протокола) IM-клетки были засеяны в мочевой (верхний) канал микрофлюидного устройства со средой индукции подоцитов. На следующий день после посева im-клеток (день 17 этого протокола) на чипы клубочкового слоя был нанесен расход жидкости 60 мкл/ч и 10% деформация при 0,4 Гц. Эти чипы испытывают напряжение сдвига 0,017дин см−2 и 0,0007дина см−2 в капиллярном и мочевом каналах соответственно 2,12. После 5 дней индукции подоцитов и 6 дней распространения эндотелия сосудов в чипе (день 21 настоящего протокола) (рисунок 2А) полученные клетки внутри клубочковых чипов экспрессировали маркеры идентификации линии.
В частности, у подоцитов в мочевом канале экспрессировали подоцин и нефрин (рисунок 2B, верхняя панель), а в viEC в капиллярном канале экспрессировали PECAM-1 (CD31) и VE-Cadherin (CD144) (рисунок 2B, нижняя панель). Кроме того, как в слоях подоцитов, так и в слоях viEC экспрессировался коллаген IV, наиболее распространенный белок GBM (рисунок 2B) в почечном клубочке. Больше коллагена IV экспрессируется в мочевом канале, потому что подоциты являются преобладающими продуцентами коллагена IV, включая изоформу α3α4α5, которая является основной изоформой гетеротримера коллагена в зрелом клубочке. Кроме того, у размножающихся в клубочковых чипах подоцитах развивались ножные отростки и секретировались VEGF165, оба из которых являются характерными чертами функциональных моделей почечного клубочка 2,12. Этот протокол также обеспечивает оценку селективной молекулярной фильтрационной функции почечного клубочка с использованием инулина и альбумина, из которых чипы клубочков избирательно фильтруют мелкие молекулы (инулин) из капилляра в мочевой канал, предотвращая при этом выход крупных белков (альбумина) из капиллярного канала (Рисунок 2C)2,10,12.
Поскольку каждая клеточная линия iPS человека демонстрирует врожденные различия во времени удвоения, важно отметить, что оптимальная плотность посева клеток для разных клеточных линий может варьироваться и, следовательно, должна быть оптимизирована исследователем. Для дифференцировки эндотелиальных клеток, если плотность посева iPS-клеток человека слишком низкая, исследователь может наблюдать более низкий выход дифференцированных эндотелиальных клеток (эффективность <30%). Если плотность посева человеческих iPS-клеток слишком высока, исследователь может наблюдать быстрый чрезмерный рост клеток, отслоение или более плохую адгезию, повышенную гибель клеток и низкий выход (эффективность <30%). Во время эндотелиальной индукции (4-7 дни дифференцировки) увеличение количества клеток, приводящее к вторичному слою клеток, является нормальным, но должно быть сведено к минимуму (рисунок 3А). Для дифференцировки IM и подоцитов пересеивание iPS-клеток человека (>100 000 клеток / лунка 12-луночной пластины) может привести к тому, что IM-клетки растут в больших кластерах или образуют агрегаты, что может препятствовать дифференцировке и приводить к появлению подоцитов с менее зрелым морфологическим фенотипом агрегированных клеток и менее вторичными и/или третичными процессами стопы10, 11.
Во время микрофлюидной культуры чипа может наблюдаться неожиданный перекрестный поток жидкости между мочевым и капиллярным каналами (рисунок 3B), если происходит разрыв или неадекватная связь компонентов чипа PDMS или если путь потока жидкости заблокирован. Этот нежелательный поток жидкости может также быть результатом скомпрометированного фильтрационного барьера, такого как модели тканей от неадекватного (низкого) посева клеток или поврежденных клеточных слоев. Чтобы предотвратить эту проблему, рекомендуется, чтобы исследователь следовал рекомендуемому протоколу и плотности посева клеток, а также визуально осматривал чипы на наличие пузырьков воздуха в каналах на каждом этапе процесса. Если пузырьки воздуха наблюдаются в резервуарах сред микрофлюидных чипов, которые находятся под потоком жидкости, насос может быть остановлен, а среда дегазирована в стерильных условиях.
Вместе этот протокол и репрезентативные результаты описывают происхождение эндотелия сосудов (viECs) и клубочкового эпителия (подоцитов) из изогенной клеточной линии iPS человека и их восстановление в микрофлюидном устройстве «орган на чипе» для повторения структуры и функции почечного клубочкового фильтрационного барьера в зависимости от пациента.
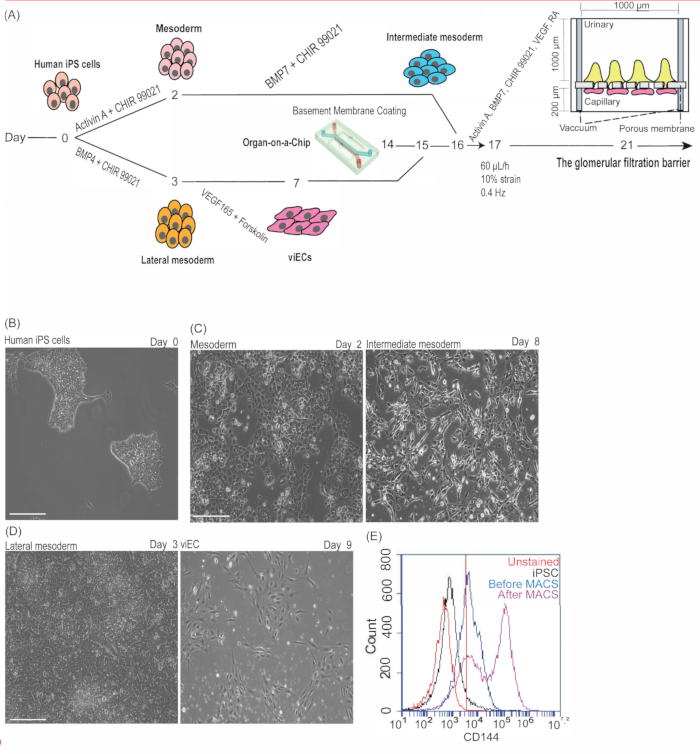
Рисунок 1: Получение изогенного клубочкового эпителия и эндотелия сосудов из iPS-клеток человека. (A) Схематическая временная шкала промежуточной индукции мезодермы и viEC, конструкция органа на чипе и покрытие матрицы базальной мембраны, посев клеток в чип и индукция подоцитов внутри чипа. (B) Репрезентативные изображения PGP1 человеческих iPS-клеток до диссоциации в день 0 протокола. (C) Репрезентативные изображения клеток мезодермы PGP1 на 2-й день дифференцировки (слева) и промежуточных клеток мезодермы на 8-й день дифференцировки (справа). (D) Репрезентативные изображения боковых клеток мезодермы PGP1 на 3-й день дифференцировки (слева) и PGP1 viECs на 9-й день дифференцировки (2 дня расширения) (справа). Шкала стержней = 275 мкм (B-D). (E) Количественная оценка дифференцировки viEC с помощью анализа проточной цитометрии для CD144-положительных клеток на 7-й день дифференцировки эндотелиальных клеток до MACS (синий) и на 9-й день расширения эндотелиальных клеток после MACS (розовый) по сравнению с CD144-окрашенными человеческими ИПСК (черные) и неокрашенными эндотелиальными клетками (красный). Эта цифра была изменена с12. Сокращения: iPSCs = индуцированные плюрипотентные стволовые клетки; viEC = сосудистые эндотелиальные клетки; BMP4/7 = костный морфогенетический белок 4/7; РА = ретиноевая кислота; VEGF = фактор роста эндотелия сосудов; MACS = сортировка ячеек с магнитной активацией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативные изображения эндотелия сосудов и клубочкового эпителия (слоя подоцитов), культивируемых в микрофлюидном чипе почечного клубочка. Репрезентативные яркие изображения viEC (слева) и клубочкового эпителия (подоциты) (справа), распространяемые в чипе клубочка. Шкала баров = 183 мкм. (B) Репрезентативные иммунофлуоресцентные изображения клубочкового эпителия (подоцитов) и viEC, показывающие экспрессию линейных маркеров. Шкала стержней = 100 мкм. (C) Репрезентативные данные, показывающие селективную молекулярную фильтрацию в чипе клубочка. Полосы погрешностей представляют SD. p < 0,0001. Эта цифра воспроизводится из 12. Сокращения: viECs = сосудистые эндотелиальные клетки; VE-кадгерин = CD144; PECAM-1 (= CD31) = молекула адгезии эндотелиальных клеток тромбоцитов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
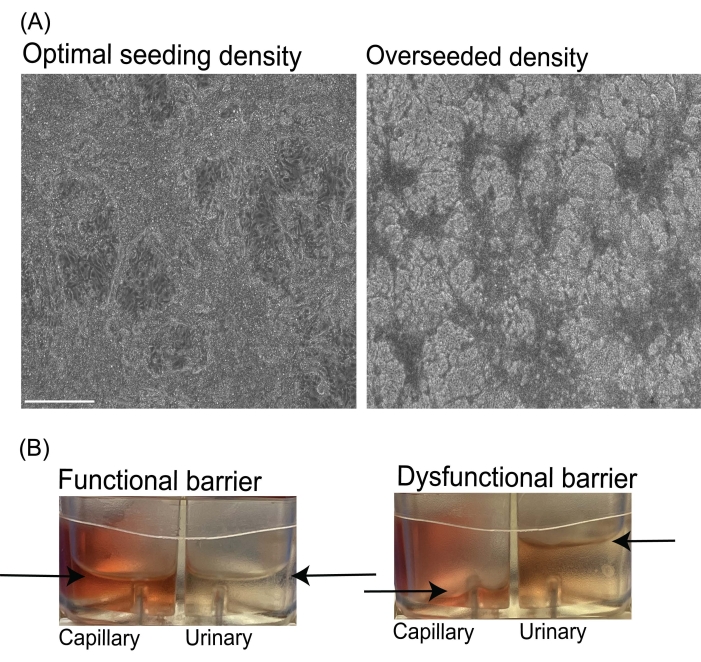
Рисунок 3: Изображения субоптимальной плотности посева эндотелия и неравномерного потока жидкости в микрофлюидных чипах. (A) Репрезентативные яркие изображения оптимальных (слева) и пересеянных (справа) клеточных культур на 6-й день дифференцировки viEC. Шкала баров = 275 мкм. (B) Репрезентативные изображения выходных резервуаров из микрофлюидных чипов с равномерным потоком жидкости и функциональным барьером (слева). Изображение с чипа с неравномерным потоком жидкости или дисфункциональным барьером (справа). Стрелки обозначают уровни жидкости в выходных резервуарах капиллярного и мочевого каналов чипсов. Аббревиатура: viECs = сосудистые эндотелиальные клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Проточная цитометрия, ИФА для сточных вод чипа и изоляция мРНК. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S1: Установки материала для культивирования в тканях. (A) Материал для культивирования в тканях, установленный для MACS, включая ведро со льдом со средой, магнит на магнитной подставке и конические трубки под магнитом. (B) Установка внутритканевого культурального капюшона чашки Петри для чипсов, с верхом, обращенным вниз, под дном чашки Петри. Аббревиатура: MACS = магнитно-активированная сортировка ячеек. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица S1: Носители и буферы, используемые в этом протоколе. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В этом отчете мы описываем протокол для получения эндотелия сосудов и клубочкового эпителия (подоцитов) из изогенной клеточной линии iPS человека и использование этих клеток для разработки 3D-системы «орган на чипе», которая имитирует структуру, интерфейс ткани-ткань и молекулярную фильтрационную функцию почечного клубочка. Этот клубочковый чип оснащен эндотелием и клубочковым эпителием, которые вместе обеспечивают барьер для селективной фильтрации молекул.
Исследователи, заинтересованные в адаптации этого протокола, должны сделать следующие соображения: во-первых, оптимизация может быть необходима для посева клеток в зависимости от присущих характеристик роста используемых линий стволовых клеток. Плотность посева клеток может варьироваться из-за внутренних различий в скорости пролиферации iPS-клеток человека. Рекомендуется, чтобы исследователи начали с плотности посева мезодермы, предложенной протоколом, а затем при необходимости скорректировали. Аналогичным образом, рекомендуется, чтобы латеральная дифференцировка мезодермы начиналась с предлагаемой плотности посева клеток перед корректировкой по мере необходимости для достижения урожайности viEC и эффективности сортировки 50% или более. Если достаточное количество клеток не дифференцировано после сортировки, ингибитор TGF-Beta (SB431542) может быть использован для предотвращения покоя и экспоненциального расширения viEC (прошлый пассаж 3). Однако некоторые клеточные процессы или сигнальные пути зависят от TGF-Beta (например, патогенез гипергликемии/диабета, иммунный гомеостаз); Таким образом, исследователям рекомендуется учитывать влияние ингибирования TGF-бета на последующий анализ или обеспечить адекватное тестирование, чтобы избежать непреднамеренных экспериментальных результатов.
Во-вторых, важно отметить возможные различия в качестве реагента и спецификациях производителя, особенно для компонентов, приобретенных у поставщиков, отличных от тех, которые указаны в протоколе. Таким образом, исследователю рекомендуется тестировать реагенты из разных номеров партий, поставщиков и продавцов для обеспечения воспроизводимости экспериментов и результатов. Как правило, исследователь должен избегать чрезмерного воздействия на человеческие iPS-клетки ферментов диссоциации в буферах отслоения, поскольку это может привести к снижению жизнеспособности клеток и изменению молекулярного профиля клеток. Кроме того, среда индукции подоцитов должна быть защищена от света, чтобы предотвратить инактивацию всей трансретиноевой кислоты. В-третьих, во время культивирования клеток «орган на чипе» важно избегать пузырьков воздуха в каналах микрофлюидного устройства при перфузии чипов. Появление пузырьков воздуха может быть сведено к минимуму или предотвращено путем регулярного осмотра стружки во время посева клеток, путем поддержания контакта жидкости с жидкостью на каждом этапе, включающем перфузию стружки, и путем не проталкивания или втягивания воздуха в жидкостные каналы при использовании кончиков пипетки и/или аспирации.
Предыдущие усилия по разработке чипов почечного клубочка с генетически подобранным эпителием и эндотелием основывались на использовании клеток животного происхождения1. Хотя эти клеточные линии животного происхождения традиционно использовались для доклинических исследований, они часто не могут повторить физиологические реакции человека, которые способствуют высокой частоте неудач (89,5%) клинических испытаний на людях18. Чтобы помочь преодолеть некоторые из этих проблем, желательны функциональные модели in vitro, которые более точно повторяют биологию человека. Достигнут прогресс в разработке многоклеточных моделей почек человека; однако клубочковые чипы использовали человеческие клетки из гетерогенных, неизогенных источников. Например, ранее мы установили чип клубочков, восстановленный из человеческих подоцитов, полученных из iPS-клеток, и первичного тканевого эндотелия10. В исследованиях других исследовательских групп использовалась смесь первичных клеток 4,9, увековеченных клеток3 или клеток, полученных из амниотической жидкости 3,6, которые ограничивают их использование для изучения специфических для пациента реакций или приложений в персонализированной медицине.
Протокол, описанный в настоящем описании, преодолевает эти ограничения, позволяя получать как сосудистый эндотелий (viECs), так и клубочковый эпителий (подоциты) из одной и той же клеточной линии iPS человека и интегрируя эти клетки в компартментализованные микрофлюидные устройства «орган на чипе» для моделирования структуры и функции стенки клубочкового капилляра почки in vitro . Учитывая неограниченное самообновление человеческих iPS-клеток в сочетании с их способностью дифференцироваться практически в любой тип клеток, этот протокол также обеспечивает путь для непрерывного поиска человеческих подоцитов и виЭК для тканевой инженерии и других биомедицинских применений. Этот подход к получению подоцитов и viEC был воспроизведен в нескольких специфических для пациента клеточных линиях iPS человека, включая PGP1- и DU11 2,10,12,17,19, что позволило создать персонализированные чипы почечных клубочков из желаемых популяций пациентов.
Стратегия дифференциации подоцитов в микрофлюидных чипах позволяет механистически изучать развивающийся почечный клубочек человека и моделировать заболевания. Однако изучение развивающегося клубочка почек человека ограничено виЭК, требующими сортировки для обогащения для желаемой популяции. Эта работа могла бы выиграть от разработки методов дифференциации виЭК без необходимости отбора субпопуляций. Это исследование также ограничено толстой мембраной PDMS, которая разделяет клеточные слои эндотелия сосудов и подоцитов. Будущая работа может интегрировать новые биоматериалы для замены толстой PDMS, чтобы лучше имитировать молекулярные и биофизические свойства клубочковой базальной мембраны. Например, альтернативная мембрана может быть спроектирована таким образом, чтобы обладать биоразлагаемыми качествами с перестраиваемой пористостью и быть тоньше (более похожей на GBM), чем мембрана PDMS толщиной 50 мкм, используемая в этом протоколе.
Тем не менее, чип клубочка, полученный по этому протоколу, может быть применен для изучения механизмов изнурительных заболеваний почек и служить платформой для тестирования нефротоксичности и открытия лекарств. Поскольку человеческие iPS-клетки поддерживают генетический профиль донора, а чип клубочка способен моделировать заболевание почек12, в будущем могут быть обнаружены новые терапевтические мишени, которые принесут пользу тем, кто страдает от наследственных форм заболевания почек. Кроме того, специфические для пациента биологические реакции на посттрансплантационные препараты могут быть более точно оценены с использованием изогенного почечного чипа, такого как описанный в этом исследовании. Наконец, этот чип клубочка предназначен для изучения эффектов динамики жидкости и дифференциального механического напряжения, таких как те, которые наблюдаются у пациентов с заболеваниями почек с гипертонией или сердечно-почечным синдромом, учитывая относительную легкость модуляции скорости потока жидкости, растяжения тканей или механического напряжения. Вполне возможно, что этот протокол может продвинуть текущее понимание развития почек человека и механизмов заболевания, а также облегчить разработку персонализированных терапевтических средств в будущем.
Раскрытие информации
С.М. является изобретателем патента, связанного с дифференцировкой подоцитов из iPS-клеток человека. Другому автору нечего раскрывать.
Благодарности
Эта работа была поддержана Инженерной школой Пратта в Университете Дьюка, Отделом нефрологии в Департаменте медицины Дьюка, стипендией Уайтхеда в области биомедицинских исследований и премией Genentech Research Award для С. Мусы. Ю. Рой является стипендиатом Университета Дьюка-Альфреда. Слоуна и стипендии Уильяма М. «Монти» Райхерта с факультета биомедицинской инженерии Университета Дьюка. Клеточная линия iPS DU11 (клон #11 Университета Дьюка) была сгенерирована на объекте Duke iPSC Core Facility и предоставлена нам лабораторией Bursac в Университете Дьюка. Авторы благодарят Н. Абуталеба, Дж. Холмса, Р. Бхаттачарью и Ю. Чжоу за техническую помощь и полезные обсуждения. Авторы также хотели бы поблагодарить членов лаборатории Мусах за полезные комментарии к рукописи. Авторы благодарят лабораторию Segura за подарок проточного цитометра Acuri C6.
Материалы
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488- and Alexa Fluor 594-conjugated secondary antibodies | Thermo/Life Technologies | A32744; A32754; A-11076; A32790; A21203; A11015 | |
| Collagen IV | Thermo/Life Technologies | 14-9871-82 | |
| Nephrin | Progen | GP-N2 | |
| PECAM-1 | R&D Systems | AF806 | |
| Podocin | Abcam | ab50339 | |
| VE-Cadherin | Santa Cruz | sc-9989 | |
| Basement membrane matrices | |||
| Corning Fibronectin, Human | Corning | 356008 | Basement membrane (3) |
| iMatrix-511 Laminin-E8 (LM-E8) fragment | Iwai North America | N8922012 | Basement membrane matrix (2) |
| Matrigel hESC-qualified matrix, 5-mL vial | BD Biosciences | 354277 | Basement membrane matrix (1); may show lot-to-lot variation |
| Cells | |||
| DU11 human iPS cells | The DU11 (Duke University clone #11) iPS cell line was generated at the Duke iPSC Core Facility and provided to us by the Bursac Lab at Duke University. The line has been tested and found to be free of mycoplasma (last test in November 2021) and karyotype abnormalities (July 2019) | ||
| Culture medium growth factors and media supplements | |||
| 0.5M EDTA, pH 8.0 | Invitrogen | 15575020 | |
| 2-Mercaptoethanol | Thermo/Life Technologies | 21985023 | |
| Albumin from Bovine serum, Texas Red conjugate | Thermo/Life Technologies | A23017 | |
| All-trans retinoic acid (500 mg) | Stem Cell Technologies | 72262 | |
| B27 serum-free supplement | Thermo/Life Technologies | 17504044 | |
| B-27 supplement (50x) without Vitamin A | Thermo/Life Technologies | 12587010 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| CHIR99021 | Stemgent | 04-0004 | May show lot-to-lot variation |
| Complete medium kit with CultureBoost-R | Cell Systems | 4Z0-500-R | Podocyte maintenance media |
| DMEM/F12 | Thermo/Life Technologies | 12634028 | |
| DMEM/F12 with GlutaMAX supplement | Thermo/Life Technologies | 10565042 | DMEM/F12 with glutamine |
| Forskolin (Adenylyl cyclase activator) | Abcam | ab120058 | |
| GlutaMAX supplement | Thermo/Life Technologies | 35050061 | glutamine supplement |
| Heat-inactivated FBS | Thermo/Life Technologies | 10082147 | |
| Heparin solution | Stem Cell Technologies | 7980 | |
| Human Activin A | Thermo/Life Technologies | PHC9544 | |
| Human BMP4 | Preprotech | 120-05ET | |
| Human BMP7 | Thermo/Life Technologies | PHC9544 | |
| Human VEGF | Thermo/Life Technologies | PHC9394 | |
| Inulin-FITC | Sigma-Aldrich | F3272 | |
| mTeSR1 medium | Stem Cell Technologies | 05850 | Human iPS cell culture media (CCM). Add 5x supplement according to the manufacturer. Human iPS CCM can be stored for up to 6 months at -20 °C. |
| N-2 Supplement (100x) | Thermo/Life Technologies | 17502048 | |
| Neurobasal media | Thermo/Life Technologies | 21103049 | Lateral mesoderm basal media |
| PBS (Phosphate-buffered saline) | Thermo/Life Technologies | 14190-250 | |
| Penicillin-streptomycin, liquid (100x) | Thermo/Life Technologies | 15140-163 | |
| ROCK inhibitor (Y27632) | Tocris | 1254 | |
| StemPro-34 SFM | Thermo/Life Technologies | 10639011 | Endothelial cell culture medium (CCM). Add supplement according to manufacturer. Endothelial CCM can be stored for up to two weeks at 4 °C or -20 °C for up to 6 months. |
| TGF-Beta inhibitor (SB431542) | Stem Cell Technologies | 72234 | |
| Enzymes and other reagents | |||
| Accutase | Thermo/Life Technologies | A1110501 | Cell detachment buffer |
| Dimethyl Suloxide (DMSO) | Sigma-Aldrich | D2438 | |
| Ethanol solution, 70% (vol/vol), biotechnology grade | VWR | 97065-058 | |
| Paraformaldehyde (PFA) | Thermo/Life Technologies | 28906 | |
| Sterile distilled water | Thermo/Life Technologies | 15230162 | |
| Triton X-100 | VWR | 97062-208 | |
| Equipment | |||
| Trypsin EDTA, 0.05% | Thermo/Life Technologies | 25300-120 | |
| (Orb) Hub module | Emulate | ORB-HM1 | |
| 100mm x 15 mm round petri dish | Fisherbrand | FB087579B | |
| 120 x 120 mm square cell culture dish | VWR | 688161 | |
| Accuri C6 | BD Biosciences | ||
| Aspirating pipettes, individually wrapped | Corning | 29442-462 | |
| Aspirating Unit | SP Bel-Art | F19917-0150 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99516 | |
| Conical centrifuge tube, 15 mL | Corning | 352097 | |
| Conical centrifuge tube, 50 mL | Corning | 352098 | |
| EVOS M7000 | Thermo/Life Technologies | AMF7000 | Fluorescent microscope to take images of fixed and stained cells. |
| Hemocytometer | VWR | 100503-092 | |
| Heracell VIOS 160i CO2 incubator | Thermo/Life Technologies | 51030403 | |
| Inverted Zeiss Axio Observer equipeed with AxioCam 503 camera | Carl Zeiss Micrscopy | 491916-0001-000(microscope) ; 426558-0000-000(camera) | |
| Kimberly-Clark nitrile gloves | VWR | 40101-346 | |
| Kimwipes, large | VWR | 21905-049 | |
| Leoca SP8 Upright Confocal Microscope | |||
| Media reservoir (POD Portable Module) | Emulate | POD-1 | |
| Microplate shaker | VWR | 12620-926 | |
| Organ-chip | Emulate | S-1 Chip | |
| Organ-chip holder | Emulate | AK-CCR | |
| P10 precision barrier pipette tips | Denville Scientific | P1096-FR | |
| P100 barrier pipette tips | Denville Scientific | P1125 | |
| P1000 barrier pipette tips | Denville Scientific | P1121 | |
| P20 barrier pipette tips | Denville Scientific | P1122 | |
| P200 barrier pipette tips | Denville Scientific | P1122 | |
| Plasma Asher | Quorum tech | K1050X RF | This Plasma Etcher/Asher/Cleaner was used as a part of Duke University's Shared Materials Instrumentation Facility (SMiF). |
| Round bottom polystyrene test tube with cell strainer snap cap | Corning | 352235 | |
| Serological pipette, 10 mL, indivdually wrapped | Corning | 356551 | |
| Serological pipette, 25 mL, indivdually wrapped | Corning | 356525 | |
| Serological pipette, 5 mL, indivdually wrapped | Corning | 356543 | |
| Steriflip, 0.22 µm, PES | EMD Millipore | SCGP00525 | |
| Sterile Microcentrifuge tubes | Thomas Scientific | 1138W14 | |
| T75cm2 cell culture flask with vent cap | Corning | 430641U | |
| Tissue culture-treated 12 well plates | Corning | 353043 | |
| Tissue culture-treated 6 well plates | Corning | 353046 | |
| Vacuum modulator and perstaltic pump (Zoe Culture Module) | Emulate | ZOE-CM1 | Organ Chip Bioreactor |
| VE-Cadherin CD144 anti-human antibody - APC conjugated | Miltenyi Biotec | 130-126-010 | |
| Wide-beveled cell lifter | Corning | 3008 | |
| MACS | |||
| CD144 MicroBeads, human | Miltenyi Biotec | 130-097-857 | |
| CD31 MicroBead Kit, human | Miltenyi Biotec | 130-091-935 | |
| LS columns | Miltenyi Biotec | 130-042-401 |
Ссылки
- Wang, L., et al. A disease model of diabetic nephropathy in a glomerulus-on-a-chip microdevice. Lab on a Chip. 17 (10), 1749-1760 (2017).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), 1-12 (2017).
- Petrosyan, A., et al. A glomerulus-on-a-chip to recapitulate the human glomerular filtration barrier. Nature Communications. 10 (1), 3656 (2019).
- Hass, R., Kasper, C., Böhm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling. 9, 12 (2011).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: when do differences make a difference. Cell. 141 (4), 559-563 (2010).
- Da Sacco, S., et al. A novel source of cultured podocytes. PloS One. 8 (12), 81812 (2013).
- Singh, V. K., Kalsan, M., Kumar, N., Saini, A., Chandra, R. Induced pluripotent stem cells: applications in regenerative medicine, disease modeling, and drug discovery. Frontiers in Cell and Developmental Biology. 3, 2 (2015).
- Ebert, A. D., Liang, P., Wu, J. C. Induced pluripotent stem cells as a disease modeling and drug screening platform. Journal of cardiovascular pharmacology. 60 (4), 408-416 (2012).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Roye, Y. A personalized glomerulus chip engineered from stem cell-derived epithelium and vascular endothelium. Micromachines. 12 (8), 967 (2021).
- Roselli, S., et al. Podocin localizes in the kidney to the slit diaphragm area. The American Journal of Pathology. 160 (1), 131-139 (2002).
- Ruotsalainen, V., et al. Nephrin is specifically located at the slit diaphragm of glomerular podocytes. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7962-7967 (1999).
- Privratsky, J. R., Newman, P. J. PECAM-1: regulator of endothelial junctional integrity. Cell and Tissue Research. 355 (3), 607-619 (2014).
- Menon, M. C., Chuang, P. Y., He, C. J. The glomerular filtration barrier: components and crosstalk. International Journal of Nephrology. 2012, 749010 (2012).
- Abutaleb, N. O., Truskey, G. A. Differentiation and characterization of human iPSC-derived vascular endothelial cells under physiological shear stress. STAR Protocols. 2 (2), 100394 (2021).
- Pammolli, F., Magazzini, L., Riccaboni, M. The productivity crisis in pharmaceutical R&D. Nature Reviews. Drug Discovery. 10 (6), 428-438 (2011).
- Atchison, L., et al. iPSC-derived endothelial cells affect vascular function in a tissue-engineered blood vessel model of Hutchinson-Gilford progeria syndrome. Stem Cell Reports. 14 (2), 325-337 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены