Method Article
Puce de glomérule rénal isogénique conçue à partir de cellules souches pluripotentes induites par l’homme
Dans cet article
Résumé
Un protocole visant à concevoir un système personnalisé d’organe sur puce qui récapitule la structure et la fonction de la barrière de filtration glomérulaire rénal en intégrant des cellules endothéliales épithéliales et vasculaires génétiquement appariées différenciées des cellules souches pluripotentes induites par l’homme. Ce système de bio-ingénierie peut faire progresser la médecine de précision rénale et les applications connexes.
Résumé
L’insuffisance rénale chronique (IRC) affecte 15% de la population adulte américaine, mais la mise en place de thérapies ciblées a été limitée par le manque de modèles fonctionnels capables de prédire avec précision les réponses biologiques humaines et la néphrotoxicité. Les progrès de la médecine rénale de précision pourraient aider à surmonter ces limites. Cependant, les modèles in vitro précédemment établis du glomérule rénal humain - le site principal pour la filtration du sang et une cible clé de nombreuses maladies et toxicités médicamenteuses - utilisent généralement des populations cellulaires hétérogènes avec des caractéristiques fonctionnelles limitées et des antécédents génétiques inégalés. Ces caractéristiques limitent considérablement leur application pour la modélisation de maladies spécifiques au patient et la découverte thérapeutique.
Cet article présente un protocole qui intègre l’épithélium glomérulaire (podocytes) dérivé de cellules souches pluripotentes induites humaines (iPS) et l’endothélium vasculaire d’un seul patient pour concevoir une puce de glomérule rénal microfluidique isogénique et vascularisée. La puce glomérule résultante est composée de couches de cellules endothéliales et épithéliales dérivées de cellules souches qui expriment des marqueurs spécifiques à la lignée, produisent des protéines de membrane basale et forment une interface tissu-tissu ressemblant à la barrière de filtration glomérulaire du rein. La puce de glomérule modifiée filtre sélectivement les molécules et récapitule les lésions rénales induites par les médicaments. La capacité de reconstituer la structure et la fonction du glomérule rénal à l’aide de types de cellules isogéniques crée la possibilité de modéliser la maladie rénale avec la spécificité du patient et de faire progresser l’utilité des organes sur puce pour la médecine rénale de précision et les applications connexes.
Introduction
Les dispositifs d’organe sur puce sont des modèles 3D dynamiques in vitro qui utilisent la stimulation moléculaire et mécanique, ainsi que la vascularisation, pour former des interfaces tissus-tissus qui modélisent la structure et la fonction d’organes spécifiques. Les dispositifs d’organe sur puce précédemment établis qui visaient à récapituler le glomérule du rein (puces de glomérule) étaient constitués de lignées cellulaires animales1 ou de lignées cellulaires primaires et immortalisées humaines de sources hétérogènes 2,3. L’utilisation de sources cellulaires génétiquement hétérogènes présente des variations qui limitent considérablement les études des réponses spécifiques aux patients et de la génétique ou des mécanismes de la maladie 4,5. Pour relever ce défi, il faut disposer de lignées cellulaires isogéniques provenant d’individus spécifiques ayant des profils moléculaires et génétiques préservés afin de fournir un microenvironnement plus précis pour l’ingénierie de modèles in vitro 2,3,6. Les lignées cellulaires isogéniques d’origine humaine peuvent maintenant être facilement générées grâce aux progrès de la culture cellulaire iPS humaine. Parce que les cellules iPS humaines sont généralement d’origine non invasive, peuvent s’auto-renouveler indéfiniment et se différencier en presque n’importe quel type de cellule, elles servent de source attrayante de cellules pour l’établissement de modèles in vitro, tels que la puce glomérule 7,8. La barrière de filtration glomérulaire est le site principal de filtration du sang. Le sang est d’abord filtré par l’endothélium vasculaire, la membrane basale glomérulaire, et enfin par un épithélium spécialisé appelé podocytes. Les trois composants de la barrière de filtration contribuent à la filtration sélective des molécules. Un protocole visant à établir un dispositif d’organe sur puce interfacé avec l’endothélium vasculaire et l’épithélium glomérulaire à partir d’une seule source de cellules iPS humaines est présenté. Bien que ce protocole soit particulièrement utile pour concevoir une puce isogénique et vascularisée pour récapituler la barrière de filtration glomérulaire, il fournit également un plan pour le développement d’autres types d’organes sur puce personnalisés et de plates-formes multi-organes telles qu’un système isogénique « corps sur puce ».
Le protocole décrit ici commence par une différenciation divergente des cellules iPS humaines en deux lignées distinctes - les cellules mésodermiques latérales et mésodermiques, qui sont ensuite différenciées en endothélium vasculaire et épithélium glomérulaire, respectivement. Pour générer des cellules mésodermiques latérales, des cellules iPS humaines ont été ensemencées sur des plaques recouvertes de matrice basale 1 de membrane basale et cultivées pendant 3 jours (sans échange de milieu) dans un milieu N2B27 complété par l’activateur Wnt, CHIR 99021, et le puissant inducteur du mésoderme, os-morphogénétique 4 (BMP4). Les cellules du mésoderme latéral résultantes étaient auparavant caractérisées par l’expression de la brachyurie (T), de l’homéobox mixte (MIXL) et de l’éomésodermine (EOMES)9. Par la suite, les cellules latérales du mésoderme ont été cultivées pendant 4 jours dans un milieu supplémenté en VEGF165 et en forskoline pour induire des cellules endothéliales vasculaires qui ont été triées en fonction de l’expression de VE-Cadhérine et / ou de PECAM-1 en utilisant le tri cellulaire activé magnétiquement (MACS). Les cellules endothéliales vasculaires résultantes (viEC) ont été dilatées en les cultivant sur des flacons recouverts de matrice 3 de membrane basale jusqu’à ce qu’ils soient prêts à être ensemencés dans le dispositif microfluidique.
Pour générer des cellules mésodermiques, des cellules iPS humaines ont été ensemencées sur des plaques recouvertes de matrice 2 membranaires basales et cultivées pendant 2 jours dans un milieu contenant de l’activine A et CHIR99021. Les cellules mésodermiques résultantes ont été caractérisées par l’expression de HAND1, goosecoid et brachury (T) comme décrit précédemment 2,10,11. Pour induire la différenciation cellulaire du mésoderme intermédiaire (IM), les cellules du mésoderme ont été cultivées pendant 14 jours dans un milieu supplémenté en BMP-7 et CHIR99021. Les cellules IM résultantes expriment la tumeur de Wilm 1 (WT1), le gène boîte apparié 2 (PAX2) et la protéine apparentée impair sautée 1 (OSR-1)2,10,11.
Une puce microfluidique à base de polydiméthylsiloxane à deux canaux (PDMS) a été conçue pour récapituler la structure de la barrière de filtration glomérulaire in vitro. Le canal urinaire est de 1 000 μm x 1 000 μm (l x h) et la dimension du canal capillaire est de 1 000 μm x 200 μm (l x h). Les cycles cycliques d’étirement et de relaxation ont été facilités par les chambres creuses présentes de chaque côté des canaux fluidiques. Les cellules ont été ensemencées sur une membrane PDMS flexible (50 μm d’épaisseur) qui sépare les canaux urinaire et capillaire. La membrane est équipée de pores hexagonaux (7 μm de diamètre, 40 μm de distance) pour aider à promouvoir la signalisation intercellulaire (Figure 1A)2,12. Deux jours avant la fin de l’induction de l’IM, les puces microfluidiques ont été recouvertes de la matrice 2 de la membrane basale. Les viECs ont été ensemencés dans le canal capillaire de la puce microfluidique à l’aide d’un milieu d’entretien endothélial 1 jour avant la fin de l’induction IM, et la puce a été retournée pour permettre l’adhésion cellulaire sur la face basale de la membrane PDMS recouverte d’ECM. Le jour où l’induction IM a été terminée, les cellules ont été ensemencées dans le canal urinaire de la puce microfluidique en utilisant un milieu supplémenté en BMP7, Activin A, CHIR99021, VEGF165 et tout l’acide rétinoïque trans pour induire la différenciation des podocytes dans la puce. Le lendemain, les réservoirs de milieux ont été remplis de milieu d’induction de podocyte et de milieu d’entretien endothélial, et une contrainte mécanique de 10 % à 0,4 Hz et un débit de fluide (60 μL/h) ont été appliqués sur les copeaux.
Les puces microfluidiques cellularisées ont été cultivées pendant 5 jours supplémentaires en utilisant le milieu d’induction Podocyte (dans le canal urinaire) et le milieu d’entretien endothélial (dans le canal vasculaire). Les copeaux de glomérule rénal résultants ont été cultivés jusqu’à 7 jours supplémentaires dans des milieux d’entretien pour les cellules podocytiques et endothéliales. Les podocytes différenciés exprimaient positivement les protéines spécifiques de la lignée, y compris la podocine et la néphrine 13,14, tandis que les viEC exprimaient positivement les protéines d’identification de la lignée PECAM-1 et VE-Cadhérine, qui sont toutes des molécules essentielles au maintien de l’intégrité de la barrière de filtration glomérulaire 15,16 . Les podocytes et les viECs se sont tous deux avérés sécréter la protéine de membrane basale glomérulaire la plus abondante, le collagène IV, qui est également importante pour la maturation et la fonction des tissus.
Le système à trois composants de la barrière de filtration - endothélium, membrane basale et épithélium - dans les puces gloméruleuses s’est avéré filtrer sélectivement les molécules et répondre à un traitement médicamenteux chimiothérapeutique néphrotoxique. Les résultats du traitement médicamenteux ont indiqué que la puce du glomérule peut être utilisée pour les études de néphrotoxicité et pour la modélisation de la maladie. Ce protocole fournit la ligne directrice générale pour la conception d’une puce de glomérule rénal microfluidique fonctionnelle à partir de dérivés isogéniques de cellules iPS. Les analyses en aval de la puce artificielle peuvent être effectuées comme le souhaite le chercheur. Pour plus d’informations sur l’utilisation de la puce glomérule pour modéliser les lésions glomérulaires induites par le médicament, reportez-vous aux publications précédentes 2,12.
Protocole
1. Préparer les solutions de matrice membranaire basale et les substrats revêtus
- Décongeler la matrice 1 de la membrane basale pendant la nuit sur la glace à 4 °C. Aliquote selon la suggestion du fabricant pour le taux de dilution. À l’aide d’un tube conique et d’une pipette de 50 mL, bien mélanger une quantité appropriée de matrice membranaire basale 1 dans 25 mL de DMEM/F12 froid jusqu’à décongélation et dissolution complète.
- Pour dissoudre une aliquote congelée, prélever ~200 μL dans les 25 mL de DMEM/F12 froid et les transférer dans le tube aliquote congelé. Pipeter de haut en bas jusqu’à ce que la matrice soit complètement décongelée et dissoute. Transférer le contenu complet du tube de la matrice 1 de la membrane basale dans le reste du DMEM/F12 froid.
- Pipeter 1 mL de solution de matrice 1 de membrane basale dans chaque puits d’une plaque à 6 puits. Pour utiliser les plaques revêtues le jour même, incuber à 37 °C pendant 2 h.
- Alternativement, les plaques revêtues peuvent être enveloppées de parafilm et conservées à 4 ° C jusqu’à 2 semaines. Lorsque vous êtes prêt à utiliser la plaque stockée, incuber à 37 °C pendant 30 min.
- Diluer la matrice membranaire basale 2 dans 9 mL d’eau distillée stérile pour obtenir une concentration finale de 5 μg/mL. Pipeter 700 μL de solution de matrice 2 de membrane basale dans chaque puits d’une plaque de 12 puits. Envelopper les plaques recouvertes de matrice de membrane basale à 2 avec un parafilm et conserver à 4 °C jusqu’à 2 semaines.
- Reconstituer la matrice 3 de la membrane basale lyophilisée pour atteindre une concentration finale de 1 mg/mL dans une solution saline tamponnée au phosphate (sans PBS, Ca+2 et Mg+2), comme suggéré par le fabricant. Diluer une partie aliquote de 250 μL jusqu’à une concentration finale de 25 μg/mL dans 9,75 mL de PBS (Ca+2 et Mg+2 libre). Utiliser 6 mL de cette solution pour enrober une fiole T75 (concentration finale de 2 μg/cm2). Conservez les fioles enduites de matrice à 4 °C jusqu’à 1 semaine.
2. Culture cellulaire iPS humaine
NOTE: La lignée DU11 utilisée dans ce protocole a été testée et s’est avérée exempte d’anomalies des mycoplasmes et des caryotypes.
- Incuber les plaques revêtues de matrice 1 de membrane basale à 37°C pendant 1-2 h.
- Laver chaque puits de la plaque à 6 puits 3x avec 1 mL de DMEM/F12 chaud (37 °C). Ajouter 2 mL de milieu de culture cellulaire iPS humain (CCM) (tableau supplémentaire S1) à chaque puits de la plaque à 6 puits. Incuber les plaques à 37 °C pendant que les cellules sont préparées pour l’ensemencement comme décrit ci-dessous.
- Lavez chaque puits de la plaque à 6 puits contenant des cellules iPS humaines avec 1 mL de DMEM/F12 chaud.
- Aspirez le DMEM/F12. Ajouter 1 mL de tampon de détachement de cellules chaudes à chaque puits de la plaque de 6 puits. Incuber à 37 °C pendant 1 min.
- Inspectez visuellement chaque puits au microscope pour la dissociation autour des bords de la colonie cellulaire. Aspirez soigneusement le tampon de détachement cellulaire des cellules. Lavez délicatement chaque bien avec 1 mL de DMEM/F12 chaud.
- Inspectez les plaques au microscope pour vous assurer que les cellules ne se sont pas complètement détachées de la plaque ou n’ont pas été accidentellement aspirées.
- Ajouter 3 mL de CCM iPS humain chaud à chaque puits de la plaque de 6 puits avec des cellules. À l’aide d’un élévateur de cellule, grattez doucement les colonies. À l’aide d’une pipette sérologique de 5 mL, mélanger délicatement la suspension cellulaire dans chaque puits de haut en bas une fois.
- Sortez la nouvelle plaque revêtue de matrice 1 de membrane basale de l’incubateur. Transférer 0,5 mL de la suspension cellulaire à chaque puits de la nouvelle plaque revêtue de matrice 1 membranaire basale. Déplacez la plaque dans un mouvement en forme de huit pour répartir les cellules uniformément. Incuber à 37 °C dans un incubateur à 5% de CO2 .
- Aspirer le milieu usé et le remplacer par 3 mL de CCM iPS humain chaque jour de culture jusqu’à ce que les cellules soient confluentes à 70 % (environ 4 jours après le passage).
3. Jours 0-16 : différenciation des CSPi humaines en cellules mésodermiques intermédiaires
- Jours 0-2 : induction du mésoderme
- Déplacer les plaques revêtues de matrice à membrane basale de 2 °C de 4 °C à température ambiante pendant 2 h pour les équilibrer après l’entreposage.
- Aspirer le milieu usé de chaque puits de la plaque à 6 puits contenant environ 70% de cellules iPS humaines confluentes. Lavez doucement les cellules 3x avec 1 mL de DMEM/F12 chaud.
- Aspirez le DMEM/F12. Ajouter 1 mL de tampon de détachement cellulaire à chaque puits de la plaque de 6 puits de cellules iPS humaines. Incuber à 37 °C pendant 5-7 min.
- Inspectez visuellement chaque puits au microscope pour la dissociation autour des bords de la colonie cellulaire. À l’aide d’un élévateur de cellule, grattez doucement les colonies.
- Transférer les suspensions cellulaires de tous les puits de la plaque à 6 puits dans un tube conique de 15 ml et utiliser un P1000 pour pipeter plusieurs fois de haut en bas pour obtenir une suspension unicellulaire des cellules iPS.
- Remplissez la suspension cellulaire dans le tube conique à 14 mL avec DMEM/F12. Centrifuger pendant 5 min à 200 × g à température ambiante.
- Aspirer le surnageant. Remettez en suspension la pastille de la cellule dans 14 mL de DMEM/F12 chaud. Répéter la centrifugation pendant 5 min à 200 × g à température ambiante.
- Aspirer le surnageant. Remettez les cellules en suspension dans 1 mL de milieu d’induction Mesoderm (tableau supplémentaire S1). Comptez les cellules à l’aide d’un hémocytomètre. Diluer dans le milieu d’induction du mésoderme pour obtenir une concentration finale de 1 × 105 cellules/mL.
- Aspirer le revêtement de la plaque revêtue de matrice de membrane basale à 2. Rincer chaque puits de la plaque 2 à matrice membranaire basale 2x avec 1 mL de DMEM/F12 chaud.
- Pipeter doucement la suspension cellulaire de haut en bas 2x. Transférer 1 mL de la suspension cellulaire dans chaque puits de la plaque à matrice membranaire basale à 2 revêtements. Déplacez doucement la plaque dans un mouvement en forme de huit pour répartir les cellules uniformément.
- Incuber la plaque à 37 °C pendant une nuit. Le lendemain (jour 1), aspirez le milieu usé de chaque puits de la plaque de 12 puits. Remplacer par 1 mL de milieu chaud d’induction Mesoderm. Incuber à 37 °C pendant une nuit.
- Jours 2 à 16 : induction intermédiaire du mésoderme
- Aspirer le milieu d’induction Mesoderm usé. Remplacer par 1 m L de milieu d’induction intermédiaire du mésoderme chaud (tableau supplémentaire S1). Aspirer le milieu usé et le remplacer par 1 mL de milieu d’induction intermédiaire du mésoderme chaud tous les jours pendant 14 jours.
4. Jours 0-15 : différenciation et expansion des CSPi humaines en cellules endothéliales vasculaires
- Jour 0 : ensemencement des cellules iPS humaines
- Préparer 15 mL de CCM iPS humaine avec inhibiteur de ROCK (tableau supplémentaire S1). Conserver au chaud à 37 °C.
- Incuber une plaque à matrice de membrane basale 1 pendant 1-2 h à 37 °C. Aspirer la matrice de membrane basale 1. Lavez 3x avec 1 mL de DMEM/F12 chaud.
- Aspirez le DMEM/F12. Ajouter 2 mL de CCM iPS humain avec inhibiteur de ROCK à chaque puits de la plaque de 6 puits. Incuber les plaques à 37 °C pendant que les cellules sont préparées pour l’ensemencement comme décrit ci-dessous.
- Aspirer le milieu usé de chaque puits de la plaque à 6 puits contenant environ 70% de cellules iPS humaines confluentes. Lavez doucement les cellules 3x avec 1 mL de DMEM/F12 chaud.
- Aspirez le DMEM/F12. Ajouter 1 mL de tampon de détachement cellulaire à chaque puits de la plaque de 6 puits de cellules iPS humaines. Incuber à 37 °C pendant 5-7 min pour dissocier les cellules en cellules individuelles.
REMARQUE: En raison des différences inhérentes entre les lignées cellulaires iPS, l’utilisateur devra inspecter visuellement les cellules après 5 minutes pour déterminer le temps d’incubation optimal. - Transférer les cellules dans un tube conique de 15 mL. Porter la suspension cellulaire à 14 ml avec du DMEM/F12 chaud pour neutraliser le tampon de détachement. Centrifuger pendant 5 min à 200× g à température ambiante.
- Aspirer doucement le surnageant. Remettez les cellules en suspension dans 1 mL de CCM iPS humaine avec inhibiteur de ROCK. Compter le nombre total de cellules à l’aide d’un hémocytomètre.
- Ensemencer les cellules entre 37 000 et 47 000 cellules/cm2 (355 200 à 451 200 cellules/puits d’une plaque à 6 puits). Incuber à 37 °C pendant une nuit.
REMARQUE: En raison des différences inhérentes entre les lignées cellulaires iPS, l’utilisateur devra déterminer la densité d’ensemencement optimale.
- Jours 1 à 3 : induction latérale du mésoderme
- Le lendemain (jour 1), aspirez le milieu usé de chaque puits de la plaque de 6 puits des cellules iPS humaines. Remplacer chaque puits de la plaque à 6 puits par 5 mL de milieu d’induction du mésoderme latéral (tableau supplémentaire S1). Lors de la mise à l’échelle du récipient de culture (p. ex., flacons), remplacez généralement par 3 fois le volume de travail dans le récipient de culture.
- Ne changez pas ce support pendant 3 jours.
REMARQUE: Le milieu d’induction du mésoderme latéral dans les puits changera normalement de couleur du rouge au jaune à mesure que les cellules utilisent les nutriments. Cependant, un milieu trouble ou un milieu avec croissance bactérienne n’est pas normal et doit être décontaminé et jeté comme tel.
- Jours 4-6 : induction des cellules endothéliales
- Aspirer le milieu usé de chaque puits de la plaque à 6 puits. Remplacer chaque puits de la plaque à 6 puits par 3 mL de milieu d’induction endothéliale chaud (tableau supplémentaire S1). Incuber la plaque à 37 °C pendant une nuit.
- Pendant les 2 jours suivants (jours 5 et 6), recueillir le milieu usé de tous les puits dans un tube conique de 50 mL. Conserver le tube conique à 4 °C. Reconstituer les cellules avec 3 mL de milieu d’induction endothéliale chaud. Incuber la plaque à 37 °C.
- Jour 7 : tri des cellules endothéliales (viEC)
- Retirer les flacons de la matrice 3 de membrane basale et laisser à température ambiante pendant 1 h.
- Préparer 50 mL de tampon MACS (tableau supplémentaire S1).
- Placez le tampon de détachement cellulaire, le tampon MACS, la CCM endothéliale et le PBS (Ca 2+ et Mg2+ libres) sur de la glace dans le capot de culture tissulaire.
- Placez l’aimant sur le support MACS. Placez deux tubes coniques de 50 ml et un tube conique de 15 ml dans un porte-tube conique.
- Placez le support MACS (avec aimant attaché) et une colonne LS dans le capot de culture tissulaire. Installez le support de tube conique (avec tubes coniques à l’intérieur) sur le support MACS, sous l’aimant (figure supplémentaire S1A).
- Recueillir le milieu usé de chaque puits de la plaque de 6 puits dans le tube conique de 50 ml à l’étape 4.3.2. Lavez chaque puits de la plaque à 6 puits avec du PBS (Ca 2+ et Mg2+ libre).
- Aspirez le PBS. Ajouter 1 mL de tampon de détachement cellulaire. Incuber à 37 °C pendant 5-7 min pour dissocier complètement les cellules.
- Transférer les cellules dans un tube conique de 50 mL. Amener la suspension cellulaire à 15 mL avec CCM endothéliale froide. Centrifuger à 200 × g pendant 5 min à température ambiante.
- Aspirer le surnageant. Remettez les cellules en suspension dans 1 mL de tampon MACS froid. Comptez les cellules à l’aide d’un hémocytomètre.
- Ajouter 10 mL de tampon MACS à la suspension cellulaire. Centrifuger pendant 5 min à 200 × g à température ambiante.
- Aspirer le surnageant. Remettez les cellules en suspension dans 80 μL de tampon MACS pour 10 millions de cellules. Ajouter 20 μL par 10 millions de cellules de réactif bloquant FcR, de microbilles CD31 et de microbilles CD144. Incuber pendant 15 min sur la glace.
- Pendant l’incubation de la suspension cellulaire, centrifuger le milieu prélevé à partir de l’induction endothéliale (étape 4.3.2) à 200 × g pendant 10 min.
- Recueillir le surnageant dans un filtre à vide de 500 mL de 0,22 μm. Préparer le milieu endothélial conditionné (tableau supplémentaire S1). Filtrer le milieu dans des conditions stériles et le garder au chaud à 37 °C.
NOTE: Le taux de prolifération des cellules endothéliales commencera à diminuer après le passage 3. Pour obtenir une croissance exponentielle après le passage 3, le milieu endothélial conditionné et d’entretien peut être complété par un inhibiteur 10 μM du TGF-Bêta (SB431542) à partir du passage 1. - Après l’incubation de 15 minutes à l’étape 4.4.11, ajouter 10 mL de tampon MACS par 10 millions de cellules (maximum 30 mL de tampon MACS) à la suspension cellulaire. Centrifuger à 200 × g pendant 5 min.
- Aspirer le surnageant. Remettez en suspension dans 1 mL de tampon MACS.
- Prenez la colonne LS et retirez le piston de la seringue. Replacez le piston dans le manchon en plastique. Placez la colonne sur l’aimant.
- Placez le premier tube conique de 50 mL sous la colonne. Ajoutez 1 mL de tampon MACS à la colonne. Recueillir dans le tube conique de 50 ml en dessous.
- Laissez le liquide s’écouler, mais pas complètement pour empêcher la colonne de sécher. Lorsque les gouttes de liquide commencent à couler lentement, ajoutez la suspension cellulaire à la colonne. Recueillir le flux dans le même tube conique de 50 mL.
- Lorsque les gouttes de liquide commencent à couler lentement, placez le tube conique suivant de 50 ml sous la colonne. Ajoutez le flux initial (étape 4.4.18) à la colonne. Recueillir dans le tube conique de 50 ml en dessous.
- Lorsque les gouttes liquides commencent à couler lentement, ajoutez 500 μL de tampon MACS 3x pour laver la colonne.
- Retirez la colonne de l’aimant. Placez la colonne sur le tube conique de 15 mL. Ajouter 1 mL de PBS froid à la colonne.
- Pour recueillir les cellules, retirez le piston du manchon en plastique et poussez-le fermement dans la colonne.
- Comptez les cellules à l’aide d’un hémocytomètre. Amener la suspension cellulaire à 5 mL avec PBS. Centrifuger pendant 5 min à 200 × g.
- Pendant que les cellules subissent une centrifugation, laver le flacon 3 à matrice membranaire basale 3x avec 5 mL de PBS pour préparer l’ensemencement cellulaire. Aspirer le PBS et ajouter 20 mL de milieu endothélial conditionné dans la fiole à matrice 3 de la membrane basale.
- Retirez les cellules de la centrifugeuse et aspirez le surnageant. Resuspendre les cellules dans un milieu endothélial conditionné pour les ensemencer à 26 000 cellules/cm2 (1,95 × 106 cellules/T75 en flacon). Ensemencez les cellules.
- Pour calculer l’efficacité de tri et le rendement cellulaire, divisez le nombre de cellules de l’étape 4.4.23 par le nombre de cellules de l’étape 4.4.9.
- Jours 8-15 : expansion des viEC
- Le lendemain (jour 8), aspirer le milieu usé de la fiole. Remplacer par 10 ml de milieu endothélial conditionné. Remplacer le milieu conditionné endothélial tous les deux jours jusqu’à ce que la fiole soit confluente à 90 % ou jusqu’à ce que le flacon de milieu conditionné endothélial soit complètement utilisé.
- Aspirer le milieu usé et le remplacer par 10 mL de milieu d’entretien endothélial (tableau supplémentaire S1) tous les deux jours pour une expansion continue.
- Pour faire passer les viCE, préparer deux flacons T75 à matrice à matrice basale 3. Laisser les flacons à température ambiante pendant 1 h. Lavez soigneusement les flacons fraîchement préparés 3x avec 5 ml de PBS.
- Aspirez le PBS. Ajouter 10 ml de milieu d’entretien endothélial chaud à chaque fiole fraîchement préparée. Incuber les plaques à 37 °C pendant que les cellules sont préparées pour l’ensemencement comme décrit ci-dessous.
- Ajouter 5 mL de tampon de détachement cellulaire à une fiole T75 confluente à 90 % de viCE. Incuber à 37 °C pendant 5-7 min. Transférer les cellules dans un tube conique de 15 mL. Ajouter 5 mL de DMEM/F12 chaud. Centrifuger à 200 × g pendant 5 min.
- Aspirer le surnageant. Resuspendre dans 1 mL de milieu d’entretien endothélial chaud. Ajouter 500 μL de suspension cellulaire à chacune des fioles T75 fraîchement préparées.
- Le lendemain, aspirez le milieu dépensé. Remplacer par 10 ml de milieu d’entretien endothélial. Aspirer le milieu usé et le remplacer par 10 ml de milieu d’entretien endothélial tous les deux jours jusqu’à ce que la fiole soit confluente à 90 %.
5. Jour 14 : préparation de puces d’organes microfluidiques pour la culture cellulaire
- Traitement plasma et revêtement matriciel 2 de membrane basale
- Préparer la solution de matrice 2 de membrane basale (étape 1.3). Mettez-le de côté.
- Dans une hotte de culture tissulaire stérile, déballez la boîte de Petri ronde stérile de 100 mm x 15 mm. Placer le dessus de la boîte de Pétri, vers le bas, sous le fond de la boîte de Petri (figure supplémentaire S1B).
- À l’aide d’une pince à épiler, retirez les puces microfluidiques de l’emballage et placez-les à l’intérieur de la boîte de Pétri. Fermez la boîte de Petri en utilisant le couvercle situé sous la boîte.
- Au niveau de l’asher plasma, placez le couvercle de la boîte de Petri sous la boîte, le haut tourné vers le bas, en les maintenant ensemble comme une seule unité. Placez la boîte de Petri dans la chambre d’analyse à plasma. Commencez l’asher plasma avec de l’oxygène à 100 W, 15 SCCM, 30 s.
- Sensible au facteur temps: Une fois le traitement terminé, retirez l’unité de boîte de Petri de l’asher plasma. Essuyez rapidement et légèrement le couvercle de la boîte de Petri avec de l’éthanol à 70% pulvérisé sur une lingette de laboratoire. Couvrir la boîte de Petri avec son couvercle.
- Apportez la boîte de Petri à la hotte de culture tissulaire stérile. Ajouter doucement 25 μL de solution de matrice 2 pour membrane basale dans le canal urinaire (supérieur) de la puce. Ajouter 20 μL de solution de matrice 2 pour membrane basale dans le canal capillaire (inférieur) de la puce.
- Prenez deux capsules de tubes coniques stériles de 15 ml et remplissez-les d’eau distillée stérile (~500 μL). Placez le capuchon dans la boîte de Petri pour éviter que les canaux de copeaux et la membrane ne se dessèchent. Placez le couvercle sur le plat. Incuber à 37 °C pendant une nuit.
6. Ensemencement des VIEC et des cellules intermédiaires du mésoderme dans les dispositifs microfluidiques
- Jour 15 : viECs
- Aspirer le milieu à partir de flacons T75 contenant 90% de viEC confluents. Ajouter 5 mL de tampon de détachement cellulaire et incuber à 37 °C pendant 5-7 min.
- Transférer les cellules dans un tube conique de 15 mL. Ajouter 5 mL de DMEM/F12. Centrifuger à 200 × g pendant 5 min.
NOTE: Chaque flacon T75 contenant environ 90% de viEC confluents donnera ~3 millions de cellules. - Aspirer le surnageant. Remettez les cellules en suspension dans 300 μL de milieu d’entretien endothélial pour obtenir environ 2 millions de cellules/300 μL. Compter les cellules à l’aide d’un hémocytomètre. Mettez la suspension cellulaire de côté.
- Transférer la boîte de Petri contenant les puces microfluidiques dans la hotte de culture tissulaire. Fixez une pointe de barrière P200 à l’extrémité d’un aspirateur.
- Rincer les canaux supérieur et inférieur de la puce microfluidique avec 200 μL de DMEM/F12 tout en aspirant simultanément la périphérie de la sortie.
- Tenez fermement la puce avec l’embout de barrière P200 fixé à l’aspirateur, loin de la sortie du canal inférieur. Injecter fermement 20 μL de la suspension viEC avec environ 134 000 cellules dans le canal capillaire (inférieur) de la puce. Aspirer soigneusement le milieu à partir de la périphérie de la prise.
- Vérifiez au microscope s’il n’y a pas de bulles ou une densité d’ensemencement viEC inégale.
- Retournez doucement la puce pour l’inverser afin que les viEC puissent adhérer à la face basale de la membrane PDMS flexible. Placez la puce dans la cartouche du support. Ajouter 3 ml de PBS dans la cartouche du porte-puce pour empêcher la membrane de sécher. Incuber la puce à 37 °C pendant 3 h.
- Vérifiez le canal inférieur au microscope pour une couche confluente de viEC fixée à la membrane PDMS flexible. Déposer 200 μL de milieu d’entretien endothélial à l’entrée du canal inférieur et le laisser s’écouler à travers le canal pour laver le canal des cellules endothéliales non attachées tout en aspirant soigneusement à partir de la périphérie de la sortie du canal capillaire (inférieur).
- Replacez la puce dans la cartouche du support. Incuber à 37 °C pendant une nuit.
- Jour 16 : cellules du mésoderme intermédiaire (IM)
- Rincer doucement le canal capillaire (inférieur) avec 200 μL de milieu d’entretien endothélial tout en aspirant soigneusement la périphérie de l’orifice de sortie.
- Rincer le canal urinaire (supérieur) avec 200 μL de DMEM/F12 tout en aspirant soigneusement la périphérie de la sortie. Déposez ~50 μL de DMEM/F12 sur les orifices d’entrée et de sortie.
- Aspirer le milieu d’induction du mésoderme intermédiaire de chaque puits de la plaque de 12 puits.
NOTE: Chaque puits à la fin de la différenciation donne environ 1,5 million de cellules IM. - Ajouter 1 mL de trypsine-EDTA dans chaque puits de la plaque de 12 puits et incuber à 37 °C pendant 5 min.
- Grattez doucement les cellules à l’aide d’un élévateur de cellule et pipette de haut en bas pour dissocier les cellules à l’aide d’un P1000. Ajouter 2 mL de solution de neutralisation de la trypsine (tableau supplémentaire S1) à chaque puits. Transférer les cellules dans un tube conique de 50 mL. Porter le volume de la suspension cellulaire à 50 mL avec DMEM/F12 et centrifuger à 200 × g pendant 5 min.
- Aspirer le surnageant. Resuspendre les cellules dans 500 μL de milieu d’induction du mésoderme intermédiaire pour obtenir environ 3 millions de cellules/500 μL. Compter les cellules à l’aide d’un hémocytomètre.
- Tenez fermement la puce avec l’embout de barrière P200 fixé à l’aspirateur, loin de la sortie du canal urinaire (supérieur). Injecter fermement 25 μL de suspension cellulaire avec environ 112 500 cellules IM dans le canal urinaire (supérieur) de la puce et aspirer soigneusement le milieu à partir de la périphérie de la sortie.
- Vérifiez au microscope s’il y a des bulles ou une densité d’ensemencement des cellules IM inégale. Ajouter 3 mL de PBS dans la cartouche du porte-puce. Incuber à 37 °C pendant 3 h.
- Rincer les deux canaux avec 200 μL de leur milieu de culture cellulaire respectif tout en aspirant soigneusement la périphérie des sorties de copeaux pour aider à empêcher l’écoulement en arrière du milieu usé et des débris cellulaires.
- Fixez les embouts de barrière P200 vides dans les deux sorties des canaux urinaire et capillaire. Pipeter 200 μL de milieu d’entretien endothélial et en injecter la moitié dans l’entrée du canal capillaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée de sorte que l’entrée et la sortie du canal soient maintenant fixées aux embouts de pipette remplis de milieu.
- Pipeter 200 μL de milieu d’entretien IM et en injecter la moitié dans l’entrée du canal urinaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée de sorte que l’entrée et la sortie du canal soient maintenant fixées aux embouts de pipette remplis de milieu. Incuber les copeaux avec des pointes incrustées à 37 °C pendant la nuit.
- Connectez les puces au bioréacteur à puces d’organes pour appliquer un écoulement de fluide et une contrainte mécanique.
- Retirez les embouts P200 des canaux urinaires et capillaires. Ajouter des gouttelettes de média respectif à l’entrée et à la sortie des canaux urinaires et capillaires pour éviter le dessèchement.
- Ajouter 3 mL de milieu chaud d’induction de podocyte (tableau supplémentaire S1) dans le réservoir d’entrée urinaire. Ajouter 3 mL de milieu d’entretien endothélial chaud au réservoir d’entrée capillaire.
- Ajouter 300 μL de milieu d’induction podocytaire chaud au réservoir de sortie du canal urinaire directement au-dessus de l’orifice de sortie. Ajouter 300 μL de milieu d’entretien endothélial chaud au réservoir de sortie du canal capillaire directement au-dessus de l’orifice de sortie.
- Faites glisser les capsules sur le plateau et dans le bioréacteur à puces d’organes.
- Utilisez le cadran rotatif du bioréacteur à puce d’organe pour sélectionner et démarrer le cycle Prime (2 min). Inspectez visuellement la face inférieure de la capsule à la recherche de petites gouttelettes aux quatre orifices fluidiques.
- Pour obtenir un contact fluide-fluide entre la face inférieure du Pod et les ports de puce microfluidique, faites glisser doucement le support de puce dans le Pod. Appuyez doucement sur la languette du support de puce vers l’intérieur et vers le haut. Aspirer l’excès de milieu de la surface de la puce.
- Réglez le débit du bioréacteur à puce d’organe à 60 μL/h. Réglez la déformation cyclique à 10 % à 0,4 Hz. Utilisez le cadran rotatif du bioréacteur à puce d’organe pour sélectionner le cycle de régulation et fonctionner pendant 2 h.
- Inspectez visuellement les réservoirs de sortie pour une augmentation du niveau de milieu.
- Utilisez le cadran rotatif du bioréacteur à puce d’organe pour sélectionner le cycle de régulation.
7. Jours 17-21 et au-delà : induction de podocytes et entretien des puces
- Aspirer le milieu des réservoirs de sortie du canal urinaire en diagonale loin du port, mais garder un peu de milieu dans le réservoir chaque jour de culture. Reconstituer le réservoir d’entrée du canal urinaire avec jusqu’à 3 mL de milieu d’induction podocytaire tous les 2 jours pendant 5 jours.
- Après 5 jours, aspirez le milieu du canal urinaire mais gardez un peu de milieu dans le réservoir. Reconstituer quotidiennement le réservoir d’entrée du canal urinaire avec 3 mL de milieu d’entretien Podocyte.
- Aspirer le milieu des réservoirs de sortie du canal capillaire en diagonale loin du port, mais garder un peu de milieu dans le réservoir chaque jour de culture. Reconstituer quotidiennement le réservoir d’entrée du canal capillaire avec jusqu’à 3 mL de milieu d’entretien endothélial.
8. Essai fonctionnel et imagerie par immunofluorescence
REMARQUE : Voir le dossier supplémentaire 1 pour plus de détails sur l’analyse par cytométrie en flux, ELISA pour l’effluent de puce et l’isolement de l’ARNm.
- Essai fonctionnel (filtration moléculaire) utilisant l’inuline et l’albumine
- Aspirez le milieu du réservoir de sortie du canal capillaire en diagonale loin du port, mais gardez un peu de milieu dans le réservoir. Remplacer par 3 mL de milieu d’entretien endothélial complété par de l’inuline et de l’albumine (tableau supplémentaire S1) pendant 6 h.
- À l’aide d’une pipette sérologique de 5 mL, mesurer le volume (en mL) de milieu à partir du canal urinaire et transférer dans un tube conique de 15 mL. Enveloppez le tube dans du papier d’aluminium pour le protéger de la lumière et minimiser le photoblanchiment de l’inuline et de l’albumine conjuguées au fluorophore. Réapprovisionner le réservoir avec 3 mL de milieu d’entretien Podocyte.
- Préparer une solution mère d’inuline dans un milieu d’entretien Podocyte. À partir de 25 μg/mL d’inuline, préparer huit étalons d’inuline par dilution en série 2x dans un milieu d’entretien Podocyte.
- De même, préparer une solution mère d’albumine dans un milieu d’entretien Podocyte. À partir de 150 μg/mL d’albumine, préparer huit étalons d’albumine par dilution en série 2x dans un milieu d’entretien Podocyte.
- Pipeter en double 100 μL de chaque concentration standard d’inuline dans chaque puits d’une plaque noire de 96 puits (ou 16 puits au total d’inuline). Pipeter en double 100 μL de chaque concentration standard d’albumine dans chaque puits de la même plaque de 96 puits (16 puits d’albumine au total). Pipette en double 100 μL de milieu d’entretien Podocyte pour servir d’ébauche (ou deux puits totaux de milieu d’entretien Podocyte).
- Pipeter en double 100 μL de milieu d’effluent du canal urinaire dans chaque puits de la même plaque de 96 puits. Pipette en double 100 μL de milieu d’effluent du canal capillaire.
- Insérez la plaque dans le lecteur de plaque et mesurez la fluorescence de l’albumine à une excitation de 550 nm et d’une émission de 615 nm. Mesurer la même plaque pour l’inuline à excitation 513 nm et émission 577 nm.
- À partir des données générées, faites la moyenne des mesures en double (par puce). Soustrayez la valeur de blanc correspondant à cette lecture de plaque du reste des données de la feuille.
- Tracer les valeurs correspondant aux étalons d’albumine pour créer une courbe étalon avec concentration [μg/mL] sur l’axe des x et fluorescence sur l’axe des y. Tracer les valeurs correspondant aux étalons d’inuline pour créer une courbe étalon avec concentration [μg/mL] sur l’axe des x et fluorescence sur l’axe des y.
- Utiliser un progiciel d’analyse statistique et une interpolation linéaire pour déterminer la concentration urinaire d’inuline et d’albumine, respectivement, dans le milieu d’effluent des copeaux.
- Déterminer la clairance urinaire de l’inuline/albumine des puces à l’aide de l’équation (1)2 :
clairance urinaire = ([U] × UV) / [P] (1)
Où [U] est la concentration urinaire de l’étape 8.1.10, UV est le volume d’effluent recueilli des canaux urinaires à l’étape 8.1.2 et [P] est la concentration capillaire d’inuline ou d’albumine (10 μg/mL d’inuline ou 100 μg/mL d’albumine).
- Imagerie par immunofluorescence
- Injectez un embout P200 vide dans les orifices de sortie des canaux urinaires et capillaires. Pour fixer les cellules, pipeter 200 μL de formaldéhyde à 4% et en injecter la moitié dans l’entrée du canal inférieur. Relâchez l’embout de la pipette à l’intérieur de l’entrée.
- Pipeter 200 μL de formaldéhyde à 4 % et en injecter la moitié dans l’entrée du canal urinaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée de sorte que l’entrée et la sortie du canal soient maintenant fixées aux embouts de pipette remplis de fixateur.
- Incuber les copeaux à température ambiante pendant 20 min.
- Après 20 min, jeter toutes les pointes de pipette. Injectez des embouts P200 propres et vides dans les orifices de sortie des canaux urinaires et capillaires. Pour perméabiliser les cellules, pipeter 200 μL de Triton X-100/PBS à 0,125 % et en injecter la moitié dans l’entrée du canal capillaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée.
- Pipette 200 μL de Triton X-100/PBS à 0,125 % et injectez-en la moitié dans l’entrée du canal urinaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée. Incuber la puce à température ambiante pendant 5 min.
- Jetez tous les embouts de pipette. Injectez des embouts P200 propres et vides dans les orifices de sortie des canaux urinaires et capillaires. Pour bloquer les cellules, pipeter 200 μL d’albumine sérique bovine (BSA) à 1% dans du Triton X-100 / PBS à 0,125% et en injecter la moitié dans l’entrée du canal capillaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée.
- Pipeter 200 μL de BSA à 1% dans du Triton X-100/PBS à 0,125% et en injecter la moitié dans l’entrée du canal urinaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée. Incuber à température ambiante pendant 30 min.
- Jetez tous les embouts de pipette. Laver les deux canaux 3x en pipetant 200 μL de Triton X-100/PBS à 0,125 % dans chaque canal et en incubant à température ambiante pendant 5 min.
- Préparer 100 μL d’anticorps primaire par canal avec la dilution recommandée par le fabricant dans du Triton X-100/PBS à 0,125 %. Injectez des embouts P200 propres et vides dans les orifices de sortie des canaux urinaires et capillaires. Pipeter 100 μL d’anticorps primaire et injecter la moitié dans les canaux respectifs. Relâchez l’embout de la pipette à l’intérieur de l’entrée.
- Incuber pendant 1 h à température ambiante ou, pour de meilleurs résultats, toute la nuit à 4 °C.
REMARQUE : Plusieurs anticorps primaires peuvent être appliqués à la fois; Cependant, la solution d’anticorps primaire doit être diluée conformément aux instructions du fabricant. - Laver les canaux 3 x 10 min comme décrit à l’étape 8.2.8.
- Préparer 100 μL d’anticorps secondaire par canal avec le facteur de dilution recommandé par le fabricant dans du Triton X-100/PBS à 0,125 %. Injectez des embouts P200 propres et vides dans les orifices de sortie des canaux urinaires et capillaires. Pipeter 100 μL d’anticorps secondaire et injecter la moitié dans les canaux respectifs. Relâchez les embouts de la pipette à l’intérieur de l’entrée. Incuber pendant 1 h à température ambiante.
REMARQUE : Chaque anticorps secondaire doit être appliqué séparément. Laver au moins 3 x 10 min entre chaque application conformément à l’étape 8.2.8. - Laver les canaux 3 x 10 min comme décrit à l’étape 8.2.8.
- Rincer les deux canaux une fois avec 200 μL d’eau distillée tout en aspirant le liquide résiduel de la périphérie des orifices de sortie des copeaux.
- Injectez du P200 propre et vide dans les orifices de sortie des canaux urinaires et capillaires. Pour contrer la coloration des cellules, pipeter 200 μL de 4',6-diamidino-2-phénylindole (DAPI, dilution 1:1 000 dans de l’eau distillée) et en injecter la moitié dans l’entrée du canal capillaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée, et pipette 200 μL de DAPI et injectez-en la moitié dans l’entrée du canal urinaire. Relâchez l’embout de la pipette à l’intérieur de l’entrée et incuber à température ambiante pendant 5 min.
- Jetez tous les embouts de pipette. Injectez des embouts P200 propres et vides dans les orifices de sortie des canaux urinaires et capillaires. Pour contrer la coloration des cellules, pipeter 200 μL de phalloïdine (dilution de 1:1 000 dans du PBS sans Ca 2+ et Mg2+) et injecter la moitié de celle-ci dans l’entrée du canal capillaire et libérer l’embout de la pipette à l’intérieur de l’entrée. Pipeter 200 μL de phalloïdine (dilution de 1:1 000 dans du PBS sans Ca 2+ et Mg2+) et en injecter la moitié dans l’entrée du canal urinaire et libérer l’embout de la pipette à l’intérieur de l’entrée. Incuber à température ambiante pendant 15 min.
- Rincer les canaux 3x avec 200 μL de PBS sans Ca 2+ et Mg2+, et aspirer l’excès de liquide de la périphérie des orifices de sortie.
- Visualisez les puces.
Résultats
Nous montrons ici qu’un modèle 3D in vitro fonctionnel du glomérule peut être vascularisé et épithélialisé à partir d’une source isogénique de cellules iPS humaines. Plus précisément, ce protocole fournit des instructions sur la façon d’appliquer la technologie des cellules iPS humaines, en particulier leur capacité à se différencier en types de cellules spécialisées, pour générer un épithélium glomérulaire rénal (podocytes) et un endothélium vasculaire (viCE) qui peuvent être intégrés à des dispositifs microfluidiques pour modéliser la structure et la fonction du rein humain au niveau spécifique du patient. Un aperçu schématique de ce protocole et de cette chronologie (Figure 1A) décrit comment cultiver des cellules iPS humaines mitotiquement actives (Figure 1B), puis les différencier (en parallèle) en lignées cellulaires mésodermiques et mésodermiques latérales (Figure 1C,D). Les cellules mésodermiques résultantes exprimaient la brachyurie (T), tandis que les cellules du mésoderme latéral exprimaient la brachyurie (T), MIXL et EOMES 2,9,10,11.
La différenciation ultérieure des cellules du mésoderme a produit des cellules mésodermiques intermédiaires (IM), tandis que la différenciation des cellules du mésoderme latéral a produit des viEC (Figure 1D)2,10,11,17. L’analyse par cytométrie de flux a été utilisée pour examiner l’expression de CD144 dans les viEC différenciées (avant et après le tri de la CMA) par rapport aux témoins négatifs (y compris les cellules iPS humaines indifférenciées colorées et non colorées et l’endothélium non coloré). Une différenciation endothéliale optimisée se traduira par des cellules CD31/CD144 positives de 50 % ou plus avant le tri MAC, ce qui améliorera considérablement après le tri cellulaire par rapport aux témoins. Des résultats représentatifs montrent une efficacité de différenciation de 59 % pour CD144 avant le tri MAC, qui a augmenté à 77 % ou plus de cellules CD144 positives (sans compter les cellules CD31-positives) après le tri MAC (Figure 1E).
Le jour 14 de ce protocole (avant l’achèvement de la différenciation IM et de l’expansion viEC), les dispositifs d’organe sur puce ont été préparés pour l’ensemencement cellulaire par traitement au plasma et fonctionnalisation avec la matrice 2 de membrane basale. Le lendemain (jour 15 du protocole), les CEv ont été ensemencés dans le canal capillaire (inférieur) du dispositif microfluidique avec un milieu viEC. Le lendemain de l’ensemencement viEC (jour 16 du protocole), les cellules IM ont été ensemencées dans le canal urinaire (supérieur) du dispositif microfluidique avec un milieu d’induction podocytaire. Le lendemain de l’ensemencement des cellules IM (jour 17 de ce protocole), un débit de fluide de 60 μL/h et une déformation de 10 % à 0,4 Hz ont été appliqués sur les copeaux du glomérule. Ces copeaux subissent une contrainte de cisaillement de 0,017 dyn cm−2 et 0,0007dyn cm−2 dans les canaux capillaire et urinaire, respectivement 2,12. Après jusqu’à 5 jours d’induction de podocytes et 6 jours de propagation de l’endothélium vasculaire dans la puce (jour 21 de ce protocole) (Figure 2A), les cellules résultantes dans les puces glomérées ont exprimé des marqueurs d’identification de la lignée.
Plus précisément, les podocytes dans le canal urinaire exprimaient la podocine et la néphrine (Figure 2B, panneau supérieur), et les viEC dans le canal capillaire exprimaient PECAM-1 (CD31) et VE-Cadhérine (CD144) (Figure 2B, panneau inférieur). De plus, les couches podocyte et viEC exprimaient le collagène IV, la protéine GBM la plus abondante (Figure 2B) dans le glomérule rénal. Plus de collagène IV est exprimé dans le canal urinaire parce que les podocytes sont les principaux producteurs de collagène IV, y compris l’isoforme α3α4α5, qui est la principale isoforme hétérotrimère du collagène dans le glomérule mature. De plus, les podocytes propagés dans les puces du glomérule ont développé des processus du pied et sécrété du VEGF165, deux caractéristiques des modèles fonctionnels du glomérulerénal 2,12. Ce protocole fournit également une évaluation de la fonction de filtration moléculaire sélective du glomérule rénal à l’aide d’inuline et d’albumine, à partir desquelles les puces du glomérule filtrent sélectivement les petites molécules (inuline) du capillaire dans le canal urinaire, tout en empêchant les grosses protéines (albumine) de quitter le canal capillaire (Figure 2C)2,10,12.
Comme chaque lignée cellulaire iPS humaine présente des différences inhérentes dans le temps de doublement, il est important de noter que les densités d’ensemencement cellulaires optimales pour différentes lignées cellulaires peuvent varier et doivent donc être optimisées par le chercheur. Pour la différenciation des cellules endothéliales, si la densité d’ensemencement des cellules iPS humaines est trop faible, le chercheur peut observer un rendement plus faible de cellules endothéliales différenciées (efficacité de <30%). Si la densité d’ensemencement des cellules iPS humaines est trop élevée, le chercheur peut observer une prolifération cellulaire rapide, un détachement ou une faible adhérence, une augmentation de la mort cellulaire et un faible rendement (efficacité de <30%). Au cours de l’induction endothéliale (jours 4-7 de différenciation), une augmentation du nombre de cellules entraînant une couche secondaire de cellules est normale mais doit être réduite au minimum (Figure 3A). Pour la différenciation IM et podocyte, le surensemencement des cellules iPS humaines (>100 000 cellules/puits d’une plaque de 12 puits) peut entraîner la croissance de cellules IM en grandes grappes ou la formation d’agrégats, ce qui peut entraver la différenciation et donner des podocytes avec un phénotype morphologique moins mature de cellules agrégées et moins de processus secondaires et/ou tertiairesdu pied 10, 11.
Au cours de la culture de puces microfluidiques, un écoulement croisé inattendu entre les canaux urinaire et capillaire (Figure 3B) peut être observé en cas de rupture ou de liaison inadéquate des composants de la puce PDMS, ou si le trajet de l’écoulement du fluide est bloqué. Cet écoulement croisé indésirable du fluide peut également résulter d’une barrière de filtration compromise, telle que des modèles tissulaires provenant d’un ensemencement cellulaire inadéquat (faible) ou de couches cellulaires endommagées. Pour éviter ce problème, il est recommandé au chercheur de suivre le protocole et les densités d’ensemencement cellulaire recommandés, ainsi que d’inspecter visuellement les copeaux à la recherche de bulles d’air dans les canaux à chaque étape du processus. Si des bulles d’air sont observées dans les réservoirs de milieux des puces microfluidiques qui sont sous écoulement de fluide, la pompe peut être arrêtée et le milieu dégazé dans des conditions stériles.
Ensemble, ce protocole et les résultats représentatifs décrivent la dérivation de l’endothélium vasculaire (viCE) et de l’épithélium glomérulaire (podocytes) à partir d’une lignée cellulaire iPS humaine isogénique, et leur reconstitution dans un dispositif microfluidique d’organe sur puce pour récapituler la structure et la fonction de la barrière de filtration glomérulaire rénale d’une manière spécifique au patient.
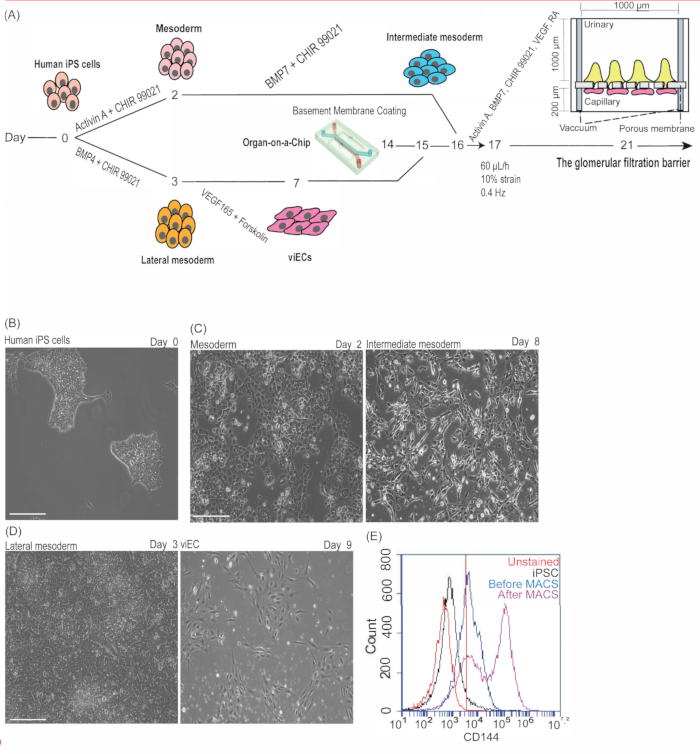
Figure 1 : Dérivation de l’épithélium glomérulaire isogénique et de l’endothélium vasculaire à partir de cellules iPS humaines. (A) Chronologie schématique de l’induction intermédiaire du mésoderme et de la CEi, conception de l’organe sur puce et revêtement de la matrice membranaire basale, ensemencement cellulaire dans la puce et induction de podocytes dans la puce. (B) Images représentatives en fond clair de cellules iPS humaines PGP1 avant dissociation au jour 0 du protocole. (C) Images représentatives en fond clair des cellules du mésoderme PGP1 au jour 2 de la différenciation (à gauche) et des cellules du mésoderme intermédiaire au jour 8 de la différenciation (à droite). (D) Images représentatives en fond clair des cellules du mésoderme latéral PGP1 au jour 3 de la différenciation (à gauche) et des viEC PGP1 au jour 9 de la différenciation (2 jours d’expansion) (à droite). Barres d’échelle = 275 μm (B-J). (E) Quantification de la différenciation viEC par analyse cytométrique en flux pour les cellules CD144-positives au jour 7 de la différenciation des cellules endothéliales avant MACS (bleu) et au jour 9 de l’expansion des cellules endothéliales après MACS (rose) par rapport aux CSPi humaines colorées CD144 (noir) et aux cellules endothéliales non colorées (rouge). Ce chiffre a été modifié par rapport à12. Abréviations : CSPi = cellules souches pluripotentes induites; viEC = cellules endothéliales vasculaires; BMP4/7 = protéine morphogénétique osseuse 4/7; PR = acide rétinoïque; VEGF = facteur de croissance de l’endothélium vasculaire; MACS = tri des cellules activées magnétiquement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images représentatives de l’endothélium vasculaire et de l’épithélium glomérulaire (couche de podocyte) cultivés dans la puce microfluidique du glomérule rénal. Images représentatives en fond clair des viEC (à gauche) et de l’épithélium glomérulaire (podocytes) (à droite) propagées dans la puce gloméruleuse. Barres d’échelle = 183 μm. (B) Images immunofluorescentes représentatives de l’épithélium glomérulaire (podocytes) et de la CEvi montrant l’expression de marqueurs spécifiques à la lignée. Barres d’échelle = 100 μm. (C) Données représentatives montrant une filtration moléculaire sélective dans la puce du glomérule. Les barres d’erreur représentent SD. p < 0,0001. Ce chiffre a été reproduit à partir de 12. Abréviations : viECs = cellules endothéliales vasculaires; VE-cadhérine = CD144; PECAM-1 (= CD31) = molécule d’adhésion des cellules endothéliales plaquettaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
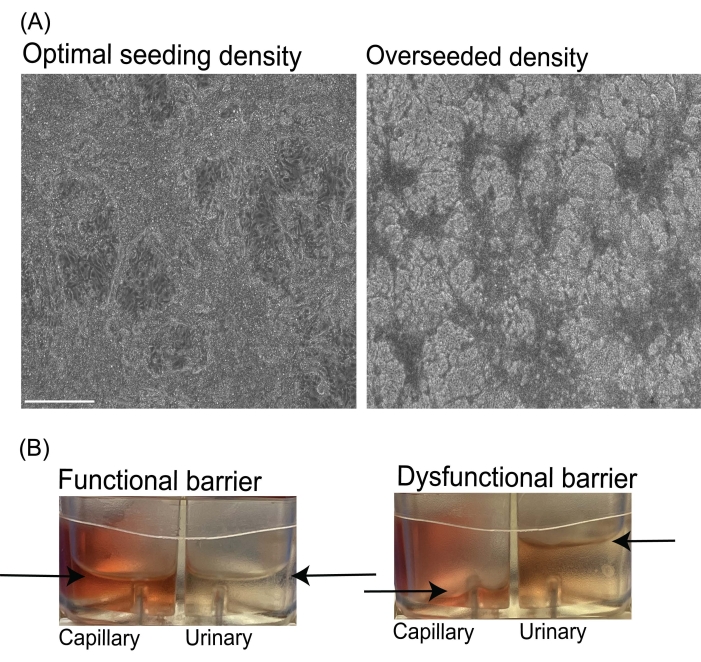
Figure 3 : Images de la densité d’ensemencement de l’endothélium sous-optimale et de l’écoulement inégal du fluide dans les puces microfluidiques. (A) Images représentatives en fond clair de cultures cellulaires optimales (à gauche) et surensemencées (à droite) au jour 6 de la différenciation viEC. Barres d’échelle = 275 μm. (B) Images représentatives des réservoirs de sortie des copeaux microfluidiques avec un écoulement régulier du fluide et une barrière fonctionnelle (à gauche). Image d’une puce avec un écoulement de fluide inégal ou une barrière dysfonctionnelle (à droite). Les flèches indiquent les niveaux de liquide dans les réservoirs de sortie pour les canaux capillaires et urinaires des copeaux. Abréviation : viECs = cellules endothéliales vasculaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Cytométrie en flux, test ELISA pour les effluents de puces et isolement de l’ARNm. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S1 : Configurations de matériel de cagoule de culture tissulaire. (A) Matériau de hotte de culture dans les tissus mis en place pour MACS, y compris un seau à glace avec média, un aimant sur support magnétique et des tubes coniques sous l’aimant. (B) Installation du matériau de la hotte de culture tissulaire de la boîte de Petri pour copeaux, avec le haut, orienté vers le bas, sous le fond de la boîte de Pétri. Abréviation : MACS = tri des cellules activées magnétiquement. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S1 : Milieux et tampons utilisés dans ce protocole. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Dans ce rapport, nous décrivons un protocole pour dériver l’endothélium vasculaire et l’épithélium glomérulaire (podocytes) à partir d’une lignée cellulaire iPS humaine isogénique et l’utilisation de ces cellules pour concevoir un système 3D d’organe sur puce qui imite la structure, l’interface tissu-tissu et la fonction de filtration moléculaire du glomérule rénal. Cette puce glomérule est équipée d’un endothélium et d’un épithélium glomérulaire qui, ensemble, constituent une barrière pour filtrer sélectivement les molécules.
Les chercheurs intéressés à adapter ce protocole devraient tenir compte des considérations suivantes : premièrement, une optimisation peut être nécessaire pour l’ensemencement cellulaire en fonction des caractéristiques de croissance inhérentes aux lignées de cellules souches utilisées. La densité d’ensemencement cellulaire peut varier en raison des différences intrinsèques dans les taux de prolifération des cellules iPS humaines. Il est recommandé aux chercheurs de commencer par la densité d’ensemencement du mésoderme suggérée par le protocole, puis de l’ajuster si nécessaire. De même, il est recommandé que la différenciation latérale du mésoderme commence par la densité d’ensemencement cellulaire suggérée avant de s’ajuster au besoin pour obtenir un rendement viEC et une efficacité de tri de 50% ou plus. Si suffisamment de cellules ne sont pas différenciées après le tri, l’inhibiteur du TGF-bêta (SB431542) peut être utilisé pour prévenir la quiescence et aider à développer exponentiellement les viEC (passage passé 3). Cependant, plusieurs processus cellulaires ou voies de signalisation dépendent du TGF-bêta (p. ex. pathogenèse de l’hyperglycémie/diabète, homéostasie immunitaire); par conséquent, il est recommandé aux chercheurs de tenir compte des effets de l’inhibition du TGF-bêta sur l’analyse en aval ou de s’assurer que les tests adéquats sont effectués pour éviter des résultats expérimentaux imprévus.
Deuxièmement, il est important de noter les variations possibles dans la qualité des réactifs et les spécifications du fabricant, en particulier pour les composants acquis auprès de fournisseurs autres que ceux spécifiés par le protocole. Ainsi, il est recommandé que le chercheur teste des réactifs provenant de différents numéros de lot, fournisseurs et vendeurs pour assurer la reproductibilité des expériences et des résultats. En règle générale, le chercheur devrait éviter une exposition excessive des cellules iPS humaines aux enzymes de dissociation dans les tampons de détachement, car cela peut entraîner une diminution de la viabilité cellulaire et une altération du profil moléculaire des cellules. De plus, le milieu d’induction podocytaire doit être protégé de la lumière pour empêcher l’inactivation de tout l’acide trans rétinoïque. Troisièmement, lors de la culture de cellules d’organe sur puce, il est essentiel d’éviter les bulles d’air dans les canaux du dispositif microfluidique lors de la perfusion des puces. L’apparition de bulles d’air peut être minimisée ou évitée en inspectant régulièrement les copeaux pendant l’ensemencement cellulaire, en maintenant le contact liquide-liquide à chaque étape impliquant la perfusion des copeaux et en ne poussant ni n’aspirant l’air dans les canaux fluidiques lors de l’utilisation des pointes de pipette et/ou de l’aspiration.
Les efforts antérieurs pour concevoir des puces de glomérule rénal avec un épithélium et un endothélium génétiquement adaptés reposaient sur l’utilisation de cellules d’origine animale1. Bien que ces lignées cellulaires d’origine animale aient traditionnellement été utilisées pour des études précliniques, elles ne parviennent souvent pas à récapituler les réponses physiologiques humaines, ce qui contribue au taux d’échec élevé (89,5%) des essais cliniques chez l’homme18. Pour aider à surmonter certains de ces problèmes, des modèles in vitro fonctionnels qui récapitulent plus étroitement la biologie humaine sont souhaitables. Des progrès ont été réalisés dans la mise au point de modèles multicellulaires du rein humain; Cependant, les puces de glomérule utilisaient des cellules humaines provenant de sources hétérogènes et non isogéniques. Par exemple, nous avons précédemment établi une puce glomérule reconstituée à partir de podocytes dérivés de cellules iPS humaines et d’endothélium10 dérivé de tissus primaires. Des études menées dans d’autres groupes de recherche ont utilisé un mélange de cellules primaires 4,9, de cellules immortalisées 3 ou de cellules dérivées du liquide amniotique 3,6 qui limitent leur utilisation pour étudier les réponses ou les applications spécifiques aux patients en médecine personnalisée.
Le protocole décrit ici surmonte ces limites en permettant la dérivation de l’endothélium vasculaire (viCE) et de l’épithélium glomérulaire (podocytes) à partir de la même lignée cellulaire iPS humaine et en intégrant ces cellules dans des dispositifs compartimentés d’organe microfluidique sur puce pour modéliser la structure et la fonction de la paroi capillaire glomérulaire rénale in vitro . Compte tenu de l’auto-renouvellement illimité des cellules iPS humaines, combinée à leur capacité à se différencier en presque tous les types de cellules, ce protocole fournit également une voie pour l’approvisionnement continu en podocytes humains et viEC pour l’ingénierie tissulaire et d’autres applications biomédicales. Cette approche pour les dérivations de podocytes et de viECs a été reproduite dans plusieurs lignées cellulaires iPS humaines spécifiques au patient, y compris PGP1- et DU11 2,10,12,17,19, permettant ainsi l’établissement de puces de glomérule rénale personnalisées à partir des populations de patients souhaitées.
La stratégie de différenciation des podocytes dans les puces microfluidiques permet l’étude mécaniste du glomérule rénal humain en développement et la modélisation de la maladie. Cependant, l’étude du glomérule rénal humain en développement est limitée par les viEC nécessitant un tri pour enrichir la population désirée. Ces travaux pourraient bénéficier de l’établissement de méthodes de différenciation des CEV sans qu’il soit nécessaire de sélectionner des sous-populations. Cette étude est également limitée par l’épaisse membrane PDMS qui sépare les couches cellulaires de l’endothélium vasculaire et du podocyte. Les travaux futurs pourraient intégrer de nouveaux biomatériaux pour remplacer le PDMS épais afin de mieux imiter les propriétés moléculaires et biophysiques de la membrane basale glomérulaire. Par exemple, une membrane alternative pourrait être conçue pour posséder des qualités biodégradables avec une porosité accordable et être plus mince (plus semblable au GBM) que la membrane PDMS de 50 μm d’épaisseur utilisée dans ce protocole.
Néanmoins, la puce glomérule produite par ce protocole peut être appliquée pour étudier les mécanismes des maladies rénales débilitantes et servir de plate-forme pour les tests de néphrotoxicité et la découverte de médicaments. Étant donné que les cellules iPS humaines maintiennent le profil génétique du donneur et que la puce glomérule est capable de modéliser la maladie rénale12, de nouvelles cibles thérapeutiques pourraient être découvertes à l’avenir pour bénéficier aux personnes souffrant de formes héréditaires de maladie rénale. De plus, les réponses biologiques spécifiques au patient aux médicaments post-transplantation peuvent être évaluées avec plus de précision à l’aide d’une puce rénale isogénique telle que celle décrite dans cette étude. Enfin, cette puce glomérule est prête à étudier les effets de la dynamique des fluides et de la déformation mécanique différentielle, tels que ceux observés chez les patients atteints d’hypertension rénale ou de syndrome cardio-rénal, compte tenu de la facilité relative de moduler les taux d’écoulement des fluides, d’étirement tissulaire ou de tension mécanique. Il est concevable que ce protocole puisse faire progresser la compréhension actuelle du développement des reins humains et des mécanismes de la maladie, ainsi que faciliter le développement de thérapies personnalisées à l’avenir.
Déclarations de divulgation
S.M. est un inventeur d’un brevet lié à la différenciation des podocytes par rapport aux cellules iPS humaines. L’autre auteur n’a rien à divulguer.
Remerciements
Ce travail a été soutenu par la Pratt School of Engineering de l’Université Duke, la Division de néphrologie du Département de médecine de Duke, une bourse Whitehead en recherche biomédicale et une bourse de recherche Genentech pour S. Musah. Y. Roye est récipiendaire de la bourse de la Duke University-Alfred P. Sloan Foundation et de la bourse d’études supérieures William M. « Monty » Reichert du département de génie biomédical de l’Université Duke. La lignée cellulaire UD11 (clone #11 de l’Université Duke) a été générée à l’installation principale de Duke iPSC et nous a été fournie par le laboratoire Bursac de l’Université Duke. Les auteurs remercient N. Abutaleb, J. Holmes, R. Bhattacharya et Y. Zhou pour leur assistance technique et leurs discussions utiles. Les auteurs aimeraient également remercier les membres du Musah Lab pour leurs commentaires utiles sur le manuscrit. Les auteurs remercient le laboratoire Segura pour le don d’un cytomètre en flux Acuri C6.
matériels
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488- and Alexa Fluor 594-conjugated secondary antibodies | Thermo/Life Technologies | A32744; A32754; A-11076; A32790; A21203; A11015 | |
| Collagen IV | Thermo/Life Technologies | 14-9871-82 | |
| Nephrin | Progen | GP-N2 | |
| PECAM-1 | R&D Systems | AF806 | |
| Podocin | Abcam | ab50339 | |
| VE-Cadherin | Santa Cruz | sc-9989 | |
| Basement membrane matrices | |||
| Corning Fibronectin, Human | Corning | 356008 | Basement membrane (3) |
| iMatrix-511 Laminin-E8 (LM-E8) fragment | Iwai North America | N8922012 | Basement membrane matrix (2) |
| Matrigel hESC-qualified matrix, 5-mL vial | BD Biosciences | 354277 | Basement membrane matrix (1); may show lot-to-lot variation |
| Cells | |||
| DU11 human iPS cells | The DU11 (Duke University clone #11) iPS cell line was generated at the Duke iPSC Core Facility and provided to us by the Bursac Lab at Duke University. The line has been tested and found to be free of mycoplasma (last test in November 2021) and karyotype abnormalities (July 2019) | ||
| Culture medium growth factors and media supplements | |||
| 0.5M EDTA, pH 8.0 | Invitrogen | 15575020 | |
| 2-Mercaptoethanol | Thermo/Life Technologies | 21985023 | |
| Albumin from Bovine serum, Texas Red conjugate | Thermo/Life Technologies | A23017 | |
| All-trans retinoic acid (500 mg) | Stem Cell Technologies | 72262 | |
| B27 serum-free supplement | Thermo/Life Technologies | 17504044 | |
| B-27 supplement (50x) without Vitamin A | Thermo/Life Technologies | 12587010 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| CHIR99021 | Stemgent | 04-0004 | May show lot-to-lot variation |
| Complete medium kit with CultureBoost-R | Cell Systems | 4Z0-500-R | Podocyte maintenance media |
| DMEM/F12 | Thermo/Life Technologies | 12634028 | |
| DMEM/F12 with GlutaMAX supplement | Thermo/Life Technologies | 10565042 | DMEM/F12 with glutamine |
| Forskolin (Adenylyl cyclase activator) | Abcam | ab120058 | |
| GlutaMAX supplement | Thermo/Life Technologies | 35050061 | glutamine supplement |
| Heat-inactivated FBS | Thermo/Life Technologies | 10082147 | |
| Heparin solution | Stem Cell Technologies | 7980 | |
| Human Activin A | Thermo/Life Technologies | PHC9544 | |
| Human BMP4 | Preprotech | 120-05ET | |
| Human BMP7 | Thermo/Life Technologies | PHC9544 | |
| Human VEGF | Thermo/Life Technologies | PHC9394 | |
| Inulin-FITC | Sigma-Aldrich | F3272 | |
| mTeSR1 medium | Stem Cell Technologies | 05850 | Human iPS cell culture media (CCM). Add 5x supplement according to the manufacturer. Human iPS CCM can be stored for up to 6 months at -20 °C. |
| N-2 Supplement (100x) | Thermo/Life Technologies | 17502048 | |
| Neurobasal media | Thermo/Life Technologies | 21103049 | Lateral mesoderm basal media |
| PBS (Phosphate-buffered saline) | Thermo/Life Technologies | 14190-250 | |
| Penicillin-streptomycin, liquid (100x) | Thermo/Life Technologies | 15140-163 | |
| ROCK inhibitor (Y27632) | Tocris | 1254 | |
| StemPro-34 SFM | Thermo/Life Technologies | 10639011 | Endothelial cell culture medium (CCM). Add supplement according to manufacturer. Endothelial CCM can be stored for up to two weeks at 4 °C or -20 °C for up to 6 months. |
| TGF-Beta inhibitor (SB431542) | Stem Cell Technologies | 72234 | |
| Enzymes and other reagents | |||
| Accutase | Thermo/Life Technologies | A1110501 | Cell detachment buffer |
| Dimethyl Suloxide (DMSO) | Sigma-Aldrich | D2438 | |
| Ethanol solution, 70% (vol/vol), biotechnology grade | VWR | 97065-058 | |
| Paraformaldehyde (PFA) | Thermo/Life Technologies | 28906 | |
| Sterile distilled water | Thermo/Life Technologies | 15230162 | |
| Triton X-100 | VWR | 97062-208 | |
| Equipment | |||
| Trypsin EDTA, 0.05% | Thermo/Life Technologies | 25300-120 | |
| (Orb) Hub module | Emulate | ORB-HM1 | |
| 100mm x 15 mm round petri dish | Fisherbrand | FB087579B | |
| 120 x 120 mm square cell culture dish | VWR | 688161 | |
| Accuri C6 | BD Biosciences | ||
| Aspirating pipettes, individually wrapped | Corning | 29442-462 | |
| Aspirating Unit | SP Bel-Art | F19917-0150 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99516 | |
| Conical centrifuge tube, 15 mL | Corning | 352097 | |
| Conical centrifuge tube, 50 mL | Corning | 352098 | |
| EVOS M7000 | Thermo/Life Technologies | AMF7000 | Fluorescent microscope to take images of fixed and stained cells. |
| Hemocytometer | VWR | 100503-092 | |
| Heracell VIOS 160i CO2 incubator | Thermo/Life Technologies | 51030403 | |
| Inverted Zeiss Axio Observer equipeed with AxioCam 503 camera | Carl Zeiss Micrscopy | 491916-0001-000(microscope) ; 426558-0000-000(camera) | |
| Kimberly-Clark nitrile gloves | VWR | 40101-346 | |
| Kimwipes, large | VWR | 21905-049 | |
| Leoca SP8 Upright Confocal Microscope | |||
| Media reservoir (POD Portable Module) | Emulate | POD-1 | |
| Microplate shaker | VWR | 12620-926 | |
| Organ-chip | Emulate | S-1 Chip | |
| Organ-chip holder | Emulate | AK-CCR | |
| P10 precision barrier pipette tips | Denville Scientific | P1096-FR | |
| P100 barrier pipette tips | Denville Scientific | P1125 | |
| P1000 barrier pipette tips | Denville Scientific | P1121 | |
| P20 barrier pipette tips | Denville Scientific | P1122 | |
| P200 barrier pipette tips | Denville Scientific | P1122 | |
| Plasma Asher | Quorum tech | K1050X RF | This Plasma Etcher/Asher/Cleaner was used as a part of Duke University's Shared Materials Instrumentation Facility (SMiF). |
| Round bottom polystyrene test tube with cell strainer snap cap | Corning | 352235 | |
| Serological pipette, 10 mL, indivdually wrapped | Corning | 356551 | |
| Serological pipette, 25 mL, indivdually wrapped | Corning | 356525 | |
| Serological pipette, 5 mL, indivdually wrapped | Corning | 356543 | |
| Steriflip, 0.22 µm, PES | EMD Millipore | SCGP00525 | |
| Sterile Microcentrifuge tubes | Thomas Scientific | 1138W14 | |
| T75cm2 cell culture flask with vent cap | Corning | 430641U | |
| Tissue culture-treated 12 well plates | Corning | 353043 | |
| Tissue culture-treated 6 well plates | Corning | 353046 | |
| Vacuum modulator and perstaltic pump (Zoe Culture Module) | Emulate | ZOE-CM1 | Organ Chip Bioreactor |
| VE-Cadherin CD144 anti-human antibody - APC conjugated | Miltenyi Biotec | 130-126-010 | |
| Wide-beveled cell lifter | Corning | 3008 | |
| MACS | |||
| CD144 MicroBeads, human | Miltenyi Biotec | 130-097-857 | |
| CD31 MicroBead Kit, human | Miltenyi Biotec | 130-091-935 | |
| LS columns | Miltenyi Biotec | 130-042-401 |
Références
- Wang, L., et al. A disease model of diabetic nephropathy in a glomerulus-on-a-chip microdevice. Lab on a Chip. 17 (10), 1749-1760 (2017).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), 1-12 (2017).
- Petrosyan, A., et al. A glomerulus-on-a-chip to recapitulate the human glomerular filtration barrier. Nature Communications. 10 (1), 3656 (2019).
- Hass, R., Kasper, C., Böhm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling. 9, 12 (2011).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: when do differences make a difference. Cell. 141 (4), 559-563 (2010).
- Da Sacco, S., et al. A novel source of cultured podocytes. PloS One. 8 (12), 81812 (2013).
- Singh, V. K., Kalsan, M., Kumar, N., Saini, A., Chandra, R. Induced pluripotent stem cells: applications in regenerative medicine, disease modeling, and drug discovery. Frontiers in Cell and Developmental Biology. 3, 2 (2015).
- Ebert, A. D., Liang, P., Wu, J. C. Induced pluripotent stem cells as a disease modeling and drug screening platform. Journal of cardiovascular pharmacology. 60 (4), 408-416 (2012).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Roye, Y. A personalized glomerulus chip engineered from stem cell-derived epithelium and vascular endothelium. Micromachines. 12 (8), 967 (2021).
- Roselli, S., et al. Podocin localizes in the kidney to the slit diaphragm area. The American Journal of Pathology. 160 (1), 131-139 (2002).
- Ruotsalainen, V., et al. Nephrin is specifically located at the slit diaphragm of glomerular podocytes. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7962-7967 (1999).
- Privratsky, J. R., Newman, P. J. PECAM-1: regulator of endothelial junctional integrity. Cell and Tissue Research. 355 (3), 607-619 (2014).
- Menon, M. C., Chuang, P. Y., He, C. J. The glomerular filtration barrier: components and crosstalk. International Journal of Nephrology. 2012, 749010 (2012).
- Abutaleb, N. O., Truskey, G. A. Differentiation and characterization of human iPSC-derived vascular endothelial cells under physiological shear stress. STAR Protocols. 2 (2), 100394 (2021).
- Pammolli, F., Magazzini, L., Riccaboni, M. The productivity crisis in pharmaceutical R&D. Nature Reviews. Drug Discovery. 10 (6), 428-438 (2011).
- Atchison, L., et al. iPSC-derived endothelial cells affect vascular function in a tissue-engineered blood vessel model of Hutchinson-Gilford progeria syndrome. Stem Cell Reports. 14 (2), 325-337 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon