Method Article
Chip glomerulo renale isogenico ingegnerizzato da cellule staminali pluripotenti indotte umane
In questo articolo
Riepilogo
Presentato qui è un protocollo per progettare un sistema organo-on-a-chip personalizzato che ricapitola la struttura e la funzione della barriera di filtrazione glomerulare renale integrando cellule endoteliali epiteliali e vascolari geneticamente abbinate differenziate dalle cellule staminali pluripotenti indotte umane. Questo sistema bioingegnerizzato può far progredire la medicina di precisione renale e le applicazioni correlate.
Abstract
La malattia renale cronica (CKD) colpisce il 15% della popolazione adulta degli Stati Uniti, ma l'istituzione di terapie mirate è stata limitata dalla mancanza di modelli funzionali in grado di prevedere con precisione le risposte biologiche umane e la nefrotossicità. I progressi nella medicina di precisione renale potrebbero aiutare a superare questi limiti. Tuttavia, i modelli in vitro precedentemente stabiliti del glomerulo renale umano - il sito primario per la filtrazione del sangue e un bersaglio chiave di molte malattie e tossicità dei farmaci - impiegano tipicamente popolazioni cellulari eterogenee con caratteristiche funzionali limitate e background genetici senza pari. Queste caratteristiche limitano significativamente la loro applicazione per la modellazione della malattia specifica del paziente e la scoperta terapeutica.
Questo articolo presenta un protocollo che integra l'epitelio glomerulare derivato dalle cellule staminali pluripotenti indotte umane (iPS) e l'endotelio vascolare da un singolo paziente per progettare un chip glomerulo renale microfluidico isogenico e vascolarizzato. Il chip glomerulo risultante è costituito da strati di cellule endoteliali ed epiteliali derivati da cellule staminali che esprimono marcatori specifici del lignaggio, producono proteine di membrana basale e formano un'interfaccia tessuto-tessuto simile alla barriera di filtrazione glomerulare del rene. Il chip glomerulo ingegnerizzato filtra selettivamente le molecole e ricapitola il danno renale indotto da farmaci. La capacità di ricostituire la struttura e la funzione del glomerulo renale utilizzando tipi di cellule isogeniche crea l'opportunità di modellare la malattia renale con la specificità del paziente e far progredire l'utilità degli organi su chip per la medicina di precisione renale e le applicazioni correlate.
Introduzione
I dispositivi organ-on-a-chip sono modelli dinamici 3D in vitro che impiegano la stimolazione molecolare e meccanica, nonché la vascolarizzazione, per formare interfacce tessuto-tessuto che modellano la struttura e la funzione di organi specifici. I dispositivi organ-on-a-chip precedentemente stabiliti che miravano a ricapitolare il glomerulo del rene (chip di glomerulo) consistevano in linee cellulari animali1 o linee cellulari primarie e immortalizzate umane di fonti eterogenee 2,3. L'uso di fonti cellulari geneticamente eterogenee presenta variazioni che limitano significativamente gli studi sulle risposte paziente-specifiche e sulla genetica o sui meccanismi di malattia 4,5. Affrontare questa sfida dipende dalla disponibilità di linee cellulari isogeniche provenienti da individui specifici con profili molecolari e genetici conservati per fornire un microambiente più accurato per l'ingegneria di modelli in vitro 2,3,6. Le linee cellulari isogeniche di origine umana possono ora essere facilmente generate grazie ai progressi nella coltura di cellule iPS umane. Poiché le cellule iPS umane sono tipicamente di origine non invasiva, possono auto-rinnovarsi indefinitamente e differenziarsi in quasi tutti i tipi di cellule, servono come fonte attraente di cellule per la creazione di modelli in vitro, come il chip glomerulo 7,8. La barriera di filtrazione glomerulare è il sito principale per la filtrazione del sangue. Il sangue viene prima filtrato attraverso l'endotelio vascolare, la membrana basale glomerulare e infine attraverso epitelio specializzato chiamato podocit. Tutti e tre i componenti della barriera di filtrazione contribuiscono alla filtrazione selettiva delle molecole. Presentato qui è un protocollo per stabilire un dispositivo organ-on-a-chip interfacciato con endotelio vascolare ed epitelio glomerulare da una singola fonte di cellule iPS umane. Mentre questo protocollo è particolarmente utile per progettare un chip isogenico e vascolarizzato per ricapitolare la barriera di filtrazione glomerulare, fornisce anche un modello per lo sviluppo di altri tipi di organi su chip personalizzati e piattaforme multi-organo come un sistema isogenico "body-on-a-chip".
Il protocollo qui descritto inizia con la differenziazione divergente delle cellule iPS umane in due linee separate: mesoderma laterale e cellule mesodermiche, che vengono successivamente differenziate rispettivamente in endotelio vascolare ed epitelio glomerulare. Per generare cellule mesodermiche laterali, le cellule iPS umane sono state seminate su piastre rivestite di matrice 1 della membrana basale e coltivate per 3 giorni (senza scambio di media) in terreno N2B27 integrato con l'attivatore Wnt, CHIR 99021, e il potente induttore del mesoderma, osso-morfogenetico 4 (BMP4). Le cellule del mesoderma laterale risultanti erano precedentemente caratterizzate dall'espressione di brachyury (T), mix paired-like homeobox (MIXL) ed eomesodermin (EOMES)9. Successivamente, le cellule del mesoderma laterale sono state coltivate per 4 giorni in un mezzo integrato con VEGF165 e Forskolin per indurre cellule endoteliali vascolari che sono state selezionate in base all'espressione di VE-Cadherin e / o PECAM-1 utilizzando la selezione cellulare attivata magneticamente (MACS). Le cellule endoteliali vascolari risultanti (viEC) sono state espanse coltivandole su matraccio rivestiti con matrice basale a 3 della membrana basale fino al momento di seminare nel dispositivo microfluidico.
Per generare cellule mesodermiche, le cellule iPS umane sono state seminate su piastre rivestite con matrice di membrana basale 2 e coltivate per 2 giorni in un mezzo contenente Activina A e CHIR99021. Le cellule del mesoderma risultanti erano caratterizzate dall'espressione di HAND1, goosecoide e brachury (T) come descritto in precedenza 2,10,11. Per indurre la differenziazione delle cellule del mesoderma intermedio (IM), le cellule del mesoderma sono state coltivate per 14 giorni in un terreno integrato con BMP-7 e CHIR99021. Le cellule IM risultanti esprimono il tumore 1 di Wilm (WT1), il gene box accoppiato 2 (PAX2) e la proteina 1 correlata a salto dispari (OSR-1)2,10,11.
Un chip microfluidico a base di polidimetilsilossano (PDMS) a due canali è stato progettato per ricapitolare la struttura della barriera di filtrazione glomerulare in vitro. Il canale urinario è 1.000 μm x 1.000 μm (l x ora) e la dimensione del canale capillare è 1.000 μm x 200 μm (l x ora). I cicli ciclici di stretching e rilassamento erano facilitati dalle camere cave presenti su ciascun lato dei canali fluidici. Le cellule sono state seminate su una membrana flessibile PDMS (50 μm di spessore) che separa i canali urinario e capillare. La membrana è dotata di pori esagonali (7 μm di diametro, 40 μm di distanza) per contribuire a promuovere la segnalazione intercellulare (Figura 1A)2,12. Due giorni prima che l'induzione IM fosse completa, i chip microfluidici sono stati rivestiti con matrice di membrana basale 2. I viECs sono stati seminati nel canale capillare del chip microfluidico utilizzando il mezzo di mantenimento endoteliale 1 giorno prima che l'induzione IM fosse completa e il chip è stato capovolto per consentire l'adesione cellulare sul lato basale della membrana PDMS rivestita di ECM. Il giorno in cui è stata completata l'induzione IM, le cellule sono state seminate nel canale urinario del chip microfluidico utilizzando un mezzo integrato con BMP7, Activina A, CHIR99021, VEGF165 e tutto l'acido trans retinoico per indurre la differenziazione dei podociti all'interno del chip. Il giorno seguente, i serbatoi dei fluidi sono stati riempiti con mezzo di induzione podocita e mezzo di mantenimento endoteliale, e il 10% di sforzo meccanico a 0,4 Hz e flusso di fluido (60 μL / h) sono stati applicati ai trucioli.
I chip microfluidici cellularizzati sono stati coltivati per ulteriori 5 giorni utilizzando il mezzo di induzione podocita (nel canale urinario) e il mezzo di mantenimento endoteliale (nel canale vascolare). I chip di glomerulo renale risultanti sono stati coltivati per un massimo di 7 giorni aggiuntivi in terreni di mantenimento sia per il podocita che per le cellule endoteliali. I podociti differenziati hanno espresso positivamente proteine specifiche del lignaggio, tra cui podocina e nefrrina 13,14, mentre le viECs hanno espresso positivamente le proteine di identificazione del lignaggio PECAM-1 e VE-Cadherin, tutte molecole essenziali per mantenere l'integrità della barriera di filtrazione glomerulare 15,16 . Si è scoperto che i podociti e le viECs secernono la proteina glomerulare più abbondante della membrana basale, il collagene IV, che è anche importante per la maturazione e la funzione dei tessuti.
Il sistema a tre componenti della barriera di filtrazione - endotelio, membrana basale ed epitelio - nei chip del glomerulo è stato trovato per filtrare selettivamente le molecole e rispondere a un trattamento farmacologico chemioterapico e nefrotossico. I risultati del trattamento farmacologico hanno indicato che il chip del glomerulo può essere utilizzato per studi di nefrotossicità e per la modellizzazione della malattia. Questo protocollo fornisce le linee guida generali per la progettazione di un chip funzionale di glomerulo renale microfluidico da derivati isogeni delle cellule iPS. Le analisi a valle del chip ingegnerizzato possono essere eseguite come desiderato dal ricercatore. Per ulteriori informazioni sull'uso del chip glomerulo per modellare la lesione glomerulare indotta da farmaci, fare riferimento alle pubblicazioni precedenti 2,12.
Protocollo
1. Preparare soluzioni di matrice di membrana basale e substrati rivestiti
- Scongelare la matrice della membrana basale 1 durante la notte su ghiaccio a 4 °C. Aliquote secondo il rapporto di diluizione suggerito dal fabbricante. Utilizzando un tubo conico da 50 mL e una pipetta, mescolare accuratamente una quantità appropriata di matrice di membrana basale 1 in 25 mL di DMEM/F12 freddo fino a completo scongelamento e dissoluzione.
- Per sciogliere un'aliquota congelata, prelevare ~200 μL dai 25 mL di DMEM/F12 freddo e trasferirlo nel tubo aliquote congelato. Pipettare su e giù fino a quando la matrice è completamente scongelata e sciolta. Trasferire l'intero contenuto del tubo della matrice della membrana basale 1 nel resto del DMEM/F12 freddo.
- Pipettare 1 mL di soluzione di matrice di membrana basale 1 in ciascun pozzetto di una piastra a 6 pozzetti. Per utilizzare le piastre rivestite lo stesso giorno, incubare a 37 °C per 2 ore.
- In alternativa, le piastre rivestite possono essere avvolte con parafilm e conservate a 4 °C per un massimo di 2 settimane. Quando è pronto per l'uso della piastra immagazzinata, incubare a 37 °C per 30 minuti.
- Diluire la matrice della membrana basale 2 in 9 mL di acqua distillata sterile per ottenere una concentrazione finale di 5 μg/mL. Pipettare 700 μL di soluzione di matrice 2 della membrana basale in ciascun pozzetto di una piastra da 12 pozzetti. Avvolgere le piastre rivestite a 2 strati della membrana basale con parafilm e conservare a 4 °C per un massimo di 2 settimane.
- Ricostituire la matrice 3 della membrana basale liofilizzata per ottenere una concentrazione finale di 1 mg/mL in soluzione salina tamponata fosfato (PBS, Ca+2- e Mg+2-free) come suggerito dal produttore. Diluire un'aliquota da 250 μL fino ad una concentrazione finale di 25 μg/mL in 9,75 mL di PBS (Ca+2 e Mg+2 free). Usare 6 mL di questa soluzione per rivestire un matraccio T75 (concentrazione finale di 2 μg/cm2). Conservare i matraccio rivestiti di matrice a 4 °C per un massimo di 1 settimana.
2. Coltura cellulare iPS umana
NOTA: La linea DU11 utilizzata in questo protocollo è stata testata ed è risultata priva di anomalie del micoplasma e del cariotipo.
- Incubare piastre rivestite con matrice basale a 1 a 37°C per 1-2 h.
- Lavare ogni pozzetto della piastra a 6 pozzetti 3x con 1 mL di DMEM/F12 caldo (37 °C). Aggiungere 2 ml di terreno di coltura cellulare iPS umano (CCM) (Tabella supplementare S1) a ciascun pozzetto della piastra a 6 pozzetti. Incubare le piastre a 37 °C mentre le cellule vengono preparate per la semina come descritto di seguito.
- Lavare ogni pozzetto della piastra a 6 pozzetti contenente cellule iPS umane con 1 mL di DMEM/F12 caldo.
- Aspirare il DMEM/F12. Aggiungere 1 mL di tampone di distacco della cella calda a ciascun pozzetto della piastra a 6 pozzetti. Incubare a 37 °C per 1 min.
- Ispezionare visivamente ogni pozzetto al microscopio per la dissociazione attorno ai bordi della colonia cellulare. Aspirare con attenzione il tampone di distacco cellulare dalle cellule. Lavare delicatamente ogni pozzetto con 1 mL di DMEM/F12 caldo.
- Ispezionare le piastre al microscopio per assicurarsi che le cellule non si siano completamente staccate dalla piastra o siano state aspirate accidentalmente.
- Aggiungere 3 ml di CCM iPS umano caldo a ciascun pozzetto della piastra a 6 pozzetti con celle. Usando un sollevatore di cellule, raschiare delicatamente le colonie. Utilizzando una pipetta sierologica da 5 ml, mescolare delicatamente la sospensione cellulare in ciascun pozzetto su e giù una volta.
- Estrarre la nuova piastra rivestita con matrice di membrana basale 1 dall'incubatore. Trasferire 0,5 ml della sospensione cellulare in ciascun pozzetto della nuova piastra rivestita con 1 matrice della membrana basale. Muovi la piastra con un movimento a forma di otto per distribuire uniformemente le celle. Incubare a 37 °C in un incubatore al 5% di CO2 .
- Aspirare il mezzo esaurito e sostituirlo con 3 ml di CCM iPS umano ogni giorno di coltura fino a quando le cellule sono confluenti al 70% (circa 4 giorni dopo il passaggio).
3. Giorni 0-16: differenziazione delle iPSC umane in cellule mesodermiche intermedie
- Giorni 0-2: induzione del mesoderma
- Spostare le piastre rivestite a matrice basale a 2 da 4 °C a temperatura ambiente per 2 ore per equilibrare dopo lo stoccaggio.
- Aspirare il mezzo esaurito da ciascun pozzetto della piastra a 6 pozzetti contenente circa il 70% di cellule iPS umane confluenti. Lavare delicatamente le celle 3 volte con 1 mL di DMEM/F12 caldo.
- Aspirare il DMEM/F12. Aggiungere 1 mL di tampone di distacco cellulare a ciascun pozzetto della piastra a 6 pozzetti di cellule iPS umane. Incubare a 37 °C per 5-7 min.
- Ispezionare visivamente ogni pozzetto al microscopio per la dissociazione attorno ai bordi della colonia cellulare. Usando un sollevatore di cellule, raschiare delicatamente le colonie.
- Trasferire le sospensioni cellulari da tutti i pozzetti della piastra a 6 pozzetti in un tubo conico da 15 mL e utilizzare un P1000 per pipettare su e giù più volte per ottenere una sospensione a cella singola delle cellule iPS.
- Riempire la sospensione cellulare nel tubo conico a 14 mL con DMEM/F12. Centrifugare per 5 min a 200 × g a temperatura ambiente.
- Aspira il surnatante. Risospendere il pellet cellulare in 14 ml di DMEM/F12 caldo. Ripetere la centrifugazione per 5 minuti a 200 × g a temperatura ambiente.
- Aspira il surnatante. Risospendere le cellule in 1 mL di mezzo di induzione Mesoderm (Tabella supplementare S1). Contare le cellule usando un emocitometro. Diluire in mezzo di induzione Mesoderm per raggiungere una concentrazione finale di 1 × 105 cellule/ml.
- Aspirare il rivestimento dalla piastra rivestita a 2 strati della membrana basale della membrana. Risciacquare ogni pozzetto della membrana basale 2 piastre rivestite 2x con 1 mL di DMEM/F12 caldo.
- Pipettare delicatamente la sospensione cellulare su e giù 2x. Trasferire 1 mL della sospensione cellulare in ciascun pozzetto della piastra rivestita con 2 della membrana basale. Spostare delicatamente la piastra in un movimento a figura di otto per distribuire uniformemente le celle.
- Incubare la piastra a 37 °C durante la notte. Il giorno successivo (giorno 1), aspirare il mezzo esaurito da ciascun pozzetto della piastra a 12 pozzetti. Sostituire con 1 mL di mezzo caldo Mesoderm Induction. Incubare a 37 °C durante la notte.
- Giorni 2-16: induzione intermedia del mesoderma
- Aspirare il mezzo di induzione Mesoderm esaurito. Sostituire con 1 m L di mezzo di induzione Mesoderma intermedio caldo (Tabella supplementare S1). Aspirare il mezzo esaurito e sostituirlo con 1 ml di mezzo di induzione Mesoderma intermedio caldo ogni giorno per 14 giorni.
4. Giorni 0-15: differenziazione ed espansione delle iPSCs umane in cellule endoteliali vascolari
- Giorno 0: semina delle cellule iPS umane
- Preparare 15 mL di CCM iPS umano con inibitore ROCK (Tabella supplementare S1). Tenere in caldo a 37 °C.
- Incubare una piastra rivestita con 1 membrana basale per 1-2 ore a 37 °C. Aspirare la matrice della membrana basale 1. Lavare 3 volte con 1 mL di DMEM/F12 caldo.
- Aspirare il DMEM/F12. Aggiungere 2 ml di CCM iPS umano con inibitore ROCK a ciascun pozzetto della piastra a 6 pozzetti. Incubare le piastre a 37 °C mentre le cellule vengono preparate per la semina come descritto di seguito.
- Aspirare il mezzo esaurito da ciascun pozzetto della piastra a 6 pozzetti contenente circa il 70% di cellule iPS umane confluenti. Lavare delicatamente le celle 3 volte con 1 mL di DMEM/F12 caldo.
- Aspirare il DMEM/F12. Aggiungere 1 mL di tampone di distacco cellulare a ciascun pozzetto della piastra a 6 pozzetti di cellule iPS umane. Incubare a 37 °C per 5-7 minuti per dissociare le cellule in singole cellule.
NOTA: A causa delle differenze intrinseche tra le linee cellulari iPS, l'utente dovrà ispezionare visivamente le cellule dopo 5 minuti per determinare il tempo di incubazione ottimale. - Trasferire le cellule in un tubo conico da 15 ml. Portare la sospensione cellulare fino a 14 ml con DMEM/F12 caldo per neutralizzare il tampone di distacco. Centrifugare per 5 min a 200× g a temperatura ambiente.
- Aspirare delicatamente il surnatante. Risospendere le cellule in 1 mL di CCM iPS umano con inibitore ROCK. Contare il numero totale di cellule utilizzando un emocitometro.
- Seminare le cellule tra 37.000 e 47.000 cellule / cm2 (da 355.200 a 451.200 cellule / pozzetto di una piastra a 6 pozzetti). Incubare a 37 °C durante la notte.
NOTA: a causa delle differenze intrinseche tra le linee cellulari iPS, l'utente dovrà determinare la densità di semina ottimale.
- Giorni 1-3: induzione del mesoderma laterale
- Il giorno successivo (giorno 1), aspirare il mezzo esaurito da ciascun pozzetto della piastra a 6 pozzetti di cellule iPS umane. Sostituire ciascun pozzetto della piastra a 6 pozzetti con 5 ml di mezzo di induzione del mesoderma laterale (Tabella supplementare S1). Quando si scala il recipiente di coltura (ad esempio, i palloni di coltura), in genere, sostituire con 3 volte il volume di lavoro nel recipiente di coltura.
- Non cambiare questo supporto per 3 giorni.
NOTA: Il mezzo di induzione del mesoderma laterale nei pozzetti normalmente cambia colore dal rosso al giallo man mano che le cellule consumano i nutrienti. Tuttavia, il terreno torbido o il terreno con crescita batterica non è normale e deve essere decontaminato e scartato come tale.
- Giorni 4-6: induzione delle cellule endoteliali
- Aspirare il mezzo esaurito da ciascun pozzetto della piastra a 6 pozzetti. Sostituire ciascun pozzetto della piastra a 6 pozzetti con 3 ml di mezzo caldo di induzione endoteliale (Tabella supplementare S1). Incubare la piastra a 37 °C durante la notte.
- Per i successivi 2 giorni (giorni 5 e 6), raccogliere il mezzo esaurito da tutti i pozzetti in un tubo conico da 50 ml. Conservare il tubo conico a 4 °C. Ricostituire le cellule con 3 ml di mezzo caldo di induzione endoteliale. Incubare la piastra a 37 °C.
- Giorno 7: selezione delle cellule endoteliali (viEC)
- Estrarre la matrice della membrana basale 3 palloni e lasciare a temperatura ambiente per 1 ora.
- Preparare 50 mL di buffer MACS (Tabella supplementare S1).
- Posizionare il tampone di distacco cellulare, il tampone MACS, il CCM endoteliale e il PBS (liberi da Ca 2+ e Mg2+) sul ghiaccio nella cappa di coltura tissutale.
- Posizionare il magnete sul supporto MACS. Posizionare due tubi conici da 50 mL e un tubo conico da 15 mL in un supporto per tubo conico.
- Posizionare il supporto MACS (con magnete collegato) e una colonna LS nella cappa di coltura tissutale. Posizionare il supporto del tubo conico (con tubi conici all'interno) sul supporto MACS, sotto il magnete (Figura supplementare S1A).
- Raccogliere il mezzo esaurito da ciascun pozzetto della piastra a 6 pozzetti nel tubo conico da 50 mL dal punto 4.3.2. Lavare ogni pozzetto della piastra a 6 pozzetti con PBS (libero da Ca 2+ e Mg2+).
- Aspirare il PBS. Aggiungere 1 mL di buffer di distacco della cella. Incubare a 37 °C per 5-7 minuti per dissociare completamente le cellule.
- Trasferire le cellule in un tubo conico da 50 ml. Portare la sospensione cellulare a 15 ml con CCM endoteliale freddo. Centrifugare a 200 × g per 5 minuti a temperatura ambiente.
- Aspira il surnatante. Risospendere le celle in 1 mL di tampone MACS freddo. Contare le cellule con un emocitometro.
- Aggiungere 10 mL di buffer MACS alla sospensione cellulare. Centrifugare per 5 min a 200 × g a temperatura ambiente.
- Aspira il surnatante. Risospendere le celle in 80 μL di buffer MACS per 10 milioni di celle. Aggiungere 20 μL per 10 milioni di cellule di reagente bloccante FcR, microsfere CD31 e microsfere CD144. Incubare per 15 minuti su ghiaccio.
- Durante l'incubazione della sospensione cellulare, centrifugare il terreno raccolto dall'induzione endoteliale (punto 4.3.2) a 200 × g per 10 minuti.
- Raccogliere il surnatante in un filtro sottovuoto da 500 ml da 0,22 μm. Preparare il mezzo endoteliale condizionato (Tabella supplementare S1). Filtrare il terreno in condizioni sterili e mantenerlo caldo a 37 °C.
NOTA: Il tasso di proliferazione delle cellule endoteliali inizierà a diminuire dopo il passaggio 3. Per ottenere una crescita esponenziale dopo il passaggio 3, il terreno endoteliale condizionato e di mantenimento può essere integrato con inibitore del TGF-beta 10 μM (SB431542) a partire dal passaggio 1. - Dopo l'incubazione di 15 minuti al punto 4.4.11, aggiungere 10 mL di tampone MACS per 10 milioni di cellule (massimo 30 mL di tampone MACS) alla sospensione cellulare. Centrifugare a 200 × g per 5 min.
- Aspira il surnatante. Risospendere in 1 mL di buffer MACS.
- Prendere la colonna LS ed estrarre lo stantuffo dalla siringa. Riposizionare lo stantuffo nel manicotto di plastica. Posizionare la colonna sul magnete.
- Posizionare il primo tubo conico da 50 mL sotto la colonna. Aggiungere 1 mL di buffer MACS alla colonna. Raccogliere nel tubo conico da 50 mL sottostante.
- Lasciare passare il liquido, anche se non completamente per evitare che la colonna si asciughi. Quando le gocce di liquido iniziano a gocciolare lentamente, aggiungere la sospensione cellulare alla colonna. Raccogliere il flusso nello stesso tubo conico da 50 ml.
- Quando le gocce di liquido iniziano a gocciolare lentamente, posizionare il successivo tubo conico da 50 ml sotto la colonna. Aggiungere il flusso iniziale (passaggio 4.4.18) alla colonna. Raccogliere nel tubo conico da 50 mL sottostante.
- Quando le gocce di liquido iniziano a gocciolare lentamente, aggiungere 500 μL di tampone MACS 3x per lavare la colonna.
- Rimuovere la colonna dal magnete. Posizionare la colonna sul tubo conico da 15 ml. Aggiungere 1 mL di PBS freddo alla colonna.
- Per raccogliere le celle, prendere lo stantuffo dal manicotto di plastica e spingerlo saldamente nella colonna.
- Contare le cellule usando un emocitometro. Portare la sospensione cellulare a 5 mL con PBS. Centrifugare per 5 min a 200 × g.
- Mentre le cellule sono sottoposte a centrifugazione, lavare il matraccio rivestito con matrice basale a 3 volte con 5 ml di PBS per preparare la semina cellulare. Aspirare il PBS e aggiungere 20 ml di mezzo endoteliale condizionato al matraccio rivestito con matrice basale a 3 rivestiti.
- Rimuovere le cellule dalla centrifuga e aspirare il surnatante. Risospendere le cellule in mezzo endoteliale condizionato per seminare a 26.000 cellule/cm2 (1,95 × 106 cellule/pallone T75). Semina le cellule.
- Per calcolare l'efficienza di ordinamento e la resa delle celle, dividere il conteggio delle celle dal punto 4.4.23 per il conteggio delle celle dal punto 4.4.9.
- Giorni 8-15: espansione delle viECs
- Il giorno successivo (giorno 8), aspirare il mezzo esaurito dal pallone. Sostituire con 10 ml di mezzo endoteliale condizionato. Sostituire il mezzo Endoteliale Condizionato a giorni alterni fino a quando il matraccio è confluente al 90% o fino a quando il flacone con mezzo Endoteliale Condizionato è completamente utilizzato.
- Aspirare il mezzo esaurito e sostituirlo con 10 ml di terreno di mantenimento endoteliale (Tabella supplementare S1) a giorni alterni per continuare l'espansione.
- Per far passare i viECs, preparare due matraschi T75 rivestiti con matrice basale a 3 rivestiti. Lasciare i palloni a temperatura ambiente per 1 ora. Lavare accuratamente i palloni appena preparati 3x con 5 ml di PBS.
- Aspirare il PBS. Aggiungere 10 ml di terreno caldo di mantenimento endoteliale a ciascun matraccio appena preparato. Incubare le piastre a 37 °C mentre le cellule vengono preparate per la semina come descritto di seguito.
- Aggiungere 5 mL di tampone di distacco di cellule a un matraccio T75 confluente al 90% di viECs. Incubare a 37 °C per 5-7 min. Trasferire le cellule in un tubo conico da 15 ml. Aggiungere 5 ml di DMEM/F12 caldo. Centrifugare a 200 × g per 5 min.
- Aspira il surnatante. Risospendere in 1 mL di terreno caldo di mantenimento endoteliale. Aggiungere 500 μL della sospensione cellulare a ciascuno dei palloni T75 appena preparati.
- Il giorno dopo, aspirare il mezzo esaurito. Sostituire con 10 mL di terreno di mantenimento endoteliale. Aspirare il mezzo esaurito e sostituirlo con 10 mL di mezzo di mantenimento endoteliale a giorni alterni fino a quando il matraccio è confluente al 90%.
5. Giorno 14: preparazione di dispositivi microfluidici con chip d'organo per la coltura cellulare
- Trattamento al plasma e rivestimento della membrana basale matrix 2
- Preparare la soluzione di matrice 2 della membrana basale (fase 1.3). Mettetelo da parte.
- In una cappa di coltura sterile, disimballare la capsula di Petri rotonda sterile da 100 x 15 mm. Posizionare la parte superiore della capsula di Petri, rivolta verso il basso, sotto il fondo della capsula di Petri (Figura supplementare S1B).
- Usando una pinzetta, estrarre i chip microfluidici dalla confezione e posizionarli all'interno della capsula di Petri. Chiudere la piastra di Petri usando il coperchio da sotto il piatto.
- Al dosher al plasma, posizionare il coperchio della capsula di Petri sotto il piatto, rivolto verso il basso, tenendoli insieme come un'unica unità. Posizionare l'unità della capsula di Petri nella camera di asher al plasma. Avviare l'asher al plasma con ossigeno a 100 W, 15 SCCM, 30 s.
- Sensibile al tempo: una volta completato il trattamento, estrarre l'unità a piastre di Petri dall'analizzatore al plasma. Pulire rapidamente e leggermente il coperchio della capsula di Petri con etanolo al 70% spruzzato su una salvietta da laboratorio. Coprire la capsula di Petri con il coperchio.
- Portare la capsula di Petri sul cappuccio di coltura del tessuto sterile. Aggiungere delicatamente 25 μL di soluzione di matrice 2 della membrana basale nel canale urinario (superiore) del chip. Aggiungere 20 μL di soluzione di matrice 2 della membrana basale nel canale capillare (inferiore) del chip.
- Prendere due tappi conici sterili da 15 mL e riempirli con acqua distillata sterile (~500 μL). Posizionare il cappuccio nella capsula di Petri per evitare che i canali del chip e la membrana si secchino. Posizionare il coperchio sul piatto. Incubare a 37 °C durante la notte.
6. Semina di viECs e cellule mesodermiche intermedie nei dispositivi microfluidici
- Giorno 15: viECs
- Aspirare il mezzo da palloni T75 contenenti il 90% di viECs confluenti. Aggiungere 5 ml di tampone di distacco cellulare e incubare a 37 °C per 5-7 minuti.
- Trasferire le cellule in un tubo conico da 15 ml. Aggiungere 5 mL di DMEM/F12. Centrifugare a 200 × g per 5 min.
NOTA: Ogni pallone T75 con circa il 90% di viECs confluenti produrrà ~ 3 milioni di cellule. - Aspira il surnatante. Risospendere le cellule in 300 μL di terreno di mantenimento endoteliale per ottenere circa 2 milioni di cellule/300 μL. Contare le cellule con un emocitometro. Mettere da parte la sospensione cellulare.
- Trasferire la capsula di Petri contenente i chip microfluidici nella cappa di coltura tissutale. Fissare una punta barriera P200 alla punta di un aspiratore.
- Lavare entrambi i canali superiore e inferiore del chip microfluidico con 200 μL di DMEM/F12 aspirando contemporaneamente la periferia dell'uscita.
- Tenere saldamente il chip con la punta della barriera P200 attaccata all'aspiratore, lontano dall'uscita del canale inferiore. Iniettare saldamente 20 μL della sospensione viEC con circa 134.000 cellule nel canale capillare (inferiore) del chip. Aspirare con cura il mezzo dalla periferia della presa.
- Verificare al microscopio la presenza di bolle o di una densità di semina viEC non uniforme.
- Capovolgere delicatamente il chip per capovolgerlo in modo che i viECs possano aderire al lato basale della membrana PDMS flessibile. Inserire il chip nella cartuccia del supporto. Aggiungere 3 mL di PBS nella cartuccia del portachip per evitare che la membrana si asciughi. Incubare il trucioli a 37 °C per 3 ore.
- Controllare il canale inferiore sotto il microscopio per uno strato confluente di viECs attaccato alla membrana PDMS flessibile. Far cadere 200 μL di mezzo di mantenimento endoteliale sull'ingresso del canale inferiore e lasciarlo fluire attraverso il canale per lavare il canale delle cellule endoteliali non attaccate mentre si aspira accuratamente dalla periferia dell'uscita del canale capillare (inferiore).
- Rimettere il chip nella cartuccia del supporto. Incubare a 37 °C durante la notte.
- Giorno 16: cellule intermedie del mesoderma (IM)
- Lavare delicatamente il canale capillare (inferiore) con 200 μL di mezzo di mantenimento endoteliale aspirando con attenzione la periferia della porta di uscita.
- Lavare il canale urinario (superiore) con 200 μL di DMEM/F12 aspirando con attenzione la periferia dell'uscita. Rilasciare ~50 μL di DMEM/F12 sulle porte di ingresso e uscita.
- Aspirare il mezzo intermedio di induzione del mesoderma da ciascun pozzetto della piastra a 12 pozzetti.
NOTA: Ogni pozzetto alla fine della differenziazione fornisce circa 1,5 milioni di cellule IM. - Aggiungere 1 mL di tripsina-EDTA a ciascun pozzetto della piastra a 12 pozzetti e incubare a 37 °C per 5 minuti.
- Raschiare delicatamente le cellule usando un sollevatore di cellule e pipettare su e giù per dissociare le cellule usando un P1000. Aggiungere 2 mL di soluzione di neutralizzazione della tripsina (Tabella supplementare S1) a ciascun pozzetto. Trasferire le cellule in un tubo conico da 50 ml. Portare il volume della sospensione cellulare a 50 mL con DMEM/F12 e centrifugare a 200 × g per 5 minuti.
- Aspira il surnatante. Risospendere le cellule in 500 μL di mezzo intermedio di induzione del mesoderma per ottenere circa 3 milioni di cellule/500 μL. Contare le cellule con un emocitometro.
- Tenere saldamente il chip con la punta barriera P200 attaccata all'aspiratore, lontano dall'uscita del canale urinario (superiore). Iniettare con decisione 25 μL di sospensione cellulare con circa 112.500 cellule IM nel canale urinario (superiore) del chip e aspirare accuratamente il mezzo dalla periferia dell'uscita.
- Controllare al microscopio la presenza di bolle o di una densità di semina delle celle IM irregolare. Aggiungere 3 mL di PBS nella cartuccia portachip. Incubare a 37 °C per 3 ore.
- Lavare entrambi i canali con 200 μL dei rispettivi terreni di coltura cellulare aspirando attentamente la periferia delle uscite del chip per aiutare a prevenire il flusso all'indietro del mezzo esaurito e dei detriti cellulari.
- Attaccare punte di barriera P200 vuote in entrambe le uscite dei canali urinario e capillare. Pipettare 200 μL di terreno di mantenimento endoteliale e iniettarne metà nell'ingresso del canale capillare. Rilasciare la punta della pipetta all'interno dell'ingresso in modo che sia l'ingresso che l'uscita del canale siano ora collegati alle punte delle pipette riempite con il fluido.
- Pipettare 200 μL di terreno di mantenimento IM e iniettarne metà nell'ingresso del canale urinario. Rilasciare la punta della pipetta all'interno dell'ingresso in modo che sia l'ingresso che l'uscita del canale siano ora collegati alle punte delle pipette riempite con il fluido. Incubare i trucioli con punte incorporate a 37 °C durante la notte.
- Collegare i chip al bioreattore Organ Chip per applicare il flusso del fluido e la deformazione meccanica.
- Rimuovere le punte P200 dai canali urinario e capillare. Aggiungere goccioline dei rispettivi mezzi all'ingresso e all'uscita dei canali urinario e capillare per prevenire l'essiccazione.
- Aggiungere 3 ml di mezzo caldo di induzione Podocyte (Tabella supplementare S1) al serbatoio urinario in ingresso. Aggiungere 3 ml di mezzo caldo di mantenimento endoteliale al serbatoio di ingresso capillare.
- Aggiungere 300 μL di mezzo caldo di induzione Podocyte al serbatoio di uscita del canale urinario direttamente sopra la porta di uscita. Aggiungere 300 μL di mezzo caldo di mantenimento endoteliale al serbatoio di uscita del canale capillare direttamente sopra la porta di uscita.
- Far scorrere i baccelli sul vassoio e nel bioreattore Organ Chip.
- Utilizzare il quadrante rotante sul bioreattore del chip dell'organo per selezionare e avviare il primo ciclo (2 min). Ispezionare visivamente la parte inferiore del pod per individuare piccole goccioline in tutte e quattro le porte fluidiche.
- Per ottenere un contatto fluido-fluido tra la parte inferiore del Pod e le porte del chip microfluidico, far scorrere delicatamente il supporto del chip nel Pod. Premere delicatamente la linguetta del portachip verso l'interno e verso l'alto. Aspirare il mezzo in eccesso dalla superficie del chip.
- Impostare la portata del bioreattore con chip d'organo a 60 μL/h. Impostare la deformazione ciclica al 10% a 0,4 Hz. Utilizzare il quadrante rotante sul bioreattore del chip dell'organo per selezionare il ciclo di regolazione e correre per 2 ore.
- Ispezionare visivamente i serbatoi di uscita per un aumento del livello del mezzo.
- Utilizzare la manopola sul bioreattore Organ Chip per selezionare il ciclo di regolazione.
7. Giorni 17-21 e oltre: induzione del podocita e mantenimento dei trucioli
- Aspirare il terreno dai serbatoi di uscita del canale urinario in diagonale lontano dalla porta, ma mantenere un po 'di terreno nel serbatoio ogni giorno di coltura. Ricostituire il serbatoio di ingresso del canale urinario con un massimo di 3 ml di terreno di induzione podocita ogni 2 giorni per 5 giorni.
- Dopo 5 giorni, aspirare il mezzo dal canale urinario ma mantenere un po 'di terreno nel serbatoio. Ricostituire quotidianamente il serbatoio di ingresso del canale urinario con 3 ml di terreno di mantenimento Podocyte.
- Aspirare il terreno dai serbatoi di uscita del canale capillare in diagonale lontano dal porto, ma mantenere un po 'di terreno nel serbatoio ogni giorno di coltura. Ricostituire quotidianamente il serbatoio di ingresso del canale capillare con un massimo di 3 ml di mezzo di mantenimento endoteliale.
8. Saggio funzionale e imaging a immunofluorescenza
NOTA: Vedere il file supplementare 1 per i dettagli sull'analisi della citometria a flusso, ELISA per l'effluente del chip e l'isolamento dell'mRNA.
- Saggio funzionale (filtrazione molecolare) mediante inulina e albumina
- Aspirare il fluido dal serbatoio di uscita del canale capillare in diagonale lontano dalla porta, ma mantenere un po 'di mezzo nel serbatoio. Sostituire con 3 mL di terreno di mantenimento endoteliale integrato con inulina e albumina (Tabella supplementare S1) per 6 ore.
- Utilizzando una pipetta sierologica da 5 ml, misurare il volume (in ml) del terreno dal canale urinario e trasferirlo in un tubo conico da 15 ml. Avvolgere il tubo in un foglio di alluminio per proteggere dalla luce e ridurre al minimo il fotosbiancamento dell'inulina e dell'albumina coniugate con fluoroforo. Ricostituire il serbatoio con 3 ml di mezzo di mantenimento Podocyte.
- Preparare una soluzione madre di inulina in mezzo di mantenimento Podocyte. A partire da 25 μg/mL di inulina, preparare otto standard di inulina mediante una diluizione seriale 2x in mezzo di mantenimento Podocyte.
- Allo stesso modo, preparare una soluzione madre di albumina in mezzo di mantenimento Podocyte. A partire da 150 μg/mL di albumina, preparare otto standard di albumina tramite una diluizione seriale 2x in mezzo di mantenimento Podocyte.
- Pipettare in duplicato 100 μL di ciascuna concentrazione standard di inulina in ciascun pozzetto di una piastra nera a 96 pozzetti (o 16 pozzetti totali di inulina). Pipettare in duplicati 100 μL di ciascuna concentrazione standard di albumina in ciascun pozzetto della stessa piastra a 96 pozzetti (16 pozzetti totali di albumina). Pipettare in un mezzo di manutenzione Podocyte da 100 μL da 100 μL per fungere da bianco (o due pozzetti totali del mezzo di manutenzione Podocyte).
- Pipettare in duplicati 100 μL di mezzo effluente dal canale urinario in ciascun pozzetto della stessa piastra a 96 pozzetti. Pipettare in duplicati 100 μL di mezzo effluente dal canale capillare.
- Inserire la piastra nel lettore di piastre e misurare la fluorescenza per l'albumina a eccitazione 550 nm ed emissione 615 nm. Misurare la stessa piastra per l'inulina all'eccitazione 513 nm e all'emissione 577 nm.
- Dai dati generati, calcolare la media delle misurazioni duplicate (per chip). Sottrarre il valore vuoto corrispondente a quella lettura della lastra dal resto dei dati sul foglio.
- Tracciare i valori corrispondenti agli standard dell'albumina per creare una curva standard con concentrazione [μg/ml] sull'asse x e fluorescenza sull'asse y. Tracciare i valori corrispondenti agli standard di inulina per creare una curva standard con concentrazione [μg/mL] sull'asse x e fluorescenza sull'asse y.
- Utilizzare un pacchetto software di analisi statistica e l'interpolazione lineare per determinare la concentrazione urinaria di inulina e albumina, rispettivamente, nel mezzo effluente dai chip.
- Determinare la clearance urinaria di inulina/albumina dai chip usando l'equazione (1)2:
Clearance urinaria = ([U] × UV) / [P] (1)
Dove [U] è la concentrazione urinaria della fase 8.1.10, UV è il volume dell'effluente del canale urinario raccolto dal punto 8.1.2 e [P] è la concentrazione capillare di inulina o albumina (10 μg/mL di inulina o 100 μg/mL di albumina).
- Imaging a immunofluorescenza
- Iniettare una punta P200 vuota nelle porte di uscita dei canali urinario e capillare. Per fissare le celle, pipettare 200 μL di formaldeide al 4% e iniettarne metà nell'ingresso del canale inferiore. Rilasciare la punta della pipetta all'interno dell'ingresso.
- Pipettare 200 μL di formaldeide al 4% e iniettarne metà nell'ingresso del canale urinario. Rilasciare la punta della pipetta all'interno dell'ingresso in modo che sia l'ingresso che l'uscita del canale siano ora collegati alle punte delle pipette riempite con fissativo.
- Incubare le patatine a temperatura ambiente per 20 minuti.
- Dopo 20 minuti, eliminare tutte le punte delle pipette. Iniettare punte P200 pulite e vuote nelle porte di uscita dei canali urinario e capillare. Per permeabilizzare le cellule, pipettare 200 μL di Triton X-100/PBS allo 0,125% e iniettarne metà nell'ingresso del canale capillare. Rilasciare la punta della pipetta all'interno dell'ingresso.
- Pipettare 200 μL di Triton X-100/PBS allo 0,125% e iniettarne metà nell'ingresso del canale urinario. Rilasciare la punta della pipetta all'interno dell'ingresso. Incubare il chip a temperatura ambiente per 5 minuti.
- Eliminare tutte le punte delle pipette. Iniettare punte P200 pulite e vuote nelle porte di uscita dei canali urinario e capillare. Per bloccare le cellule, pipettare 200 μL di albumina sierica bovina all'1% (BSA) in Triton X-100/PBS allo 0,125% e iniettarne metà nell'ingresso del canale capillare. Rilasciare la punta della pipetta all'interno dell'ingresso.
- Pipettare 200 μL di BSA all'1% in Triton X-100/PBS allo 0,125% e iniettarne metà nell'ingresso del canale urinario. Rilasciare la punta della pipetta all'interno dell'ingresso. Incubare a temperatura ambiente per 30 min.
- Eliminare tutte le punte delle pipette. Lavare entrambi i canali 3 volte mediante pipettaggio di 200 μL di Triton X-100/PBS allo 0,125% in ciascun canale e incubare a temperatura ambiente per 5 minuti.
- Preparare 100 μL di anticorpo primario per canale con la diluizione raccomandata dal produttore in 0,125% Triton X-100/PBS. Iniettare punte P200 pulite e vuote nelle porte di uscita dei canali urinario e capillare. Pipettare 100 μL di anticorpo primario e iniettarne metà nei rispettivi canali. Rilasciare la punta della pipetta all'interno dell'ingresso.
- Incubare per 1 ora a temperatura ambiente o, per risultati migliori, per una notte a 4 °C.
NOTA: più anticorpi primari possono essere applicati contemporaneamente; Tuttavia, la soluzione anticorpale primaria deve essere diluita secondo le istruzioni del produttore. - Lavare i canali 3 x 10 minuti come descritto al punto 8.2.8.
- Preparare 100 μL di anticorpo secondario per canale con il fattore di diluizione raccomandato dal produttore in 0,125% Triton X-100/PBS. Iniettare punte P200 pulite e vuote nelle porte di uscita dei canali urinario e capillare. Pipettare 100 μL di anticorpo secondario e iniettarne metà nei rispettivi canali. Rilasciare le punte delle pipette all'interno dell'ingresso. Incubare per 1 ora a temperatura ambiente.
NOTA: Ogni anticorpo secondario deve essere applicato separatamente. Lavare almeno 3 x 10 minuti tra ogni applicazione secondo il punto 8.2.8. - Lavare i canali 3 x 10 minuti come descritto al punto 8.2.8.
- Lavare entrambi i canali una volta con 200 μL di acqua distillata aspirando il fluido residuo dalla periferia delle porte di uscita del truciolo.
- Iniettare P200 pulito e vuoto nelle porte di uscita dei canali urinario e capillare. Per contrastare le cellule, pipettare 200 μL di 4',6-diamidino-2-fenilindolo (DAPI, diluizione 1:1.000 in acqua distillata) e iniettarne metà nell'ingresso del canale capillare. Rilasciare la punta della pipetta all'interno dell'ingresso, pipettare 200 μL di DAPI e iniettarne metà nell'ingresso del canale urinario. Rilasciare la punta della pipetta all'interno dell'ingresso e incubare a temperatura ambiente per 5 minuti.
- Eliminare tutte le punte delle pipette. Iniettare punte P200 pulite e vuote nelle porte di uscita dei canali urinario e capillare. Per contrastare le cellule, pipettare 200 μL di falloidina (diluizione 1:1.000 in PBS senza Ca 2+ e Mg2+) e iniettarne metà nell'ingresso del canale capillare e rilasciare la punta della pipetta all'interno dell'ingresso. Pipettare 200 μL di falloidina (diluizione 1:1.000 in PBS senza Ca 2+ e Mg2+) e iniettarne metà nell'ingresso del canale urinario e rilasciare la punta della pipetta all'interno dell'ingresso. Incubare a temperatura ambiente per 15 min.
- Lavare i canali 3x con 200 μL di PBS senza Ca 2+ e Mg2+ e aspirare il fluido in eccesso dalla periferia delle porte di uscita.
- Visualizza i chip.
Risultati
Qui mostriamo che un modello funzionale 3D in vitro del glomerulo può essere vascolarizzato ed epitelalizzato da una fonte isogenica di cellule iPS umane. In particolare, questo protocollo fornisce istruzioni su come applicare la tecnologia delle cellule iPS umane, in particolare la loro capacità di differenziarsi in tipi cellulari specializzati, per generare epitelio glomerulare renale (podociti) ed endotelio vascolare (viECs) che possono essere integrati con dispositivi microfluidici per modellare la struttura e la funzione del rene umano a livello specifico del paziente. Una panoramica schematica di questo protocollo e della linea temporale (Figura 1A) descrive come coltivare cellule iPS umane mitoticamente attive (Figura 1B) e quindi differenziarle (in parallelo) in mesoderma e linee cellulari laterali del mesoderma (Figura 1C, D). Le cellule del mesoderma risultanti sono risultate esprimere brachiuria (T), mentre le cellule del mesoderma laterale esprimevano brachiuria (T), MIXL e EOMES 2,9,10,11.
La successiva differenziazione delle cellule del mesoderma ha prodotto cellule mesodermiche intermedie (IM), mentre la differenziazione delle cellule del mesoderma laterale ha prodotto viECs (Figura 1D)2,10,11,17. L'analisi della citometria a flusso è stata utilizzata per esaminare l'espressione di CD144 in viECs differenziate (prima e dopo l'ordinamento MAC) rispetto ai controlli negativi (incluse cellule iPS umane indifferenziate colorate e non colorate ed endotelio non colorato). Una differenziazione endoteliale ottimizzata si tradurrà in cellule CD31/CD144-positive al 50% o più prima della selezione MAC, che migliorerà significativamente dopo la selezione cellulare rispetto ai controlli. I risultati rappresentativi mostrano un'efficienza di differenziazione del 59% per CD144 prima dell'ordinamento MAC, che è aumentata al 77% o più di cellule CD144-positive (escluse le cellule CD31-positive) dopo l'ordinamento MAC (Figura 1E).
Il giorno 14 di questo protocollo (prima del completamento della differenziazione IM e dell'espansione viEC), i dispositivi organ-on-a-chip sono stati preparati per la semina cellulare mediante trattamento al plasma e funzionalizzazione con matrice di membrana basale 2. Il giorno seguente (giorno 15 del protocollo), le viEC sono state seminate nel canale capillare (inferiore) del dispositivo microfluidico con mezzo viEC. Il giorno dopo la semina viEC (giorno 16 del protocollo), le cellule IM sono state seminate nel canale urinario (superiore) del dispositivo microfluidico con mezzo di induzione podocita. Il giorno successivo alla semina delle cellule IM (giorno 17 di questo protocollo), ai chip glomerulici sono stati applicati una portata del fluido di 60 μL/h e una deformazione del 10% a 0,4 Hz. Questi chip subiscono uno sforzo di taglio di 0,017 dyn cm-2 e 0,0007dyn cm-2 nei canali capillare e urinario, rispettivamente 2,12. Dopo fino a 5 giorni di induzione del podocita e 6 giorni di propagazione dell'endotelio vascolare nel chip (giorno 21 di questo protocollo) (Figura 2A), le cellule risultanti all'interno dei chip del glomerulo hanno espresso marcatori di identificazione della linea.
In particolare, i podociti nel canale urinario esprimevano podocina e nefrrina (Figura 2B, pannello superiore), e le viECs nel canale capillare esprimevano PECAM-1 (CD31) e VE-Cadherin (CD144) (Figura 2B, pannello inferiore). Inoltre, sia gli strati di podocite che quelli di viEC esprimevano collagene IV, la proteina GBM più abbondante (Figura 2B) nel glomerulo renale. Più collagene IV è espresso nel canale urinario perché i podociti sono i produttori predominanti di collagene IV, compresa l'isoforma α3α4α5, che è la principale isoforma eterotrimera di collagene nel glomerulo maturo. Inoltre, i podociti propagati nei chip del glomerulo hanno sviluppato processi del piede e secreto VEGF165, entrambi tratti caratteristici dei modelli funzionali del glomerulo renale 2,12. Questo protocollo fornisce anche una valutazione della funzione di filtrazione molecolare selettiva del glomerulo renale utilizzando inulina e albumina, da cui i chip del glomerulo filtrano selettivamente piccole molecole (inulina) dal capillare nel canale urinario, impedendo alle proteine di grandi dimensioni (albumina) di lasciare il canale capillare (Figura 2C)2,10,12.
Poiché ogni linea cellulare iPS umana presenta differenze intrinseche nel tempo di raddoppio, è importante notare che le densità ottimali di semina cellulare per diverse linee cellulari possono variare e devono quindi essere ottimizzate dal ricercatore. Per il differenziamento delle cellule endoteliali, se la densità di semina delle cellule iPS umane è troppo bassa, il ricercatore può osservare una resa inferiore di cellule endoteliali differenziate (efficienza del <30%). Se la densità di semina delle cellule iPS umane è troppo alta, il ricercatore può osservare una rapida crescita eccessiva delle cellule, distacco o adesione più scarsa, aumento della morte cellulare e bassa resa (efficienza <30%). Durante l'induzione endoteliale (giorni 4-7 di differenziazione), un aumento del numero di cellule risultante in uno strato secondario di cellule è normale, ma dovrebbe essere ridotto al minimo (Figura 3A). Per la differenziazione IM e podocit, la sovrasemina di cellule iPS umane (>100.000 cellule/pozzetto di una piastra a 12 pozzetti) può provocare cellule IM che crescono in grandi cluster o formano aggregati, che possono impedire la differenziazione e produrre podociti con un fenotipo morfologico meno maturo di cellule aggregate e processi del piede meno secondari e/o terziari10, 11.
Durante la coltura di chip microfluidici, può essere osservato un flusso incrociato di fluidi inaspettato tra i canali urinario e capillare (Figura 3B) se vi è un legame rotto o inadeguato dei componenti del chip PDMS o se il percorso del flusso del fluido è bloccato. Questo flusso incrociato di fluidi indesiderati può anche derivare da una barriera di filtrazione compromessa come modelli di tessuto da semina cellulare inadeguata (bassa) o strati cellulari danneggiati. Per evitare questo problema, si raccomanda che il ricercatore segua il protocollo raccomandato e le densità di semina delle cellule, nonché ispezionare visivamente i chip per le bolle d'aria nei canali in ogni fase del processo. Se si osservano bolle d'aria nei serbatoi dei fluidi dei chip microfluidici che sono sotto il flusso del fluido, la pompa può essere fermata e il mezzo degassato in condizioni sterili.
Insieme, questo protocollo e i risultati rappresentativi descrivono la derivazione dell'endotelio vascolare (viECs) e dell'epitelio glomerulare (podociti) da una linea cellulare iPS umana isogenica e la loro ricostituzione in un dispositivo microfluidico organ-on-a-chip per ricapitolare la struttura e la funzione della barriera di filtrazione glomerulare renale in modo specifico per il paziente.
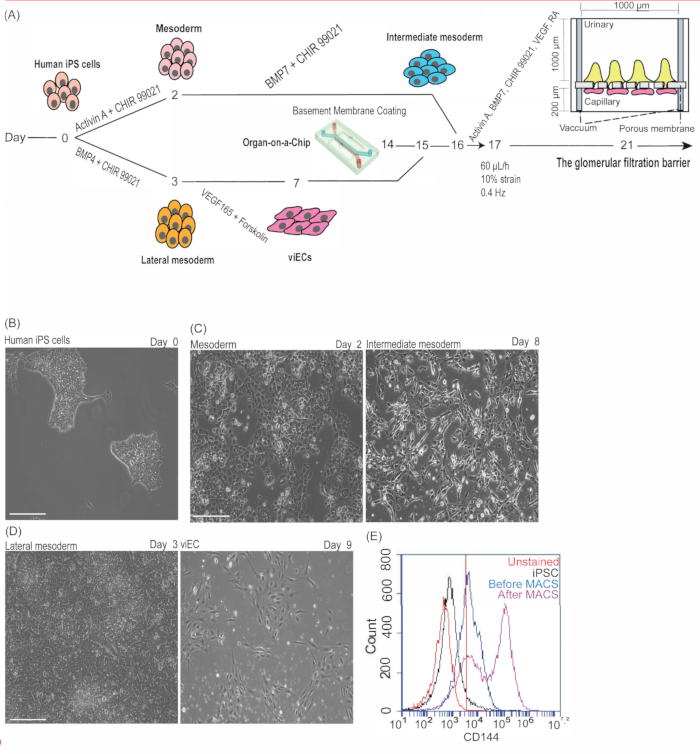
Figura 1: Derivazione dell'epitelio glomerulare isogeno e dell'endotelio vascolare da cellule iPS umane. (A) Cronologia schematica dell'induzione intermedia del mesoderma e della viEC, progettazione organ-on-a-chip e rivestimento della matrice della membrana basale, semina cellulare nel chip e induzione del podocita all'interno del chip. (B) Immagini rappresentative in campo chiaro di cellule iPS umane PGP1 prima della dissociazione al giorno 0 del protocollo. (C) Immagini rappresentative in campo chiaro delle cellule del mesoderma PGP1 il giorno 2 della differenziazione (a sinistra) e delle cellule del mesoderma intermedio il giorno 8 della differenziazione (a destra). (D) Immagini rappresentative in campo chiaro delle cellule del mesoderma laterale PGP1 il giorno 3 di differenziazione (a sinistra) e delle viECs PGP1 il giorno 9 della differenziazione (2 giorni di espansione) (a destra). Barre di scala = 275 μm (B-D). (E) Quantificazione della differenziazione viEC tramite analisi citometrica a flusso per cellule CD144-positive il giorno 7 del differenziamento delle cellule endoteliali prima del MACS (blu) e il giorno 9 dell'espansione delle cellule endoteliali dopo MACS (rosa) rispetto alle iPSC umane colorate con CD144 (nere) e alle cellule endoteliali non colorate (rosso). Questa cifra è stata modificata da12. Abbreviazioni: iPSCs = cellule staminali pluripotenti indotte; viEC = cellule endoteliali vascolari; BMP4/7 = proteina morfogenetica ossea 4/7; RA = acido retinoico; VEGF = fattore di crescita endoteliale vascolare; MACS = ordinamento cellulare attivato magneticamente. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Immagini rappresentative dell'endotelio vascolare e dell'epitelio glomerulare (strato di podocita) coltivati all'interno del chip glomeruloso renale microfluidico. Immagini rappresentative in campo chiaro delle viECs (a sinistra) e dell'epitelio glomerulare (podociti) (a destra) propagate nel chip glomerulo. Barre della scala = 183 μm. (B) Immagini immunofluorescenti rappresentative dell'epitelio glomerulare (podociti) e viEC che mostrano l'espressione di marcatori specifici del lignaggio. Barre di scala = 100 μm. (C) Dati rappresentativi che mostrano la filtrazione molecolare selettiva nel chip glomerulo. Le barre di errore rappresentano SD. p < 0.0001. Questa cifra è stata riprodotta da 12. Abbreviazioni: viECs = cellule endoteliali vascolari; VE-caderina = CD144; PECAM-1 (= CD31) = molecola di adesione delle cellule endoteliali piastriniche. Fare clic qui per visualizzare una versione ingrandita di questa figura.
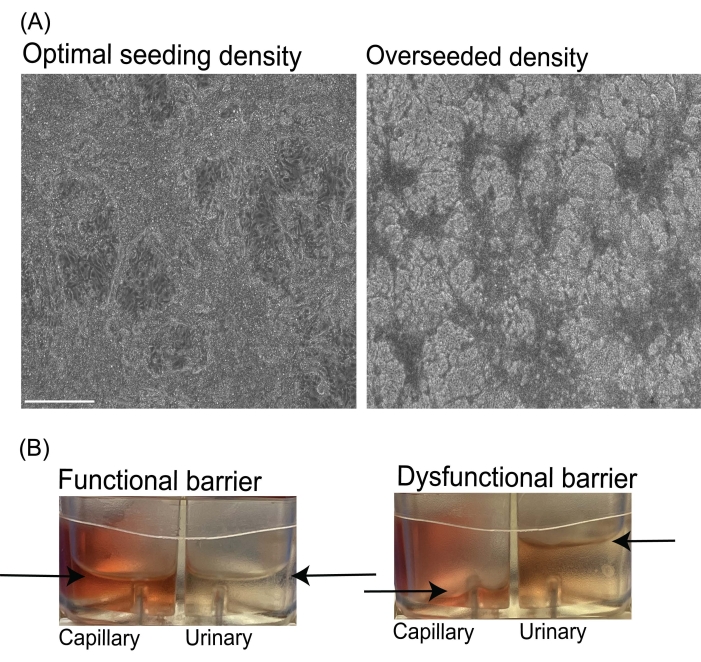
Figura 3: Immagini della densità di semina subottimale dell'endotelio e del flusso irregolare del fluido nei chip microfluidici . (A) Immagini rappresentative in campo chiaro di colture cellulari ottimali (a sinistra) e sovraseminate (a destra) il giorno 6 della differenziazione viEC. Barre di scala = 275 μm. (B) Immagini rappresentative dei serbatoi di uscita da chip microfluidici con un flusso uniforme del fluido e una barriera funzionale (a sinistra). Immagine da un chip con flusso di fluido irregolare o barriera disfunzionale (a destra). Le frecce indicano i livelli di fluido nei serbatoi di uscita per i canali capillari e urinari dei chip. Abbreviazione: viECs = cellule endoteliali vascolari. Fare clic qui per visualizzare una versione ingrandita di questa figura.
File supplementare 1: citometria a flusso, ELISA per effluenti di chip e isolamento dell'mRNA. Clicca qui per scaricare questo file.
Figura supplementare S1: Configurazioni del materiale del cappuccio di coltura in tessuto. (A) Materiale per cappuccio di coltura in tessuto predisposto per MACS, compreso secchiello per il ghiaccio con supporto, magnete su supporto magnetico e tubi conici sotto il magnete. (B) Configurazione del materiale della cappa di coltura in tessuto della capsula di Petri per trucioli, con la parte superiore, rivolta verso il basso, sotto il fondo della capsula di Petri. Abbreviazione: MACS = selezione cellulare attivata magneticamente. Clicca qui per scaricare questo file.
Tabella supplementare S1: supporti e buffer utilizzati in questo protocollo. Clicca qui per scaricare questa tabella.
Discussione
In questo rapporto, delineiamo un protocollo per derivare l'endotelio vascolare e l'epitelio glomerulare (podociti) da una linea cellulare iPS umana isogenica e l'uso di queste cellule per progettare un sistema 3D organ-on-a-chip che imita la struttura, l'interfaccia tessuto-tessuto e la funzione di filtrazione molecolare del glomerulo renale. Questo chip glomerulo è dotato di endotelio ed epitelio glomerulare che, insieme, forniscono una barriera per filtrare selettivamente le molecole.
I ricercatori interessati ad adattare questo protocollo dovrebbero fare le seguenti considerazioni: in primo luogo, l'ottimizzazione può essere necessaria per la semina cellulare a seconda delle caratteristiche di crescita intrinseche delle linee di cellule staminali utilizzate. La densità di semina cellulare può variare a causa delle differenze intrinseche nei tassi di proliferazione delle cellule iPS umane. Si raccomanda ai ricercatori di iniziare con la densità di semina del mesoderma suggerita dal protocollo e quindi di regolarla se necessario. Allo stesso modo, si raccomanda che la differenziazione laterale del mesoderma inizi con la densità di semina cellulare suggerita prima di regolarsi secondo necessità per ottenere una resa viEC e un'efficienza di selezione del 50% o più. Se un numero sufficiente di cellule non viene differenziato dopo la selezione, l'inibitore del TGF-beta (SB431542) può essere usato per prevenire la quiescenza e aiutare ad espandere esponenzialmente le viEC (passato passaggio 3). Tuttavia, diversi processi cellulari o vie di segnalazione dipendono dal TGF-Beta (ad esempio, patogenesi di iperglicemia/diabete, omeostasi immunitaria); pertanto, si raccomanda ai ricercatori di considerare gli effetti dell'inibizione del TGF-Beta sull'analisi a valle o di garantire test adeguati per evitare risultati sperimentali non intenzionali.
In secondo luogo, è importante notare possibili variazioni nella qualità dei reagenti e nelle specifiche del produttore, in particolare per i componenti acquistati da fornitori diversi da quelli specificati dal protocollo. Pertanto, si raccomanda che il ricercatore testi i reagenti di diversi numeri di lotto, fornitori e venditori per garantire la riproducibilità degli esperimenti e dei risultati. In generale, il ricercatore dovrebbe evitare un'eccessiva esposizione delle cellule iPS umane agli enzimi di dissociazione nei tamponi di distacco in quanto ciò può portare a una diminuzione della vitalità cellulare e ad un alterato profilo molecolare delle cellule. Inoltre, il mezzo di induzione dei podociti deve essere protetto dalla luce per prevenire l'inattivazione di tutto l'acido transretinoico . In terzo luogo, durante la coltura cellulare organ-on-a-chip, è fondamentale evitare bolle d'aria nei canali del dispositivo microfluidico quando si perfondono i chip. La comparsa di bolle d'aria può essere ridotta al minimo o prevenuta ispezionando regolarmente i trucioli durante la semina cellulare, mantenendo il contatto liquido-liquido in ogni fase che coinvolge la perfusione di trucioli e non spingendo o tirando aria nei canali fluidici quando si utilizzano le punte delle pipette e/o l'aspirazione.
Precedenti sforzi per progettare chip di glomerulo renale con epitelio ed endotelio geneticamente abbinati si sono basati sull'uso di cellule di origine animale1. Mentre queste linee cellulari di origine animale sono state tradizionalmente utilizzate per studi preclinici, spesso non riescono a ricapitolare le risposte fisiologiche umane, che contribuiscono all'alto tasso di fallimento (89,5%) degli studi clinici sull'uomo18. Per aiutare a superare alcuni di questi problemi, sono auspicabili modelli funzionali in vitro che ricapitolino più da vicino la biologia umana. Sono stati compiuti progressi nello sviluppo di modelli multicellulari del rene umano; Tuttavia, i chip del glomerulo impiegavano cellule umane provenienti da fonti eterogenee e non isogene. Ad esempio, abbiamo precedentemente stabilito un chip glomerulo ricostituito da podociti derivati da cellule iPS umane e endotelio10 derivato dal tessuto primario. Studi di altri gruppi di ricerca hanno impiegato una miscela di cellule primarie 4,9, cellule immortalizzate 3 o cellule derivate dal liquido amniotico 3,6 che limitano il loro uso per lo studio di risposte o applicazioni specifiche del paziente nella medicina personalizzata.
Il protocollo qui descritto supera queste limitazioni consentendo la derivazione sia dell'endotelio vascolare (viECs) che dell'epitelio glomerulare (podociti) dalla stessa linea cellulare iPS umana e integrando queste cellule in dispositivi organo-on-a-chip microfluidici compartimentati per modellare la struttura e la funzione della parete capillare glomerulare renale in vitro. . Dato l'illimitato auto-rinnovamento delle cellule iPS umane, combinato con la loro capacità di differenziarsi in quasi tutti i tipi di cellule, questo protocollo fornisce anche una strada per l'approvvigionamento continuo di podociti umani e viEC per l'ingegneria tissutale e altre applicazioni biomediche. Questo approccio per le derivazioni di podociti e viECs è stato riprodotto in più linee cellulari iPS umane paziente-specifiche, tra cui PGP1- e DU11 2,10,12,17,19, consentendo così la creazione di chip di glomerulo renale personalizzati dalle popolazioni di pazienti desiderate.
La strategia per differenziare i podociti all'interno dei chip microfluidici consente lo studio meccanicistico del glomerulo renale umano in via di sviluppo e la modellizzazione della malattia. Tuttavia, lo studio del glomerulo renale umano in via di sviluppo è limitato dalle viECs che richiedono l'ordinamento per arricchire per la popolazione desiderata. Questo lavoro potrebbe trarre vantaggio dalla definizione di metodi per la differenziazione delle viEC senza la necessità di una selezione della sottopopolazione. Questo studio è anche limitato dalla spessa membrana PDMS che separa gli strati di endotelio vascolare e cellule di podocita. Il lavoro futuro potrebbe integrare nuovi biomateriali per sostituire lo spesso PDMS per imitare meglio le proprietà molecolari e biofisiche della membrana basale glomerulare. Ad esempio, una membrana alternativa potrebbe essere progettata per possedere qualità biodegradabili con porosità sintonizzabile ed essere più sottile (più simile a GBM) rispetto alla membrana PDMS spessa 50 μm utilizzata in questo protocollo.
Tuttavia, il chip glomerulo prodotto da questo protocollo può essere applicato per studiare i meccanismi delle malattie renali debilitanti e servire come piattaforma per i test di nefrotossicità e la scoperta di farmaci. Poiché le cellule iPS umane mantengono il profilo genetico del donatore e il chip glomerulo è in grado di modellare la malattia renale12, in futuro potrebbero essere scoperti nuovi bersagli terapeutici a beneficio di coloro che soffrono di forme ereditarie di malattia renale. Inoltre, le risposte biologiche specifiche del paziente ai farmaci post-trapianto possono essere valutate in modo più accurato utilizzando un chip renale isogenico come quello descritto in questo studio. Infine, questo chip glomerulo è pronto per studiare gli effetti della fluidodinamica e della tensione meccanica differenziale, come quelli osservati nei pazienti con malattia renale con ipertensione o sindrome cardio-renale, data la relativa facilità di modulare i tassi di flusso di fluidi, allungamento dei tessuti o sforzo meccanico. È concepibile che questo protocollo possa far progredire l'attuale comprensione dello sviluppo del rene umano e dei meccanismi di malattia, oltre a facilitare lo sviluppo di terapie personalizzate in futuro.
Divulgazioni
S.M. è inventore di un brevetto relativo alla differenziazione dei podociti dalle cellule iPS umane. L'altro autore non ha nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla Pratt School of Engineering della Duke University, dalla Divisione di Nefrologia presso il Duke Department of Medicine, da una borsa di studio Whitehead in Biomedical Research e da un Genentech Research Award per S. Musah. Y. Roye ha ricevuto la borsa di studio della Duke University-Alfred P. Sloan Foundation e la William M. "Monty" Reichert Graduate Fellowship del Dipartimento di Ingegneria Biomedica della Duke University. La linea cellulare iPS DU11 (Duke University clone #11) è stata generata presso la Duke iPSC Core Facility e fornitaci dal Bursac Lab della Duke University. Gli autori ringraziano N. Abutaleb, J. Holmes, R. Bhattacharya e Y. Zhou per l'assistenza tecnica e le utili discussioni. Gli autori desiderano anche ringraziare i membri del Musah Lab per gli utili commenti sul manoscritto. Gli autori ringraziano il Segura Lab per il dono di un citometro a flusso Acuri C6.
Materiali
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488- and Alexa Fluor 594-conjugated secondary antibodies | Thermo/Life Technologies | A32744; A32754; A-11076; A32790; A21203; A11015 | |
| Collagen IV | Thermo/Life Technologies | 14-9871-82 | |
| Nephrin | Progen | GP-N2 | |
| PECAM-1 | R&D Systems | AF806 | |
| Podocin | Abcam | ab50339 | |
| VE-Cadherin | Santa Cruz | sc-9989 | |
| Basement membrane matrices | |||
| Corning Fibronectin, Human | Corning | 356008 | Basement membrane (3) |
| iMatrix-511 Laminin-E8 (LM-E8) fragment | Iwai North America | N8922012 | Basement membrane matrix (2) |
| Matrigel hESC-qualified matrix, 5-mL vial | BD Biosciences | 354277 | Basement membrane matrix (1); may show lot-to-lot variation |
| Cells | |||
| DU11 human iPS cells | The DU11 (Duke University clone #11) iPS cell line was generated at the Duke iPSC Core Facility and provided to us by the Bursac Lab at Duke University. The line has been tested and found to be free of mycoplasma (last test in November 2021) and karyotype abnormalities (July 2019) | ||
| Culture medium growth factors and media supplements | |||
| 0.5M EDTA, pH 8.0 | Invitrogen | 15575020 | |
| 2-Mercaptoethanol | Thermo/Life Technologies | 21985023 | |
| Albumin from Bovine serum, Texas Red conjugate | Thermo/Life Technologies | A23017 | |
| All-trans retinoic acid (500 mg) | Stem Cell Technologies | 72262 | |
| B27 serum-free supplement | Thermo/Life Technologies | 17504044 | |
| B-27 supplement (50x) without Vitamin A | Thermo/Life Technologies | 12587010 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| CHIR99021 | Stemgent | 04-0004 | May show lot-to-lot variation |
| Complete medium kit with CultureBoost-R | Cell Systems | 4Z0-500-R | Podocyte maintenance media |
| DMEM/F12 | Thermo/Life Technologies | 12634028 | |
| DMEM/F12 with GlutaMAX supplement | Thermo/Life Technologies | 10565042 | DMEM/F12 with glutamine |
| Forskolin (Adenylyl cyclase activator) | Abcam | ab120058 | |
| GlutaMAX supplement | Thermo/Life Technologies | 35050061 | glutamine supplement |
| Heat-inactivated FBS | Thermo/Life Technologies | 10082147 | |
| Heparin solution | Stem Cell Technologies | 7980 | |
| Human Activin A | Thermo/Life Technologies | PHC9544 | |
| Human BMP4 | Preprotech | 120-05ET | |
| Human BMP7 | Thermo/Life Technologies | PHC9544 | |
| Human VEGF | Thermo/Life Technologies | PHC9394 | |
| Inulin-FITC | Sigma-Aldrich | F3272 | |
| mTeSR1 medium | Stem Cell Technologies | 05850 | Human iPS cell culture media (CCM). Add 5x supplement according to the manufacturer. Human iPS CCM can be stored for up to 6 months at -20 °C. |
| N-2 Supplement (100x) | Thermo/Life Technologies | 17502048 | |
| Neurobasal media | Thermo/Life Technologies | 21103049 | Lateral mesoderm basal media |
| PBS (Phosphate-buffered saline) | Thermo/Life Technologies | 14190-250 | |
| Penicillin-streptomycin, liquid (100x) | Thermo/Life Technologies | 15140-163 | |
| ROCK inhibitor (Y27632) | Tocris | 1254 | |
| StemPro-34 SFM | Thermo/Life Technologies | 10639011 | Endothelial cell culture medium (CCM). Add supplement according to manufacturer. Endothelial CCM can be stored for up to two weeks at 4 °C or -20 °C for up to 6 months. |
| TGF-Beta inhibitor (SB431542) | Stem Cell Technologies | 72234 | |
| Enzymes and other reagents | |||
| Accutase | Thermo/Life Technologies | A1110501 | Cell detachment buffer |
| Dimethyl Suloxide (DMSO) | Sigma-Aldrich | D2438 | |
| Ethanol solution, 70% (vol/vol), biotechnology grade | VWR | 97065-058 | |
| Paraformaldehyde (PFA) | Thermo/Life Technologies | 28906 | |
| Sterile distilled water | Thermo/Life Technologies | 15230162 | |
| Triton X-100 | VWR | 97062-208 | |
| Equipment | |||
| Trypsin EDTA, 0.05% | Thermo/Life Technologies | 25300-120 | |
| (Orb) Hub module | Emulate | ORB-HM1 | |
| 100mm x 15 mm round petri dish | Fisherbrand | FB087579B | |
| 120 x 120 mm square cell culture dish | VWR | 688161 | |
| Accuri C6 | BD Biosciences | ||
| Aspirating pipettes, individually wrapped | Corning | 29442-462 | |
| Aspirating Unit | SP Bel-Art | F19917-0150 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99516 | |
| Conical centrifuge tube, 15 mL | Corning | 352097 | |
| Conical centrifuge tube, 50 mL | Corning | 352098 | |
| EVOS M7000 | Thermo/Life Technologies | AMF7000 | Fluorescent microscope to take images of fixed and stained cells. |
| Hemocytometer | VWR | 100503-092 | |
| Heracell VIOS 160i CO2 incubator | Thermo/Life Technologies | 51030403 | |
| Inverted Zeiss Axio Observer equipeed with AxioCam 503 camera | Carl Zeiss Micrscopy | 491916-0001-000(microscope) ; 426558-0000-000(camera) | |
| Kimberly-Clark nitrile gloves | VWR | 40101-346 | |
| Kimwipes, large | VWR | 21905-049 | |
| Leoca SP8 Upright Confocal Microscope | |||
| Media reservoir (POD Portable Module) | Emulate | POD-1 | |
| Microplate shaker | VWR | 12620-926 | |
| Organ-chip | Emulate | S-1 Chip | |
| Organ-chip holder | Emulate | AK-CCR | |
| P10 precision barrier pipette tips | Denville Scientific | P1096-FR | |
| P100 barrier pipette tips | Denville Scientific | P1125 | |
| P1000 barrier pipette tips | Denville Scientific | P1121 | |
| P20 barrier pipette tips | Denville Scientific | P1122 | |
| P200 barrier pipette tips | Denville Scientific | P1122 | |
| Plasma Asher | Quorum tech | K1050X RF | This Plasma Etcher/Asher/Cleaner was used as a part of Duke University's Shared Materials Instrumentation Facility (SMiF). |
| Round bottom polystyrene test tube with cell strainer snap cap | Corning | 352235 | |
| Serological pipette, 10 mL, indivdually wrapped | Corning | 356551 | |
| Serological pipette, 25 mL, indivdually wrapped | Corning | 356525 | |
| Serological pipette, 5 mL, indivdually wrapped | Corning | 356543 | |
| Steriflip, 0.22 µm, PES | EMD Millipore | SCGP00525 | |
| Sterile Microcentrifuge tubes | Thomas Scientific | 1138W14 | |
| T75cm2 cell culture flask with vent cap | Corning | 430641U | |
| Tissue culture-treated 12 well plates | Corning | 353043 | |
| Tissue culture-treated 6 well plates | Corning | 353046 | |
| Vacuum modulator and perstaltic pump (Zoe Culture Module) | Emulate | ZOE-CM1 | Organ Chip Bioreactor |
| VE-Cadherin CD144 anti-human antibody - APC conjugated | Miltenyi Biotec | 130-126-010 | |
| Wide-beveled cell lifter | Corning | 3008 | |
| MACS | |||
| CD144 MicroBeads, human | Miltenyi Biotec | 130-097-857 | |
| CD31 MicroBead Kit, human | Miltenyi Biotec | 130-091-935 | |
| LS columns | Miltenyi Biotec | 130-042-401 |
Riferimenti
- Wang, L., et al. A disease model of diabetic nephropathy in a glomerulus-on-a-chip microdevice. Lab on a Chip. 17 (10), 1749-1760 (2017).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), 1-12 (2017).
- Petrosyan, A., et al. A glomerulus-on-a-chip to recapitulate the human glomerular filtration barrier. Nature Communications. 10 (1), 3656 (2019).
- Hass, R., Kasper, C., Böhm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling. 9, 12 (2011).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: when do differences make a difference. Cell. 141 (4), 559-563 (2010).
- Da Sacco, S., et al. A novel source of cultured podocytes. PloS One. 8 (12), 81812 (2013).
- Singh, V. K., Kalsan, M., Kumar, N., Saini, A., Chandra, R. Induced pluripotent stem cells: applications in regenerative medicine, disease modeling, and drug discovery. Frontiers in Cell and Developmental Biology. 3, 2 (2015).
- Ebert, A. D., Liang, P., Wu, J. C. Induced pluripotent stem cells as a disease modeling and drug screening platform. Journal of cardiovascular pharmacology. 60 (4), 408-416 (2012).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Roye, Y. A personalized glomerulus chip engineered from stem cell-derived epithelium and vascular endothelium. Micromachines. 12 (8), 967 (2021).
- Roselli, S., et al. Podocin localizes in the kidney to the slit diaphragm area. The American Journal of Pathology. 160 (1), 131-139 (2002).
- Ruotsalainen, V., et al. Nephrin is specifically located at the slit diaphragm of glomerular podocytes. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7962-7967 (1999).
- Privratsky, J. R., Newman, P. J. PECAM-1: regulator of endothelial junctional integrity. Cell and Tissue Research. 355 (3), 607-619 (2014).
- Menon, M. C., Chuang, P. Y., He, C. J. The glomerular filtration barrier: components and crosstalk. International Journal of Nephrology. 2012, 749010 (2012).
- Abutaleb, N. O., Truskey, G. A. Differentiation and characterization of human iPSC-derived vascular endothelial cells under physiological shear stress. STAR Protocols. 2 (2), 100394 (2021).
- Pammolli, F., Magazzini, L., Riccaboni, M. The productivity crisis in pharmaceutical R&D. Nature Reviews. Drug Discovery. 10 (6), 428-438 (2011).
- Atchison, L., et al. iPSC-derived endothelial cells affect vascular function in a tissue-engineered blood vessel model of Hutchinson-Gilford progeria syndrome. Stem Cell Reports. 14 (2), 325-337 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon