Method Article
Выделение, культивирование и характеристика первичных шванновских клеток, кератиноцитов и фибробластов из крайней плоти человека
В этой статье
Резюме
Изучение заживления ран, связанных с повреждением опорно-двигательного аппарата, часто требует оценки взаимодействий in vitro между шванновскими клетками (SCs), кератиноцитами и фибробластами. Этот протокол описывает выделение, культивирование и характеристику этих первичных клеток из крайней плоти человека.
Аннотация
Этот протокол описывает методы изоляции, условия культивирования и характеристику первичных клеток человека с высоким выходом и жизнеспособностью с использованием быстрой ферментативной диссоциации кожи. Первичные кератиноциты, фибробласты и шванновские клетки собираются из крайней плоти новорожденного человека, которая доступна в соответствии со стандартными процедурами ухода. Удаленная кожа дезинфицируется, а подкожный жир и мышцы удаляются с помощью скальпеля. Метод состоит из ферментативного и механического разделения эпидермального и дермального слоев с последующим дополнительным ферментативным перевариванием для получения одноклеточных суспензий из каждого из этих слоев кожи. Наконец, одиночные клетки выращиваются в соответствующих средах клеточных культур в соответствии со стандартными протоколами клеточной культуры для поддержания роста и жизнеспособности в течение нескольких недель. Вместе этот простой протокол позволяет выделять, культивировать и характеризовать все три типа клеток из одного куска кожи для оценки in vitro моделей кожи-нерва. Кроме того, эти клетки могут быть использованы вместе в кокультурах для оценки их воздействия друг на друга и их реакций на травму in vitro в виде царапин, выполненных роботизированно в культуре, связанной с заживлением ран.
Введение
Первичные клетки, полученные из живой ткани и культивируемые в условиях in vitro , очень похожи на физиологическое состояние1, что делает их идеальной моделью для исследования физиологических и патофизиологических процессов. Кожа содержит несколько типов клеток, включая кератиноциты, фибробласты, себоциты, меланоциты и шванновские клетки (SCs), которые могут быть выделены и культивированы для экспериментов in vitro . Методы выделения и культивирования кератиноцитов, фибробластов и СК из одного куска кожи не были описаны. Цель этого протокола двояка: 1) установить надежный и воспроизводимый метод выделения и культивирования кожных СК и 2) использовать эффективный, надежный метод выделения кератиноцитов, фибробластов и СК из одной крайней плоти человека.
В настоящее время существуют установленные протоколы выделения кератиноцитов кожи 2,3,4 и фибробластов 5,6. Эти исследования описывают выделение кератиноцитов, фибробластов или обоих из кожи, но ни в одном протоколе не рассматривается, как создавать культуры первичных СК из кожи человека. Недавние исследования показывают, что нейронные СК модулируют клеточные процессы кератиноцитов и фибробластов и регулируют нормальные физиологические функции кожи7. Таким образом, SCs имеют решающее значение для гомеостаза кожи и вносят существенный вклад в физиологию регулирования, которая влияет на поведение соседних типов клеток кожи, присутствующих8. Поэтому протокол, который позволяет изолировать каждый из этих типов клеток, идеально подходит для экспериментов in vitro, включающих клеточную связь или перекрестные разговоры между типами клеток.
Этот протокол описывает создание отдельных клеточных культур первичных клеток из одного куска кожи. Этот протокол особенно полезен, когда количество доступной ткани ограничено. Кроме того, выделение всех трех типов клеток от одного донора позволяет проводить надежные сравнения между типами клеток или экспериментами с кокультурой, одновременно смягчая влияние генетики во время желаемого эксперимента.
протокол
Приобретение и использование деидентифицированной ткани крайней плоти человека в исследовательских целях было рассмотрено и получило определение «не человеческих исследований» Советом по институциональному обзору Медицинского колледжа штата Пенсильвания (IRB #17574).
ПРИМЕЧАНИЕ: Следуя приведенному ниже протоколу, из одной крайней плоти получают 2,4 х 106 кератиноцитов, 4,4 х 106 фибробластов и 1,1 х 106 СК. В общем, эти первичные клетки могут быть использованы в течение 3 проходов, в зависимости от условий эксперимента.
1. Выделение первичных клеток и условий культивирования
- Процедура разделения эпидермиса и дермы
- Приобретите неонатальную крайнюю плоть в соответствии со стандартными процедурами ухода врача в соответствии с утвержденными протоколами регулирования больницы. Врач определяет сроки обрезания после рождения и количество удаленной кожи.
- Поместите иссеченную крайнюю плоть в микроцентрифужную трубку, содержащую 8-10 мл ледяной базальной среды Dulbecco Modified Eagle Medium (DMEM), и немедленно транспортируйте крайнюю плоть в лабораторию клеточной культуры для изоляции клеток. Дважды промойте кожу 20-25 мл 1x фосфатно-буферного физиологического раствора Dulbecco (DPBS), содержащего 1x антибиотика/антимикотика.
ПРИМЕЧАНИЕ: Для максимальной жизнеспособности клеток иссеченную крайнюю плоть следует поместить при 4 °C до обработки, а клетки должны быть собраны в течение 24 ч. - После промывания DPBS/антибиотиками замочите крайнюю плоть в 25-30 мл ледяной базальной среды DMEM в течение 10-15 мин в чашке для культуры тканей 10 см. Выполните все этапы обработки в вытяжке культуры тканей с использованием стерильной техники.
- С помощью скальпеля аккуратно разрезайте крайнюю плоть и обнажите дерму и подкожную жировую клетчатку.
- Удалите подкожную жировую клетчатку с помощью щипцов, лезвия скальпеля и ножниц по мере необходимости. Отбросьте жировую ткань. Нарежьте очищенную крайнюю плоть на три-пять более мелких кусочков.
- Переложите кусочки кожи в стерильную коническую трубку, содержащую 16-20 мл диспазно-I/DMEM среды (4 мг/мл в базальной среде DMEM).
- Перемешайте кусочки кожи в конической трубке путем инверсии, с перерывами, в течение первых 30 мин инкубации с диспазой-I. Затем поместите коническую трубку при 4 °C в течение 16-18 ч, помня о погружении кусочков кожи в dispase-I/media.
ПРИМЕЧАНИЕ: Раствор Диспазы-I следует готовить непосредственно перед добавлением с использованием холодной базальной среды DMEM, фильтровать с помощью ситечка 0,22 мкм и хранить при 4 °C. - После ночного переваривания с диспазом-I удалить кусочки кожи и поместить их на сухую, стерильную, культуральную посуду. Раскрутите каждый кусочек кожи так, чтобы внешний эпидермальный слой касался блюда культуры.
- Используя два набора щипцов, тщательно отделите эпидермис от дермы. Начните с края ткани и отшелушите эпидермис от дермы.
ПРИМЕЧАНИЕ: Если слой эпидермиса трудно отделить от дермы, то диспазно-I пищеварения было недостаточно. Варианты устранения неполадок: 1) возврат кусочков кожи в раствор dispase-I/DMEM и инкубация в течение дополнительных 2-3 ч при 4 °C; 2) поместить кусочки кожи в свежую диспазу-I/DMEM и инкубировать при 4 °C еще 2-3 ч. - Используют разделенный эпидермис и дерму для выделения кератиноцитов (эпидермиса) и фибробластов и шванновских клеток (дермы).
ПРИМЕЧАНИЕ: Выполните следующие действия для определенных типов клеток изоляции и условий культивирования.
- Выделение кератиноцитов из эпидермиса
- Добавьте 5 мл буферного физиологического раствора HEPES (HBS) в 10 см культуральную чашку и добавьте отделенные фрагменты эпидермиса. Инкубировать при комнатной температуре (RT) в течение 10 мин.
- После инкубации HBS собирают раствор HBS в коническую трубку объемом 50 мл. Добавьте 5 мл буфера нейтрализации трипсина (TNB) (Таблица материалов) в коническую трубку объемом 50 мл и отложите в сторону.
- Добавьте 3 мл раствора трипсина к эпидермальным фрагментам. Инкубировать при 37 °C в течение 10 мин.
- Аккуратно перемешайте эпидермальные фрагменты с помощью щипцов до тех пор, пока раствор трипсина не станет мутным.
- Добавьте раствор трипсина/кератиноциты к трубке, содержащей HBS и TNB, на стадии 1.2.2.
- Для любых оставшихся эпидермальных фрагментов, которые не растворились в первоначальном переваривании трипсина, добавьте 3 мл 0,25% трипсина / этилендиаминтетрауксусной кислоты (ЭДТА). Инкубируют при 37 °C в течение 10 мин и повторяют шаги 1.2.4 и 1.2.5.
- Добавьте 2 мл фетальной бычьей сыворотки (FBS) в раствор трипсина/ЭДТА, содержащий пробирки для растворов HBS и TNB.
- Центрифугируют сборную трубку, содержащую HBS/TNB/трипсин и кератиноциты при 870 х г в течение 5 мин при 4 °C.
- Аспирировать супернатант и повторно суспендировать клеточную гранулу в 3 мл кератиноцитарной полной питательной среды (Таблица материалов).
- Фильтруйте клеточную суспензию стерильным фильтром 100 мкМ в стерильную коническую трубку объемом 50 мл для удаления мусора.
- Количественно оцените количество клеток и жизнеспособность клеток.
ПРИМЕЧАНИЕ: Здесь для количественной оценки количества и жизнеспособности ячеек использовалось специализированное устройство для отбора проб и окрашивания клеток (Таблица материалов) в соответствии с инструкциями производителя. - Тарелки для посева семян по мере необходимости для экспериментов. Рекомендуемая плотность посева составляет ~45 000 клеток/см2.
- Поместите культуральные пластины в инкубатор при 37 °C в 5% CO2 в течение 2 дней, чтобы кератиноциты прилипли к блюду.
- Через 2 дня аспирируют любые неприлипшие клетки. Обновляйте среду культивирования клеток через день до тех пор, пока кератиноциты не достигнут желаемого слияния для экспериментов по прохождению или последующему течению (слияние 50-80%).
- Выделение шванновских клеток (SCs) и фибробластов из дермы
- Предварительно покрывать колбы T25 поли-L-лизином (ФАПЧ, 0,01 мкг/мкл) с использованием 5 мл 1x DPBS. Поместите предварительно покрытые колбы при температуре 37 °C в течение 3 ч. Дважды вымойте матрицу покрытия ФАПЧ, используя 1 dpBS (5 мл).
ПРИМЕЧАНИЕ: Колбы T25 могут быть приготовлены заранее. - Изолированные кусочки дермы промыть 5 мл базальной среды ДМЭМ.
- Измельчите дерму на мелкие кусочки ножницами или скальпелем.
- Переварить измельченную дерму 5 мл коллагеназы (2 мг/мл в базальной среде ДМЭМ) при 37 °C в течение 2,5 ч. Аккуратно тритурируйте измельченную дерму кончиком пипетки каждые 30 минут, пока дерма полностью не отделится.
- Фильтруйте клеточную суспензию с помощью клеточного ситечка 70 мкМ. Необходимо приложить механическую силу с помощью шприца 1 мл для полной фильтрации суспензии.
- Разбавить фильтрованную клеточную суспензию 5 мл полной dmEM среды (базальная среда DMEM + 5% FBS + 1x антибиотика), чтобы остановить ферментативную активность коллагеназы.
- Центрифугируйте клеточную суспензию при 870 х г в течение 5 мин при РТ для гранулирования клеток.
- Из этой клеточной гранулы будут получены как фибробласты, так и СК. Повторно суспендируют ячейку гранулы в 2 мл полной среды DMEM для деления клеток (1 мл клеточной суспензии / трубки) и центрифуги при 870 х г в течение 5 мин при РТ.
- Для культуры СК выполните шаги 1.3.10-1.3.17, а для культуры фибробластов - шаги 1.3.18-1.3.22.
- Начиная с шага 1.3.8, аспирируйте супернатант. Повторно суспендируйте ячейку гранулы в 5 мл свежей полной среды DMEM.
- Количественно оцените количество клеток и жизнеспособность.
ПРИМЕЧАНИЕ: Здесь для количественной оценки количества и жизнеспособности ячеек использовалось специализированное устройство для отбора проб и окрашивания клеток (Таблица материалов) в соответствии с инструкциями производителя. - Засейте предварительно покрытые колбы T25 5 мл повторно суспендированных клеток плотностью 4,0 х 103 клетки/мл. Инкубируют колбу при 37 °C в присутствии 5% CO2 в течение ночи (~12-16 ч инкубации).
- Через 16 ч подтвердить адгезию клеток с помощью микроскопии (Таблица материалов) при 10-кратном увеличении.
- Удалите неадгезивные клетки и промыть колбу 3x 5 мл 1x DPBS.
- Добавьте 5 мл 10 мкМ цитозина арабинозида (антимитотическое средство, убивает фибробласты) в полную среду DMEM. Инкубировать колбу при 37 °C в присутствии 5% CO2 в течение 24 ч.
- Аспирировать цитозинарабинозид, содержащий среду из колбы. Промыть колбу 3x 5 мл 1x DPBS.
- Наполните колбу для культивирования 5 мл полной питательной среды SCs (Таблица материалов) и инкубируйте при 37 °C в присутствии 5% CO2 в течение 48 ч. Обновляйте полную культуральную среду SC через день до тех пор, пока SCs не достигнут 80% слияния.
- Аспирировать супернатант из диссоциированного кожного слоя (стадия 1.3.8) и повторно суспендировать клеточную гранулу 5 мл фибробластной полной среды (базальная среда фибробластов + 5% FBS + 1x антибиотик).
- Количественная оценка количества клеток и жизнеспособности клеток.
ПРИМЕЧАНИЕ: Здесь для количественной оценки количества и жизнеспособности ячеек использовалось специализированное устройство для отбора проб и окрашивания клеток (Таблица материалов) в соответствии с инструкциями производителя. - Обложите фибробласты плотностью клеток 4,0 х 103 клетки/мл в колбах культуры Т25 (без предварительного покрытия) с использованием 5 мл фибробластной полной среды. Инкубировать при 37 °C в присутствии 5% CO2 в течение ночи (~12-16 ч инкубации).
- Через 16-24 ч подтвердить адгезию клеток с помощью микроскопии (Таблица материалов) при 10-кратном увеличении. Аспирировать неадгезивные клетки из колбы и дважды промыть колбу 5 мл 1x DPBS.
- Добавить 5 мл свежей фибробластной полной среды и инкубировать при 37 °C в присутствии 5% CO2 в течение 48 ч. Обновляйте культуральную среду через день до тех пор, пока фибробласты не достигнут желаемого слияния для проходных или последующих анализов (50-80% слияние).
- Предварительно покрывать колбы T25 поли-L-лизином (ФАПЧ, 0,01 мкг/мкл) с использованием 5 мл 1x DPBS. Поместите предварительно покрытые колбы при температуре 37 °C в течение 3 ч. Дважды вымойте матрицу покрытия ФАПЧ, используя 1 dpBS (5 мл).
2. Верификация эпидермальных кератиноцитов, кожных СК и белкового маркера фибробластов иммунофлуоресценцией
- День 1 - Стеклянные слайды камеры покрытия и отсоединяющие ячейки
- Предварительное покрытие стеклянных слайдов с 4-луночной камерой коллагеном-I для кератиноцитов или PLL для SCs или, только 1x DPBS для фибробластов (0,5 мл в каждой лунке). Убедитесь, что покрыта вся поверхность. Инкубационная камера скользит при 37 °C в течение 2 ч. Во время инкубации подготовьте клетки.
- После того, как культивируемые клетки достигнут 50%-80% слияния, промыть колбы 1x DPBS 3x (1 мл на каждую лунку).
- Отсоедините прилипшие клетки 5 мл 0,25% раствора трипсина-ЭДТА (ТЭ) путем инкубации при 37 °C в присутствии 5% CO2 в течение 2 мин, пока клетки не начнут становиться круглыми. Визуализация отслоения клеток с помощью микроскопии (Таблица материалов) с 10-кратным увеличением.
- После инкубации переложите раствор ТЭ, содержащий клетки, в коническую трубку с 5 мл фетальной бычьей сыворотки (FBS).
- Добавьте 5 мл буфера нейтрализации трипсина (TNB) в колбу для культивирования, а затем перенесите содержимое в вышеупомянутую центрифужную трубку (клетки с TE и FBS). Визуализация отслоения клеток с помощью микроскопии (Таблица материалов) с 10-кратным увеличением.
ПРИМЕЧАНИЕ: TNB или FBS или оба могут быть использованы для нейтрализации активности трипсина. - Центрифугирование конической трубки, содержащей ячейки/TE/TNB при 870 х г в течение 5 мин. Перенесите надосадочную среду в другую трубку и повторно суспендируйте клеточную гранулу в соответствующей полной питательной среде. Измерьте жизнеспособность клеток, как указано на этапе 1.2.11.
- Промыть предварительно покрытые стеклянные стекла камеры (этап 2.1.1) 1x DPBS (1 мл для каждой скважины) 3x.
- Полусухие горки внутри тканевой культуральной вытяжки и семенных кератиноцитов, СК или фибробластов с соответствующей плотностью (30 000 клеток / 0,5 мл / камера) в соответствующей полной клеточной питательной среде.
- Инкубируйте скользящие ступени камеры при 37 °C в течение ночи, чтобы ячейки прилипали.
- День 2 - Блокирование стеклянной горки камеры с помощью бычьего сывороточного альбумина (BSA) и инкубации первичных антител
- Аспирируйте клеточную среду из камерных слайдов и промывайте 3x с 1 мл 1x DPBS.
- Зафиксируйте прилипшие клетки 4% параформальдегидом в 1x DPBS (1 мл на каждую лунку) и инкубируйте в течение 15 мин на RT внутри вытяжки культуры тканей.
- Аспирировать 4% параформальдегида из камерных слайдов и промыть камерные слайды 3x с 1x DPBS (1 мл для каждой скважины).
- Пермеабилизируют клеточные мембраны 1% TritonX-100 в 1x DPBS (1 мл на каждую лунку) и инкубируют в течение 15 мин при RT.
- Аспирировать блокирующий раствор из камерных слайдов, промыть 3x с 1x DPBS (1 мл для каждой скважины) в течение 30 с, а затем аспирировать 1x DPBS из скважины.
- Заблокируйте камерные слайды с 5% BSA (0,5 мл на каждую лунку) и инкубируйте в течение 45 мин на RT.
- Аспирировать блокирующий раствор с горок камеры, промыть 3x с 1x DPBS (1 мл для каждой скважины) в течение 30 с каждая, а затем аспирировать 1x DPBS из скважины.
- Разбавляют первичные антитела 5% BSA (0,2 мл на каждую лунку) (Первичные разведения антител: Кератиноциты: мышиный цитокератин 14 антитело (1:100) и цитокератин 10 антитело (1:100); Шванновские клетки: антитело S100 мыши (1:200) и антитело рецептора фактора роста нервов кролика (p75-NTR) (1:500); Фибробласты: антитело к виментину кролика (1:200) и антитело к альфа-гладкомышечному актину мыши (α-СМА) (1:200)).
- Добавляют первичные антитела к соответствующим клеткам на стеклянном слайде камеры и инкубируют в течение примерно 15-16 ч (ночью) при 4 °C в увлажненной камере.
- Аспирировать первичные антитела из камерных слайдов, промыть 3 раза 1x DPBS (1 мл для каждой лунки) в течение 30 с каждая, а затем аспирировать 1x DPBS из скважины.
- Разбавляют вторичные антитела (Козье анти-кролик IgG Вторичное антитело-Alexa Fluor 488 (1:500) и Козье анти-Мышиное IgG Вторичное антитело-Alexa Fluor 594 (1:500)) с 0,5% BSA. Добавьте соответствующее вторичное антитело к каждой лунке (0,2 мл на каждую лунку). Инкубировать в течение 45 мин на RT.
- Аспирировать вторичное антитело из камерных слайдов, промыть 3x с 1x DPBS (1 мл для каждой лунки) в течение 30 с каждая, а затем аспирировать 1x DBPS из скважины.
- Снимите прокладку на затворе камеры с 4 лунками с помощью абсорбционного средства. Старайтесь не оставлять клея на слайде, так как это мешает нанесению крышки. Добавьте каплю монтажной среды с 4',6-диамидино-2-фенилиндолом (DAPI). В качестве альтернативы можно окрасить скважины с помощью DAPI и использовать монтажную среду, не содержащую этикетки.
- Осторожно поместите крышку на стеклянную горку, избегая пузырьков воздуха, и запечатайте конец крышки клеем. Наблюдение за паттернами иммунофлуоресцентного окрашивания с помощью микроскопии (Таблица материалов) при 10-кратном и/или 20-кратном увеличении.
Результаты
Нормальная неонатальная крайняя плоть использовалась для выделения первичных эпидермальных кератиноцитов и кожных СК и фибробластов. Изолированные первичные клетки культивировали в соответствующих клеточных культуральных средах, содержащих факторы роста. После посева СК и фибробластов в колбы для культивирования большая часть клеток прилипала к дну колбы в течение 2 ч. В случае кератиноцитов большинство кератиноцитов прилипает к 24 ч. Изолированные эпидермальные первичные кератиноциты достигали 85% слияния к 7-му дню и проявляли характерную морфологию клеток (булыжниковую форму) (рисунок 1А). К 5-му дню СК достигли 95% слияния и оказались биполярными или триполярными по форме (рисунок 1В). Культуры фибробластов достигли 95% слияния к 4-му дню, и большинство клеток демонстрировали морфологию формы веретена (рисунок 1C). Клеточно-специфическая экспрессия белка была подтверждена в этих культурах иммунофлуоресцентным окрашиванием. Кератиноциты были положительными для белков K10 (маркер дифференцировки) и K14 (маркер пролиферации) (рисунок 2A); аналогичным образом, СК были положительными для S100 и p75-NTR (рисунок 2C). Фибробласты положительно экспрессировали виментин, но не экспрессировали маркер миофибробластов, альфа-гладкомышечный актин (α-СМА) (Рисунок 2Е).
Объединенные изображения иммунофлуоресценции кератина и ядерного окрашивания DAPI (рисунок 2A) показали, что 97,8% клеток в культурах были кератиноцитами (рисунок 2B). Двойные S100 и p75-NTR положительные шванновские клетки предполагают чистоту 95,2% SCs в культуре по протоколу (рисунок 2C,D). Аналогичным образом, 97,2% клеток в культурах фибробластов положительно экспрессировали виментин (рисунок 2E,F). Таким образом, характерная экспрессия белка обнаруживается в соответствующих типах клеток, и протокол позволяет изолировать относительно чистые популяции клеток.
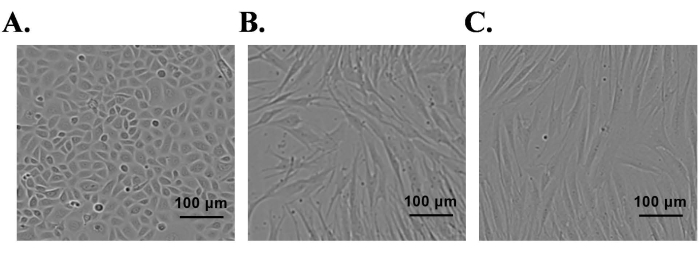
Рисунок 1: Выделение первичных кератиноцитов, полученных из крайней плоти человека, шванновских клеток и фибробластов. (A) Кератиноциты, (B) шванновские клетки и (C) фибробласты под фазовым контрастным микроскопом; шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
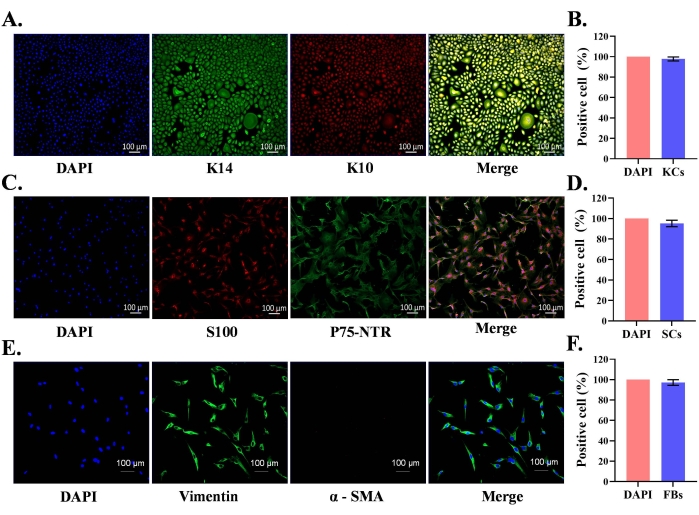
Рисунок 2: Характеристика первичных кератиноцитов, полученных из крайней плоти человека, шванновских клеток и фибробластов. (А) Кератиноциты были идентифицированы с использованием кератина 14 (K14, пролиферативные кератиноциты) и K10 (кератин 10, маркер дифференцировки кератиноцитов); шкала bar = 100 мкм. (B) Статистический анализ чистоты культивируемых кератиноцитов с использованием иммунофлуоресценций двойных окрашенных клеток. (C) Шванновские клетки были идентифицированы с использованием S100 и p75-NTR (рецептор фактора роста нервов); шкала bar = 100 мкм. (D) Статистический анализ чистоты культивируемых СК с использованием иммунофлуоресценций двойных окрашенных клеток. (E) Фибробласты были идентифицированы с использованием виментина (фибробласт) и α гладкомышечного актина (дифференцировка фибробластов, миофибробласт); шкала bar = 100 мкм. (F) Статистический анализ чистоты культивируемых фибробластов с использованием иммунофлуоресценций виментин окрашенных клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол описывает метод выделения трех различных клеточных популяций из одного куска крайней плоти, а именно кератиноцитов, фибробластов и шванновских клеток. Существует несколько протоколов изоляции для выделения кератиноцитов и фибробластов 2,3,5,6, но ни один из них не описывает изоляцию SC. Помимо ключевых структурных клеток кожи, кератиноцитов и фибробластов, кожа также сильно иннервируется сенсорными афферентными структурами и вегетативными эфферентами. Сенсорные афференты играют значительную роль в передаче легкого прикосновения, вибрации, боли, зуда, а также горячих и холодных ощущений. Вегетативные эфференты иннервируют потовые железы и арректоры пили мышц9. Каждый нервный аксон покрыт SC, глиальными клетками периферической нервной системы. Исследовательские и клинические интересы в СК значительно возросли, поскольку СК поддерживают регенерацию аксонов10,11. Кожные нервы являются важными регуляторами физиологии кожи и патологии заболеваний через сигналы связи (нейромодуляторы/нейромедиаторы) с ненейронными клетками 12,13,14.
Несмотря на широкое распространение нервных СК в коже, существует ограниченная информация о конкретной роли СК в физиологии кожи. Как SCs в коже взаимодействуют с другими ненейрональными клетками в коже? Ответу на этот вопрос мешало отсутствие надежных моделей клеточных культур in vitro . Таким образом, с помощью этого протокола анализ каждой отдельной клетки и их взаимодействия с клетками из одной и той же ткани может точно выявить характерные особенности роли шванновских клеток в гомеостазе кожи и патофизиологии.
Одним из ключевых преимуществ этого протокола является простая, недорогая экспериментальная процедура по установлению трех первичных клеток (СК, кератиноцитов и фибробластов) из одной крайней плоти человека. Он также имеет преимущество в том, что все три типа клеток изолированы из одной и той же ткани, тем самым смягчая генетические различия в сравнении клеток и оптимизируя изоляцию клеток, когда ткань находится в ограниченном количестве. Этот протокол занимает 2 дня и упрощает процедуру выделения трех первичных клеток из ткани кожи и условий культивирования. Этот протокол надежно дает большое количество жизнеспособных клеток, и начальные проходы этих клеток достигают ~ 90% слияния через 4-7 дней после первоначального покрытия. Мы использовали кератиноциты в течение как минимум 3 проходов (~ 21 день), а фибробластные и шванновские клетки могут быть использованы в течение 5-6 проходов (~ 40 дней в культуре).
Этот протокол не лишен технических проблем. Достаточное удаление подлежащей жировой ткани и эффективное эпидермальное /дермальное разделение перед ферментативным пищеварением являются ключом к получению относительно чистых популяций клеток из каждого слоя кожи. Кожные СК труднее изолировать от кожи из-за их относительно низкой распространенности в коже по сравнению с более многочисленными фибробластами. Любой перенос фибробластов в культурах SC быстро перерастет SCs15. Чтобы повысить адгезию SC, мы решили предварительно покрыть тканевую культуру ФАПЧ, поскольку это увеличивает адгезию SCs16. Для дальнейшего смягчения загрязнения фибробластами цитозин арабинозид (антимитотический агент) добавляли после того, как клетки прилипали в течение короткого периода времени, чтобы удалить быстро делящиеся фибробласты из культур SCs. Однако более длительное воздействие арабинозида цитозина также может быть вредным для СК.
Принятие вышеописанного протокола позволяет выделить отдельные КОЖНЫЕ СК, кератиноциты и культуры фибробластов для экспериментов in vitro . Эти различные клеточные популяции могут быть использованы для исследования SCs, кератиноцитов и фибробластов по отдельности или в комбинации во время нормальной физиологии кожи, заживления ран или в условиях, которые имитируют условия заболевания.
Раскрытие информации
Все остальные авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы хотели бы поблагодарить д-ра Фадию Камаль и д-ра Рейада Эльбарбари за то, что они позволили нам использовать лабораторные инструменты и техническую поддержку. Эта работа была поддержана грантами NIH (K08 AR060164-01A) и DOD (W81XWH-16-1-0725) J. C. E. в дополнение к институциональной поддержке со стороны Медицинского центра Херши Университета штата Пенсильвания.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µM sterile filters (Millex-GP Syringe Filter Unit,polyethersulfone) | MilliporeSigma | SLGPR33RS | |
| 70 µM cell strainers | CELLTREAT | 229483 | |
| 100 µM cell strainers | CELLTREAT | 229485 | |
| 1 mL disposable syringes | BD Luer-Lok | BD-309659 | |
| 5 mL disposable syringes (Syringe sterile, single use) | BD Luer-Lok | BD309646 | |
| 10 mL disposable syringes | BD Luer-Lok | BD305462 | |
| 1% TritonX-100 | Sigma | X100-1L | Prepared at the time of use |
| 4% paraformaldehyde solution | ThermoFisher Scientific | J19943.K2 | Ready to use and store at 4 °C |
| 5% BSA | Sigma | A7906-100G | Prepared at the time of use |
| 70% ethanol | Pharmco | 111000200 | |
| Antibiotic | ScienCell Research | 503 | |
| Chemometec Vial1-Cassette | Fisher Scientific | NC1420193 | |
| Collagenase | Gibco | 17018-029 | |
| Coverslip | Fisherbrand | 12544D 22*50-1.5 | |
| Dispase I | Sigma-Aldrich | D46693 | |
| DMEM basal medium | ScienCell Research | 9221 | |
| Dulbecco's phosphate-buffered saline free from Ca2+ and Mg2+ (DPBS) | Corning | 21-031-CV) | |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339653 | |
| 1.5 mL micro-centrifuge tubes | Fisherbrand | 02-681-5 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 10082147 | |
| Fibroblast complete medium | ScienCell Research | 2331 | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Invitrogen | A11032 | Dilution (1:500) |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11008 | Dilution (1:500) |
| Hanks' Buffered Saline Solution (HBSS buffer) | Lonza | CC-5022 | |
| Human foreskin | De-identified human foreskin tissue for research purposes (Institutional Review Board- IRB #17574). | ||
| KGM-GOLD keratinocyte medium (KGM gold and supplements) | Lonza | 00192151 and 00192152 | |
| Mouse alpha-smooth muscle actin antibody | ThermoFisher Scientific | 14-9760-82 | Dilution (1:200) |
| Mouse Cytokeratin14 antibody | Abcam | ab7800 | Dilution (1:100) |
| Mouse S100 antibody | ThermoFisher Scientific | MA5-12969 | Dilution (1:200) |
| Multi chambered (4 well glass slide) | Tab-Tek | 154526 | |
| NucleoCounter -Via1-Cassette | Chemometec | 941-0012 | |
| Poly-L-Lysisne (PLL) | ScienCell Research | 32503 | |
| ProLong Gold Anti-fade Mountant with DAPI | Invitrogen | P36935 | |
| Rabbit K10 antibody | Sigma-Aldrich | SAB4501656 | Dilution (1:100) |
| Rabbit p75-NTR antibody | Millipore | AB1554 | Dilution (1:500) |
| Rabbit vimentin | ProteinTech | 10366-1-AP | Dilution (1:200) |
| Schwann cell culture medium | ScienCell Research | 1701 | |
| Precision tweezers DUMONT straight with extra fine tips Dumostar, 5 | ROTH | LH75.1 | Sterilize with 70% alcohol before use |
| IRIS Scissors, sharp/sharp. Length 4–3/8"(111mm) | Codman | 54-6500 | Sterilize with 70% alcohol before use |
| Sterilized surgical - sharp blade (Duro Edge Economy Single Edge Blades) | Razor blade company | 94-0120 | Sterilize with 70% alcohol before use |
| T25 culture flask | Corning | 353109 | |
| Trypsin neutralization buffer (TNS) | Lonza | CC-5002 | |
| Trypsin/EDTA | Lonza | CC-5012 | |
| Inverted microscope | ZEISS | Axio Observer 7- Axiocam 506 mono – Apotome.2 microscope | For immunofluorescence of chamber slide containing stained cells |
| Inverted microscope | ZEISS | Primovert | For visulaizing/observing cell attachment or detachment |
Ссылки
- Hawksworth, G. M. Advantages and disadvantages of using human cells for pharmacological and toxicological studies. Human & Experimental Toxicology. 13 (8), 568-573 (1994).
- Green, H., Kehinde, O., Thomas, J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proceedings of the National Academy of Sciences of the United States of America. 76 (11), 5665-5668 (1979).
- Fuchs, E., Green, H. Changes in keratin gene expression during terminal differentiation of the keratinocyte. Cell. 19 (4), 1033-1042 (1980).
- Aasen, T., Izpisua Belmonte, J. C. Isolation and cultivation of human keratinocytes from skin or plucked hair for the generation of induced pluripotent stem cells. Nature Protocols. 5 (2), 371-382 (2010).
- Seluanov, A., Vaidya, A., Gorbunova, V. Establishing primary adult fibroblast cultures from rodents. Journal of Visualized Experiments: JoVE. (44), e2033(2010).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Silva, W. N., et al. Role of Schwann cells in cutaneous wound healing. Wound Repair and Regeneration. 26 (5), 392-397 (2018).
- Bray, E. R., Cheret, J., Yosipovitch, G., Paus, R. Schwann cells as underestimated, major players in human skin physiology and pathology. Experimental Dermatology. 29 (1), 93-101 (2020).
- Laverdet, B., et al. Skin innervation: important roles during normal and pathological cutaneous repair. Histology and Histopathology. 30 (8), 875-892 (2015).
- Jessen, K. R., Mirsky, R., Lloyd, A. C. Schwann cells: Development and role in nerve repair. Cold Spring Harbor Perspectives in Biology. 7 (7), 020487(2015).
- Bentley, C. A., Lee, K. F. p75 is important for axon growth and Schwann cell migration during development. The Journal of Neuroscience. 20 (20), 7706-7715 (2000).
- Rutkowski, J. L., et al. Signals for proinflammatory cytokine secretion by human Schwann cells. Journal of Neuroimmunology. 101 (1), 47-60 (1999).
- Kumar, A., Brockes, J. P. Nerve dependence in tissue, organ, and appendage regeneration. Trends in Neurosciences. 35 (11), 691-699 (2012).
- Balakrishnan, A., et al. Insights into the role and potential of Schwann cells for peripheral nerve repair from studies of development and injury. Frontiers in Molecular Neuroscience. 13, 608442(2020).
- Gresset, A., et al. Boundary caps give rise to neurogenic stem cells and terminal glia in the skin. Stem Cell Reports. 5 (2), 278-290 (2015).
- Stratton, J. A., et al. Purification and characterization of Schwann cells from adult human skin and nerve. eNeuro. 4 (3), (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены