Method Article
ヒト包皮からの初代シュワン細胞、ケラチノサイト、および線維芽細胞の単離、培養、および特性評価
要約
筋骨格損傷に関連する創傷治癒の研究は、しばしば、シュワン細胞(SC)、ケラチノサイト、および線維芽細胞間の インビトロ 相互作用の評価を必要とする。このプロトコルは、ヒト包皮からのこれらの初代細胞の単離、培養、および特性評価を記述している。
要約
このプロトコールは、皮膚の迅速な酵素解離を用いた高収率および生存率を有するヒト初代細胞の単離方法、培養条件、および特性評価を記載する。初代ケラチノサイト、線維芽細胞、およびシュワン細胞はすべて、ヒト新生児包皮から採取され、標準的なケア手順に従って入手可能である。除去された皮膚を消毒し、皮下の脂肪と筋肉をメスを用いて除去する。この方法は、表皮層および真皮層の酵素的および機械的分離、続いてこれらの表皮層のそれぞれから単一細胞懸濁液を得るためのさらなる酵素消化からなる。最後に、単一細胞を標準的な細胞培養プロトコルに従って適切な細胞培養培地中で増殖させ、数週間にわたって増殖および生存率を維持する。このシンプルなプロトコルを組み合わせることで、皮膚神経モデルの in vitro 評価のために、単一の皮膚から3つの細胞タイプすべてを単離、培養、および特性評価することができます。さらに、これらの細胞は、創傷治癒に関連する培養においてロボット的に行われる傷の形で、互いに対するそれらの効果および in vitro 外傷に対するそれらの応答を測定するために、共培養において一緒に使用することができる。
概要
生体組織由来の初代細胞を in vitro 条件下で培養すると、生理状態1によく似ており、生理学的・病態生理学的過程を調べるのに理想的なモデルとなっています。皮膚には、ケラチノサイト、線維芽細胞、皮脂細胞、メラノサイト、シュワン細胞(SC)を含む複数の細胞タイプが含まれており、 これらはインビトロ 実験のために単離および培養することができる。ケラチノサイト、線維芽細胞、およびSCを単一の皮膚片から単離および培養する方法は、記載されていない。このプロトコルの目標は、1)真皮SCの単離および培養のための信頼性が高く再現可能な方法を確立すること、および2)単一のヒト包皮からケラチノサイト、線維芽細胞、およびSCを単離するための効率的で堅牢な方法を使用することの2つである。
現在、皮膚ケラチノサイト2、3、4および線維芽細胞5,6を単離するための確立されたプロトコルがある。これらの研究は、皮膚からのケラチノサイト、線維芽細胞、またはその両方の単離を記述しているが、ヒト皮膚から初代SCの培養を確立する方法を扱うプロトコルはない。最近の研究は、ニューロンSCがケラチノサイトおよび線維芽細胞の細胞プロセスを調節し、正常な皮膚生理学的機能を調節することを示唆している7。したがって、SCは皮膚の恒常性に重要であり、隣接する皮膚細胞型の挙動に影響を与える生理機能を調節するのに実質的に寄与する8。したがって、これらの各細胞型の単離を可能にするプロトコルは、細胞間通信または細胞型間のクロストークを含むin vitro実験に理想的である。
このプロトコルは、単一の皮膚片からの初代細胞の個々の細胞培養物の確立を記述する。このプロトコールは、利用可能な組織の量が限られている場合に特に有用である。さらに、単一のドナーから3つの細胞型すべてを単離することで、所望の実験中の遺伝学の影響を軽減しながら、細胞型間の堅牢な比較または共培養実験が可能になります。
プロトコル
研究目的での非同定ヒト包皮組織の取得および使用は、ペンシルベニア州立医科大学治験審査委員会(IRB #17574)によってレビューされ、「ヒト研究ではない」という決定を受けた。
注:以下のプロトコルに従うことによって、2.4 x 106ケラチノサイト、4.4 x 106線維芽細胞および1.1 x106 SCが単一の包皮から得られる。一般に、これらの初代細胞は、実験条件に応じて3継代に用いることができる。
1. 初代細胞の単離と培養条件
- 表皮と真皮の分離手順
- 承認された病院の規制プロトコルの下で医師による標準的なケア手順に従って新生児包皮を取得する。医師は、出生後の割礼のタイミングと除去された皮膚の量を決定します。
- 摘出した包皮を、氷冷したダルベッコ改変イーグル培地(DMEM)基礎培地8~10mLを含む微量遠心チューブに入れ、包皮を細胞培養ラボに直ちに輸送して細胞単離する。1x抗生物質/抗真菌薬を含む1xダルベッコリン酸緩衝生理食塩水(DPBS)20〜25mLで皮膚を2回すすいでください。
注:細胞生存率を最大限に高めるには、摘出した包皮を処理まで4°Cに置き、24時間以内に細胞を回収する必要があります。 - DPBS/抗生物質ですすぎた後、包皮を氷冷DMEM基礎培地25〜30mLに10〜15分間浸し、10cmの組織培養皿に入れます。滅菌技術を使用して組織培養フード内のすべての処理ステップを実行します。
- メスを使用して、包皮を慎重にスライスし、真皮および皮下脂肪組織を露出させる。
- 必要に応じて、鉗子、メス刃、はさみを用いて皮下脂肪組織を除去します。脂肪組織を捨てる。きれいにした包皮を3〜5個に切る。
- 16〜20mLのディスパーゼ-I/DMEM培地(DMEM基礎培地では4mg/mL)を含む滅菌円錐管に皮膚片を移す。
- ディスパーゼ-Iとのインキュベーションの最初の30分間に、断続的に反転させて円錐管内の皮膚片を混合する。その後、円錐形のチューブを4°Cで16〜18時間置き、皮膚片をディスパーゼI/メディアに浸すように注意してください。
注:Dispase-I溶液は、冷たいDMEM基礎培地を使用して添加する直前に調製し、0.22μmのストレーナーで濾過し、4°Cに保温するべきである。 - dispase-Iで一晩消化した後、皮膚片を取り除き、乾燥した滅菌した培養皿の上に置きます。表皮層の外側が培養皿に触れるように各皮膚を転がす。
- 2組の鉗子を使用して、表皮を真皮から慎重に分離する。組織の端から始めて、表皮を真皮から剥がします。
注:表皮層が真皮から分離しにくい場合、ディスパーゼ-I消化は十分ではなかった。トラブルシューティングオプション:1)皮膚片をディスパーゼI / DMEM溶液に戻し、4°Cでさらに2〜3時間インキュベートする。2)新鮮なディスパーゼI/DMEMにスキンピースを入れ、4°Cでさらに2〜3時間インキュベートする。 - 分離した表皮および真皮を使用して、ケラチノサイト(表皮)および線維芽細胞およびシュワン細胞(真皮)を単離する。
注: 特定の細胞タイプの単離および培養条件については、以下の手順に従ってください。
- 表皮からのケラチノサイトの単離
- 5 mLのHEPES緩衝液生理食塩水(HBS)を10cm培養皿に加え、分離した表皮断片を加える。室温(RT)で10分間インキュベートする。
- HBSインキュベーション後、HBS溶液を50mL円錐管に集める。50 mL の円錐管に 5 mL のトリプシン中和バッファー (TNB) (材料表) を加え、脇に置いておきます。
- 表皮断片に3mLのトリプシン溶液を加える。37°Cで10分間インキュベートする。
- トリプシン溶液が濁るまで鉗子を用いて表皮断片を穏やかに攪拌する。
- ステップ1.2.2でトリプシン溶液/ケラチノサイトをHBSおよびTNB含有チューブに加える。
- 最初のトリプシン消化で溶解していない残りの表皮断片については、3mLの0.25%トリプシン/エチレンジアミン四酢酸(EDTA)を加える。37°Cで10分間インキュベートし、ステップ1.2.4および1.2.5を繰り返します。
- HBSおよびTNB溶液チューブを含むトリプシン/EDTA溶液に2mLのウシ胎児血清(FBS)を加える。
- HBS/TNB/トリプシンおよびケラチノサイトを含む収集チューブを870 x g で4°Cで5分間遠心分離します。
- 上清を吸引し、細胞ペレットを3mLのケラチノサイト完全増殖培地に再懸濁する(材料表)。
- 滅菌 100 μM フィルターで細胞懸濁液を滅菌 50 mL 円錐管にろ過し、破片を除去します。
- 細胞数および細胞生存率を定量化する。
注:ここでは、特殊な細胞サンプリングおよび染色装置(材料表)を使用して、製造元の指示に従って細胞数および生存率を定量した。 - 実験のために必要に応じて種培養プレート。推奨される播種密度は〜45,000セル/cm2です。
- 培養プレートを5%CO2 中で37°Cのインキュベーター内に2日間置き、ケラチノサイトがディッシュに接着するようにした。
- 2日後、接着していない細胞を吸引する。ケラチノサイトが継代または下流実験のための所望のコンフルエント(50%〜80%コンフルエント)に達するまで、細胞培養培地を1日おきにリフレッシュする。
- 真皮からのシュワン細胞(SC)および線維芽細胞の単離
- T25フラスコをポリL-リジン(PLL、0.01μg/μL)でプレコートし、5mLの1x DPBSを使用します。プレコートフラスコを37°Cで3時間置く。PLLコーティングマトリックスを1x DPBS(5mL)を使用して2回洗浄します。
注:T25フラスコは事前に準備することができます。 - 真皮の単離片を5mLのDMEM基礎培地ですすいでください。
- 真皮をはさみやメスで小片に刻む。
- ミンチした真皮を5 mLのコラゲナーゼ(DMEM基礎培地では2 mg/mL)で37°Cで2.5時間消化する。真皮が完全に解離するまで、30分ごとにピペットチップでミンチした真皮を静かに粉砕する。
- 細胞懸濁液を70μMの細胞ストレーナーでろ過する。懸濁液を完全に濾過するために、1mLシリンジを使用して機械的力を加える必要がある。
- 濾過した細胞懸濁液を5mLの完全DMEM培地(DMEM基礎培地+5%FBS+抗生物質1x)で希釈し、コラゲナーゼの酵素活性を停止させた。
- 細胞懸濁液をRTで5分間870 x g で遠心分離し、細胞をペレット化する。
- この細胞ペレットから、線維芽細胞およびSCの両方が得られるであろう。細胞ペレットを2 mLのDMEM完全培地に再懸濁して細胞を分割し(1 mL細胞懸濁液/チューブ)、RTで870 x g で5分間遠心分離します。
- SC培養の場合はステップ1.3.10~1.3.17に従い、線維芽細胞培養の場合はステップ1.3.18~1.3.22に従います。
- ステップ1.3.8から、上清を吸引する。細胞ペレットを5mLの新鮮なDMEM完全培地に再懸濁する。
- 細胞数と生存率を定量化する。
注:ここでは、特殊な細胞サンプリングおよび染色装置(材料表)を使用して、製造元の指示に従って細胞数および生存率を定量した。 - プレコーティングされたT25フラスコに、密度4.0 x103 細胞/mLで5 mLの再懸濁細胞を播種する。フラスコを5%CO2存在下で37°Cで一晩インキュベートする(〜12 〜16時間インキュベーション)。
- 16時間後、倍率10倍の顕微鏡(材料表)により細胞接着を確認した。
- 非接着細胞を除去し、5mLの1x DPBSで3xフラスコを洗浄する。
- DMEM完全培地に5mLの10μMシトシンアラビノシド(抗有糸分裂剤、線維芽細胞を殺す)を加える。フラスコを37°Cで5%CO2存在下で24時間インキュベートする。
- フラスコからシトシンアラビノシド含有培地を吸引する。フラスコを5mLの1xDPBSで3xすすいでください。
- 培養フラスコに5mLのSCs完全培養培地(材料表)を補充し、5%CO2の存在下で37°Cで48時間インキュベートする。SCが80%コンフルエントに達するまで、1日おきにSC完全培養培地をリフレッシュする。
- 解離した真皮層から上清を吸引し(ステップ1.3.8)、細胞ペレットを5mLの線維芽細胞完全培地(線維芽細胞基礎培地+ 5%FBS + 1x抗生物質)で再懸濁する。
- 細胞数と細胞生存率を定量化する。
注:ここでは、特殊な細胞サンプリングおよび染色装置(材料表)を使用して、製造元の指示に従って細胞数および生存率を定量した。 - 5 mLの線維芽細胞完全培地を用いて、T25培養フラスコ(プレコーティングされていない)に4.0 x103 細胞/mLの細胞密度で線維芽細胞をプレートする。5%CO2の存在下で37°Cで一晩インキュベートする(〜12 〜16時間インキュベーション)。
- 16~24時間後、倍率10倍の顕微鏡(材料表)により細胞接着を確認した。フラスコから非接着細胞を吸引し、5mLの1x DPBSでフラスコを2回洗浄する。
- 5mLの新鮮な線維芽細胞完全培地を加え、5%CO2 の存在下で37°Cで48時間インキュベートする。線維芽細胞が継代または下流アッセイのための所望の合流点(50%〜80%コンフルエント)に達するまで、1日おきに培養培地をリフレッシュする。
- T25フラスコをポリL-リジン(PLL、0.01μg/μL)でプレコートし、5mLの1x DPBSを使用します。プレコートフラスコを37°Cで3時間置く。PLLコーティングマトリックスを1x DPBS(5mL)を使用して2回洗浄します。
2. 免疫蛍光による表皮角化細胞、真皮SC、線維芽細胞タンパク質マーカーの検証
- 1日目 - チャンバーガラススライドのコートとセルの剥離
- 4ウェルチャンバーガラススライドをケラチノサイト用のコラーゲン-I、SC用のPLLまたは線維芽細胞用のDPBSのみ1x(各ウェル0.5mL)でプレコートする。必ず全面をコーティングしてください。インキュベートチャンバースライドを37°Cで2時間。インキュベーション中に、細胞を調製する。
- 培養細胞が50%〜80%コンフルエントに達した後、フラスコを1x DPBS 3x(各ウェルに1mL)で洗浄する。
- 5 mL の 0.25% トリプシン-EDTA (TE) 溶液で接着した細胞を剥離し、細胞が丸くなり始めるまで 37 °C で 5%CO2 存在下で 2 分間インキュベートします。顕微鏡(材料表)で細胞剥離を10倍の倍率で視覚化します。
- インキュベーション後、細胞を含むTE溶液を5mLウシ胎児血清(FBS)と共に円錐管に移す。
- 5mLのトリプシン中和緩衝液(TNB)を培養フラスコに加え、内容物を上記の遠沈管(TEおよびFBSを有する細胞)に移す。顕微鏡(材料表)で細胞剥離を10倍の倍率で視覚化します。
注:TNBまたはFBSまたはその両方を使用して、トリプシン活性を中和することができます。 - 細胞/TE/TNBを含む円錐管を870 x g で5分間遠心分離します。上清を別のチューブに移し、細胞ペレットを対応する完全培養培地に再懸濁する。ステップ1.2.11で述べたように細胞生存率を測定する。
- プレコートチャンバースライドガラス(ステップ2.1.1)を1x DPBS(各ウェルに1mL)3xですすいでください。
- 組織培養フード内のスライドを半乾燥させ、種子ケラチノサイト、SC、または線維芽細胞を適切な密度(30,000細胞/0.5mL/チャンバー)で適切な完全細胞培養培地で乾燥させる。
- チャンバースライドを37°Cで一晩インキュベートして、細胞が接着できるようにします。
- 2日目-ウシ血清アルブミン(BSA)および一次抗体インキュベーションでチャンバースライドガラスをブロッキング
- チャンバースライドから細胞培地を吸引し、1mLの1x DPBSで3x洗浄する。
- 接着した細胞を1x DPBS(各ウェルに1mL)中の4%パラホルムアルデヒドで固定し、組織培養フード内のRTで15分間インキュベートする。
- チャンバースライドから4%パラホルムアルデヒドを吸引し、チャンバースライドを1x DPBS(各ウェルに1mL)で3x洗浄します。
- 1x DPBS中の1%TritonX-100(各ウェルに1mL)で細胞膜を透過処理し、RTで15分間インキュベートする。
- チャンバースライドからブロッキング溶液を吸引し、1x DPBS(各ウェルに1mL)で30秒間3x洗浄してから、ウェルから1x DPBSを吸引します。
- チャンバースライドを5% BSA(各ウェルに0.5mL)でブロックし、RTで45分間インキュベートします。
- チャンバースライドからブロッキング溶液を吸引し、1x DPBS(各ウェルに1mL)で3xを30秒間洗浄してから、ウェルから1x DPBSを吸引します。
- 一次抗体を5%BSA(各ウェルあたり0.2mL)で希釈する(一次抗体希釈液:ケラチノサイト:マウスサイトケラチン14抗体(1:100)および、サイトケラチン10抗体(1:100);シュワン細胞:マウスS100抗体(1:200)、およびウサギ神経成長因子受容体(p75-NTR)抗体(1:500);線維芽細胞:ウサギビメンチン抗体(1:200)、およびマウスα-平滑筋アクチン(α-SMA)抗体(1:200))。
- スライドガラスチャンバー上の対応する細胞に対する一次抗体を加え、加湿チャンバー内で4°Cで約15〜16時間(一晩)インキュベートする。
- チャンバースライドから一次抗体を吸引し、1x DPBS(各ウェルに1mL)で30秒間3回洗浄してから、ウェルから1x DPBSを吸引します。
- 二次抗体(ヤギ抗ウサギIgG二次抗体 - Alexa Fluor 488(1:500)およびヤギ抗マウスIgG二次抗体 - Alexa Fluor 594(1:500))を0.5%BSAで希釈する。適切な二次抗体を各ウェルに加える(各ウェルにつき0.2 mL)。RTで45分間インキュベートする。
- チャンバースライドから二次抗体を吸引し、1x DPBS(ウェルごとに1mL)で3xを30秒間洗浄し、ウェルから1x DBPSを吸引します。
- ガスケットリムーバーを使用して、4ウェルチャンバースライドのガスケットを取り外します。スライドに接着剤を残さないようにしてください。これはカバースリップの塗布を妨げるためです。4',6-ジアミジノ-2-フェニルインドール(DAPI)を含むマウント培地を一滴加える。あるいは、DAPIでウェルを対比染色し、非標識含有マウント培地を使用する。
- 気泡を避けてスライドガラスの上にカバースリップを慎重に置き、カバースリップの端を接着剤で密封します。免疫蛍光染色パターンを顕微鏡(材料表)により10倍および/または20倍の倍率で観察する。
結果
正常な新生児包皮は、初代表皮角化細胞ならびに真皮SCおよび線維芽細胞の単離に使用した。単離した初代細胞を、成長因子を含む各細胞培養培地で培養した。SCsおよび線維芽細胞を培養フラスコに播種した後、ほとんどの細胞は2時間以内にフラスコの底に接着した。ケラチノサイトの場合、ほとんどのケラチノサイトは24時間で接着した。単離された表皮初代ケラチノサイトは、7日目までに85%コンフルエントに達し、特徴的な細胞形態(石畳状)を示した(図1A)。SCは5日目までに95%の合流点に達し、双極または三極の形をしたように見えた(図1B)。線維芽細胞培養物は4日目までに95%コンフルエントに達し、ほとんどの細胞は紡錘体形状形態を示した(図1C)。細胞型特異的タンパク質発現は、免疫蛍光染色によりこれらの培養物において確認された。ケラチノサイトは、K10(分化マーカー)およびK14(増殖マーカー)タンパク質に対して陽性であった(図2A);同様に、SCはS100およびp75-NTRに対して陽性であった(図2C)。線維芽細胞はビメンチンを陽性に発現したが、筋線維芽細胞マーカー、α平滑筋アクチン(α-SMA)を発現しなかった(図2E)。
ケラチン免疫蛍光とDAPI核染色のマージ画像(図2A)は、培養物中の細胞の97.8%がケラチノサイトであることを示した(図2B)。ダブルS100およびp75-NTR陽性シュワン細胞は、プロトコールに従った培養における95.2%SCsの純度を示唆している(図2C、D)。同様に、線維芽細胞培養物中の細胞の97.2%がビメンチンを陽性に発現した(図2E、F)。したがって、特徴的なタンパク質発現は、それぞれの細胞型において見出され、プロトコルは、比較的純粋な細胞集団の単離を可能にする。
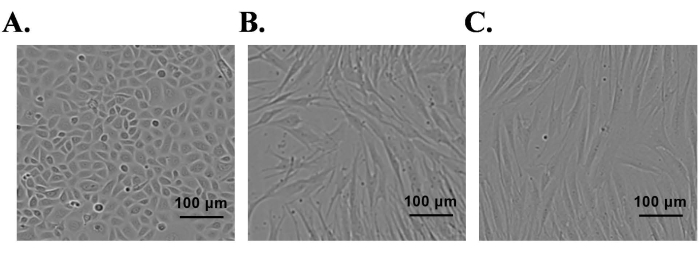
図1:ヒト包皮由来初代ケラチノサイト、シュワン細胞、および線維芽細胞の単離。 (A)ケラチノサイト、(B)シュワン細胞、および(C)位相差顕微鏡下での線維芽細胞;スケール バー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
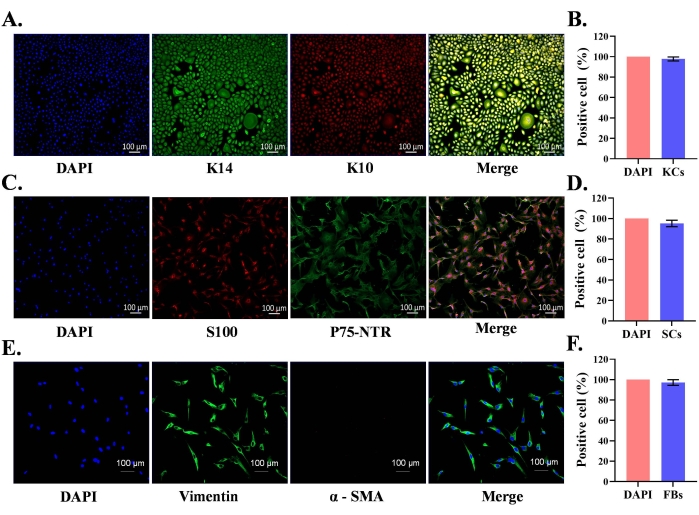
(A)ケラチノサイトを、ケラチン14(K14、増殖性ケラチノサイト)およびK10(ケラチン10、ケラチノサイト分化マーカー)を用いて同定した。(B)二重染色細胞の免疫蛍光を用いた培養ケラチノサイトの純度の統計解析。(c)シュワン細胞を、S100およびp75-NTR(神経成長因子受容体)を用いて同定した;スケールバー = 100 μm. (D) 二重染色細胞の免疫蛍光を用いた培養SCの純度の統計解析。(e)線維芽細胞をビメンチン(線維芽細胞)およびα平滑筋アクチン(線維芽細胞分化、筋線維芽細胞)を用いて同定した;(F)ビメンチン染色細胞の免疫蛍光を用いた培養線維芽細胞の純度の統計解析。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、包皮の単一片から3つの異なる細胞集団、すなわちケラチノサイト、線維芽細胞、およびシュワン細胞を単離する方法を記載する。ケラチノサイトおよび線維芽細胞2,3,5,6を単離するために利用可能な単離プロトコルはいくつかあるが、SC単離を記載するものはない。皮膚の重要な構造細胞、ケラチノサイト、線維芽細胞とは別に、皮膚は感覚求心性構造と自律神経遠心性によって高度に神経支配されています。感覚求心性は、軽い接触、振動、痛み、かゆみ、および熱い感覚と冷たい感覚の伝達において重要な役割を果たします。自律神経滓性は汗腺と耳介のピリ筋を神経支配する9.各神経軸索は、末梢神経系のグリア細胞であるSCによって鞘付けされている。SCが軸索再生をサポートするため、SCの研究および臨床的関心が大幅に高まっている10,11。皮膚神経は、非神経細胞への通信信号(神経調節因子/神経メディエーター)を介して皮膚生理学および疾患病理の重要な調節因子である12,13,14。
皮膚における神経SCの広範な分布にもかかわらず、皮膚生理学におけるSCの特異的な役割に関する情報は限られている。皮膚中のSCは、皮膚内の他の非ニューロン細胞とどのように相互作用しますか?この質問に答えることは、信頼できる in vitro 細胞培養モデルの欠如によって妨げられてきた。したがって、このプロトコルでは、個々の細胞の分析と、同じ組織の細胞との相互作用を分析することで、皮膚の恒常性と病態生理学におけるシュワン細胞の役割の特徴的な特徴を正確に明らかにすることができます。
このプロトコルの主な利点の1つは、単一のヒト包皮から3つの初代細胞(SC、ケラチノサイトおよび線維芽細胞)を確立するための簡単で安価な実験手順である。また、3つの細胞タイプすべてが同じ組織から単離されるという利点があるため、細胞比較における遺伝的差異が緩和され、組織の供給が限られている場合に細胞単離が最適化されます。このプロトコルは、皮膚組織および培養条件からの3つの初代細胞の単離手順を実行し、2日間かかる。このプロトコールは、多数の生細胞を確実に得られ、これらの細胞の初期継代は、最初のめっき後4〜7日で〜90%のコンフルエントに達した。ケラチノサイトを少なくとも3継代(約21日)使用し、線維芽細胞およびシュワン細胞を5〜6継代(培養中〜40日)に使用しました。
このプロトコルには技術的な課題がないわけではありません。酵素消化前の基礎となる脂肪組織の十分な除去と効率的な表皮/真皮分離は、各皮膚層から比較的純粋な細胞集団を得るための鍵です。真皮SCは、より多数の線維芽細胞と比較して皮膚における有病率が比較的低いため、皮膚から単離することがより困難である。SC培養における線維芽細胞の持ち越しは、SCs15を急速に上回るであろう。SCの接着性を高めるために、SCs16の接着性を高めるため、PLLで組織培養器具をプレコートすることを選択しました。線維芽細胞汚染をさらに緩和するために、細胞が短時間接着した後にシトシンアラビノシド(抗有糸分裂剤)を添加し、急速に分裂した線維芽細胞をSCs培養物から除去した。しかし、シトシンアラビノシドへのより長い曝露はまた、SCに有害であり得る。
上記のプロトコールを採用することで、 インビトロ 実験のために個々の皮膚SC、ケラチノサイト、および線維芽細胞培養物を単離することが可能になる。これらの別個の細胞集団は、正常な皮膚生理学、創傷治癒の間、または疾患設定を模倣する条件下で、SC、ケラチノサイト、および線維芽細胞を個々にまたは組み合わせて調査するために使用することができる。
開示事項
他のすべての著者は、競合する金銭的利益はないと宣言しています。
謝辞
ファディア・カマル博士とレイアド・エルバーバリ博士に、ラボ機器と技術サポートの使用を許可してくれたことに感謝します。この研究は、ペンシルベニア州立大学ハーシー医療センターからの制度的支援に加えて、NIH(K08 AR060164-01A)およびDOD(W81XWH-16-1-0725)からJ. C. E.への助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µM sterile filters (Millex-GP Syringe Filter Unit,polyethersulfone) | MilliporeSigma | SLGPR33RS | |
| 70 µM cell strainers | CELLTREAT | 229483 | |
| 100 µM cell strainers | CELLTREAT | 229485 | |
| 1 mL disposable syringes | BD Luer-Lok | BD-309659 | |
| 5 mL disposable syringes (Syringe sterile, single use) | BD Luer-Lok | BD309646 | |
| 10 mL disposable syringes | BD Luer-Lok | BD305462 | |
| 1% TritonX-100 | Sigma | X100-1L | Prepared at the time of use |
| 4% paraformaldehyde solution | ThermoFisher Scientific | J19943.K2 | Ready to use and store at 4 °C |
| 5% BSA | Sigma | A7906-100G | Prepared at the time of use |
| 70% ethanol | Pharmco | 111000200 | |
| Antibiotic | ScienCell Research | 503 | |
| Chemometec Vial1-Cassette | Fisher Scientific | NC1420193 | |
| Collagenase | Gibco | 17018-029 | |
| Coverslip | Fisherbrand | 12544D 22*50-1.5 | |
| Dispase I | Sigma-Aldrich | D46693 | |
| DMEM basal medium | ScienCell Research | 9221 | |
| Dulbecco's phosphate-buffered saline free from Ca2+ and Mg2+ (DPBS) | Corning | 21-031-CV) | |
| Nunc 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339651 | |
| Nunc 50 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339653 | |
| 1.5 mL micro-centrifuge tubes | Fisherbrand | 02-681-5 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 10082147 | |
| Fibroblast complete medium | ScienCell Research | 2331 | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Invitrogen | A11032 | Dilution (1:500) |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11008 | Dilution (1:500) |
| Hanks' Buffered Saline Solution (HBSS buffer) | Lonza | CC-5022 | |
| Human foreskin | De-identified human foreskin tissue for research purposes (Institutional Review Board- IRB #17574). | ||
| KGM-GOLD keratinocyte medium (KGM gold and supplements) | Lonza | 00192151 and 00192152 | |
| Mouse alpha-smooth muscle actin antibody | ThermoFisher Scientific | 14-9760-82 | Dilution (1:200) |
| Mouse Cytokeratin14 antibody | Abcam | ab7800 | Dilution (1:100) |
| Mouse S100 antibody | ThermoFisher Scientific | MA5-12969 | Dilution (1:200) |
| Multi chambered (4 well glass slide) | Tab-Tek | 154526 | |
| NucleoCounter -Via1-Cassette | Chemometec | 941-0012 | |
| Poly-L-Lysisne (PLL) | ScienCell Research | 32503 | |
| ProLong Gold Anti-fade Mountant with DAPI | Invitrogen | P36935 | |
| Rabbit K10 antibody | Sigma-Aldrich | SAB4501656 | Dilution (1:100) |
| Rabbit p75-NTR antibody | Millipore | AB1554 | Dilution (1:500) |
| Rabbit vimentin | ProteinTech | 10366-1-AP | Dilution (1:200) |
| Schwann cell culture medium | ScienCell Research | 1701 | |
| Precision tweezers DUMONT straight with extra fine tips Dumostar, 5 | ROTH | LH75.1 | Sterilize with 70% alcohol before use |
| IRIS Scissors, sharp/sharp. Length 4–3/8"(111mm) | Codman | 54-6500 | Sterilize with 70% alcohol before use |
| Sterilized surgical - sharp blade (Duro Edge Economy Single Edge Blades) | Razor blade company | 94-0120 | Sterilize with 70% alcohol before use |
| T25 culture flask | Corning | 353109 | |
| Trypsin neutralization buffer (TNS) | Lonza | CC-5002 | |
| Trypsin/EDTA | Lonza | CC-5012 | |
| Inverted microscope | ZEISS | Axio Observer 7- Axiocam 506 mono – Apotome.2 microscope | For immunofluorescence of chamber slide containing stained cells |
| Inverted microscope | ZEISS | Primovert | For visulaizing/observing cell attachment or detachment |
参考文献
- Hawksworth, G. M. Advantages and disadvantages of using human cells for pharmacological and toxicological studies. Human & Experimental Toxicology. 13 (8), 568-573 (1994).
- Green, H., Kehinde, O., Thomas, J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proceedings of the National Academy of Sciences of the United States of America. 76 (11), 5665-5668 (1979).
- Fuchs, E., Green, H. Changes in keratin gene expression during terminal differentiation of the keratinocyte. Cell. 19 (4), 1033-1042 (1980).
- Aasen, T., Izpisua Belmonte, J. C. Isolation and cultivation of human keratinocytes from skin or plucked hair for the generation of induced pluripotent stem cells. Nature Protocols. 5 (2), 371-382 (2010).
- Seluanov, A., Vaidya, A., Gorbunova, V. Establishing primary adult fibroblast cultures from rodents. Journal of Visualized Experiments: JoVE. (44), e2033(2010).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Silva, W. N., et al. Role of Schwann cells in cutaneous wound healing. Wound Repair and Regeneration. 26 (5), 392-397 (2018).
- Bray, E. R., Cheret, J., Yosipovitch, G., Paus, R. Schwann cells as underestimated, major players in human skin physiology and pathology. Experimental Dermatology. 29 (1), 93-101 (2020).
- Laverdet, B., et al. Skin innervation: important roles during normal and pathological cutaneous repair. Histology and Histopathology. 30 (8), 875-892 (2015).
- Jessen, K. R., Mirsky, R., Lloyd, A. C. Schwann cells: Development and role in nerve repair. Cold Spring Harbor Perspectives in Biology. 7 (7), 020487(2015).
- Bentley, C. A., Lee, K. F. p75 is important for axon growth and Schwann cell migration during development. The Journal of Neuroscience. 20 (20), 7706-7715 (2000).
- Rutkowski, J. L., et al. Signals for proinflammatory cytokine secretion by human Schwann cells. Journal of Neuroimmunology. 101 (1), 47-60 (1999).
- Kumar, A., Brockes, J. P. Nerve dependence in tissue, organ, and appendage regeneration. Trends in Neurosciences. 35 (11), 691-699 (2012).
- Balakrishnan, A., et al. Insights into the role and potential of Schwann cells for peripheral nerve repair from studies of development and injury. Frontiers in Molecular Neuroscience. 13, 608442(2020).
- Gresset, A., et al. Boundary caps give rise to neurogenic stem cells and terminal glia in the skin. Stem Cell Reports. 5 (2), 278-290 (2015).
- Stratton, J. A., et al. Purification and characterization of Schwann cells from adult human skin and nerve. eNeuro. 4 (3), (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved